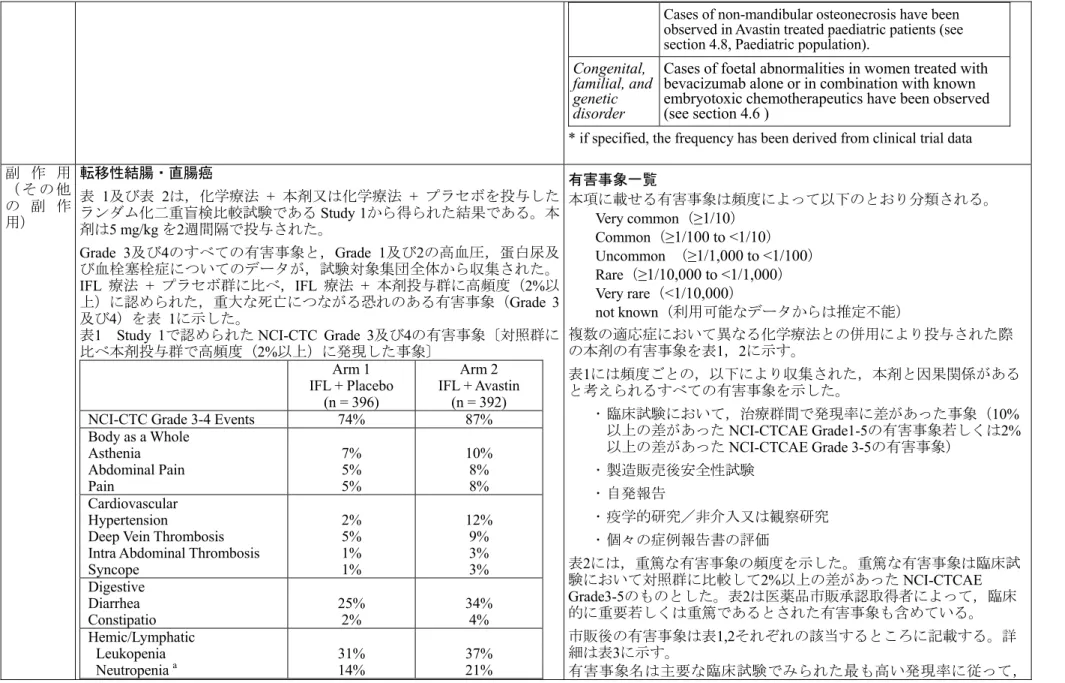
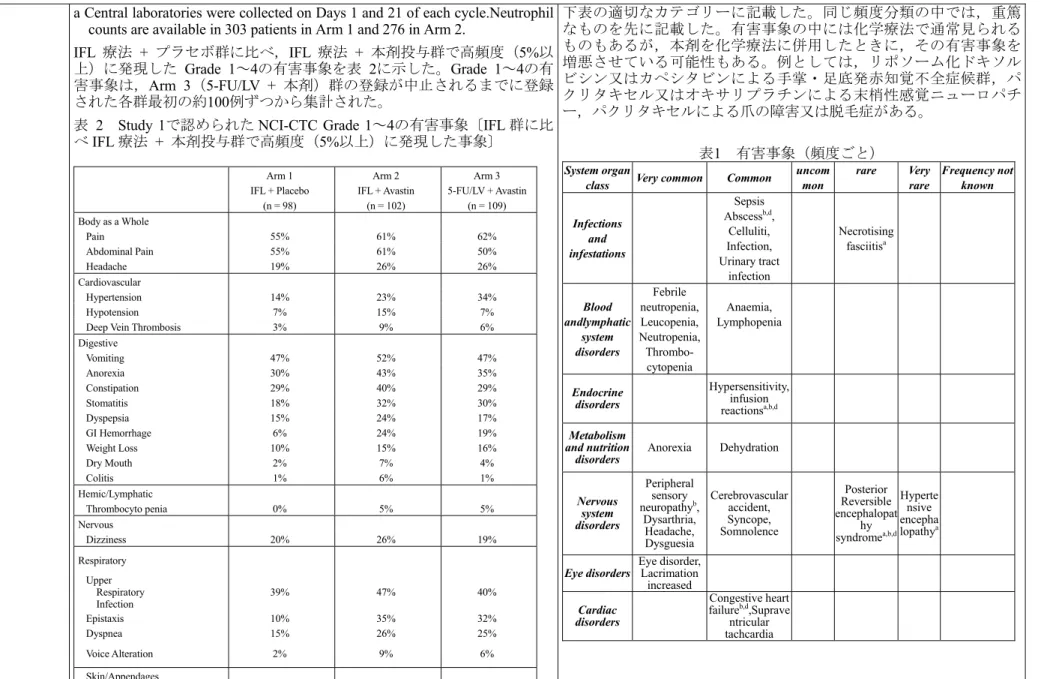
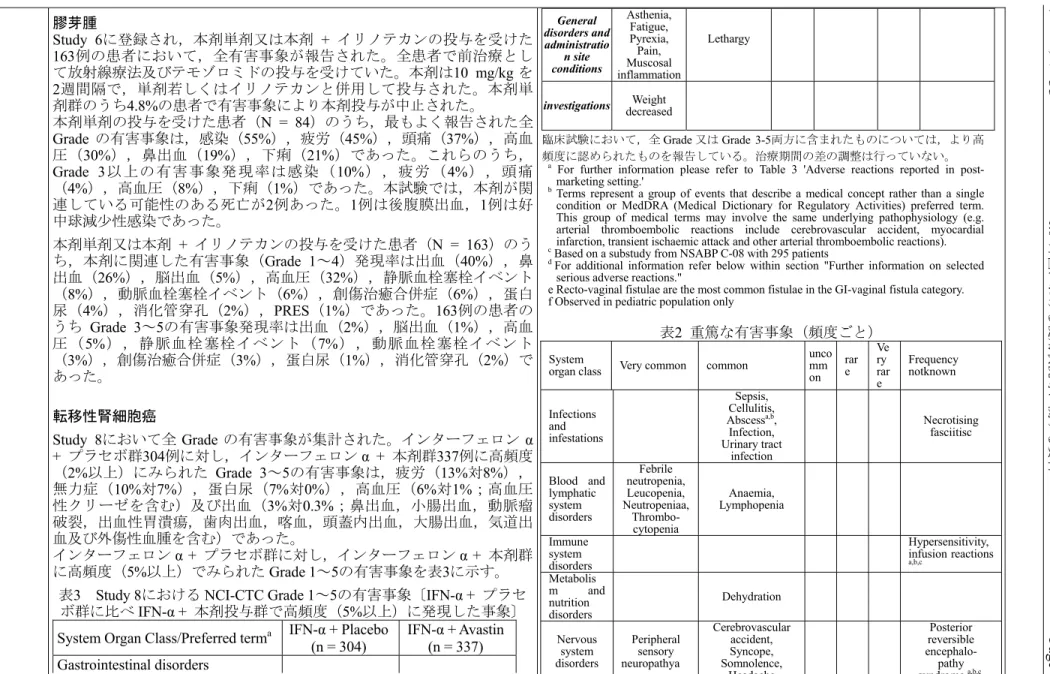
アバスチン点滴静注用100 mg/4 mL
アバスチン点滴静注用400 mg/16 mL
に関する資料
本資料に記載された情報に係る権利及び内容の責任は,
中外製薬株式会社にあります。当該製品の適正使用の目的
以外の営利目的に本資料を利用することはできません。
中外製薬株式会社
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
1
アバスチン点滴静注用100 mg/4 mL
アバスチン点滴静注用400 mg/16 mL
(ベバシズマブ(遺伝子組換え))
[進行・再発の子宮頸癌]
第
1部 (モジュール1):
申請書等行政情報及び添付文書に関する情報
1.5 起原又は発見の経緯及び開発の経緯
中外製薬株式会社
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
2
目次
頁 1.5 起原又は発見の経緯及び開発の経緯 ... 3 1.5.1 はじめに ... 3 1.5.2 子宮頸癌の疫学と病態 ... 3 1.5.3 子宮頸癌に対する治療の現状 ... 4 1.5.4 子宮頸癌における本剤の開発経緯 ... 5 1.5.4.1 非臨床開発の経緯 ... 5 1.5.4.2 臨床開発の経緯 ... 5 1.5.4.2.1 海外における臨床開発・承認申請の経緯 ... 5 1.5.4.2.2 国内における臨床開発・承認申請の経緯 ... 6 1.5.4.2.3 開発の経緯図 ... 6 1.5.4.3 海外で実施中の試験 ... 7 1.5.5 参考文献 ... 8アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
3
1.5 起原又は発見の経緯及び開発の経緯
1.5.1 はじめに
アバスチン点滴静注用100 mg/4 mL,同400 mg/16 mL(以下,本剤)は,血管内皮増殖因子 (Vascular Endothelial Growth Factor; VEGF)を標的として米国の Genentech 社により創製され, 世界で初めて臨床的に有用性を示し,医薬品として承認・臨床応用された血管新生阻害剤であ る。
VEGF は,VEGF mRNA のスプライシングのパターンによって,数種のアイソフォームが存
在することが報告されている。主なアイソフォームとして,VEGF121,VEGF165,VEGF189及び
VEGF206の4つが挙げられ,このうち VEGF165が生体内において大多数を占めている1)。VEGF
は VEGF 受容体(VEGFR)と結合することでシグナル伝達が活性化され,血管内皮細胞の増
殖・遊走,未成熟な内皮細胞の生存及び血管透過性の亢進といった作用をもたらす。これらの 作用は血管新生において重要な役割を果たし,VEGF は血管新生の主要な調整因子である。
本剤の有効成分であるベバシズマブ(遺伝子組換え)は,ヒト VEGF165を抗原として作製し
たマウス抗ヒト VEGF モノクローナル抗体 A4.6.12)をもとにして,IgG1フレームワークを組み
合わせ,VEGF に対する結合活性を最適化した組換え型ヒト化モノクローナル抗体である3)。
本剤はVEGF と結合することで,VEGF と VEGFR(VEGFR-1及び VEGFR-2)との結合を阻害
することによりシグナル伝達を遮断し,腫瘍組織における血管新生を抑制し,腫瘍増殖を阻害 する4)。VEGF は正常な生理的プロセス並びに腫瘍増殖等の病的プロセスの両方において血管 新生を制御しており,結腸・直腸癌,非小細胞肺癌,乳癌,腎細胞癌,卵巣癌,子宮頸癌等 様々なヒト腫瘍において発現が認められている5),6)。このことから,本剤は様々な癌腫に対し て有効性が期待されたため,1997年に本剤の臨床開発が米国で開始された。 本剤の臨床的有用性は,まず転移性結腸・直腸癌の一次治療において検証され,2004年2月 に米国,2005年1月に欧州で承認された。その後,欧米で様々な癌腫について効能追加が行わ れ,現在,米国では,転移性結腸・直腸癌の一次治療及び二次治療と本剤の前治療のある二次 治療,進行・再発の非小細胞肺癌(扁平上皮癌を除く)の一次治療,転移性腎細胞癌,再発膠 芽腫,治療抵抗性・転移性・再発子宮頸癌及び白金製剤抵抗性再発卵巣癌において承認されて いる。欧州では,転移性結腸・直腸癌,転移性乳癌の一次治療,進行・再発の非小細胞肺癌 (扁平上皮癌を除く)の一次治療,進行・転移性腎細胞癌の一次治療,進行卵巣癌の初回治療, 白金製剤感受性再発卵巣癌,白金製剤抵抗性再発卵巣癌及び治療抵抗性・転移性・再発子宮頸 癌において承認されている。 本邦では,2007年4月18日に治癒切除不能な進行・再発の結腸・直腸癌(用法・用量 5 mg/kg 又は10 mg/kg の2週間隔)において承認された。その後,2009年9月18日で同効能におけ る7.5 mg/kg の3週間隔投与の用法・用量追加,2009年11月6日に扁平上皮癌を除く切除不能な 進行・再発の非小細胞肺癌,2011年9月26日に手術不能又は再発乳癌,2013年6月14日に悪性神 経膠腫,2013年11月22日に卵巣癌の効能追加が承認された。
1.5.2 子宮頸癌の疫学と病態
子宮頸癌は,世界では女性で4番目に多い癌であり,2012年に52.8万人が新たに診断され, 26.6万人が子宮頸癌により死亡している7)。 本邦における子宮頸癌の罹患数は,1999年に6,936人であった罹患者数は2011年には11,378人 まで増加している8)。また,2025年~2029年の罹患者数は12,600人と推計されており9),今後も 増加傾向が続くと考えられる。年齢別の罹患者数は,20代後半から増加し,30代半ば~40代半 ばが最も多く,それ以降の年齢では減少する傾向が認められる。多くの癌では年齢とともに罹 患者数が増加するのに比べ,子宮頸癌は比較的若年層の患者が多いことが特徴である8)。 本邦における子宮頸癌による死亡者は,1970年代前半から一貫して増加傾向にあり,1970年 代前半に約1,500人であった死亡者数は2013年には2,656人まで増加している8)。2025年~2029年アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
4
の死亡者数は2,800人と推計されており9),子宮頸癌による死亡者数は,今後も現在と同程度か 増加傾向が続くと考えられている。 子宮頸癌は,ヒトパピローマウィルス(human papillomavirus; HPV)の感染が引き金になっ て発症することが明らかになっている。HPV による発癌機序は,HPV が子宮頸部上皮を構成 する基底層の基底細胞に感染することにより始まり,3段階の異形成と呼ばれる病変(軽度異 形成,中等度異形成,高度異形成)及び上皮内癌を経て浸潤癌に至る。これら異形成及び上皮 内癌は,子宮頸部上皮内腫瘍(cervical intraepithelial neoplasia; CIN)と呼ばれ,子宮頸癌の前 癌病変と考えられている。 HPV は主に性交渉により感染することから,多くの女性が感染するリスクを有するが,ほと んどの場合 HPV は免疫系により排除されるため,一過性の感染にとどまり発癌には至らない。 軽度異形成から浸潤癌に至るまでには数年から数十年を要し,発癌まで至る割合は約10%であ る10)。子宮頸癌はウイルス感染が主要原因であり,子宮頸癌予防ワクチンが世界120カ国以上 で承認されている。子宮頸癌予防ワクチンの接種者の増加に伴い子宮頸癌患者の減少が期待さ れるが,実際に罹患率や死亡率の減少が確認されるまでには,10~30年程度の期間を要すると 報告されている11)。本邦でも子宮頸癌ワクチンは2剤が承認され,2013年4月からは定期接種化 されたものの,現在は副作用等への懸念から積極的な接種勧奨が一時差し控えられており,本 邦においても子宮頸癌患者が減少するまでには長期間要すると想定される。子宮頸癌の病期分類は世界的にInternational Federation of Gynecology and Obstetrics(以下,
FIGO)分類が用いられており12),13),本邦でも日本産科婦人科学会が FIGO 分類に基づき作成
した病期分類[子宮頸癌進行期分類(日産婦2011,FIGO 2008)]に沿って症例登録されてい る14)。
1.5.3 子宮頸癌に対する治療の現状
子宮頸癌に対する治療は,Stage IA1~Stage IVA では手術療法,放射線療法,同時化学放射
線療法から選択される。国内外で手術療法,同時化学放射線療法の適応 Stage や放射線療法の
照射法に若干の違いが認められるものの,基本的な治療方針は国内外でほぼ同様である。根治
的治療が可能であるため治療成績は比較的良好であり,本邦における調査15)では,2005年に治
療を開始した子宮頸癌患者の5年生存率は,Stage I で91.3%,Stage II で77.8%,Stage III で 56.9%,Stage IVA で42.7%と報告されている。 一方,遠隔転移を有する Stage IVB 及び再発の子宮頸癌の治療成績は決して満足できるもの ではなく,Stage IVB の5年生存率は15~22.7%15),16),再発の5年生存率は5%未満17)と報告され, 極めて予後不良である。Stage IVB 及び再発の子宮頸癌の治療は,国内外とも再発部位,放射 線療法の治療歴,年齢や全身状態,癌の広がりなどを総合的に考慮し,手術療法,放射線療法, 化学療法,緩和医療から選択されるが,化学療法が重要な役割を果たしている。本邦の子宮頸 癌治療ガイドライン14)でも,全身状態が良好かつ臓器機能が保たれているStage IVB 症例に対 する治療の第一選択は全身化学療法を推奨しており,また,手術や放射線治療により根治が望 めない再発癌に対し,症状緩和と延命を図る手段として全身化学療法の有用性が期待されると 記載されている。 進行・再発の子宮頸癌に対する化学療法は,シスプラチン(以下,Cis)に関する報告が多 く,単剤投与で20~30%の奏効率を示すことから,20年以上にわたり key drug として用いられ ている14)。治療成績向上を目指し,Cis と他の抗悪性腫瘍剤の併用による2剤併用レジメンが検 討されてきている。GOG-0204試験において,Cis との併用薬として,パクリタキセル(以下, Pac),トポテカン(以下,Top),ゲムシタビン及びビノレルビンを選択する,4群での比較 試験が実施された。その結果,全生存期間(以下,Overall Survival; OS),無増悪生存期間 (以下,Progression Free Survival; PFS)及び奏効率のいずれでも4群に統計学的な有意差は認 められず,安全性は,発現率に差がある有害事象は認められたものの,全体としては大きな違 いはないと結論付けられた。また,QOL 評価でも4群に大きな違いは認められなかった。有効
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
5
性について,Pac との併用は統計学的有意ではないものの,OS,PFS 及び奏効率のいずれでも他の3群より良好な成績であったため,Cis と Pac の併用が最も有用なレジメンと結論付けられ た18)。
本邦では,Japan Clinical Oncology Group(以下,JCOG)が Cis と Pac 併用療法を対照として, カルボプラチン(以下,Car)と Pac 併用療法の臨床的有用性を評価するため,第 III 相ランダ
ム化試験である JCOG-0505試験19)を実施した。その結果,主要評価項目である OS について,
Car と Pac 併用療法の Cis と Pac 併用療法に対する非劣性が証明され,安全性も大きな違いは 認められなかった。 本邦の子宮頸癌治療ガイドライン14)では,全身状態が良好で臓器機能が保たれている再発子 宮頸癌患者には全身化学療法がグレード B(有効性を示すランダム化比較試験のエビデンスが 少なくとも一つあり,行うよう奨められる)として推奨され,そのレジメンは Cis(又はその 他のプラチナ製剤)を中心とした単剤若しくは2剤併用療法をグレード B として推奨されてい る。また,Stage IVB の子宮頸癌では,全身状態が良好で臓器機能が保たれている場合は,治 療の第一選択は原則として全身化学療法と記載されているが,その推奨の基準はグレード C1 (行うことを考慮してもよいが,いまだ科学的根拠が十分ではない)である。
海外では,National Comprehensive Cancer Network(以下,NCCN)の子宮頸癌ガイドライン
12)において,Stage IVB 及び再発子宮頸癌に対する化学療法として Cis と Pac の併用が category
1(高レベルのエビデンスに基づいており,その介入が適切であるという NCCN の統一したコ ンセンサスが存在する)として推奨され,Car + Pac,Cis + Top,Top + Pac などの併用療法が category 2A(比較的低レベルのエビデンスに基づいており,その介入が適切であるという NCCN の統一したコンセンサスが存在する)として推奨されている。
1.5.4 子宮頸癌における本剤の開発経緯
1.5.4.1
非臨床開発の経緯
今回の申請にあたり,副次的薬理試験,安全性薬理試験,薬物動態試験,毒性試験について 新たな試験は実施していない。1.5.4.2 臨床開発の経緯
1.5.4.2.1
海外における臨床開発・承認申請の経緯
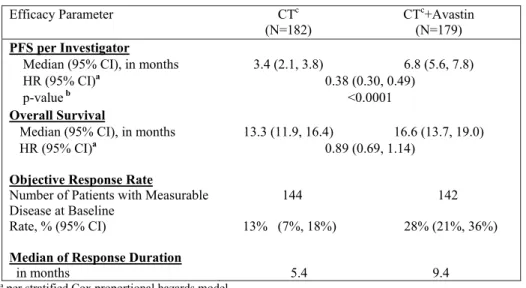
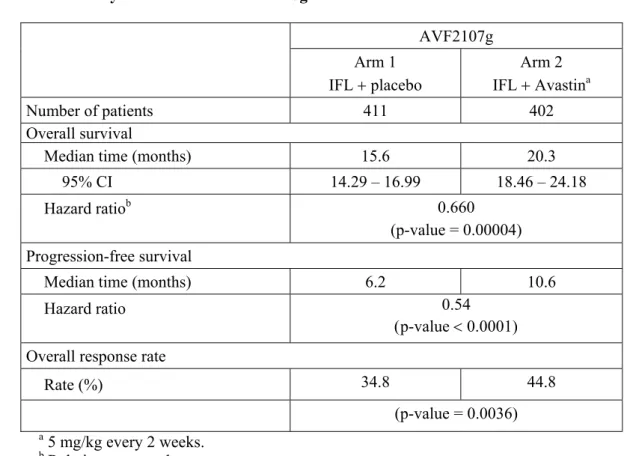
子宮頸癌に対する本剤の開発は,Gynecologic Oncology Group(以下,GOG)が主体となっ て着手した。 2002年4月より,1レジメン又は2レジメンの化学療法歴を有する治療抵抗性又は再発の子宮 頸癌患者46例を対象とした非対照第 II 相試験(GOG-0227C 試験)が実施された20)。本剤 15 mg/kg を3週間間隔で投与した際の有効性及び安全性について検討された。本剤が投与され た46例中11例(23.9%)で6カ月以上の無増悪生存が認められたほか,PFS の中央値は,3.40カ 月,OS の中央値は7.29カ月であり,GOG で実施されていたその他の臨床試験と比較しても良 好な結果であった。 GOG-0227C 試験の結果を踏まえ,GOG-0240試験が計画され,2009年4月より開始された。 GOG-0240試験は,Stage IVB,治療抵抗性又は再発子宮頸癌患者452例を対象とした非盲検ラ ンダム化比較第 III 相臨床試験であり,米国及びスペインで実施された。GOG-0240試験は,
OS を主要評価項目として,化学療法単独(Cis + Pac 又は Top + Pac)に対する本剤と化学療法 併用[Cis + Pac + ベバシズマブ(以下,Bv)又は Top + Pac + Bv]の優越性の検証及び白金製 剤含有化学療法(Cis + Pac ± Bv)に対する白金製剤非含有化学療法(Top + Pac ± Bv)の優越 性の検証を目的とした2 × 2要因の試験として計画された。本剤の有用性評価の結果,化学療
法単独群と比較して,本剤と化学療法の併用群において,主要評価項目である OS を統計学的
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
6
イドラインで,本剤 + Cis + Pac 及び本剤 + Top + Pac が category 1として推奨されている。GOG-0240試験の成績に基づき,Genentech 社は2014年4月に米国における承認申請を行い, Priority review として審査され,2014年8月に承認された。EU においては F. Hoffmann-La Roche 社(以下,Roche 社)が2014年6月に承認申請を行い,2015年3月に承認された。
1.5.4.2.2
国内における臨床開発・承認申請の経緯
本邦における本剤の「子宮頸癌」に対する効能・効果については,2009年に行われた第1回 医療上の必要性が高い未承認薬・適応外薬に係る開発要望の公募にて,開発要望を受けた。し かしながら,当時は,前述した GOG-0227C 試験結果に基づく米国の公的保険メディケアでの 保険償還リストに「再発性子宮頸部扁平上皮癌」に対する本剤単剤投与が記載されているのみ であり,本剤の当該適応に関わるエビデンスが確立されているとは言い難い状況であり,「医 療上の必要性に係る基準」への該当性に関する専門作業班(WG)の評価において,医療上の 必要性の基準には該当しないと判断された。 GOG-0240試験の結果を受け,国内では申請者が 年 月から進行・再発子宮頸癌患者を対 象に,本剤と化学療法の併用療法の忍容性を検討するために,第 II 相臨床試験(JO29569試験) を実施した。 本試験を実施するにあたり,申請者は試験デザインと承認申請データパッケージについて助 言を得ることを目的に,医薬品医療機器総合機構と対面助言を行った。対面助言の結果を受け,本試験はStage IVB,治療抵抗性又は再発子宮頸癌患者を対象に Pac,Cis 及び本剤を投与し,
各症例のサイクル1における忍容性を評価するデザインとした。なお,最終症例の1サイクル観 察終了時点までのデータを集計して,安全性を検討する試験デザインとした。 今般,JO29569試験において,進行・再発子宮頸癌患者に対する本剤と化学療法の併用療法 の忍容性が確認されたため,GOG-0240試験の成績とともに承認申請を行うこととした。
1.5.4.2.3
開発の経緯図
図 1.5.4.2.3-1 本剤の子宮頸癌における開発経緯図 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 海外 国内*1:First Patient In から主解析 Cut off までの期間 *2:First Randomised から追加解析 Cut off までの期間
海外第II 相臨床試験GOG-0227C*1 海外第III 相臨床試験GOG-0240*2 2014 04 US 申請 2014 08US 承認 2014 06 EU 申請 2015 03EU 承認 04 04 03 04
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
7
1.5.4.3 海外で実施中の試験
本項では,治療抵抗性・転移性・再発子宮頸癌に対する一次治療を対象として実施中の本剤 海外臨床試験を記載する。 ・治療抵抗性・転移性・再発子宮頸癌を対象とした,カルボプラチン,パクリタキセルとベ バシズマブの併用による多施設共同非対照第II 相臨床試験(MO29594試験) 治療抵抗性・転移 性・再発子宮頸癌 症例数:150 病勢増悪,死亡,許容 できない有害事象又は 同意撤回まで継続 本剤 15 mg/kg 3週間間隔 パクリタキセル 175 mg/m2 3週間間隔 カルボプラチン AUC 5 3週間間隔アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
8
1.5.5 参考文献
1) Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9: 669-76. 2) Kim KJ, Li B, Houck K, Winer J, Ferrara N. The vascular endtheliai growth factor proteins:
identification of biologically relevant regions by neutralizing monoclonal antibodies. Growth Factors 1992, 7: 53-64.
3) Presta LG, Chen H, O’Connor SJ, Chisholm V, Meng YG, Krummen L, et al. Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders. Cancer Res 1997; 57: 4593-9.
4) Willett CG, Boucher Y, di Tomaso E, Duda DG, Munn LL, Tong RT, et al. Direct evidence that the VEGF-specific antibody Bevacizumab has antivascular effects in human rectal cancer. Nat Med 2004, 10: 145-7.
5) Ferrara N. Vascular Endothelial Growth Factor: Basic Science and Clinical Progress. Endocr Rev 2004; 25: 581-611.
6) Santin AD, Hermonat PL, Ravaggi A, Pecorelli S, Cannon MJ, Parham GP. Secretion of vascular endothelial growth factor in adenocarcinoma and squamous cell carcinoma of the uterine cervix. Obstet Gynecol 1999; 94: 78-82.
7) Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray, F. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013. Available from: http://globocan.iarc.fr, accessed on day/month/year.
8) 国立がん研究センターがん対策情報センター がん情報サービス 最新がん統計<アクセス
日:2015年4月23日>,Available from URL: http://ganjoho.jp/public/statistics/index.html
9) がん・統計白書2012−データに基づくがん対策のために(篠原出版新社)/国立がん研究セ ン タ ー が ん 対 策 情 報 セ ン タ ー < ア ク セ ス 日 :2015 年 4 月 23 日 > Available from URL: http://ganjoho.jp/professional/statistics/statistics.html
10) 鈴木理絵,宮城悦子 ヒトパピローマウイルスと子宮頸がん 予防医学 2013; 55:41-9 11) WHO reference number: WHO/RHR/06.11: Preparing for the introduction of HPV vaccines: policy
and programme guidance for countries.
12) NCCN Clinical Practice Guideline in Oncology Cervical Cancer Version 2. 2015
13) N. Colombo, S. Carinelli, A. Colombo, Marini C, Rollo D, Sessa C. Cervical Cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2012; 23 (Suppl 7): vii27-vii32.
14) 日本婦人科腫瘍学会編 子宮頸癌治療ガイドライン 2011年版
15) 婦人科腫瘍委員会 第53回治療年報 2005年に治療した子宮頸癌,子宮体癌,卵巣悪性・境
界悪性腫瘍の5年治療成績について 日本産婦人科学会雑誌2013; 65:1147-208
16) American Cancer Society: Last Revised: 01/31/2014: [Web page] Available from URL: http://www.cancer.org/cancer/cervicalcancer/detailedguide/cervical-cancer-survival
17) Hirte HW, Strychowsky JE, Oliver T, Fung-Kee-Fung M, Elit L, Oza AM. Chemotherapy for Recurrent, Metastatic, or Persistent Cervical Cancer. Int J Gynecol Cancer. 2007; 17:1194-204.
18) Monk BJ, Sill MW, McMeekin DS, Cohn DE, Ramondetta LM, Boardman CH, et al. Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 2009;27: 4649-55.
19) Kitagawa R, Noriyuki K, Shibata T, Kamura T, Kasamatsu T, Nakanishi T et al. Paclitaxel Plus Carboplatin Versus Paclitaxel Plus Cisplatin in Metastatic or Recurrent Cervical Cancer: The Open-Label Randomized Phase III Trial JCOG0505. J Clin Oncol 2015; 33: 2129-35.
20) Monk BJ, Sill MW, Burger RA, Gray HJ, Buekers TE, Roman LD. Phase II trial of bevacizumab in the treatment of persistent or recurrent squamous cell carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol. 2009;27: 1069-74.
アバスチンCC 1.5 起原又は発見の経緯及び開発の経緯 Page
9
21) Tewari KS, Sill MW, Long III HJ, Penson RT, Huang H, Ramondetta LM et al. Improved Survivalアバスチン点滴静注用100 mg/4 mL
アバスチン点滴静注用400 mg/16 mL
(ベバシズマブ(遺伝子組換え))
[進行・再発の子宮頸癌]
第
1部(モジュール1):
申請書等行政情報及び添付文書に関する情報
1.6 外国における使用状況等に関する資料
中外製薬株式会社
アバスチンCC 1.6 外国における使用状況等に関する資料 Page 1目次
頁 1.6 外国における使用状況等に関する資料 ... 3 1.6.1 外国における承認(許可)及び使用状況の概略 ... 3 1.6.2 代表的な添付文書(和訳)の概要 ... 8 1.6.2.1 薬事情報,その他 ... 9 1.6.2.2 成分・分量 ... 10 1.6.2.3 効能・効果,用法・用量 ... 11 1.6.2.4 警告,重要な基本的注意 ... 14 1.6.2.5 禁忌 ... 22 1.6.2.6 使用上の注意 ... 22 1.6.2.7 相互作用 ... 23 1.6.2.8 副作用(有害事象) ... 25 1.6.2.9 高齢者への投与 ... 44 1.6.2.10 妊婦・産婦・授乳婦への投与... 46 1.6.2.11 小児等への投与 ... 48 1.6.2.12 腎障害患者,肝障害患者への投与... 49 1.6.2.13 過量投与 ... 49 1.6.2.14 適用上の注意 ... 49 1.6.2.15 貯法,有効期間,取扱い上の注意... 51 1.6.2.16 非臨床安全性試験(その他の注意)... 51 1.6.2.17 薬物動態 ... 52 1.6.2.18 薬効薬理 ... 53 1.6.2.19 その他 ... 54 1.6.3 米国における添付文書 ... 55 1.6.4 欧州における添付文書 ... 90 1.6.5 企業中核データシート(CDS) ... 160 アバスチンCC 1.6 外国における使用状況等に関する資料 Page 21.6 外国における使用状況等に関する資料
1.6.1 外国における承認(許可)及び使用状況の概略
アバスチン点滴静注用100 mg/4 mL 及び400 mg/16 mL(以下,本剤)は,米国では FDA より Fast Track Review に指定され,申請(2003年9月26日)から5カ月の短期間(2003年9月26日申 請)で静注フルオロウラシルを含む化学療法との併用による転移性結腸・直腸癌の一次治療薬 として2004年2月26日に承認された。また,欧州連合(EU)においても中央審査方式により 2005年1月12日に承認された。 本剤は,2016年1月31日時点において,フランス,ドイツ,イギリス,イタリア,スウェー デン等の EU 加盟国と米国の他,スイス,オーストラリア,カナダ,ノルウェー等の世界100 以上の国と地域で承認・販売されている。また,進行・再発の子宮頸癌治療については,EU 加盟国28カ国を含む67の国と地域で承認されている。 Roche 社の PBRER 第3版によれば, 年 月 日から 年 月 日までに,約 例が 本剤の投与を受けたと推定されている。これにより,DIBD( 年 月 日)以降, 年 月 日までに合計 例が本剤の投与を受けたと推定される。 現在,米国では,転移性結腸・直腸癌の一次治療及び二次治療と本剤の前治療歴のある二次 治療,進行・再発非小細胞肺癌(扁平上皮癌を除く)の一次治療,成人の再発膠芽腫の治療, 転移性腎細胞癌の治療,治療抵抗性・再発又は転移性子宮頸癌の治療,白金製剤抵抗性の再発 卵巣癌の治療について,EU では転移性結腸・直腸癌の治療,進行・再発非小細胞肺癌(扁平 上皮癌を除く)の一次治療,転移性乳癌の一次治療,進行・転移性腎細胞癌の一次治療,進行 卵巣癌初回治療,白金製剤感受性初回再発卵巣癌及び白金製剤抵抗性の再発卵巣癌の治療,治 療抵抗性・再発又は転移性子宮頸癌の治療について承認されている。 米国及びEU における承認許可状況を表 1.6.1-1,表 1.6.1-2に示す。 表 1.6.1-1 米国での許可状況
Avastin Solution for intravenous infusion (バイアル,100 mg/4 mL,400 mg/16 mL) 変更内容 承認 年月日 承認効能・効果 承認用法・用量 2004 年 2 月 26 日 静注フルオロウラシルを含む化学療 法との併用による転移性結腸・直腸 癌の一次治療 病 勢 の 進 行 が 認 め ら れ る ま で ,1 回 5 mg/kg(体重)を 2 週間隔で点滴静注 する。 効能追加 2006 年 6 月 20 日 静注フルオロウラシルを含む化学療 法との併用による転移性結腸・直腸 癌の一次又は二次治療 病勢の進行が認められるまで,静注フ ルオロウラシルを含む化学療法との併 用により,14 日間隔で(5 mg/kg 又は 10 mg/kg を)点滴静注する。IFL 療法 と の 併 用 時 の 推 奨 用 量 は 5 mg/kg , FOLFOX4 と の 併 用 時 の 推 奨 用 量 は 10 mg/kg である。 効能追加 2006 年 10 月 11 日 カルボプラチン及びパクリタキセル との併用による切除不能の局所進 行,再発又は転移性非扁平上皮非小 細胞肺癌の一次治療 推奨用量は15 mg/kg の 3 週間隔点滴静 注である。 効能追加 2008 年 2 月 22 日 パクリタキセルとの併用による,化 学療法未施行の HER2 陰性転移性乳 癌の治療 推奨用量は10 mg/kg の 2 週間隔点滴静 注である。 アバスチンCC 1.6 外国における使用状況等に関する資料 Page 3
効能追加 2009 年 5 月 5 日 病勢進行又は許容できない毒性が見ら れるまで本剤の投与を継続すること。 単剤投与による前治療後に病勢進行 が認められた膠芽腫の治療 推奨用量は10 mg/kg の 2 週間隔点滴静 注である。 効能追加 2009 年 7 月 31 日 カルボプラチン及び(中略)非扁平 上皮非小細胞肺癌の一次治療 推奨用量はカルボプラチン及びパクリ タキセルとの併用による 15 mg/kg の 3 週間隔点滴静注である。 パクリタキセルとの併用による,化 学療法未施行の HER2 陰性転移性乳 癌の治療 推奨用量はパクリタキセルとの併用に よる10 mg/kg の 2 週間隔点滴静注であ る。 インターフェロンαとの併用による 転移性腎細胞癌の治療 推奨用量はインターフェロン α との併 用による10 mg/kg の 2 週間隔点滴静注 である。 効能変更 2011 年 2 月 8 日 単剤投与による前治療後に病勢進行 が認められた成人患者での膠芽腫の 治療 推奨用量は10 mg/kg の 2 週間隔点滴静 注である。 効能削除 2011 年 12 月 20 日 パクリタキセルとの併用による,化 学療法未施行の HER2 陰性転移性乳 癌の治療 推奨用量はパクリタキセルとの併用に よる10 mg/kg の 2 週間隔点滴静注であ る。 効能追加 2013 年 1 月 23 日 フッ化ピリミジン/イリノテカン又 はフッ化ピリミジン/オキサリプラ チンを含む化学療法と併用による, 初回化学療法として本剤を含むレジ メン施行後に増悪した転移性結腸・ 直腸癌患者の二次治療 静注フルオロウラシルを含む化学療法 との併用により,2 週間隔で 5 mg/kg 又は10 mg/kg を点滴静注する。 ・IFL 療法との併用により 5 mg/kg を 投与する ・FOLFOX4 との併用により 10 mg/kg を投与する ・初回化学療法として本剤を含むレジ メンを施行後増悪した転移性結腸・直 腸癌患者の二次治療として,フッ化ピ リミジン/イリノテカン又はフッ化ピリ ミジン/オキサリプラチンをベースとし て化学療法と併用により 5 mg/kg 2 週 間隔又は7.5 mg/kg 3 週間隔にて投与す る。 効能追加 2014 年 8 月 14 日 パクリタキセルとシスプラチン又は パクリタキセルとトポテカンとの併 用による治療抵抗性・再発又は転移 性子宮頸癌の治療 推奨用量はパクリタキセル・シスプラ チン又はパクリタキセル・トポテカン の化学療法レジメンのうちの一つとの 併用による15 mg/kg の 3 週間隔点滴静 注である。 効能追加 2014 年 11 月 14 日 パクリタキセル,リポソーム化ドキ ソルビシン又はトポテカンとの併用 による,2 レジメン以下の化学療法 前治療歴のある,白金製剤抵抗性の 再発上皮性卵巣癌,卵管癌,又は原 発性腹膜癌の治療 パクリタキセル,リポソーム化ドキソ ルビシン又はトポテカン(1 週間隔投 与),のうち一剤との併用により投与 する場合,本剤は 10 mg/kg(体重)を 2 週間隔で点滴静注する。トポテカン (3 週間隔投与)と併用する場合,本剤 アバスチンCC 1.6 外国における使用状況等に関する資料 Page 4
は 15 mg/kg(体重)を 3 週間隔で点滴 静注する。
下線箇所;追加承認 取消線箇所;承認取り消し 表 1.6.1-2 EU(中央審査方式)での許可状況
Avastin 25 mg/ml Concentrate for solution for infusion(バイアル,100 mg/4 mL, 400 mg/16 mL) 変更内容 承認 年月日 承認効能・効果 承認用法・用量 2005 年 1 月 12 日 フルオロウラシル・ホリナート療法 又はIFL 療法との併用による転移性 結腸・直腸癌の一次治療 病 勢 の 進 行 が 認 め ら れ る ま で , 本 剤 5 mg/kg(体重)を 14 日間隔で点滴静 注する(減量せず,副作用により休薬 又は再投与中止)。 効能追加 2007 年 3 月 27 日 パクリタキセルとの併用による転移 性乳癌の一次治療 病 勢 の 進 行 が 認 め ら れ る ま で , 本 剤 10 mg/kg(体重)を 2 週間隔又は本剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 効能追加 2007 年 8 月 21 日 白金製剤を含む化学療法との併用に よる,切除不能の進行,転移性又は 再発の,扁平上皮癌を主体としない 非小細胞肺癌の一次治療 本剤は白金製剤を含む化学療法と 6 サ イクルまで併用し,その後,病勢の進 行が認められるまで,本剤単剤投与を 行 う 。 本 剤 の 推 奨 用 量 は 7.5 又 は 15 mg/kg(体重)の 3 週間隔点滴静注 である。非小細胞肺癌患者での臨床的 有用性は 7.5 及び 15 mg/kg のいずれの 用量でも認められている。 効能追加 2007 年 12 月 14 日 インターフェロン α–2a との併用に よる進行・転移性腎細胞癌の一次治 療 病 勢 の 進 行 が 認 め ら れ る ま で , 本 剤 10 mg/kg(体重)を 2 週間隔で点滴静 注する。 効能追加 2008 年 1 月 25 日 フッ化ピリミジンを含む化学療法と の併用による転移性結腸・直腸癌の 治療 病勢の進行が認められるまで,本剤 5 mg/kg(体重)又は 10 mg/kg(体 重)のいずれかを2 週間隔で投与,若 しくは7.5 mg/kg(体重)又は 15 mg/kg(体重)を 3 週間隔で点滴静 注する(減量せず,副作用により休薬 又は再投与中止)。 効能追加 2009 年 7 月 23 日 パクリタキセル又はドセタキセルと の併用による転移性乳癌の一次治療 病勢の進行が認められるまで,本剤 10 mg/kg(体重)を 2 週間隔又は本剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 効能削除 2011 年 2 月 28 日 パクリタキセル又はドセタキセルと の併用による転移性乳癌の一次治療 病勢の進行が認められるまで,本剤 10 mg/kg(体重)を 2 週間隔又は本剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 アバスチンCC 1.6 外国における使用状況等に関する資料 Page 5
効能追加 2011 年 6 月 29 日 タキサン系薬剤又はアントラサイク リン系薬剤を含む他の化学療法によ る治療が適切ではないと考えられる 転移性乳癌患者のカペシタビンとの 併用による一次治療。術後補助療法 として,過去12 カ月以内にタキサ ン系薬剤及びアントラサイクリン系 薬剤を含む化学療法を受けた患者は 除くこと。 病 勢 の 進 行 が 認 め ら れ る ま で , 本 剤 10 mg/kg(体重)を 2 週間隔又は本剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 効能追加 2011 年 12 月 19 日 カルボプラチン及びパクリタキセル との併用による進行(FIGO Stage IIIB,IIIC,IV)上皮性卵巣癌,卵 管癌又は原発性腹膜癌の初回治療 本剤をカルボプラチン及びパクリタキ セルと 6 サイクルまで併用し,その 後,最大 15 カ月間,病勢進行又は許容 できない毒性の発現のうち最も早い期 間 ま で , 本 剤 単 独 投 与 を 行 う 。 本 剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 効能追加 2012 年 10 月 24 日 カルボプラチン及びゲムシタビンと の併用による,本剤,VEGF 阻害剤 あるいは抗 VEGF 製剤未治療の成 人の白金製剤感受性の初回再発上皮 性卵巣癌,卵管癌,又は原発性腹膜 癌の治療 初回治療:本剤をカルボプラチン及び パクリタキセルと 6 サイクルまで併用 し,その後,最大15 カ月間,病勢進行 又は許容できない毒性の発現のうち最 も 早 い 期 間 ま で , 本 剤 単 独 投 与 を 行 う。本剤 15 mg/kg(体重)を 3 週間隔 で点滴静注する。 再発例の治療:本剤 15 mg/kg(体重) を 3 週間隔で点滴静注する。本剤をカ ルボプラチン及びゲムシタビンと 6 サ イクルから最大 10 サイクルまで併用 し,その後,病勢進行まで本剤単独投 与を行なう。 効能追加 2014 年 7 月 31 日 パクリタキセル,トポテカン又はリ ポソーム化ドキソルビシンとの併用 による,2 レジメン以下の化学療法 前治療歴があり,かつ本剤,VEGF 阻害剤あるいは抗 VEGF 製剤未治 療の成人の白金製剤抵抗性の再発上 皮性卵巣癌,卵管癌,又は原発性腹 膜癌の治療 初回治療:本剤をカルボプラチン及び パクリタキセルと 6 サイクルまで併用 し,その後,最大15 カ月間,病勢進行 又は許容でき ない毒性の発現のうち最も早い期間ま で , 本 剤 単 独 投 与 を 行 う 。 本 剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。 白 金 製 剤 感 受 性 再 発 例 の 治 療 : 本 剤 15 mg/kg(体重)を 3 週間隔で点滴静 注する。本剤をカルボプラチン及びゲ ムシタビンを含む化学療法に 6 サイク ルから最大10 サイクルまで併用し,そ の後,病勢進行まで本剤単独投与を行 う。 白金製剤耐性再発例の治療:本剤は, パクリタキセル,トポテカン(1 週間 アバスチンCC 1.6 外国における使用状況等に関する資料 Page 6
隔投与)又はリポソーム化ドキソルビ シン,のうち一剤との併用により投与 すること。本剤の推奨用量は 10 mg/kg (体重)の 2 週間隔点滴静注である。 本剤をトポテカン(3 週間隔にて Day 1-5 に投与)と併用する場合,本剤は 15 mg/kg(体重)を 3 週間隔で点滴静 注する。本剤の投与は,病勢進行又は 許容できない毒性が見られるまで継続 すること。 効能追加 2015 年 3 月 30 日 パクリタキセル及びシスプラチン, 又は,代替として,白金製剤による 治療を受けることのできない患者に 対するパクリタキセル及びトポテカ ンとの併用による,成人の治療抵抗 性・再発又は転移性子宮頸癌の治療 本剤は,パクリタキセル及びシスプラ チン,又はパクリタキセル及びトポテ カンのうち 1 つの化学療法レジメンと の併用により投与する。本剤 15mg/kg (体重)を 3 週間隔で点滴静注する。 本剤の投与は,病勢進行又は許容でき な い 毒 性 が 見 ら れ る ま で 継 続 す る こ と。 下線箇所;追加承認 取消線箇所;承認取り消し アバスチンCC 1.6 外国における使用状況等に関する資料 Page 7
1.6.2 代表的な添付文書(和訳)の概要
本剤の代表的な外国添付文書として,米国添付文書(2015年12月1日版)及び EU の製品概要特性(2015年11月18日版)を比較し,その概要を以 下に示す。また,元となった米国添付文書及びEU 製品概要特性の原文と,最新の企業中核データシート(2015年6月18日付 Ver 33.0)を,それぞ れ1.6.3~1.6.5に示す。 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 81.6.2.1 薬事情報,その他
項目名 米国添付文書(2015年12月1日版) EU 製品概要特性(2015年11月18日版) 販売名 Avastin 静注用 Avastin 25 mg/mL 注射用濃縮液 一般名 Bevacizumab Bevacizumab 承認番号 ― EU/1/04/300/001 - 100 mg/4 mL バイアル EU/1/04/300/002 - 400 mg/16 mL バイアル 承認日 初回承認:2004年2月26日 初回承認日:2005年1月12日 製造 販売元 Genentech Inc 1 DNA WaySouth San Francisco, CA 94080-4990
Roche Registration Limited 6 Falcon Way
Shire Park
Welwyn Garden City AL7 1TW United Kingdom アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 9
1.6.2.2 成分・分量
項目名 米国添付文書(2015年12月1日版) EU 製品概要特性(2015年11月18日版)
成分及び 分量
ベバシズマブは,in vitro 及び in vivo 試験系において,ヒト VEGF と
結合することにより生物活性を阻害する遺伝子組換え型ヒト化モノ クローナルIgG1抗体である。ヒト IgG1に由来するフレームワーク部 とマウス抗VEGF 抗体の相補性決定部からなり,分子量は約149 kD である。ゲンタマイシンを含む培養液中でチャイニーズハムスター 卵巣細胞を用いて生産される。ゲンタマイシンは最終産物では検出 されていない。 ベバシズマブは,点滴静注用で,透明からわずかに乳白色,無色か ら微褐色,無菌,pH 6.2の液体である。 Avastin(25 mg/mL)を100 mg 又は400 mg 含有する,保存料を含ま ない4 mL 又は16 mL 入りの使い捨てバイアル。100 mg 製剤中に α, α–トレハロース二水和物240 mg,リン酸ナトリウム(一塩基,二水 和物)23.2 mg,リン酸ナトリウム(二塩基,無水和物)4.8 mg,ポ リソルベート20 1.6 mg,注射用水(USP)を含有する。400 mg 製剤 中にα, α–トレハロース二水和物960 mg,リン酸ナトリウム(一塩 基,二水和物)92.8 mg,リン酸ナトリウム(二塩基,無水和物) 19.2 mg,ポリソルベート20 6.4 mg,注射用水(USP)を含有する。 ベバシズマブ25 mg/mL を含有する。1バイアル中にベバシズマブ100 mg/4 mL 又はベバシズマブ400 mg/16 mL を含有する。推奨する希釈方 法を用いると,1.4~16.5 mg/mL に相当する。 ベバシズマブは,チャイニーズハムスター卵巣細胞を用いたDNA 技術 により生産される遺伝子組換えヒト化モノクローナル抗体である。 添加物: トレハロース二水和物,リン酸ナトリウム,ポリソルベート20,注射 用水 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 10
1.6.2.3 効能・効果,用法・用量
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 効 能 ・ 効果 転移性結腸直腸癌 本剤は,転移性結腸・直腸癌の一次又は二次治療として,フルオロウラ シルの静脈内投与を含む化学療法と併用投与する。 本剤は,初回化学療法として本剤を含むレジメン施行後に増悪した転移 性結腸・直腸癌患者の二次治療として,フッ化ピリミジン/イリノテカン 又はフッ化ピリミジン/オキサリプラチンを含む化学療法と併用投与す る。 本剤は結腸癌の術後補助療法として投与しないこと(「臨床成績」の項 参照)。 非扁平上皮非小細胞肺癌 本剤は,切除不能の局所進行,再発又は転移性非扁平上皮非小細胞肺癌 の一次治療として,カルボプラチン及びパクリタキセルと併用投与す る。 膠芽腫 本剤は,前治療後に病勢進行が認められた成人患者での膠芽腫の治療と して,単剤で投与する。 膠芽腫における本剤の有効性は奏効率の改善に基づくものである。本剤 による疾患関連症状の改善又は生存率の改善を示唆するデータは存在し ない(「臨床成績」の項参照)。 転移性腎細胞癌 本剤は,転移性腎細胞癌の治療として,インターフェロン α と併用投与 する。 治療抵抗性、再発又は転移性子宮頸癌 本剤は,治療抵抗性、再発又は転移性子宮頸癌の治療として,パクリタ キセルとシスプラチン又はパクリタキセルとトポテカンと併用投与する (「臨床成績」の項参照)。 白金製剤抵抗性の再発上皮性卵巣癌,卵管癌,原発性腹膜癌 2種類以下の化学療法レジメンを受けたことがある白金製剤に抵抗性を 示す再発上皮性卵巣癌,卵管癌,又は原発性腹膜癌の治療として,パク リタキセル,リポソーム化ドキソルビシン又はトポテカンと併用投与す る。 • フッ化ピリミジン系薬剤を含む化学療法との併用による成人の転移 性結腸・直腸癌の治療。 • パクリタキセルとの併用による成人の転移性乳癌の一次治療。 HER2発現状況に関するさらなる情報は,「臨床成績」の項を参 照。 • タキサン又はアントラサイクリンを含む他の化学療法による治療が 適切でないと考えられる成人の転移性乳癌患者に対するカペシタビ ンとの併用による一次治療。過去12カ月以内に術後補助化学療法と して,タキサン及びアントラサイクリンを含む化学療法の投与を受 けた患者は,本剤とカペシタビンとの併用による治療を行なうべき ではない。 HER2発現状況に関するさらなる情報は,「臨床成績」 の項を参照。 • 白金製剤を含む化学療法との併用による,成人の切除不能の進行, 転移性又は再発の,扁平上皮癌を主体としない非小細胞肺癌の一次 治療。 • インターフェロン α–2a との併用による成人の進行・転移性腎細胞 癌の一次治療。 • カルボプラチン及びパクリタキセルとの併用による成人の進行(FIGO Stage IIIB,IIIC 又は IV)の上皮性卵巣癌,卵管癌又は原発 性腹膜癌の初回治療。 • カルボプラチン,ゲムシタビンとの併用による,本剤,VEGF 阻害 剤あるいは抗VEGF 製剤未治療の成人における白金製剤感受性の上 皮性卵巣癌,卵管癌又は原発性腹膜癌の初回及び再発治療 • パクリタキセル,トポテカン又はリポソーム化ドキソルビシンとの 併用による,2レジメン以下の化学療法前治療歴があり,かつ本 剤,VEGF 阻害剤あるいは抗 VEGF 製剤未治療の成人の白金製剤抵 抗性の再発上皮性卵巣癌,卵管癌,又は原発性腹膜癌の治療 • パクリタキセルとシスプラチンとの併用,又は,代替として,白金 製剤の投与を受けることができない場合はパクリタキセルとトポテ カンとの併用による,成人の治療抵抗性・再発又は転移性の子宮頸 癌の治療 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 11
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 用 法 ・ 用量 病勢進行又は許容できない毒性が見られるまで,本剤の投与を継続する こと。 転移性結腸・直腸癌: 静注フルオロウラシルを含む化学療法との併用により,2週間隔で5 mg/kg 又は10 mg/kg を点滴静注する。 ・IFL 療法との併用により5 mg/kg を投与する ・FOLFOX4との併用により10 mg/kg を投与する ・初回化学療法として本剤を含むレジメン施行後増悪した転移性結腸・ 直腸癌患者の二次治療として,フッ化ピリミジン/イリノテカン又はフ ッ化ピリミジン/オキサリプラチンをベースとして化学療法と併用によ り5 mg/kg を2週間隔又は7.5 mg/kg を3週間隔にて投与する 非扁平上皮非小細胞肺癌: 推奨用量はカルボプラチン及びパクリタキセルとの併用による15 mg/kg の3週間隔点滴静注である。 膠芽腫: 推奨用量は10 mg/kg の2週間隔点滴静注である。 転移性腎細胞癌: 推奨用量はインターフェロンα との併用による10 mg/kg の2週間隔点滴 静注である。 子宮頸癌: 推奨用量はパクリタキセルとシスプラチンとの併用,又はパクリタキセ ルとトポテカンとの併用による15mg/kg の3週間隔点滴静注である。 白金製剤抵抗性の上皮性卵巣癌,卵管癌,原発性腹膜癌: 推奨用量は,パクリタキセル,リポソーム化ドキソルビシン,トポテカ ン(1週間隔投与)との併用による10mg/kg の2週間隔点滴静注,又はト ポテカン(3週間隔投与)との併用による15mg/kg の3週間隔点滴静注で ある。 本剤は,抗悪性腫瘍剤の使用経験のある医師の監督の下で投与するこ と。 転移性結腸・直腸癌: 本剤の推奨用量は,1回5 mg/kg(体重)又は10 mg/kg(体重)の2週間 隔,若しくは7.5 mg/kg(体重)又は15 mg/kg(体重)の3週間隔点滴静注 である。 本剤の投与は,病勢進行若しくは許容できない毒性が見られるまで継続 することが望ましい。 非小細胞肺癌: 本剤は白金製剤を含む6サイクルまでの化学療法に併用し,その後,病 勢の進行が認められるまで,本剤単剤投与を行う。 本剤の推奨用量は7.5又は15 mg/kg(体重)の3週間隔点滴静注である。 非小細胞肺癌患者での臨床的有用性は7.5及び15 mg/kg のいずれの用量で も認められている(「臨床成績」の項を参照)。 本剤の投与は,病勢進行若しくは許容できない毒性が見られるまで継続 することが望ましい。 転移性乳癌: 本剤の推奨用量は,1回10 mg/kg(体重)の2週間隔又は15 mg/kg(体 重)の3週間隔点滴静注である。 本剤の投与は,病勢進行若しくは許容できない毒性が見られるまで継続 することが望ましい。 進行・転移性腎細胞癌: 本剤の推奨用量は,1回10 mg/kg(体重)の2週間隔点滴静注である。 本剤の投与は,病勢進行若しくは許容できない毒性が見られるまで継続 することが望ましい。 上皮性卵巣癌,卵管癌,原発性腹膜癌: 初回治療:本剤はカルボプラチン,パクリタキセルと併用し6サイクル まで投与を行う。その後,最大15カ月間,病勢進行又は許容できない毒 性の発現のうち最も早い時点まで,本剤単独投与を行う。 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 12
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 本剤の推奨用量は,1回15 mg/kg(体重)の3週間隔点滴静注である。 白金製剤感受性の再発治療:本剤はカルボプラチン,ゲムシタビンと併 用し6サイクル,最大10サイクルまで投与を行う。その後,病勢の進行 が認められるまで,本剤単剤投与を行う。本剤の推奨用量は,1回15 mg/kg(体重)の3週間隔点滴静注である。 白金製剤抵抗性の再発治療:本剤は,パクリタキセル,トポテカン(1 週間隔投与)又はリポソーム化ドキソルビシン,のうち一剤との併用に より投与すること。本剤は10 mg/kg(体重)を2週間隔で点滴静注する。 本剤をトポテカン(3週間隔にて Day 1-5に投与)と併用する場合,本剤 は15 mg/kg(体重)を3週間隔で点滴静注する。本剤の投与は,病勢進行 又は許容できない毒性が見られるまで継続すること。 子宮頸癌:本剤は,以下の化学療法のどちらかとの併用により投与する こと。 パクリタキセルとシスプラチン パクリタキセルとトポテカン 本剤は15mg/kg(体重)を3週間隔で点滴静注する。本剤の投与は,病勢 進行又は許容できない毒性が見られるまで継続すること。 用量調節 本剤の投与に関し減量は望ましくない。 以下の事象が現れた場合は本剤の投与を中止すること: 消化管穿孔(消化管穿孔,消化管内の瘻孔形成,腹腔内膿瘍),内臓 器官の瘻孔形成(「警告(枠囲み)」及び「警告・使用上の注意」の 項参照)。 医学的処置を必要とする創し開及び創傷治癒合併症(「警告・使用上 の注意」の項参照)。 重篤な出血(医学的処置を必要とする)(「警告(枠囲み)」及び 「警告・使用上の注意」の項参照)。 重度の動脈血栓塞栓症(「警告・使用上の注意」の項参照)。 肺塞栓症を含む致命的な(Grade4)静脈血栓塞栓症(「警告・使用上 の注意」の項参照)。 高血圧性クリーゼ又は高血圧性脳症(「警告・使用上の注意」の項参 照)。 可逆性後白質脳症症候群(「警告・使用上の注意」の項参照)。 ネフローゼ症候群(「警告・使用上の注意」の項参照)。 以下の事象が現れた場合は本剤を一時休薬すること: アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 13
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 待機手術の少なくとも4週間前には休薬(「警告・使用上の注意」の 項参照)。 医学的処置によるコントロールが不良の重度の高血圧(「警告・使用 上の注意」の項参照)。 中等度~高度の蛋白尿(「警告・使用上の注意」の項参照)。 重度のインフュージョンリアクション(「警告・使用上の注意」の項 参照)。
1.6.2.4 警告,重要な基本的注意
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 特別な警告,使用上の注意 生物学的製剤の追跡可能性を強化するために,投与された製品の商品名 とバッチ番号を患者カルテに明確に記録(若しくは記載)すべきであ る。 警 告 , 重 要 な 基 本 的注意 ( 消 化 管 穿 孔 , 瘻 孔) 警告(冒頭,枠囲み) 消化管穿孔 本剤投与により,時に致死的ともなる消化管穿孔の発現率は0.3~3.2% である。消化管穿孔が認められた患者では投与を中止すること。 (「用法・用量」の項及び「警告・使用上の注意」の項参照)。 警告(枠囲みなし) 消化管穿孔及び瘻孔 重篤でときに致死的な転帰に至る消化管穿孔の発現率が対照群に比較 し本剤投与群で増加する。消化管穿孔の発現率は,各臨床試験を通じ 0.3%~3.2%であった(「副作用」の項参照)。治療抵抗性・再発又は 転移性子宮頸癌患者における臨床試験において,本剤治療群で3.2%の 消化管穿孔が報告され,それらは全て骨盤部放射線照射歴のある患者 であった。致命的な転帰をたどったものは本剤を投与された患者のう ち1%未満であった。白金製剤による治療抵抗性の卵巣癌患者における 臨床試験においては,1.7%(3/179)の患者で消化管穿孔が報告され た。当該試験では,骨盤内検査により直腸 S 状結腸への腫瘍の巻き込 みが見られる患者や,CT スキャンにより腸管への腫瘍の巻き込みが見 られる患者,腸閉塞の臨床症状が見られる患者は対象外とされてい た。 消化管穿孔及び瘻孔(「副作用」の項参照) 本剤投与により,消化管穿孔及び胆嚢穿孔を発現する可能性が高くなる ことがある。転移性結腸・直腸癌患者において,腹腔内炎症過程は消化 管穿孔のリスク因子になる可能性があるので,このような患者に本剤を 投与する際は注意すること。治療抵抗性・再発又は転移性子宮頸癌患者 に対する本剤の治療おいて,前放射線照射は消化管穿孔のリスク因子で あり,消化管穿孔を発現した患者すべてに放射線治療歴があった。消化 管穿孔があらわれた場合には,投与を中止し,再投与しないこと。 GOG-0240試験で認められた消化管腟瘻 本剤を投与した治療抵抗性・再発又は転移性子宮頸癌患者において,腟 と消化管のあらゆる部位との間の瘻孔(消化管腟瘻)のリスクが増加し た。放射線の前治療は消化管腟瘻発現の主なリスク因子であり、消化管 腟瘻を発現した全ての患者は放射線の治療歴を有していた。放射線照射 野内での癌の再発は消化管腟瘻発現のさらなる重要なリスク因子であ る。 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 14項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 典型的な症状には腹痛,悪心,嘔吐,便秘,発熱が含まれる。穿孔に は腹腔内膿瘍,瘻孔形成,及び人工肛門造設の必要性を伴う場合があ る。多くの場合は本剤投与開始50日以内に発現した。 骨盤内検査により直腸S 状結腸への腫瘍の巻き込みが見られる患者 や,CT スキャンにより腸管への腫瘍の巻き込みが見られる患者,腸閉 塞の臨床症状が見られる患者には再度本剤を投与しないこと。 本剤の臨床試験において,転移性結腸・直腸癌及び卵巣癌の患者で は,消化管瘻の発現率は2%以下であった。子宮頸癌の臨床試験におい ては,消化管腟瘻の発現率は本剤投与群で8.3%,対照群で 0.9%であ り,全員が事前に骨盤への放射線照射を受けたことのある患者であっ た。消化管腟瘻を起こす患者は腸閉塞症も有していることや,人工肛 門造設等の外科的介入が必要となることもある。(「警告」及び「用 法・用量」の項参照) 警 告 , 重 要 な 基 本 的注意 ( 消 化 管 以 外 の 瘻 孔) 警告(枠囲みなし) 消化管以外の瘻孔 重篤でときに致死的ともなる消化管以外の部位(気管食道,気管支胸 膜,胆管,腟,腎臓及び膀胱)の瘻孔が,本剤群において対照群に比 較し高頻度にみられた。消化管以外の部位を含む瘻孔が1%以下の頻度 ではあるが,複数癌腫の臨床試験及び市販後において報告されてい る。イベントのほとんどが本剤による治療を開始して6か月以内に発現 している。 治療抵抗性・再発又は転移性子宮頸癌患者における臨床試験において は,本剤投与群では1.8%で,対照群では1.4%で消化管以外の腟,膀 胱,女性生殖管間の瘻孔が報告されている。 気管食道瘻,Grade4以上の全ての瘻孔を起こした患者には再度本剤を 投与しないこと。 内臓器官を含む瘻孔形成が起こった患者では本剤の投与を中止するこ と。(「用法・用量」の項参照) 消化管以外の瘻孔(「副作用」の項参照) 本剤投与により,瘻孔を発現するリスクが高くなることがある。 気管食道瘻又はGrade 4(NCI-CTCAE v.3)の瘻孔があらわれた場合に は,投与を中止し,再投与しないこと。その他の瘻孔を有する患者で は,本剤の投与を継続した場合の情報は限られている。消化管以外に内 瘻があらわれた場合には,本剤の投与中止を検討すること 警 告 , 重 要 な 基 本 的注意 ( 創 傷 治 癒 合 併 症) 警告(冒頭,枠囲み) 手術及び創傷治癒合併症 本剤の投与を受けた患者で,重篤及び致死的なものを含む創傷治癒合 併症及び手術に関連した合併症の発現率が上昇する。創し開が認めら れた患者では投与を中止すること。創傷治癒障害・創し開のリスクを 避けるために適切な,本剤投与終了からその後の待機手術までの期間 特別な警告,使用上の注意 創傷治癒合併症(「副作用」の項参照) 本剤は創傷治癒に好ましくない影響を及ぼす可能性がある。吻合部合併 症を含む致死的な転帰をたどる重篤な創傷治癒合併症が報告されてい る。大きな手術を行った場合は少なくとも術後28日が経過してから,又 は術創が十分に治癒してから本剤の投与を開始すること。本剤投与中に アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 15
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) は明らかになっていない。手術より28日以上前に本剤の投与を中止す ること。手術から少なくとも28日間及び術創が完全に治癒するまでは 本剤の投与を開始しないこと(「用法・用量」の項,「警告・使用上 の注意」の項及び「副作用」の項参照)。 警告(枠囲みなし) 手術及び創傷治癒合併症 非臨床試験のモデル動物において本剤による創傷治癒障害が認められ た(「非臨床における毒性」の項参照)。本剤の臨床試験において は,術後28日以上経過していない患者には本剤を投与しないこととし た。比較試験において,本剤による治療中に手術を受けた結腸・直腸 癌患者のうち重篤又は致死的なものも含む創傷治癒合併症の発現率は 15%であり,本剤の投与を受けていない患者では4%であった(「副作 用」の項参照)。 手術から少なくとも28日間又は術創が完全に治癒するまでは,本剤の 投与をするべきではない。医学的措置を必要とする創傷治癒合併症が 認められた場合は本剤の投与を中止すること。 創傷治癒合併症のリスクを避けるために適切な,本剤投与終了から その後の待機手術までの期間は明らかになっていない。しかしなが ら,本剤の半減期は約20日と推定されている。待機手術に先立って, 少なくとも28日間は本剤を休薬すること。術創が完全に治癒するまで は本剤を投与しないこと(「警告(枠囲み)」の項及び「用法・用 量」の項参照)。 本剤の投与を受けた患者において致死的な転機を含む壊死性筋膜炎の 発現が報告されている。本事象は,通常,創傷治癒遅延による合併 症,消化管穿孔又は瘻孔形成に続発して発現する。壊死性筋膜炎が認 められた患者においては,本剤の投与を中止すること(「副作用」の 項参照)。 創傷治癒合併症があらわれた患者に対しては,創傷が十分に治癒するま で本剤投与を行わないこと。待機手術を行う場合も,投与を控えるこ と。 本剤を投与した患者で,死亡例を含む壊死性筋膜炎がまれに報告され ており,その多くは,創傷治癒合併症,消化管穿孔又は瘻孔に続発して 発現している。壊死性筋膜炎が発現した患者では,本剤治療を中止し, 速やかに適切な治療を行うこと。 警 告 , 重 要 な 基 本 的 注 意 (出血) 警告(冒頭,枠囲み) 出 血 本剤投与により,喀血,消化管出血,脳出血,鼻出血,腟出血を含む 重度又は致死的な出血の発現頻度が最大で5倍であった。重篤な出血又 は直近に喀血のあった患者には本剤を投与しないこと(「用法・用 量」の項,「警告・使用上の注意」の項及び「副作用」の項参照)。 警告(枠囲みなし) 特別な警告,使用上の注意 出 血 本剤による治療を行った患者では,出血発現リスク,特に腫瘍関連出血 発現リスクが高くなる。本剤投与中にGrade 3又は4の出血(NCI-CTCAE v.3)があらわれた場合は,本剤の投与を中止し,再投与しないこと (「副作用」の項参照)。 本剤の臨床試験では,画像診断や兆候・症状に基づき,未治療の脳転移 アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 16
項目 米国添付文書(2015年12月1日版) 欧州添付文書(2015年11月18日版) 出 血 本剤投与例では,出血について2つの異なる発現パターンが認められる 可能性がある。一つは軽度の出血で最も一般的なのが Grade 1の鼻出 血,もう一つは重篤で,死亡に至る場合がある出血である。化学療法 単独群と比較して,本剤投与群において喀血,消化管出血,吐血,脳 出血,鼻出血,腟出血を含む重度又は致死的な出血の発現頻度が最大 で5倍であった。各効能を通じ,本剤の投与を受けた患者における Grade 3以上の出血事象の発現率は0.4~6.9%であった(「副作用」の項 参照)。 本剤併用群の扁平上皮非小細胞肺癌患者13例のうち4例(31%)及び本 剤併用群の非扁平上皮非小細胞肺癌患者53例のうち2例(4%)で重篤 又は致死的肺出血が認められたが,化学療法単独患者32例では認めら れなかった(0%)。 非小細胞肺癌の臨床試験において,本剤投与開始の4週間以上前に放射 線療法と手術を終えた脳転移のある患者について,一連の脳の画像の 評価が行われ,症候性の Grade 2の脳出血が本剤投与群83例中1例で報 告された(発現率1.2%,95%CI 0.06%~5.93%)。 頭蓋内出血は前治療歴のある膠芽腫患者163例中8例に認められた。そ の内2例が Grade 3~4の出血であった。 直近にティースプーン1/2杯以上の鮮血の喀血が認められた患者には 本剤を投与しないこと。出血が認められた患者では本剤の投与を中止 すること(「警告(枠囲み)」及び「用法・用量」の項参照)。 を有する患者は一律に除外されてきた。したがってその様な患者におけ る脳出血のリスクは前向きの無作為化試験では評価されていない(「副 作用」の項参照)。脳出血の兆候・症状の観察を行い,脳内出血があら われた場合には,本剤の投与を中止すること。 先天性出血素因,後天性凝固障害のある患者,又は本剤投与開始前に血 栓塞栓症の治療のため十分量の抗凝固薬が投与されていた患者における 本剤の安全性については,これらの患者が臨床試験から除外されていた ため情報がない。したがって,このような患者では投与開始前に注意す ること。しかしながら,本剤投与中に静脈血栓症を発現した患者におい て,Full dose のワルファリンと本剤を併用した場合に,Grade 3以上の出
血(NCI-CTCAE v.3)の発現率の上昇は認められなかった。 特別な警告,使用上の注意 肺出血/喀血 本剤の投与を受けた非小細胞肺癌患者において,重篤な,ときに致死的 な肺出血又は喀血が発現するおそれがある。肺出血又は喀血(2.5 mL を 超える量の鮮血)が発現してから間もない患者には本剤を投与しないこ と。 警 告 , 重 要 な 基 本 的 注 意 ( 高 血 圧) 警告(枠囲みなし) 高血圧 本剤投与群において,重度の高血圧の発現率が対照群に比べ上昇す る。複数の臨床試験における Grade 3又は4の高血圧発現率は,5~18% の範囲であった。 本剤による治療中は,血圧を2~3週間に1回は測定すること。高血圧に 対する適切な治療を行い,定期的に血圧を測定すること。本剤の投与 を中止した後でも,本剤によって高血圧が誘発又は悪化した患者にお いては定期的に血圧を測定すること。 医学的処置によるコントロールが不良の重度の高血圧があらわれた場 合には本剤を一時休薬すること。高血圧性クリーゼ又は高血圧性脳症 があらわれた場合,本剤の投与を中止すること(「用法・用量」の項 参照)。 特別な警告,使用上の注意 高血圧(「副作用」の項参照) 本剤投与例において,高血圧の発現率上昇が認められた。臨床試験にお ける安全性成績によると,高血圧の発現率は用量に依存することが示唆 されている。高血圧の既往がある場合には,本剤による治療を開始する 前に十分コントロールしておくべきである。投与開始時点でコントロー ル不能な高血圧患者に対する本剤の影響については情報がない。投与中 は血圧をモニターすることが一般的に推奨される。 高血圧は,ほとんどの場合,個々の患者の状態に合わせた,標準的な降 圧剤治療により十分に管理されていた。高血圧の管理に利尿剤を用いる ことは,シスプラチンを含む化学療法を受けている患者には推奨できな い。医学的に重大な降圧剤により十分に管理できない高血圧の場合,若 しくは高血圧性クリーゼ又は高血圧性脳症があらわれた場合は,本剤の アバスチン CC 1.6 外国におけ る使用状況等に関する資料 Page 17