消化器がん患者の術後合併症発症に対する運動器関連要因の影響力
8
0
0
全文
(2) 218. 理学療法学 第 46 巻第 4 号. 案した。本研究では,消化器がん患者を対象に先行研究. 験(6-minute walk test;以下,6MWT)を採用した。. で報告されている術後合併症発症の関連要因を収集し,. SMI は,手術前に主治医が主疾患を確定診断する目的. 構造方程式モデリングを使用して術後合併症発症に至る. で撮影された腹部 CT 画像の第 3 腰椎の左右横突起がもっ. 要因モデルを構築することで,他の関連要因を含めた運. とも鮮明に観察できるレベル(以下,L3CT 画像)から. 動器関連要因の影響力について検証することを目的と. 計測した。本研究で採用した L3CT 画像から算出する. した。. SMI は,がん患者の除脂肪量と高い相関関係. 20). が認め. られ,周術期がん患者の術後合併症と関連が報告されて. 対象と方法. いる. 17). 。計測方法は,L3CT 画像を骨格筋がもっとも反. 1.対象. 映する ‒ 29 Hounsfield unit(以下,HU)から +150 HU. 対象は,2012 年 5 月 1 日∼ 2016 年 1 月 31 日までに. に調整. 国際医療福祉大学三田病院へ手術目的で入院し,リハビ. 2 測した。計測値には,腹部各筋の断面積の和(cm )を. リテーション科へ依頼のあった周術期消化器がん患者. 2 2 2 身長の二乗(m )で正規化した値(cm /m )を採用した。. 415 例である。本研究の実施期間中において消化器がん. IKEF の計測機器には,下肢筋力強化機器のアイソメ. 患者に対する治療手技および治療機器,術後管理体制等. トリック・テスト機構(HUR,5530 レッグエクステン. に,特記すべき変更はなかった。対象者の取り込み基準. ション/カールリハブ)を使用した。計測姿勢は,対象. は,1)手術前に運動および認知機能に障害を認めず. 者の膝窩部が座面に接触し機器のグリップを把持した座. 日 常 生 活 動 作 の 指 標 で あ る Functional Independence. 位姿勢で,大. Measure が満点であった者,2)自宅退院した者とした。. 面にパッドを設置した状態とした。計測動作は,パッド. 除外基準は,1)手術前に骨転移を診断された者,2)手. に対し最大努力下で 5 秒間膝伸展筋力を発揮することと. 術前に化学療法を受けた者,3)データに欠損値を認め た者とした。本研究では,取り込み基準に該当し本研究. 21). した後,Image J1.48 で腹部各筋の断面積を計. 部を付属のベルトで固定し下. 遠位端前. した。計測値は,右下肢で 2 回計測したうちの最大値 (N)と膝関節内側の関節裂隙からパッドが下. 遠位端. 参加への同意が得られた 189 例のうち,除外基準に該当. 前面に設置している部位までの距離(m)より関節トル. した 70 例を除く 119 例を対象とした。対象者を先行研. クを算出し,対象者の体重(kg)で正規化した値(Nm/. 究に準じて術後 1 ヵ月間経過観察し. 4)6)11)17)18). ,外科. 19). 合併症基準(Clavien-Dindo 分類). の Grade Ⅰ以上に. kg)を採用した。 6MWT は,計測前にアメリカ胸部医学会のガイドラ 22). に基づき説明し実施した。計測動作は,対象者. 該当した有害事象を発症した者と有害事象を発症しな. イン. かった者の 2 群に分類し,術後合併症発症の有無を判断. が院内の勾配のない平坦な 50 m の直線コースを 6 分間. した。また,対象者の属性情報には,先行研究で報告さ. で可能な限り往復することを 1 回実施することとした。. れている術後合併症発症の関連要因. 3‒13). を参考に基本. 計測値は,計測動作中の対象者を検査者が後方から追跡. 情報(年齢,性別,がん進行度(Stage 分類),併存疾患),. し,歩行用距離測定器(セキスイ樹脂,SDM-1)を使用. 手術情報(手術部位,手術術式,手術時間,術中出血量,. して得られた歩行距離(m)を採用した。. 術中輸血量) ,手術日より 1 日以上前(以下,手術前). なお,運動器関連要因の各評価項目において,SMI. の血液検査から得られた生化学データ(Alb,血小板数,. の算出は 1 名の理学療法士が実施し,IKEF と 6MWT. 白血球数,好中球数,リンパ球数,推算糸球体濾過量,. の計測には各対象者を担当した理学療法士が実施した。. CRP) ,術後 3 日経過時の CRP,手術前の呼吸機能検査 より 1 秒率,在院日数をカルテより収集した(表 1)。. 4.体格・内臓脂肪面積評価 体格評価は,BMI を使用し,衣服着用下で計測した. 2.研究デザイン. 2 2 身長と体重を「BMI= 体重(kg)/身長 (m )」の式. 研究デザインは,手術前に対象者から収集する運動器. に挿入し算出した。VFA は,SMI と同様の L3CT 画像. 関連要因および他の術後合併症発症の関連要因と術後. を脂肪組織がもっとも反映する ‒ 190 HU から ‒ 30 HU. 1 ヵ月間経過観察中の合併症発症の有無との関連性を検. に調整. 証する横断研究とした。. 21). した後,Image J1.48 で内臓脂肪組織の断面. 2. 積(cm )を計測した。なお,VFA の算出には,SMI 算出と同様の理学療法士 1 名が実施した。. 3.運動器関連要因評価 運動器関連要因評価には,筋肉量を腹部 computed. 5.統計学的処理. tomographic scanning(以下,CT)画像より算出した. 対象者各群において術後合併症発症の関連要因は,対. SMI,筋力を等尺性膝伸展筋力(Isometric Knee Exten-. 応のない t 検定とカイ二乗検定を使用して比較した。対. sion Force;以下,IKEF) ,運動耐容能を 6 分間歩行試. 象者各群で有意差を認めた術後合併症発症の関連要因.
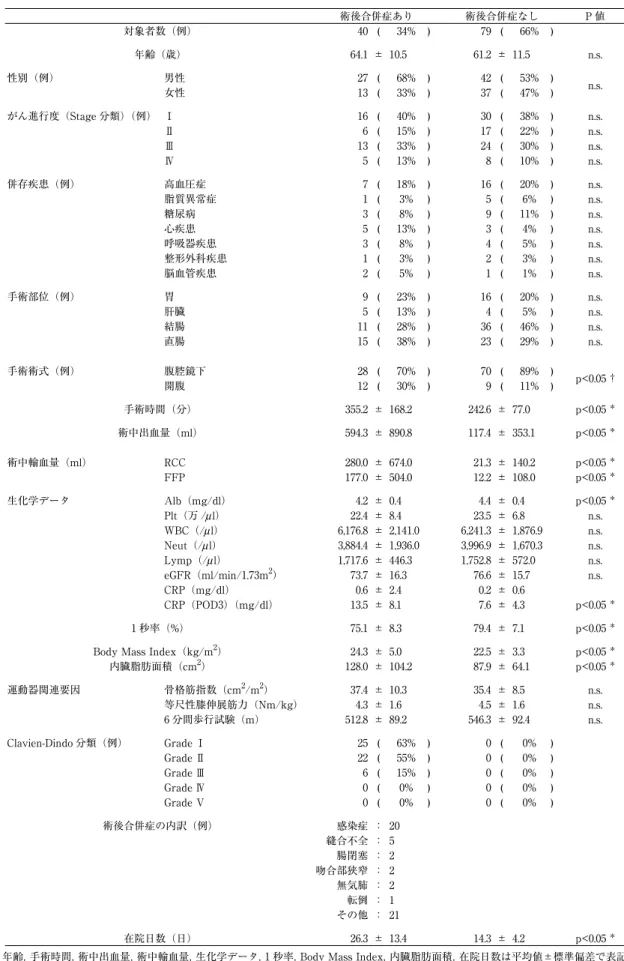
(3) 消化器がん患者の術後合併症発症に対する運動器関連要因の影響力. 219. 表 1 対象者の術後合併症発症に関連する属性情報と各パラメーター 対象者数(例). 術後合併症あり 40 ( 34%. 年齢(歳). 64.1 ± 10.5. 性別(例). 男性 女性. がん進行度(Stage 分類)(例) Ⅰ Ⅱ Ⅲ Ⅳ. ). 術後合併症なし 79 ( 66%. P値 ). 61.2 ± 11.5. n.s.. 27 ( 13 (. 68% 33%. ) ). 42 ( 37 (. 53% 47%. ) ). n.s.. 16 6 13 5. ( ( ( (. 40% 15% 33% 13%. ) ) ) ). 30 17 24 8. ( ( ( (. 38% 22% 30% 10%. ) ) ) ). n.s. n.s. n.s. n.s.. 7 1 3 5 3 1 2. ( ( ( ( ( ( (. 18% 3% 8% 13% 8% 3% 5%. ) ) ) ) ) ) ). 16 5 9 3 4 2 1. ( ( ( ( ( ( (. 20% 6% 11% 4% 5% 3% 1%. ) ) ) ) ) ) ). n.s. n.s. n.s. n.s. n.s. n.s. n.s.. 併存疾患(例). 高血圧症 脂質異常症 糖尿病 心疾患 呼吸器疾患 整形外科疾患 脳血管疾患. 手術部位(例). 胃 肝臓 結腸 直腸. 9 5 11 15. ( ( ( (. 23% 13% 28% 38%. ) ) ) ). 16 4 36 23. ( ( ( (. 20% 5% 46% 29%. ) ) ) ). n.s. n.s. n.s. n.s.. 手術術式(例). 腹腔鏡下 開腹. 28 ( 12 (. 70% 30%. ) ). 70 ( 9 (. 89% 11%. ) ). p<0.05 †. 手術時間(分). 355.2 ± 168.2. 242.6 ± 77.0. p<0.05 *. 術中出血量(ml). 594.3 ± 890.8. 117.4 ± 353.1. p<0.05 *. 280.0 ± 674.0 177.0 ± 504.0. 21.3 ± 140.2 12.2 ± 108.0. p<0.05 * p<0.05 *. 術中輸血量(ml). RCC FFP. 生化学データ. Alb(mg/dl) Plt(万 /μ l) WBC(/μ l) Neut(/μ l) Lymp(/μ l) 2 eGFR(ml/min/1.73m ) CRP(mg/dl) CRP(POD3)(mg/dl) 1 秒率(%) 2. Body Mass Index(kg/m ) 内臓脂肪面積(cm2) 2. 2. 運動器関連要因. 骨格筋指数(cm /m ) 等尺性膝伸展筋力(Nm/kg) 6 分間歩行試験(m). Clavien-Dindo 分類(例). Grade Ⅰ Grade Ⅱ Grade Ⅲ Grade Ⅳ Grade Ⅴ. 術後合併症の内訳(例). 在院日数(日). 4.2 22.4 6,176.8 3,884.4 1,717.6 73.7 0.6 13.5. ± ± ± ± ± ± ± ±. 0.4 8.4 2,141.0 1,936.0 446.3 16.3 2.4 8.1. 4.4 23.5 6,241.3 3,996.9 1,752.8 76.6 0.2 7.6. ± ± ± ± ± ± ± ±. p<0.05 * n.s. n.s. n.s. n.s. n.s.. 0.4 6.8 1,876.9 1,670.3 572.0 15.7 0.6 4.3. p<0.05 *. 75.1 ± 8.3. 79.4 ± 7.1. p<0.05 *. 24.3 ± 5.0 128.0 ± 104.2. 22.5 ± 3.3 87.9 ± 64.1. p<0.05 * p<0.05 *. 37.4 ± 10.3 4.3 ± 1.6 512.8 ± 89.2. 35.4 ± 8.5 4.5 ± 1.6 546.3 ± 92.4. n.s. n.s. n.s.. 25 22 6 0 0 感染症 縫合不全 腸閉塞 吻合部狭窄 無気肺 転倒 その他. ( ( ( ( ( : : : : : : :. 63% 55% 15% 0% 0%. ) ) ) ) ). 0 0 0 0 0. ( ( ( ( (. 0% 0% 0% 0% 0%. ) ) ) ) ). 20 5 2 2 2 1 21. 26.3 ± 13.4. 14.3 ± 4.2. p<0.05 *. 年齢,手術時間,術中出血量,術中輸血量,生化学データ,1 秒率,Body Mass Index,内臓脂肪面積,在院日数は平均値±標準偏差で表記, その他は実測値(割合)で表記 生化学データ,1 秒率,Body Mass Index,内臓脂肪面積,運動器関連要因は,手術前のデータを表記 CRP は,手術前と手術後 3 日のデータを表記 術後合併症の内訳は件数のみ表記,Clavien-Dindo 分類,術後合併症の内訳は重複症例あり RCC; red cell concentrates, FFP; fresh frozen plasma, Alb; serum albumin, Plt; platelet, WBC; white blood corpuscles, Neut; neutrophil, Lymp; lymphocyte, eGFR; estimate glomerular filtration rate, CRP; C-reactive protein,POD; postoperative day *; 対応のない t 検定 , †; カイ二乗検定 , n.s.; not significant.
(4) 220. 理学療法学 第 46 巻第 4 号. は,術後合併症発症の有無を従属変数に設定したロジス ティック回帰分析(変数増加法:尤度比)の独立変数と して投入した。なお,ロジスティック回帰モデルの適合 度判定には,ホスマー・レメショウの検定を使用した。 次に対象者から収集した運動器関連要因とロジス ティック回帰分析から検出された術後合併症発症の関連 要因を使用して,術後合併症発症に至る仮説モデルと, 仮説モデルを修正した修正モデルを構造方程式モデリン グのパス解析で検証した。仮説モデルと修正モデルの適 2 合度判定には,χ 値,CMIN/DF,GFI,CFI,RMSEA 2 を使用した。各適合度判定指標は,χ 値が有意でなく,. CMIN/DF が 2:1,GFI と CFI が 0.95 以上で 1 により近 い 数 値,RMSEA が 0.07 以 下 の 数 値 で あ る こ と を 基 準. 23). に良好な適合度を有するモデルと判断した。統計. ソフトには,IBM SPSS Statistics 24.0 および IBM SPSS Amos 24.0 を使用し,有意水準 5% とした。. 図 1 パス解析を用いた消化器がん患者が術後合併症発症に 至る要因構造の仮説モデル パス図では,図中に標準化係数を示し,各要因の外生変数を 簡略化して図示 モデル適合度:χ 2 値 = 31.970, df = 6, p = 0.00, CMIN/DF = 5.328, GFI = 0.924, CFI = 0.751, RMSEA = 0.191, * = p<0.05 SMI; Skeletal Muscle Index, 6MWT; 6-Minute Walk Test, IKEF; Isometric Knee Extension Force, CRP; C-reactive protein, POD; postoperative day. 6.倫理的配慮 本研究は,国際医療福祉大学三田病院倫理委員会の承. 血量,1 秒率を術後合併症発症の有無に対して直接的に. 認(5-15-1)を受け実施した。なお対象者には,研究の. 関連させ,各運動器関連要因を研究仮説にしたがい探索. 趣旨や目的,研究結果の取り扱いなどについて書面で十. 的に,術後合併症発症の有無に対して直接的および術後. 分に説明し同意を得た。. 3 日経過時の CRP,術中出血量,1 秒率を介して間接的. 結 果 1.術後合併症発症に関連する属性情報および各パラ メーター. に関連させて構築した(図 1)。この仮説モデルの適合 2 度は,すべての指標で判定基準を満たさなかった(χ. 値 = 31.970, df = 6, p = 0.00, CMIN/DF = 5.328, GFI = 0.924, CFI = 0.751, RMSEA = 0.191) 。. 対象者各群における術後合併症発症に関連する属性情 報および各パラメーターは,表 1 に示した。対象者各群 では,手術術式,手術時間,術中出血量,術中輸血量,. 3.消化器がん患者における術後合併症発症に至る要因 構造の修正モデル検証. 手術前の Alb,術後 3 日経過時の CRP,1 秒率,BMI,. 修正モデルでは,有意でなかった各運動器関連要因の. VFA に有意差が認められた。次に術後合併症発症の有. 術後合併症発症の有無に対する直接的影響と術後 3 日経. 無(有:1,無:0)を従属変数に設定したロジスティッ. 過時の CRP,術中出血量,1 秒率に対する直接的影響を. ク回帰分析(変数増加法:尤度比)の独立変数として対. 除外し再検証した(図 2)。この修正モデルの適合度は,. 象者各群で有意差が認められた属性情報および各パラ. 2 CFI 以外のすべての指標で判定基準を満たした(χ 値. メーターを投入した結果,術後 3 日経過時の CRP(偏. = 14.000, df = 9, p = 0.12, CMIN/DF = 1.556, GFI =. 回 帰 係 数:0.163, 有 意 確 率:0.000, オ ッ ズ 比:1.177,. 0.963, CFI = 0.940, RMSEA = 0.068) 。各観測変数の標. 95% 信頼区間:1.083 ‒ 1.279) ,術中出血量(偏回帰係数:. 準化直接効果,標準化間接効果,標準化総合効果は,表. 0.001,有意確率:0.004,オッズ比:1.001,95% 信頼区. 2 に示した。消化器がん患者の運動器関連要因は,術後. 間:1.000 ‒ 1.002) ,1 秒率(偏回帰係数:‒ 0.083,有意確. 合併症発症に他の関連要因を介して SMI が正の影響,. 率:0.016,オッズ比:0.920,95% 信頼区間:0.860 ‒ 0.985). 6MWT が負の影響を示した。. が有意な独立変数として検出された。なお,モデルカイ 二乗検定は有意であり,ホスマー・レメショウの検定結. 考 察. 果は p = 0.321 で良好であった。. 1.消化器がん患者における術後合併症発症の関連要因. 2.消化器がん患者における術後合併症発症に至る要因. 本研究では,他の術後合併症発症の関連要因と比較し. について 構造の仮説モデル検証. て術後 3 日経過時の CRP,術中出血量,手術前の 1 秒. 仮説モデルは,ロジスティック回帰分析で有意な独立. 率が消化器がん患者の術後合併症発症に強く関連する要. 変数として検出された術後 3 日経過時の CRP,術中出. 因であることが明らかとなった。.
(5) 消化器がん患者の術後合併症発症に対する運動器関連要因の影響力. 221. 術後の CRP 上昇は,手術侵襲に伴い損傷した細胞の. 機能不全となり術後合併症発症に至る 31)。この手術操. 修復や病原体侵入防止など生体内での免疫反応を捉える. 作による急性出血は,さらに高度となると消化器がん患. ことができ. 24). ,特に術後における T リンパ球機能の低 24)25). 者の術後死亡率が増加する. 32). 。これらのことより術中. 。加え. 出血量は,消化器がん患者の術後合併症発症の関連要因. て,周術期において CRP は,術後 48 時間に最大値を示. として検出されたと推察する。しかしながら術中出血量. 下や蛋白異化に伴う高血糖などを反映する し,術後 120 時間まで変動し続ける. 26). 。これらのこと. より,CRP は,手術侵襲に伴う生体反応の変化を捉え る代表的な指標として位置づけられている. 27). 。消化器. は,消化器がん患者が受けた手術術式に依存するため, 手術術式を統制した対象者で術後合併症発症の有無に対 する影響力を再検討すべきである。. がん患者においても CRP は,前述したように手術侵襲. 一般的に全身麻酔下で手術を受けた患者は,術後に肺. に伴う免疫反応を捉えられることが推察され,特に術後. 機能が低下する. 3 日経過時の CRP 上昇が術後感染症発症の関連要因と. 術後肺機能低下に伴う痰の喀出量低下や手術治療に伴う. して有用と報告されている. 12). 。本研究では,消化器が. 33). 。加えて周術期患者では,前述した. 痰量の増加が術後合併症発症率の関連要因と報告されて 34). 。手術前の 1 秒率は,痰の喀出に重要な自発的. ん患者の術後合併症が創部感染や縫合不全など感染症の. いる. 割合が多く(表 1),先行研究と同様に術後 3 日経過時. 最大咳嗽時の呼出流速と呼出気量を関連する. の CRP が消化器がん患者に術後感染症と関連した可能. に手術前の 1 秒率は,対象者の喫煙歴や閉塞性肺疾患の. 性が推察される。. 既往などに伴う肺機能低下を反映し. 手術操作より急性出血した生体内では,体液維持や交. 響する気道内の線毛運動低下なども間接的に反映す. 換に加え,血中内のヘモグロビン低下に伴う生体組織の. る. 低酸素状態を回避するために心拍出量を増加させ生命維. 術前の 1 秒率低下は,術後合併症発症と関連することが. 持を図る. 28). 。生体組織への酸素供給量確保は,手術侵. 襲に伴う免疫反応にも重要であり. 29). ,酸素要求量を確. 保できない場合,生体組織が酸素負債を引き起こし. 30). 35). 。さら. 36). ,痰の喀出に影. 37). 。これらのことから,消化器がん患者において手. 報告されている. 13). 。本研究では,消化器がん患者の詳. 細な喫煙歴や厳密な閉塞性肺疾患既往の実態など調査で きていないが,手術前の 1 秒率が痰の喀出能力を反映し, 術後合併症発症の関連要因として検出された可能性が推 察される。 以上のことより消化器がん患者では,他の要因と比較 し,術後 3 日経過時の CRP,術中出血量,手術前の 1 秒率が術後合併症発症に強く関連する要因であることが 明らかとなった。 2.消化器がん患者の術後合併症発症に対する運動器関 連要因の位置づけ 消化器がん患者が術後合併症発症に至る要因構造モデ. 図 2 パス解析を用いた消化器がん患者が術後合併症発症に 至る要因構造の修正モデル パス図では,図中に標準化係数を示し,各要因の外生変数を 簡略化して図示 モデル適合度:χ 2 値 = 14.000, df = 9, p = 0.12, CMIN/DF = 1.556, GFI = 0.963, CFI = 0.940, RMSEA = 0.068, * = p<0.05 SMI; Skeletal Muscle Index, 6MWT; 6-Minute Walk Test, CRP; C-reactive protein, POD; postoperative day. ルを検証した結果より運動器関連要因は,SMI が術後 3 日経過時の CRP,6MWT が術後 3 日経過時の CRP と 術中出血量の各々を介して間接的に影響することが明ら かとなった(図 2) 。 消化器がん患者において SMI は,術後合併症発症の 関連要因. 17). であるが,本研究の結果より術後合併症発. 表 2 修正モデルにおける術後合併症発症に対する各観測変数の影響 標準化直接効果 CRP(POD3) 術中出血量 1 秒率 SMI 6MWT. 標準化間接効果. 0.395. 標準化総合効果 0.395. 0.282. 0.282. ‒ 0.199. ‒ 0.199 0.187. 0.187. ‒ 0.158. ‒ 0.158. CRP; C-reactive protein, SMI; Skeletal Muscle Index, 6MWT; 6-Minute Walk Test, POD; postoperative day.
(6) 222. 理学療法学 第 46 巻第 4 号. 症に対して直接影響せず,術後 3 日経過時の CRP を介. 短縮やそれに伴う医療経済効果が期待できると考える。. して正の影響を示すことが明らかとなった(図 2,表 2) 。 一般的に骨格筋量は,手術侵襲に伴う免疫反応活性のエ. 3.本研究の限界. ネルギー源を反映する重要な要因として位置づけられて. 本研究は,通常の周術期医療で得られる計測値を採. いる. 38). 。また,本研究において SMI と関連した術後の. CRP は,前述したように手術侵襲に伴う免疫反応や術. 用,収集しているため,テストステロン シトニン. 44). ,プレアルブミン. 45). 43). やプロカル. など通常診療外のバ. 27). イオマーカーを含めた検証ができていない。また,本研. したがって,消化器がん患者の術後合併症発症には,術. 究は,単施設での観察研究であるため,対象者の選択バ. 後に CRP が反映する手術侵襲に伴う免疫反応の高低が. イアスを考慮した多施設共同観察研究や運動器関連要因. 強く関連し,手術前の SMI が免疫反応活性のエネルギー. の影響力を検証する介入研究などを実施し,より信頼性. 源を反映していると推察する。これらのことより消化器. のある見解を導き出す必要がある。. 後の生体反応の変化を反映する代表的な指標である. 。. がん患者において手術前の SMI は,術後合併症発症の 軽減に寄与せず,あくまで手術侵襲に伴う免疫反応のエ. 結 論. ネルギー源として重要な位置づけにある可能性が推察さ. 消化器がん患者の運動器関連要因は,手術前運動耐容. れた。一方で IKEF は,消化器がん患者の術後合併症発. 能の高低が術後合併症発症の有無に対し,術後 3 日経過. 症に対して有意な直接的および間接的な影響力が認めら. 時の CRP,術中出血量を介した間接的な影響力を有す. れなかった。一般的に筋力は免疫反応のエネルギー源で. る可能性が明らかとなった。. ある骨格筋量と直線的な関係性になく. 39)40). ,IKEF で. は除脂肪量と比較して免疫機能と弱い関係性にあること が報告されている. 41). 。したがって,消化器がん患者の. 免疫機能が影響する術後合併症発症には,IKEF より SMI が強い影響力を有した可能性が推察される。 リハビリテーション医学分野において 6MWT は,骨 格筋など末梢器官での酸素利用増加と呼吸循環器による 全身性酸素供給の双方を捉え. 42). ,酸素摂取量,二酸化. 炭素の排出量,肺血流量などを反映する 肺機能予備力の評価スケールである. 30). 簡易的な心. 22)30). 。本研究の結. 果より 6MWT は,消化器がん患者の術後合併症発症に 直接影響せず,術後 3 日経過時の CRP と術中出血量を 介して負の影響を示すことが明らかとなった(図 2,表 2)。前述したように術後 CRP は手術侵襲に伴う免疫反 応の多寡. 24). ,術中出血量は術後の生体組織の低酸素状. 態回避に伴う循環動態への負担. 28). を各々反映する。周. 術期症例では,手術前より心肺機能予備力が高い者ほ ど,術後に生体組織内で酸素負債を起こさず全身性酸素 供給量を確保でき,手術侵襲に伴う生体反応に適応でき る可能性が高いと推察する。したがって,消化器がん患 者において手術前の 6MWT は,手術侵襲に伴う免疫反 応活性や低酸素状態回避などの生体反応に適応する心肺 機能予備力を反映し,術後 CRP と術中出血量を介して 術後合併症発症の軽減に寄与した可能性が推察された。 以上のことより,消化器がん患者において手術前の運 動器関連要因は,術後の生体反応を反映する因子を介し て術後合併症発症に関連し,心肺機能予備力を反映する 6MWT が術後合併症発症の軽減に寄与する可能性が明ら かとなった。消化器がん患者に対する手術前の運動耐容 能を向上させることを目的とした理学療法介入が,術後 合併症発症予防へ貢献できる可能性があり,在院日数の. 利益相反 本研究に開示すべき利益相反はない。 文 献 1)Brown SR, Mathew R, et al.: The impact of postoperative complications on long-term quality of life after curative colorectal cancer surgery. Ann Surg. 2014; 259: 916‒923. 2)Farid SG, Aldouri A, et al.: Correlation between postoperative infective complications and long-term outcomes after hepatic resection for colorectal liver metastasis. Ann Surg. 2010; 251: 91‒100. 3)Koch M, Antolovic D, et al.: Leucocyte-depleted blood transfusion is an independent predictor of surgical morbidity in patients undergoing elective colon cancer surgery-a single-center analysis of 531 patients. Ann Surg Oncol. 2011; 18: 1404‒1411. 4)Kubota T, Hiki N, et al.: Significance of the inflammationbased Glasgow prognostic score for short- and long-term outcomes after curative resection of gastric cancer. J Gastrointest Surg. 2012; 16: 2037‒2044. 5)Kvasnovsky CL, Adams K, et al.: Elderly patients have more infectious complications following laparoscopic colorectal cancer surgery. Colorectal Dis. 2016; 18: 94‒100. 6)Hanaoka M, Yasuno M, et al.: Morphologic change of the psoas muscle as a surrogate marker of sarcopenia and predictor of complications after colorectal cancer surgery. Int J Colorectal Dis. 2017; 32: 847‒856. 7)Haruki K, Shiba H, et al.: Negative impact of surgical site infection on long-term outcomes after hepatic resection for colorectal liver metastases. Anticancer Res. 2013; 33: 1697‒1703. 8)Mörner M, Gunnarsson U: Volume of blood loss during surgery for colon cancer is a risk determinant for future small bowel obstruction caused by recurrence ̶ a population-based epidemiological study. Langenbecks Arch Surg. 2015; 400: 599‒607. 9)Ge X, Dai X, et al.: Early Postoperative Decrease of Serum Albumin Predicts Surgical Outcome in Patients Undergoing Colorectal Resection. Dis Colon Rectum. 2017;.
(7) 消化器がん患者の術後合併症発症に対する運動器関連要因の影響力 60: 326‒334. 10)Inaoka K, Kanda M, et al.: Clinical utility of the plateletlymphocyte ratio as a predictor of postoperative complications after radical gastrectomy for clinical T2-4 gastric cancer. World J Gastroenterol. 2017; 23: 2519‒2526. 11)Mohri Y, Tanaka K, et al.: Impact of Preoperative Neutrophil to Lymphocyte Ratio and Postoperative Infectious Complications on Survival After Curative Gastrectomy for Gastric Cancer: A Single Institutional Cohort Study. Medicine (Baltimore). 2016; 95: e3125. 12)Platt JJ, Ramanathan ML, et al.: C-reactive protein as a predictor of postoperative infective complications after curative resection in patients with colorectal cancer. Ann Surg Oncol. 2012; 19: 4168‒4177. 13)Shiozaki A, Fujiwara H, et al.: Risk factors for postoperative respiratory complications following esophageal cancer resection. Oncol Lett. 2012; 3: 907‒912. 14)Tanaka Y, Kanda M, et al.: Usefulness of preoperative estimated glomerular filtration rate to predict complications after curative gastrectomy in patients with clinical T2-4 gastric cancer. Gastric Cancer. 2017; 20: 736‒743. 15)Chen CH, Ho-Chang, et al.: Hand-grip strength is a simple and effective outcome predictor in esophageal cancer following esophagectomy with reconstruction: a prospective study. J Cardiothorac Surg. 2011; 6: 98. 16)Smith TP, Kinasewitz GT, et al.: Exercise capacity as a predictor of post-thoracotomy morbidity. Am Rev Respir Dis. 1984; 129: 730‒734. 17)Lieffers JR, Bathe OF, et al.: Sarcopenia is associated with postoperative infection and delayed recovery from colorectal cancer resection surgery. Br J Cancer. 2012; 107: 931‒936. 18)Ozoya OO, Siegel EM, et al.: Quantitative Assessment of Visceral Obesity and Postoperative Colon Cancer Outcomes. J Gastrointest Surg. 2017; 21: 534‒542. 19)Clavien PA, Barkun J, et al.: The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009; 250: 187‒196. 20)Mourtzakis M, Prado CM, et al.: A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab. 2008; 33: 997‒1006. 21)Mitsiopoulos N, Baumgartner RN, et al.: Cadaver validation of skeletal muscle measurement by magnetic resonance imaging and computerized tomography. J Appl Physiol. 1998; 85: 115‒122. 22)ATS Committee on Proficiency Standard for Clinical Pulmonary Function Laboratories: ATS Statement guideline for six-minute walk test. Am J Respir Crit Care Med. 2002; 166: 111‒117. 23)Hooper D, Coughlan J, et al.: Structural Equation Modelling: Guidelines for Determining Model Fit. The Electronic Journal of Business Research Methods. 2008; 6: 53‒60. 24)Sander LE, Sackett SD, et al.: Hepatic acute-phase proteins control innate immune responses during infection by promoting myeloid-derived suppressor cell function. J Exp Med. 2010; 207: 1453‒1464. 25)Fietta AM, Morosini M, et al.: Systemic inflammatory response and downmodulation of peripheral CD25+Foxp3+ T-regulatory cells in patients undergoing radiofrequency thermal ablation for lung cancer. Hum Immunol. 2009; 70: 477‒486.. 223. 26)Colley CM, Fleck A: Early time course of the acute phase protein response in man. J Clin Pathol. 1983; 36: 203‒207. 27)Brewster N, Guthrie C, et al.: CRP levels as a measure of surgical trauma: a comparison of different general surgical procedures. J R Coll Surg Edinb. 1994; 39: 86‒88. 28)Allen JB, Allen FB: The minimum acceptable level of hemoglobin. Int Anesthesiol Clin. 1982; 20: 1‒22. 29)Gilbreth EM, Weisman IM: Role of exercise stress testing in preoperative evaluation of patients for lung resection. Clin Chest Med. 1994; 15: 389‒403. 30)Ferguson MK, Lehman AG, et al.: The role of diffusing capacity and exercise tests. Thorac Surg Clin. 2008; 18: 9‒17. 31)Shoemaker WC, Appel PL, et al.: Tissue oxygen debt as a determinant of lethal and nonlethal postoperative organ failure. Crit Care Med. 1988; 16: 1117‒1120. 32)Spence RK, Carson JA: Elective surgery without transfusion: influence of preoperative hemoglobin level and blood loss on mortality. Am J Surg. 1990; 159: 320‒324. 33)Ford GT, Whitelaw WA, et al.: Diaphragm function after upper abdominal surgery in humans. Am Rev Respir Dis. 1983; 127: 431‒436. 34)Yamashita S, Yamaguchi H, et al.: Effect of smoking on intraoperative sputum and postoperative pulmonary complication in minor surgical patients. Respir Med. 2004; 98: 760‒766. 35)Koike T, Hirono T, et al.: Pulmonary complication after resection of lung cancer ̶ difficulty in expectoration and cough dynamics. Nihon Kyobu Geka Gakkai Zasshi. 1989; 37: 1889‒1892. 36)Kuwano H, Sumiyoshi K, et al.: Relationship between preoperative assessment of organ function and postoperative morbidity in patients with oesophageal cancer. Eur J Surg. 1998; 164: 581‒586. 37)Vastag E, Matthys H, et al.: Mucociliary clearance in smokers. Eur J Respir Dis. 1986; 68: 107‒113. 38)Souba WW, Austgen TR: Interorgan glutamine flow following surgery and infection. JPEN J Parenter Enteral Nutr. 1990; 14: 90S‒93S. 39)Goodpaster BH, Park SW, et al.: The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. J Gerontol A Biol Sci Med Sci. 2006; 61: 1059‒1064. 40)Janssen I, Baumgartner RN, et al.: Skeletal muscle cutpoints associated with elevated physical disability risk in older men and women. Am J Epidemiol. 2004; 159: 413‒421. 41)Al-Attar A , Presnell SR, et al.: Human Body Composition and Immunity: Visceral Adipose Tissue Produces IL-15 and Muscle Strength Inversely Correlates with NK Cell Function in Elderly Humans. Front Immunol. 2018; 9: 440. 42)Olsen GN: The evolving role of exercise testing prior to lung resection. Chest. 1989; 95: 218‒225. 43)Sah BK, Chen MM, et al.: Does testosterone prevent early postoperative complications after gastrointestinal surgery? World J Gastroenterol. 2009; 15: 5604‒5609. 44) Takakura Y, Hinoi T, et al.: Procalcitonin as a predictive marker for surgical site infection in elective colorectal cancer surgery. Langenbecks Arch Surg. 2013; 398: 833‒839. 45)Zhou J, Hiki N, et al.: Role of Prealbumin as a Powerful and Simple Index for Predicting Postoperative Complications After Gastric Cancer Surgery. Ann Surg Oncol. 2017; 24: 510‒517..
(8) 224. 理学療法学 第 46 巻第 4 号. 〈Abstract〉. The Effect of Musculoskeletal Factors on Postoperative Complications in Patients with Gastrointestinal Cancer. Tsuyoshi HARA, PT, PhD, Akira KUBO, PT, PhD Department of Physical Therapy, School of Health Science, International University of Health and Welfare Eisuke KOGURE, PT, PhD Itabashi Rehabili Home Visit Nursing Station. Purpose: The purpose of this study was to examine the effects of musculoskeletal factors on postoperative complications using structural equation modeling in patients with gastrointestinal cancers. Methods: The study included 119 perioperative patients with gastrointestinal cancer [69 men and 50 women aged 62.2 ± 11.2 years (mean ± SD)]. Musculoskeletal factors included measurement of skeletal muscle index (SMI), which was determined by the cross-sectional area of the skeletal muscle on abdominal computed tomography; muscle strength, which was determined by isometric knee extension force; and exercise capacity, which was determined by 6-minute walk test (6MWT). Basic and operative information, biochemical data, and respiratory function were also collected as other factors. Statistial analysis were performed to assess the relationship between each parameter and onset of postoperative complications. Results: Musculoskeletal factors were indirectly affected by the postoperative complications; SMI 2 through C-reactive protein (CRP), 6MWT through CRP and blood loss (χ = 14.000, CMIN/DF = 1.556,. GFI = 0.963, CFI = 0.940, RMSEA = 0.068). Conclusions: Musculoskeletal factors have indirect impacts on the postoperative complications in patients with gastrointestinal cancers. Key Words: Gastrointestinal cancer patients, Postoperative complications, Musculoskeletal factors.
(9)
図
関連したドキュメント
、術後生命予後が良好であり(平均42.0±31.7ケ月),多
12.自覚症状は受診者の訴えとして非常に大切であ
therapy後のような抵抗力が減弱したいわゆる lmuno‑compromisedhostに対しても胸部外科手術を
〇新 新型 型コ コロ ロナ ナウ ウイ イル ルス ス感 感染 染症 症の の流 流行 行が が結 結核 核診 診療 療に に与 与え える る影 影響 響に
Fatiguing inspiratory muscle work causes reflex sympathetic activation in humans. 19 ) Sheel AW, Derchak PA, Morgan BJ, et al: Fatiguing inspiratory muscle work causes
〈下肢整形外科手術施行患者における静脈血栓塞栓症の発症 抑制〉
アスピリン バイアスピリン 7 日(5 日でも可) 個別検討 なし 術後早期より クロピドグレル プラビックス 7 日(5 日でも可) 7 日(5 日でも可) なし
〈下肢整形外科手術施行患者における静脈血栓塞栓症の発症 抑制〉