45-50,2017 散発性で体細胞系変異が65%[6],遺伝性で生殖細胞系変 異が95%以上に認められる[6~12]。 RETはチロンシンキナーゼ受容体であり,細胞表面に 存在し腫瘍増殖に重要な働きをしている。同様に血管内皮 増殖因子受容体(VEGFR)や上皮増殖因子受容体(EGFR) の回路も甲状腺髄様癌の増殖と関連していると報告されて おり[7~11,13],これらの知見よりRET受容体やVEG-FR,EGFRを阻害するチロシンキナーゼ阻害薬が,進行 甲状腺髄様癌に対し欧米において一次治療として推奨され るようになった[3,14](表
1
)。 今回,海外で行われた臨床試験において有効性,安全性 が検証され,国内でも承認された薬剤を中心に,分子標的 薬の臨床成績と有害事象,今後の課題について述べたい。 はじめに 甲状腺髄様癌は甲状腺癌の中でも1~2%と非常に稀な 組 織 型 で あ る が, 予 後 は 一 般 的 に 良 好 で あ る と さ れ る[1, 2]。しかし,リンパ節転移や被膜外浸潤,遠隔転 移がある場合や手術で全摘出が不可能な症例では予後不良 で[1],有望な治療が少ない状況であった。近年,甲状腺 癌の分子生物学的研究の進歩に基づき,分子標的薬による 化学療法という選択肢が加わることになった[2~5]。 髄様癌は散発性と遺伝性(3亜型)で分類されるが,と もにRET(rearranged during transfection)遺伝子変異が,別冊請求先:〒810-8563 福岡県福岡市中央区地行浜1-8-1 独立行政法人国立病院機構九州医療センター腫瘍内科 川越志穂 E-mail address:s-kawagoe@kyumed.jp
甲状腺髄様癌に対する分子標的薬
独立行政法人国立病院機構九州医療センター腫瘍内科
川越 志穂
内野 慶太
Molecular target drug for medullary thyroid cancer
Department of Medical Oncology, Clinical Research Institute, National Hospital Organization Kyushu Medical Center Shiho Kawagoe and Keita Uchino
甲状腺髄様癌は,本邦では甲状腺に発生する癌の約1~2%と稀な癌である。散発性と遺伝性がある が,髄様癌のほとんどでRET遺伝子の変異が認められる。放射線治療や化学療法の治療効果は一般的に 乏しく治療は手術が中心であるが,転移・再発症例に対しては有効な全身治療はなかった。近年,主に RET遺伝子変異と血管新生を標的とした分子標的薬の開発が進んできており,本邦でもVandetanib, Lenvatinib,Sorafenibが承認され,他の薬剤も開発途中である。Vandetanibは髄様癌に対する海外第Ⅲ 相試験,国内第Ⅱ相試験から有効な薬剤として第1選択となり,髄様癌患者への福音となっているが, 特有の副作用も発現する延命目的の治療となることからも適応,投与開始時期,副作用の管理には慎重 を要し,多診療科間,他職種間のチーム医療や診療連携を意識した診療が重要となる。
Key words: 甲状腺髄様癌(medullary thyroid cancer),分子標的薬(molecular target drug), vandetanib(vandetanib),lenvatinib(lenvatinib),sorafenib(sorafenib)
甲状腺髄様癌の診断と治療の革新
特集2
分子標的薬
1
.Vandetanib
Vandetanibは,RET,VEGFR2-3,EGFRを標的とした マルチチロシンキナーゼ受容体阻害薬であり,甲状腺髄様 癌に対する初めての分子標的薬として,欧米についで国内 でも2015年に承認された経口の薬剤である。 欧米や本邦で行われた第Ⅰ相試験において,vandetanib の推奨用量は300mg/日であり[4,15],第Ⅱ-Ⅲ相試験に おいて同量で抗腫瘍効果を得られている[16~19]。 局所進行性あるいは転移性の甲状腺髄様癌患者が2:1 の比率でvandetanib 300mg/日もしくはplaceboに割り付 けられる多施設共同無作為化二重盲検試験(ZETA trial) が行われた。この試験において,vandetanib群はplacebo 群と比較し有意に主要評価項目である無増悪生存期間 (PFS)を延長させた(PFS中央値;vandetanib群 30.5カ 月 vs. placebo群19.3カ月,ハザード比 0.46,95%信頼区間 0.31~0.69,p値<0.001)。さらに,vandetanibは奏効率45 %(placebo群 13%),病勢制御率 87%(placebo群 71%), カルシトニン奏効率69%(placebo群 3%),CEA奏効率 52%(placebo群 2%)と統計学的にも明らかに良好な結 果であった。Crossoverも容認された試験デザインであり, 全生存期間の改善は認められなかった。vandetanib治療群 28人の遺伝性髄様癌患者13人で46.4%の奏効がを認めた。 興味深いことに,散発性に分類された髄様癌のうち, RET遺伝子上のM918T変異がある患者において奏効率が 高いことが指摘されている(vandetanib群 54.5% vs. pla-cebo群 30.9%)。Grade3以上の有害事象としては下痢,高 血圧,QTc延長,疲労などが報告されており,減量が必要 であったのはvandetanib群で35%,毒性により治療を中止 したのは12%であった[20,21]。国内で行われた,14例を 対象とした第1/ 2相試験において,300mg/日の投与に より治療効果や有害事象は海外の臨床試験とほぼ同等であ り,薬剤の代謝においても日本人と欧米人で差はなかった ことが示された[22]。2
.Lenvatinib
LenvatinibはVEGFR-1,2,3,FGFR-1,2,3,4,RET,KIT, 血小板由来成長因子受容体(PDGFR)αを阻害するマル チチロンシンキナーゼ受容体阻害薬である。VEGFR阻害 活性が高く,FGFRを阻害することから,他のVEGFR阻 害剤耐性例への治療効果も期待された薬剤である[23]。 放射性ヨード治療抵抗性分化型甲状腺癌患者を対象に行 われた多施設共同無作為化二重盲検試験(SELECT trial) が行われ,主要評価項目PFS中央値を有意に延長すること が 示 さ れ た(lenvatinib群 18.3カ 月,placebo群 3.6カ 月, ハザード比 0.21,95%信頼区間 0.14~0.31,p値<0.0001)。 主な有害事象は高血圧,下痢,疲労,食欲不振,体重減少, 嘔気嘔吐,口内炎,手足症候群,蛋白尿であった[23]。 2015年に米国で放射性ヨード治療抵抗性の分化型甲状腺癌 に対し承認され,同年3月に本邦でも承認された。甲状腺 髄様癌を対象とした臨床試験は少ないが,欧米での第Ⅱ相 試験では36%で部分奏効(PR)を認め,29%で24週以上 にわたって病変の維持(SD)が可能であった[24]。国内 においては,分化癌25例,髄様癌9例,未分化癌17例に対 する第Ⅱ相試験が行われ,奏効率は髄様癌において22%で あった[25]。主な有害事象は高血圧,食欲不振,手足症候 群,疲労,蛋白尿であり,多くの患者で休薬や減量が必要 であったが,毒性による中止は認めなかった。3
.Sorafenib
Sorafenib は EGFR2,3,PDGFR β,FLT3,KIT, BRAF,RAF1,RETを抑制するマルチチロシンキナーゼ 受容体阻害薬である。腎細胞癌,肝細胞癌に承認され,甲 状腺分化癌に対しては欧米に次いで2014年3月に本邦で承 認された。 放射性ヨード治療抵抗性の甲状腺分化癌患者に対する第 Ⅲ相試験(DECISION trial)が行われ,無増悪生存期間 (PFS)中央値を有意に延長した(sorafenib 10.8カ月, placebo 5.8カ月,ハザード比 0.59,95%信頼区間 0.45~ 0.76,p値<0.0001)[26]。主な有害事象は手足症候群,下痢, 脱毛,皮疹,疲労,体重減少,高血圧であり,Grade3以 上の有害事象としては手足症候群,下痢,皮疹,疲労,高 血圧が報告されている。有害事象による減量は64.3%に認 められ,18.8%で治療の中止が必要であった。中止の理由 としては手足症候群が最多であった。 甲状腺髄様癌に対するsorafenibの治療効果のデータは 少なく,Lamらが行った16例の第Ⅱ相試験において奏効率 マルチキナーゼ阻害薬 標的分子
axitinib VEGFR1, VEGFR2, VEGFR3, PDGFR, KIT cabozantinib VEGFR2, RET, c-MET
motesanib VEGFR1, VEGFR2, VEGFR3, RET, PDGFR, KIT pazopanib VEGFR1, VEFDR2, VEGFR3, PDGFR, KIT
sorafenib VEGFR1, VEGFR2, VEGFR3, RET, PDGFR, BRAF, KIT sunitinib VEGFR1, VEGFR2, VEGFR3, RET, PDGFR, KIT, FLT3, CSF1R vandetanib VEGFR2, VEGFR3, RET, EGFR
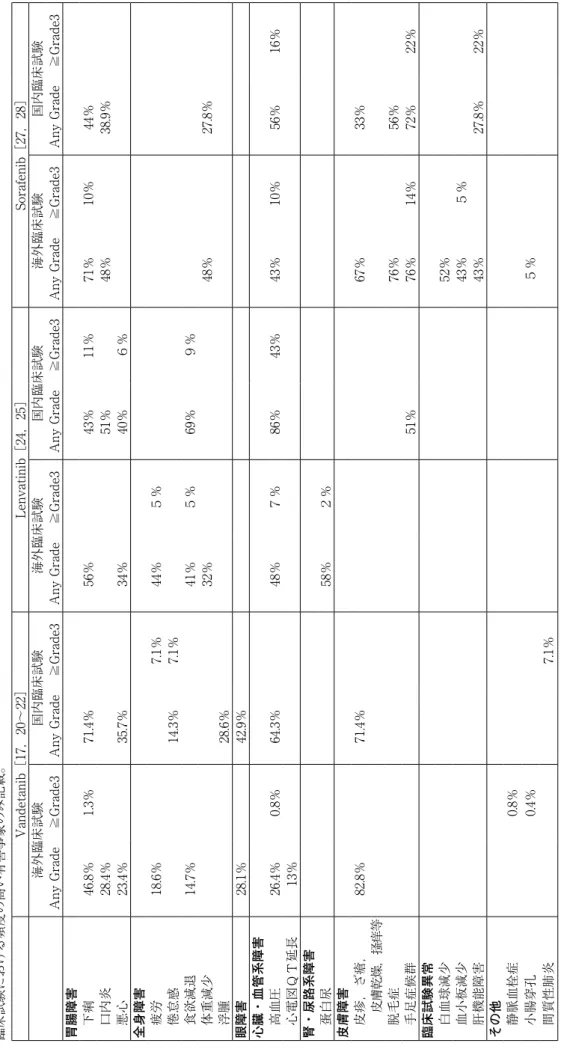
Vandetanib[17,20~22] Lenvatinib[24,25] Sorafenib[27,28] 海外臨床試験 国内臨床試験 海外臨床試験 国内臨床試験 海外臨床試験 国内臨床試験 Any Grade ≧Grade3 Any Grade ≧Grade3 Any Grade ≧Grade3 Any Grade ≧Grade3 Any Grade ≧Grade3 Any Grade ≧Grade3 胃 腸 障 害 下痢 46.8% 1.3% 71.4% 56% 43% 11% 71% 10% 44% 口内炎 28.4% 51% 48% 38.9% 悪心 23.4% 35.7% 34% 40% 6% 全 身 障 害 疲労 18.6% 7.1% 44% 5% 倦怠感 14.3% 7.1% 食欲減退 14.7% 41% 5% 69% 9% 体重減少 32% 48% 27.8% 浮腫 28.6% 眼 障 害 28.1% 42.9% 心 臓 ・ 血 管 系 障 害 高血圧 26.4% 0.8% 64.3% 48% 7% 86% 43% 43% 10% 56% 16% 心電図QT延長 13% 腎 ・ 尿 路 系 障 害 蛋白尿 58% 2% 皮 膚 障 害 皮疹,ざ瘡, 82.8% 71.4% 67% 33% 皮膚乾燥, 掻痒等 脱毛症 76% 56% 手足症候群 51% 76% 14% 72% 22% 臨 床 試 験 異 常 白血球減少 52% 血小板減少 43% 5% 肝機能障害 43% 27.8% 22% そ の 他 静脈血栓症 0.8% 小腸穿孔 0.4% 5% 間質性肺炎 7.1% 表 2 . vandetanib,lenvatinib,sorafenibの有害事象 臨床試験における頻度の高い有害事象のみ記載。
6%,SD 87.5%,PFS 17.9カ月と報告されている[27]。 現在本邦では,1~3の分子標的薬剤が承認され使用可 能となっている。Head-to-headの臨床試験がなく直接比 較は困難で使い分けについては明確な根拠がないのが現状 であるが,エビデンスレベルやコンセンサスからもvande-tanibが第一選択となる。しかし,vandetanibに不耐の患 者や適応に関し注意を要する併存疾患や相互作用のある薬 剤の内服を受けている患者では,副作用のプロファイルも 参考にlenvatinibやsorafenibを検討することも考えられる (表
2
)[17,20~22,24,25,27,28]。現時点では,逐 次治療,併用療法については明確な根拠がなく推奨されな い。4
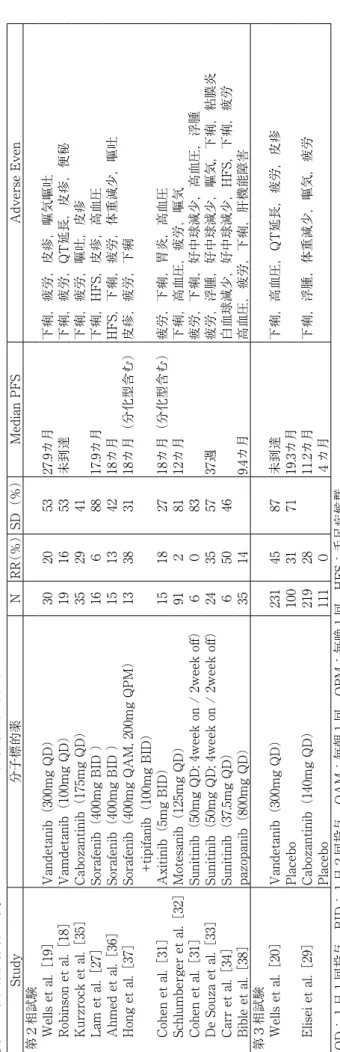
.その他の分子標的薬 Cabozantinib は VEGFR2,MET,KIT,RET,AXL, FLT3などを抑制するマルチキナーゼ阻害薬で,米国にお いて甲状腺髄様癌に対し承認されている薬剤である(本邦 では未承認)。 進行性甲状腺髄様癌患者を対象にした第Ⅲ相試験(EXAM trial)では,2:1の比率でcabozantinib 140mg/日また はplaceboに割り付けられた。PFS中央値はcabozantinib群 11.2カ月,placebo群 4.0カ月とcabozantinib投与群におい て有意に延長された(ハザード比 0.28,5% 信頼区間 0.19~0.4,p値<0.001)。登録された330例のうち,48%に RET遺伝子変異を認めていたが,PFSに遺伝子変異の有無 は関連していなかった。奏効率は28%であり,生存期間に 有意差は認められなかった[29]。奏効率や生存期間でも RET遺伝子変異の有無に有意差はなかったが,RET遺伝 子変異において最も予後の悪いM918T変異症例では生存期 間の改善を認めた(M918T変異群15カ月,他のRET変異群 9カ月,ハザード比 0.53,p=0.0179)[5,29,30]。有害 事象としては高血圧,下痢,疲労,手足症候群などが認め られ,Grade3以上の有害事象は下痢,手足症候群,疲労 などが報告されている[29]。NCCNガイドライン(2016, Version1)ではvandetanibとともにcategory 1の推奨とな っている[14]。 分化型甲状腺癌で治療効果が認められている他の多数の チロシンキナーゼ阻害薬で,甲状腺髄様癌への治療効果が 研 究 さ れ て い る( 表3
) [18~20,27,29,31~38]。Ax-itinibは分化型甲状腺癌もしくは髄様癌患者を対象とした 第Ⅱ相多施設共同研究において,甲状腺髄様癌のPRが18 %であった[31]。Motesanibは91人の甲状腺髄様癌患者の うち,81%でSD,PFS中央値は48週であったと報告され ている[32]。Sunitinibにおいても,甲状腺髄様癌患者を対 象とした第Ⅱ相試験において83%でSDであったという報 告などがあり[33~35],現在多数の臨床試験が進行中であ る。また,RET遺伝子についても研究途上であり,今後 さらなる治療の開発が期待できる。 Study 分子標的薬 N RR (%) SD(%) Median PFS Adverse Even 第2相試験 Wells et al.[19] Vandetanib(300mg QD) 30 20 53 27.9カ月 下痢,疲労,皮疹,嘔気嘔吐 Robinson et al.[18] Vamdetanib(100mg QD) 19 16 53 未到達 下痢,疲労,QT延長,皮疹,便秘 Kurzrock et al.[35] Cabozantinib(175mg QD) 35 29 41 下痢,疲労,嘔吐,皮疹 Lam et al.[27] Sorafenib(400mg BID ) 16 6 88 17.9カ月 下痢,HFS,皮疹,高血圧 Ahmed et al.[36] Sorafenib(400mg BID ) 15 13 42 18カ月 HFS,下痢,疲労,体重減少,嘔吐 Hong et al.[37]Sorafenib(400mg QAM, 200mg QPM) +tipifanib(100mg BID)
13 38 31 18カ月(分化型含む) 皮疹,疲労,下痢 Cohen et al.[31] Axitinib(5mg BID) 15 18 27 18カ月(分化型含む) 疲労,下痢,胃炎,高血圧 Schlumberger et al.[32] Motesanib(125mg QD) 91 2 81 12カ月 下痢,高血圧,疲労,嘔気 Cohen et al.[31]
Sunitinib(50mg QD; 4week on / 2week off)
6
0
83
疲労,下痢,好中球減少,高血圧,浮腫
De Souza et al.[33]
Sunitinib(50mg QD; 4week on / 2week off)
24 35 57 37週 疲労,浮腫,好中球減少,嘔気,下痢,粘膜炎 Carr et al.[34] Sunitinib(37.5mg QD) 6 50 46 白血球減少,好中球減少,HFS,下痢,疲労 Bible et al.[38] pazopanib(800mg QD) 35 14 9.4カ月 高血圧,疲労,下痢,肝機能障害 第3相試験 Wells et al.[20] Vandetanib(300mg QD) 231 45 87 未到達 下痢,高血圧,QT延長,疲労,皮疹 Placebo 100 31 71 19.3カ月 Elisei et al.[29] Cabozantinib(140mg QD) 219 28 11.2カ月 下痢,浮腫,体重減少,嘔気,疲労 Placebo 111 0 4カ月 QD;1日1回投与 BID:1日2回投与 QAM:毎朝1回 QPM:毎晩1回 HFS:手足症候群 表 3 . 甲状腺髄様癌を対象としたマルチキナーゼ阻害薬の臨床試験
おわりに 進行再発甲状腺髄様癌に対しては,本邦ではvandetanib, lenvatinib,sorafenibの3剤が承認されている。上記に述 べた通り,甲状腺髄様癌に対する第Ⅲ相試験,日本人での 安全性・有効性の検証からvandetanibが第一に選択される 薬剤と考える[19]。有害事象の管理を緻密に行うことによ って「いのちの質」を保ちながら有効性を維持し治療を継 続することが重要であり,多診療科や他職種をまじえたチ ーム医療がそれを支える基盤となる。また,現在関連5学 会においても「甲状腺癌診療連携プログラム」を構築し, 学会間の連携をもとに診療連携・教育を向上させる事業を 行っている。最後に,甲状腺癌髄様癌は進行性であっても 進行が緩徐な症例も多く,分子標的薬治療が進行を抑制す ることを目的とした治療であること,投与による様々な有 害事象が出現する可能性などを考慮した上で,投与のタイ ミングや適応症例の選択は慎重に判断するべきであり,連 携の重要性はここでも求められるものと考える。 【文 献】 1. 日本内分泌外科学会・日本甲状腺外科学会編:甲状腺腫瘍 ガ イ ド ラ イ ン2010年 版 金 原 出 版, 東 京,2010,p102-118.
2.Kloos RT, Eng C, Evans DB, et al. : Medullary thyroid cancer ; management guidelines of the American Thyroid Association. Thyroid 19 : 565-612, 2009
3. Wells SA Jr, Asa SL, Dralle H, et al. : Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid, 25 : 567-610, 2015 4. 櫻井晃洋:ATA甲状腺髄様癌取扱いガイドラインと日本
のMEN2診療の現状.日内分泌・甲状腺外会誌 32:267-273,2015
5. 高橋俊二:甲状腺髄様癌における分子標的治療の開発.日 内分泌・甲状腺外会誌 33:145-150,2016
6. Brandi ML, Gagel RF, Angeli A, et al. : Guidelines for di-agnosis and therapy of MEN type 1 and type 2. J Clin En-docrinol Metab 86 : 5658-5671, 2001
7. Carlson KM, Dou S, Chi D, et al. : Single missense muta-tion in the thyrosine kinase catalytic domain of the RET protooncogene is associated with multiple endocrine neo-plasia type 2B. Proc Natl Acad Sci U S A 91 : 1579-1583, 1994
8. Doni-Keller H, Dou S, Chi D, et al. : Mutations is the RET proto-oncogene are associated with MEN 2A and FMTC. Hum Mol Genet 2 : 851-856, 1993
9. Elisei R, Cosci B, Romei C, et al. : Prognostic significance of somatic RET oncogene mutations In sporadic medul-lary thyroid cancer ; a 10-year follow-up study. J Clin En-docrinol Metab 93 : 682-687, 2008
10. Marsh DJ, Learoyd DL, Andrew SD, et al. : Somatic muta-tions in the RET proto-oncogene in sporadic medullarry thyroid carcinoma. Clin Endocrinol(Oxf) 44 : 249-257, 1996 11. Mulligan LM, Kwok JB, Healey CS, et al. : Germ-line
muta-tions of the RET proto-oncogene in the multiple endocrine neoplasia type 2A. Nature 363 : 458-460, 1993
12. 内野眞也,野口志郎:甲状腺髄様癌におけるRET遺伝子変 異.病理と臨 29:486-490,2011
13. Carlomagno F, Vitagliano D, Guida T, et al. : ZD6474, an orally inhibitor of KDR thyrosine kinase activity, efficien-cy blocks oncologenic RET kinases. Cancer RES 62 : 7284-7290, 2002
14. National Comprehensive Cancer Network Guidelines in Oncology : Thyroid carcinoma Version 1. https : //www. nccn.org/professionals/physician_gls/pdf/thyroid.pdf Ac-cessed 2016 Nov 20
15. Moura MM, Cavaco BM, Pinto AE, et al. : Correlation of RET somatic mutations with clinicopathological features in sporadic medullary thyroid carcinomas. Br J Cancer 100 : 1777-1783, 2009
16. Holden SN, Eckhardt SG, Basser R, et al. : Clinical evalua-tion of ZD6474, an orally active inhibitor of EGFR and VEGFR2 in medullary thyroid carcinomas is related to metastasis. Endocr Relat Cancer 17 : 7-16, 2010
17. Tamura T, Minami H, Yamada Y, et al. : A Phase Ⅰ dose-escalation of ZD6474 in Japansease patients with solid, malignant tumors. J Thorac Oncol 1 : 1002-1009, 2006 18. Robinson BG, Paz-Ares L, Krebs A, et al. : Vandetanib
(100mg) in patients with locally advenced or metastatic heredity medyllary tyroid cancer. J Clin Endocrinol Metab 95 : 2664-2671, 2010
19. Wells SA Jr, Gosnell JE, Gagel RF, et al. : Vandetanib for the treatment of patients with locally advenced or meta-static heredity medullary tyroid cancer. J Clin Oncol 28 : 767-772, 2010
20. Wells SA Jr, Robinson BG, Gagel RF, et al. : Vandetanib in patients with locally advenced or metastatic medullary thyroid cancer : a rndmized, double-blind phase Ⅲ trial. J Clin Oncol 30 : 134-141, 2012
21. Kim BH, Kim IJ : Recent Updates on the Management of Medullary Thyroid Carcinoma. Endocrinol Metab(Seoul) 31 : 392-399, 2016
22. Uchino K, Komoda M, Tomomatsu J, et al. : Safety and tol-erability of vandetanib in Japanease patients with medul-lary tyroid cancer : a phase Ⅰ/Ⅱ open-label study. Endocr Pract 2016 Nov 7. [Epub ahead of print]
23. Schlumberger M, Tahara M, Wirth LJ, et al. : Lenvatinib versus Placebo in Radioiodine-Refractory Thyroid Cancer. N Engl J Med 372 : 621-630, 2015
24. Schlumberger M, Jarzab B, Cabanillas ME, et al. : A phase Ⅱ trial of the multitargeted kinase inhibitor lenvatinib
(E7080) in advanced medullary thyroid cancer (MTC). J Clin Oncol 30(Suppl) : Abstract 5591, 2012
25. Takahashi S, Tahara M, Kiyota N, et al. : Phase Ⅱ study of lenvatinib (LEN), a multi-targeted tyrosine kinase inhib-itor, in patients (pts) with all histologic subtypes of ad-vanced thyroid cancer. Annals of Oncology 25(Suppl4), 2014
26. Brose MS, Nutting CM, Jarzab B, et al. : Sorafenib in local-ly advanced or metastatic, radioactive iodinerefractory, differenciated tyroid cancer : a randomized, double-blind, phase 3 trial. Lancet 384 : 319-328, 2014
27. Lam ET, Ringel MD, Kloors RT, et al. : Phase Ⅱ Clinical Traial of Sorafenib in Metastatic Medullary Thyroid Can-cer. J Clin Oncol 28 : 2323-2330, 2010
28. バイエル薬品:国内第Ⅱ相臨床試験(試験17073)におけ る副作用.ネクサバール適正使用ガイド 95-96,2016 29. Elisei R, Schlumberger MJ, Muller SP, et al. : Cabozantinib
in Progressive Medullary Thyroid Cancer. J Clin Oncol 31 : 3639-3646, 2013
30. Covell LL, Ganti AK : Treatment of Advanced thyroid cancer : role of molecularly targeted herapies. Target On-col 10 : 311-324, 2015
31. Cohen EE, Rosen LS, Vokes EE, et al. : Axitinib Is an Ac-tive Treatment for All Histologic Subtypes of Advanced Thyroid Cancer : Results From a Phase Ⅱ Study. J Clin Oncol 26 : 4708-4713, 2008
32. Schlumberger MJ, Elisei R, Bastholt L, et al. : Phase Ⅱ Study of Safety and Efficacy of Motesanib in Patients With Pro-gressive or Symptomatic, Advanced or Metastatic Medul-lary Thyroid Cancer. J Clin Oncol 27 : 3794-3801, 2009
33. De Souza JA, Busaidy N, Zimrin A, et al. : Phase Ⅱ trial of sunitinib in medullary thyroid cancer (MTC). J Clin On-col 28(Suppl) : abstr5504, 2010
34. Carr LL, Mankoff DA, Goulart BH, et al. : Phase Ⅱ Study of Daily Sunitinib in FDG-PET-Positive, Iodine-Refractory Differentiated Thyroid Cancer and Metastatic Medullary Carcinoma of the Thyroid with Functional Imaging Cor-relation. Clin Cancer Res 16 : 5260-5268, 2010
35. Kurzrock R, Sherman SI, Ball DW, et al. : Activity of XL 184 (Cabozantinib), an oral tyrosine kinase inhibitor, in pa-tients with medullary cancer. J Clin Oncol 29 : 2660-2666, 2011
36. Ahmed M, Barbachqno Y, Riddle A, et al. : Analysis of the efficacy and toxicity of sorafenib in thyroid cancer ; a phase Ⅱ study in a UK based population. Eur J Endocri-nol 165 ; 315-322, 2012
37. Hong DS, Cabanillas ME, Wheler J, et al. : Inhibitation of the Ras/ Raf/ MEK/ ERK and RET kinase pathways with the combination of the multikinase inhibitor sorafenib and the farnesyltransferase inhibitor tipifarnib in medul-lary and differenciated tyeroid malignancies. J Clin Endo-crinol Metab 96 : 997-1005, 2011
38. Bible KC, Suman VJ, Molina JR, et al. : A Multikinase phase 2 traial of pazopanib in Metastatic and Progressive Medullary Thyroid Carcinoma : MC057H. J Clin Endocri-nol Metab 99 : 1687-1693, 2014