CS-866AZ
2.6.6 毒性試験の概要文
目 次
2.6.6 毒性試験の概要文 ... 1 1. まとめ... 1 1.1 試験概要... 1 1.2 単回投与毒性試験... 2 1.3 反復投与毒性試験... 2 1.4 遺伝毒性試験... 3 1.5 生殖発生毒性試験... 3 1.6 その他の毒性試験... 3 2. 単回投与毒性試験... 4 2.1 ラット単回経口投与毒性試験(4.2.3.1-1,TK:4.2.3.1-2) ... 4 2.2 イヌ単回経口投与毒性試験(4.2.3.1-3,TK:4.2.3.1-4) ... 5 3. 反復投与毒性試験... 5 3.1 ラット 28 日間反復経口投与毒性試験(4.2.3.2-1,TK:4.2.3.2-2) ... 5 3.2 ラット 6 箇月間反復経口投与毒性試験(4.2.3.2-3,TK:4.2.3.2-4) ... 7 3.3 イヌ 28 日間反復経口投与毒性試験(4.2.3.2-5,TK:4.2.3.2-6) ... 10 3.4 イヌ 9 箇月間反復経口投与毒性試験(4.2.3.2-7,TK:4.2.3.2-8) ... 11 4. 遺伝毒性試験... 12 4.1 細菌を用いる遺伝子突然変異試験(4.2.3.3-1)... 12 4.2 哺乳類培養細胞を用いる染色体異常試験(4.2.3.3-2)... 13 4.3 げっ歯類を用いる小核試験(4.2.3.3-3)... 13 5. がん原性試験... 13 6. 生殖発生毒性試験... 13 6.1 ラット胚・胎児発生への影響に関する試験(4.2.3.5-1,TK:4.2.3.5-2) ... 13 6.2 マウス胚・胎児発生への影響に関する試験(4.2.3.5-3,TK:4.2.3.5-4) ... 14 7. 局所刺激性試験... 14 8. その他の毒性試験... 14 8.1 イヌ心血管系への影響に関する試験(4.2.3.7-1,TK:4.2.3.7-2) ... 14 9. 考察及び結論... 15 10. 参考... 17 10.1 CS-866 の毒性試験の概要... 17 10.2 CS-905 の毒性試験の概要... 21 11. 引用文献... 24表の目次
表 2.6.6.1-1 毒性試験プログラム ... 2 表 2.6.6.2-1 ラット単回経口投与毒性試験成績... 4 表 2.6.6.2-2 イヌ単回経口投与毒性試験成績... 5 表 2.6.6.3-1 ラット 28 日間反復経口投与毒性試験成績... 7 表 2.6.6.3-2 ラット 6 箇月間反復経口投与毒性試験成績... 9 表 2.6.6.3-3 イヌ 28 日間反復経口投与毒性試験成績... 10 表 2.6.6.3-4 イヌ 9 箇月間反復経口投与毒性試験成績... 12 表 2.6.6.8-1 イヌ心血管系への影響に関する成績... 15 表 2.6.6.10-1 CS-866 の毒性試験成績一覧 ... 20 表 2.6.6.10-2 CS-905 の毒性試験成績一覧 ... 23略号一覧
略号 略していない表現(英) 略していない表現(日)
ACE Angiotensin converting enzyme アンジオテンシン変換酵素
AII Angiotensin II アンジオテンシンII
ALT Alanine aminotransferase アラニンアミノトランスフェラーゼ
ALP Alkaline phosphatase アルカリホスファターゼ
AST Aspartate aminotransferase アスパラギンアミノトランスフェラーゼ
AUC0-24h Area under the plasma concentration-time
curve up to 24h
投与後24 時間までの血漿中濃度-時間曲線 下面積
BUN Blood urea nitrogen 血液尿素窒素
CHL 細胞 Chinese hamster lung cell チャイニーズハムスター雌肺組織由来線維 芽細胞
Cmax Maximum plasma concentration 最高血漿中濃度
CMC-Na Carboxymethylcellulose sodium カルボキシメチルセルロース ナトリウム CPK Creatine phosphokinase クレアチンホスホキナーゼ
Cre Creatinine クレアチニン
DMSO Dimethyl sulfoxide ジメチルスルフォキシド
DNA Deoxyribonucleic acid デオキシリボ核酸
EPO Erythropoietin エリスロポエチン
FCA Freund’s complete adjuvant フロイド完全アジュバンド
Hb Hemoglobin ヘモグロビン
HCT Hematocrit ヘマトクリット
KO Knockout ノックアウト
LD50 50% Lethal dose 50%致死量
LDH Lactate dehydrogenase 乳酸脱水素酵素
MLA Mouse lymphoma assay マウスリンフォーマ細胞を用いた遺伝子突
然変異試験
PCA Passive cutaneous anaphylaxis 受身皮膚アナフィラキシー
RA Renin angiotensin レニン・アンジオテンシン
RBC Red blood cell 赤血球
S9 Supernatant at 9000g 9000g 上清
SANA Systemic anaphylaxis 全身アナフィラキシー
SHE assay Syrian hamster embryo cell transformation assay
ハムスター胚細胞を用いた形質転換試験
TK Toxicokinetics トキシコキネティクス
化合物一覧 略号(一般名) 由来 CS・866 (オノレメサ 原 薬 /レタンメドキソ ミ/レ) RNH-6270 CS-866の活性代謝物 CS-905 (アゼ/レニ 原 薬 ジピン) TUK-9300 CS-905の類縁物質, R4 UBS・0653 CS-905の類縁物質, R5 構 造 式 叫
4
ぢ
ト
2.6.6 毒性試験の概要文
1. まとめ 1.1 試験概要 CS-866AZ は,既承認成分であるアンジオテンシン II(AII)受容体拮抗薬の CS-866 (オルメサルタン メドキソミル)とジヒドロピリジン系カルシウムチャネル拮抗薬 の CS-905(アゼルニジピン)を有効成分とする新医療用配合剤である。非臨床毒性 試験におけるCS-866AZ の検討は,CS-866AZ の有効成分である CS-866 及び CS-905 の併用により行った。各有効成分の臨床における常用量(CS-866: 10~20 mg,CS-905: 8~16 mg)を参考として,主な非臨床毒性試験における CS-866 と CS-905 の併用比は 5:4 に設定した。毒性試験として,単回投与毒性試験,反復投与毒性試験,遺伝毒性 試験及び生殖発生毒性試験を実施した。CS-866AZ の毒性試験プログラムの概略を表 2.6.6.1-1 に示す。 胚・胎児発生への影響に関する試験では,ウサギがAII 受容体拮抗薬に対し高感受 性を示し,母動物において毒性が強く発現することから(参考資料 4.2.3.5-5),ラッ トに加え第二動物種としてマウスを用いた。がん原性試験については,各単剤にがん 原性がないこと,及びCS-866AZ において遺伝毒性がないことが示されたため,実施 しなかった。また,CS-905 のラット及びイヌ反復投与毒性試験では心臓への影響が 認められていることから,CS-866 投与量比を増加させ併用した際に CS-905 による心 血管系への影響に変化があるか否かを検討するため,イヌを用いたテレメトリー試験 をその他の毒性試験として実施した。 CS-866AZ の反復投与試験の一部では CS-866 あるいは CS-905 の単独投与との毒性 プロファイルを同一試験内で比較し,その他の毒性試験では既に報告されているそれ ぞれ単剤のプロファイルと比較した。なお,単剤の毒性試験概要を参考資料として 2.6.6.10 に示す。 以上の試験より,CS-866AZ において CS-866 あるいは CS-905 の毒性試験における 変化と質的に異なる新たな変化は発現せず,また単剤において確認されている既知の 変化の増強も認められなかった。表 2.6.6.1-1 毒性試験プログラム 試験の種類及び期間 投与経路 動物種 被験物質 単回投与毒性* 経口 ラット CS-866AZ 経口 イヌ CS-866AZ 反復投与毒性* 28 日間 経口 ラット CS-866AZ 6 箇月間 経口 ラット CS-866AZ,CS-866,CS-905 28 日間 経口 イヌ CS-866AZ 9 箇月間 経口 イヌ CS-866AZ,CS-866,CS-905 遺伝毒性* 遺伝子突然変異試験 in vitro サルモネラ菌,大腸菌 CS-866AZ 染色体異常試験 in vitro チャイニーズハムスター 肺線維芽細胞 CS-866AZ 小核試験(単回) 経口 マウス CS-866AZ 生殖発生毒性* 胚・胎児発生への影 響に関する試験 経口 経口 ラット マウス CS-866AZ CS-866AZ 経口 イヌ CS-866AZ,CS-905 その他 心血管系への影響に関す る試験(4 日間) * : GLP 遵守試験 1.2 単回投与毒性試験 ラット単回経口投与試験では,軟便・下痢や活動性の低下・腹臥位姿勢などの一般 状態の変化や体重増加抑制傾向が観察されたが,投与に起因した死亡例はなく,最小 致 死 量 は 雌 雄 と も CS-866 1000 mg/kg + CS-905 800 mg/kg [ 以 下 1800 mg/kg (O/A=1000/800 mg/kg)として記載]より大きいと考えられた(4.2.3.1-1)。イヌ単回 経口投与試験では,投与に起因すると考えられる嘔吐が認められたが,死亡例はなく, 最小致死量は 1800 mg/kg より大きいと考えられた。また,ラット及びイヌで認めら れた変化は,CS-866 あるいは CS-905 単剤で認められている変化と質的に同じと判断 した(4.2.3.1-3)。 1.3 反復投与毒性試験 ラットの28 日間反復経口投与試験では,一般状態の変化は観察されず,投与に起 因した死亡例も認められなかった。一方,CS-866 の薬理作用に関連すると思われる 二次的変化として,尿たん白,赤血球系パラメータ,BUN 及び電解質,心臓・腎臓 重量の軽度な変化が観察された(4.2.3.2-1)。CS-866 あるいは CS-905 の単独投与群を 併設した6 箇月間反復経口投与試験では,これらの変化に加え,摂水量及び尿量の増 加,尿浸透圧の低下,軽度の尿細管再生などの変化が観察されたが,休薬によりそれ らは回復することが確認された。CS-866AZ のラット 6 箇月間反復経口投与試験の無 毒性量は,22.5 mg/kg と考えられた。比較のために設けた CS-866 あるいは CS-905 単 独投与群でも同質の変化が観察され,ラットにおけるCS-866AZ の毒性プロファイル は CS-866 あるいは CS-905 の単独投与により発現する変化と質的に同じであり, CS-866 と CS-905 の併用により毒性の増強や新たな毒性の発現はないと結論した (4.2.3.2-3)。
イヌの28 日間及び 9 箇月間反復経口投与試験では,CS-866AZ 群あるいは単剤群 のいずれにおいても一般状態の変化は観察されず,投与に起因した死亡例も認められ なかった。また,体重,摂餌量,尿検査,血圧,心電図,眼科学的検査,血液学的検 査,血液化学的検査,病理解剖学的及び病理組織学的検査においても投与に起因した 変化は認められず,CS-866AZ のイヌ 9 箇月間反復経口投与試験の無毒性量は最高用 量である6.75 mg/kg と考えられた。また,CS-866 と CS-905 の併用投与による毒性の 増強や新たな毒性の発現はないと結論した(4.2.3.2-5,4.2.3.2-7)。 以上より,CS-866AZ のラット及びイヌ反復投与試験では,CS-866 あるいは CS-905 の単独投与時に観察されている所見以外の毒性学的な異常は発現しないと判断され, CS-866 と CS-905 の併用投与による毒性の質的変化及び増強が起こる可能性は低いと 考えられた。また,TK データより,毒性の質的変化及び増強を起こさない用量での ラットのRNH-6270 の曝露並びにラット及びイヌの CS-905 の曝露は,臨床における これら化合物の曝露と同等あるいはそれ以上であることが示された(4.2.3.2-4, 4.2.3.2-8)。 1.4 遺伝毒性試験
CS-866AZ の遺伝毒性の有無を検索する目的で,in vitro 試験として細菌を用いる遺 伝子突然変異試験及び哺乳類培養細胞を用いる染色体異常試験を,in vivo 試験として マウス小核試験を実施した。その結果,遺伝子突然変異試験,染色体異常試験,及び マウス小核試験のいずれにおいても陰性であったことから,CS-866AZ には遺伝毒性 はないと結論した(4.2.3.3-1,4.2.3.3-2,4.2.3.3-3)。 1.5 生殖発生毒性試験 ラットを用いた胚・胎児発生に関する試験では,67.5 mg/kg 投与群で,母動物に対 する影響として体重増加抑制傾向及び摂餌量の減少が認められたが,CS-866AZ の投 与に起因した胎児の外表異常,内臓異常,及び骨格異常は認められず,CS-866AZ の ラットに対する催奇形性は認められなかった。次世代に対する無毒性量は67.5 mg/kg であった。なお,CS-866AZ 投与による母動物の死亡例については,CS-905 単剤のラ ット器官形成期投与試験においても同用量で死亡例が認められていることから, CS-866 との併用による毒性の増強ではないと結論した(4.2.3.5-1)。マウスを用いた 胚・胎児発生に関する試験においては,675 mg/kg 投与群で,母動物に対する影響と して摂餌量の減少が認められたが,CS-866AZ の投与に起因した胎児の外表異常,内 臓異常,及び骨格異常は認められず,CS-866AZ のマウスに対する催奇形性は認めら れなかった。次世代に対する無毒性量は675 mg/kg であった(4.2.3.5-3)。 以上より,CS-866AZ には,CS-866 あるいは CS-905 単剤同様に,催奇形性はない ものと判断した。 1.6 その他の毒性試験 CS-905 のラット及びイヌ反復投与毒性試験では心臓への影響が認められているこ とから,CS-866 投与量比を増加させ併用した際に CS-905 による心血管系への影響に
変化があるか否かを検討するため,テレメトリー送信器を埋め込んだイヌを用い CS-866AZ を 4 日間反復投与した。その結果,臨床における RNH-6270 の曝露を上回 るCS-866 用量においても,薬理作用である血圧低下以外の心血管系への影響は認め られず,CS-866 を併用投与しても CS-905 による心血管系への影響には変化がないも のと判断した(4.2.3.7-1,4.2.3.7-2)。 2. 単回投与毒性試験 2.1 ラット単回経口投与毒性試験(4.2.3.1-1,TK:4.2.3.1-2) 方法: ラット(F344,7 週齢,1 群雌雄各 5 例)に CS-866AZ を 180,540,及び 1800 mg/kg の投与量で単回経口投与し,一般状態の観察及び体重測定を行い,投与 15 日後に解剖して病理学的検査を実施した。本試験における最高投与量は,単剤の 単回投与試験の結果,CS-866AZ の臨床での配合比,及び医薬品毒性試験法ガイドラ インの単回投与試験における技術的投与可能最大量を考慮して,1800 mg/kg に設定し た。また,血漿中薬物濃度測定群(1 群雌雄各 4 例)を設け,同様に CS-866AZ を投 与し血漿中薬物濃度を測定した。 結果: 試験成績を表 2.6.6.2-1 に示す。投与に起因した死亡例は認められなかっ た。一般状態では,軟便・下痢が180 mg/kg 以上の投与群で,活動性低下・腹臥位姿 勢が1800 mg/kg 投与群で観察されたが,下痢・軟便は投与 2 日目に,活動性の低下・ 腹臥位姿勢は投与3 時間後に回復した。病理解剖学的検査では異常は認められなかっ た。また,1800 mg/kg 投与群において体重の増加抑制傾向が認められた。 以上の結果から,最小致死量は雌雄とも1800 mg/kg より大きいと結論した。 表 2.6.6.2-1 ラット単回経口投与毒性試験成績 動物種,系統, 週齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 ラット F344/DuCrj 7 週齢 単回 経口 ♂♀各5 (TK 群: ♂♀各4) ・ 180(O/A=100/80) ・ 540(O/A=300/240) ・ 1800(O/A=1000/800) 死亡例:なし 最小致死量: >1800 mg/kg(♂♀) 一般状態: ・下痢,軟便(≥180 mg/kg) ・体重の増加抑制傾向,活動性低下,腹臥位 姿勢(1800 mg/kg) 病理解剖学的検査:異常なし TK パラメータ(1800 mg/kg,数値は ♂/♀): ・ Cmax(ng/mL); 2237 / 2535(RNH-6270) 2018 / 2251(CS-905) ・ AUC0-24h(ng・h/mL); 36345 / 40075(RNH-6270) 32472 / 41099(CS-905)
2.2 イヌ単回経口投与毒性試験(4.2.3.1-3,TK:4.2.3.1-4) 方法: イヌ(ビーグル,9~10 箇月齢,1 群雌雄各 1 例)に CS-866AZ を 180 及 び1800 mg/kg の投与量で単回経口投与し,一般状態の観察,体重・摂餌量測定,血液 学的検査,血液化学的検査,及び血漿中薬物濃度の測定を行い,投与15 日後に解剖 して病理学的検査を実施した。本試験における最高投与量は,単剤の単回投与試験の 結果,CS-866AZ の臨床での配合比,及び医薬品毒性試験法ガイドラインの単回投与 試験における技術的投与可能最大量を考慮して,1800 mg/kg に設定した。 結果: 試験成績を表 2.6.6.2-2 に示す。死亡例は認められなかった。一般状態の 変化として,180 及び 1800 mg/kg 投与群において,投与に起因した嘔吐が観察された。 体重,摂餌量,血液学的検査,血液化学的検査,病理解剖学的検査,及び標的器官で ある心臓の病理組織学的検査において投与に起因した変化は認められなかった。 以上の結果から,最小致死量は雌雄ともに1800 mg/kg より大きいと結論した。 表 2.6.6.2-2 イヌ単回経口投与毒性試験成績 動物種,品種, 月齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 イヌ ビーグル 9~10 箇月齢 単回 経口 ♂♀各1 ・ 180(O/A=100/80) ・ 1800(O/A=1000/800) 死亡例:なし 最小致死量: >1800 mg/kg(♂♀) 一般状態: ・嘔吐(≥180 mg/kg) 病理解剖学的検査:異常なし 病理組織学的検査(心臓):異常なし TK パラメータ(1800 mg/kg,数値は ♂/♀): ・ Cmax (ng/mL); 1702 / 2263(RNH-6270) 1494 / 1725(CS-905) ・ AUC0-24h (ng・h/mL); 24100 / 29261(RNH-6270) 26511 / 29921(CS-905) 3. 反復投与毒性試験 3.1 ラット 28 日間反復経口投与毒性試験(4.2.3.2-1,TK:4.2.3.2-2) 方法: ラット(F344,7 週齢,1 群雌雄各 10 例)に CS-866AZ を 0,6.75,22.5, 及び67.5 mg/kg の投与量で 28 日間反復経口投与した。本試験における最高投与量は, CS-905 のラット 14 日間反復経口投与毒性試験(投与量:0,3,10,30,100 mg/kg) の結果(100 mg/kg 群で死亡例あり)及び CS-866AZ の臨床での配合比を考慮して 67.5 mg/kg に設定した。投与期間中に一般状態の観察,体重・摂餌量の測定,尿検査, 及び眼科学的検査を行い,投与期間終了時に血液学的検査,血液化学的検査,及び病
理学的検査を実施した。また,血漿中薬物濃度測定群(1 群雌雄各 4 例)を設け,同 様にCS-866AZ を投与し,血漿中薬物濃度を測定した。 結果: 試験成績を表 2.6.6.3-1 に示す。投与期間を通して死亡例及び投与に起因 した一般状態の変化は認められなかった。体重増加率の軽度な抑制が22.5 mg/kg 以上 の投与群の雄で観察された。尿検査では,尿たん白の減少が22.5 mg/kg 以上の投与群 で観察された。血液学的検査ではRBC,Hb,及び HCT の軽度減少(CS-866 起因)が 67.5 mg/kg 投与群で観察され,血液化学的検査では BUN 及び K の上昇(それぞれ CS-866/CS-905 起因及び CS-866 起因)が 67.5 mg/kg 投与群で,Ca 及び P の低下(CS-905 起因)が22.5 mg/kg 以上の投与群で,Na の軽度低下(CS-866/CS-905 起因)が 6.75 mg/kg 以上の投与群でそれぞれ認められた。これらの変化はいずれも薬理作用に関連した変 化と考えられ,CS-866 及び CS-905 単剤のラット反復投与毒性試験で認められている 変化と質的に同じであり,併用投与による変化の増強も認められなかった。器官重量 では,心臓重量の減少(CS-866 による減少作用と CS-905 による増加作用の相殺とし て)及び腎臓重量の増加(CS-866/CS-905 起因)が認められたが,変化の程度は軽度 であり,病理解剖学・組織学的検査では投与に起因した変化は認められなかった。血 漿中薬物濃度については,RNH-6270 及び CS-905 の Cmax及びAUC0-24hは投与量に伴 って増加し,これらTK パラメータには明らかな性差は認められなかった。 以上の結果から,無毒性量は雌雄ともに67.5 mg/kg と判断した。また,CS-866AZ では,CS-866 及び CS-905 単剤でそれぞれ認められている変化の増強あるいは質的に 異なる新たな変化の発現もないものと判断した。なお,67.5 mg/kg 投与群の投与 27 日目における RNH-6270 の Cmax及び AUC0-24h は,雄がそれぞれ 1646 ng/mL 及び 10267 ng・h/mL,雌がそれぞれ 1964 ng/mL 及び 10162 ng・h/mL であった。同様に CS-905 のCmax及びAUC0-24hは,雄がそれぞれ710 ng/mL 及び 10073 ng・h/mL,雌がそれぞれ 806 ng/mL 及び 10637 ng・h/mL であった。
表 2.6.6.3-1 ラット 28 日間反復経口投与毒性試験成績 動物種,系統, 週齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 ラット F344/DuCrj 7 週齢 28 日間 反復 経口 ♂♀各10 (TK 群: ♂♀各4) ・媒体 ・6.75(O/A=3.75/3) ・22.5(O/A=12.5/10) ・67.5(O/A=37.5/30) 死亡例:なし 無毒性量:67.5 mg/kg 一般状態:変化なし 体重増加率:減少(♂≥22.5 mg/kg) 摂餌量:変化なし 尿検査:尿たん白減少(≥22.5 mg/kg) 眼科学的検査:異常なし 血液学的検査: ・RBC,Hb,HCT;減少(♂67.5 mg/kg) 血液化学的検査: ・ BUN;上昇(67.5 mg/kg) ・ K;上昇(♀67.5 mg/kg) ・ Na;減少(♀≥6.75 mg/kg) ・ Ca,P;減少(≥22.5 mg/kg) 器官重量(相対): ・ 心臓;減少(67.5 mg/kg) ・ 腎臓;増加(≥6.75 mg/kg) 病理解剖学的検査:異常なし 病理組織学的検査:異常なし TK パラメータ(67.5 mg/kg,数値は D1/D27): ・ Cmax (ng/mL); ♂1885 / 1646,♀1729 / 1964(RNH-6270) ♂544 / 710,♀828 / 806(CS-905) ・ AUC0-24h (ng・h/mL); ♂7716 / 10267,♀7660 / 10162(RNH-6270) ♂7179 / 10073,♀11818 / 10637(CS-905) 3.2 ラット 6 箇月間反復経口投与毒性試験(4.2.3.2-3,TK:4.2.3.2-4) 方法: ラット(F344,6 週齢,1 群雌雄各 15 例)に CS-866AZ を 0,6.75,22.5, 及び67.5 mg/kg の投与量で 6 箇月間反復経口投与した。本試験における最高投与量は, CS-866AZ のラット 28 日間反復経口投与毒性試験における無毒性量が 67.5 mg/kg で あったことから,67.5 mg/kg に設定した。また,CS-866AZ との比較を目的に CS-866 を37.5 mg/kg,あるいは CS-905 を 30 mg/kg の投与量でそれぞれ単独投与する群を設 けた。さらに,CS-866AZ の 0 及び 67.5 mg/kg 投与群については 1 箇月間の休薬群を 設け変化の回復性を検討した。投与期間中に一般状態の観察,体重・摂餌量の測定, 尿検査(摂水量を含む),及び眼科学的検査を行い,投与期間もしくは休薬期間終了 時に血液学的検査,血液化学的検査,及び病理学的検査を実施した。また,血漿中薬 物濃度測定群(1 群雌雄各 4 例)を設け,同様に CS-866AZ を投与し,血漿中 RNH-6270 及びCS-905 濃度を測定した。 結果: 試験成績を表 2.6.6.3-2 に示す。投与期間及び休薬期間を通して死亡例及 び投与に起因した一般状態の変化は認められなかった。また,体重・摂餌量,眼科学 的検査,及び剖検においても投与に起因した変化は認められなかった。尿検査では, 摂水量及び尿量の増加,それにともなう尿浸透圧の低下が67.5 mg/kg 投与群で観察さ
れた(主に CS-905 起因)。血液学的検査では RBC,Hb,及び HCT の軽度減少が 22.5 mg/kg 以上の投与群で観察された(CS-866 起因)。血液化学的検査では,BUN 及 びK の上昇(それぞれ CS-866/CS-905 起因及び CS-866 起因)がそれぞれ 67.5 mg/kg 投与群及び 22.5 mg/kg 以上の投与群で認められ,Na の減少(CS-866/CS-905 起因) が22.5 mg/kg 以上の投与群,Ca 及び P の低下(CS-905 起因)がそれぞれ 22.5 mg/kg 以上の投与群及び 67.5 mg/kg 投与群で認められた。器官重量では,心臓重量の減少 (CS-866 による減少と CS-905 による増加作用の相殺として)及び腎臓重量の増加 (CS-866/CS-905 起因)が 6.75 mg/kg 以上の投与群で観察された。以上の変化は薬理 作用に関連するものと考えられた。さらに,病理組織学的検査でも,薬理作用に伴う 二 次 的 変 化 と 考 え ら れ る 腎 臓 の 輸 入 細 動 脈 及 び 葉 間 動 脈 壁 の 軽 微 な 肥 厚 が 22.5 mg/kg 以上の投与群で観察された。67.5 mg/kg 投与群では,軽度な再生尿細管が 数例で観察された。上記変化はいずれもCS-866 あるいは CS-905 単独投与でも認め られている変化であり,また,薬理作用に起因する腎臓の輸入細動脈及び葉間動脈壁 の肥厚を除いては休薬後に回復し,可逆性であった。血漿中薬物濃度については, RNH-6270 及び CS-905 の Cmax及びAUC0-24hはCS-866AZ の投与量に伴って増加した。
またCS-866AZ 反復投与後の RNH-6270 及び CS-905 の Cmax及びAUC0-24hは,投与約
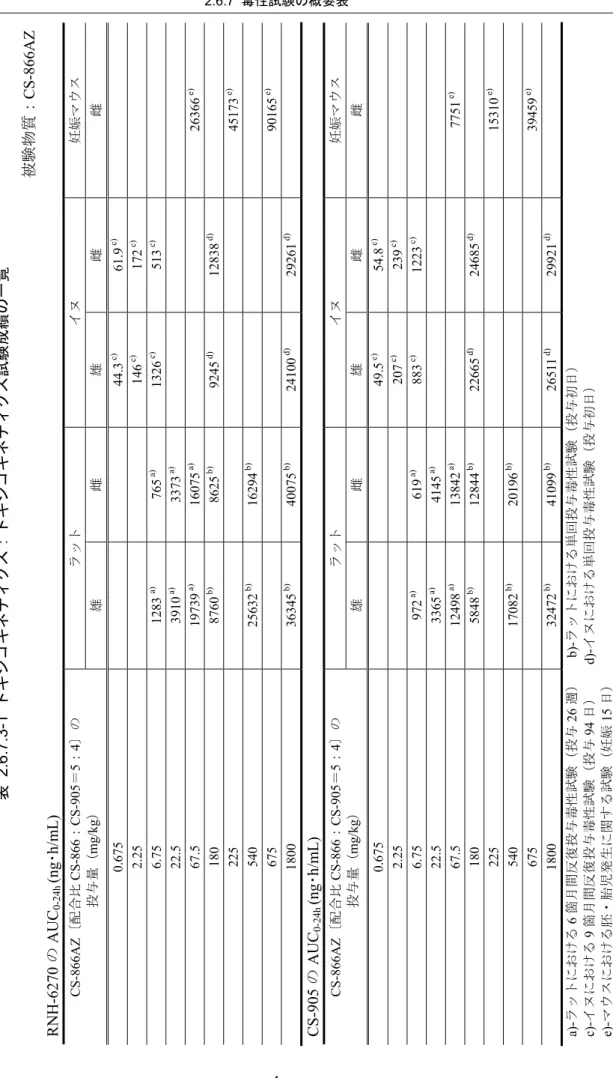
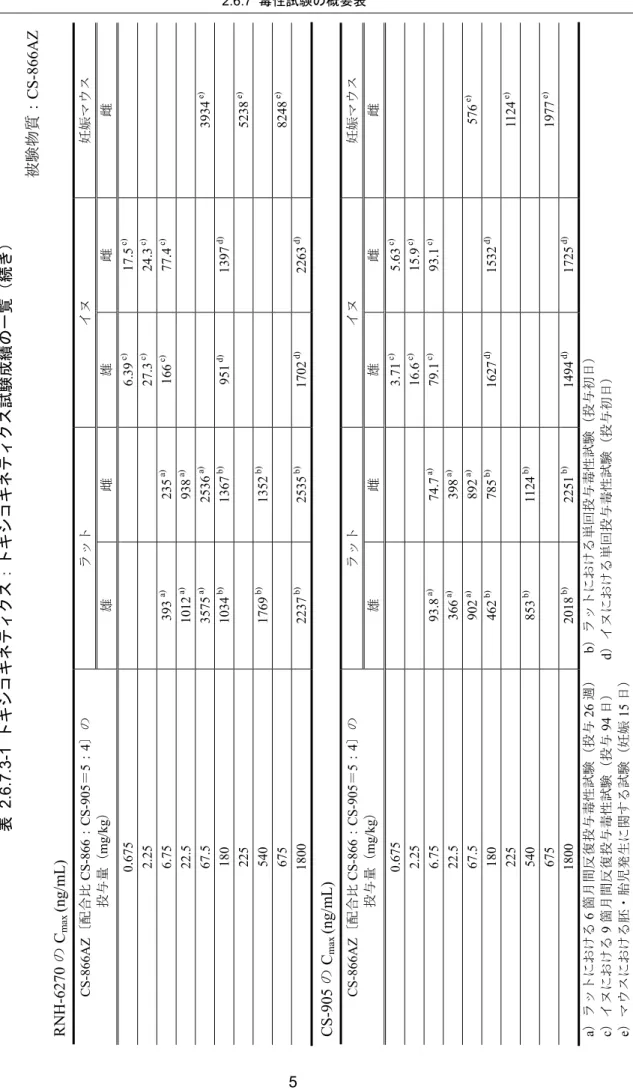
4 週後に定常状態であり,これら TK パラメータには明らかな性差は認められなかっ た。RNH-6270 曝露量は,CS-866AZ の 67.5 mg/kg 投与群(CS-866 として 37.5 mg/kg 投与)ではCS-866 の 37.5 mg/kg 単独投与群に比べて高値(Cmaxで1.8~3.3 倍,AUC0-24h で3.2~4.8 倍)であった。この曝露上昇については,CS-905 の薬理作用による腸管 の平滑筋弛緩が薬物懸濁液の消化管内貯留をもたらし,消化管からのCS-866 の吸収 を増加させたためと考えられた(参考資料 4.2.3.7-3,参考資料 4.2.3.7-4)。 以上の結果から,本試験におけるCS-866AZ の無毒性量は,腎臓における再生尿細 管の出現に基づき,22.5 mg/kg と判断した。また,CS-866AZ では,CS-866 及び CS-905 単剤でそれぞれ認められた変化の増強はなく,質的に異なる新たな変化の発現もない ものと判断した。なお,22.5 mg/kg 投与群の投与 26 週目における RNH-6270 の Cmax 及び AUC0-24h は,雄がそれぞれ 1012 ng/mL 及び 3910 ng・h/mL,雌がそれぞれ 938 ng/mL 及び 3373 ng・h/mL であった。同様に CS-905 の Cmax及びAUC0-24hは,雄が それぞれ366 ng/mL 及び 3365 ng・h/mL,雌がそれぞれ 398 ng/mL 及び 4145 ng・h/mL であった。これら TK データより,RNH-6270 あるいは CS-905 の曝露は,臨床にお ける曝露に対しそれぞれ同等あるいはそれ以上であることが示された。
表 2.6.6.3-2 ラット 6 箇月間反復経口投与毒性試験成績 動物種, 系統,週齢 投与期 間 経路 性 例数 投与量 (mg/kg) 結 果 ラット F344/Jcl 6 週齢 6 箇月間 反復 経口 ♂♀各15 (TK 群: ♂♀各4) ・媒体 ・6.75 (O/A=3.75/3) ・22.5 (O/A=12.5/10) ・67.5 (O/A=37.5/30) ・CS-866:37.5 ・CS-905:30 死亡例:なし 無毒性量:22.5 mg/kg 一般状態:変化なし 体重増加率:変化なし 摂餌量:変化なし 尿検査: ・ 摂水量;増加(CS-866AZ ♂67.5 mg/kg,CS-866 ♂ 37.5 mg/kg,CS-905 30 mg/kg) ・ 尿量;増加(CS-866AZ ♂67.5 mg/kg,CS-905 30 mg/kg) ・ 尿浸透圧;減少(CS-866AZ 67.5 mg/kg,CS-905 30 mg/kg) 眼科学的検査:異常なし 血液学的検査: ・RBC,Hb,HCT;減少(CS-866AZ ≥22.5 mg/kg,CS-866 37.5 mg/kg) 血液化学的検査: ・ BUN;上昇(CS-866AZ 67.5 mg/kg,CS-866 ♂ 37.5 mg/kg,CS-905 30 mg/kg) ・ K;上昇(CS-866AZ ≥22.5 mg/kg,CS-866 37.5 mg/kg) ・ Na;減少(CS-866AZ ≥22.5 mg/kg,CS-866 37.5 mg/kg, CS-905 ♀30 mg/kg) ・ Ca;減少(CS-866AZ ≥22.5 mg/kg,CS-905 ♀30 mg/kg) ・ P;減少(CS-866AZ ♂67.5 mg/kg,CS-905 ♂30 mg/kg) 器官重量(相対): ・ 心臓;減少(CS-866AZ ≥6.75 mg/kg,CS-866 37.5 mg/kg), 増加(CS-905 30 mg/kg) ・ 腎臓;増加(CS-866AZ ≥6.75 mg/kg,CS-905 30 mg/kg) 病理解剖学的検査:異常なし 病理組織学的検査: ・ 輸入細動脈/葉間動脈壁肥厚(CS-866AZ ≥22.5 mg/kg, CS-866 37.5 mg/kg) ・ 再生尿細管(CS-866AZ ♂67.5 mg/kg) TK パラメータ 無毒性量(CS-866AZ 22.5 mg/kg,数値は D1/W26): ・ Cmax (ng/mL); ♂1189 / 1012,♀1133 / 938(RNH-6270) ♂267 / 366,♀532 / 398(CS-905) ・ AUC0-24h (ng・h/mL); ♂4238 / 3910,♀3153 / 3373(RNH-6270) ♂2496 / 3365,♀6351/ 4145 (CS-905) 単剤群との比較(CS-866AZ 67.5 mg/kg,CS-866 37.5 mg/kg, CS-905 30 mg/kg,数値は W26 の CS-866AZ/単剤): ・ Cmax (ng/mL); ♂3575 / 1069,♀2536 / 1375(RNH-6270) ♂902 / 955,♀892 / 1245(CS-905) ・ AUC0-24h (ng・h/mL); ♂19739 / 4114,♀16075 / 5056(RNH-6270) ♂12498 / 13411,♀13842 / 18666(CS-905)
3.3 イヌ 28 日間反復経口投与毒性試験(4.2.3.2-5,TK:4.2.3.2-6) 方法: イヌ(ビーグル,8~9 箇月齢,1 群雌雄各 3 例)に CS-866AZ を 0,0.675, 2.25,及び 6.75 mg/kg の投与量で 28 日間反復経口投与した。本試験における最高投 与量は,CS-905 の 12 箇月間反復経口投与毒性試験の結果(10 mg/kg 群で投与 9 日に 死亡例あり)及び CS-866AZ の臨床での配合比を考慮して,6.75 mg/kg に設定した。 投与期間中に一般状態の観察,体重・摂餌量の測定,尿検査,血圧・心電図の測定, 眼科学的検査,血液学的検査,血液化学的検査,及び血漿中薬物濃度測定を行い,投 与期間終了時に病理学的検査を実施した。 結果: 試験成績を表 2.6.6.3-3 に示す。投与期間を通して死亡例及び投与に起因 した一般状態の変化は認められなかった。また,体重,摂餌量,尿検査,血圧,心電 図,眼科学的検査,血液学的検査,血液化学的検査,病理解剖学的,及び病理組織学 的検査においても投与に起因した変化は認められなかった。血漿中薬物濃度について は,RNH-6270 及び CS-905 の Cmax及びAUC0-24hは投与量に伴って増加し,これらTK パラメータには明らかな性差は認められなかった。 以上の結果から,無毒性量は雌雄ともに6.75 mg/kg と判断した。また,CS-866AZ では,これまでに CS-866 及び CS-905 単剤でそれぞれ報告されている変化の増強あ るいは質的に異なる新たな変化の発現もないものと判断した。なお,6.75 mg/kg 投与 群の投与28 日目における RNH-6270 の Cmax及びAUC0-24hは,雄がそれぞれ49.9 ng/mL 及び331 ng・h/mL,雌がそれぞれ 56.7 ng/mL 及び 416 ng・h/mL であった。同様に CS-905 のCmax及び AUC0-24hは,雄がそれぞれ 54.0 ng/mL 及び 731 ng・h/mL,雌がそれぞれ 57.1 ng/mL 及び 860 ng・h/mL であった。 表 2.6.6.3-3 イヌ 28 日間反復経口投与毒性試験成績 動物種,品種, 月齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 イヌ ビーグル 12 箇月齢 28 日間 反復 経口 ♂♀各3 ・ 媒体 ・ 0.675(O/A=0.375/0.3) ・ 2.25(O/A=1.25/1) ・ 6.75(O/A=3.75/3) 死亡例:なし 無毒性量:6.75 mg/kg 一般状態:変化なし 体重増加率:変化なし 摂餌量:変化なし 尿検査:異常なし 眼科学的検査:異常なし 血圧・心電図:異常なし 血液学的検査:異常なし 血液化学的検査:異常なし 器官重量(相対):変化なし 病理解剖学的検査:異常なし 病理組織学的検査:異常なし TK パラメータ(6.75 mg/kg,数値は D1/D28): ・ Cmax (ng/mL); ♂100 / 49.9,♀84.2 / 56.7(RNH-6270) ♂32.4 / 54.0,♀39.9 / 57.1(CS-905) ・ AUC0-24h (ng・h/mL); ♂925 / 331,♀748 / 416(RNH-6270) ♂426 / 731,♀486 / 860(CS-905)
3.4 イヌ 9 箇月間反復経口投与毒性試験(4.2.3.2-7,TK:4.2.3.2-8) 方法: イヌ(ビーグル,14~16 箇月齢,1 群雌雄各 4 例)に CS-866AZ を 0,0.675, 2.25,及び 6.75 mg/kg の投与量で 9 箇月間反復経口投与した。本試験における最高投 与量は,CS-905 の 12 箇月間反復経口投与毒性試験の結果(10 mg/kg 群で投与 9 日に 死亡例あり)及び CS-866AZ の臨床での配合比を考慮して,6.75 mg/kg に設定した。 また,CS-866AZ との比較を目的に CS-866 を 3.75 mg/kg,あるいは CS-905 を 3 mg/kg の投与量でそれぞれ単独投与する群を設けた。投与期間中に一般状態の観察,体重・ 摂餌量の測定,尿検査,血圧・心電図の測定,眼科学的検査,血液学的検査,血液化 学的検査,及び血漿中薬物濃度測定を行い,投与期間終了時に病理学的検査を実施し た。 結果: 試験成績を表 2.6.6.3-4 に示す。投与期間を通して死亡例及び投与に起因 した一般状態の変化は認められなかった。また,体重,摂餌量,尿検査,血圧,心電 図,眼科学的検査,血液化学的検査,病理解剖学的,及び病理組織学的検査において も投与に起因した変化は認められなかった。血液学的検査ではRBC,Hb,及び HCT の減少が6.75 mg/kg 投与群の雌で投与 37 日目に観察されたが,投与 9 箇月目にはこ れら変化に関する有意差はなかった。これら血液パラメータの減少は,相当する CS-866 及び CS-905 の単剤投与群の雌でも同様の傾向が認められた。血漿中薬物濃度 については,RNH-6270 の Cmax及びAUC0-24hは CS-866AZ の投与量に伴い増加し,
CS-905 のこれらパラメータについては投与量を上回る増加であった。CS-866AZ 反復 投与後のRNH-6270 及び CS-905 の Cmax及びAUC0-24hは,投与28 日後にほぼ定常状 態であり,また,明らかな性差は認められなかった。なお,ラットの併用群で認めら れたRNH-6270 の曝露上昇は,イヌでは観察されなかった。 以上の結果から,本試験におけるCS-866AZ の無毒性量は雌雄ともに 6.75 mg/kg と 判断した。また,本試験においては単剤群においても毒性所見は認められなかったも のの,これまでに CS-866 及び CS-905 の単剤でそれぞれ報告されている変化の増強 あるいは質的に異なる新たな変化の発現もないものと判断した。なお,CS-866AZ の 6.75 mg/kg 投与群の投与 94 日目における RNH-6270 の Cmax及びAUC0-24hは,雄がそ れぞれ166 ng/mL 及び 1326 ng・h/mL,雌がそれぞれ 77.4 ng/mL 及び 513 ng・h/mL で あった。同様にCS-905 の Cmax及びAUC0-24hは,雄がそれぞれ79.1 ng/mL 及び 883 ng・ h/mL,雌がそれぞれ 93.1 ng/mL 及び 1223 ng・h/mL であった。これら TK データより, CS-905 の曝露は臨床における曝露を上回ることが示された。
表 2.6.6.3-4 イヌ 9 箇月間反復経口投与毒性試験成績 動物種,品種, 月齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 イヌ ビーグル 14~16 箇月齢 9 箇月間 反復 経口 ♂♀各4 ・ 媒体 ・ 0.675(O/A=0.375/0.3) ・ 2.25(O/A=1.25/1) ・ 6.75(O/A=3.75/3) ・ CS-866:3.75 ・ CS-905:3 死亡例:なし 無毒性量:6.75 mg/kg 一般状態:変化なし 体重増加率:変化なし 摂餌量:変化なし 尿検査:異常なし 眼科学的検査:異常なし 血圧・心電図:異常なし 血液学的検査: ・RBC,Hb,HCT;減少(CS-866AZ ♀6.75 mg/kg の投与37 日目。ただし,減少傾向は CS-866 ♀3.75 mg/kg 及び CS-905 ♀3 mg/kg の 37 日 目でも認められた) 血液化学的検査:異常なし 器官重量(相対):変化なし 病理解剖学的検査:異常なし 病理組織学的検査:異常なし TK パラメータ 無毒性量(6.75 mg/kg,数値は D1/D94): ・ Cmax(ng/mL); ♂89.5 / 166,♀99.8 / 77.4(RNH-6270) ♂61.5 / 79.1,♀107 / 93.1(CS-905) ・ AUC0-24h (ng・h/mL); ♂460 / 1326,♀484 / 513(RNH-6270) ♂808 / 883,♀1269 /1223(CS-905) 単剤群との比較(CS-866AZ 6.75 mg/kg,CS-866 3.75 mg/kg,CS-905 3 mg/kg,数値は W13 の CS-866AZ/単剤): ・ Cmax(ng/mL); ♂166 / 62.8,♀77.4 / 77.6(RNH-6270) ♂79.1 / 72.7,♀93.1 / 41.6(CS-905) ・ AUC0-24h(ng・h/mL); ♂1326 / 401,♀513 / 503(RNH-6270) ♂883 / 816,♀1223 / 530(CS-905) 4. 遺伝毒性試験 4.1 細菌を用いる遺伝子突然変異試験(4.2.3.3-1) 方法: 4 種のサルモネラ菌(TA1535,TA1537,TA98,TA100)及び 1 種の大腸 菌(WP2uvrA)を用い,ラット肝 S9 添加による代謝活性化系の存在下及び非存在下 で検討した。CS-866AZ の用量は,用量設定試験(投与量:9.77~5000 μg/plate)での 復帰変異コロニー数並びに菌床観察の結果を参考にして,4.88~5000 µg/plate 濃度で 添加し,48 時間処理後に出現する復帰変異コロニー数を計数した。陽性対照として 5 種の既知変異原物質,及び陰性対照として媒体対照を設けた。 結果: 代謝活性化の有無にかかわらず,CS-866AZ を処理した全菌全用量で復帰 変異コロニー数の増加は観察されなかったことから,CS-866AZ には復帰突然変異誘 発性はないと判断した。
4.2 哺乳類培養細胞を用いる染色体異常試験(4.2.3.3-2) 方法: 雌チャイニーズハムスター肺組織由来の線維芽細胞(CHL 細胞)を用い, ラット肝 S9 添加による代謝活性化系の存在下及び非存在下で検討した。CS-866AZ の用量は,用量設定試験(投与量:23.6~250 μg/mL)での細胞増殖抑制の結果を参 考にして,栄養増殖培地中59.2~168 µg/mL の濃度とし,連続処理法では 24 時間, 短時間処理法では6 時間(その後 18 時間の回復時間設定)の処理後,染色体構造異 常細胞及び数的異常細胞の出現頻度を求めた。陽性対照として2 種の既知変異原物質, 並びに陰性対照として媒体対照及び無処置対照を設けた。 結果: 代謝活性化の有無にかかわらず,CS-866AZ のすべての用量において染色 体の構造異常及び数的異常の増加は認められなかったことから,CS-866AZ には染色 体異常誘発性はないと判断した。 4.3 げっ歯類を用いる小核試験(4.2.3.3-3) 方法: マウス(ICR:雄性,8 週齢,1 群 6 例)に CS-866AZ を 0,450,900,及 び 1800 mg/kg の投与量で単回経口投与した。本試験の最高投与量は,用量設定試験 (投与量:112.5~1800 mg/kg)において 1800 mg/kg 群で死亡例が認められなかった ことから,1800 mg/kg に設定した。投与 48 時間後にマウス尾部より採血し,小核保 有網赤血球出現頻度及び網赤血球出現頻度を求めた。陽性対照としてマイトマイシン C を単回腹腔内投与した。 結果: CS-866AZ のすべての投与量において小核保有網赤血球出現頻度の有意な 増加は認められず,CS-866AZ に小核誘発性はないと判断した。 5. がん原性試験 該当資料なし。 6. 生殖発生毒性試験 6.1 ラット胚・胎児発生への影響に関する試験(4.2.3.5-1,TK:4.2.3.5-2) 方法: 妊娠ラット(SD,10 週齢,1 群 20~21 例)に CS-866AZ を 0,6.75,22.5, 及び67.5 mg/kg の投与量で,妊娠 7~17 日まで 11 日間反復経口投与し,母体及び胚・ 胎児発生への影響について検討した。本試験における最高投与量は,CS-866AZ のラ ット胚・胎児発生に関する用量設定試験(参考資料 4.2.3.5-1-1,投与量:22.5,67.5, 225 mg/kg)の結果(225 mg/kg 群で死亡例あり)を考慮して,67.5 mg/kg に設定した。 また,血漿中薬物濃度測定群(1 群 4 例)を設け,同様に CS-866AZ を投与し,血漿 中RNH-6270 及び CS-905 濃度を測定した。 結果: 母体に対する影響では,67.5 mg/kg 群の 1 例が妊娠 20 日に一般状態の悪 化を伴い死亡した。その他の動物では一般状態の変化は認められなかった。また, 67.5 mg/kg 群で体重増加抑制傾向及び摂餌量の減少が認められた。胚・胎児に対する 影響では,妊娠20 日の剖検において胎児体重の変化及び胚・胎児に対する致死作用
は観察されなかった。また,投与に起因した外表異常,内臓異常,及び骨格異常は認 められなかった。血漿中RNH-6270 及び CS-905 濃度は投与量に伴って増加した。 以上の結果から,CS-866AZ はラットに対して催奇形性作用はないと判断した。ま た,母動物に対する無毒性量は22.5 mg/kg,次世代発生に対する無毒性量は 67.5 mg/kg と判断した。 6.2 マウス胚・胎児発生への影響に関する試験(4.2.3.5-3,TK:4.2.3.5-4) 方法: 妊娠マウス(ICR,12 週齢,1 群 17~20 例)に CS-866AZ を 0,67.5,225, 及び675 mg/kg の投与量で,妊娠 6~15 日まで 10 日間反復経口投与し,母体及び胚・ 胎児発生への影響について検討した。本試験における最高投与量は,CS-905 のマウ ス 14 日間反復経口投与毒性試験(投与量:0,3,10,30,100,300 mg/kg)の結果 (300 mg/kg 群で死亡例あり)及び CS-866AZ の臨床での配合比を考慮して 675 mg/kg に設定した。また,血漿中薬物濃度測定群(1 群 3 例)を設け,同様に CS-866AZ を 投与し,血漿中RNH-6270 及び CS-905 濃度を測定した。 結果: 母体に対する影響では,投与に起因すると考えられる死亡例,一般状態, 及び体重の変化は認められなかったが,675 mg/kg 投与群で摂餌量の低下が認められ た。胚・胎児に対する影響では,妊娠18 日の剖検において胎児体重の変化及び胚・ 胎児に対する致死作用は観察されなかった。また,投与に起因した外表異常,内臓異 常,及び骨格異常は認められなかった。血漿中RNH-6270 及び CS-905 濃度は投与量 に伴って増加した。 以上の結果から,CS-866AZ はマウスに対して催奇形性作用はないと判断した。ま た,母動物に対する無毒性量は225 mg/kg,次世代発生に対する無毒性量は 675 mg/kg と判断した。 7. 局所刺激性試験 該当資料なし。 8. その他の毒性試験 CS-905 のラット及びイヌ反復投与毒性試験では心臓への影響が認められているこ とから,CS-866 投与量比を増加させ併用した際に CS-905 による心血管系への影響に 変化があるか否かの検討を行った。また,CS-866AZ 投与時に認められた RNH-6270 曝露量上昇に関する検討を行った(表 2.6.7.17-2 に結果を示す)。 8.1 イヌ心血管系への影響に関する試験(4.2.3.7-1,TK:4.2.3.7-2) 方法: テレメトリー送信器を埋め込んだイヌ(ビーグル,14 箇月齢,雌雄各 2 例)に,カプセルのみ,CS-905 3 mg/kg,CS-866AZ(O/A=37.5/3 mg/kg,O/A=75/3 mg/kg) の順に漸増経口投与した。なお,CS-905 の用量は臨床での CS-905 曝露量を上回る用 量である3 mg/kg で固定し,併用する CS-866 用量を増加させた際の CS-905 の心臓へ の影響増悪の有無を確認することとした。各用量を4 日間反復投与し,各用量間の休
薬は3 日間とした。心拍数及び血圧は,5 分間隔にて 10 秒間のデータを毎日収集し た。心電図は各用量の投与2 及び 3 日目にそれぞれ 24 時間のデータを取得した。投 与期間中,一般状態の観察及び体重・摂餌量の測定を行い,血漿中薬物濃度測定を各 用量の投与1 日目に,病理学的検査を最終投与終了時に実施した。 結果: 試験成績を表 2.6.6.8-1 に示す。一般状態,体重・摂餌量,及び心拍数に は投与に起因した有意な変化は認められなかった。平均血圧では,媒体投与群と比較 し,O/A=37.5/3 mg/kg 及び O/A=75/3 mg/kg 群で薬理作用による低下傾向が認められ たが,心電図ではすべての投与群で投与に起因した変化は認められず,心臓に病理学 的 変 化 は な か っ た 。CS-866 の 活 性 代 謝 物 で あ る RNH-6270 の AUC0-24h は , O/A=37.5/3 mg/kg 及び O/A=75/3 mg/kg 群でそれぞれ 12753 ng・h/mL 及び 16421 ng・ h/mL であり,臨床での曝露を大きく上回るものであった。 これらの結果より,CS-866 投与量比を増加させた場合でも薬理作用である血圧低 下以外の心血管系への影響は認められず,CS-866 併用投与において CS-905 による心 血管系への影響に変化がないものと判断した。 表 2.6.6.8-1 イヌ心血管系への影響に関する成績 動物種,品種, 月齢 投与期間 経路 性 例数 投与量 (mg/kg) 結 果 イヌ ビーグル 14 箇月齢 4 日間 反復経口 (漸増) ♂♀各2 ・媒体 ・CS-905:3 ・CS-866AZ: O/A=37.5/3 O/A=75/3 死亡例:なし 一般状態:変化なし 体重・摂餌量:変化なし 心血管系: ・ 心拍数;変化なし ・ 血圧;≥ O/A=37.5/3 mg/kg で低下傾向 ・ 心電図;変化なし 病理解剖学的検査:異常なし TK パラメータ(O/A=75/3 群,数値は♂♀平均): ・ Cmax(ng/mL); 1531(RNH-6270) 59.0(CS-905) ・ AUC0-24h (ng・h/mL); 16421(RNH-6270) 533(CS-905) 9. 考察及び結論 CS-866AZ は,AII 受容体拮抗薬の CS-866 及び Ca 拮抗薬の CS-905 の配合剤である。 本剤の毒性評価として,単回及び反復投与毒性試験を実施した結果,CS-866 及び CS-905 の単独投与毒性試験において観察された既知の変化の増強は認められず,ま た質的に異なる新たな変化の発現も認められなかった。また,CS-866AZ には,遺伝 毒性及び催奇形性はないものと判断された。さらに,CS-866 投与量比を増加させた 場合,臨床におけるRNH-6270 の曝露を上回る CS-866 の用量においても,薬理作用 である血圧低下以外の心血管系への影響は認められなかった。したがって,CS-866AZ はCS-866 及び CS-905 と同じ毒性プロファイルを有するものと考えられる。
なお,ラットでCS-866 と CS-905 の併用投与時に RNH-6270 の曝露上昇が認められ た。この上昇は,CS-905 の薬理作用による腸管の平滑筋弛緩が薬物懸濁液の消化管 内貯留をもたらし,消化管からのCS-866 の吸収を増加させたためと考えられたが, イヌの反復投与毒性試験やCS-866AZ の臨床試験では認められておらず,臨床への外 挿性のない事象と判断した。 これらのことから,CS-866AZ におけるリスク・アセスメントとして,CS-866 単独 投与時に投与起因性と判断された赤血球系パラメータ及び腎臓の変化(2.6.6.10.1 CS-866 の毒性試験の概要),及び CS-905 単独投与時に投与起因性と判断された心臓 の変化(2.6.6.10.2 CS-905 の毒性試験の概要)についてそれぞれ以下に考察した。 赤血球系パラメータへの影響 CS-866AZ のラット 28 日間及び 6 箇月間反復投与毒性試験において認められた赤 血球系パラメータ(RBC,Hb,HCT)の低値については,CS-866 のラット 28 日間及 び6 箇月間反復経口投与毒性試験においても認められており,CS-866 に基づく変化 と考えられた。この変化は,レニン・アンジオテンシン(RA)系に作用する AII 受 容体拮抗薬あるいはアンジオテンシン変換酵素(ACE)阻害薬に共通して認められ, 薬理作用に関連した変化と考えられている。また,その機序はエリスロポエチン (EPO)の減少に基づくことが示唆されており 1~3),EPO 減少には薬理作用に基づく 腎血流量増加に対するフィードバック機構の関与が考えられている 2, 3)。なお, CS-866AZ の第 III 相比較試験では,単剤群に対し併用群で治験責任医師より臨床的 に有意と判断された赤血球パラメータの異常変動が増加する傾向は認められなかっ た。 以上のことから,CS-866 と同様 CS-866AZ についても,臨床において赤血球系パ ラメータに影響を及ぼす可能性が考えられるが,ラットにおける赤血球系パラメータ の変化は CS-905 併用により増強されなかったことから,その作用が CS-866 単独投 与時よりも強く現れる可能性は低く,重篤な副作用に至る可能性は低いものと推察さ れる。 腎臓への影響 CS-866AZ のラット 28 日間及び 6 箇月間反復投与毒性試験において,BUN 及び K の高値,Ca 及び P の低値,Na の軽度低値,並びに腎臓の重量増加及び病理組織学的 変化(輸入細動脈及び葉間動脈壁の肥厚,再生尿細管)が認められた。これら腎臓へ の影響を示唆する所見はCS-866 のラット反復経口投与毒性試験においても認められ ている。しかしながら,これらの変化はRA 系に作用する AII 受容体拮抗薬あるいは ACE 阻害薬に共通して認められる変化で,血圧低下あるいは体液中 Na 平衡の変化に 起因した薬理作用に基づく変化と考えられることから 4~12),毒性学的な意義はない ものと判断している。したがって,CS-866AZ についても,CS-866 と同様に薬理作用
に基づく変化であり毒性学的な意義はないものと判断した。また,CS-866AZ の第 III 相比較試験でも,単剤群に対し併用群で治験責任医師より臨床的に有意と判断された BUN 上昇が増加する傾向は認められなかった。 以上のことから,CS-866 と同様 CS-866AZ についても,臨床において腎機能に影 響を及ぼす可能性が考えられるが,ラットにおける変化がCS-905 併用により増強さ れなかったことから,その作用がCS-866 単独投与時よりも強く現れる可能性は低く, 腎臓への影響が重篤な副作用に至る可能性は低いと推察される。 心臓への影響 CS-905 のラット及びイヌ反復投与毒性試験では心臓への影響が認められており, ラットでは心臓重量の増加,イヌでは心臓乳頭筋の変性・壊死,線維化あるいは石灰 化病巣が認められている。イヌで認められた心臓乳頭筋の変化は,血圧低下に対する 二次的な生理的反射性頻脈により発現することが知られており 13),ジヒドロピリジ ン系Ca 拮抗薬に共通した変化で類薬でも同様の変化が認められている。しかしなが ら,本作用は副交感神経による心臓支配が優位なイヌに発現しやすい変化であり,交 感神経支配が優位な高血圧症患者ではそのリスクは低いものと考えられている。実際, CS-905 の臨床試験では顕著な心拍数の増加は認められておらず,心臓への影響に起 因した重篤な副作用も認められていない。 さらに,CS-866 と CS-905 の併用投与において CS-866 投与量比を増加させた場合, CS-905 によるイヌ心血管系への影響に変化があるか否かを検討したところ,臨床に おけるRNH-6270 の曝露を上回る CS-866 用量においても,薬理作用である血圧低下 以外の心血管系への影響は認められなかった。また,CS-866AZ の第 III 相比較試験 でも,単剤群に対し併用群で血圧低下を含め心血管系の自覚症状・他覚所見の発現が 増加する傾向は認められなかったことから,CS-866AZ の臨床で心臓への影響が認め られる可能性は低いと考えられる。 以上のことから,CS-905 で認められている心臓への作用は,CS-866 併用により CS-905 単独投与時よりも強く現れる可能性は低く,心臓への影響が重篤な副作用に 至る可能性は低いと推察される。 10. 参考 10.1 CS-866 の毒性試験の概要 CS-866 の毒性試験の概要を以下に示し,各試験成績の一覧を表 2.6.6.10-1 に示し た。 10.1.1 単回投与毒性試験 ラット(500,1000,2000 mg/kg)及びイヌ(1000,2000 mg/kg)のいずれにおい ても最高用量まで死亡例は認められず,最小致死量は 2000 mg/kg より大きいと判断 した。
10.1.2 反復投与毒性試験 ラット28 日間(100,300,1000 mg/kg)及び 6 箇月間(30,100,300,1000 mg/kg), イヌ3 箇月間(30,60,125,250,500 mg/kg)及び 12 箇月間(10,40,160 mg/kg) の試験を実施した。その結果,無毒性量はラットでは28 日間投与試験が 1000 mg/kg, 6 箇月間投与試験が雄 100 mg/kg,雌 1000 mg/kg と判断し,イヌでは 3 箇月間投与毒 性試験が60 mg/kg,12 箇月間投与試験が 160 mg/kg と判断した。これらの試験では, 尿細管上皮の再生あるいは管腔の拡張,傍糸球体細胞顆粒指数あるいは傍糸球体細胞 の過形成/傍糸球体細胞顆粒の増加,及びBUN の高値が,ラット及びイヌに共通し て認められた。また,ラットでは体重増加抑制及び摂餌量の抑制,摂水量及び尿量の 増加,尿たん白の減少,赤血球系パラメータ(RBC,Hb,HCT)の低値,K 及びク レアチニンの高値,Na の低値,心臓重量の低値及び腎臓重量の高値,並びに腎臓動 脈壁肥厚が認められた。これらの変化の多くは腎臓への影響を示すものであり, CS-866 の主な標的臓器は腎臓と考えられた。このうち,ラット及びイヌに認められ た尿細管上皮の再生あるいは管腔の拡張は,腎臓の器質的変化を示すことから, CS-866 投与による毒性所見と判断した。 10.1.3 遺伝毒性試験 In vitro 試験として細菌を用いた遺伝子突然変異試験,チャイニーズハムスター雌 肺由来線維芽細胞を用いた染色体異常試験,マウスリンフォーマ細胞を用いた遺伝子 突然変異試験(MLA),及びシリアンハムスター胚細胞を用いた形質転換試験(SHE assay)を,in vivo 試験としてマウス小核試験,ラット肝臓不定期 DNA 合成試験,及 びトランスジェニック(Tg)マウスを用いた遺伝子突然変異試験を実施した。その 結果,in vitro の染色体異常試験及び MLA においてのみ陽性応答が認められ, RNH-6270 あるいは側鎖エステル由来の代謝物であるジアセチルの陽性応答に基づく 反応と考えられた。しかしながら,RNH-6270 の陽性応答は過度の細胞毒性に起因し た反応であること,ジアセチルは速やかに分解されるためCS-866 投与による生体内 ジアセチル濃度の顕著な増加は認められないことから,CS-866 の陽性応答は生体に おける遺伝毒性を示唆するものではないと判断した。 10.1.4 がん原性試験 ラットを用いた24 箇月間混餌投与試験(200,600,2000 mg/kg),p53 がん抑制遺 伝子ヘテロ欠損マウスを用いた26 週間投与試験(100,300,1000 mg/kg),及びヒト プロト型発がん遺伝子c-Ha-ras 導入 Tg マウスを用いた 26 週間投与試験(1000 mg/kg) を実施した。その結果,いずれの試験においても催腫瘍性は認められず,CS-866 に 発がん性はないものと判断した。 10.1.5 生殖発生毒性試験 ラットを用いた妊娠前及び妊娠初期投与試験(Seg.I:40,200,1000 mg/kg),胎児 の器官形成期投与試験(Seg.II:40,200,1000 mg/kg),周産期及び授乳期投与試験 (Seg.III:0.3,1.6,8,40,200 mg/kg),及びウサギを用いた胎児の器官形成期投与
試験(Seg.II:0.3,1,3 mg/kg)を実施した。その結果,親動物の体重増加抑制及び 摂餌量減少が認められ,出生児では体重増加抑制及び腎盂拡張など既存のAII 受容体 拮抗薬に共通した所見が認められた他,生後分化及び発育抑制等が認められたが,催 奇形性を示唆する所見は認められなかった。 10.1.6 その他の毒性試験 マウスを用いた受身皮膚アナフィラキシー(PCA)試験(0.02,0.2 mg/body),並 びにモルモットを用いた PCA 及び全身アナフィラキシー(SANA)試験(0.1, 1 mg/body)を実施した結果,マウス及びモルモットともに抗原性はないと判断した。
表 2.6.6.10-1 CS-866 の毒性試験成績一覧 試験の種類 動物種 (1 群例数) 投与期間 経路 投与量 (mg/kg) 試験結果 単回投与 毒性試験 ラット (♂♀各5) 経口 500 1000 2000 死亡例:なし 主な所見:特記すべき所見なし 最小致死量:>2000 mg/kg イヌ (♂♀各1) 経口 1000 2000 死亡例:なし 主な所見:一過性の摂餌量減少(♂♀1000 mg/kg,♀2000 mg/kg) 最小致死量:>2000 mg/kg 反復投与 毒性試験 ラット (♂♀各15) 28 日間 反復経口 100 300 1000 無毒性量:1000 mg/kg 死亡例:投与に起因する死亡例なし 主な所見:体重増加抑制,摂餌量減少,摂水量・尿量増加,尿たん白 減少,RBC・Hb・HCT 減少,BUN・K・Cre 上昇,Na 低下, 心臓重量減少,腎臓重量増加,傍糸球体細胞顆粒指数増加 ラット (♂♀各15) 6 箇月間 反復経口 30 100 300 1000 無毒性量:♂100 mg/kg,♀1000 mg/kg 死亡例:投与に起因する死亡例なし 主な所見:体重増加抑制,摂餌量減少,摂水量・尿量増加,尿たん白 減少,尿比重・浸透圧低下,RBC・Hb・HCT 減少,BUN・ K・Cre 上昇,Na 低下,心臓重量減少,腎臓重量増加,傍 糸球体細胞顆粒指数増加,腎臓血管壁肥厚,尿細管上皮再 生(300 mg/kg 以上の♂) 125 250 500 無毒性量:<125 mg/kg 死亡例:500 mg/kg の♂1 例(腎障害) 主な所見:BUN 上昇,傍糸球体細胞過形成・顆粒増加,尿細管上皮再 生・拡張(≥125 mg/kg) イヌ (♂♀各3) 3 箇月間 反復経口 30 60 無毒性量:60 mg/kg 死亡例:投与に起因する死亡例なし 主な所見:傍糸球体細胞顆粒増加(≥30 mg/kg) イヌ (♂♀各4) 12 箇月間 反復経口 10 40 160 無毒性量:160 mg/kg 死亡例:なし 主な所見:傍糸球体細胞の過形成(160 mg/kg),顆粒増加(≥40 mg/kg) 遺伝毒性試験 156~5000 μg/plate 陰性 RNH-6270:200~5000 μg/plate 陰性 diacetyl:200~5000 μg/plate 陽性 遺伝子突然変異 (サルモネラ, 大腸 菌) in vitro acetoin:200~5000 μg/plate 陰性 直接法24h:43.8~350 μg/mL 直接法48h:30.9~248 μg/mL S9(+):495~1980 μg/mL S9(-):124~990 μg/mL 直接法24h・48h,代謝活性化法 S9(-)で陽性 RNH-6270: 0.313~1.25 mM(DMSO 溶液) 0.0391~10 mM(CMC-Na 懸 濁) CMC-Na 懸濁で直接法 48h 及び代謝活性化法 S9(+) において陽性 diacetyl:0.0781~10 mM 直接法24h,代謝活性化法 S9(-)・S9(+)で陽性 染色体異常 (CHL 細胞) in vitro acetoin:1.25~10 mM 陰性 31.25~750 μg/mL 50~700 μg/mL S9(-)・S9(+)ともに陽性 RNH-6270:156~2500 μg/mL S9(-)で陽性 遺伝子突然変異 (マウス リンフォーマ細胞) in vitro diacetyl:3.13~50 μg/mL 30~90 μg/mL S9(-)・S9(+)ともに陽性 SHE assay (シリアン ハムスター胚細胞) in vitro 10~50 μg/mL 陰性 マウス小核 腹腔内 500, 1000, 2000 陰性 ラット不定期 DNA 合成 経口 600, 2000 陰性 100, 1000, 2000 LacZ 遺伝子を検索対象とした小腸粘膜遺伝子突然変異:出現頻度の軽 度増加 Tg マウス 遺伝子突然変異 (MutaTM Mouse) 5 日間 反復経口 2000 LacZ 及び cII 遺伝子を検索対象とした小腸粘膜遺伝子突然変異:陰性, 変異スペクトルの変化なし
表 2.6.6.10-1 CS-866 の毒性試験成績一覧(続き) 試験の種類 動物種 (1 群例数) 投与期間 経路 投与量 (mg/kg) 試験結果 がん原性試験 ラット (♂♀各50) 24 箇月間 混餌 200, 600, 2000 催腫瘍性なし p53 KO マウス (♂♀各15) 26 週間 反復経口 100, 300, 1000 催腫瘍性なし Tg Hras2 マウス (♂♀各15) 26 週間 混餌 1000 催腫瘍性なし 生殖発生 毒性試験 ラットSeg.I (♂♀各25) 経口 ♂:交配前9 週間 ~交配期間2 週間 ♀:交配前2 週間 ~妊娠7 日 40 200 1000 無毒性量:親一般;<40 mg/kg,親生殖・次世代発生;>1000 mg/kg 主な所見:親動物で体重増加抑制・摂餌量減少 ラットSeg.II (♀34~39) 経口 妊娠7~17 日 40 200 1000 催奇形性なし 無毒性量:親一般・親生殖・次世代発生;40 mg/kg 主な所見:親動物;体重増加抑制・摂餌量減少,一般状態悪化を伴う 死亡,母性行動不良,出生児;体重減少・生後分化抑制, 生存胎児;体重減少・尾椎化骨核数減少 ラットSeg.III (♀22~24) 8 40 200 (♀26~28) 経口 妊娠17 日 ~出産21 日 0.3 1.6 無毒性量:親一般;8 mg/kg,親生殖;40 mg/kg,次世代発生;0.3 mg/kg 主な所見:親動物;体重増加抑制・摂餌量減少,出生児;母体の一般 状態悪化に伴う死亡,体重増加抑制,生後分化遅延,発育 抑制,腎盂拡張(死亡例) ウサギSeg.II (♀9~25) 経口 妊娠6~18 日 0.3 1 3 催奇形性なし 無毒性量:親一般;0.3 mg/kg,親生殖・次世代発生;>1 mg/kg 主な所見:親動物で一般状態悪化及び体重増加抑制・摂餌量減少(死亡 例) 抗原性試験 マウス (♀各6) 経口: 5 回/週×3 週間 腹腔(+Alum): 1 週間隔 3 回 0.02, 0.2 mg/body PCA 反応:陰性 モルモット (♀6) 経口: 5 回/週×4 週間 皮下(+FCA): 10 日間隔 3 回 0.1, 1 mg/body
PCA 反応:陰性(0.1 mg/body FCA 併用免疫群の 1/6 例に 10 倍
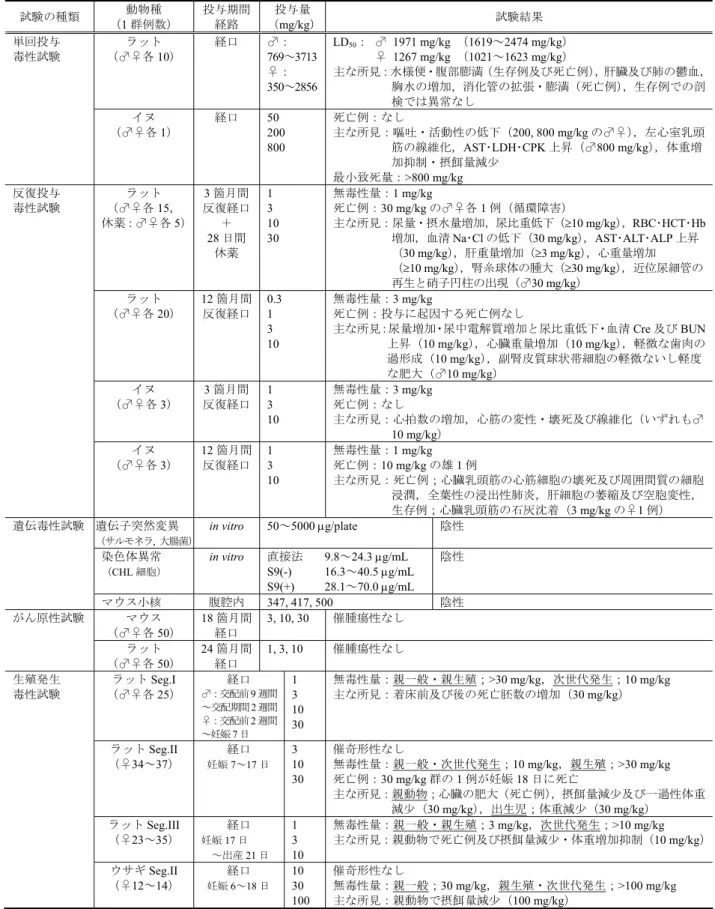
のPCA 抗体価が認められたが,1 mg/body は すべて陰性) SANA 反応:陰性 10.2 CS-905 の毒性試験の概要 CS-905 の毒性試験の概要を以下に示し,各試験成績の一覧を表 2.6.6.10-2 に示し た。 10.2.1 単回投与毒性試験 ラット経口投与のLD50値は,雄1971 mg/kg,雌 1267 mg/kg であった。イヌ経口投 与では800 mg/kg まで死亡例は認められず,雌雄ともに嘔吐及び血圧低下に伴う活動 性の低下が認められた。 10.2.2 反復投与毒性試験 ラット3 箇月間(1,3,10,30 mg/kg)及び 12 箇月間(0.3,1,3,10 mg/kg),イ ヌ3 箇月間(1,3,10 mg/kg)及び 12 箇月間(1,3,10 mg/kg)の試験を実施した。 その結果,無毒性量はラットでは3 箇月間投与試験で 1 mg/kg,12 箇月間投与試験で 3 mg/kg と判断し,イヌでは 3 箇月間投与試験で 3 mg/kg,12 箇月間投与試験で 1 mg/kg と判断した。 ラットでは,3 箇月間及び 12 箇月間投与試験ともに心重量の増加及び尿量の増加 が認められた。その他,3 箇月間投与試験では肝重量の増加が,ラット 12 箇月間投
与試験では副腎球状帯細胞の肥大が認められた。副腎の変化は類薬でも報告されてお り,ジヒドロピリジン系Ca 拮抗薬に共通した変化と考えられた。 イヌでは,3 箇月間及び 12 箇月間投与試験ともに心筋の変性・壊死が認められた。 このような心筋の障害は類薬でも報告されており,血圧の急激な低下に対する反射性 頻脈がその原因と考えられている。 10.2.3 遺伝毒性試験 In vitro 試験として細菌を用いた遺伝子突然変異試験及び哺乳類培養細胞を用いた 染色体異常試験を,in vivo 試験としてマウス小核試験を実施した。その結果,いずれ の試験も陰性であった。 10.2.4 がん原性試験 ラット24 箇月間がん原性試験(1,3,10 mg/kg),マウス 18 箇月間がん原性試験 (3,10,30 mg/kg)を実施した。その結果,催腫瘍性は認められず,CS-905 に発が ん性はないものと判断した。 10.2.5 生殖発生毒性試験 ラットを用いた妊娠前及び妊娠初期投与試験(Seg.I:1,3,10,30 mg/kg),胎児 の器官形成期投与試験(Seg.II:3,10,30 mg/kg),周産期及び授乳期投与試験(Seg.III: 1,3,10 mg/kg),及びウサギを用いた胎児の器官形成期投与試験(Seg.II:10,30, 100 mg/kg)を実施した。その結果,ラットの Seg.III 試験において妊娠期間の延長及 び難産が認められたが,その他いずれの試験においても催奇形性を示唆する所見は認 められなかった。 10.2.6 その他の試験 抗原性試験として,マウスを用いたPCA 試験(0.01,0.1 mg/body),モルモットを 用いたPCA 及び SANA 試験(0.1,1 mg/body),並びにウサギを用いた PCA 及び遅 延型皮膚反応試験(0.2,1 mg/kg)を実施した。その結果,ウサギの FCA 併用免疫(皮 下及び筋肉内投与)において,弱い遅延型皮膚反応が認められたが,そのほかの試験 はいずれも陰性であることから,マウス,モルモット及びウサギともに抗原性はない ものと判断した。 In vitro 光毒性試験及び in vivo 光感作性試験(モルモット)を実施した結果,いず れも陰性であった。 光学異性体を用いたマウス単回経口投与試験を実施した結果,概略の LD50値はR 体が250~500 mg/kg,S 体が 2000 mg/kg より大きいと判断された。 類縁物質R4(TUK-9300)及び R5(UBS-0653)について,14 日間反復投与毒性試 験及びin vitro 遺伝毒性試験(細菌を用いた復帰突然変異試験及び哺乳類培養細胞を 用いた染色体異常試験)を実施した結果,毒性所見は認められず,また遺伝毒性も陰 性であった。
表 2.6.6.10-2 CS-905 の毒性試験成績一覧 試験の種類 動物種 (1 群例数) 投与期間 経路 投与量 (mg/kg) 試験結果 ラット (♂♀各10) 経口 ♂: 769~3713 ♀: 350~2856 LD50: ♂ 1971 mg/kg (1619~2474 mg/kg) ♀ 1267 mg/kg (1021~1623 mg/kg) 主な所見:水様便・腹部膨満(生存例及び死亡例),肝臓及び肺の鬱血, 胸水の増加,消化管の拡張・膨満(死亡例),生存例での剖 検では異常なし 単回投与 毒性試験 イヌ (♂♀各1) 経口 50 200 800 死亡例:なし 主な所見:嘔吐・活動性の低下(200, 800 mg/kg の♂♀),左心室乳頭 筋の線維化,AST・LDH・CPK 上昇(♂800 mg/kg),体重増 加抑制・摂餌量減少 最小致死量:>800 mg/kg 反復投与 毒性試験 ラット (♂♀各15, 休薬:♂♀各5) 3 箇月間 反復経口 + 28 日間 休薬 1 3 10 30 無毒性量:1 mg/kg 死亡例:30 mg/kg の♂♀各 1 例(循環障害) 主な所見:尿量・摂水量増加,尿比重低下(≥10 mg/kg),RBC・HCT・Hb 増加,血清Na・Cl の低下(30 mg/kg),AST・ALT・ALP 上昇 (30 mg/kg),肝重量増加(≥3 mg/kg),心重量増加 (≥10 mg/kg),腎糸球体の腫大(≥30 mg/kg),近位尿細管の 再生と硝子円柱の出現(♂30 mg/kg) ラット (♂♀各20) 12 箇月間 反復経口 0.3 1 3 10 無毒性量:3 mg/kg 死亡例:投与に起因する死亡例なし 主な所見:尿量増加・尿中電解質増加と尿比重低下・血清Cre 及び BUN 上昇(10 mg/kg),心臓重量増加(10 mg/kg),軽微な歯肉の 過形成(10 mg/kg),副腎皮質球状帯細胞の軽微ないし軽度 な肥大(♂10 mg/kg) イヌ (♂♀各3) 3 箇月間 反復経口 1 3 10 無毒性量:3 mg/kg 死亡例:なし 主な所見:心拍数の増加,心筋の変性・壊死及び線維化(いずれも♂ 10 mg/kg) イヌ (♂♀各3) 12 箇月間 反復経口 1 3 10 無毒性量:1 mg/kg 死亡例:10 mg/kg の雄 1 例 主な所見:死亡例;心臓乳頭筋の心筋細胞の壊死及び周囲間質の細胞 浸潤,全葉性の浸出性肺炎,肝細胞の萎縮及び空胞変性, 生存例;心臓乳頭筋の石灰沈着(3 mg/kg の♀1 例) 遺伝毒性試験 遺伝子突然変異 (サルモネラ, 大腸菌) in vitro 50~5000 μg/plate 陰性 染色体異常 (CHL 細胞) in vitro 直接法 9.8~24.3 μg/mL S9(-) 16.3~40.5 μg/mL S9(+) 28.1~70.0 μg/mL 陰性 マウス小核 腹腔内 347, 417, 500 陰性 がん原性試験 マウス (♂♀各50) 18 箇月間 経口 3, 10, 30 催腫瘍性なし ラット (♂♀各50) 24 箇月間 経口 1, 3, 10 催腫瘍性なし 生殖発生 毒性試験 ラットSeg.I (♂♀各25) 経口 ♂:交配前9 週間 ~交配期間2 週間 ♀:交配前2 週間 ~妊娠7 日 1 3 10 30 無毒性量:親一般・親生殖;>30 mg/kg,次世代発生;10 mg/kg 主な所見:着床前及び後の死亡胚数の増加(30 mg/kg) ラットSeg.II (♀34~37) 経口 妊娠7~17 日 3 10 30 催奇形性なし 無毒性量:親一般・次世代発生;10 mg/kg,親生殖;>30 mg/kg 死亡例:30 mg/kg 群の 1 例が妊娠 18 日に死亡 主な所見:親動物;心臓の肥大(死亡例),摂餌量減少及び一過性体重 減少(30 mg/kg),出生児;体重減少(30 mg/kg) ラットSeg.III (♀23~35) 経口 妊娠17 日 ~出産21 日 1 3 10 無毒性量:親一般・親生殖;3 mg/kg,次世代発生;>10 mg/kg 主な所見:親動物で死亡例及び摂餌量減少・体重増加抑制(10 mg/kg) ウサギSeg.II (♀12~14) 経口 妊娠6~18 日 10 30 100 催奇形性なし 無毒性量:親一般;30 mg/kg,親生殖・次世代発生;>100 mg/kg 主な所見:親動物で摂餌量減少(100 mg/kg)
表 2.6.6.10-2 CS-905 の毒性試験成績一覧(続き) 試験の種類 動物種 (1 群例数) 投与期間 経路 投与量 (mg/kg) 試験結果 抗原性試験 モルモット (♀5~6) 経口: 5 回/週×4 週間 皮下(+FCA): 10 日間隔 3 回 0.1 1 mg/body PCA 反応:陰性 SANA 反応:陰性 マウス (♀6) 経口: 5 回/週×3 週間 腹腔(+Alum): 1 週間隔 3 回 0.01 0.1 mg/body PCA 反応:陰性 ウサギ (♀3) 経口: 5 回/週×4 週間 皮下・筋肉内(+FCA): 10 日間隔 3 回 0.2 1 PCA 反応:陰性 遅延型皮膚反応:FCA 併用免疫で陽性 光毒性試験 培養細胞 (3T3 NRU) in vitro 紫外線非照射:0.316~1000 μg/mL 紫外線照射:0.0316~100 μg/mL 陰性 光感作性試験 モルモット (♀5) Adjuvant and Strip 法 光感作:0.15% 光惹起:0.075%, 0.25% 陰性 光学異性体の 単回投与 毒性試験 マウス (♀♂各5) 単回経口 R 体:125, 250, 500 mg/kg S 体:500, 1000, 2000 mg/kg 概略のLD50値: R 体 ♂♀ 250~500 mg/kg S 体 ♂♀ >2000 mg/kg ラット (♂♀各10) 14 日間 反復経口 3,10,30,100 mg/kg 無毒性量:100 mg/kg 死亡例:なし 主な所見:なし 遺伝子突然変異 (サルモネラ, 大腸菌) in vitro 156.3~5000 μg/plate 陰性 類縁物質R4 (TUK-9300)の 毒性試験 染色体異常 (CHL 細胞) in vitro 直接法 12.5~200 μg/mL S9(-)・S9(+) 25~400 μg/mL 陰性 ラット (♂♀各10) 14 日間 反復経口 3,10,30,100 mg/kg 無毒性量:100 mg/kg 死亡例:なし 主な所見:なし 遺伝子突然変異 (サルモネラ, 大腸菌) in vitro 39.1~5000 μg/plate 陰性 類縁物質R5 (UBS-0653)の 毒性試験 染色体異常 (CHL 細胞) in vitro 直接法 12.5~200 μg/mL S9(-)・S9(+) 25~400 μg/mL 陰性 11. 引用文献
1) Gould AB, Goodman S, DeWolf R, Onesti G, Swartz C. Interrelation of the renin system and erythropoietin in rats. J Lab Clin Med 1980 ; 96 : 523-34.
2) Gould AB, Goodman SA. Effect of an angiotensin-converting enzyme inhibitor on blood pressure and erythropoiesis in rats. Eur J Pharmacol 1990 ; 181 : 225-34.
3) Naeshiro I, Sato K, Chatani F, Sato S. Possible mechanism for the anemia induced by candesartan cilexetil (TCV-116), an angiotensin II receptor antagonist, in rats. Eur J Pharmacol 1998 ; 354 : 179-87. 4) 橋本虎六,今井清,吉村慎介,大滝恒夫.Angiotensin I 変換酵素阻害剤 captopril の実験的 毒性研究―第3 報 ラットに於ける 12 ヶ月慢性毒性について―.J Toxicol Sci 1981 ; 6 : 215-46. 5) 高岡雅哉,木村邦男,山下和男,宮腰昶宏,真鍋淳,松沼尚史,他.Temocapril Hydrochloride (CS-622)の 1 年間連続経口投与によるラットに対する慢性毒性試験.薬理と治療 1991 ;