動物用医薬品・飼料添加物・対象外物質
※
評価書
カルシフェロール及び
25-ヒドロキシコレカルシフェロール
2014年7月
食品安全委員会
※ 食品衛生法(昭和22年法律第233号)第11条第3項の規定に基づき、 人の健康を損なうおそれのないことが明らかであるものとして厚生労働大臣が 定める物質 資料7-4 (参考資料)目 次 頁 ○ 審議の経緯 ... 2 ○ 食品安全委員会委員名簿 ... 2 ○ 食品安全委員会肥料・飼料等専門調査会専門委員名簿 ... 2 ○ 要 約 ... 4 Ⅰ.評価対象動物用医薬品及び飼料添加物の概要 ... 5 1.用途 ... 5 2.有効成分の一般名 ... 5 3.化学名 ... 5 4.分子式 ... 5 5.分子量 ... 6 6.構造式 ... 6 7.使用目的及び使用状況等 ... 6 Ⅱ.安全性に係る知見の概要 ... 7 1.吸収・分布・代謝・排泄 ... 7 (1)薬物動態試験 ... 8 (2)残留試験 ... 10 2.毒性に関する知見 ... 13 (1)遺伝毒性試験 ... 13 (2)急性毒性試験 ... 13 (3)亜急性毒性試験 ... 14 (4)慢性毒性及び発がん性試験 ... 15 (5)生殖発生毒性試験 ... 16 (6)ヒトにおける知見 ... 18 (7)対象動物を用いた安全性試験 ... 22 3.国際機関等における評価について ... 23 (1)EFSA における評価 ... 23 (2)EMEA における評価 ... 23 (3)その他 ... 24 (4)日本における評価 ... 24 Ⅲ.食品健康影響評価 ... 24 ・ 別紙1:ビタミン D 関連物質略称 ... 26 ・ 別紙2:検査値等略称 ... 26 ・ 参照 ... 27
〈審議の経緯〉 2005 年 11 月 29 日 対象外物質告示(参照 1) 2010 年 2 月 16 日 カルシフェロールについて厚生労働大臣から食品衛生法第 11 条第3 項の規定に基づき、人の健康を損なうおそれのないこと が明らかである物質を定めることに係る食品健康影響評価につ いて要請(厚生労働省発食安0215 第 55 号)、関係資料の接受 2010 年 2 月 18 日 第 320 回食品安全委員会(要請事項説明) 2013 年 12 月 20 日 25-ヒドロキシコレカルシフェロールについて農林水産大臣か ら飼料添加物としての指定に係る食品健康影響評価について要 請(25 消安第 4445 号)、関係資料の接受 2013 年 12 月 24 日 25-ヒドロキシコレカルシフェロールについて厚生労働大臣か ら食品衛生法第11 条第 3 項の規定に基づき、人の健康を損なう おそれのないことが明らかである物質を定めることに係る食品 健康影響評価について要請(厚生労働省発食安1220 第 20 号)、 関係資料の接受 2014 年 1 月 7 日 第 499 回食品安全委員会(要請事項説明) 2014 年 2 月 5 日 第 83 回肥料・飼料等専門調査会 2014 年 5 月 13 日 第 513 回食品安全委員会(報告) 2014 年 5 月 14 日 から 6 月 12 日まで 国民からの意見・情報の募集 2014 年 7 月 2 日 肥料・飼料等専門調査会座長から食品安全委員会委員長へ報告 2014 年 7 月 8 日 第 521 回食品安全委員会(報告) 同日付けで食品安全委員会委員長から厚生労働大臣及び農林水 産大臣へ通知 〈食品安全委員会委員名簿〉 (2011 年 1 月 6 日まで) (2012 年 6 月 30 日まで) (2012 年 7 月 1 日から) 小泉 直子(委員長) 小泉 直子(委員長) 熊谷 進 (委員長*) 見上 彪 (委員長代理*) 熊谷 進 (委員長代理*) 佐藤 洋 (委員長代理*) 長尾 拓 長尾 拓 山添 康 (委員長代理*) 野村 一正 野村 一正 三森 国敏(委員長代理*) 畑江 敬子 畑江 敬子 石井 克枝 廣瀬 雅雄 廣瀬 雅雄 上安平 洌子 村田 容常 村田 容常 村田 容常 * :2009 年 7 月 9 日から * :2011 年 1 月 13 日から * :2012 年 7 月 2 日から 〈食品安全委員会肥料・飼料等専門調査会専門委員名簿〉 (2011 年 9 月 30 日まで) (2013 年 9 月 30 日まで) (2013 年 10 月 1 日から) 唐木 英明(座長) 唐木 英明(座長) 津田 修治(座長*) 酒井 健夫(座長代理) 津田 修治(座長代理) 今井 俊夫(座長代理*)
青木 宙 髙橋 和彦 青木 宙 髙橋 和彦 荒川 宜親 戸塚 恭一 秋葉 征夫 舘田 一博 秋葉 征夫 舘田 一博 池 康嘉 中山 裕之 池 康嘉 津田 修治 池 康嘉 戸塚 恭一 石原 加奈子 細川 正清 今井 俊夫 戸塚 恭一 今井 俊夫 細川 正清 今田 千秋 宮島 敦子 江馬 眞 細川 正清 江馬 眞 宮島 敦子 桑形 麻樹子 宮本 亨 桑形 麻樹子 宮島 敦子 桑形 麻樹子 山中 典子 小林 健一 山田 雅巳 下位 香代子 元井 葭子 下位 香代子 吉田 敏則 下位 香代子 山中 典子 高木 篤也 吉田 敏則 髙橋 和彦 吉田 敏則 * :2013 年 10 月 10 日から 〈第83 回肥料・飼料等専門調査会専門参考人名簿〉 唐木 英明
要 約 食品衛生法(昭和22 年法律第 233 号)第 11 条第 3 項の規定に基づき、人の健康を損な うおそれのないことが明らかであるものとして厚生労働大臣が定める物質(対象外物質) にカルシフェロール及びその代謝物である 25-ヒドロキシコレカルシフェロールを定める こと、飼料の安全性の確保及び品質の改善に関する法律(昭和28 年法律第 35 号)第 2 条 第 3 項の規定に基づき、25-ヒドロキシコレカルシフェロールを飼料添加物に指定するこ と、並びに同法第3 条第 1 項の規定に基づき、この飼料添加物の基準及び規格並びにこれ を含む飼料の基準及び規格を設定することについて、EFSA 及び EMEA の評価書等を用 いて食品健康影響評価を実施した。 カルシフェロールは、抗くる病作用を持つ脂溶性ビタミンであるビタミンD の総称であ り、生理学的に重要なものは、エルゴカルシフェロール(ビタミンD2)及びコレカルシフ ェロール(ビタミンD3)の2 種類のみである。カルシフェロールは、紫外線の照射を受け てヒトの体内でも生合成されるが、魚肉、バター、卵黄等に含まれており、通常食品を通 じて摂取されている。 カルシフェロールはしばしば、過剰投与が問題になる。しかし、通常の食事では過剰量 のカルシフェロールを摂取することはなく、補助的なサプリメントなどによる過剰摂取に よりカルシフェロール過剰症が起こる可能性が高いとされている。 EFSA では、現在認められている最大量のコレカルシフェロールを飼料に添加しても許 容上限摂取量(UL)を超えないと結論付けている。また、各年齢層における UL は、高 Ca 血症をカルシフェロールの毒性の指標として設定されているが、多量に摂取するヒト においても、その摂取量はどの年齢層でもUL 未満であることが示されている。 EMEA では、動物用医薬品として最大残留基準値(MRL)を設定する必要はないとさ れている。 さらに、カルシフェロールは我が国における飼料添加物、食品添加物等、様々な分野で 使用されており、その使用実績においてもこれまでに安全性に関する特段の問題は認めら れていない。 これらのことから、食品を介してヒトがカルシフェロールを過剰に摂取することはない と考えられる。また、カルシフェロールを含む食品について、長年の食習慣における弊害 も認められていない。 25-ヒドロキシコレカルシフェロールは、コレカルシフェロールの代謝物であり、その毒 性についてはカルシフェロールより強いとは考えられない。また、食品を介してヒトが 25-ヒドロキシコレカルシフェロールを過剰に摂取することはないと考えられる。 以上のことから、カルシフェロール及び 25-ヒドロキシコレカルシフェロールは、動物 用医薬品及び飼料添加物として通常使用される限りにおいて、食品に残留することにより 人の健康を損なうおそれのないことが明らかであるものであると考えられる。
Ⅰ.評価対象動物用医薬品及び飼料添加物の概要 1.用途 動物用医薬品(代謝用薬) 飼料添加物(飼料の栄養成分その他の有効成分の補給) 2.有効成分の一般名 和名:カルシフェロール 英名:Calciferol 3.化学名 エルゴカルシフェロール(Ergocalciferol、ビタミン D2) IUPAC 英名:(1S,3Z)-3-[(2E)-2-[(1R,3aS,7aR)-1-[(E,2R,5R)-5,6-dimethylhept-3-en-2-yl] -7a-methyl-2,3,3a,5,6,7-hexahydro-1H-inden-4-ylidene]ethylidene]-4- methylidenecyclohexan-1-ol CAS (No. 50-14-6) 英名:(3β,5Z,7E,22E)-9,10-Secoergosta-5,7,10(19),22-tetraen-3-ol コレカルシフェロール(Cholecalciferol、ビタミン D3) IUPAC 英名:(1S,3Z)-3-[(2E)-2-[(1R,3aS,7aR)-7a-methyl-1-[(2R)-6-methylheptan-2-yl] -2,3,3a,5,6,7-hexahydro-1H-inden-4-ylidene]ethylidene]-4- methylidenecyclohexan-1-ol CAS (No. 67-97-0) 英名:(3β,5Z,7E)-9,10-Secocholesta-5,7,10(19)-trien-3-ol 25-ヒドロキシコレカルシフェロール(25-hydroxycholecalciferol、25(OH)D3) IUPAC 英名:(1S,3Z)-3-[(2E)-2-[(1R,3aS,7aR)-1-[(2R)-6-hydroxy-6-methylheptan-2-yl] -7a-methyl-2,3,3a,5,6,7-hexahydro-1H-inden-4-ylidene]ethylidene]-4- methylidenecyclohexan-1-ol CAS (No. 19356-17-3) 英名:(3β,5Z,7E)-9,10-Secocholesta-5,7,10(19)-trien-3,25-diol 4.分子式 C28H44O(エルゴカルシフェロール) C27H44O(コレカルシフェロール) C27H44O2(25-ヒドロキシコレカルシフェロール)
5.分子量 396.65 (エルゴカルシフェロール) 384.64 (コレカルシフェロール) 400.64 (25-ヒドロキシコレカルシフェロール) 6.構造式 エルゴカルシフェロール コレカルシフェロール 25-ヒドロキシコレカルシフェロール (参照 2) 7.使用目的及び使用状況等 カルシフェロールは、抗くる病作用を持つ脂溶性ビタミンであるビタミンD の総称で ある。ビタミンD には 17 位の側鎖構造の違いにより D2~D7が存在し、このうち自然 界に広く分布し、生理学的に重要なものは、エルゴカルシフェロール(ビタミンD2)及 びコレカルシフェロール(ビタミンD3)1の2 種類のみである。両者の分子量はほぼ等 しく、体内で同様に代謝され、ほぼ同等の生理効力を現す。(参照3、4、5、6) ビタミンは、生物が正常な生理機能を維持するための必要量は微量であるが、体内で 生合成できないか、できても不十分であるため、食物から栄養素として取り入れなけれ ばならない一群の有機化合物(タンパク質、炭水化物、脂肪及び無機質以外の物質)の 総称である。ビタミンは、その溶解性から水溶性と脂溶性に分類される。多くのビタミ ンは、補酵素や補欠分子族の主要構成成分として生体反応に関与している。(参照4) 1 狭義のカルシフェロール
ビタミンD には 2 つの供給源がある。一つは皮膚に存在するプロビタミン D3(7-デ ヒドロコレステロール)が日光中の紫外線の照射を受けてプレビタミン D3となり、さ らに体温により熱異性化されてビタミン D3になったもので、もう一つは食品から摂取 されるものである。(参照6) 食品中のビタミンD は、ほとんどがビタミン D3で、魚類の肝臓、魚肉、バター、卵 黄等に含まれるが、大部分の植物性食品には含まれず、キノコ類にエルゴステロール(プ ロビタミンD2)が含まれているのみである。主な生理作用はCa 及びリンの代謝の保持 であり、小腸における Ca 及びリンの吸収促進、血中 Ca 濃度の調節、骨組織へのリン 酸Ca の沈着などの作用を示す。(参照 4) また、最近の研究から、造血系においてビタミンD が細胞分化及び増殖に影響を及ぼ し、インスリンの分泌過程に一定の役割を果たす等の作用があることが明らかになって きた。(参照7) 日本では、動物用医薬品としては、コレカルシフェロールがビタミン剤や代謝用剤と して承認されている。 飼料添加物としては、エルゴカルシフェロール、コレカルシフェロール、ビタミンD 粉末及びビタミン D3油が飼料の栄養成分その他の有効成分の補給を目的に指定されて おり、対象飼料、添加量等の規定はない。 食品添加物としては、エルゴカルシフェロール及びコレカルシフェロールが指定添加 物(強化剤)として使用されており、使用食品及び使用量は定められていない。 カルシフェロールは、食品に残留する農薬等に関するポジティブリスト制度の導入に 伴い、食品衛生法(昭和22 年法律第 233 号)第 11 条第 3 項の規定に基づき、人の健康 を損なうおそれのないことが明らかであるものとして厚生労働大臣が定める物質(以下 「対象外物質」という。)として、暫定的に定められている。今回、対象外物質カルシフ ェロール及びコレカルシフェロールの代謝物である 25-ヒドロキシコレカルシフェロー ル(25(OH)D3)について、厚生労働省から食品安全委員会に食品健康影響評価が要請 された。また、25-ヒドロキシコレカルシフェロールの豚及び鶏を対象とした飼料添加物 の指定について、農林水産省から食品健康影響評価が要請された。 Ⅱ.安全性に係る知見の概要
本評価書では、EFSA 及び EMEA の評価書、25(OH)D3の飼料添加物指定のための審
査用資料等を基に、ビタミンD2、ビタミンD3及び25(OH)D3等に関する科学的知見を 整理した。 ビタミンD 関連物質略称及び検査値等略称を別紙 1 及び 2 に示した。 1.吸収・分布・代謝・排泄 ビタミンD は、胆汁酸の分泌により溶解性が高まり小腸下部からリンパ管吸収を経て 循環血に到達し各組織に分布する。利用されなかったビタミンD はほとんど胆汁から小 腸へ排泄される。 吸収されたビタミンD は、肝臓において水酸化され 25-ヒドロキシカルシフェロール
(25(OH)D)となり、血漿中の α 及び β リポタンパク質に結合して腎臓へ分布する。そ こでさらに水酸化され、1α,25-ジヒドロキシカルシフェロール(1α,25(OH)2D)又は 24,25-ジヒドロキシカルシフェロール(24,25(OH)2D)となる。 ヒトにおける紫外線によるビタミンD3の生成及びビタミンD3の代謝経路を図1 に、 ヒトにおけるビタミンD2の代謝経路を図2 に示す。 1α, 25(OH)2D は最終的な活性物質として、小腸上皮粘膜細胞において Ca 結合タンパ ク質の合成を促進することにより、Ca の小腸からの吸収に関与する。 水酸化体はグルクロン酸抱合又は硫酸抱合を受け、主として胆汁中へ、一部は尿中へ 排泄される。未変化体は尿中へは排泄されない。胆汁中へ排泄された代謝物は腸肝循環 を行う。半減期は約40 日とされている。血液中では α 及び β リポタンパク質と結合す る。25(OH)D の血中濃度は約 0.01~0.04 μg/mL である。(参照 5、8) 図1 ヒトにおける紫外線によるビタミン D3の生成及びビタミンD3の代謝経路 図2 ヒトにおけるビタミン D2の代謝経路 (1)薬物動態試験 ① ラット ラット(性別、匹数等不明)に3H 標識 25(OH)D3を静脈内投与(0.7 μg/kg 体重)し、 薬物動態試験が実施された。25(OH)D3は投与8 時間後に血清中放射活性の約 76%を占
めたが、ビタミンD3及びビタミンD エステル類はそれぞれ 6.8 及び 9.8%であった。投 与後8 時間の尿中には、より極性の高い分画である 25(OH)D3及び1α,25-ジヒドロキシ コレカルシフェロール(1α,25(OH)2D3)がそれぞれ96 及び 2.6%みられた。投与 8 時間 後の肝臓及び腎臓における放射活性の約90%は、25(OH)D3であった。また、1α,25 (OH)2 D3のような極性代謝物及びビタミンD3も検出された。(参照9) ② 豚 豚(性別、頭数等不明)にビタミンD3を1 か月間混餌投与(0、90、350 又は 250,000 IU(0、2.25、8.75 又は 6,250 μg)2/頭/日、摂取量(μg/kg 体重)及び被験動物の体重は不明) し、薬物動態試験が実施された。最終投与後のビタミン D3の血中濃度は、それぞれ 0.0065、0.008、0.013 及び 58.43 μg/mL であった。その後血中濃度は低下し、最終投 与4 週後には 0.007、0.0055、0.00875 及び 0.051 μg/mL となった。最終投与 12 週後 には、6,250 μg /頭/日投与群の血中濃度は、0.016 μg/mL であった。(参照 9) ③ 羊 羊(性別、頭数等不明)にビタミンD3を筋肉内投与(25、250 又は 2,500 μg/kg 体重) した結果、25 μg/kg 体重投与群では、投与後 6 日間のビタミン D3の血漿中濃度は、0.004 ~0.005 μg/mL であった。(参照 9) 羊(性別、頭数等不明)にビタミンD3を単回経口又は筋肉内投与(2,500~3,125 μg/kg 体重(推奨用量の 50 倍以上))した。投与 1 日後のビタミン D3の血漿中濃度は0.007~ 0.008 μg/mL であった。その後漸減し投与 15 日後には 0.004~0.005 μg/mL となった。 (参照9) 羊(性別、頭数等不明)にビタミンD3を単回静脈内投与(50,000 μg/頭:1,000~1,250 μg/kg 体重)した結果、投与 1、5 及び 20 日後の血漿中濃度はそれぞれ 1.47、0.3 及び 0.04 μg/mL であった。(参照 9) 羊(性別、頭数等不明)に25(OH)D3を単回静脈内投与(50,000 μg /頭:1,000~1,250 μg/kg 体重)した結果、投与 1、5 及び 20 日後の血漿中濃度はそれぞれ 0.60、0.40 及び 0.030 μg/mL であった。(参照 9) 羊(性別、頭数等不明)に3H 標識ビタミン D3を単回筋肉内投与(50 μCi)した結果、 投与3 日後の血漿中放射活性は、全て 25(OH)D3であった(検出濃度(μg/mL)不明)。(参 照9) 2 ビタミン D の国際単位(IU)は、結晶ビタミン D3の0.025 μg を 1 IU と定めている(参照 3)ことから、 以下参照資料中に記載のIU を単位とする投与量等は μg に換算して記載した。
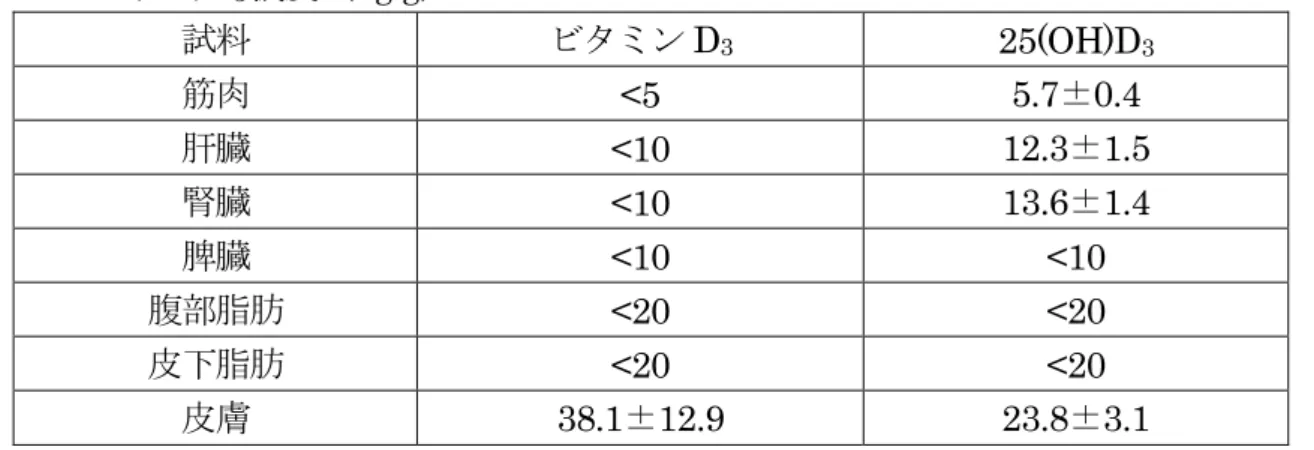
④ 鶏 鶏(1 日齢、雄)に 14 日間ビタミン D3欠乏飼料を投与後、3H 標識ビタミン D3又は 3H 標識 25(OH)D3を6 日間混餌投与した。最終投与後、腸を採取し放射活性を測定し た。 その結果、ビタミンD3及び25(OH)D3はそれぞれ投与量の66.5±3.3 及び83.6±2.1% が吸収された。十二指腸から分泌された25(OH)D3及びその他の代謝物の一部は空腸で 再吸収された。また、1 日当たり摂取されたビタミン D3及び25(OH)D3はそれぞれ20 及び7%が排泄された。(参照 10) (2)残留試験 ① 豚 豚(交雑種、6 週齢、雌雄各 6 頭/群)にビタミン D3又は25(OH)D3を42 日間混餌投 与(50、250 又は 500 ppm:2.2~3.3、11.0~16.7 又は 22.0~33.3 μg/kg 体重/日、ビ タミンD3は50 ppm のみ)し、最終投与直後の組織中 25(OH)D3濃度を測定した。 結果を表1 に示した。(参照 11) 表 1 豚におけるビタミン D3及び 25(OH)D3 42 日間混餌投与後の組織中 25(OH)D3 濃度(ng/g) 試料 ビタミンD3 25(OH)D3 50 ppm 50 ppm 250 ppm 500 ppm 筋肉 <5 6.00±1.15 20.38±7.57 26.86±7.81 肝臓 <10 19.3±4.2 49.8±16.1 87.2±19.5 皮膚 25.1±4.0 30.0±9.1 88.2±34.6 151.5±56.6 定量限界:筋肉 5 ng/g、肝臓 10 ng/g、皮膚 20 ng/g 豚(交雑種(WL)、28 日齢、20 頭/群)にビタミン D3又は25(OH)D3を86 日間混餌 投与(50 ppm:2.2~3.3 μg/kg 体重/日)し、最終投与直後の組織中 25(OH)D3濃度を測 定した。 結果を表2 に示した。(参照 12)
表 2 豚におけるビタミン D3又は25(OH)D3 86 日間混餌投与(50 ppm)後の組織中 25(OH)D3濃度(ng/g) 試料 ビタミンD3 25(OH)D3 筋肉 <5 5.7±0.4 肝臓 <10 12.3±1.5 腎臓 <10 13.6±1.4 脾臓 <10 <10 腹部脂肪 <20 <20 皮下脂肪 <20 <20 皮膚 38.1±12.9 23.8±3.1 定量限界:筋肉 5 ng/g、肝臓・腎臓・脾臓 10 ng/g、脂肪・皮膚 20 ng/g 豚(性別、頭数等不明)にビタミンD3を1 か月間混餌投与(0、2.25、8.75 又は 6,250 μg/頭/日:摂取量(μg /kg 体重)不明)し、残留試験が実施された。投与終了時、肝臓中の ビタミンD3濃度はそれぞれ2.25、1.75、5.25 及び 677.5 μg/kg であった。6,250 μg/頭/ 日投与群では、最終投与4、12 及び 24 週後においてそれぞれ 22.25、3.75 及び 2.25 μg/kg と減少した。他の可食部組織の知見は得られなかった。(参照9) ② 羊 羊(性別、頭数等不明)に3H 標識 25(OH)D3(50 μCi)又は3H 標識ビタミン D3(50 μCi)の単回筋肉内投与後、かなりの量の放射活性が肝臓及び腎臓から検出されたが、 組織中放射活性は急激に減衰したため、可食部組織における残留濃度の評価はできなか った。(参照9) 羊(雌、4 頭/群)にビタミン D3を単回筋肉内投与(500~625 μg/kg 体重:推奨用量 の10 倍量)し、投与 1、2、3、4 及び 7 か月後に組織中濃度を測定した。ビタミン D3 濃度は、投与1 か月後では筋肉、脂肪、肝臓及び腎臓中でそれぞれ 2.90、5.40、2.90 及 び4.0 μg/kg であり、投与 7 か月後でも、腎臓(1.60 μg/kg)及び脂肪(3.26 μg/kg)中 から検出された。(参照9) 羊(性別、頭数等不明)にビタミンD3を単回経口、筋肉内又は静脈内投与(2,500~ 3,125 μg/kg 体重(推奨用量の 50 倍以上))し、残留試験が実施された。投与 22 日後の組 織中ビタミンD3濃度は、肝臓で3.40~4.96 μg/kg、腎臓で 3.97~5.06 μg/kg、脂肪で 4.73~6.46 μg/kg であり、経口投与の場合が最も低いと報告されている。(参照 9) ③ 乳汁 乳汁中でビタミンD2及びビタミンD3並びに22,23-ジヒドロエルゴステロール(ビタ ミンD4)及び7-デヒドロシトステロール(ビタミン D5)のようなより微量な物質の痕 跡がみられることが報告されている。通常乳汁中には、ビタミンD は痕跡程度の量しか
みられない。(参照9) ビタミンD3の大量単回経口投与(125,000~250,000 μg/乳用動物:約 250~500 μg/kg 体重)により、投与後10 日間に、低用量群で 1~3 μg/L、高用量群で 1.58~7 μg/L が 検出された。投与28 日後にはビタミン D3は検出されなかった。(参照9) ビタミンD3の大量単回静脈内投与(125,000~250,000 μg/動物:約 250~500 μg/kg 体重)により、投与7 日後の乳汁中のビタミン D3濃度は、低用量群で2. 5 μg/L、高用 量群で9 μg/L であった。投与 28 日後には、ビタミン D3は、少数の動物からのみ検出 された(0.5~2.25 μg/L)。(参照 9) 羊(乳用種)に、ビタミンD3を単回静脈内投与(50,000 μg/頭:1,000~1,250 μg/kg 体重)した結果、乳汁中のビタミンD3濃度は、投与1、3 及び 10 日後で 360、200 及 び40 μg/L であった。投与 20 日後には、乳汁中のビタミン D3は投与前のレベル(2~3 μg/L)に回復した。(参照 9) ④ 鶏 鶏(採卵鶏(デカルブ)、24 週齢、10 羽/群×9 反復;計 450 羽)にビタミン D3又は 25(OH)D3を224 日間混餌投与し、最終投与後の組織及び卵中 25(OH)D3濃度を測定し た。投与量はビタミンD3が69 ppm(3.8~4.2 μg/kg 体重/日)、25(OH)D3が41.25、82.5、 412.5 又は 825.0 ppm(2.3~2.5、4.6~5.0、23~25 又は 46~50 μg/kg 体重/日)であ った。 結果を表3 に示した。(参照 13) 表 3 鶏におけるビタミン D3又は25(OH)D3 224 日間混餌投与後の組織中 25(OH)D3 濃度(ng/g) 試料 ビタミンD3 25(OH)D3 69 ppm 41.25 ppm 82.5 ppm 412.5 ppm 825.0 ppm 卵 10.5±3.0 11.9±6.7 13.2±7.0 24.2±7.9 46.9±9.5 肝臓 7.6±0.9 7.5±1.9 9.2±2.0 25.6±6.0 46.5±18.5 筋肉(胸部) 2.5±0.8 - 3.4±1.0 8.2±5.2 - 筋肉(大腿) 3.7±0.7 - 4.6±0.7 14.5±5.9 - 皮膚+脂肪 10.7±1.9 - 13.5±2.2 44.6±6.2 - -:測定せず 定量限界不明 鶏(肉用鶏、1 日齢、雌雄各 40 羽/群)にビタミン D3又は25(OH)D3を36 日間混餌 投与(それぞれ125 ppm:7.4~10.8 μg/kg 体重/日又は 100 ppm:9.3~13.5 μg/kg 体重 /日)し、最終投与後の組織中 25(OH)D3濃度を測定した。 結果を表4 に示した。25(OH)D3濃度は全組織で定量限界未満であった。(参照14)
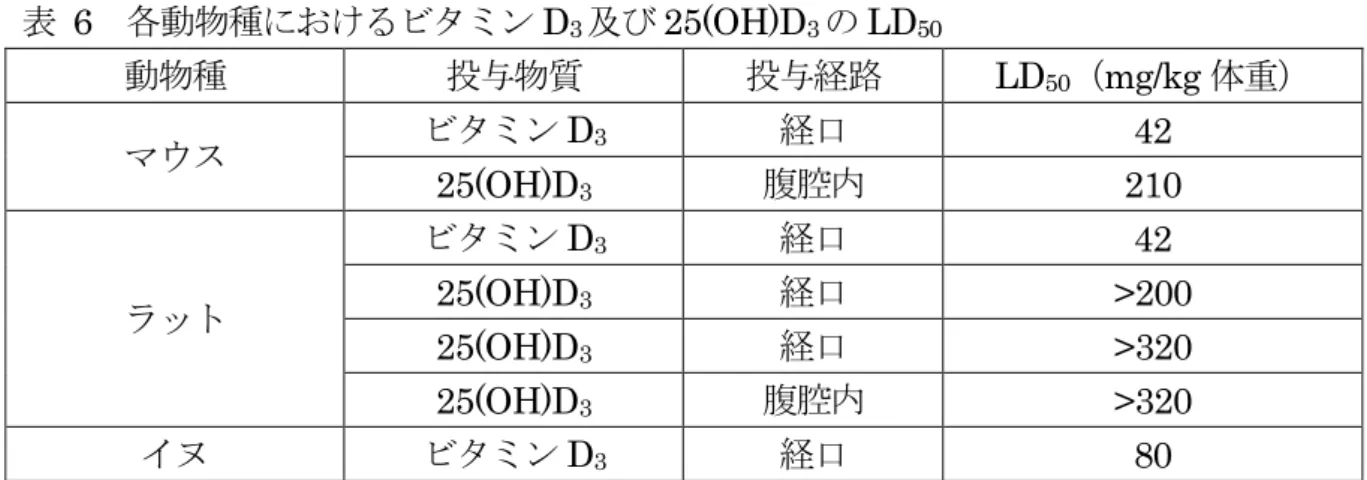
表 4 鶏におけるビタミン D3又は 25(OH)D3 36 日間混餌投与後の組織中 25(OH)D3 濃度(ng/g) 試料 ビタミンD3 25(OH)D3 125 ppm 100 ppm 肝臓 <10 <10 腎臓 <10 <10 筋肉 <5 <5 脂肪 <20 <20 定量限界:筋肉 5 ng/g、肝臓・腎臓 10 ng/g、脂肪 20 ng/g 2.毒性に関する知見 (1)遺伝毒性試験 Salmonella typhimurium を用いたビタミン D3の復帰突然変異試験及びヒト培養末 梢血リンパ球を用いた25(OH)D3の染色体異常試験の内容を表5 に示した。結果はいず れも陰性であった。(参照15、24) 表 5 ビタミン D3及び25(OH) D3の遺伝毒性試験 試験 被験物質 対象 用量 結果 復帰突然変異 試験 ビタミンD3 S. typhimurium TA98、TA100、 TA1535、TA1537 0.033 ~ 10 mg/plate (±S9) 陰性* 染色体異常試 験 25(OH)D3 ヒト培養末梢血リンパ 球 2.0、3.5、6.1、10.7、 18.7、32.7 μg/mL (-S9)22 h 培養 5.7、10.0 μg/mL (-S9)46 h 培養 18.7、32.7、57.1 μg/mL (+S9)22 h 培養 10.7、18.7、32.7、57.1 μg/mL(+S9)46 h 培 養 陰性 *:1 mg/plate 以上の用量で僅かな毒性を示した。 h:時間 (2)急性毒性試験 各動物種における急性毒性試験の結果を表6 に示した。(参照 9、16、17)
表 6 各動物種におけるビタミン D3及び25(OH)D3のLD50 動物種 投与物質 投与経路 LD50(mg/kg 体重) マウス ビタミンD3 経口 42 25(OH)D3 腹腔内 210 ラット ビタミンD3 経口 42 25(OH)D3 経口 >200 25(OH)D3 経口 >320 25(OH)D3 腹腔内 >320 イヌ ビタミンD3 経口 80 ラット(Wistar 系)にビタミン D3を3 日間連続投与(100,000 IU(2.5 mg):投与経 路不明)すると、心筋壊死がみられた。(参照8) ラット(雄)にビタミン D2を混餌投与し、急性毒性試験が実施された。0.39 %以上 投与群では投与3 日以内に全てのラットが死亡した。投与後 7 日間の累計摂取 LD50は 110.5 mg/kg であった。生存及び死亡ラットで多くの器官に石灰沈着が、また腎尿細管 障害、肺出血、肝小葉中心性壊死及び高Ca 血症が認められた。(参照 8) ラット、マウス及びイヌの急性毒性試験では、食欲不振、衰弱、血清中 Ca 及びリン の増加並びにほぼ全ての臓器の出血、壊死及び石灰化がみられた。(参照9) イヌにおける致死量は13 mg/kg 体重とされている。直接的な影響は血性下痢、食欲 不振、多尿及び衰弱である。生残動物においては、慢性のビタミン D 過剰症と同様の Ca 蓄積がみられた。(参照 7) (3)亜急性毒性試験 ① 4 及び 26 週間亜急性毒性試験(ラット) ラット(Crl:CD BR、10 週齢)にビタミン D3を26 週間反復経口投与(0、125、250 又は500 μg/kg 体重/日3)し、亜急性毒性試験が実施された。全投与群でCa 及びリン の血清中濃度及びCa の尿中排泄が増加した。投与開始 4 週後に、125 及び 250 μg/kg 体重/日投与群で腎尿細管の散発的な石灰沈着巣がみられ、500 μg/kg 体重/日投与群では さらに明瞭な変化がみられた。投与開始26 週後には、500 μg/kg 体重/日投与群では全 例で腎に軽度又は中等度の腎石灰沈着が、250 μg/kg 体重/日投与群では軽度の石灰沈着 がみられたが、125 μg/kg 体重/日投与群ではほとんど石灰沈着はみられなかった。(参 照7) ② 6 か月間亜急性毒性試験(ラット) ラット(SD 系、雌雄各 15 匹/群)に 25(OH)D3を6 か月間混餌投与(0、0.012、0.04 3 参照資料原文では 12.5、25 又は 50 μg/kg 体重/日
又は0.12 mg/kg 体重/日)し、亜急性毒性試験が実施された。 一般状態、血液学的検査、臓器重量に投与に起因する影響はみられなかった。 摂餌量が、0.04 mg/kg 体重/日以上投与群で、対照群及び 0.012 mg/kg 体重/日投与群 に比べ低下した。 病理組織学的検査で、腎の石灰化が対照群を含む全群の雌でみられた。結石が 0.04 mg/kg 体重/日以上投与群の雄で膀胱に、0.12 mg/kg 体重/日投与群の雄で腎盂にみられ た。(参照18) ③ 7~21 日間亜急性毒性試験(イヌ) イヌ(性別、頭数等不明)にビタミンD2を7~21 日間経口投与(500 又は 1,000 μg/kg 体重/日)した結果、高 Ca 血症を伴う腎症を発症した。(参照 9) ④ 4 か月間亜急性毒性試験(豚) 豚(2 か月齢)にビタミン D3を4 か月間混餌投与(0.025、0.075、0.05 又は 0.1 ppm: 0.15、0.45、3 又は 6 μg/kg 体重/日に相当)し、亜急性毒性試験が実施された。特に 6 μg/kg 体重/日投与群で冠状動脈血管内膜の肥厚がみられ、同部で脂肪を含有した細胞及び変性 細胞の増加もみられた。(参照7) ⑤ 反復投与試験(サル) アカゲザル(性別、頭数等不明)にビタミン D3(1,250~10,000 μg/匹)を反復経口 投与(日数不明)した結果、全例に高 Ca 血症が生じて死亡し、軟部組織に高度の石灰 化が認められた。(参照8) (4)慢性毒性及び発がん性試験 慢性毒性試験及び発がん性試験は実施されていない。 ① 26 週間投与試験(ラット)〈参考データ〉 種々の糖アルコール類の高用量投与により誘発される褐色細胞腫の発がん機序とし て推察される、血中カルシウム濃度の上昇による髄質細胞の増殖を解析するため、ラッ ト(Crl:CD)にビタミン D3を26 週間反復経口投与(125、250 又は 500 μg/匹)した 試験が実施された。 その結果、血中 Ca 濃度が上昇し、副腎褐色細胞の細胞増殖が増加するとともに、限 局性過形成が誘発され、また250 又は 500 μg/匹投与群で、各 1 例ではあるが褐色細胞 腫の発生がみられたことから、副腎褐色細胞腫誘発に関連している可能性が示唆された。 (参照8) ② 発がん修飾作用a〈参考データ〉 1,2-ジメチルヒドラジンによりイニシエーション処置され、20%脂肪食を付加するこ とにより結腸腫瘍が誘発されたラットにビタミン D3を混餌投与すると、結腸腫瘍や前 腫瘍性病変の発現は抑制された。(参照8)
③ 発がん修飾作用b〈参考データ〉 50 mg/kg 体重のメチルニトロソ尿素を 50 日齢のラット(SD 系、雌)に投与するこ とにより誘発された乳腺腫瘍は、ビタミンD3と9-シス-レチン酸を 150 日間混餌投与す ることにより発生頻度が44%減少した。(参照 8) 1980 年、日光照射時間の短い地方で大腸がんの発生率の高いことが報告されて以来、 ビタミンD と大腸がんとの関係が注目された。一方、1981 年にはin vitro で活性型ビ タミン D が直接的に白血病や固形がん細胞の分化誘導作用により発育を抑制すること が報告されたが、その作用発現に要する濃度はビタミン D の生理的濃度に比べ約 100 倍程度高濃度である。したがって、悪性腫瘍の治療のためにビタミンD 製剤を投与し有 用な効果の報告がされているものの、高用量が必要であるため副作用として高Ca 血症 をきたすことが問題となる。(参照5) (5)生殖発生毒性試験 ① 生殖毒性試験(ラット) ラット(SD 系、雄 10 匹/群、雌 20 匹/群)を用いて 25(OH)D3の強制経口投与(0、 12 又は 40 μg/kg 体重/日、対照群には溶媒(コーン油)を投与)による生殖毒性試験が実 施された。投与は、雄では交配60 日前から交配期間中に、雌では交配 14 日前から交配 及び妊娠分娩期間中に実施された。 母動物では、12 μg/kg 体重/日投与群の雌雄で対照群と比べ体重が軽度に減少したが有 意差はみられず、40 μg/kg 体重/日投与群では対照群と同様であった。12 μg/kg 体重/日 投与群の母動物1 例で児の死産(産児数 10 匹)が認められ、投与群における死産児数 は対照群に比べ高値を示したが、用量相関性はみられず投与の影響とはみなされなかっ た。 交配率、妊娠及び分娩に投与に起因する影響はみられなかった。(参照19) ② 発生毒性試験(ラット) ラット(SD 系、12 匹/群)の妊娠 6~15 日に 25(OH)D3を強制経口投与(0、12 又は 40 μg/kg 体重/日、対照群には溶媒(コーン油)を投与)し、発生毒性試験が実施された。 母動物では、投与群の体重が対照群に比べて僅かに低値であった。12 μg/kg 体重/日投 与群の同腹児数が対照群に比べて少なかったが、1 例の出産児数が僅か 5 匹であったた めであり、40 μg/kg 体重/日投与群では対照群と同様であった。 胎児では、40 μg/kg 体重/日投与群で、1 匹に 4 種の肋骨骨格異常がみられた。また、 12 μg/kg 体重/日投与群で、1 例の体重が 1.9 g であった胎児に頭蓋骨の未発達及び第 5 中手骨欠損がみられたが、投与に起因するものとは考えられなかった。(参照19) 催奇形性はみられなかった。 ③ 発生毒性試験(ラット) ラット(SD 系、12 匹/群)の妊娠 6~15 日に 25(OH)D3を強制経口投与(0 又は60 μg/kg
体重/日、対照群には溶媒(コーン油)を投与)し、発生毒性試験が実施された(Segment II 試験の一部)。 60 μg/kg 体重/日投与群において、低体重を示した 3 例の胎児に骨格異常及び骨化不全 がみられたが、異常の出現率は対照群と比べて低いか又は同程度であると考えられた。 (参照19) 催奇形性はみられなかった。 ④ 発生毒性試験(ラット) ラット(SD 系、20 匹/群)の妊娠 15 日から 3 週間の授乳期間を通じて 25(OH)D3を 強制経口投与(0、12、 40 又は 60 μg/kg 体重/日、対照群には溶媒(コーン油)を投与) し、周産期及び授乳期投与試験が実施された。妊娠、分娩、授乳及び児動物の生存率に 投与の影響はみられず、各種測定値は全投与群において対照群と同程度であった。(参照 19) ⑤ 発生毒性試験(ウサギ) ウサギ(15 匹/群)の妊娠 6~18 日に 25(OH) D3を強制経口投与(0、5、25 又は 50 μg/kg 体重/日、対照群には溶媒(コーン油)を投与)し、発生毒性試験が実施された。 5 μg/kg 体重/日投与群で異常はみられなかったが、25 μg/kg 体重/日以上投与群で骨格 異常の発現率に有意差がみられた。 25(OH) D3は25 μg/kg 体重/日以上の用量でウサギに催奇形性を示すと考えられた。 (参照19) ⑥ 発生毒性試験(ウサギ)〈参考データ〉 ビタミンD はヒトの推奨用量の 4~15 倍の用量を投与した場合、動物に催奇形性を発 現することが判明している。ビタミンD を高用量(ヒトの推奨用量の 4~15 倍)投与 された妊娠ウサギから生まれた児動物に大動脈弁上狭窄症に類似した病変がみられ、こ の病変のみられない児動物では急性ビタミン D 過剰症の成動物と同様の血管の変化が みられた。これらの症状はおそらく高Ca 血症によるものである。(参照 7) ウサギは催奇形性を検討する上で汎用される動物であるが、ビタミンD に対し極めて 感受性が高く要求量以上の過剰なCa を吸収する。このことからビタミン D 関連物質の ヒトにおける催奇形性を検討するのに適した動物モデルとは言い難い。(参照20) ⑦ 発生毒性試験(豚)〈参考データ〉 豚(雌)にビタミンD3を混餌投与(8,150 又は 55,000 ppm:0.5 又は 3.4 μg/kg 体重 /日、投与期間不明)し、6 週齢の児動物の冠状動脈を検査した結果、高用量投与群の児 動物では、低用量投与群の児動物に比べ、より多くの平滑筋細胞の変性がみられた。(参 照7)
(6)ヒトにおける知見 ① 急性毒性 血清中Ca 濃度が 2.75 mmol/L 未満の高齢の被験者は、ビタミン D2の単回筋肉内投 与(7,500 μg/ヒト)を年に 1 回、4 年にわたり実施しても十分に忍容性があった。一過 性に高 Ca 血症を示した可能性のある例を除き、投与直後の血清中 Ca 濃度の報告はな い。血清中Ca 濃度の僅かな上昇は投与 2~3 か月後までみられた。ビタミン D を 10,000 μg/ヒトの用量で単回筋肉内投与しても明らかな毒性影響はみられなかった。(参照 7) 1~2 歳の幼児に、ビタミン D を 3~5 か月毎に経口投与(15,000 μg/ヒト)した。Ca、 リン及びビタミンD 代謝物が各投与前及び投与 2 週後に測定された。25(OH)D は、平 均濃度が240~430 nmol/L(範囲:130~930 nmol/L)まで上昇し、次の投与前には 130 nmol/L 未満にまで回復した。全ての幼児は初回投与前に血清中 Ca 濃度は正常値であっ たが、14 例(34%)で血清中 Ca 濃度が 2.80 mmol/L 以上(2.81~3.32 mmol/L)とな り、25(OH)D の蓄積性の増加はみられなかったが、ビタミン D の用量が過剰であった ことが示された。 上記試験と同様の投与を実施された 10 名の 1.5~14 歳の子供が腎石灰沈着症と診断 された。しかし、試験の時点においては血清中のビタミンD 濃度は正常であった。これ は、反復する一過性のビタミンD 過剰症及び高 Ca 血症の発現であっても、腎石灰沈着 症のような不可逆性の毒性影響を誘発することを示唆していると考えられた。(参照7) 子供(年齢不明)にビタミンD3を3 か月毎に経口投与(2,500、5,000 又は 15,000 μg/ ヒト)した。各投与群における初回投与2 週後の 25(OH)D 濃度はそれぞれ 92±42、150 ±55 及び 307±160 nmol/L であった。血清中 Ca 濃度が 15,000 μg/ヒト投与群で一過 性に上昇したが、他の投与群では上昇しなかった。15,000 μg/ヒト投与群の半数の児に おいてビタミンD の過剰状態が初回投与 6 か月後まで持続した。(参照 7) 幼児において、中等度の高 Ca 血症が一度発現すると、数か月にわたり発育阻害が生 じる可能性がある。(参照7) ② 生殖発生毒性 妊娠期間中、母体の血清中25(OH)D はビタミン D の摂取と相関性があるが、血清中 の活性代謝物である1α,25(OH)2D は、主に胎盤の脱落膜細胞における合成に依存しビタ ミンD 結合タンパク質(DBP)も増加する。胎児は母体からの 25(OH)D の供給に全て 依存しており、同時に24,25(OH)2D も胎盤を通過して容易に拡散すると考えられる。母 体と胎児の1α,25(OH)2D 濃度の関係はより複雑であり、相関性を示す知見と、それを支 持しない知見もある。(参照7) 副甲状腺機能低下症の女性及び(遺伝的に)1α,25(OH)2D 非感受性の女性の妊娠中に おける1α,25(OH)2D の投与(それぞれ 0.5~2 μg/ヒト/日及び 17~36 μg/ヒト/日)に関 する報告がある。後者の症例では、母体における血漿中1α,25(OH)2D 濃度は非常に高か
ったが、Ca 濃度は正常であった。出産時に臍帯血清中 1α,25(OH)2D 濃度は著しく上昇 し(940 pmol/L、正常値の平均値:47.5 pmol/L)、子供は生後 2 日間に軽度の高 Ca 血 症を呈した。他の毒性徴候を示す子供はみられなかった。このことから、1α,25(OH)2D の血中濃度は子宮内のCa 濃度にほとんど影響を及ぼさないと考えられる。 このことは、妊娠後期にビタミンD を補充(25 μg/ヒト/日)しても発育遅延を呈する 乳児の割合は減少することからも裏付けられている。(参照7) 妊娠中に母体が高Ca 血症を呈した場合、胎児において、ビタミン D に対する感受性、 副甲状腺機能の抑制又は妖精顔症候群(syndrome of elfin face)、精神発達の遅滞及び 先天性大動脈弁上狭窄症を増加させる可能性がある。 しかしながら、妊婦における試験では対照群の設定がなく、どのくらいの用量でこの ような所見が起こるのか不明である。(参照7) 授乳中の女性に冬季にビタミンD2を投与(25 又は 50 μg/ヒト/日)した結果、50 μg/ ヒト/日投与群の子供のみで血中のビタミン D 代謝物濃度が正常であった。ビタミン D を10 μg/ヒト/日の用量で投与され、またビタミン D を補充されていない母親から授乳 されている乳児における血中のビタミンD の状態は、50 μg/ヒト/日投与群の母親の子供 と同様であった。(参照7) ③ 過剰症について ビタミンD は、尋常性狼そう等に大量投与されるが、大量連続投与により、ビタミン D 過剰症が発現する。小児特に乳児が過剰症に陥りやすく、高 Ca 食は過剰症を促進す る。ビタミン D に対する感受性は個人差が大きいため注意を要する。ビタミン D の過 剰投与(3,750 μg /日)により、腸管からの Ca 吸収が促進され、血漿中 Ca 濃度は増加 する。これは副甲状腺の機能抑制を招き、尿中リン排泄が抑制され、血漿中のリン濃度 が上昇する。このため、リン酸 Ca が、気管、肺胞、血管壁、腎臓等に沈着し、最終的 に尿毒症を招くことがある。また骨から血中への Ca 移動を起こし、骨粗しょう症や骨 破壊も現れる。 脂質代謝も阻害され、血漿中コレステロール濃度を上昇させる。臨床症状として食欲 不振、便秘、脚気、嘔吐、口渇、多飲、多尿、倦怠感、筋力低下、頭痛、高血圧、体重 減少、皮膚がん、痔、色素沈着、排尿障害等がみられる。軽症例ではビタミンD の投与 を中止すると治癒するが、重症例には副腎皮質ホルモンが奏効する。(参照8) ビタミンD 過剰症は高 Ca 血症の生理学的影響と関連があり、いったん腎臓における Ca 排泄能の限度を超過すると発現する。最も高頻度にみられるビタミン D 過剰症の臨 床徴候は、食欲不振、体重減少、虚弱、倦怠感、見当識障害、嘔吐及び便秘である。高 Ca 血症は、また、子供の発育遅延、興奮性、無力症、持続性の発熱、多尿症及び多渇 症、脱水、高血圧並びに機能性腎不全をも引き起こす。持続性の高 Ca 血症に伴う長期 間にわたる毒性により、軟部組織、特に腎実質、尿管、血管壁、筋肉及び腱でCa の過 剰な沈着を招く。(参照7)
通常の食事では過剰量のビタミンD を摂取することはなく、補助的なサプリメントな どによる過剰摂取によりビタミン D 過剰症が起こる可能性が高いとされている。(参照 5) ④ 血清中25(OH)D とビタミン D の毒性 35 報のレポートから、ビタミン D の摂取と投与群における血清中 25(OH)D 濃度の用 量相関性についてまとめられている。試験の多くは投与期間が 4 週間以下であり、 25(OH)D の半減期が 1~2 か月であることから、そのような短期間で定常状態に達する とは考えられない。しかし、ビタミンD を 20 μg/ヒト/日から 250~500 μg/ヒト/日の用 量で投与しても、血清中25(OH)D 濃度は 75~220 nmol/L の狭い範囲に維持されてい る。ビタミンD の摂取量がこの生理学的範囲を超えると、25(OH)D が用量相関的に上 昇し、毒性に関与する。明らかに、ビタミンD 関連物質の投与に対し、血清中 25(OH)D 濃度を調節することで、その作用を和らげる恒常性維持機構が存在している。このビタ ミン D の摂取の生理学的範囲は、全身を日光に当てて産生されると考えられる 250~ 625 μg/ヒト/日と同程度である。(参照 7) ビタミン D を月に 1 回数か月間投与(7,500 μg/ヒト/回)された患者では、血清中 25(OH)D 濃度が約 600 nmol/L であり、毒性がみられた。これは、25(OH)D の産生に よる明らかな恒常性維持機構の一時的な破綻に由来する毒性徴候の発現と考えられる。 ビタミンD の大量単回投与では、血清中 25(OH)D 濃度が急速に高いピークを示し、そ の後濃度は徐々に低下した。(参照7)
血清中25(OH)D 濃度が約 67 nmol/L の若い健康な男性にビタミン D3を投与(25、
250 又は 1,250 μg/ヒト/日)した。投与 8 週後に血清中 25(OH)D 濃度はそれぞれ 29、 146(100~225)及び 643(400~1,000)nmol/L 増加した。25(OH)D の反応は BMI (Body Mass Index)又は体重との関連性はなかった。BMI が高い場合、投与に対し 25(OH)D の変化は少ないと予測された。この試験における投与期間は短く、25(OH)D の定常状態に達することはできなかった。(参照7) 高齢者にビタミンD3の6 週間経口投与(50 μg/ヒト/日)試験を二重盲検法により実 施した。投与開始7 週(最終投与後)に血清中 25(OH)D 濃度は 80.1±6.7 nmol/L に達 したが、定常状態に達しなかったということを完全に否定することはできない。(参照7) ビタミンD の 2.5 か月間投与(10、25 又は 250 μg/ヒト/日)試験が実施された。10 及び25 μg/ヒト/日投与群では血清中 25(OH)D 濃度が約 55 nmol/L の定常状態に達した が、 250 μg/ヒト/日投与群では約 120~140 nmol/L に達した。しかし、この場合定常状 態には達していないと考えられ、ビタミンD の形態も不明である。(参照 7) 4 か月以上にわたりビタミン D2又はビタミンD3を毎日同量投与され、定常状態に達
した128 人の血清中25(OH)D 濃度を測定した結果、45 μg/ヒト/日投与群では全員が130 nmol/L 未満であったが、150 μg/ヒト/日投与群では大部分が 130 nmol/L 以上 200 nmol/L 未満であった。60~70 μg/ヒト/日の投与量における回帰直線の 95%信頼限界の 上限値は、25(OH)D 濃度 130 nmol/L であった。(参照 7) 健常ボランティア(33 及び 28 人/群)にビタミン D3を1~5 か月間経口投与(それぞ れ25 又は 100 μg/ヒト/日)した。投与開始 4 及び 5 か月時に 25 μg/ヒト/日投与群の平 均血清中25(OH)D 濃度は 70 nmol/L(45~120 nmol/L)であったが、100 μg/ヒト/日 投与群では100 nmol/L(65~120 nmol/L)であった。(参照 7)
健康な閉経前の女性(19 人)にビタミン D2又はビタミンD3を8 週間経口投与(100
μg/ヒト/日)した。被験者には Ca も投与(0.5 g/ヒト/日)された。最終投与後(投与開 始8週後)の血清中25(OH)D濃度はビタミンD2及びビタミンD3投与群でそれぞれ35.5
nmol/L(19.7~48.3 nmol/L)及び 45.4 nmol/L(31.0~55.4 nmol/L)であった。血清 中25(OH)D3濃度の低下がビタミンD2投与群でみられ、その結果、総25(OH)D 濃度は 投与前の状態と変化がなかった。(参照7) ⑤ ビタミンD の摂取と高 Ca 血症 高Ca 血症は、血清中 Ca 濃度が 2.75 mmol/L 以上、または血清中 Ca イオンが 1.35 mmol/L 以上と定義されている。50 μg/ヒト/日のビタミン D を 6 か月間投与した場合血 清中のCa は正常であり、健常な成人に 250 μg/ヒト/日の用量で 6 週間投与しても血清 及び尿中Ca 濃度に有意な上昇はみられなかった。1,250 μg/ヒト/日以上の投与では、血 清中Ca 濃度は 2.82~4.00 mmol/L の範囲であった。中高年の女性の骨粗しょう症の治 療にビタミンD が使用される場合について評価された。これらの女性は骨粗しょう症に 加え健康問題を抱えており、1,250 μg/ヒトの用量で週に 1 回の投与から同用量で 6 週間 から5 年間のビタミン D の投与で腎機能低下及び高 Ca 血症が伴うことが判明した。(参 照7) 結核感染者又は非感染者におけるビタミンD 投与の血清中 Ca 濃度に対する影響につ いて調べられた。被験者の食事には3 か月間にわたりビタミン D が添加(10、20、30、 60 又は 95 μg/ヒト/日)された。21~60 歳の健康な男女 30 人を結核非感染群とした。 この群では、60 μg/ヒト/日以上投与により血清中 Ca の有意な上昇がみられた。正常対 照におけるビタミンD 60 μg/ヒト/日投与後の血清中 Ca 濃度は 2.43 mmol/L から 2.62 mmol/L に上昇したが、高 Ca 血症は示さなかった。95 μg/ヒト/日の用量の投与後は、 正常対照における血清中Ca 濃度は 2.46 mmol/L から 2.83 mmol/L に上昇した。ビタミ ンD 製剤の性質、ビタミン D 摂取の背景及び血清中 25(OH)D 濃度についての情報は得 られていない。(参照7) 健康な閉経前の女性(19 人)にビタミン D2又はビタミンD3を8 週間経口投与(100 μg/ヒト/日)し、血清中ビタミン D 代謝物及び Ca 濃度について調べた。ビタミン D3
を投与(100 μg/ヒト/日)した場合、血清中 Ca 濃度はすぐに有意に上昇した(0.05 mmol/L)。尿中 Ca 排泄は僅かに増加し、Ca/クレアチニンの平均モル比は 0.518 となっ たが、Ca 尿症の 1.0 を十分に下回っていた。(参照 7) 健常ボランティア(33 及び 28 人/群)にビタミン D3を1~5 か月間経口投与(それぞ れ25 又は 100 μg/ヒト/日)した。全被験者の血清中 Ca 濃度は基準値の範囲内であり、 大きく外れた値はみられなかった。同様に、尿における Ca/クレアチニンモル比にも基 礎値から大きく外れた値はみられなかった。25 μg/ヒト/日投与群より 100 μg/ヒト/日投 与群において、Ca/クレアチニンモル比が 1.0 を超える被験者が多かった。(参照 7) ⑥ 血清中25(OH)D、血清中 Ca 及び高 Ca 血症 くる病患者では、紫外線照射による治療期間において、血清中 25(OH)D 濃度及び血 清中Ca 濃度は並行して増加する。投与により、血清中 Ca 濃度は 2.5 mmol/L を超える ことはなく、血清中25(OH)D 濃度も 125 nmol/L を超えることはなかった。また、ビタ ミンD を強化したミルクを過剰に摂取した患者では、血清中 25(OH)D 濃度及び血清中 Ca 濃度に相関性がみられた。Ca 濃度が 2.75 mmol/L 以上の Ca 血症の血清では、 25(OH)D 濃度が 200 nmol/L を超えるという特徴があった。(参照 7) 血清中Ca 濃度は正常であるが、血清中 25(OH)D 濃度が 177±41(132~222) nmol/L で高Ca 尿症であり血清中副甲状腺ホルモン(PTH)値が低い 4 人の患者の報告がある。 サプリメントとしてビタミンD を摂取し、摂取量は不明であった。サプリメントの摂取 を中止すると尿中Ca は正常となり、血清中 25(OH)D 濃度も正常(<130 nmol/L)に なった。(参照7) 8~9 月に海辺で働いたイスラエルの救助員 45 人について、同様の人数、年齢及び季 節の対照群と比較検討した。両群とも血清中Ca 濃度は同様であったが、救助員群では、 血清中PTH 値が有意に低く、血清中 25(OH)D 濃度は高く(対照群が 65±25 nmol/L に対し148±105 nmol/L)、Ca の尿中排泄率は高かった。11 人の救助員は腎結石症で あり、この発現率は通常の発生率より有意に高かった。救助員群では対照群に比べて僅 かに尿量が少なかった。(参照7) (7)対象動物等を用いた安全性試験 ① 牛 牛にビタミンD2を7 日間経口投与(750,000 μg/頭/日:1,500 μg/kg 体重/日、推奨用 量の30 倍)しても毒性影響はみられなかった。より長期間(10、21 又は 30 日間)の 投与では、剖検所見で臓器の石灰化が報告されている。これらの影響はその範囲と重篤 度で投与期間と相関性がみられた。(参照9) ② 豚 豚にビタミン D3を推奨用量の625 倍までの用量で経口投与した結果、臨床徴候(食
欲不振、多尿症)がみられた。推奨用量の25、125 又は 625 倍量の用量の投与では、副 甲状腺機能低下及び血漿中 Ca 濃度の増加が報告されている。5 倍量の投与では投与に よる影響はみられなかった。(参照9) ③ 馬 馬では、少なくとも 2 か月間の注射による投与(100,000 μg/頭/週)又は数か月間の 経口投与(5,000 μg/頭/日)による、ビタミン D の過剰症の報告がある(体重は不明)。 (参照9) 3.国際機関等における評価について (1)EFSA における評価 EFSA では、成人に対しては、高 Ca 血症がビタミン D の毒性の指標として選択され た。ヒトの2 試験で、234~275 μg/ヒト/日の摂取では高Ca 血症は発現せず、NOAEL 250 μg/ヒト/日が設定された。これらの試験の不確定要素を考慮して、妊婦及び授乳中の女 性を含む成人の許容上限摂取量(UL)は 100 μg/ヒト/日に設定された。小児及び若年層 における高用量のビタミン D の摂取のデータが不足しているものの、11~17 歳の年齢 層に対し、この年代は骨生成及び成長が迅速に行われる年齢層であり、成人と比較して ビタミンD の許容値が低いとは考えにくいことから、100 μg/ヒト/日の UL が設定され た。1~10 歳の子供にも同様の考え方が適用され、体格が小さいことを考慮し、50 μg/ ヒト/日の UL が設定された。乳児(0~12 か月齢)に対しては、高用量のビタミン D の 摂取により成長が障害され、高Ca 血症が発現するというデータが過去に得られており、 過去のリスク評価以来限定的ではあるが更なる知見も得られたため、25 μg/ヒト/日の UL が保持された。欧州 14 か国の調査におけるビタミン D の摂取のデータから、多量 に摂取するヒトにおいても、その摂取量はどの年齢層でもこれらのビタミンD の UL 未 満であることが示された。(参照21) また、家畜及び家きんの飼料中のビタミンD3含有量について評価された。欧州14 か
国における最近の栄養調査では、ビタミンD の摂取量は安全上限値(Upper Safe Limit) を十分下回ることが判明した。動物由来の食品はビタミン D3の飼料添加を含む最近の 飼育方法で生産されることを前提とした場合、現在認められている最大量のビタミンD を飼料に添加してもUL を超えないと結論付けている。(参照 22) (2)EMEA における評価 ビタミンD は体内で生合成され、通常食品として摂取される栄養要素であり、動物用 医薬品としては、個々の動物の短期的な治療のためだけに使用される。投与された動物 は治療中又は治療直後に食用に供されることは考えにくい。動物の可食部に自然に存在 するビタミンD 濃度には大きなバラツキがあり、MRL 確立のための調査は非常に困難 である。これらのことから、EMEA では MRL を設定する必要はないと結論付けた。(参 照9)
(3)その他
CRN4では、高Ca 血症を指標とした NOAEL 100 μg/ヒト/日は他の評価機関でも支持
されている値ではあるが、臨床試験で60 μg/ヒト/日摂取で副作用がなかったことからビ タミンD の Tolerable Upper Intake Level from Supplements(ULS)として 60 μg/ヒ ト/日が設定されている。(参照 23) (4)日本における評価 日本では、「日本人の食事摂取基準2010 年版」(厚生労働省)において、ビタミン D の過剰摂取による健康障害は、高Ca 血症を指標とすることが適当と考えられ、高齢者、 妊婦及び授乳婦を含む成人では50 μg/ヒト/日をULとしている。また、乳児については、 多量のビタミン D 摂取によって成長遅延が生じる危険性があることから、25 μg/ヒト/ 日のUL が設定されている。小児については、表 7 のとおり設定されている。(参照 6) 表7 小児の UL 年齢(歳) UL(μg/ヒト/日) 1~2 25 3~5 30 6~7 30 8~9 35 10~11 35 12~14 45 15~17 50 Ⅲ.食品健康影響評価 カルシフェロールは、抗くる病作用を持つ脂溶性ビタミンであり、紫外線の照射を受 けてヒトの体内でも生合成される。また、魚肉、バター、卵黄等に含まれており、通常 食品を通じて摂取されている。 カルシフェロールはしばしば、過剰投与が問題になる。しかし、通常の食事では過剰 量のカルシフェロールを摂取することはなく、補助的なサプリメントなどによる過剰摂 取によりカルシフェロール過剰症が起こる可能性が高いとされている。 EFSA では、家畜及び家きんの飼料中のコレカルシフェロールの含有量について評価 されており、現在認められている最大量のコレカルシフェロールを飼料に添加しても UL を超えないと結論付けている。また、EFSA では、各年齢層における UL は、高 Ca 血症をカルシフェロールの毒性の指標として設定されているが、欧州 14 か国の調査に おけるカルシフェロールの摂取のデータから、多量に摂取するヒトにおいても、その摂 取量はどの年齢層でもUL 未満であることが示されている。 EMEA では、動物用医薬品としては短期的な治療のためだけに使用され、投与された
4 Council for Responsible Nutrition:米国に本拠を置く、栄養補助食品製造企業と原材料供給企業の代
表者で構成される民間団体
動物が治療中又は治療直後に食用に供されることは考えにくく、MRL を設定する必要 はないとされている。 さらに、カルシフェロールは我が国における飼料添加物、食品添加物等、様々な分野 で使用されており、その使用実績においてもこれまでに安全性に関する特段の問題は認 められていない。 これらのことから、食品を介してヒトがカルシフェロールを過剰に摂取することはな いと考えられる。また、カルシフェロールを含む食品について、長年の食習慣における 弊害も認められていない。 25-ヒドロキシコレカルシフェロールは、コレカルシフェロールの代謝物であり、その 毒性についてはカルシフェロールより強いとは考えられない。また、食品を介してヒト が25-ヒドロキシコレカルシフェロールを過剰に摂取することはないと考えられる。 以上のことから、カルシフェロール及び 25-ヒドロキシコレカルシフェロールは、動 物用医薬品及び飼料添加物として通常使用される限りにおいて、食品に残留することに より人の健康を損なうおそれのないことが明らかであるものであると考えられる。
〈別紙1:ビタミン D 関連物質略称〉 略 称 物 質 名 ビタミンD カルシフェロール ビタミンD2 エルゴカルシフェロール ビタミンD3 コレカルシフェロール ビタミンD4 22,23-ジヒドロエルゴステロール ビタミンD5 7-デヒドロシトステロール 25(OH)D 25-ヒドロキシカルシフェロール 25(OH)D3 25-ヒドロキシコレカルシフェロール(カルシフェジオール) 24,25(OH) 2D 24,25-ジヒドロキシカルシフェロール 1α,25(OH) 2D 1α,25-ジヒドロキシカルシフェロール 1α,25(OH)2D3 1α,25-ジヒドロキシコレカルシフェロール(カルシトリオール) 〈別紙2:検査値等略称〉 略称等 名称 EFSA 欧州食品安全機関 EMEA 欧州医薬品審査庁 LD50 半数致死量 MRL 最大残留基準値 NOAEL 無毒性量 PTH 副甲状腺ホルモン
〈参照〉
1. 食品衛生法第11条第3項の規定により人の健康を損なうおそれのないことが明らかで あるものとして厚生労働大臣が定める物質を定める件(平成 17 年厚生労働省告示第 498 号)
2. The Merck Index, 14th Edition, 2006
3. 岩波 生物学辞典 第 4 版、八杉龍一. 小関治男.古谷雅樹及び日高敏隆、岩波書店、 2002
4. 南山堂 医学大辞典、鈴木肇、南山堂、 2004
5. ビタミン総合事典、日本ビタミン学会、朝倉書店、2011 6. 厚生労働省、日本人の食事摂取基準 [2010 年版]、2010
7. EFSA: “Opinion of the scientific committee on food on the tolerable upper intake of vitamin D”, Tolerable upper intake levels for vitamins and minerals, Scientific Committee on Food, Scientific Panel on Dietetic Products, Nutrition and Allergies. 2006
8. 食品添加物公定書解説書 第 8 版、谷村顕雄及び棚元憲一、廣川書店、2007
9. EMEA: COMMITTEE FOR VETERINARY MEDICINAL PRODUCTS, VITAMIN D, SUMMARY REPORT. 1998
10. A.Bar, M.Sharvit, D.Noff, S.Edelstein and S.Hurwitz: Absorption and excretion of cholecalciferol and of 25-hydroxycholecalciferol and metabolites in birds, J. Nutr. .1980; 110: 1930-1934
11. Torelance evaluation of 25-hydroxycholecalciferol in weaner piglets(非公表)
12. Evaluation of the effects of the long term dietary supplementation with 25-hydroxycholecalciferol on the zootecnical performance and on the tissue concentration of 25-hydroxycholecalciferol on the pig(非公表)
13. Target animals safety/toxicity of ISOGEN’S HyD in laying hens fed mash feed without medication(非公表)
14. Effects of supplementation with vitamin D3 and 25-hydroxycholecalciferol on the
growth performance, bone characteristics and tissue concentrations of 25-hydroxycholecalciferol(非公表)
15. Chromosome aberration test in human lymphocytes in vitro with calcifediol(非公 表)
16. 25-hydroxycholecalciferol, Acute LD50 studies in rat and mouse(非公表)
17. Calcifediol, Acute oral toxicity study in rats(非公表)
18. 25-hydroxycholecalciferol, Six months oral toxicity in rats(非公表) 19. 25-hydroxycholecalciferol, Reproduction studies(非公表)
20. Supplement on 25-hydroxycholecalciferol safety(非公表)
21. EFSA: Scientific opinion on the tolerable upper intake levels of vitamin D. EFSA panel on dietetic products, Nutrition and allergies(NDA). EFSA Journal 2012; 10(7):2813
22. EFSA: Scientific opinion on the safety and efficacy of vitamin D3(cholecalciferol) as
a feed additive for pigs, piglets, bovines, ovines, calves, equines chickens for fattening turkeys, other poultry, fish and other animal species or categories, based on a dossier submitted by Fermenta Biotech Ltd. EFSA panel on additives and products or substances used in animal feed(FEEDAP). EFSA Journal 2013; 11(7):3289
23. CRN : J.N.Hathcock,Ph D .Summary of vitamin D. Vitamin and Mineral Safety 2nd Edition,Council for Responsible Nutrition,2004
24. K. Mortelmans, S. Haworth, T. Lawlor, W. Speck, B. Tainer and E. Zeiger: Salmonella Mutagenicity Tests: II. Results From the Testing of 270 Chemicals, Environmental Mutagenesis. 1986; Vol. 8, Supplement 7: 1-119