熊本大学学術リポジトリ
Kumamoto University Repository System
Title プロスタシンによるアルドステロン産生誘導の検証
Author(s) , 健博
Citation
Issue date 2009-03-25
Type Thesis or Dissertation
URL http://hdl.handle.net/2298/16750 Right
学 位 論 文
Doctoral Thesis
プロスタシンによるアルドステロン産生誘導の検証
(Verification of adrenal aldosterone production regulated by serine protease prostasin)
閌 健博 Takehiro Ko
熊本大学大学院医学教育部博士課程臨床医科学専攻腎臓内科学
指導教員
冨田
公夫 教授
熊本大学大学院医学教育部博士課程医学専攻腎臓内科学学
位
論
文
Doctoral Thesis
論文題名 : プロスタシンによるアルドステロン産生誘導の検証
Verification of adrenal aldosterone production regulated by serine protease
( ) prostasin 著 者 名 : 閌 健博 Takehiro Ko 指導教員名 : 熊本大学大学院医学教育部博士課程医学専攻腎臓内科学 冨田 公夫 審査委員名 : 代謝内科学担当教授 荒木 栄一 循環器病態学担当教授 小川 久雄 生体機能薬理学担当教授 光山 勝慶 2009年3月
目次 2 要旨 4 学位論文の骨格となる参考論文 5 謝辞 6 略語一覧 7 研究の背景と目的 14 実験方法 21 実験結果 31 考察 36 結語 37 参考文献
要旨 上皮型Naチャネル(ENaC)は糸球体で濾過されたNaの最終的な排泄量を調節 する重要なチャネルである。プロスタシンは ENaC を活性化する重要な調節因 子である。これまでの研究によりプロスタシンが生体において高血圧、Na代謝 に関与している可能性が示唆されている。プロスタシンを中心とした Na 再吸 収、血圧調節の分子基盤が解明されれば新規作用機序による降圧薬や利尿薬の 開発につながる可能性がある。アルドステロンは副腎皮質球状層において、デ オキシコルチコステロンを基質としてアルドステロン合成酵素によって合成さ れる アルドステロンは腎遠位尿細管のミネラルコルチコイド受容体。 (MR)に 作用して ENaC を活性化し、Na や水を体内に維持する作用が知られている ア。 デノウイルスを用いてヒトプロスタシンをラットに過剰発現させると高血圧が 発症し、さらには血漿アルドステロン濃度が上昇することが報告されている。 そこで副腎に対するプロスタシンの生理的役割を解明するために、ヒトプロス タシン cDNAアデノウイルス(Ad-hPRSS8)、組換え活性型プロスタシン蛋白お H295R よび組換え非活性型プロスタシンを作成し、ヒト副腎皮質腺腫細胞( )でのアルドステロン産生に与える影響について検討した。 cells 活性型プロスタシンをH295R cellsに作用させ アルドステロン合成酵素遺伝、
子(CYP11B2)プロモーター活性をluciferase assayで、CYP11B2 mRNA発現量
をreal time PCRで、培養上清中のアルドステロン分泌量をEIAで測定した。非
活性型プロスタシンでも同様に測定した。またAd-hPRSS8をH295R cellsに感
染させ、CYP11B2 mRNA発現量を測定した 結果として活性型プロスタシンは。
の プロモーター活性 の発現およびアル
H295R cells CYP11B2 、CYP11B2 mRNA
ドステロン分泌量を増加させることが判明した。Ad-hPRSS8 を用いプロスタシ
いてのH295R cellsのProtease-activated receptor(PAR)ノックダウンでは 活性、 型プロスタシンによるCYP11B2発現量の増加を抑制しないことがわかった 蛋。 白分解酵素阻害薬であるcamostat mesilateを共に投与した場合や 非活性型プロ、 スタシンを作用させた場合も同様に CYP11B2 発現量およびアルドステロン分 T /L protein 泌量が増加することを確認した。 型 型 カルシウムチャネル拮抗薬と 阻害薬は 活性型プロスタシンによるアルドステロン分泌量を kinase C(PKC) 、 抑制することがわかった。 これらの成績より副腎皮質においてプロスタシンによるアルドステロンの産 生誘導の可能性が示唆された。このアルドステロン産生誘導のメカニズムの一 部にカルシウムチャネルおよびPKCが関与することが示唆された。また、プロ スタシンによるアルドステロン産生誘導は、プロスタシンの蛋白分解作用を介 さない可能性が考えられた。細胞外に存在するプロスタシンを感受するメカニ ズムが副腎皮質細胞膜表面に存在する可能性が考えられた。 プロスタシンは ENaC 活性を調整する因子であるが、循環血液中のプロスタ シンの新たな役割が存在する可能性がある。今後、プロスタシンが作用する未 知の分子を特定することにより、Na 代謝異常や高血圧症に対する新たな治療薬 の開発につながる可能性がある。
学位論文の骨格となる参考論文
①関連文献
1. Takehiro Ko, Yutaka Kakizoe, Naoki Wakida, Manabu Hayata, Kohei Uchimura, Naoki Shiraishi, Taku Miyoshi, Masataka Adachi, Shizuka Aritomi,
Tomoyuki Konda, Kimio Tomita and Kenichiro Kitamura.
Regulation of adrenal aldosterone production by serine protease prostasin . in press.
Journal of Biomedicine and Biotechnology
②その他の文献リスト
1. Yutaka Kakizoe, Kenichiro Kitamura, Takehiro Ko, Naoki Wakida, Ai Maekawa, Taku Miyoshi, Naoki Shiraishi, Masataka Adachi, Zheng Zhang, Shyama Masilamani and Kimio Tomita.
Aberrant ENaC activation in Dahl salt-sensitive rats. 27: 1679-89, 2009.
J. Hypertens.
2. Ai Maekawa, Yutaka Kakizoe, Taku Miyoshi, Naoki Wakida, , Naoki Shiraishi, Masataka Adachi, Kimio Tomita Takehiro Ko
and Kenichiro Kitamura.
Camostat mesilate inhibits prostasin activity and reduces blood pressure and renal injury in salt-sensitive hypertension.
27: 181-9, 2009. J. Hypertension.
3. N Wakida, K Kitamura, DG Tuyen, A Maekawa, T Miyoshi,
M Adachi, N Shiraishi, T Ko, V Ha, H Nonoguchi and K Tomita. Inhibition of prostasin-induced ENaC activities by PN-1 and regulation of PN-1 expression by TGF-β 1 and aldosterone.
70: 1432-8, 2006. Kidney. Int.
謝辞 本研究を遂行するにあたり、御指導、御支援頂きました当研究室の冨田公夫教 授、北村健一郎博士、ならびに腎臓内科学講座の皆様に厚くご御礼申し上げま promoter-luciferase M. す。また、hCYP11B2 コンストラクトをご提供頂きました 博士と 博士に感謝いたします。 H. Bassett W. E. Rainey
略語一覧
ENaC epithelial sodium channel
GPI glycosylphosphatidylinositol
H295R human adrenocortical calcinoma cell
CYP11B2 cytochrome P450, family 11, subfamily B, polypeptide 2
PAR protease-activated receptor
PCR polymerase chain reaction
siRNA short interfering RNA
SDS sodium dodecyl sulfate
QAR-MCA N-t-Boc-Gln-Ala-Arg-7-amido-4-methyl coumarin
BCA bicinchoninic acid protein
PKC protein kinase C
Ad adenovirus
CMV cytomegalovirus
Luc luciferase
研究の背景と目的 腎臓は生体のNa調節において重要な役割を果たしている。腎臓でのNa再吸収 には①近位尿細管における各物質との共輸送系、②ヘンレの太い上行脚におけ るNa/K/2Cl共輸送系、③遠位尿細管にけるNa/Cl 共輸送系、④集合尿細管にお けるNaチャネルなどがある(figure 1)。これらの輸送系のなかで高血圧との関 連が示唆されているのは集合尿細管におけるNaチャネルであり、このNaチャ ネルは上皮型 Na チャネル(以下 ENaC)と呼ばれ糸球体でろ過されたNa の最 終的な再吸収量を調節するチャネルである。 Figure 1 腎臓におけるNa再吸収の模式図および集合尿細管の拡大図 1:近位尿細管における各物質との共輸送系
2:ヘンレの太い上行脚におけるNa/K/2Cl共輸送系
3:遠位尿細管におけるNa/Cl共輸送系
4:集合尿細管におけるNaチャネル
は 年および 年に らによってラット大腸 ライ
ENaC 1993 1994 Canessa cDNA
ブラリーよりクローニングされ、腎臓皮質集合尿細管、下行結腸、外分泌腺、 気道でのNa再吸収を制御している重要なイオンチャネルである(1-3)。腎皮質集 合尿細管において 尿細管腔側の、 NaはENaCを介して細胞内に輸送され その、 後Na-K-ATPaseによって血管側に汲み出される この経上皮。 Na輸送の律速段階 はENaCによる管腔側からのNa再吸収のステップであるため、ENaC の活性が そのままこの部位での Na 再吸収量を決定し、血圧をコントロールしている。 は相同性のある の つのサブユニットから構成され 各サブユニ ENaC 、 、 3 、 ットは約640 ~ 700 のアミノ酸残基からなる細胞外に大きなループを持つ 2回 、 。 、 膜貫通型の蛋白質であり N末端とC末端領域は細胞内に存在している 現在 の サブユニットは : : の構成比で 量体を形成して機能して ENaC 、 、 1 1 1 3 いると考えられている。ENaCはサブユニット単独でも弱いチャネル機能を示 すが、 、 サブユニットとともに多量体を形成するとそのチャネル機能は著し く増加する。このことより 、 サブユニットは調節的な役割をもっていると考 Ki < 0.5 えられている。このチャネルは低濃度のアミロライドにより抑制され( に対し高選択性をもち チャネルコンダクタンスは小さ M)、Na (P /P > 10Na K )、 く(4~5 pS)、ゆっくりとした開閉機構 平均開口時間( 2~ 秒 を持ち 半5 ) 、 減期が約1 時間と短い。遺伝性食塩感受性高血圧症の1 つであるLiddle症候群 において腎皮質集合管に存在する ENaC の活性変異体が発見されたことから腎 臓における Na 再吸収と高血圧症との間に強い因果関係が存在することが示唆
されている(4-6)。 プロスタシンは1994年にJulie Chaoのグループがヒト精液より精製した分子 量40 kDaのセリンプロテアーゼである(7)。プロスタシンはpI 4.5~4.8で、ト C リプシン様の酵素活性をもち 合成基質をもちいた検討ではアルギニン残基の、 。 、 末端を選択的に切断することが判明している 酵素活性の至適pHは9.0付近で アプロチニン、ベンザミジン、アンチパイン、ロイペプシンなどにより活性は 阻害される。組織分布は前立腺、腎臓、大腸、肺、胃、皮膚、膵臓、肝臓、唾 液腺 卵巣などに発現が認められる、 (8)。1995年にヒトプロスタシンのcDNAが
ク ロ ー ニ ン グ さ れ 、light chain お よ び heavy chain か ら 構 成 さ れ る
( ) 。
glycosylphosphatidylinositol GPI -anchored proteinであることが判明した(8;9)
また ヒトではプロスタシン遺伝子は第、 16番染色体に(16p11.2)マップされる 。 (10) プロスタシンは ENaC が発現する集合尿細管に強い発現を認め、さらに近位 尿細管にも強い発現を認めている。私たちの研究グループはアフリカツメガエ ル卵母細胞にプロスタシンと ENaC を共発現させたところアミロライド感受性 ナトリウム電流が約2~3倍に増加することを報告した(11)。そしてこの活性化の 現象はセリンプロテアーゼ阻害剤であるアプロチニンを前投与することで完全 に抑制された。このことはプロスタシンのセリンプロテアーゼとしての作用が の活性化に関与していることを示唆するものである。 活性化のメカ ENaC ENaC ニズムとして私たちの共同研究者であるKleyman らはプロスタシンが ENaC γ サブユニットの細胞外ループの186番目を切断し、さらにfurinがENaCγサブ ユニットの細胞外ループの 143 番目を切断することによって 43 アミノ酸から 構成されるインヒビトリードメインを切り出し、開口確率を増加させると報告 している(figure 2)(12)。
プロスタシンと による の活性化
Figure 2 furin ENaC
プロスタシンはGPI-anchor freeの形態で循環血液中に存在することも確認さ
れているが、生理学的な役割は依然不明である。アデノウイルスを用いてヒト プロスタシンをラットに過剰発現させると高血圧が発症し、さらには血漿アル
. Plasma aldosterone levels ( ) and plasma renin activity (PRA; ) of
Figure 3 A B
Wistar rats receiving adenoviral vectors Ad.CMV-hPRS or Ad.CMV-Luc at 3 and
14 days post gene delivery. Data are expressed as means _ SE (n _ 6). *P _ 0.05,
et al. Am.J.Physiol
Ad.CMV-hPRS vs. Ad.CMV-Luc group. Wang, C., , , 2003(13) Regul.Integr.Comp Physiol. 私たちの研究グループはSprague-Dawley ラットにアルドステロンを投与し たところ尿中プロスタシン量が約 4 倍に増加し、原発性アルドステロン症患者 に副腎摘出術を施行したところ尿中プロスタシン量が減少することを報告した また尿中プロスタシン量と尿中および血漿アルドステロン濃度が相関する (14)。 ことを報告した(15)。これらの知見はプロスタシンが食塩感受性高血圧症の発症 に強く関与していること、さらにはプロスタシンがアルドステロンの分泌調節 においてポジティブフィードバック作用を有することを示唆するものである。
Figure 4
Correlation between urinary prostasin and plasma aldosterone levels in Koda, A., , hypertensive patients. Correlation coefficient is 0.229 (P < 0.05). et al.
。 Hypertens Res, 2009(15) 副腎皮質は鉱質コルチコイドであるアルドステロンと糖質コルチコイドであ る コ ル チ ゾ ー ル を 産 生 す る 重 要 な 部 位 で あ る 。 ア ル ド ス テ ロ ン 合 成 酵 素 (CYP11B2)は副腎皮質球状層においてのみ発現しており、デオキシコルチコ ステロンを基質としてアルドステロンへ変換される(16-19)。アルドステロン分
泌を亢進させる2 つの刺激因子はアンジオテンシン II と細胞外カリウムイオン であり(20)、これら つの因子は細胞内カルシウムイオン濃度の上昇を介してア2 ルドステロン分泌を亢進させる。また、ラットの副腎組織において、トリプシ ンなどの蛋白分解酵素が直接アルドステロン分泌を亢進させることが報告され ている(21-23)。しかしながら副腎皮質におけるトリプシンによるアルドステロ protease-activated receptor-1 ン 産 生 亢 進 の 分 子 機 構 は 依 然 不 明 な 点 が あ り 、 (PAR-1)が関与している可能性が示唆されている(24)。 これまでの研究によりプロスタシンが生体において高血圧、Na代謝に関与し ていることが想定され、セリンプロテアーゼの 1 種であるプロスタシンが副腎 においてアルドステロン産生を亢進している可能性がある。プロスタシンはプ ロスタシン・アルドステロン系といった新たな経路を介して、アルドステロン と相乗的に高血圧発症に関与している可能性がある。従って生体内でプロスタ シンを抑制することが可能となれば、食塩感受性高血圧の治療戦略の一つとな 、 。 り 新規作用機序による降圧薬や利尿薬の開発につながる可能性が示唆される このような背景のもと 私たちはプロスタシンを中心とした、 Naの再吸収 血、 圧調整の分子基盤を解明するために研究を行ってきた。今回、私たちは副腎皮 質腺腫細胞(H295R cells)におけるプロスタシンのアルドステロン産生誘導お よび産生誘導メカニズムについて検討した。
実験方法
1.活性型および非活性型組換えヒトプロスタシンの作成
1)組換えヒトプロスタシンの作成
cDNA C GeneTailor Site-Directed Mutagenesis
ヒトプロスタシンの の 末端に
を使用して を付加した 。
System (Invitorogen) His tag (His 6) (prostasin His)
の と の間にエンテロキナーゼ切断部位
Prostasin His light chain heavy chain
Asp-Asp-Asp-Asp-Lys GeneTailor Site-Directed Mutagenesis System
( ) を
を使用して挿入した 。また蛋白分解酵素非活性型
(Invitorogen) (prostasin EK His)
の変異プロスタシンを作成するためにプロスタシンの活性中心の 3 か所である
His85、Asp134、Ser238 の 全 て を QuikChange Site-Directed Mutagenesis Kig
を使用して に置換した。これらの を片倉工業に送り、バ
(Stratagene) Ala cDNA
キュロウイルスに組込み、カイコに感染させ、カイコより組換えヒトプロスタ Ni Sepharose High Performance シンを作成するよう依頼した。カイコ体液を
により 次精製した。 次精製 column (HisTrap HP: GE Healthcare Bio-sciences) 1 1
16 Ion Exchange column (HiTrap Q :
後 時間透析を行い、バッファーを交換し、
で 次精製した。 次精製後 時間透析を行って脱
GE Healthcare Bio-sciences) 2 2 16
gel filtration column (Superdex 200 10/300 GL : GE Healthcare 塩を行い、
。 。
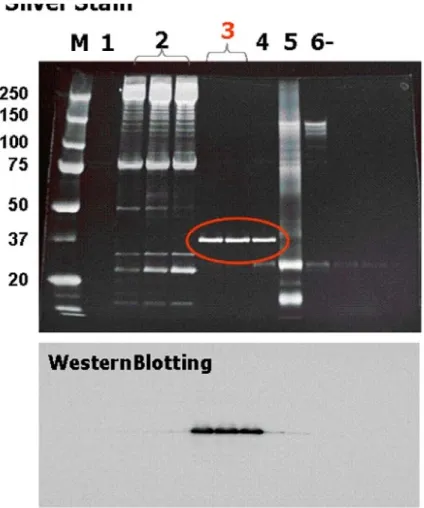
Figure 5 組換えヒトプロスタシンの精製 上:銀染色、 下:ウエスタンブロッティング 1、 、 、 、 、 :2 3 4 5 6 fruction number 2)組換えヒトプロスタシンの活性化 1)で精製した組換えヒトプロスタシン50 g に対してEK Max (Invitrogen)の エンテロキナーゼを0.1unit 加え、37℃で16時間インキュベートした。16時間
0.1unit anti-enterokinase agarose (Enterokinase
後 のエンテロキナーゼに対して
: を μ 加え 分間ロータリーミキサーでインキ
removal kit Sigma-Aldrich) 10 L 、45
N-t-Boc-Gln-Ala-Arg-7-amido-4-methyl coumarin 酵 素 活 性 は 合 成 基 質 で あ る
QAR-MCA Peptide Institute 1
( )( )を使用し測定した 組換えヒトプロスタシンの。
μ をg QAR-MCA 反応液(50 mM Tris-HCl pH 7.6、1mM QAR-MCA)で反応さ 0 5 10 15 20 25 30 excitation 360 nm emission 465 nm
せた 反応後。 、 、 、 、 、 、 分ごとに 、
の条件でfluorescent microplate reader SPECTRAFluor PLUS; Tecan, Zurich( )を使 用し測定した。各時間の測定値をプロットし、傾きから活性を算出した。
2.H295R細胞の培養
H295R細胞はthe American Type Culture Collectionより購入した。DMEM/F12 (Invitrogen)に NuSerum(BD Biosciences)を2.5% に、ITS(BS Biosciences)
1% H295R 37
を になるよう混和した培養液を用いた。 細胞は上記の培地を用い、
℃、95% air/5% CO2のもとで培養した。3 x 10 cells/well5 を12-well プレートに 播種し 細胞が、 80%コンフルエントになった後に0.2% Nuserum 1% ITS、 を含む に置換し 時間培養後に行った。 時間後に組換えプロスタシン DMEM/F12 24 24 と各種薬剤を投与した。細胞は 、 、3 6 12、24 時間培養後に細胞より RNA 分離 を施行し、48 時間培養後の培養液をアルドステロン分析に用いた。本研究では の の 細胞を用いた。 12~18 passage H295R
Luciferase reporter assay 3.
promoter-luciferase pB2 1521 M. H.
Bassett博士とW. E. Rainey博士(University of Texas Southwestern Medical Center)より提供して頂いた(26)。H295R細胞を4.5 x 10 cells/well5 にて12-well
50% FuGENE6
プレートに播種し、細胞が コンフルエントになった後に
transfection reagent Roche Applied Science( )を用い、0.3 pmol の pB2-hCYP11B2 と 3.8 fmol のpRL-TK(Promega)をコトランスフェクトさせた リポーター活。 性を測定するためにpB2-1521よりのfirefly luciferase activityを、pRL-TKよりの
を ( )を用い、
Renilla luciferese activity Dual-Luciferase Assay System Promega
( )にて測定した。
luminometer model TD-20/20, Turner Design
4.アルドステロン測定
アルドステロン測定は細胞培養液200µlよりアセトンを用い蛋白を抽出し 窒素、
Aldosterone Express EIA Kit Cayman chemical .
ガスにて乾燥固化後、 ( )を用いて
測定した アルドステロン測定値は。 bicinchoninic acid protein BCA( )にて補正し た。BCAはbicinchoninic assay kit(Pierce)を用い測定した。
5.Real-time PCR 解析
1)Total RNAの回収
12-well plate H295R RNeasy Mini kit
各実験において、 に培養した 細胞から
Real time PCR 2)
H295R細胞から抽出した 500ng のtotal RNAをQuantiTect Reverse Transcription
( )を使用して逆転写を行った。ヒト 、 、 、
Kit QIAGEN CYP11B2 PAR-1 PAR-2
GAPDH の TaqMan プローブは Applied Biosystems 社から購入した。Real-time
は ( )を使用
PCR LightCycler 480 Real-Time PCR System Roche Applied Science
した。Real time PCRによって得られた各々のCt値をGAPDHのCt値で補正し
(Ct - Ct ) GAPDH Ct
た gene of interest GAPDH 。各サンプルの発現量の変化は で補正した
との差(Ctsample - Ctcalibrator)より算出した(Ct法 。)
6.アデノウイルスの構造および感染方法
ヒトプロスタシン cDNA をサイトメガロウイルスプロモーター エンハンサー/
Ad-hPRSS8 Transpose-Ad system
下流に組み込んだアデノウイルスベクター( )を (Qbiogene)を用い作成した。コントロールウイルスとして、LacZ 遺伝子を サイトメガロウイルスプロモーター エンハンサー下流に組み込んだアデノウイ/ ルスを使用した。全てのウイルスはtranscomplemental 293細胞にて増殖し、セ シ ウムクロライド勾配超遠心法にて精製、濃縮を行った。3 x 10 cells/well5 にて
12-well plateにH295R細胞を播種し 培養液は、 DMEM/F12に2.5% Nuserum 1%、 ITSになるよう混和したものを使用した。播種 日後に3 6 x 10 plaque-forming5
のウイルス量を 中で 時間感染させ 時間後
units/well serum-free DMEM/F12 1 、1
を含む に培養液を交換し、交換後 時間培養を継
0.2% Nuserum DMEM/F12 47
ステロン測定のため回収し 細胞を、 CYP11B2 mRNA発現量確認目的にて回収し た。
7.siRNAを用いたPAR-1、PAR-2のノックダウン
ヒトPAR-1 siRNA(Silencer Select Validated siRNA, ID: s4926, Ambion)または
を を使
PAR-2 siRNA(ID: s4926, Ambion) Lipofectamine RNAiMax(Invitrogen)
用して H295R細胞にトランスフェクションした 比較対照群にはコントロール。
をトランスフェクションした トランスフェクシ
siRNA ID: 4390843, Ambion( ) 。
ョン48時間後に0.2% NuserumのDMEM/F12に交換するとともに 組換えプロ、 スタシンを投与した。24時間後に細胞よりtotal RNAを抽出した。ノックダウ ン効率はreal time PCRにて確認した。 8.蛋白質抽出、イムノブロッティング 48 H295R 200µl Microcon アデノウイルスを 時間感染させた 細胞の培養液 を ( )にて濃縮し、サンプルとした。
YM-10 (10K) Centrifugal Filter Unit Millipore
蛋白質は12%SDS-polyacrylamide gelで分離し、ニトロセルロースメンブレン
にトランスファーした。50mg/mLのskim milkで ℃、4 16時間ブロッキングし
Can get signal solution TOYOBO 1 monoclonal
た後、 Ⅰ( )溶液中で 次抗体(
antibody against prostasin; BD Biosciences)を 時間反応させた 続いて1 。 、Can get signal solutionⅡ(TOYOBO)溶液中で 次抗体(2 goat anti-mouse IgG-conjugated
with horseradish peroxidase)を反応させた。その後、Chemiluminescence substrate (ECL; Amersham Pharmacia Biotech)で発光させ、x-ray filmに感光させた(27)。
結果 細胞における 発現およびアルドステロン産生におけるプロス H295R CYP11B2 タシンの効果 遺伝子の転写活性におけるプロスタシンの効果を確認するために、 CYP11B2 細胞に をトランスフェクトし、組換えプロスタシンを 時間 H295R pB2-1521 24 作用させた。Figure 6A に示すように 400µg/ml のプロスタシンはCYP11B2転写 活性を約 1.6 倍と有意に増加した。次に私たちは H295R 細胞の内因性の 、 、 、 。 CYP11B2 mRNA発現量を 50 100 400µg/mlのプロスタシン濃度で観察した に示すように、プロスタシンによる 発現亢進には から Figure 6B CYP11B2 100 にかけて濃度依存性があった。次に私たちはプロスタシンによる 400µg/ml 発現亢進の時間依存性を検討した のプロスタシンを CYP11B2 mRNA 。100µg/ml 、 、 、 、 。 細胞に 3 6 24時間作用させ CYP11B2 発現量をreal-time PCRで分析した Figure 6C に示すように6 から 24時間にかけてプロスタシンによるCYP11B2 発現亢進を有意に認めた さらに。 100 または 400µg/mlのプロスタシンを細胞に 時間作用させ 培養液中のアルドステロン含有量を測定した に示 48 、 。Figure 6D すように、濃度依存的にプロスタシンはH295R 細胞におけるアルドステロン産 生を亢進させた。
200 150 £3 11 100 5 60 2.0 1.5 10 5 0.5 Vehicle Prostasin
400 iig/mL Prostasin (ug/mL)60 100 400
I O. k. 2.0 1.5 1.0 £ 0.5 3 6 24 Incubation time (h) 100 Prostasin (Mfl/mL) 400 Figure 6
Effect of prostasin on CYP11B2 expression and aldosterone production
(A) Effect of prostasin on human CYP11B2 promoter activity in H295R cells. Cells were transfected with human CYP11B2 promoter-luciferase construct (pB2-1521) for 24 h and then treated with vehicle or prostasin for another 24 h.
(B) Dose-dependent effect of prostasin on CYP11B2 mRNA expression in H295R cells. Cells were treated with increasing doses of prostasin for 24 h.
(C) Time course of CYP11B2 mRNA induction by prostasin in H295R cells. Cells were treated with lOOug/mL of prostasin for 0, 3, 6, and 24 h.
(D) Dose-dependent effect of prostasin on aldosterone production in H295R cells. Cells were treated with increasing concentrations of prostasin for 48 h. Values are means ± SD (n = 6). *P < 0.05, t P <0.01, and *P < 0.001.
細胞におけるアデノウイルスを用いたプロスタシン遺伝子導入による H295R 発現に対する影響 CYP11B2 細胞は内因性のプロスタシンを少量産生することが知られており、 H295R 発現に対するプロスタシンの効果を確認するため、ヒトプロスタシン CYP11B2 ( ) 。 cDNAを組み込んだアデノウイルス Ad-hPRSS8 をH295R細胞に感染させた コントロールウイルスとして、LacZ cDNA を組み込んだアデノウイルス
(Ad-LacZ)を使用した。Figure 7A および7B に示すように、Ad-hPRSS8を感
染させた細胞ではAd-LacZを感染させた細胞に比べ、CYP11B2の発現が 3.5倍 2.1 Figure と有意に増加し、またアルドステロン産生量も 倍と有意に増加した。 、 。 7C に示すように プロスタシン蛋白の発現をウエスタンブロットにて確認した 発現増加とアルドステロン産生増加の程度は、アデノウイルス感染と CYP11B2 組換え蛋白投与で同程度であった。しかし、組換えプロスタシンを投与した場 合は、アデノウイルス感染に比べ、明らかに大量のプロスタシンが細胞に作用 している。この差異は、アデノウイルス―哺乳類細胞系による蛋白産生とバキ ュロウイルス―昆虫細胞系による蛋白産生との間に生じる、プロスタシン蛋白 の性質および生物学的効果の差異に起因するものと考えられる。
y 40 _3 3.5 g3 3.0 gg 2.5 S 2 2.0 B O c 1.0 — 0 •
H
J *1
fi 1000 800 600 400 ? 200Ad-LacZ Ad-hPRSS8 Vehicle Prostasin
400|jg/mL
Ad-LacZ Ad-hPRSSa Vehicle Prostasin 400|jg/mL 45kDa Prostaisn 30 kDa iliiiililliill ^^8^^^^^ Ad-LacZ Ad-hPRSSa Figure 7
Adenovirus-mediated gene-transfer of prostasin in H295R cells markedly
enhanced the expression of CYP11B2 mRNA and aldosterone production.
Effect of adenovirus-mediated over-expression of prostasin on CYPl 1B2 expression
(A) and aldosterone production (B) in H295R cells. Cells were infected with 6 x 105 pfu of control virus (Ad-LacZ) or adenovirus carrying human prostasin (Ad-hPRSS8) for 1 h. Forty eight hours after infection, total RNA was isolated for the real time PCR and the medium was collected for the aldosterone measurement. mRNA
expression of CYP11B2 was determined by the real time PCR. Immunoblottings (C)
of prostasin expressed in H295R cells. Two hundred microliters of culture medium
were concentrated and subjected to SDS-PAGE. The blot shown is a representative
of 3 separate experiments. Values are means ± SD (/? = 6). *P < 0.001 vs. Ad-LacZ
プロスタシンによる CYP11B2 発現亢進に対する protease-activated 受容体 (PAR)ノックダウンの効果 ラット副腎皮質において トリプシンは、 PAR-1 を活性化させることによりアル ドステロン産生を増加させることがすでに報告されている(21-24;28)。今回私た ちはプロスタシンによるCYP11B2 発現亢進においてのPARの関連性を検証し た。 私たちは H295R 細胞に PAR-1 と PAR-2 が発現していることを確認したため、 と の発現をそれぞれに特異的な を用いノックダウンし、
PAR-1 PAR-2 siRNA
のプロスタシンを細胞に 時間作用させた。ノックダウン効率は
400µg/ml 24
レベルにおいて約 であった。 に示すように、 および
mRNA 90% Figure 8 PAR-1
のノックダウンは プロスタシンによる 発現亢進を抑制しなか
PAR-2 、 CYP11B2
った。この結果より、PAR シグナリングはプロスタシンによるアルドステロン
01
73
is
i
OsiRNA control control PAR-1 PAR-2
Vehicle Prostasin 400 pg/m L
Figure 8
Effect of protease-activated receptors (PAR) gene silencing on prostasin-induced CYP11B2 expression in H295R cells
Effect of PAR-1 or PAR-2 knock down on prostasin-induced CYP11B2 expression in H295R cells. Cells were transfected with siRNA for either PAR-1 or PAR-2 for 48 h and then treated with prostasin for another 24 h. mRNA expression of CYP11B2 was determined by the real time PCR. Values are means ± SD (w = 6). *P < 0.001 vs. vehicle.
プロスタシンによる CYP11B2 発現亢進およびアルドステロン産生におけるプ ロスタシンの蛋白分解酵素活性の必要性についての検討 プロスタシンの持つ蛋白分解酵素活性がアルドステロン産生亢進に必要である かを確認するために、H295R細胞に400µg/ml のプロスタシンと、in vitroにてプ ロスタシン阻害薬であることが確認されているメシル酸カモスタット(25;29)を 投与した のメシル酸カモスタットは でプロスタシン活性 100µM 。100µM in vitro (400µg/ml)を98.3 ± 0.8% とほぼ完全に抑制した。Figure 9A、9Bに示すよう に メシル酸カモスタットは、 CYP11B2発現およびアルドステロン産生にまった く影響を及ぼさなかった。これらの結果を確証するために、私たちは蛋白分解 酵素非活性型の変異プロスタシンを作成し、変異プロスタシンのアルドステロ ン産生に対する効果を検証した。驚いたことに、400µg/ml の変異プロスタシン は明らかにCYP11B2発現とアルドステロン産生を亢進させ 野生型プロスタシ、 ンと同様の結果を示した(Figure 9C、9D)。
1000 E 800 600 400 = 200 Vehicle Prostasin Vehicle Prostasin
400 ug/m L + CM 400 ug/mL
+ CM
Vehicle Prostasin Vehicle Prostasin 400|ig/mL + CM 400|ig/mL + CM 1200 1000 800 600 g 400 < 200
Vehicle Mutant Prostasin Vehicle Mutant Prostasin 400ug/mL
Figure 9
Proteolytic activity is not required for the prostasin-induced CYP11B2 expression and aldosterone production in H295R cells
Prostasin increases CYPl 1B2 expression and aldosterone production independently of its proteolytic activity in H295R cells. (A) CYP11B2 expression was measured following 24 h treatment with prostasin in the presence or absence of lOOuM camostat mesilate (CM). (B) Aldosterone production was determined following 48 h treatment with prostasin in the presence or absence of lOOuM CM. (C) CYP11B2 expression was measured following 24 h treatment with protease-dead mutant prostasin. (D) Aldosterone production was determined following 48 h treatment with mutant prostasin. Values are means ± SD (n = 6). *P < 0.001 vs. vehicle.
プロスタシンによる CYP11B2 発現亢進およびアルドステロン産生におけるア ( )、 ( )、 ンジオテンシンII タイプ 拮抗薬1 ARB カルシウムチャネル拮抗薬 CCB プロテインキナーゼ (C PKC)阻害薬の効果 つづいて 私たちは、 ARB、CCB、PKC阻害薬の プロスタシンによるアルドス、 テロン産生に対する効果をH295R細胞において検証した。400µg/mlのプロスタ シンを、100nM のバルサルタンまたは 100nM のエホニジピンまたは 1µM の ε阻害薬である と共に 細胞に 時間または 時間投 PKC Ro-31-8220 H295R 24 48 与した。投与24時間後の細胞をCYP11B2発現量の測定に、48時間後の培養液 をアルドステロン産生量の測定に使用した。Figure 10Aと10Bに示すように、 バルサルタンはプロスタシンによる CYP11B2 発現およびアルドステロン産生 にまったく影響を与えなかった 一方 エホニジピンは明らかに。 、 CYP11B2発現 とアルドステロン産生を減少させた。Figure 10C と 10D に示すように、 は 発現をコントロールレベルにまで減少させ アルドステ Ro-31-8220 CYP11B2 、 ロン産生を明らかに抑制した。
Figure 10
Effect of angiotensin II type 1 receptor blocker (AKB), calcium channel blocker
(CCB), or protein kinase C inhibitor on prostasin-induced CYP11B2 expression
and aldosterone production in H295R cells
Effect of angiotensin II type 1 receptor blocker (A, B), T-type/L-type Ca2+ channel blocker (A, B), or PKC s inhibitor (C, D) on the prostasin-induced CYP11B2
expression and aldosterone production in H295R cells. Cells were treated with
prostasin (400^g/mL) in the presence or absence of valsartan (lOOnM), efonidipine
(lOOnM), or Ro-31-8220 (l^M). CYP11B2 mRNA expression (A, C) was
determined following 24 h treatment, and aldosterone production (B, D) was evaluated following 48 h treatment. Values are means ± SD (n = 6). *P < 0.001 vs. vehicle, n.s.: not significant.
考察 今回の研究において、私たちは以下の知見を得た。 ① H295R細胞においてプロスタシンにより、CYP11B2プロモーターの転写活 性は増加した。 ② H295R細胞においてプロスタシンにより、CYP11B2 mRNA発現とアルドス テロン産生は、濃度および時間依存的に増加した。 ③ CYP11B2 mRNA発現とアルドステロン産生亢進は プロスタシンの持つ蛋、 白分解酵素活性に依存しない。 ④ CYP11B2 発現およびアルドステロン産生誘導は、カルシウムチャネル拮抗 薬またはPKC阻害薬により抑制される。 これらの結果は、プロスタシンは副腎でのアルドステロン産生を調整する役 割を担っている可能性を示唆している。 以前に私たちはラットおよびヒトにおいて、アルドステロンがプロスタシン を増加させることを報告した(14)。Wang らはラットにおいてヒトプロスタシン 遺伝子を、アデノウイルスを用い強制発現させた際、血漿プロスタシンおよび 血漿アルドステロン濃度が上昇したことを報告している(13)。これらの結果よ り、アルドステロン産生においてプロスタシンが正のフィードバック作用を有 する可能性が示唆される。副腎におけるアルドステロン産生に循環血漿中のプ ロスタシン濃度の上昇が影響を及ぼすかを確かめるため、私たちは組換えプロ スタシン蛋白を作成し、プロスタシンのH295R 細胞でのアルドステロン産生に
対する効果を検討した。 年代初頭の研究において、トリプシンはラット副腎球状層からのアルド 1980 ステロン分泌を増加させることが報告されている(21-23)。さらに、トリプシン は PAR-1 を活性化させることにより、副腎球状層からのアルドステロン分泌を 促進させていることが示されている(24)。これらの研究は プロスタシンなどの、 トリプシン様セリンプロテアーゼが、副腎でのアルドステロン産生を促進する 可能性を示唆している。今回の私たちの研究では、プロスタシンを作用させた 細胞での 発現とアルドステロン産生の有意な増加をプ H295R CYP11B2 mRNA ロスタシン濃度依存的に認めた。 今回、私たちが作成した組換えプロスタシンの合成基質に対する特異活性値 、 、 、 は ヒト精液より精製した天然のプロスタシンに比べ 約30分の しかなく1 今回の研究にて使用した組換えプロスタシン濃縮液はMokらにより報告された 血清プロスタシン濃度より比較的高濃度であった。しかしながら、私たちの予 (25;29) 想に反して、プロスタシンの強力な阻害薬であるメシル酸カモスタット をプロスタシンと共に作用させた際、メシル酸カモスタットはプロスタシンに よるアルドステロン合成に全く影響を及ぼさなかった。さらに、蛋白分解酵素 非活性型の変異プロスタシンによっても CYP11B2 発現とアルドステロン産生 が有意に促進された。これらの結果より、H295R 細胞において、蛋白分解酵素 活性はプロスタシンによるアルドステロン合成に必須ではないことが示唆され た。今回の研究で、私たちは昆虫発現システムにより組換えヒトプロスタシン を作成した。私たちの組換えプロスタシンは、非哺乳類・強制発現システムに よって、天然のプロスタシンとは異なる糖化修飾を受けている可能性や蛋白の ミスフォールディングが存在する可能性が予想される。私たちの組換えプロス タシンは特異活性が低いものであり、結果として生物学的効率の低い蛋白であ
ったことが示唆される。それゆえ、H295R 細胞でのアルドステロン合成促進を 得るためには、比較的高濃度の蛋白濃度が私たちの組換えプロスタシンでは必 要であったものと考えている。組換えプロスタシン液中の不純物がアルドステ ロン合成を促進している可能性を除外するため、私たちは残渣物質にて同様の 実験を行った。私たちは感染させていないカイコ体液を感染させたカイコ体液 と同様に精製し、コントロールとして使用したところ、H295R 細胞のアルドス テロン合成に何ら変化を来さなかった。 または のノックダウンで プロスタシンによる 発現亢
PAR-1 PAR-2 、 CYP11B2
進が全く影響を受けなかったという今回の結果は、蛋白分解酵素作用とは異な る作用をプロスタシンが有していることが認められ、プロスタシンと未知の膜 貫通型受容体の様な膜分子とが、直接蛋白―蛋白で相互に作用していることが 推測される。セリンプロテアーゼには、非触媒作用にて生物学的機能を持つも のがあり、代表的なものに肝細胞増殖因子や、マクロファージ刺激蛋白ホルモ ンなどがある。この両者は触媒機能を失っているが、膜貫通型チロシンキナー 、 。 ゼ受容体と相互作用し 受容体を介して細胞内シグナル伝達を引き起こす(30) また Chen らは、PC-3 ヒト前立腺癌細胞において、プロスタシンの蛋白分解作 用によらない作用によって、ウロキナーゼ型プラスミノーゲンアクチベーター や 合成酵素 の 発現を調整すること
(uPA) inducible nitric oxide (iNOS) mRNA
を報告している(31)が プロスタシンのシグナルを細胞内標的物質に伝える詳細、 なメカニズムに関しては明らかにされていない。細胞外プロスタシンのシグナ ルを、アルドステロン合成を引き起こす細胞内分子へ伝達する標的分子の同定 には、さらなる研究が必要である。 II 正常なヒト副腎皮質細胞では アルドステロン合成は主にアンジオテンシン、
1 AT1-R II (32;33) タイプ 受容体( )を介してアンジオテンシン により調整される ため、まず私たちはAT1-R を標的分子として検討した。私たちは何らかの機序 によりプロスタシンがAT1-Rを活性化し、CYP11B2発現亢進につながる可能性 について検討した。しかしながらバルサルタン投与にて、プロスタシンによる アルドステロン合成は消失しなかったことより、アンジオテンシン II 伝達系は このメカニズムに関与していないものと想定された。H295R 細胞において、細 胞膜を通過するカルシウムイオンの流入により CYP11B1 および CYP11B2、特 にCYP11B2 の mRNA 発現が調節されることは以前より報告されている。これ ら酵素のmRNA発現がL型カルシウムチャネル拮抗薬によって抑制され、 型L カルシウムチャネルが副腎皮質細胞においてステロイド生合成に関与している ことが示唆される(34-36)。さらに ウシ副腎細胞において、 、T型カルシウムチャ ネル活性がアルドステロン合成に関与していることが以前の研究で示唆されて いる(37)。最近では、T型およびL型カルシウムチャネルの両者に拮抗するカル シウムチャネル拮抗薬であるエホニジピンやベニジピンが、H295R 細胞におい てアルドステロン合成を抑制し それらの抑制効果は、 、L型カルシウムチャネル 拮抗薬であるニフェジピンよりも強力であったことが報告されている(38;39)。 今回の研究で、T 型/L 型カルシウムチャネル拮抗薬であるエホニジピンが 細胞におけるプロスタシンによるアルドステロン合成を抑制することが H295R 判明し、プロスタシンにアルドステロン産生において、これらのチャネルが関 与していることが示唆された 数種類の。 PKCアイソザイムが細胞内PKCµ 活性 Romero PKC を調節することが報告されている。 らは、ヒト副腎細胞において ε はPKCµの活性化に関し重要な役割を果たしており、H295R細胞においてア ンジオテンシンII による PKCµ の活性化はアルドステロン合成酵素遺伝子発現 の著明な亢進を引き起こすことを報告している(40)。また、彼らは PKC ε阻害
薬であるRo-31-8220がPKCµ のリン酸化を抑制したことを示している。私たち は、プロスタシンによるアルドステロン合成をRo-31-8220が有意に抑制したこ とを確認し、プロスタシンによるアルドステロン合成系に PKC ε が関与して いることが示唆される。 今回、私たちは、プロスタシンがH295R 細胞においてアルドステロン産生を 増加させる作用を示し、このアルドステロン産生誘導はプロスタシンの蛋白分 解作用に依存しない作用である可能性が示唆された。プロスタシンによるアル ドステロン合成に少なくとも T 型/L 型カルシウムチャネルと PKC εが関与し ている。細胞外プロスタシンのシグナルを細胞内分子へ伝達する詳細なメカニ ズムは不明であるが、私たちの今回の成績は、プロスタシン、特に循環血液中 のプロスタシンの、副腎におけるアルドステロン産生調節メカニズムで果たす 役割に関する新たな機序を提示するものである。また、以前の私たちの報告と positive 今回の知見を考え合わせると、プロスタシンとアルドステロンとの間に が存在する可能性が示唆されるが 循環血液中のプロスタシンの生理学 feedback 、 的役割を解明するためにin vivoでのさらなる研究を行う必要がある。
結語 今回、私たちは、プロスタシンが副腎皮質腺腫細胞であるH295R細胞におい てアルドステロン産生を増加させ、その増加作用はT 型/L型カルシウム拮抗薬 やPKC阻害薬により抑制されるという新たな知見を得た。またプロスタシンの 非蛋白分解作用が存在する可能性およびアルドステロンとプロスタシンとの間 にpositive feedbackが存在する可能性が示唆された。 今後の私たちの検討課題としては、in vivoでの循環血漿中プロスタシンの機 能の解明、プロスタシンの非蛋白分解作用の標的物質および細胞内シグナル伝 達系の解明、プロスタシンノックアウトマウスによるプロスタシンの生体内で の機能のさらなる解明が挙げられる。
参考文献
1. Canessa CM, Schild L, Buell G, Thorens B, Gautschi I, Horisberger JD, Rossier BC 1994 Amiloride-sensitive epithelial Na+ channel is made of three homologous subunits. Nature 367:463-467
2. Canessa CM, Horisberger JD, Rossier BC 1993 Epithelial sodium channel related to proteins involved in neurodegeneration. Nature 361:467-470
3. Garty H, Palmer LG 1997 Epithelial sodium channels: function, structure, and regulation. Physiol Rev 77:359-396
4. Schild L, Canessa CM, Shimkets RA, Gautschi I, Lifton RP, Rossier BC 1995 A mutation in the epithelial sodium channel causing Liddle disease increases channel activity in the Xenopus laevis oocyte
expression system. Proc Natl Acad Sci U S A 92:5699-5703
5. Shimkets RA, Warnock DG, Bositis CM, Nelson-Williams C, Hansson JH, Schambelan M, Gill JR, Jr., Ulick S, Milora RV, Findling JW, . 1994 Liddle's syndrome: heritable human hypertension caused by mutations in the beta subunit of the epithelial sodium channel. Cell 79:407-414
6. Tamura H, Schild L, Enomoto N, Matsui N, Marumo F, Rossier BC 1996 Liddle disease caused by a missense mutation of beta subunit of the epithelial sodium channel gene. J Clin Invest 97:1780-1784
7. Yu JX, Chao L, Chao J 1994 Prostasin is a novel human serine proteinase from seminal fluid. Purification, tissue distribution, and localization in prostate gland. J Biol Chem 269:18843-18848
8. Yu JX, Chao L, Chao J 1995 Molecular cloning, tissue-specific
expression, and cellular localization of human prostasin mRNA. J Biol Chem 270:13483-13489
Chai KX 2001 Prostasin is a glycosylphosphatidylinositol-anchored active serine protease. J Biol Chem 276:21434-21442
10. Yu JX, Chao L, Ward DC, Chao J 1996 Structure and chromosomal localization of the human prostasin PRSS8 gene. Genomics( )
32:334-340
11. Adachi M, Kitamura K, Miyoshi T, Narikiyo T, Iwashita K, Shiraishi N, Nonoguchi H, Tomita K 2001 Activation of epithelial sodium channels by prostasin in Xenopus oocytes. J Am Soc Nephrol 12:1114-1121
12. Bruns JB, Carattino MD, Sheng S, Maarouf AB, Weisz OA, Pilewski JM, Hughey RP, Kleyman TR 2007 Epithelial Na+ channels are fully activated by furin- and prostasin-dependent release of an inhibitory peptide from the gamma-subunit. J Biol Chem 282:6153-6160
13. Wang C, Chao J, Chao L 2003 Adenovirus-mediated human prostasin gene delivery is linked to increased aldosterone production and
hypertension in rats. Am J Physiol Regul Integr Comp Physiol 284:R1031-R1036
14. Narikiyo T, Kitamura K, Adachi M, Miyoshi T, Iwashita K, Shiraishi N, Nonoguchi H, Chen LM, Chai KX, Chao J, Tomita K 2002
Regulation of prostasin by aldosterone in the kidney. J Clin Invest 109:401-408
15. Koda A, Wakida N, Toriyama K, Yamamoto K, Iijima H, Tomita K, Kitamura K 2009 Urinary prostasin in humans: relationships among prostasin, aldosterone and epithelial sodium channel activity.
Hypertens Res 32:276-281
16. Curnow KM, Tusie-Luna MT, Pascoe L, Natarajan R, Gu JL, Nadler JL, White PC 1991 The product of the CYP11B2 gene is required for aldosterone biosynthesis in the human adrenal cortex. Mol Endocrinol 5:1513-1522
beta-hydroxylase produce mineralocorticoids and glucocorticoids. Mol Endocrinol 5:1853-1861
18. Kawamoto T, Mitsuuchi Y, Toda K, Yokoyama Y, Miyahara K, Miura S, Ohnishi T, Ichikawa Y, Nakao K, Imura H, . 1992 Role of steroid 11 beta-hydroxylase and steroid 18-hydroxylase in the biosynthesis of glucocorticoids and mineralocorticoids in humans. Proc Natl Acad Sci U S A 89:1458-1462
19. Ogishima T, Suzuki H, Hata J, Mitani F, Ishimura Y 1992
Zone-specific expression of aldosterone synthase cytochrome P-450 and cytochrome P-45011 beta in rat adrenal cortex: histochemical basis for the functional zonation. Endocrinology 130:2971-2977
20. Bassett MH, White PC, Rainey WE 2004 The regulation of aldosterone synthase expression. Mol Cell Endocrinol 217:67-74
21. Raven PW, McCredie E, Vinson GP, Goddard C, Whitehouse BJ 1982 Effects of proteolytic enzymes on steroid release from rat adrenal zona glomerulosa tissue: evidence for novel steroid-protein complexes.
Biochem Biophys Res Commun 104:1247-1254
22. Raven PW, McCredie E, McAuley M, Vinson GP 1983 Origins of the differences in function of rat adrenal zona glomerulosa cells incubated as intact tissue and as collagenase-prepared cell suspensions. Cell Biochem Funct 1:17-24
23. Raven PW, McAuley ME, Vinson GP 1983 Serine proteases selectively control the output of 18-hydroxycorticosterone and aldosterone in stimulated zona glomerulosa tissue of the rat adrenal. J Endocrinol 99:13-22
24. Raven PW, Kapas S, Carroll M, Hinson JP 2001 Aldosterone secretion by the rat adrenal cortex is stimulated by the activation of
protease-activated receptor 1. J Endocrinol 169:581-585
25. Maekawa A, Kakizoe Y, Miyoshi T, Wakida N, Ko T, Shiraishi N, Adachi M, Tomita K, Kitamura K 2009 Camostat mesilate inhibits
salt-sensitive hypertension. J Hypertens 27:181-189
26. Bassett MH, Zhang Y, Clyne C, White PC, Rainey WE 2002
Differential regulation of aldosterone synthase and 11beta-hydroxylase transcription by steroidogenic factor-1. J Mol Endocrinol 28:125-135 27. Kakizoe Y, Kitamura K, Ko T, Wakida N, Maekawa A, Miyoshi T,
Shiraishi N, Adachi M, Zhang Z, Masilamani S, Tomita K 2009 Aberrant ENaC activation in Dahl salt-sensitive rats. J Hypertens 27:1679-1689
28. Vinson GP, Laird SM, Hinson JP, Mallick N, Marsigliante S, Teja R 1990 Trypsin stimulation of aldosterone and 18-hydroxycorticosterone production by rat adrenal zona glomerulosa tissue is mediated by activation of protein kinase C. J Mol Endocrinol 5:85-93
29. Coote K, therton-Watson HC, Sugar R, Young A, Kenzie-Beevor A, Gosling M, Bhalay G, Bloomfield G, Dunstan A, Bridges RJ, Sabater JR, Abraham WM, Tully D, Pacoma R, Schumacher A, Harris J, Danahay H 2009 Camostat attenuates airway epithelial sodium
channel function in vivo through the inhibition of a channel-activating protease. J Pharmacol Exp Ther 329:764-774
30. Stuart KA, Riordan SM, Lidder S, Crostella L, Williams R, Skouteris GG 2000 Hepatocyte growth factor/scatter factor-induced intracellular signalling. Int J Exp Pathol 81:17-30
31. Chen M, Fu YY, Lin CY, Chen LM, Chai KX 2007 Prostasin induces protease-dependent and independent molecular changes in the human prostate carcinoma cell line PC-3. Biochim Biophys Acta
1773:1133-1140
32. Bird IM, Hanley NA, Word RA, Mathis JM, McCarthy JL, Mason JI, Rainey WE 1993 Human NCI-H295 adrenocortical carcinoma cells: a model for angiotensin-II-responsive aldosterone secretion.
Endocrinology 133:1555-1561
human adrenocortical cells. Endocr Res 21:169-182
34. Bird IM, Mathis JM, Mason JI, Rainey WE 1995 Ca 2+ -regulated( ) expression of steroid hydroxylases in H295R human adrenocortical cells. Endocrinology 136:5677-5684
35. Clyne CD, White PC, Rainey WE 1996 Calcium regulates human CYP11B2 transcription. Endocr Res 22:485-492
36. Denner K, Rainey WE, Pezzi V, Bird IM, Bernhardt R, Mathis JM 1996 Differential regulation of 11 beta-hydroxylase and aldosterone synthase in human adrenocortical H295R cells. Mol Cell Endocrinol 121:87-91
37. Rossier MF, Ertel EA, Vallotton MB, Capponi AM 1998 Inhibitory action of mibefradil on calcium signaling and aldosterone synthesis in bovine adrenal glomerulosa cells. J Pharmacol Exp Ther 287:824-831 38. Akizuki O, Inayoshi A, Kitayama T, Yao K, Shirakura S, Sasaki K,
Kusaka H, Matsubara M 2008 Blockade of T-type voltage-dependent Ca2+ channels by benidipine, a dihydropyridine calcium channel blocker, inhibits aldosterone production in human adrenocortical cell line NCI-H295R. Eur J Pharmacol 584:424-434
39. Imagawa K, Okayama S, Takaoka M, Kawata H, Naya N, Nakajima T, Horii M, Uemura S, Saito Y 2006 Inhibitory effect of efonidipine on aldosterone synthesis and secretion in human adrenocarcinoma
H295R cells. J Cardiovasc Pharmacol 47:133-138
( )
40. Romero DG, Welsh BL, Gomez-Sanchez EP, Yanes LL, Rilli S, Gomez-Sanchez CE 2006 Angiotensin II-mediated protein kinase D activation stimulates aldosterone and cortisol secretion in H295R human adrenocortical cells. Endocrinology 147:6046-6055