2017年11月改訂(第9版) 日本標準商品分類番号 87449
医薬品インタビューフォーム
日本病院薬剤師会のIF記載要領2013に準拠して作成アレルギー性疾患治療剤
剤 形 フェキソフェナジン塩酸塩錠30mg「KN」・60mg「KN」:フィルムコート錠 フェキソフェナジン塩酸塩OD錠30mg「KN」・60mg「KN」:素錠(口腔内崩壊錠) 製 剤 の 規 制 区 分 該当しない 規 格 ・ 含 量 フェキソフェナジン塩酸塩錠30mg「KN」: 1錠中、日局フェキソフェナジン塩酸塩30mg含有 フェキソフェナジン塩酸塩錠60mg「KN」: 1錠中、日局フェキソフェナジン塩酸塩60mg含有 フェキソフェナジン塩酸塩OD錠30mg「KN」: 1錠中、日局フェキソフェナジン塩酸塩30mg含有 フェキソフェナジン塩酸塩OD錠60mg「KN」: 1錠中、日局フェキソフェナジン塩酸塩60mg含有 一 般 名 和名:フェキソフェナジン塩酸塩(JAN) 洋名:Fexofenadine Hydrochloride(JAN) 製造販売承認年月日 薬価基準収載・発売年月日 製造販売承認年月日 薬価基準収載年月日 発売年月日 フェキソフェナジン塩酸塩錠30mg「KN」 2012年8月15日 2012年12月14日 2013年2月1日 フェキソフェナジン塩酸塩錠60mg「KN」 2012年8月15日 2012年12月14日 2013年2月1日 フェキソフェナジン塩酸塩OD錠30mg「KN」 2014年2月14日 2014年6月20日 2014年6月20日 フェキソフェナジン塩酸塩OD錠60mg「KN」 2013年8月15日 2013年12月13日 2013年12月13日 開発・製造販売(輸入)・ 提 携 ・ 販 売 会 社 名 製造販売元:小林化工株式会社
医薬情報担当者の連絡先 問 い 合 わ せ 窓 口 小林化工株式会社 学術情報室 0120-37-0690、TEL:0776-73-0901、FAX:0776-73-0677 医療関係者向けホームページ:http://www.kobayashikako.co.jp/product/ 本IFは 2017年 11月改訂 (第6版)(フ ェキソ フェナ ジン塩酸 塩錠 30mg「KN」・60mg「KN」)、 201 4年 6月 改 訂 (第 4版 )(フ ェ キ ソ フ ェ ナ ジ ン 塩 酸 塩 OD錠 30mg「 KN」 ・ 60mg「 KN」 )の 添 付 文 書 の 記載に基づき改訂した。日本薬局方 フェキソフェナジン塩酸塩錠
フェキソフェナジン塩酸塩錠30mg「KN」
フェキソフェナジン塩酸塩錠60mg「KN」
FEXOFENADINE HYDROCHLORIDE Tablets 30mg「KN」・60mg「KN」
フェキソフェナジン塩酸塩OD錠30mg「KN」
フェキソフェナジン塩酸塩OD錠60mg「KN」
FEXOFENADINE HYDROCHLORIDE OD Tablets 30mg「KN」・60mg「KN」
IF利用の手引きの概要 -日本病院薬剤師会-
1.医薬品インタビューフォーム作成の経緯 医療用医薬品の基本的な要約情報として医療用医薬品添付文書(以下、添付文書と略す)が ある。医療現場で医師・薬剤師等の医療従事者が日常業務に必要な医薬品の適正使用情報を活 用する際には、添付文書に記載された情報を裏付ける更に詳細な情報が必要な場合がある。 医療現場では、当該医薬品について製薬企業の医薬情報担当者等に情報の追加請求や質疑を して情報を補完して対処してきている。この際に必要な情報を網羅的に入手するための情報リ ストとしてインタビューフォームが誕生した。 昭和 63 年に日本病院薬剤師会(以下、日病薬と略す)学術第 2 小委員会が「医薬品インタ ビューフォーム」(以下、IF と略す)の位置付け並びに IF 記載様式を策定した。その後、医 療従事者向け並びに患者向け医薬品情報ニーズの変化を受けて、平成 10 年 9 月に日病薬学術 第 3 小委員会において IF 記載要領の改訂が行われた。 更に 10 年が経過し、医薬品情報の創り手である製薬企業、使い手である医療現場の薬剤 師、双方にとって薬事・医療環境は大きく変化したことを受けて、平成 20 年 9 月に日病薬医 薬情報委員会において IF 記載要領 2008 が策定された。 IF 記載要領 2008 では、IF を紙媒体の冊子として提供する方式から、PDF 等の電磁的データ として提供すること(e-IF)が原則となった。この変更にあわせて、添付文書において「効能・ 効果の追加」、「警告・禁忌・重要な基本的注意の改訂」などの改訂があった場合に、改訂の 根拠データを追加した最新版の e-IF が提供されることとなった。 最新版の e-IF は、(独)医薬品医療機器総合機構(PMDA)ホームページ「医薬品に関する情報」 (http://www.pmda.go.jp/safety/info-services/drugs/0001.html)から一括して入手可能と なっている。日本病院薬剤師会では、e-IF を掲載する医薬品医療機器総合機構(PMDA)ホームペ ージが公的サイトであることに配慮して、薬価基準収載にあわせて e-IF の情報を検討する組織 を設置して、個々の IF が添付文書を補完する適正使用情報として適切か審査・検討することと した。 2008 年より年 4 回のインタビューフォーム検討会を開催した中で指摘してきた事項を再評価 し、製薬企業にとっても、医師・薬剤師等にとっても、効率の良い情報源とすることを考え た。そこで今般、IF 記載要領の一部改訂を行い IF 記載要領 2013 として公表する運びとなっ た。 2.IFとは IF は「添付文書等の情報を補完し、薬剤師等の医療従事者にとって日常業務に必要な、医 薬品の品質管理のための情報、処方設計のための情報、調剤のための情報、医薬品の適正使用 のための情報、薬学的な患者ケアのための情報等が集約された総合的な個別の医薬品解説書と して、日病薬が記載要領を策定し、薬剤師等のために当該医薬品の製薬企業に作成及び提供を 依頼している学術資料」と位置付けられる。 ただし、薬事法・製薬企業機密等に関わるもの、製薬企業の製剤努力を無効にするもの及び 薬剤師自らが評価・判断・提供すべき事項等は IF の記載事項とはならない。言い換えると、 製薬企業から提供された IF は、薬剤師自らが評価・判断・臨床適応するとともに、必要な補 完をするものという認識を持つことを前提としている。 [IF の様式] ①規格は A4 判、横書きとし、原則として 9 ポイント以上の字体(図表は除く)で記載し、一 色刷りとする。ただし、添付文書で赤枠・赤字を用いた場合には、電子媒体ではこれに従う ものとする。 ②IF 記載要領に基づき作成し、各項目名はゴシック体で記載する。 ③表紙の記載は統一し、表紙に続けて日病薬作成の「IF 利用の手引きの概要」の全文を記載 するものとし、2 頁にまとめる。[IF の作成] ①IF は原則として製剤の投与経路別(内用剤、注射剤、外用剤)に作成される。 ②IF に記載する項目及び配列は日病薬が策定した IF 記載要領に準拠する。 ③添付文書の内容を補完するとの IF の主旨に沿って必要な情報が記載される。 ④製薬企業の機密等に関するもの、製薬企業の製剤努力を無効にするもの及び薬剤師をはじめ 医療従事者自らが評価・判断・提供すべき事項については記載されない。 ⑤「医薬品インタビューフォーム記載要領 2013」(以下、「IF 記載要領 2013」と略す)によ り作成された IF は、電子媒体での提供を基本とし、必要に応じて薬剤師が電子媒体(PDF) から印刷して使用する。企業での製本は必須ではない。 [IF の発行] ①「IF 記載要領 2013」は、平成 25 年 10 月以降に承認された新医薬品から適用となる。 ②上記以外の医薬品については、「IF 記載要領 2013」による作成・提供は強制されるもので はない。 ③使用上の注意の改訂、再審査結果又は再評価結果(臨床再評価)が公表された時点並びに適 応症の拡大等がなされ、記載すべき内容が大きく変わった場合には IF が改訂される。 3.IFの利用にあたって 「IF 記載要領 2013」においては、PDF ファイルによる電子媒体での提供を基本としてい る。情報を利用する薬剤師は、電子媒体から印刷して利用することが原則である。 電子媒体の IF については、医薬品医療機器総合機構(PMDA)ホームページに掲載場所が設定 されている。 製薬企業は「医薬品インタビューフォーム作成の手引き」に従って作成・提供するが、IF の原点を踏まえ、医療現場に不足している情報や IF 作成時に記載し難い情報等については製 薬企業の MR 等へのインタビューにより薬剤師等自らが内容を充実させ、IF の利用性を高める 必要がある。また、随時改訂される使用上の注意等に関する事項に関しては、IF が改訂され るまでの間は、当該医薬品の製薬企業が提供する添付文書やお知らせ文書等、あるいは医薬品 医療機器情報配信サービス等により薬剤師等自らが整備するとともに、IF の使用にあたって は、最新の添付文書を医薬品医療機器総合機構(PMDA)ホームページで確認する。 なお、適正使用や安全性の確保の点から記載されている「臨床成績」や「主な外国での発売 状況」に関する項目等は承認事項に関わることがあり、その取扱いには十分留意すべきであ る。 4.利用に際しての留意点 IF を薬剤師等の日常業務において欠かすことができない医薬品情報源として活用して頂き たい。しかし、薬機法や医療用医薬品プロモーションコード等による規制により、製薬企業が 医薬品情報として提供できる範囲には自ずと限界がある。IF は日病薬の記載要領を受けて、 当該医薬品の製薬企業が作成・提供するものであることから、記載・表現には制約を受けざる を得ないことを認識しておかなければならない。 また製薬企業は、IF があくまでも添付文書を補完する情報資材であり、インターネットで の公開等も踏まえ、薬機法上の広告規制に抵触しないよう留意し作成されていることを理解し て情報を活用する必要がある。 (2013 年 4 月改訂・一部変更)
目 次
Ⅰ.概要に関する項目 1.開発の経緯 ··· 1 2.製品の治療学的・製剤学的特性 ··· 1 Ⅱ.名称に関する項目 1.販売名 ··· 2 (1)和名 ··· 2 (2)洋名 ··· 2 (3)名称の由来 ··· 2 2.一般名 ··· 2 (1)和名(命名法) ··· 2 (2)洋名(命名法) ··· 2 (3)ステム ··· 2 3.構造式又は示性式 ··· 2 4.分子式及び分子量 ··· 3 5.化学名(命名法) ··· 3 6.慣用名、別名、略号、記号番号 ··· 3 7.CAS登録番号 ··· 3 Ⅲ.有効成分に関する項目 1.物理化学的性質 ··· 4 (1)外観・性状 ··· 4 (2)溶解性 ··· 4 (3)吸湿性 ··· 4 (4)融点(分解点)、沸点、凝固点 ··· 4 (5)酸塩基解離定数 ··· 4 (6)分配係数 ··· 4 (7)その他の主な示性値 ··· 4 2.有効成分の各種条件下における安定性 ··· 4 3.有効成分の確認試験法 ··· 4 4.有効成分の定量法 ··· 5 Ⅳ.製剤に関する項目 1.剤形 ··· 6 (1)剤形の区別、外観及び性状 ··· 6 (2)製剤の物性 ··· 6 (3)識別コード ··· 6 (4)pH、浸透圧比、粘度、比重、 無菌の旨及び安定なpH域等 ··· 6 2.製剤の組成 ··· 7 (1)有効成分(活性成分)の含量 ··· 7 (2)添加物 ··· 7 (3)その他 ··· 7 3.懸濁剤、乳剤の分散性に対する注意 ··· 7 4.製剤の各種条件下における安定性 ··· 7 5.調製法及び溶解後の安定性 ··· 11 6.他剤との配合変化(物理化学的変化) ··· 12 7.溶出性 ··· 12 8.生物学的試験法 ··· 21 9.製剤中の有効成分の確認試験法 ··· 21 10.製剤中の有効成分の定量法 ··· 21 11.力価 ··· 22 12.混入する可能性のある夾雑物··· 22 13.注意が必要な容器・外観が特殊な容器に 関する情報 ··· 22 14.その他 ··· 22 Ⅴ.治療に関する項目 1.効能又は効果 ··· 23 2.用法及び用量 ···23 3.臨床成績 ···23 (1)臨床データパッケージ ···23 (2)臨床効果 ···23 (3)臨床薬理試験 ···23 (4)探索的試験 ···23 (5)検証的試験 ···23 1)無作為化並行用量反応試験 ···23 2)比較試験 ···23 3)安全性試験 ···24 4)患者・病態別試験 ···24 (6)治療的使用 ···24 1)使用成績調査・特定使用成績調査 (特別調査)・製造販売後臨床試験 (市販後臨床試験) ···24 2)承認条件として実施予定の内容又は 実施した試験の概要 ···24 Ⅵ.薬効薬理に関する項目 1.薬理学的に関連ある化合物又は 化合物群 ···25 2.薬理作用 ···25 (1)作用部位・作用機序 ···25 (2)薬効を裏付ける試験成績···25 (3)作用発現時間・持続時間···26 Ⅶ.薬物動態に関する項目 1.血中濃度の推移・測定法 ···27 (1)治療上有効な血中濃度 ···27 (2)最高血中濃度到達時間 ···27 (3)臨床試験で確認された血中濃度 ···27 (4)中毒域 ···29 (5)食事・併用薬の影響 ···29 (6)母集団(ポピュレーション)解析により 判明した薬物体内動態変動要因 ···30 2.薬物速度論的パラメータ ···30 (1)解析方法 ···30 (2)吸収速度定数 ···30 (3)バイオアベイラビリティ ···30 (4)消失速度定数 ···30 (5)クリアランス ···31 (6)分布容積 ···31 (7)血漿蛋白結合率···31 3.吸収 ···31 4.分布 ···31 (1)血液-脳関門通過性 ···31 (2)血液-胎盤関門通過性 ···31 (3)乳汁への移行性 ···31 (4)髄液への移行性 ···32 (5)その他の組織への移行性 ···32 5.代謝 ···32 (1)代謝部位及び代謝経路 ···32 (2)代謝に関与する酵素(CYP450等)の 分子種 ···32 (3)初回通過効果の有無及びその割合 ···32 (4)代謝物の活性の有無及び比率 ···32(5)活性代謝物の速度論的パラメータ ··· 32 6.排泄 ··· 32 (1)排泄部位及び経路 ··· 32 (2)排泄率 ··· 33 (3)排泄速度 ··· 33 7.トランスポーターに関する情報 ··· 33 8.透析等による除去率 ··· 33 Ⅷ.安全性(使用上の注意等)に関する項目 1.警告内容とその理由 ··· 34 2.禁忌内容とその理由(原則禁忌を含む) ··· 34 3.効能又は効果に関連する使用上の注意 とその理由 ··· 34 4.用法及び用量に関連する使用上の注意 とその理由 ··· 34 5.慎重投与内容とその理由 ··· 34 6.重要な基本的注意とその理由及び 処置方法 ··· 34 7.相互作用 ··· 34 (1)併用禁忌とその理由 ··· 34 (2)併用注意とその理由 ··· 35 8.副作用 ··· 35 (1)副作用の概要 ··· 35 (2)重大な副作用と初期症状 ··· 35 (3)その他の副作用 ··· 35 (4)項目別副作用発現頻度及び 臨床検査値異常一覧 ··· 35 (5)基礎疾患、合併症、重症度及び 手術の有無等背景別の副作用発現頻度 ··· 36 (6)薬物アレルギーに対する注意 及び試験法 ··· 36 9.高齢者への投与 ··· 36 10.妊婦、産婦、授乳婦等への投与 ··· 36 11.小児等への投与 ··· 36 12.臨床検査結果に及ぼす影響 ··· 36 13.過量投与 ··· 37 14.適用上の注意 ··· 37 15.その他の注意 ··· 37 16.その他 ··· 37 Ⅸ.非臨床試験に関する項目 1.薬理試験 ··· 38 (1)薬効薬理試験 (「Ⅵ.薬効薬理に関する項目」参照) ··· 38 (2)副次的薬理試験 ··· 38 (3)安全性薬理試験 ··· 38 (4)その他の薬理試験 ··· 38 2.毒性試験 ··· 38 (1)単回投与毒性試験 ··· 38 (2)反復投与毒性試験 ··· 38 (3)生殖発生毒性試験 ··· 39 (4)その他の特殊毒性 ··· 39 Ⅹ.管理的事項に関する項目 1.規制区分 ··· 40 2.有効期間又は使用期限 ··· 40 3.貯法・保存条件 ··· 40 4.薬剤取扱い上の注意点 ··· 40 (1)薬局での取扱い上の留意点について ··· 40 (2)薬剤交付時の取扱いについて (患者等に留意すべき必須事項等) ··· 40 (3)調剤時の留意点について ··· 41 5.承認条件等 ··· 41 6.包装 ··· 41 7.容器の材質 ··· 41 8.同一成分・同効薬 ··· 42 9.国際誕生年月日 ··· 42 10.製造販売承認年月日及び承認番号 ··· 42 11.薬価基準収載年月日 ··· 42 12.効能又は効果追加、用法及び用量変更追加 等の年月日及びその内容 ··· 42 13.再審査結果、再評価結果公表年月日 及びその内容 ··· 42 14.再審査期間 ··· 42 15.投薬期間制限医薬品に関する情報 ··· 42 16.各種コード ··· 43 17.保険給付上の注意 ··· 43 ⅩⅠ.文献 1.引用文献 ··· 44 2.その他の参考文献 ··· 44 ⅩⅡ.参考資料 1.主な外国での発売状況 ··· 45 2.海外における臨床支援情報 ··· 45 ⅩⅢ.備 考 その他の関連資料 ··· 46
Ⅰ.概要に関する項目
1.開発の経緯
フェキソフェナジン塩酸塩は、ヒスタミン H1受容体拮抗作用だけでなく、各種ケミカル・ メディエーター遊離抑制作用、炎症性サイトカイン遊離抑制作用、好酸球遊走抑制作用等 を示すアレルギー性疾患治療剤である。 フェキソフェナジン塩酸塩錠 30mg「KN」及びフェキソフェナジン塩酸塩錠 60mg「KN」は、 小林化工㈱が後発医薬品として開発を企画し、薬食発第 0331015 号(平成 17 年 3 月 31 日 付)に基づき、規格及び試験方法の設定、安定性試験、生物学的同等性試験を実施し、 2012 年(平成 24 年)8 月に承認を取得し、翌年 2 月の発売に至った。 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」は、小林化工㈱が後発医薬品として開発を企 画し、薬食発第 0331015 号(平成 17 年 3 月 31 日付)に基づき、規格及び試験方法の設定、 安定性試験、生物学的同等性試験を実施し、2013 年(平成 25 年)8 月に承認を取得し、同年 12 月の薬価収載とともに発売に至った。 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」は、小林化工㈱が後発医薬品として開発を企 画し、薬食発第 0331015 号(平成 17 年 3 月 31 日付)に基づき、規格及び試験方法の設定、 安定性試験、生物学的同等性試験を実施し、2014 年(平成 26 年)2 月に承認を取得し、同年 6 月の薬価収載とともに発売に至った。2.製品の治療学的・製剤学的特性
①1 日 2 回の投与でアレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症、 アトピー性皮膚炎)に伴うそう痒に優れた効果を発揮する。 ②副作用(頻度不明) 重大な副作用として、ショック、アナフィラキシー、肝機能障害、黄疸、無顆粒球症、 白血球減少、好中球減少があらわれたとの報告がある。 <フェキソフェナジン塩酸塩錠 30mg「KN」> ・うすいだいだい色のフィルムコート錠である。 ・錠剤に含量と製品名の一部「30mgフェキソ KN」を印刷している。 <フェキソフェナジン塩酸塩錠 60mg「KN」> ・うすいだいだい色のフィルムコート錠である。 ・錠剤に含量と製品名の一部「フェキソフェナジン 60 KN」を印刷している。 <フェキソフェナジン塩酸塩 OD 錠 30mg「KN」> ・白色の素錠(口腔内崩壊錠)である。 ・錠剤に製品名の一部と含量「フェキソ OD30」を刻印している。 ・バナナ風味の錠剤である。 <フェキソフェナジン塩酸塩 OD 錠 60mg「KN」> ・白色の割線入りの素錠(口腔内崩壊錠)である。 ・錠剤に製品名の一部と含量「フェキソ OD60」を刻印している。 ・バナナ風味の錠剤である。Ⅱ.名称に関する項目
1.販売名
(1)和 名 フェキソフェナジン塩酸塩錠 30mg「KN」 フェキソフェナジン塩酸塩錠 60mg「KN」 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」 (2)洋 名FEXOFENADINE HYDROCHLORIDE Tablets 30mg「KN」 FEXOFENADINE HYDROCHLORIDE Tablets 60mg「KN」 FEXOFENADINE HYDROCHLORIDE OD Tablets 30mg「KN」 FEXOFENADINE HYDROCHLORIDE OD Tablets 60mg「KN」 (3)名称の由来 一般名+剤形+規格含量+「KN」 Kobayashikako Network Kobayashikako Nippon
2.一般名
(1)和名(命名法) フェキソフェナジン塩酸塩(JAN) (2)洋名(命名法) Fexofenadine Hydrochloride(JAN) fexofenadine(INN) (3)ステム 該当資料なし3.構造式又は示性式
構造式:4.分子式及び分子量
分子式:C32H39NO4・HCl
分子量:538.12
5.化学名(命名法)
2-(4-{(1RS)-1-Hydroxy-4-[4-(hydroxydiphenylmethyl)piperidin-1-y1]butyl}phenyl)-2- methylpropanoic acid monohydrochloride(IUPAC)
6.慣用名、別名、略号、記号番号
記号番号:KFEX(治験薬コード)
7.CAS 登録番号
153439-40-8(Fexofenadine Hydrochloride) 83799-24-0(fexofenadine)
Ⅲ.有効成分に関する項目
1.物理化学的性質
(1)外観・性状1) 白色の結晶性の粉末である。 (2)溶解性2) 各種溶媒における溶解度 メタノールに極めて溶けやすく、エタノール(99.5)にやや溶けやすく、水に溶けにくい。 (3)吸湿性2) 室温、79%RH 以下の条件下では 4 週間保存しても吸湿性は認められなかった。 (4)融点(分解点)、沸点、凝固点2) 融点:199.3℃(自動融点測定装置) (5)酸塩基解離定数2) pKa=4.25 及び 9.53(カルボキシル基及びピペリジノ基の pKa をフェキソフェナジンの 塩酸又は水酸化ナトリウム液(25℃)中での溶解度から算出) (6)分配係数 該当資料なし (7)その他の主な示性値1) メタノール溶液(3→100)は旋光性を示さない。 水分:0.5%以下(0.25g、電量滴定法) 強熱残分:0.1%以下(1g) 結晶多形が認められる。2.有効成分の各種条件下における安定性
3) ①長期保存試験(25℃ 60%RH)36 ヵ月:変化なし。 ②加速試験(40℃ 75%RH)6 ヵ月:変化なし。 ③苛酷試験 1)(温度:40℃、50℃)6 ヵ月:変化なし。 2)(湿度:30℃ 90%RH)1 ヵ月:含量に若干の低下がみられたが規格値内であった。 3)(光:120 万 Lux・hr、200W・hr/m2)12 日:含量に若干の低下がみられたが規格値 内であった。3.有効成分の確認試験法
1) (日局フェキソフェナジン塩酸塩の確認試験による。) 1)紫外可視吸光度測定法 2)赤外吸収スペクトル測定法(臭化カリウム錠剤法) 3)塩化物の定性反応(2)4.有効成分の定量法
1) (日局フェキソフェナジン塩酸塩の定量法による。) 本品及びフェキソフェナジン塩酸塩標準品(別途本品と同様の方法で水分を測定しておく) 約 25mg ずつを精密に量り、それぞれをリン酸二水素ナトリウム二水和物 7.51g 及び過塩 素酸ナトリウム 0.84g を水 1000mL に溶かし、リン酸を加えて pH2.0 に調整した液/液体 クロマトグラフィー用アセトニトリル混液(1:1)に溶かし、正確に 25mL とする。この液 3 mL ずつを正確に量り、それぞれに移動相を加えて正確に 50mL とし、試料溶液及び標準溶 液とする。試料溶液及び標準溶液 20μL ずつを正確にとり、液体クロマトグラフィーによ り試験を行い、それぞれの液のフェキソフェナジンのピーク面積AT及びASを測定する。 フェキソフェナジン塩酸塩(C32H39NO4・HCl)の量(mg)=MS× AT AS MS:脱水物に換算したフェキソフェナジン塩酸塩標準品の秤取量(mg) 検 出 器:紫外可視吸光光度計 測定波長:220nmⅣ.製剤に関する項目
1.剤形
(1)剤形の区別、外観及び性状 製 品 名 有効成分の 名称・含量 性状 外 形 直 径 厚 さ 重 量 フェキソフェナジン 塩酸塩錠30mg「KN」 1錠中、 日局フェキソフェナジン 塩酸塩30mg含有 うすいだいだい色の フィルムコート錠 約6.6mm 約3.5mm 約103mg フェキソフェナジン 塩酸塩錠60mg「KN」 1錠中、 日局フェキソフェナジン 塩酸塩60mg含有 うすいだいだい色の フィルムコート錠 長径:約12.2mm 短径:約5.6mm 約4.1mm 約206mg フェキソフェナジン 塩酸塩OD錠30mg「KN」 1錠中、 日局フェキソフェナジン 塩酸塩30mg含有 白色の素錠 (口腔内崩壊錠) 約8.6mm 約3.5mm 約225mg フェキソフェナジン 塩酸塩OD錠60mg「KN」 1錠中、 日局フェキソフェナジン 塩酸塩60mg含有 白色の割線入りの 素錠(口腔内崩壊錠) 約11.1mm 約4.2mm 約450mg (2)製剤の物性 溶出性:「Ⅳ.製剤に関する項目 7.溶出性」の項参照 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 崩壊性:日本薬局方 一般試験法 崩壊試験(1)即放性製剤の項に適合する。 (3)識別コード 製品名 薬物本体 フェキソフェナジン塩酸塩錠30mg「KN」 30mg フェキソ KN フェキソフェナジン塩酸塩錠60mg「KN」 フェキソフェナジン 60 KN フェキソフェナジン塩酸塩OD錠30mg「KN」 フェキソ OD 30 フェキソフェナジン塩酸塩OD錠60mg「KN」 フェキソ OD 60 (4)pH、浸透圧比、粘度、比重、無菌の旨及び安定なpH域等 該当しない2.製剤の組成
(1)有効成分(活性成分)の含量 フェキソフェナジン塩酸塩錠 30mg「KN」: 1 錠中、日局フェキソフェナジン塩酸塩 30mg 含有 フェキソフェナジン塩酸塩錠 60mg「KN」: 1 錠中、日局フェキソフェナジン塩酸塩 60mg 含有 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」: 1 錠中、日局フェキソフェナジン塩酸塩 30mg 含有 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 1 錠中、日局フェキソフェナジン塩酸塩 60mg 含有 (2)添加物 製 品 名 添 加 物 フェキソフェナジン塩酸塩錠30mg「KN」 結晶セルロース、部分アルファー化デンプン、 クロスカルメロースナトリウム、ポビドン、軽 質無水ケイ酸、ステアリン酸マグネシウム、ヒ プ ロ メ ロ ー ス 、 酸 化 チ タ ン 、 マ ク ロ ゴ ー ル 400、三二酸化鉄、黄色三二酸化鉄 フェキソフェナジン塩酸塩錠60mg「KN」 フェキソフェナジン塩酸塩OD錠30mg「KN」 ポビドン、結晶セルロース(粒)、アミノアルキ ルメタクリレートコポリマーE、含水二酸化ケ イ素、乳糖水和物、結晶セルロース、クロスポ ビドン、アスパルテーム(L-フェニルアラニン 化合物)、ステアリン酸マグネシウム、香料 フェキソフェナジン塩酸塩OD錠60mg「KN」 (3)その他 該当資料なし3.懸濁剤、乳剤の分散性に対する注意
該当しない4.製剤の各種条件下における安定性
4) フェキソフェナジン塩酸塩錠 30mg「KN」: 安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 苛酷試験 25℃、75%RH 無包装品 3ヵ月 性状 *1 *1 溶出試験(%) 98.3~103.9 101.9~104.3 定量試験(対表示量%) 102.4 103.9 40℃ 3ヵ月 性状 *1 *1 溶出試験(%) 98.3~103.9 102.1~104.0 定量試験(対表示量%) 102.4 103.8 蛍光灯照射 (1000lux) 50日 ( 120万 lux・ hr) 性状 *1 *1 溶出試験(%) 98.3~103.9 101.8~103.5 定量試験(対表示量%) 102.4 104.2安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 加速試験 40℃、75%RH PTP包装品 (最終包装品) 6ヵ月 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 98.3~105.5 98.0~103.9 定量試験(対表示量%) 101.5~104.1 102.2~103.9 ポリエチレン製 容器入り包装品 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 98.3~105.5 95.5~104.1 定量試験(対表示量%) 101.5~104.1 102.6~105.0 長期保存試験 25℃ 、 60% RH PTP包装品 (最終包装品) 36ヵ月 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 98.3~105.5 99.2~105.2 定量試験(対表示量%) 101.5~104.1 103.1~104.8 ポリエチレン製 容器入り包装品 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 98.3~105.5 97.9~102.7 定量試験(対表示量%) 101.5~104.1 102.1~104.8 *1:うすいだいだい色のフィルムコート錠 *2:「Ⅳ.製剤に関する項目 9.製剤中の有効成分の確認試験法」に適合した。 *3:日局(JP15)一般試験法 製剤均一性試験法 1.含量均一性試験に適合した。 最終包装製品を用いた長期保存試験(25℃、60%RH、3 年間)の結果、フェキソフェナジン 塩酸塩錠 30mg「KN」は通常の市場流通下において 3 年間安定であることが確認された。 フェキソフェナジン塩酸塩錠 60mg「KN」: 安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 苛酷試験 25℃、75%RH 無包装品 3ヵ月 性状 *1 *1 溶出試験(%) 96.4~104.4 102.2~105.7 定量試験(対表示量%) 101.7 101.9 40℃ 3ヵ月 性状 *1 *1 溶出試験(%) 96.4~104.4 102.2~104.2 定量試験(対表示量%) 101.7 103.2 蛍光灯照射 (1000lux) 50日 ( 120万 lux・ hr) 性状 *1 *1 溶出試験(%) 96.4~104.4 100.4~102.8 定量試験(対表示量%) 101.7 102.7 加速試験 40℃、75%RH PTP包装品 (最終包装品) 6ヵ月 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 95.9~104.4 98.4~102.4 定量試験(対表示量%) 99.4~102.8 102.5~104.2 ポリエチレン製 容器入り包装品 (最終包装品) 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 95.9~104.4 94.5~102.3 定量試験(対表示量%) 99.4~102.8 102.6~104.5
安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 長期保存試験 25℃ 、 60% RH PTP包装品 (最終包装品) 36ヵ月 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 95.9~104.4 95.9~101.5 定量試験(対表示量%) 99.4~102.8 97.6~102.3 ポリエチレン製 容器入り包装品 (最終包装品) 性状・確認試験 *1、*2 *1、*2 含量均一性試験 *3 *3 溶出試験(%) 95.9~104.4 97.4~102.2 定量試験(対表示量%) 99.4~102.8 98.9~103.9 *1:うすいだいだい色のフィルムコート錠 *2:「Ⅳ.製剤に関する項目 9.製剤中の有効成分の確認試験法」に適合した。 *3:日局(JP15)一般試験法 製剤均一性試験法 1.含量均一性試験に適合した。 最終包装製品を用いた長期保存試験(25℃、60%RH、3 年間)の結果、フェキソフェナジン 塩酸塩錠 60mg「KN」は通常の市場流通下において 3 年間安定であることが確認された。 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」: 安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 苛酷試験 25℃、75%RH 無包装品 3ヵ月 性状 *1 *1 純度試験 *3 - 崩壊試験(秒) 18~23 11~17 溶出試験(%) 91.9~98.7 90.9~99.0 定量試験(対表示量%) 100.0 101.2 25℃、90%RH 14日 性状 *1 *1 純度試験 *3 - 崩壊試験(秒) 18~23 25~30 溶出試験(%) 91.9~98.7 81.0~90.3 定量試験(対表示量%) 100.0 100.2 40℃ 3ヵ月 性状 *1 *1 純度試験 *3 - 崩壊試験(秒) 18~23 16~21 溶出試験(%) 91.9~98.7 96.1~103.5 定量試験(対表示量%) 100.0 100.9 60℃ 1ヵ月 性状 *1 *1 純度試験 *3 - 崩壊試験(秒) 18~23 18~20 溶出試験(%) 91.9~98.7 92.9~100.3 定量試験(対表示量%) 100.0 101.2 蛍光灯照射 (1000lux) 50日 ( 120万 lux・ hr) 性状 *1 *1 純度試験 *3 - 崩壊試験(秒) 18~23 18~20 溶出試験(%) 91.9~98.7 93.2~100.9 定量試験(対表示量%) 100.0 101.7
安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 加速試験 40℃、75%RH PTP包装品 (最終包装品) 6ヵ月 性状・確認試験 *1、*2 *1、*2 純度試験 *3 *3 含量均一性試験 *4 *4 崩壊試験(秒) 18~23 12~16 溶出試験(%) 91.9~102.9 87.5~103.2 定量試験(対表示量%) 99.4~102.0 99.6~101.2 ポリエチレン製 容器入り包装品 (最終包装品) 性状・確認試験 *1、*2 *1、*2 純度試験 *3 *3 含量均一性試験 *4 *4 崩壊試験(秒) 18~23 15~19 溶出試験(%) 91.9~102.0 89.6~103.3 定量試験(対表示量%) 99.4~102.0 98.9~101.5 長期保存試験 25℃ 、 60% RH PTP包装品 (最終包装品) 36ヵ月 性状 *1 *1 純度試験 *3 *3 崩壊試験(秒) 18~23 14~16 溶出試験(%) 91.9~102.9 94.9~106.9 定量試験(対表示量%) 100.0~101.4 100.6~103.4 ポリエチレン製 容器入り包装品 (最終包装品) 性状 *1 *1 純度試験 *3 *3 崩壊試験(秒) 18~23 13~20 溶出試験(%) 91.9~102.9 87.6~99.4 定量試験(対表示量%) 100.0~101.4 100.0~102.8 *1:白色の素錠(口腔内崩壊錠) *2:「Ⅳ.製剤に関する項目 9.製剤中の有効成分の確認試験法」に適合した。 *3:「規格及び試験方法」の純度試験に適合した。 *4:日局(JP16)一般試験法 製剤均一性試験法 1.含量均一性試験に適合した。 最終包装製品を用いた長期保存試験(25℃、60%RH、3 年間)の結果、フェキソフェナジン 塩酸塩 OD 錠 30mg「KN」は通常の市場流通下において 3 年間安定であることが確認された。 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 苛酷試験 25℃、75%RH 無包装品 3ヵ月 性状 *1 *1 崩壊試験(秒) 17~20 21~25 溶出試験(%) 93.2~98.4 85.3~92.4 定量試験(対表示量%) 100.5 98.4 25℃、90%RH 1ヵ月 性状 *1 *1 崩壊試験(秒) 17~20 27~34 溶出試験(%) 93.2~98.4 86.7~94.8 定量試験(対表示量%) 100.5 98.5 40℃、75%RH 1ヵ月 性状 *1 *1 崩壊試験(秒) 17~20 18~22 溶出試験(%) 93.2~98.4 92.0~98.4 定量試験(対表示量%) 100.5 99.2
安定性試験 保存条件 保存形態 保存期間 試験項目 結果 試験開始時 試験終了時 苛酷試験 40℃ 無包装品 3ヵ月 性状 *1 *1 崩壊試験(秒) 17~20 21~25 溶出試験(%) 93.2~98.4 91.1~97.9 定量試験(対表示量%) 100.5 101.1 60℃ 1ヵ月 性状 *1 *1 崩壊試験(秒) 17~20 21~24 溶出試験(%) 93.2~98.4 96.2~100.7 定量試験(対表示量%) 100.5 100.1 蛍光灯照射 (1000lux) 50日 ( 120万 lux・ hr) 性状 *1 *1 崩壊試験(秒) 17~20 24~26 溶出試験(%) 93.2~98.4 92.2~100.0 定量試験(対表示量%) 100.5 99.1 加速試験 40℃、75%RH PTP包装品 (最終包装品) 6ヵ月 性状・確認試験 *1、*2 *1、*2 純度試験 *3 *3 含量均一性試験 *4 *4 崩壊試験(秒) 17~24 14~18 溶出試験(%) 92.0~99.9 92.3~99.4 定量試験(対表示量%) 99.6~101.8 100.8~102.8 ポリエチレン製 容器入り包装品 性状・確認試験 *1、*2 *1、*2 純度試験 *3 *3 含量均一性試験 *4 *4 崩壊試験(秒) 17~24 18~23 溶出試験(%) 92.0~99.9 90.8~98.2 定量試験(対表示量%) 99.6~101.8 101.1~103.0 長期保存試験 25℃ 、 60% RH PTP包装品 (最終包装品) 36ヵ月 性状 *1 *1 純度試験 *3 *3 崩壊試験(秒) 17~23 16~22 溶出試験(%) 93.7~98.5 92.3~99.3 定量試験(対表示量%) 99.6~101.8 99.5~101.8 ポリエチレン製 容器入り包装品 性状 *1 *1 純度試験 *3 *3 崩壊試験(秒) 17~23 17~20 溶出試験(%) 93.7~98.5 92.6~100.0 定量試験(対表示量%) 99.6~101.8 98.4~103.3 *1:白色の割線入りの素錠(口腔内崩壊錠) *2:「Ⅳ.製剤に関する項目 9.製剤中の有効成分の確認試験法」に適合した。 *3:「規格及び試験方法」の純度試験に適合した。 *4:日局(JP16)一般試験法 製剤均一性試験法 1.含量均一性試験に適合した。 最終包装製品を用いた長期保存試験(25℃、60%RH、3 年間)の結果、フェキソフェナジン 塩酸塩 OD 錠 60mg「KN」は通常の市場流通下において 3 年間安定であることが確認された。
5.調製法及び溶解後の安定性
該当しない6.他剤との配合変化(物理化学的変化)
該当資料なし7.溶出性
5)<溶出挙動における同等性:生物学的同等性試験ガイドラインに基づく溶出試験> フェキソフェナジン塩酸塩錠 30mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第 487 号(平成 9 年 12 月 22 日付)、 含量が異なる経口固形製剤の生物学的同等性試験ガイドラインについて 医薬審第 64 号 (平成 12 年 2 月 14 日付)、後発医薬品の生物学的同等性試験ガイドライン等の一部改正 について 薬食審査発第 1124004 号(平成 18 年 11 月 24 日付) 試験条件 試験方法:日本薬局方(JP15)一般試験法 溶出試験法(パドル法) 試験液量:900mL 温 度:37±0.5℃ 試 験 液:①pH1.2(日局溶出試験 第 1 液) ②pH4.0(薄めた McIlvaine の緩衝液) ③pH6.8(日局溶出試験 第 2 液) ④水 回 転 数: 50min-1 試験液①~④ 100min-1 試験液② 判定基準 (1)平均溶出率 試験液① 標準製剤が規定された試験時間における平均溶出率の 1/2 の平均溶出率を示 す適当な時点、及び規定された試験時間において、試験製剤の平均溶出率が 標準製剤の平均溶出率±8%の範囲にあるか、又は f2 関数の値が 55 以上であ る。 試験液②、③、④ 標準製剤及び試験製剤が 15 分以内に平均 85%以上溶出するか、又は 15 分に おける試験製剤の平均溶出率が標準製剤の平均溶出率±10%の範囲にある。 (2)個々の溶出率 試験液① 最終比較時点における試験製剤の個々の溶出率について、試験製剤の平均溶 出率±12%の範囲を超えるものが 12 個中 1 個以下で、±20%の範囲を超える ものがない。 試験液②、③、④ 最終比較時点における試験製剤の個々の溶出率について、試験製剤の平均溶 出率±15%の範囲を超えるものが 12 個中 1 個以下で、±25%の範囲を超える ものがない。 試験結果 フェキソフェナジン塩酸塩錠 30mg「KN」は、フェキソフェナジン塩酸塩錠 60mg 「KN」を標準製剤としたとき、溶出挙動が等しく、両剤の生物学的同等性が確認 された。
図 1 フェキソフェナジン塩酸塩錠 30mg「KN」の溶出挙動における同等性 (試験製剤及び標準製剤の平均溶出率の比較) 試験液①:pH1.2 パドル法 50min-1 試験液②:pH4.0 パドル法 50min-1 試験液③:pH6.8 パドル法 50min-1 試験液④:水 パドル法 50min-1 試験液②:pH4.0 パドル法 100min-1 試験製剤(フェキソフェナジン塩酸塩錠 30mg「KN」) 標準製剤(フェキソフェナジン塩酸塩錠 60mg「KN」) n=12
表 1 フェキソフェナジン塩酸塩錠 30mg「KN」の溶出挙動における同等性 (試験製剤及び標準製剤の平均溶出率の比較) 試験条件 試験製剤 (フェキソフェナジン塩酸塩錠 30mg「KN」) 標準製剤 (フェキソフェナジン塩酸塩錠 60mg「KN」) 判定 方法 回転数 試験液 判定時点 平均溶出率(%) 平均溶出率(%) 溶出試験法 (パドル法) 50min-1 ①pH1.2 5 分 75.0 68.4 適合 120 分 87.9 84.0 ②pH4.0 15 分 96.7 85.2 適合 ③pH6.8 15 分 96.4 92.3 適合 ④水 15 分 92.9 91.1 適合 100min-1 ②pH4.0 15 分 99.5 95.0 適合 (n=12) (試験製剤の個々の溶出率) 試験条件 フェキソフェナジン塩酸塩錠 30mg「KN」 判定 方法 回転数 試験液 判定時点 個々の溶出率(%) 平均溶出率(%)±S.D. 溶出試験法 (パドル法) 50min-1 ①pH1.2 120 分 86.6、86.3、91.3、83.4、84.5、88.8、 89.0、90.1、89.1、89.6、88.7、87.1 87.9±2.34 適合 ②pH4.0 15 分 91.3、97.1、94.6、97.0、95.7、93.5、 99.3、98.7、97.1、100.4、99.7、96.4 96.7±2.68 適合 ③pH6.8 15 分 93.0、98.6、95.1、94.6、97.8、98.7、 96.3、99.6、95.7、92.9、99.8、94.1 96.4±2.49 適合 ④水 15 分 97.0、96.2、89.1、90.9、93.8、92.3、 91.2、94.7、92.6、92.8、91.0、93.4 92.9±2.28 適合 100min-1 ②pH4.0 15 分 101.2、100.8、99.9、100.5、97.1、98.1、 100.1、100.8、98.9、100.4、98.9、97.2 99.5±1.42 適合 (n=12) フェキソフェナジン塩酸塩錠60mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第487号(平成9年12月22日付)、後発 医薬品の生物学的同等性試験ガイドライン等の一部改正について 薬食審査発第1124004号 (平成18年11月24日付) 試験条件 試験方法:日本薬局方(JP15)一般試験法 溶出試験法(パドル法) 試験液量:900mL 温 度:37±0.5℃ 試 験 液:①pH1.2(日局溶出試験 第 1 液) ②pH4.0(薄めた McIlvaine の緩衝液) ③pH6.8(日局溶出試験 第 2 液) ④水 回 転 数: 50min-1 試験液①~④ 100min-1 試験液② 判定基準 試験液①、② 標準製剤の平均溶出率が 40%及び 85%付近の適当な 2 時点において、試験製剤の 平均溶出率が標準製剤の平均溶出率±15%の範囲にあるか、又は f2 関数の値が 42 以上である。 試験液③、④ 標準製剤及び試験製剤が 15 分以内に平均 85%以上溶出するか、又は 15 分におけ る試験製剤の平均溶出率が標準製剤の平均溶出率±15%の範囲にある。
試験結果 フェキソフェナジン塩酸塩錠60mg「KN」の各試験液における溶出挙動は、以下のと おりであった。 図2 フェキソフェナジン塩酸塩錠60mg「KN」の溶出挙動における類似性 (試験製剤及び標準製剤の平均溶出率の比較) 試験液①:pH1.2 パドル法 50min-1 試験液②:pH4.0 パドル法 50min-1 試験液③:pH6.8 パドル法 50min-1 試験液④:水 パドル法 50min-1 試験液②:pH4.0 パドル法 100min-1 試験製剤(フェキソフェナジン塩酸塩錠 60mg「KN」) 標準製剤(錠剤、60mg) n=12
表2 フェキソフェナジン塩酸塩錠60mg「KN」の溶出挙動における類似性 (試験製剤及び標準製剤の平均溶出率の比較) 試験条件 試験製剤 (フェキソフェナジン塩酸塩錠60mg「KN」) 標準製剤 (錠剤、60mg) 判定 方法 回転数 試験液 判定時点 平均溶出率(%) 平均溶出率(%) 溶出試験法 (パドル法) 50min-1 ① pH1.2 15分 77.4 39.8 不適* 90分 83.3 84.5 f2関数 37.6 ② pH4.0 10分 83.6 39.6 不適* 90分 93.1 83.7 f2関数 34.3 ③ pH6.8 15分 92.3 94.0 適合 ④ 水 15分 91.1 86.2 適合 100min-1 ② pH4.0 5分 93.9 38.9 不適* 90分 100.9 86.5 f2関数 31.4 (n=12) *著しい差が認められたが、後発医薬品の生物学的同等性試験ガイドラインにおいては、「通常 製剤においては溶出性の同等性を証明できなくても、ヒトで同等性が証明できれば、生物学的 に同等の医薬品と判定される」とされている。 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第 487 号(平成 9 年 12 月 22 日付)、 含量が異なる経口固形製剤の生物学的同等性試験ガイドラインについて 医薬審第 64 号 (平成 12 年 2 月 14 日付)、後発医薬品の生物学的同等性試験ガイドライン等の一部改正に ついて 薬食審査発第 1124004 号(平成 18 年 11 月 24 日付) 試験条件 試験方法:日本薬局方(JP15)一般試験法 溶出試験法(パドル法、回転バスケット法) 試験液量:900mL 温 度:37±0.5℃ 試 験 液:①pH1.2(日局溶出試験 第 1 液) ②pH6.0(薄めた McIlvaine の緩衝液) ③pH6.8(日局溶出試験 第 2 液) ④水 回 転 数: 50min-1 試験液①、②(パドル法) 100min-1 試験液③、④(回転バスケット法) 判定基準 (1)平均溶出率 試験液① 標準製剤が規定された試験時間における平均溶出率の 1/2 の平均溶出率を示 す適当な時点、及び規定された試験時間において、試験製剤の平均溶出率が 標準製剤の平均溶出率±8%の範囲にあるか、又は f2 関数の値が 55 以上であ る。
試験液②、④ 標準製剤及び試験製剤が 15 分以内に平均 85%以上溶出するか、又は 15 分に おける試験製剤の平均溶出率が標準製剤の平均溶出率±10%の範囲にある。 試験液③ 標準製剤の平均溶出率が 40%及び 85%付近の適当な 2 時点において、試験製剤 の平均溶出率が標準製剤の平均溶出率±10%の範囲にあるか、又は f2 関数の 値が 50 以上である。 (2)個々の溶出率 試験液① 最終比較時点における試験製剤の個々の溶出率について、試験製剤の平均溶 出率±12%の範囲を超えるものが 12 個中 1 個以下で、±20%の範囲を超えるも のがない。 試験液②、③、④ 最終比較時点における試験製剤の個々の溶出率について、試験製剤の平均溶 出率±15%の範囲を超えるものが 12 個中 1 個以下で、±25%の範囲を超えるも のがない。 試験結果 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」は、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」を標準製剤としたとき、溶出挙動が等しく、両剤の生物学的同等性が 確認された。 図 3 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」の溶出挙動における同等性 (試験製剤及び標準製剤の平均溶出率の比較) 試験液①:pH1.2 パドル法 50min-1 試験液②:pH6.0 パドル法 50min-1 試験製剤(フェキソフェナジン塩酸塩 OD 錠 30mg「KN」) 標準製剤(フェキソフェナジン塩酸塩 DO 錠 60mg「KN」) n=12
試験液③:pH6.8 回転バスケット法 100min-1 試験液④:水 回転バスケット法 100min-1 表 3 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」の溶出挙動における同等性 (試験製剤及び標準製剤の平均溶出率の比較) 試験条件 試験製剤 (フェキソフェナジン塩酸塩 OD 錠 30mg「KN」) 標準製剤 (フェキソフェナジン塩酸塩 OD 錠 60mg「KN」) 判定 方法 回転数 試験液 判定時点 平均溶出率(%) 平均溶出率(%) 溶出試験法 (パドル法) 50min -1 ①pH1.2 5 分 45.7 43.7 適合 120 分 63.4 60.1 ②pH6.0 15 分 92.6 87.9 適合 溶出試験法 (回転バスケット法) 100min -1 ③pH6.8 5 分 39.5 41.4 適合 30 分 78.7 83.4 ④水 15 分 93.5 94.9 適合 (n=12) (試験製剤の個々の溶出率) 試験条件 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」 判定 方法 回転数 試験液 判定時点 個々の溶出率(%) 平均溶出率(%)±S.D. 溶出試験法 (パドル法) 50min -1 ①pH1.2 120 分 50.4、60.4、61.0、73.1、70.3、67.4、 56.6、69.9、70.4、61.8、65.0、54.8 63.4±7.12 適合 ②pH6.0 15 分 96.4、94.9、97.1、95.9、88.5、86.6、 90.0、90.5、88.2、93.3、96.8、93.4 92.6±3.73 適合 溶出試験法 (回転バスケット法) 100min -1 ③pH6.8 30 分 79.8、78.0、62.0、64.6、80.8、80.6、 80.3、85.5、83.1、84.8、81.1、83.7 78.7±7.53 適合 ④水 15 分 84.3、89.8、89.3、88.1、100.3、100.2、 96.6、95.8、82.3、102.8、95.0、97.9 93.5±6.64 適合 (n=12) フェキソフェナジン塩酸塩OD錠60mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第487号(平成9年12月22日付)、後 発医薬品の生物学的同等性試験ガイドライン等の一部改正について 薬食審査発第0229第10 号(平成24年2月29日付) 試験条件 試験方法:日本薬局方(JP16)一般試験法 溶出試験法(パドル法) 試験液量:900mL 温 度:37±0.5℃ 試 験 液:①pH1.2(日局溶出試験 第 1 液) ②pH6.5(薄めた McIlvaine の緩衝液) ③pH6.8(日局溶出試験 第 2 液) ④水
回 転 数: 50min-1 試験液①~④ 100min-1 試験液② 判定基準 試験液①、③ 標準製剤が規定された試験時間における平均溶出率の 1/2 の平均溶出率を示す適 当な時点、及び規定された試験時間において、試験製剤の平均溶出率が標準製剤 の平均溶出率±12%の範囲にあるか、又は f2 関数の値が 46 以上である。 試験液②(50min-1)、④ 標準製剤の平均溶出率が 40%及び 85%付近の適当な 2 時点において、試験製剤の平 均溶出率が標準製剤の平均溶出率±15%の範囲にあるか、又は f2 関数の値が 42 以 上である。 試験液②(100min-1) 標準製剤及び試験製剤が 15 分以内に平均 85%以上溶出するか、又は 15 分におけ る試験製剤の平均溶出率が標準製剤の平均溶出率±15%の範囲にある。 試験結果 フェキソフェナジン塩酸塩OD錠60mg「KN」の溶出挙動は各試験液において標準製剤 と類似していることが確認された。 図4 フェキソフェナジン塩酸塩OD錠60mg「KN」の溶出挙動における類似性 (試験製剤及び標準製剤の平均溶出率の比較) 試験液①:pH1.2 パドル法 50min-1 試験液②:pH6.5 パドル法 50min-1 試験液③:pH6.8 パドル法 50min-1 試験液④:水 パドル法 50min-1 試験製剤(フェキソフェナジン塩酸塩 OD 錠 60mg「KN」) 標準製剤(OD 錠、60mg) n=12
試験液②:pH6.5 パドル法 100min-1 表4 フェキソフェナジン塩酸塩OD錠60mg「KN」の溶出挙動における類似性 (試験製剤及び標準製剤の平均溶出率の比較) 試験条件 試験製剤 (フェキソフェナジン塩酸塩OD錠60mg「KN」) 標準製剤 (OD錠、60mg) 判定 方法 回転数 試験液 判定時点 平均溶出率(%) 平均溶出率(%) 溶出試験法 (パドル法) 50min-1 ① pH1.2 5分 43.7 32.2 適合 120分 60.1 53.5 ② pH6.5 5分 53.8 39.2 適合 90分 92.6 85.2 ③ pH6.8 5分 46.9 39.1 適合 360分 82.6 84.7 ④ 水 5分 69.8 55.1 適合 180分 82.2 85.2 100min-1 ② pH6.5 15分 91.5 97.8 適合 (n=12) <公的溶出試験への適合性:日本薬局方に基づく溶出試験> フェキソフェナジン塩酸塩錠30mg「KN」: 日本薬局方医薬品各条に定められたフェキソフェナジン塩酸塩錠の溶出規格に適合してい ることが確認されている。 試験条件 日局溶出試験法(パドル法) 条件:回転数 50min-1 試験液:水、900mL 溶出規格:30分間の溶出率は80%以上である。 試験結果 30分間の溶出率は98.5~100.5%であり、規格に適合した(n=6)。
フェキソフェナジン塩酸塩錠60mg「KN」: 日本薬局方医薬品各条に定められたフェキソフェナジン塩酸塩錠の溶出規格に適合してい ることが確認されている。 試験条件 日局溶出試験法(パドル法) 条件:回転数 50min-1 試験液:水、900mL 溶出規格:30分間の溶出率は80%以上である。 試験結果 30分間の溶出率は97.1~100.2%であり、規格に適合した(n=6)。 <公的溶出試験への適合性:品質再評価に基づく溶出試験> フェキソフェナジン塩酸塩OD錠30mg「KN」、フェキソフェナジン塩酸塩OD錠60mg「KN」: 本剤は品質再評価未指定である。
8.生物学的試験法
該当しない9. 製剤中の有効成分の確認試験法
1) フェキソフェナジン塩酸塩錠 30mg「KN」、フェキソフェナジン塩酸塩錠 60mg「KN」: (日局フェキソフェナジン塩酸塩錠の確認試験による。) 紫外可視吸光度測定法 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 紫外可視吸光度測定法10. 製剤中の有効成分の定量法
1) フェキソフェナジン塩酸塩錠 30mg「KN」、フェキソフェナジン塩酸塩錠 60mg「KN」: (日局フェキソフェナジン塩酸塩錠の定量法による。) 本品 20 個をとり、薄めた酢酸(100)(17→10000)V/5mL を加え、錠剤が崩壊するまで振り混 ぜる。次に液体クロマトグラフィー用アセトニトリル 3V/5mL を加え、よく振り混ぜた後、 1mL 中にフェキソフェナジン塩酸塩(C32H39NO4・HCl)約 1.2mg を含む液となるように液体クロ マトグラフィー用アセトニトリル/薄めた酢酸(100)(17→10000)混液(3:1)を加えて正確に VmL とする。この液 15mL を正確に量り、移動相を加えて正確に 50mL とする。さらにこの液 5mL を正確に量り、移動相を加えて正確に 100mL とし、孔径 0.45μm 以下のメンブランフィ ルターでろ過する。初めのろ液 2mL を除き、次のろ液を試料溶液とする。別にフェキソフ ェナジン塩酸塩標準品(別途「フェキソフェナジン塩酸塩」と同様の方法で水分を測定して おく)約 45mg を精密に量り、液体クロマトグラフィー用アセトニトリル/薄めた酢酸(100) (17→10000)混液(3:1)に溶かし、正確に 200mL とする。この液 20mL を正確に量り、移動 相を加えて正確に 250mL とし、標準溶液とする。試料溶液及び標準溶液 20μL ずつを正確 にとり、液体クロマトグラフィーにより試験を行う。それぞれの液のフェキソフェナジン のピーク面積AT及びASを測定する。本品 1 個中のフェキソフェナジン塩酸塩(C32H39NO4・HCl)の量(mg)=MS× AT × V AS 750 MS:脱水物に換算したフェキソフェナジン塩酸塩標準品の秤取量(mg) 検 出 器:紫外吸光光度計 測定波長:220nm フェキソフェナジン塩酸塩 OD 錠 30mg「KN」、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 液体クロマトグラフィー(内標準法) 内標準溶液:パラオキシ安息香酸ベンジルの希釈液溶液(6→10000) 検 出 器:紫外吸光光度計 測定波長:220nm
11.力価
該当しない12.混入する可能性のある夾雑物
1) 参考:日局フェキソフェナジン塩酸塩の純度試験 (2)類縁物質による。 混在される主な類縁物質がEPに記載されている。個々の類縁物質の許容限度は0.1%以下に 規定されている。13.注意が必要な容器・外観が特殊な容器に関する情報
該当しない14.その他
該当しないⅤ.治療に関する項目
1.効能又は効果
アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症、アトピー性皮膚炎) に伴うそう痒2.用法及び用量
フェキソフェナジン塩酸塩錠 30mg「KN」、フェキソフェナジン塩酸塩錠 60mg「KN」: 通常、成人にはフェキソフェナジン塩酸塩として 1 回 60mg を 1 日 2 回経口投与する。 通常、7 歳以上 12 歳未満の小児にはフェキソフェナジン塩酸塩として 1 回 30mg を 1 日 2 回、12 歳以上の小児にはフェキソフェナジン塩酸塩として 1 回 60mg を 1 日 2 回経口投与 する。 なお、症状により適宜増減する。 フェキソフェナジン塩酸塩 OD 錠 30mg「KN」、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 通常、成人にはフェキソフェナジン塩酸塩として 1 回 60mg を 1 日 2 回経口投与する。 通常、7 歳以上 12 歳未満の小児にはフェキソフェナジン塩酸塩として 1 回 30mg を 1 日 2 回、12 歳以上の小児にはフェキソフェナジン塩酸塩として 1 回 60mg を 1 日 2 回経口投与 する。 なお、症状により適宜増減する。 <用法・用量に関連する使用上の注意> 本剤は口腔内で崩壊するが、口腔粘膜から吸収されることはないため、唾液又は水で飲 み込むこと。[「適用上の注意」の項参照]3.臨床成績
(1)臨床データパッケージ 該当資料なし (2)臨床効果 該当資料なし (3)臨床薬理試験 該当資料なし (4)探索的試験 該当資料なし (5)検証的試験 1)無作為化並行用量反応試験 該当資料なし 2)比較試験 該当資料なし3)安全性試験 該当資料なし 4)患者・病態別試験 該当資料なし (6)治療的使用 1)使用成績調査・特定使用成績調査(特別調査)・製造販売後臨床試験(市販後臨床試験) 該当資料なし 2)承認条件として実施予定の内容又は実施した試験の概要 該当しない
Ⅵ.薬効薬理に関する項目
1.薬理学的に関連ある化合物又は化合物群
6) 抗ヒスタミン薬:ジフェンヒドラミン塩酸塩、クレマスチンフマル酸塩、ホモクロルシ クリジン塩酸塩、ヒドロキシジン塩酸塩、ヒドロキシジンパモ酸塩、 シプロヘプタジン塩酸塩、プロメタジン塩酸塩、アリメマジン酒石酸 塩、トリプロリジン塩酸塩、d-クロルフェニラミンマレイン酸塩、ク ロルフェニラミンマレイン酸塩、オキサトミド、ベポタスチンベシル 酸塩、オロパタジン塩酸塩、メキタジン、フマル酸エメダスチン、ア ゼラスチン塩酸塩、エピナスチン塩酸塩、セチリジン塩酸塩、レボセ チリジン塩酸塩、ケトチフェンフマル酸塩、エバスチン、ロラタジン2.薬理作用
(1)作用部位・作用機序1) 抗原抗体反応に伴って起こる肥満細胞からのヒスタミンなどのケミカルメディエーター の遊離を抑制すると共に、ヒスタミンの H1作用に拮抗することにより、アレルギー症 状を緩和する。 (2)薬効を裏付ける試験成績 該当資料なし 以下の報告がある。3) ①ヒスタミン H1受容体拮抗作用: フェキソフェナジン塩酸塩は、ヒスタミン H1受容体においてヒスタミンと拮抗し、 モルモット摘出回腸標本及び気管標本におけるヒスタミン誘発収縮を抑制した(10-7 ~3×10-6M)。また、全身投与でモルモット・ヒスタミン誘発気道収縮及び皮膚反応 を抑制した。なお、フェキソフェナジン塩酸塩にはアドレナリン、アセチルコリン、 セロトニン及びタキキニンの各受容体ならびに L 型カルシウムチャネルに対する親 和性は認められていない。 ②I 型アレルギー病態モデル動物に対する作用: フェキソフェナジン塩酸塩は、モルモット抗原誘発アレルギー性鼻炎、ラット受身 皮膚アナフィラキシー(PCA)反応、ラット抗原誘発全身性アナフィラキシー反応及 びモルモット抗原誘発即時型喘息反応を抑制した。 ③好酸球、炎症性サイトカインおよび細胞接着分子に対する作用: フェキソフェナジン塩酸塩は、季節性アレルギー性鼻炎患者由来鼻粘膜上皮細胞培 養上清により誘発されるヒト好酸球の遊走を 10-6M 以上で抑制した。また、季節性 アレルギー性鼻炎患者由来鼻粘膜上皮細胞を活性化ヒト好酸球とともに培養したと きに培養上清中に遊離される炎症性サイトカインである IL-8 及び GM-CSF をそれぞ れ 10-6M 以上及び 10-9M 以上で抑制し、細胞接着分子である sICAM-1 を 10-9M 以上で 減少させた。 ④ケミカルメディエーター遊離抑制作用: フェキソフェナジン塩酸塩は、健康成人の末梢血好塩基球及びアトピー性皮膚炎患 者の末梢血白血球からの抗ヒト IgE 抗体刺激によるヒスタミン遊離を抑制した(10-6 ~10-5M)。また、モルモット抗原誘発即時型喘息モデルにおいて気管支肺胞洗浄液 (BALF)中のロイコトリエン量を減少させた。(3)作用発現時間・持続時間 該当資料なし
Ⅶ.薬物動態に関する項目
1.血中濃度の推移・測定法
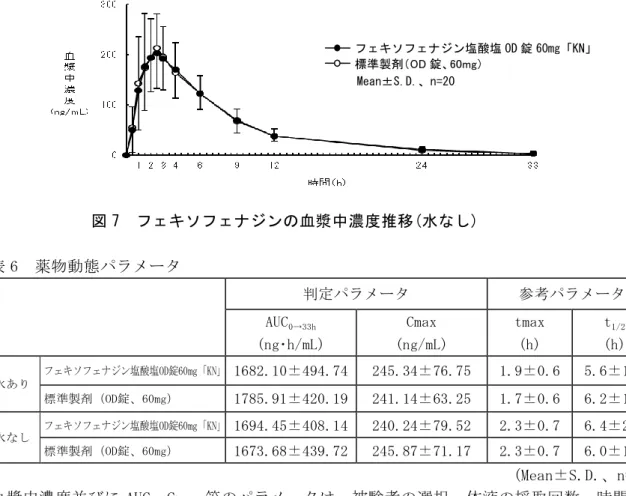
(1)治療上有効な血中濃度 該当資料なし (2)最高血中濃度到達時間7) 薬 剤 名 投与量 Tmax(hr) フェキソフェナジン塩酸塩錠60mg「KN」 60mg 2.1±0.9 (Mean±S.D.、n=30) 薬剤名 投与量 tmax(h) フェキソフェナジン塩酸塩OD錠60mg「KN」 水あり 60mg 1.9±0.6 水なし 60mg 2.3±0.7 (Mean±S.D.、n=20) (3)臨床試験で確認された血中濃度7) <生物学的同等性試験> フェキソフェナジン塩酸塩錠30mg「KN」: フェキソフェナジン塩酸塩錠30mg「KN」は「含量が異なる経口固形製剤の生物学的同 等性試験ガイドライン(平成12年2月14日付)医薬審第64号」及び「後発医薬品の生物 学的同等性試験ガイドライン等の一部改正について(平成18年11月24日付)薬食審査 発第1124004号」に基づき、フェキソフェナジン塩酸塩錠60mg「KN」を標準製剤とした 溶出試験の結果、溶出挙動は同等と判定され、生物学的に同等とみなされた。 フェキソフェナジン塩酸塩錠 60mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第487号(平成9年12月22日付) 、 後発医薬品の生物学的同等性試験ガイドライン等の一部改正について 薬食審査発第 1124004号(平成18年11月24日付) フェキソフェナジン塩酸塩錠 60mg「KN」と標準製剤を、それぞれ 1 錠(フェキソフェナ ジン塩酸塩 60mg)を、2 剤 2 期のクロスオーバー法により健康成人男子に水 150mL とと もに絶食単回経口投与した。第Ⅰ期と第Ⅱ期の休薬期間は 7 日間とした。治験薬の投与 前、投与 0.5、1、1.5、2、2.5、3、4、6、9、12、24 及び 50 時間後の計 13 時点に採血 を行い、LC/MS/MS 法にて血漿中未変化体濃度を測定し、得られた薬物動態パラメータ ( AUC 、 Cmax ) に つ い て 90% 信 頼 区 間 法 に て 統 計 解 析 を 行 っ た 結 果 、 log(0.8) ~ log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(図 5、表 5)。 図 5 フェキソフェナジンの血漿中濃度推移 Mean±S.D.、n=30 フェキソフェナジン塩酸塩錠 60mg「KN」 標準製剤(錠剤、60mg)表 5 薬物動態パラメータ 判定パラメータ 参考パラメータ AUC0→50hr (ng・hr/mL) Cmax (ng/mL) Tmax (hr) T1/2 (hr) フェキソフェナジン塩酸塩錠60mg「KN」 2009.54±612.80 292.11±109.34 2.1±0.9 6.8±4.1 標準製剤(錠剤、60mg) 1983.90±641.41 277.42±123.74 2.4±0.8 6.2±3.2 (Mean±S.D.、n=30) 血漿中濃度並びに AUC、Cmax 等のパラメータは、被験者の選択、体液の採取回数・時間等 の試験条件によって異なる可能性がある。 フェキソフェナジン塩酸塩OD錠30mg「KN」: フェキソフェナジン塩酸塩 OD 錠 30mg「KN」は「含量が異なる経口固形製剤の生物学的 同等性試験ガイドライン(平成 12 年 2 月 14 日付)医薬審第 64 号」及び「後発医薬品 の生物学的同等性試験ガイドライン等の一部改正について(平成 18 年 11 月 24 日付) 薬食審査発第 1124004 号」に基づき、フェキソフェナジン塩酸塩 OD 錠 60mg「KN」を標 準製剤とした溶出試験の結果、溶出挙動は同等と判定され、生物学的に同等とみなされ た。 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」: 後発医薬品の生物学的同等性試験ガイドライン 医薬審第487号(平成9年12月22日付)、 後発医薬品の生物学的同等性試験ガイドライン等の一部改正について 薬食審査発第 0229第10号(平成24年2月29日付) フェキソフェナジン塩酸塩 OD 錠 60mg「KN」と標準製剤を、それぞれ 1 錠(フェキソフ ェナジン塩酸塩 60mg)を、2 剤 2 期のクロスオーバー法により健康成人男性に水あり及 び水なしで絶食単回経口投与した。第Ⅰ期と第Ⅱ期の休薬期間は 7 日間とした。治験薬 の投与前、投与 0.5、1、1.5、2、2.5、3、4、6、9、12、24 及び 33 時間後の計 13 時点 に採血を行い、LC/MS/MS 法にて血漿中未変化体濃度を測定し、得られた薬物動態パラ メータ(AUC、Cmax)について 90%信頼区間法にて統計解析を行った結果、log(0.8)~ log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(図 6、図 7、表 6)。 図 6 フェキソフェナジンの血漿中濃度推移(水あり) Mean±S.D.、n=20 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」 標準製剤(OD 錠、60mg)
図 7 フェキソフェナジンの血漿中濃度推移(水なし) 表 6 薬物動態パラメータ 判定パラメータ 参考パラメータ AUC0→33h (ng・h/mL) Cmax (ng/mL) tmax (h) t1/2 (h) 水あり フェキソフェナジン塩酸塩OD錠60mg「KN」 1682.10±494.74 245.34±76.75 1.9±0.6 5.6±1.6 標準製剤(OD錠、60mg) 1785.91±420.19 241.14±63.25 1.7±0.6 6.2±1.6 水なし フェキソフェナジン塩酸塩OD錠60mg「KN」 1694.45±408.14 240.24±79.52 2.3±0.7 6.4±2.1 標準製剤(OD錠、60mg) 1673.68±439.72 245.87±71.17 2.3±0.7 6.0±1.7 (Mean±S.D.、n=20) 血漿中濃度並びに AUC、Cmax 等のパラメータは、被験者の選択、体液の採取回数・時間等 の試験条件によって異なる可能性がある。 (4)中毒域 該当資料なし (5)食事・併用薬の影響 「Ⅷ.安全性(使用上の注意等)に関する項目 7.相互作用」の項参照 以下の報告がある。 食事の影響1) 健康成人男子にクロスオーバー法で、空腹時及び食後(高脂肪食)にフェキソフェナジン 塩酸塩製剤120mgを単回経口投与時、空腹時に比べ食後投与時のAUC0-∞及び最高血漿中濃 度はそれぞれ15%及び14%減少した(外国人データ)。 併用薬の影響2) 健康成人男子:併用により血漿中フェキソフェナジン濃度が約2倍に上昇した場合でも QTc等の心電図を含め安全性に問題はみられなかった。Cmaxが承認用量投与時の10倍以上 となる条件下でも同様に心電図への影響はなく、有害事象の増加も認められず、薬物相 互作用による血漿中フェキソフェナジン濃度の上昇に起因する安全性への影響はないと 考えられた。 ①エリスロマイシン 18例にフェキソフェナジン製剤1回120mg1日2回とエリスロマイシン1回300mg1日4回7 日間併用して反復経口投与時、血漿中フェキソフェナジンのCmaxはフェキソフェナジ ン製剤単独投与時の約2倍に上昇。一方、血漿中エリスロマイシン濃度には、併用に よる影響はなかった。海外における同様の試験(19例)でも、血漿中フェキソフェナジ Mean±S.D.、n=20 フェキソフェナジン塩酸塩 OD 錠 60mg「KN」 標準製剤(OD 錠、60mg)
ン濃度は同程度上昇。この血漿中フェキソフェナジン濃度上昇の機序は動物試験から、 P糖蛋白阻害によるフェキソフェナジンのクリアランス低下及び吸収率増加に起因す ると推定。 ②ケトコナゾール 23例にフェキソフェナジン製剤1回120mg1日2回とケトコナゾール製剤400mg1日1回7日 間併用して反復経口投与時、血漿中フェキソフェナジン濃度はフェキソフェナジン製 剤単独投与時の約2倍に上昇、血漿中ケトコナゾール濃度には、併用による影響はな かった(外国人データ)。血漿中フェキソフェナジン濃度上昇の機序はエリスロマイシ ンと同様と推定。 ③オメプラゾール 23例にフェキソフェナジン製剤120mgの投与11時間前と1時間前にオメプラゾール製剤 をそれぞれ40mg及び20mgを単回投与時、フェキソフェナジン製剤の薬物動態に影響は なかった(外国人データ)。 ④水酸化アルミニウム・水酸化マグネシウム含有製剤 22例にフェキソフェナジン製剤120mgの投与15分前に水酸化アルミニウム・水酸化マ グネシウム含有製剤を単回投与時、フェキソフェナジンのAUC0-30及びCmaxはフェキソ フェナジン製剤単独投与時の約40%減少(外国人データ)。これは水酸化アルミニウム ・水酸化マグネシウムがフェキソフェナジンを一時的に吸着することで吸収量が減少 することによると推定。 (6)母集団(ポピュレーション)解析により判明した薬物体内動態変動要因 該当資料なし