機能的磁気共鳴画像法を用いた脳機能計測方法とその応用
7
0
0
全文
(2) 430. 理学療法学 第 43 巻第 5 号. 理前のボクセルサイズは平均で 55 mm3 程度であると いわれる. 13). 。そこには,5.5 百万のニューロン,2.2 ‒ 5.5. 3. × 10 個 の シ ナ プ ス, そ し て 22 km の 樹 状 突 起 と 220 km の軸索が含まれている計算になる. 13). 。. 3.神経活動と BOLD fMRI これまで述べたように,fMRI による脳機能解析では 神経活動に続く二次的シグナルを解析している手法であ るがゆえに,その使用と理解に注意を要する。ここでは, 興奮性シナプス. 抑制性シナプス. 図 1 興奮性シナプス(左)と抑制性シナプス(右)で生じ る局所電流.興奮性シナプスでは,伝達物質が放出さ れた後にシナプス間隙で膜の脱分極を生じ,その部分 に電流が流入する.抑制性シナプスでは電流の向きが 逆になる.. その理由となる生理学的背景を簡単に解説する。 グルコースの代謝と局所的な脳血流(cerebral blood flow:以下,CBF)の変化は緊密に関連しており,脳血 流の増加は直接的に神経活動に伴うものだと考えられて 2) きた 。神経活動の増加は,脳局所における酸素代謝率. (cerebral metabolic rate of O2: 以 下,CMRO2) の 上 昇を誘導する。この酸素消費の増大を補うために CBF, の計測方法には,活動電位記録や脳磁図などがある。. 脳血液量(cerebral blood volume:以下,CBV)も上. 神経活動においては酸素によって糖を解糖するエネル. 昇する。酸素消費を表す CMRO2 の上昇と血液量であ. ギー産生が必要であり,組織低酸素化が起こる。さらに,. る CBV の増加は deoxy-Hb 量の増加に作用し,血流量. ニューロンの活動に伴う種々の生化学的変化(一酸化窒. である CBF の増加は単位体積あたりの deoxy-Hb 量の. 素やプロスタグランジン)などが影響して比較的速やか. 減少に作用する。BOLD コントラストは deoxy-Hb 量. 9). に血管拡張反応が生じ ,血流が増大する。これは,神. の増減に依存するため,結果的に CMRO2,CBF,CBV. 経の興奮現象である一次シグナルに対して,0.5 から数. の 3 つのパラメータにより決定されることとなる. 6). 。. 秒の遅れで発生する時間的にゆっくりした現象であり,. CMRO2 を CBF と動脈血中の酸素濃度で除したものは,. 8) 二次シグナルと呼ばれる 。fMRI で計測される情報は,. 酸 素 摂 取 率(oxygen extraction fraction:OEF) と 呼. この二次シグナルによるものである。. ばれ,BOLD コントラストの指標のひとつとされる。一 般的に,脳活動に伴う CBF の増加(単位体積あたりの. 2.神経−血管カップリング. deoxy-Hb 量の減少)は,CMRO2,CBV の増加(deoxy-. 神経活動は,大まかには局所電位と活動電位とに分け. Hb 量の増加)に比較してはるかに大きいため,単位体. られる. 10). 。局所電位は神経入力によるシナプス活動で. 11) 生じると考えられており(図 1) ,活動電位は細胞体 10). 2). 積あたりの deoxy-Hb 量は低下する(図 4) 。たとえば, ヒトに対する視覚刺激や体性感覚刺激中の脳血流量と酸. 。これらの活動をす. 素代謝率とを解析した研究では,刺激の結果として毛細. るニューロンに加えて,さらにグリア細胞の一種である. 血管と静脈の酸素化レベルが増加し(oxy-Hb の流入に. アストロサイト,血管平滑筋細胞および血管内皮細胞. よる),deoxy-Hb 量の上昇を誘導する CMRO2 の増加を. が,微小循環制御ユニット(neurovascular unit)を構. 相対的に抑制することが報告された. が閾値を超えることで発生する. 2). 14)15). 。Deoxy-Hb. 成している 。ニューロンの活動に伴ってグルコースの. 量の低下は,不均一磁場の低減となるため,周辺組織の. 消費と ATP の産生過程が進行する。この過程がアスト. T2* 緩和時間が延長し,T2* 強調画像の信号強度を上昇. ロサイト(図 2 の黄色)とニューロン(図 2 の緑色)近. させる。これらの現象が BOLD コントラストの成因と. 12). くでの毛細血管(図 2 右下の黒色). およびその上流. にある動脈が拡張する現象へとつながる. 2). 。図 3 では,. 6) 考えられている 。. このように,概念的レベルにおいて,神経活動と. ニューロンと血管との構築学的関係について,皮質第Ⅱ. BOLD fMRI 信号との関係について適切に理解しておき. 層から灰白質までのうち(図 3 左) ,第Ⅳ層の横断面か. たい。これまでの研究によって,BOLD fMRI 応答は神. ら表層にむかって 3 次元的に再構築して示されている. 経活動のうちで局所電流よりもスパイク活動によるとす. 13). (図 3 右) 。この緊密ともいえる神経−血管カップリ. る研究,むしろ局所電流によるとする研究,両方がかか. ング現象が,血液に基盤をおく fMRI アプローチを理解. わるとする研究に分けられ,論争が続いているとされ. 2). 2). するキーポイントとなるとされる 。. る. ち な み に,fMRI の 典 型 的 な 分 解 能 は 平 面 で 9 ∼. BOLD コントラスト法は,このような生理学的バッ. 2. 16 mm ,スライス厚が 5 ∼ 7 mm とされ,フィルタ処. 。. クグラウンドの下に脳賦活を検出している。MR 信号が.
(3) 機能的磁気共鳴画像法を用いた脳機能計測方法とその応用. 図 2 ニューロン,アストロサイト,血管,ニューロピル の構築学的関係 ラット運動皮質の 2 光子励起顕微鏡による写真(左図).カ ルシウム指示薬がロードされたニューロン(緑) ,アストロ サイト(黄),そしてニューロピル(樹状突起,軸索,シ ナプス終末,アストロサイトの突起などを含む細胞体の間) が示されている.右図は脳軟膜の表面から 250 μ m 下方部分 の切片.すなわち,XZ 面である左図の白点線部分を XY 面 でみると,右図のようになる。右下は右上と同じ関心領域 の写真であるが,染色された細胞を解説するためにマーキ ングしてある.白丸で囲まれているのがニューロン,白い 四角で囲まれたのがアストロサイト,青丸(黒い背景)が 血管内腔,そして灰色部分はニューロピルである(文献 12 より).. 431. 図 3 1 つのボクセルに含まれる神経細胞と血管 左は,サルの視覚野における血管網の X 線微小断層像(X-ray microtomography) .血管径が色分けされて示されている. 軟膜血管を除いて皮質表面が最上部に描出されており,下 方が灰白質である(左側のパネルはニッスル染色切片).血 管の密度は 3%にすぎず(中央写真の白い部分) ,血管の間 隔は平均で 50 μ m である.この間隔が血液から酸素が拡散 する距離であると考えることができる.そこに密集してい るのは,ニューロン,シナプス,そしてグリア細胞である(右 上図).中央上図には,ニューロンタイプを具体的に図示さ れている(赤:錐体細胞,濃い青;抑制性バスケット細胞, など) (文献 13 より転載).. 図 4 神経活動に対する血管応答と想定される MR 関連の変数 2) 血流中の酸素化ヘモグロビン(赤点)と脱酸素化ヘモグロビン(青点)が動脈を通り,細動脈,毛 細血管,細静脈,そして最後に静脈へと至る過程を示す.酸素は,oxy-Hb を介して運ばれて血管 外の組織へ拡散し,そこで代謝にかかわる.刺激前のベースライン状態で,血中酸素飽和度は動脈 においてほぼ 100%であり,一方で静脈では 60%以内である.正確な値は,生理的状況に応じて変 化する.神経活動の増加は血流速度増加と血管拡張のトリガとなる.血液潅流が増加した結果,酸 素消費割合の増加で必要とされる量を超え,結果的により高い酸素化ヘモグロビンレベル,および 低い脱酸素化ヘモグロビンレベルとなり,毛細血管と静脈の酸素化レベルが増加する.. 増加するにもかかわらず deoxy-Hb が増加する例も報告. がないこと,②空間分解能と時間分解能に優れているこ. 7) されており ,あくまでも間接的に神経活動を捉えてい. 16) とである(表 1) 。. ることに留意しなければならない. 6). 。. 非侵襲的脳機能計測としての特徴. BOLD fMRI 信号の解析方法 fMRI を用いた実験は,ある認知・行動機能に関連す. 神経活動の二次的シグナルを計測する方法として. る脳活動部位を推定することを第一の目的としているこ. ポジトロンエミッション断層撮影(positron emission. とが多い。この項では,取得した fMRI 画像から脳機能. tomography:以下,PET)がある。fMRI が PET に比. 部位を特定するまでの画像解析の基本的な流れとその概. べて優れている点は,①血中に外来物質を注入する必要. 要を説明する。.
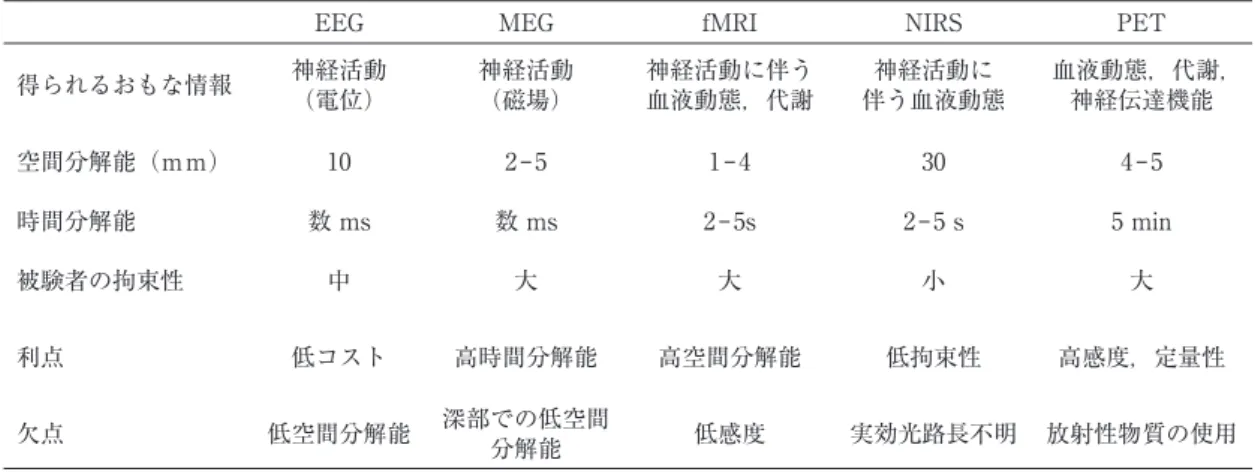
(4) 432. 理学療法学 第 43 巻第 5 号. 表 1 非侵襲的脳機能計測法の比較 EEG. MEG. fMRI. NIRS. PET. 得られるおもな情報. 神経活動 (電位). 神経活動 (磁場). 神経活動に伴う 血液動態,代謝. 神経活動に 伴う血液動態. 血液動態,代謝, 神経伝達機能. 空間分解能(mm). 10. 2‒5. 1‒4. 30. 4‒5. 数 ms. 数 ms. 2 ‒ 5s. 2‒5 s. 5 min. 中. 大. 大. 小. 大. 利点. 低コスト. 高時間分解能. 高空間分解能. 低拘束性. 高感度,定量性. 欠点. 低空間分解能. 深部での低空間 分解能. 低感度. 実効光路長不明. 放射性物質の使用. 時間分解能 被験者の拘束性. 文献 16 より改変. 1.前処理 まず,fMRI 画像解析は“前処理”と呼ばれる一連の 時・空間的画像補正手続きから開始される. 17). 。fMRI 画. 像は 1 断面毎に数十∼数百 ms で撮像され,数秒かけて 1 ボリューム画像(関心脳領域の全断面画像)が得られ る。そのため,最初と最後に撮像された断面画像間には 数秒の時間的隔たりがあることになる。この時間的隔た りを解消するため,1 ボリュームに含まれるすべての断 面画像が時間的に同一時刻に撮像されたように補正する (slice timing correction) 。次に,心拍や呼吸などの体 動に伴ってわずかに変化する画像間の空間的位置を時系 列で一定になるよう補正する(realignment) 。さらに, 全断面画像の空間的位置を,個人毎に別途撮像された高 解像度の解剖学的構造画像,さらには国際的に定義され たテンプレート脳に合わせるよう補正する(coregister と normalization) 。これにより,個人間で同様の空間 的位置・形態・座標系をもった fMRI 画像が得られる ことになる。最後に,画像を平滑化し,上述した過程 では補正しきれない個人間の脳構造の違いを緩和する (smoothing)。 2.脳活動推定のための統計解析. 図 5 (A)実際に計測された fMRI BOLD 信号の一例. (B) 課題実行と安静の時系列を表す計画行列(課題実行を 1,安静を 0 としている)と,それに血液動態反応関数(右 上小パネル)を畳み込み積分した出力反応波形.一般 線形モデルを用いた統計解析では,BOLD 信号を従属 変数,推定された出力反応波形を説明変数として,両 変数の関係性の強さ(回帰係数)が求められる.. 次に,ブロックデザイン(例;“課題実行”と“安静” を繰り返す実験デザイン)を用いて取得された fMRI 画 像を例に,もっとも一般的な統計手法,すなわち一般線. 説明変数の差の 2 乗平均を最小にする最小自乗法を用. 形モデル(重回帰分析)を用いて課題に関連する脳機能. いて回帰係数を求める。これを fMRI 画像にあてはめ. 部位を推定するための統計解析手法を概説する。. たとき,各ボクセル(fMRI 画像を数 mm ∼ cm の立方. 一般線形モデルとは,統計モデルをたてて統計解析を. 体に分けたときの単位)の BOLD 信号を従属変数(図. 行う一手法であり,説明変数 X と従属変数 Y の間の関. 5-A),実験要因(課題実行・安静)を説明変数とする。. 係を線形式 1.1 で表現するモデルである。. 実際の説明変数には,課題実行と安静の時系列を表す計 画行列(実行時を 1,安静時を 0 とした行列)に脳血流. Y = Xβ + ∈. (1.1). の応答遅れを反映した血液動態反応関数を掛け合わせた 出力反応波形が用いられる(図 5-B) 。. β は回帰係数,ε は誤差である。ここから従属変数と. 次に,一般線形モデルで求められた各ボクセルの回帰.
(5) 機能的磁気共鳴画像法を用いた脳機能計測方法とその応用. 433. 係数 β に対して仮説検定を行う。β がゼロと異なること. 定の多重比較補正理論を用いた際にはクラスタサイズに. が示されれば,そのボクセルは課題実行に応じて線形に. も統計値が算出されるため,有意水準 5%のサイズを超. 応答すること,すなわち課題実行に対応した脳活動の生. えるクラスタを意味のある活動として見なすといった方. 起が推定できる。このとき,帰無仮説 H0 は,β = 0,コ. 法が採択されることが多い。. ントラスト(c;重みづけベクトル)は c =[1]とし,. ここで閾値設定の正誤についての結論をだすことは難. cβ = β となる。あるいは,ひとつの実験に要因が 2 種. しいが,fMRI 論文を読み進める際には,採用されてい. 類ある場合(回帰係数 β が 2 つ;[β A β B])において,. る統計閾値を確認したうえで結果・解釈の妥当性を慎重. β A β B が異なる(要因 A と B の間の脳活動に差がある). に判断する必要がある。. ことを示したい場合,H0 は β A ‒ β B = 0,コントラスト は c =[1 ‒ 1]となる。つまり,いずれにしても,帰無. 研究の実例. 仮説 H0 は cβ = 0(cβ は統計学的にゼロと有意に違わ. 1.認知課題を用いたブロックデザインの研究. ない)となる。この帰無仮説を基に,コントラストに応. 図 7 に,我々が過去に行ったブロックデザインによる. じた各ボクセルの統計値が求められる。. fMRI 実験のデザインを示す. その後,各被験者から得られた結果をより一般化する. たスクリーンに投影された動画を見ることによって(図. ため,複数人のデータを用いた集団解析を行う。各ボク. 7-A),自分がリアルタイムに運動しているかのような. 20). 。被験者の頭上におかれ. セルで推定された回帰係数 β の被験者間平均を算出し,. 自己運動錯覚を感じる条件(錯覚条件:self),単に他者. 帰無仮説 H0 を“平均値は統計学的にゼロと有意に違わ. の手が運動しているところを観察している条件(観察条. ない”とした 1 標本の t 検定を実施する。その結果,統. 件:other),そして意味のないシンボルを眺めている安. 計閾値を下回るボクセルが課題実行に応じた脳部位とし. 静時条件を繰り返し行い(図 7-B) ,錯覚条件における. て推定されることになる。この統計値に応じてボクセル. 脳活動の特徴を検出した研究である。. を色づけすることで,学術論文等で呈示される脳活動カ. 結果として示された脳活動部位は,観察条件と錯覚条. ラーマップが完成する。. 件とを比較して錯覚条件で有意に高い結果となったもの. な お, 一 連 の 画 像 解 析 手 続 き は,SPM(Statistical. である(図 8) 。実験方法と結果についての詳細は,他. 18). Parametric Mapping) 19). Library). や FSL(FMRIB Software. に代表される画像分析ソフトウェアを通じ. て比較的手軽に行えるようになっている。. の解説. 21‒23). または原著 20)を参照されたい。このよう. な認知科学的実験を行うために重要な点として強調して おきたいのは,心理学的に標的としている状況が課題中 に真に得られているかどうかを十分に担保する必要があ. 3.統計解析に伴う多重比較問題. ることである。そのためには,心理物理学的実験を,事. 上述した解析手続きには,各ボクセル(典型的な脳画. 前にいかに精密に再現性をもって行うかの努力が必要で. 像は万単位のボクセルを含む)に対して統計検定を繰り. あり,その点に注意しながら論文を読む必要がある。た. 返すことで生じる多重比較の問題が伴う,ということを. とえば我々の実験では,視覚刺激によって自己運動錯覚. 認識しておく必要がある。この場合の多重比較の問題と. が誘導されることがポイントであった。このために,事. は,検定が繰り返されると帰無仮説 H0 が棄却される確. 前の実験室内実験においてトレーニング期間を設け,さ. 率(有意水準)が増大する統計的第一種過誤のことを指. らに錯覚を知覚するかどうか,そしてそのタイミングを. す。すなわち,本来は活動がないのに活動があると採択. 実験的にあらかじめ確認して一定の基準を満たした場合. されてしまう過誤のことである。この過誤の発生を極力. に MRI 実験へ進むよう工夫した。また,MRI スキャナー. 抑えるため,fMRI 統計解析には,任意に厳しい統計閾. 内でも同レベルの強度で錯覚感が誘導されたことを検査. 値を設定するか,ある種の多重比較補正理論に基づいて. しており,脳活動を計測している最中の心理状況が担保. 算出された補正閾値を用いた手続きが採用される。任意. されていたことを原著論文内に示している. 20). 。. に閾値を設定する場合には,慣例として 0.5%や 0.1%の 有意水準を採用することが多い。また,多くの画像分析. 2.安静時の BOLD 信号に着目した研究. ソフトウェアに実装されている多重比較補正法を適用し. これまでの多くの fMRI 研究は,認知・行動課題を課. た場合,その有意水準は心理実験で一般的に用いられて. すことで,標的とする機能の脳機能局在を明らかにする. いる 5%が採用されることが多い(図 6)。. ことを目的としてきた。このとき,“安静時”の脳活動. また,どの程度のつながったボクセルの集団(クラス. 動態はいわゆる比較対照条件として利用されることが多. タサイズ)を意味のある活動として見なすか,という点. かった。一方で,特別な課題を遂行していない安静状態. にも注意すべきである。多くの場合,任意の数値(例;. であっても脳内神経活動はある周波数帯域をもった揺ら. クラスタサイズ 50 以上)を設定するか,あるいは,特. ぎを呈するという事実から. 24). ,安静状態であっても脳.
(6) 434. 理学療法学 第 43 巻第 5 号. A. B. 多重比較補正あり. 多重比較補正なし. 多重比較補正なし. 有意水準 < 5%. 有意水準 < 0.1%. 有意水準 < 0.5%. 厳しい. 緩い. 図 6 統計閾値を変更したときの脳活動の広がりの違い. 色づけされた領域は,左側手指での系列タッピング 運動を 16 秒間行っている最中に活動が推定された脳 部位を表している. (A)は脳表面のボクセルのみ赤 くマッピングしたもの, (B)は脳深部のボクセルも 含めて脳表面にマッピングしたものである.有意水 準が厳しくなると推定される脳活動領域が縮小し, 逆に有意水準が緩くなるとその脳領域が広がってい るのが見てとれる.. 図 8 図 7 に示す実験で検出された,錯覚条件で統計学的に 有意に高いとされた脳神経回路.この実験デザインで は, 視覚入力とは独立して“自己運動錯覚”の知覚によっ て活動した部位と解釈できる(文献 20 より).. では意味のある重要な活動が営まれているという考えが 広まりつつある。こうした背景のもと,安静時の BOLD 信号変化に着目した fMRI 研究が近年増えつつある たとえば,Albert ら. 26). 25). 。. は,運動学習が成立した前後. で安静時 BOLD 信号を計測し,その活動動態に変化が 生じることを明らかにしている。すなわち,学習成立後 は当該運動課題実行に関連する前頭−頭頂回路と小脳 回路内に含まれるボクセルの BOLD 信号間の相関関係 が増強する(脳領域間の機能結合強度の増加)ことを示 している。学習を通じて獲得された記憶は約 6 時間後を ピークとして徐々に固定化されるプロセスを経ることが 心理物理的実験によって明らかになっているため 図 7 (A)実験室における心理物理実験の設定. 錯覚を知覚したらスイッチを押すことで 錯覚が誘導される反応時間を計測した. MRI 実験では,スイッチ以外の環境は基 本的に実験室の設定と同様であった(文 献 20 より).. 27)28). ,. 学習成立後の脳領域間機能結合の強化は,運動記憶の固 定化に関する神経処理過程を反映したものであるとの 解釈がなされている。こうした解釈を支持するように, Della-Maggiore ら. 29). の研究では,運動学習後の安静時. 脳活動の変化を 15 分後,1,3,5.5,24 時間後とさらに 細かく追跡し,当該運動課題実行に関連する脳領域間の 機能結合強度が 5.5 時間後をピークに増強することを示 している。 fMRI 計測によって得られる安静時 BOLD 信号と,そ の相関関係から推定される脳領域間機能結合の機能的意 味合いについては未だ議論がなされている段階ではある が,これらの研究成果は,行動として表に現れない脳内 での重要な神経プロセスを探るひとつの指標として安静 時 BOLD 信号が利用できる可能性を示している。. 図 7 (B)ブロックデザインの一例.
(7) 機能的磁気共鳴画像法を用いた脳機能計測方法とその応用. ま と め 本稿では,磁気共鳴画像法をもちいた脳活動計測につ いて,物理的および生理学的原理について概念的に理解 されることを念頭に解説した。非常に多くの実験研究が 示されるなかにおいて,読み手が実験プロトコルおよび 統計学的処理の妥当性と限界に注意しながら結論を解釈 することは重要である。さらに今後も,異なる数理情報 科学的手法によって脳神経回路活動が解析されることが 予測されるが,まずは,生データがもつ意味について理 解したい。 文 献 1)Ogawa S, Lee TM: Magnetic resonance imaging of blood vessels at high fields: in vivo and in vitro measurements and image simulation. Magn Reson Med. 1990; 16(1): 9‒18. 2)Kim SG, Ogawa S: Biophysical and physiological origins of blood oxygenation level-dependent fMRI signals. J Cereb Blood Flow Metab. 2012; 32(7): 1188‒1206. 3)工 藤 興 亮:MRI の 基 礎 原 理 と 安 全 性. 臨 床 画 像.2011; 27(5): 588‒597. 4)Small SA, Heeger DJ: カ ン デ ル 神 経 科 学 5ed.In: Kandel ER, Schwartz JH, et al., (eds):認知の機能的イメー ジング.メディカル・サイエンス・インターナショナル, 東京,2014,pp. 421‒436. 5)荒木 力:MRI 完全解説.影山博之(編) ,秀潤社,東京, 2010. 6)福永雅喜:fMRI の検出原理と脳機能解釈― BOLD 信号の 起源とその意味.INNERVISION.2015; 30(9): 7‒9. 7)山本 徹:デオキシヘモグロビンと fMRI 信号の多様な関 係.脈管学.2007; 47(1): 5‒10. 8)飯島敏夫,高橋俊光,他:FMRI の基礎と活用上の注意点. 認知神経科学.2000; 2(2): 112‒117. 9)宮内 哲:脳を測る.心理学評論.2013; 56: 414‒454. 10)小原昭作:標準生理学 5ed.興奮と伝導.豊田順一,熊 田 衛,他(編),医学書院,東京,2003. 11)Eccles J: The Synapse. Sci Am. 1965; 212: 56‒66. 12)Kerr JND, Greenberg D, et al.: Imaging input and output of neocortical networks in vivo. Proc Natl Acad Sci USA. 2005: 102(39): 14063‒14068. 13)Logothetis NK: What we can do and what we cannot do with fMRI. Nature. 2008; 453(7197): 869‒878.. 435. 14)Fox PT, Raichle ME: Focal physiological uncoupling of cerebral blood flow and oxidative metabolism during somatosensory stimulation in human subjects. Proc Natl Acad Sci U S A. 1986; 83(4): 1140‒1144. 15)Fox PT, Raichle ME, et al.: Nonoxidative glucose consumption during focal physiologic neural activity. Science. 1988; 241(4864): 462‒464. 16)亀井裕孟,小川誠二:高次脳機能計測法の現状と今後.神 経進歩.2003; 47(6): 878‒881. 17)Friston KJ, Ashburner J, et al.: Statistical Parametric Mapping: The Analysis of Functional Brain Images. Academic Press, 2007. 18)SPM. http://www.fil.ion.ucl.ac.uk/spm/. (2016 年 06 月 23 日引用) 19)FSL. http://fsl.fmrib.ox.ac.uk/fsl/fslwiki/. (2015 年 10 月 29 日引用) 20)Kaneko F, Blanchard C, et al.: Brain regions associated to a kinesthetic illusion evoked by watching a video of one’s own moving hand. PLOS ONE. 2015; 10(8): e0131970. 21)金子文成,稲田 亨,他:四肢の視覚誘導性運動錯覚に係 る生理学的機序とリハビリテーションへの応用.バイオメ カニズム.2016; 23: 97‒106. 22)金 子 文 成: 拡 張 現 実 に よ る 自 己 運 動 錯 覚 の 誘 導.The Japanese Journal of Rehabilitation Medicine. 2016; 53(3): 234‒240. 23)金子文成:運動錯覚.神経科学の最前線とリハビリテー ション.里宇明元,牛場潤一(編),医歯薬出版,東京, 2015,pp. 173‒176. 24)Buzsáki G, Draguhn A: Neuronal oscillations in cortical networks. Science. 2004; 304(5679): 1926‒1929. 25)Raichle ME: The restless brain. Brain Connect. 2011; 1(1): 3‒12. 26)Albert NB, Robertson EM, et al.: The resting human brain and motor learning. Curr Biol. 2009; 19(12): 1023‒ 1027. 27)Walker MP, Brakefield T, et al.: Dissociable stages of human memory consolidation and reconsolidation. Nature. 2003; 425(6958): 616‒620. 28)Shadmehr R, Brashers-Krug T: Functional stages in the formation of human long-term motor memory. J Neurosci. 1997; 17(1): 409‒419. 29)Della-Maggiore V, Villalta JI, et al.: Functional Evidence for Memory Stabilization in Sensorimotor Adaptation: A 24-h Resting-State fMRI Study. Cereb Cortex. 2015; 8: 1‒10..
(8)
図
関連したドキュメント
機能(目的) 設定方法 画面で見るマニュアル 参照先.. 便利な使い方.
ク ロー ン型
Acute effects of static stretching on the hamstrings using shear elastic modulus determined by ultrasound shear wave elastography: Differences in flexibility between
研究計画書(様式 2)の項目 27~29 の内容に沿って、個人情報や提供されたデータの「①利用 目的」
・Syslog / FTP(S) / 共有フォルダ / SNMP
[r]
平成 14 年( 2002 )に設立された能楽学会は, 「能楽」を学会名に冠し,その機関誌
Recent developments in neuroimaging methodologies have increased our understanding of neuropsychological functions and networks, and have shown that the right frontal lobe