286
最近の研究から
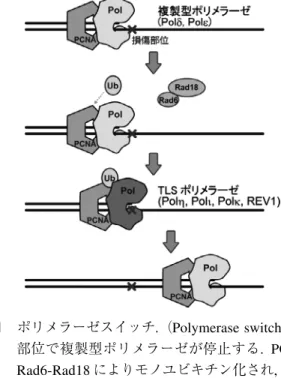
1.はじめに 生物は細胞分裂の過程で染色体 DNA を正確かつ迅速に 複製する必要がある. そのために真核細胞は, DNA 上に 損傷を感知すると, チェックポイント機構により細胞周期 の進行を一時停止し, 損傷の修復を試みる. しかし転写や 複製中に損傷が生じた場合, 細胞としては転写や複製が最 優先であるため, DNA 損傷による転写や複製の停止を免 れる機構を備えている. DNA 損傷による複製停止を解消 する方法の 1 つが損傷乗り越え DNA 合成(TLS)である. 複製型ポリメラーゼである Polδ/Polεは, 鋳型鎖上の損 傷塩基に遭遇すると, それを乗り越えて DNA を合成する ことができない. この場合, TLS ポリメラーゼと呼ばれる 特殊な DNA ポリメラーゼが複製型ポリメラーゼに代わっ て一時的に DNA を合成する(図1). TLSポリメラーゼは 複製忠実度は低いが, 損傷塩基にとりあえず塩基を対合し DNAを合成することができる. その後再び複製型ポリメ ラーゼが DNA 合成を行い, 複製は完了する. 複製型ポリメラーゼと TLS ポリメラーゼの交換(ポリ メラーゼスイッチ)の足場と考えられているタンパク質が 増殖細胞核抗原(PCNA)である. PCNA は二本鎖 DNA を 囲む 3 量体の環状構造をとり, DNA ポリメラーゼを複製 フォークに保持する. TLS ポリメラーゼの Polη, Polκ, Polι も PCNA と相互作用する. PCNA の K164 は DNA 損傷部 位で Rad6-Rad18 によりモノユビキチン化され, ポリメラ ーゼスイッチが促進されると考えられている.1)-4) TLSポ リメラーゼはその種類により乗り越えられる損傷が異な る. Polηは T-T シクロブタン型ピリミジンダイマー, Polκ はベンゾ[a]ピレンジオールエポキシドの付加したグア ニン, Polιは 6-4 光産物を主に乗り越えるが,5)-10) 損傷で 停止した複製フォークにどのようにして特定の TLS ポリ メラーゼがリクルートされるかはわかっていない. PCNAと相互作用するタンパク質は数多く存在し, 8 ア ミノ酸残基からなる共通配列(PIP-box)をもつ.11),12) それ らは PCNA の N ドメインと C ドメインをつなぐループ (Inter-Domain Connecting Loop ;IDCL)およびその近傍 の領域と相互作用する. これまでにヒト PCNA との複合損傷乗り越え型
DNA
ポリメラーゼと
PCNA
の相互作用
横浜市立大学大学院生命ナノシステム科学研究科 菱木麻美, 橋本 博
Asami HISHIKI and Hiroshi HASHIMOTO: Structural Basis for Novel Interactions
between Human TLS Polymerases and PCNA
TransLesion Synthesis(TLS)is a DNA damage tolerance mechanism that allows continued DNA synthesis, even in the presence of damaged DNA templates. In response to DNA damage, TLS polymerases are recruited to replication forks via interactions with ubiquitinated Proliferating Cell Nuclear Antigen(PCNA)involving PCNA-interacting protein box(PIP-box)and ubiquitin-binding domains(UBDs). We now report the first crystal structures of human PCNA in complex with three TLS polymerase peptides containing the non-canonical PIP-box. TLS polymerases interact with PCNA in different ways, both from one another and from canonical PIP-box peptides. Furthermore, we discuss these TLS polymerases interact with ubiquitinated PCNA.
図1 ポリメラーゼスイッチ.(Polymerase switch.)損傷 部位で複製型ポリメラーゼが停止する. PCNA は Rad6-Rad18によりモノユビキチン化され, 複製型 ポリメラーゼは TLS ポリメラーゼに交換される. TLSポリメラーゼが損傷塩基をバイパスすると, 複製型ポリメラーゼが DNA 合成を再開する.
体構造が報告されているペプチドおよびタンパク質は, 細 胞周期調節因子 p21 のペプチド, 複製や修復に関与するヌ
クレアーゼの 1 つである flap endonuclease-1(FEN1), Polδ
のサブユニットの 1 つである p66 のペプチド, 人工的に設
計された Pogo-Ligase(PL)ペプチドの 4 種類である.13)-16)
これらの PIP-box はすべて共通配列 Q-x-x-h-x-x-a-a(h :
M/I/L, a: F/Y)を含む典型的な PIP-box である(図2a). p21, FEN1, p66, PLの典型的な PIP-box と PCNA との相 互作用は非常に類似している. まずは PCNA と典型的な PIP-boxの相互作用の例として, PCNA-p21 ペプチド複合 体の構造を紹介する(図3).13) PIP-boxの position 1(p1) に位置する Q144 は, 側鎖が直接または水分子を介して PCNAのポケット(Q-pocket)と複数の水素結合を形成す る. p4-p8 は 310へリックスを形成し, p4, p7, p8 の疎水性 および芳香族側鎖は, PCNA の疎水性ポケット(ソケット) と疎水性相互作用をする. p21 と FEN1 は PIP-box に続く 領域が長く, PCNA の IDCL と逆平行β-シートを形成する.
興味深いことに TLS ポリメラーゼ Polη, Polκ, Polιの
PIP-boxは保存された Q をもたず, 典型的な PIP-box では
ない(図2a). また, Polηと Polκの PIP-box はそれぞれの
C末端部分に存在するのに対し, Polιの PIP-box は中央部
分に位置する(図2b). さらに Polη, Polκ, Polιは 1 ∼ 2 個
のユビキチン結合ドメイン(UBZ または UBM)をもち, ユビキチン化 PCNA のユビキチン部分と相互作用する (図2b).17),18) われわれは, ポリメラーゼスイッチのメカニズムを解明 する第一歩として, 非典型的な PIP-box を含む TLS ポリメ ラーゼのペプチドと PCNA との複合体構造を X 線結晶構 造解析により明らかにした.19) 本稿では TLS ポリメラーゼ の非典型的な PIP-box と PCNA との相互作用を解説する. さらに, 結晶構造を基に, ユビキチン化 PCNA と TLS ポリ メラーゼの相互作用モデルを提唱する. 2.実験 2.1 PCNA の発現と精製
PCNAは, プラスミド pT7-PCNA で大腸菌 BL21(DE3)
を形質転換し大量発現させた. 菌体を超音波破砕後, 陰イ オン交換カラム, 疎水性相互作用カラム, ゲルろ過カラム を用いて高純度に精製した. 2.2 結晶化と X 線結晶構造解析 さまざまなペプチドで共結晶化を検討した結果, 以下の 3種類のペプチドを用いて PCNA との共結晶化に成功し た(Polηの N 末端の C, Polκの C 末端 PLTH は結晶化のた めの付加残基). 287
(a)
(b)
図2 PIP-boxの配列と TLS ポリメラーゼの構造模式図. (PIP-box sequence and schematic representation of TLS polymerases.)(a)h は疎水性アミノ酸, a は芳 香族アミノ酸. * は C 末端,( )内の数字はタン パク質の全長の残基数を示している.(b)Polηと Polκの PIP-box は C 末端付近, Polιの PIP-box は 中央部分に位置する. Polη, Polκ, Polιには 1 ∼ 2 カ 所のユビキチン結合ドメイン(UBZ または UBM) が存在する.図3 PCNA-p21ペプチド複合体の結晶構造.(Crystal structure of PCNA-p21 peptide complex.)PCNA は 3量体を形成する. 単量体は構造の類似した N ドメ インと C ドメインからなる. p21 ペプチドを黒色で 表示した. p21 の Q144(p1)の側鎖は PCNA の Q-pocketと直接または水分子を介した複数の水素結 合を形成する(①). 保存残基の M147(p4), F150 (p7), Y151(p8)の側鎖は PCNA と疎水性相互作 用し(②), p21の PIP-box に続く領域は PCNA の IDCLと逆平行β-シートを形成する(③).
Polη (CKRPRPEGMQTLESFFKPLTH) Polκ (PKHTLDIFFKPLTH) Polι (ALNTAKKGLIDYYLMPSLSTTSR) PCNAとの共結晶化はハンギングドロップ蒸気拡散法 で行い, 得られた結晶の回折強度データを SPring-8 および Photon Factoryで収集した. 回折データをプログラム HKL200020) で処理し, 構造解析はプログラム MOLREP21) を用いた分子置換法で行った. モデル分子として近年報告 されたヒト PCNA の構造を用いた.16) プログラム COOT22)
を用いて PCNA-Polη, PCNA-Polκ, PCNA-Polιのモデル構
築と修正を行い, プログラム CNS,23) REFMAC24) を用い て構造精密化を行った. 2.3 プルダウンアッセイ GSTタグを付加した全長 Polηまたは全長 Polιを, 野生 型または変異体 PCNA と混合し, グルタチオンセファロ ース 4B(GS4B)レジンに吸着させた. レジンを洗浄後, 還 元型グルタチオンを含むバッファーで溶出させて SDS-PAGEを行い, 抗 GST 抗体および抗 PCNA 抗体を用いた ウェスタンブロッティングで検出した. 3.結果 3.1 全体構造
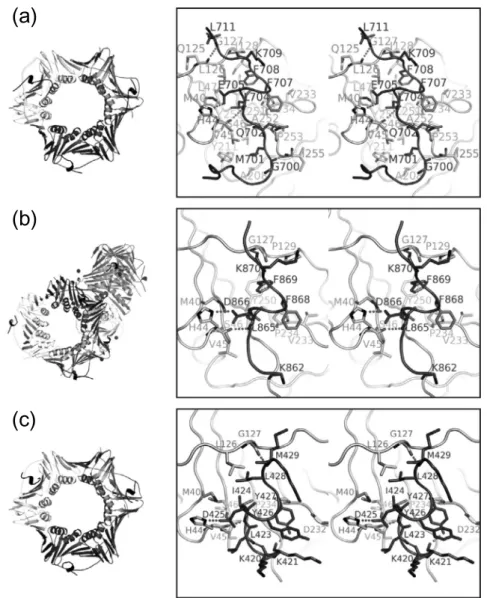
PCNA-Polη, PCNA-Polκ, PCNA-Polιは, これまでの報 告と同様に PCNA のサブユニットが head-to-tail に配置さ れた 3 量体の環状構造を形成し, すべての PCNA サブユニ ットの IDCL 近傍に TLS ポリメラーゼペプチドが結合し ていた(図4a-c左). PCNA-Polκペプチド複合体は, 非対 称単位中に Polκペプチドの結合した 3 量体 PCNA が 2 分 子存在していた(図4b左). 3.2 PCNA と Polηの相互作用(図 4a 右) Polηの M701(p1)は典型的な PIP-box の Q と同様に, 側 288
(a)
(b)
(c)
図4 PCNA-Polηペプチド複合体(a), PCNA-Polκペプチド複合体(b), PCNA-Polιペプチド複合体(c)の構造. (Structure of PCNA bound to the Polη(a), Polκ(b), or Polι(c)peptide.)それぞれ全体構造(左)とペプチド 結合部位のステレオ図(右)を示した. TLS ポリメラーゼのペプチドを黒色, TLS ポリメラーゼと PCNA との静 電相互作用を点線でを示した.
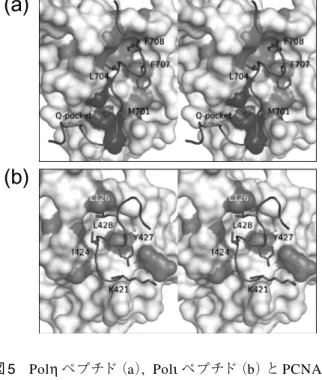
鎖が PCNA の Q-pocket 内に入り込んでいた. しかし, 典型 的な PIP-box の Q が Q-pocket 内で水素結合を形成してい たのに対し, M701(p1)の側鎖は Q-pocket と疎水性相互 作用をしていた. 興味深いことに M701Q 変異体は野生型 よりも PCNA に強く結合した(非掲載). L704(p4), F707 (p7), F708(p8)は典型的な PIP-box と同様に 310へリック スを形成し, PCNA のソケットに入り込み, 疎水性相互作 用をしていた(図5a). PIP-boxに続く領域は, K709 の主 鎖カルボニル酸素が PCNA の G127 の主鎖アミド窒素と, L711の主鎖アミド窒素が PCNA の Q125 の主鎖カルボニ ル酸素とそれぞれ水素結合していた. 3.3 PCNA と Polκの相互作用(図 4b 右) 野生型の Polκペプチドでは複合体の結晶は得られなか ったが, C 末端に Polηの C 末端 4 残基(PLTH)を付加し たペプチド(PKHTLDIFFKPLTH)を用いたところ, PCNA との共結晶化に成功した. K862(p1)の側鎖は Q-pocket と 相互作用せず, ディスオーダーしていた. K の側鎖は Q や Mよりも大きく, Q-pocket 内に入り込むことができない と考えられる. L865(p4), F868(p7), F869(p8)は 310へリ ックスを形成し, 側鎖は PCNA-Polηなどの複合体構造と 同様にソケットと疎水性相互作用をしていた. PIP-box に 続く領域では, K870 の主鎖カルボニル酸素が PCNA の G127の主鎖アミドと水素結合を形成していた. Polκペプ チドの C 末端に付加した PLTH の 4 残基は PCNA と相互 作用していなかった. 3.4 PCNA と Polιの相互作用(図 4c 右)
Polιの PIP-box はこれまで 420-KKGLIDYY-427 である
と考えられていた.25),26) しかし構造解析の結果, Polιの PIP-boxは 421-KGLIDYYL-428 であることが明らかにな った. K421(p1)の側鎖は PCNA-Polκの構造と同様に Q-pocketと相互作用していなかったが, 主鎖カルボニル酸素 が Y427(p7)の側鎖のヒドロキシル基と分子内水素結合 を形成していた. 興味深いことに Y427F 変異は PCNA と の相互作用を著しく弱めた(非掲載). また, K420 の主鎖 カルボニル酸素は L423(p3)の主鎖アミド窒素と水素結 合を形成し, β-ターン様構造を形成していた. I424(p4), Y427(p7), L428(p8)はほかの構造と同様 に 310へリックスを形成していたが, L428(p8)の側鎖は ソケットに入り込まず, PCNA の L126 の側鎖と疎水性相 互作用し, これまで知られている構造とは異なっていた (図5b). さらに Polιは PIP-box に続く領域が長いにもかかわら ず, IDCL との水素結合は PIP-box 直後の M429 の主鎖ア ミド窒素と PCNA の G127 の主鎖カルボニル酸素との間 の 1 カ所のみであった. この水素結合様式はこれまでに報 告されている典型的な PIP-box の構造とは異なっていた. 3.5 保存されたイオンペア
結晶構造から, Polιの PIP-box は 420-KKGLIDYY-427
ではなく, 421-KGLIDYYL-428 であることが明らかとな った. その結果を基に, アミノ酸配列を比較すると, TLS ポリメラーゼの p5 には酸性残基が保存されていることが
示された(図2a). それらの酸性残基, Polηの E705(p5),
Polκの D866(p5), Polιの D425(p5)の側鎖はすべて PCNA
の H44 の側鎖とイオンペアを形成していた(図4).
GST-Polη, GST-Polιと PCNA の野生型または H44A 変異体と のプルダウンアッセイを行った結果, PCNA H44A 変異 体は, 野生型と比較して Polηや Polιとの相互作用が弱く なった(図6 レーン 1-4). 289
(a)
(b)
図5 Polηペプチド(a), Polιペプチド(b)と PCNA と の疎水性相互作用.(Hydrophobic interaction of the Polη(a)or Polι(b)peptide with PCNA.) PCNAを白色の表面図で示し, Polη(a), Polι(b) と疎水性相互作用しているアミノ酸残基を灰色で 示した. Polη, Polιはリボン図で表示し, PIP-box の保存残基の側鎖をスティックで示した. Polηの M701(p1)の側鎖は PCNA の Q-pocket(a 濃灰色 部分)と疎水的な相互作用をしていた.
図6 Polη, Polιと PCNA との相互作用.(Physical inter-actions of the Polη and Polι with PCNA. )GST-Polη全長または GST-Polι全長と, PCNA 野生型 (WT)および H44A 変異体(H44A)のプルダウン アッセイを行い, それぞれ抗 GST 抗体または抗 PCNA抗体を用いて検出した. レーン 5-8 はコン トロール.
4.考察
4.1 複合体中の PIP-box の構造
これまで PCNA と PIP-box の複合体構造は 4 種類報告 されている. しかし, それらはすべての共通配列が保存さ れている典型的な PIP-box である. 今回初めて非典型的な
PIP-boxをもつ 3 種類の TLS ポリメラーゼ(Polη, Polκ, Polι)
と PCNA の相互作用を明らかにした. この結果, Polη,
Polκ, Polιの PIP-box はすべて異なる相互作用で PCNA と 結合し, さらにそれらの相互作用はすでに報告されている 典型的な PIP-box の相互作用とも異なっていた(図7). Polηの M701(p1)の側鎖は保存残基の Q とは異なり, Q-pocketと疎水的な相互作用をしていた. Polη M701Q 変異体は野生型よりも PCNA に強く結合する. p66(複製 型ポリメラーゼ Polδの PCNA 相互作用サブユニット)の p1には Q が保存されており, p1 における相互作用の違い
が, Polδと Polηの PCNA に対する親和性を決定する要因
の 1 つであると考えられる.
Polιの PIP-box は全長タンパク質の中央部分に位置し,
PIP-boxに続く領域が長いにもかかわらず, PCNA の IDCL
と広範囲な逆平行β-シートを形成しない. L428(p8)の側 鎖は芳香族残基と比較して小さいためソケットに入り込 めず, ソケットの入り口部分に位置する PCNA の L126 の 側鎖と疎水性相互作用していた. このことが直後の水素結 合様式を変え, p21 や FEN1 で見られたような IDCL との 逆平行β-シートの形成を妨げ, 溶媒に露出した構造にな ったものと考えられる. Polιは PCNA との水素結合が少な いにもかかわらず, Polηと同程度の強さで PCNA に結合
する. Polιの Y427F 変異が PCNA との相互作用を著しく
弱めることから, Polιでは分子内相互作用による内部構造
の安定化が PCNA との相互作用に寄与していると考えら れる.
4.2 ユビキチン化 PCNA と TLS ポリメラーゼの相互作 用モデル
PCNAの K164 は DNA 損傷部位で Rad6-Rad18 によるモ
ノユビキチン化を受け, それがポリメラーゼスイッチに必 要であると考えられている. PCNA は 3 量体を形成する ことから, 潜在的に 3 カ所のユビキチン化部位が存在す
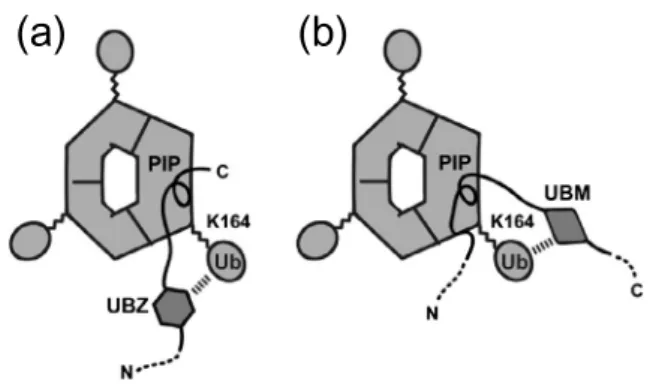
る. 前述のように, Polηと Polκは PIP-box の N 末端側に
UBZをもつ. したがって, これらの UBZ は PIP-box が結合
しているサブユニットのユビキチン部分と相互作用する
と考えられる(図8a). 一方, Polιは PIP-box の C 末端側
に UBM をもつ. 今回の構造解析の結果, Polιの PIP-box に
続く領域は PCNA の IDCL と逆平行β-シートを形成せず,
溶媒に露出していた. このことから Polιの UBM も
PIP-boxが結合しているサブユニットのユビキチン部分と相 互作用すると考えられる(図8b). よって, TLS ポリメラ ーゼは PIP-box と UBD の位置関係は異なるが, すべて PIP-boxが結合している PCNA と同じサブユニットのユビ キチン部分と相互作用すると考えられる. 5.おわりに 本研究では TLS ポリメラーゼの非典型的な PIP-box と PCNAとの相互作用を原子レベルで明らかにした. TLS ポ
リメラーゼの Polη, Polκ, Polιはそれぞれ異なる相互作用
で PCNA に結合し, これらの結合様式はこれまでに知ら れている典型的な PIP-box の相互作用とも異なっていた. PCNAはさまざまなタンパク質と相互作用し, その中には 非典型的な PIP-box をもつものも多い. したがって, TLS 290
(a)
(b)
図8 K164ユビキチン化 PCNA と Polη, Polκ(a), Polι (b)の相互作用モデル.(Proposed models of the in-teraction of K164-monoubiquitinated PCNA with Polη or Polκ(a)and Polι(b).)Ub はユビキチン. 図7 複合体でのペプチド構造の重ね合わせ.
(Superimposition of PIP-box structures bound to PCNA.)典型的な PIP-box をもつ p21 のペプチド と非典型的な PIP-box をもつ TLS ポリメラーゼ Polη, Polκ, Polιの PCNA との複合体での構造を 重ね合わせた. PIP-box の p1, p4, p7, p8 のみ側鎖 をスティックモデルで表示し, Polιのみ残基番号 を記した. N, C はそれぞれペプチドの N, C 末端 を示している.
ポリメラーゼとは異なるさまざまな相互作用様式が見つ かる可能性があり, PIP-box 相互作用の多様性とその構造 機能相関は大変興味深い. また, 先に述べたように, 細胞 がどのようにして損傷のある複製フォークに特定の TLS ポリメラーゼをリクルートするかはわかっていない. し たがって, 今後はポリメラーゼスイッチの制御機構を解 明するために, PCNA のユビキチン化と TLS におけるタ ンパク質間相互作用に関するさらなる構造生物学的研究 が求められる. 謝 辞 本研究は京都大学ウイルス研究所, 大森治夫准教授の グループとの共同研究によるものです. X 線回折強度デー タ収集は, SPring-8 BL41XU, BL38B1, 高エネルギー加 速器研究機構 PF-AR NW12A のビームライン担当の方に お世話になりました. 関係者の方々に厚く御礼申し上げ ます. 文 献
1)C. Hoege, B. Pfander, G. L. Moldovan, G. Pyrowolakis and S. Jentsch: Nature 419, 135 (2002).
2)P. Stelter and H. D. Ulrich: Nature 425, 188 (2003).
3)P. L. Kannouche, J. Wing and A. R. Lehmann: Mol. Cell 14, 491 (2004).
4)K. Watanabe, S. Tateishi, M. Kawasuji, T. Tsurimoto, H. Inoue and M. Yamaizumi: EMBO J. 23, 3886 (2004).
5)C. Masutani, R. Kusumoto, S. Iwai and F. Hanaoka: EMBO J.
19, 3100 (2000).
6)N. Suzuki, E. Ohashi, A. Kolbanovskiy, N. E. Geacintov, A. P. Grollman, H. Ohmori and S. Shibutani: Biochemistry 41, 6100 (2002).
7)Y. Zhang, F. Yuan, X. Wu, M. Wang, O. Rechkoblit, J. S. Taylor, N. E. Geacintov and Z. Wang: Nucleic Acids Res. 28, 4138 (2000).
8)Y. Zhang, X. Wu, D. Guo, O. Rechkoblit and Z. Wang: DNA Repair 1, 559 (2002).
9)A. Tissier, E. G. Frank, J. P. McDonald, S. Iwai, F. Hanaoka and R. Woodgate: EMBO J. 19, 5259 (2000).
10)A. Vaisman, E. G. Frank, S. Iwai, E. Ohashi, H. Ohmori, F. Hanaoka and R. Woodgate: DNA Repair 2, 991 (2003). 11)G. L. Moldovan, B. Pfander and S. Jentsch: Cell 129, 665
(2007).
12)E. Warbrick: BioEssays 20, 195 (1998).
13)J. M. Gulbis, Z. Kelman, J. Hurwitz, M. O’Donnell and J. Kuriyan: Cell 87, 297 (1996).
14)S. Sakurai, K. Kitano, H. Yamaguchi, K. Hamada, K. Okada, K. Fukuda, M. Uchida, E. Ohtsuka, H. Morioka, T. Hakoshima: EMBO J. 24, 683 (2005).
15)J. B. Bruning and Y. Shamoo: Structure 12, 2209 (2004).
16)G. Kontopidis, S. -Y. Wu, D. I. Zheleva, P. Taylor, C. McInnes, D. P. Lane, P. M. Fischer and M. D. Walkinshaw: Proc. Natl. Acad. Sci. U.S.A. 102, 1871 (2005).
17)M. Bienko, C. M. Green, N. Crosetto, F. Rudolf, G. Zapart, B. Coull, P. Kannouche, G. Wider, M. Peter, A. R. Lehmann, K. Hofmann and I. Dikic: Science 310, 1821 (2005).
18)B. S. Plosky, A. E. Vidal, A. R. de Henestrosa, M. P. Mclenigan, J. P. McDonald, S. Mead and R. Woodgate: EMBO J. 25, 2847 (2006).
19)A. Hishiki, H. Hashimoto, T. Hanafusa, K. Kamei, E. Ohashi, T. Shimizu, H. Ohmori and M. Sato: J. Biol. Chem. 284, 10552 (2009). 20)Z. Otwinowski, W. Minor: Methods Enzymol. 276, 307 (1997). 21)A. Vagin, A. Teplyakov: J. Appl. Crystallogr. 30, 1022 (1997). 22)P. Emsley and K. Cowtan: Acta Crystallogr. D Biol. Crystallogr.
60, 2126 (2004).
23)A. T. Brunger, P. D. Adams, G. M. Clore, W. L. DeLano, P. Gros, R. W. Grosse-Kunstleve, J. S. Jiang, J. Kuszewski, M. Nilges, N. S. Pannu, R. J. Read, L. M. Rice, T. Simonson and G. L. Warren: Acta Crystallogr. D Biol. Crystallogr. 54, 905 (1998). 24)G. N. Murshudov, A. A. Vagin and E. J. Dodson: Acta Crystallogr.
Sect D Biol. Crystallogr. 53, 240 (1997).
25)A. E. Vidal, P. Kannouche, V. N. Podust, W. Yang, A. R. Lehmann and R. Woodgate: J. Biol. Chem. 279, 48360 (2004).
26)L. Haracska, N. Acharya, I. Unk, R. E. Johnson, J. Hurwitz, L. Prakash and S. Prakash: Mol. Cell. Biol. 25, 1183 (2005). プロフィール
菱木麻美 Asami HISHIKI
横浜市立大学大学院生命ナノシステム科学研究科 Graduate School of Nanobioscience, Yokohama City University
〒 230-0045 横浜市鶴見区末広町 1-7-29
1-7-29 Suehiro, Tsurumi, Yokohama 230-0045, Japan e-mail: asami@tsurumi.yokohama-cu.ac.jp 最終学歴:横浜市立大学大学院国際総合科学研究 科 博士後期課程 博士(理学) 専門分野:構造生物学 現在の研究テーマ:損傷乗り越え DNA 合成にか かわる構造機能研究 橋本 博 Hiroshi HASHIMOTO 横浜市立大学大学院生命ナノシステム科学研究科 Graduate School of Nanobioscience, Yokohama City University
〒 230-0045 横浜市鶴見区末広町 1-7-29
1-7-29 Suehiro, Tsurumi, Yokohama 230-0045, Japan e-mail: hash@tsurumi.yokohama-cu.ac.jp 最終学歴:大阪大学大学院工学研究科 博士後期 課程 博士(工学) 専門分野:構造生物学 現在の研究テーマ:損傷乗り越え DNA 合成にか かわる構造機能研究 291