セレコキシブ
非臨床概要①
緒言及び薬理
アステラス製薬株式会社
フ ァ イ ザ ー 株 式 会 社
目次
2.6 非臨床概要
2.6.1 緒言
··· 12.6.2 薬理試験の概要文
··· 3 2.6.2.1 まとめ ··· 4 2.6.2.2 効力を裏付ける試験 ··· 8 2.6.2.3 副次的薬理試験 ··· 25 2.6.2.4 安全性薬理試験 ··· 26 2.6.2.5 薬力学的薬物相互作用試験 ··· 28 2.6.2.6 考察及び結論 ··· 29 2.6.2.7 引用文献 ··· 352.6.3 薬理試験概要表
··· 372.6 非臨床概要
2.6.1 緒言
セレコキシブは,アラキドン酸をプロスタグランジン(PG)G/H に変換するシクロオキシゲ ナーゼ(COX)の 2 つのアイソザイム1,2)であるCOX-1 及び COX-2 のうち,COX-2 を選択的に 阻害するコキシブ系抗炎症鎮痛薬であり,関節リウマチ(RA),変形性関節症(OA),腰痛症 等を効能・効果として開発されている.一方,臨床において汎用されている既存の非ステロイ ド性抗炎症薬(NSAID)は,COX-1 及び COX-2 の双方を非選択的に阻害する抗炎症鎮痛薬で ある1). アラキドン酸からCOX-1 又は COX-2 により変換された PGG/H は,各種合成酵素により更に PG 類及びトロンボキサン(TX)類に変換される1,2).COX-1 は,胃,血小板等多くの組織で構 成的に発現している酵素で,生理機能の恒常性維持に関与している 3).例えば,胃粘膜におい て合成されたPG は,胃酸等の種々の胃粘膜障害物質から胃粘膜を保護し4),血小板では,活性 化に伴って産生されたTXA2が血小板凝集に関与している 5).一方,COX-2 は細胞分裂促進物 質やサイトカイン,成長因子等の様々な炎症性メディエータ刺激により誘導され,産生された PG 類は RA 等における炎症/肉芽腫生成,痛覚過敏等の病態生理に関与していると考えられて
いる6~12).COX-2 は,正常なヒト関節滑膜ではほとんど認められないが,RA のほか,OA 患者
の滑膜でもその発現が免疫組織化学的に確認されており13,14),OA の病態進展にも密接に関与し ていることが示唆されている.したがって,慢性疼痛等における非選択的 COX 阻害薬である NSAID の有効性は,主に COX-2 阻害に基づき発現されているものと考えられる.しかしなが ら,非選択的COX 阻害薬は消化管粘膜障害あるいは血小板凝集阻害等の副作用を惹起すること から,臨床上問題となっており,これは非選択的COX 阻害薬が COX-2 とともに COX-1 を阻害 することによる生理機能の恒常性の破綻に起因すると考えられている15,16). コキシブ系抗炎症鎮痛薬セレコキシブは米国サール社(現米国ファイザー社)で合成され, 既存のNSAID にみられる非選択的な COX 阻害に基づく副作用を軽減できる RA 及び OA 治療 薬として期待される.今回の本邦申請にあたり,セレコキシブの薬理学的,薬物動態学的及び 毒性学的特徴を明らかにする目的で,酵素,細胞あるいは動物を用いて各種試験を行った. 引用文献
1) Smith WL, Dewitt DL. Prostaglandin endoperoxide H synthases-1 and-2. Adv Immunol 1996;62:167-215.
2) Vane JR, Bakhle YS, Botting RM. Cyclooxygenases 1 and 2. Annu Rev Pharmacol Toxicol 1998;38:97-120.
3) Seibert K, Masferrer JL. Role of inducible cyclooxygenase (COX-2) in inflammation. Receptor 1994;4:17-23.
5) Reilly M, Fitzgerald GA. Cellular activation by thromboxane A2 and other eicosanoids. Eur Heart J
1993;14(Suppl K):88-93.
6) Williams TJ, Morley J. Prostaglandins as potentiators of increased vascular permeability in inflammation. Nature 1973;246:215-7.
7) Williams TJ. Prostaglandin E2, prostaglandin I2 and the vascular changes of inflammation. Br J
Pharmacol 1979;65:517-24.
8) Moncada S, Ferreira SH, Vane JR. Prostaglandins, aspirin-like drugs and the oedema of inflammation. Nature 1973;246:217-9.
9) Ferreira SH. Prostaglandins, aspirin-like drugs and analgesia. Nat New Biol 1972;240:200-3. 10) Ferreira SH, Nakamura M, de Abreu Castro MS. The hyperalgesic effects of prostacyclin and
prostaglandin E2. Prostaglandins 1978;16:31-7.
11) Davies P, Bailey PJ, Goldenberg MM, Ford-Hutchinson AW. The role of arachidonic acid oxygenation products in pain and inflammation. Annu Rev Immunol 1984;2:335-57.
12) Seibert K, Zhang Y, Leahy K, Hauser S, Masferrer J, Perkins W, et al. Pharmacological and
biochemical demonstration of the role of cyclooxygenase 2 in inflammation and pain. Proc Natl Acad Sci USA 1994;91:12013-7.
13) Siegle I, Klein T, Backman JT, Saal JG, Nüsing RM, Fritz P. Expression of cyclooxygenase 1 and cyclooxygenase 2 in human synovial tissue : differential elevation of cyclooxygenase 2 in inflammatory joint diseases. Arthritis Rheum 1998;41:122-9.
14) Alaaeddine N, Di Battista JA, Pelletier JP, Cloutier JM, Kiansa K, Dupuis M, et al. Osteoarthritic synovial fibroblasts possess an increased level of tumor necrosis factor-receptor 55 (TNF-R55) that mediates biological activation by TNF-α. J Rheumatol 1997;24:1985-94.
15) Langman MJS, Weil J, Wainwright P, Lawson DH, Rawlins MD, Logan RFA, et al. Risks of bleeding peptic ulcer associated with individual non-steroidal anti-inflammatory drugs. Lancet
1994;343:1075-8.
16) Schafer AI. Effects of nonsteroidal antiinflammatory drugs on platelet function and systemic hemostasis. J Clin Pharmacol 1995;35:209-19.
2.6.2 薬理試験の概要文
本項で使用した用語及び略号を表2.6.2.1 に示す. 表2.6.2.1 用語及び略号一覧 用語及び略号 内容 CCD-27SK 細胞 ヒト皮膚線維芽細胞 COX シクロオキシゲナーゼ ED30 30%有効量 ED50 50%有効量 GABA ガンマアミノ酪酸 HEK293 細胞 ヒト胎児腎臓細胞 HERG ヒトether-a-go-go 関連遺伝子 IC50 50%抑制濃度 IL インターロイキン LPS リポポリサッカライド LT ロイコトリエン NSAID 非ステロイド性抗炎症薬 OA 変形性関節症 PG プロスタグランジン RA 関節リウマチ SC-60613 セレコキシブの代謝物(ベンジル水酸化体) SC-62807 セレコキシブの代謝物(カルボン酸体) TX トロンボキサン U-937 細胞 ヒト組織球性リンパ腫細胞 UD50 50%の動物が消化管粘膜障害を発現する用量2.6.2.1 まとめ
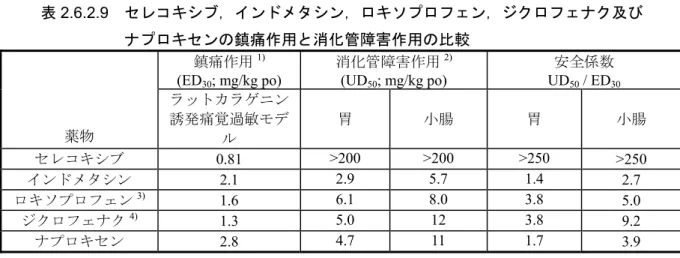
セレコキシブは選択的なシクロオキシゲナーゼ(COX)-2 阻害作用を有するコキシブ系抗炎症 鎮痛薬である.今回の本邦申請にあたり,本薬のCOX-2 阻害作用に基づく抗炎症及び鎮痛作用並 びに既存の非ステロイド性抗炎症薬(NSAID)等の非選択的 COX 阻害薬で問題となっている消 化管粘膜障害作用及び血小板凝集機能抑制作用を中心に検討した.以下に本薬の効力を裏付ける 試験,副次的薬理試験,安全性薬理試験及び薬力学的薬物相互作用試験の成績をまとめる. 効力を裏付ける試験 COX 阻害作用In vitro におけるセレコキシブの COX 阻害選択性は,組換えヒト COX 及びヒト由来細胞を用
いて評価した.組換えヒトCOX-1 及び COX-2 に対して,セレコキシブは濃度依存的な阻害作 用を示し,COX-1 及び COX-2 に対する 50%抑制濃度(IC50値)はそれぞれ15 及び 0.042 μM で
あり,COX-2 に対する阻害選択性を示した.一方,既存の NSAID であるインドメタシンは COX を阻害することが知られているが,COX-2 に対して阻害選択性を示さなかった.
COX-1 を発現しているヒト組織球性リンパ腫細胞 U-937 及びインターロイキン(IL)-1β刺激 によりCOX-2 を発現させたヒト皮膚線維芽細胞 CCD-27SK を用いた試験において,セレコキシ ブの COX-2 に対する阻害活性は COX-1 に対する阻害活性より 31 倍強かった.一方,既存の NSAID であるインドメタシン,ジクロフェナク,ロキソプロフェン-SRS(ロキソプロフェンの 活性代謝物),イブプロフェン及びナプロキセンはCOX-2 に対する阻害選択性を示さなかった. In vivo における COX 阻害選択性はラットカラゲニン空気嚢モデルを用いて評価した.セレコ キシブは1 mg/kg の経口投与から COX-2 由来と考えられている空気嚢内滲出液プロスタグラン ジン(PG)E2含量を有意に減少させたが,COX-1 由来と考えられている胃組織 PGE2含量に対
しては10 mg/kg においても影響を及ぼさなかった. セレコキシブのCOX 以外の各種受容体及び酵素に対する作用を検討したところ,セレコキシ ブは10 μM の濃度においてドーパミン取り込みを 60%抑制したが,その他の受容体及び酵素に 対しては顕著な影響を及ぼさなかった. 抗炎症作用 ラットカラゲニン誘発足浮腫モデルにおいて,セレコキシブ及び既存の NSAID であるインド メタシン,ジクロフェナク及びロキソプロフェンをそれぞれ単回経口投与したところ,いずれの 薬物も急性炎症である足浮腫を抑制するとともに炎症局所のPGE2産生を抑制した. ラットアジュバント関節炎モデルを用いて慢性炎症に対するセレコキシブ及び既存のNSAID の作用を検討した.セレコキシブ,ロキソプロフェン及びインドメタシンは,関節炎惹起後15 日目から1 日 2 回 10 日間反復経口投与したとき,いずれも足腫脹を用量依存的に抑制し,50% 有効量(ED50値)は,それぞれ0.42,1.7 及び 0.18 mg/kg/day であった.更に,同モデルの足組 織において,セレコキシブ及びインドメタシンは炎症による骨破壊を有意に抑制したが,ロキ ソプロフェンは有意な作用を示さなかった.なお,軟骨組織破壊に対してはセレコキシブ,ロ キソプロフェン及びインドメタシンはいずれも作用を示さなかった.
鎮痛作用 ラットカラゲニン誘発痛覚過敏モデルにおいて,セレコキシブ及び既存のNSAID であるイン ドメタシン,ジクロフェナク,ロキソプロフェン及びナプロキセンは急性の痛覚過敏成立後に 単回経口投与したとき,いずれも用量依存的な鎮痛作用を示し,30%有効量(ED30 値)はそれ ぞれ0.81,2.1,1.3,1.6 及び 2.8 mg/kg であった.また,同一動物から得られた脳脊髄液及び浮 腫足滲出液PGE2含量をいずれの薬物も有意に減少させた. ラットアジュバント関節炎モデルの慢性疼痛に対するセレコキシブ,ロキソプロフェン及び インドメタシンの作用を検討した.各薬物を関節炎惹起後15 日目から 1 日 2 回 10 日間反復経 口投与し,足根関節の屈曲による啼鳴頻度を指標に痛みの程度を判定したところ,いずれの薬 物も有意な鎮痛作用を示した. 代謝物のCOX 阻害作用 組換えヒトCOX-1 及び COX-2 に対して,セレコキシブの 2 種の代謝物 [ベンジル水酸化体 (SC-60613)及びカルボン酸体(SC-62807)] は,いずれも 100 μM の濃度で阻害活性を示さな かった. 消化管粘膜障害作用 セレコキシブ200 mg/kg をラットに単回経口投与したとき,胃及び小腸粘膜に障害は惹起さ れなかった.一方,既存のNSAID であるインドメタシン,ロキソプロフェン,ジクロフェナク 及びナプロキセンは用量依存的に消化管粘膜障害を惹起した.50%の動物が消化管粘膜障害を 発現する用量(UD50値)は胃粘膜障害においてはそれぞれ2.9,6.1,5.0 及び 4.7 mg/kg であり, 小腸粘膜障害においてはそれぞれ5.7,8.0,12 及び 11 mg/kg であった. 既存のNSAID はいずれも用量依存的かつ有意に胃組織 PGE2含量を減少させた.一方,セレ コキシブは,胃組織PGE2含量に対して200 mg/kg まで有意な影響を及ぼさなかった. ラットにおける1 日 2 回 10 日間の反復経口投与試験において,セレコキシブは 200 mg/kg/day までの用量で胃及び小腸粘膜に対する障害性を示さなかったが,インドメタシンは4 mg/kg/day で有意な小腸粘膜障害惹起作用を示した. 血小板機能に対する作用 セレコキシブ1~100 mg/kg を単回経口投与したラットの末梢血を採取した.この末梢血をカ ルシウムイオノフォアで刺激したときのトロンボキサン(TX)B2 産生は有意な影響を受けな かった.同様の方法でインドメタシンの影響を検討したところ,1 mg/kg で TXB2産生は有意に 抑制された. ヒト末梢血から得られた血小板において,セレコキシブは30 μM までアラキドン酸惹起血小 板凝集を抑制しなかった.一方,既存のNSAID であるロキソプロフェン-SRS,インドメタシン, ジクロフェナク及びイブプロフェンはいずれも臨床投与量における血漿中未変化体濃度を含む
副次的薬理試験 解熱作用 リポポリサッカライド(LPS)をラットの腹腔内に投与した体温上昇モデルにおいて,セレ コキシブ及び既存のNSAID であるインドメタシン,ジクロフェナク及びイブプロフェンを単回 経口投与したところ,用量依存的な体温上昇抑制作用が認められた.それぞれの薬物のED50値 は1.3,21,0.47 及び 2 mg/kg であった. 安全性薬理試験 セレコキシブ及び代謝物の安全性薬理試験 ラット4 日間反復経口投与試験において,セレコキシブ 20 mg/kg/day で,後肢握力及び自発 運動量の軽度低下が認められた.低用量ペンテトラゾール誘発痙攣に対しては5 mg/kg/day で抗 痙攣作用が,ヘキソバルビタール誘発睡眠に対しては5 及び 20 mg/kg/day で睡眠時間の短縮が 認められた.マウス単回経口投与試験において,セレコキシブ50 mg/kg 以上で酢酸誘発疼痛反 応の抑制が,150 mg/kg 以上で抗痙攣及び睡眠時間延長作用が認められた. 麻酔モルモットにおいて,セレコキシブの静脈内投与(12 mg/kg/15 min の負荷投与後,0.141 mg/kg/min の 45 分間維持投与)により収縮期血圧及び平均血圧の上昇が認められた.麻酔イヌ において,セレコキシブの静脈内投与(1.4 及び 4 mg/kg/15 min の負荷投与後,それぞれ 0.104 及び0.311 mg/kg/15 min の維持投与)により左室拡張期圧の軽度上昇及び 200 mg/kg の十二指腸 内投与で大腿動脈血流量の増加傾向が認められた. モルモット摘出乳頭筋の活動電位及びヒト胎児腎臓細胞(HEK293 細胞)に発現させたヒト ether-a-go-go 関連遺伝子(HERG)チャネルを介する K+電流に対し,セレコキシブ10 μM は影 響を及ぼさなかった. ラット4 日間反復経口投与試験において,セレコキシブ 100 mg/kg/day で垂涎及び血中コレス テロールの軽度上昇並びに尿中Na+及びCl-排泄量の減少が認められたが,尿量及び腎組織・消 化管の剖検では薬物に起因する変化は認められなかった.また,ラット単回経口投与試験では, 15 mg/kg 以上で尿量の減少及び尿浸透圧の上昇,50 mg/kg 以上で尿中 Na+及びCl-排泄量の減少 が認められたが一過性の変化であった. マウス及びラットにおいて,セレコキシブは消化管輸送能に影響しなかった. モルモット摘出回腸において,セレコキシブ 4 μM 以上で自動運動及び各種作動薬による収 縮の抑制作用が認められた. セレコキシブの主要代謝物であるSC-62807 は,15 及び 50 mg/kg の静脈内投与でマウスの一 般症状に対し影響を及ぼさなかった 薬力学的薬物相互作用試験 ニューキノロン系抗菌薬との併用による痙攣誘発作用 ニューキノロン系抗菌薬との併用において,検討した既存のNSAID のうちフェンブフェン,イ ンドメタシン及びナプロキセンは痙攣を誘発したが,セレコキシブは痙攣誘発作用を示さなかった.
考察及び結論
組換えヒトCOX-1 及び COX-2,あるいは COX-1 及び COX-2 発現細胞を用いた in vitro 試験 で明らかなように,今回用いた既存のNSAID は COX-1 に選択的又は両 COX に非選択的な阻害 作用を示した.一方,セレコキシブはヒト酵素及びヒト由来細胞のいずれにおいてもCOX-2 に 選択的阻害作用を示した.ラットカラゲニン空気嚢モデルを用いたin vivo 試験において,セレ
コキシブはCOX-2 蛋白発現が増加している炎症局所の PGE2産生を1 mg/kg の経口投与で有意
に抑制したが,COX-1 由来の胃組織 PGE2含量に対しては10 mg/kg の用量でも影響せず,セレ
コキシブが既存のNSAID とは異なり COX-2 阻害選択性を有することが in vitro 及び in vivo にお いて示された. COX-2 蛋白の発現を伴うラットカラゲニン誘発足浮腫モデル及びラットカラゲニン誘発痛覚 過敏モデルにおいて,セレコキシブは既存の NSAID と同様に有意な抗炎症,鎮痛作用を示し, 足滲出液及び脳脊髄液PGE2含量を減少させた.また,炎症像及び疼痛閾値低下がより重篤なラッ トアジュバント関節炎モデルにおいても,関節炎発症後の治療投与により既存の NSAID と同様 に,セレコキシブは有意な抗炎症,鎮痛作用を示したことから,セレコキシブは臨床においても 既存のNSAID と同程度の効果を示すことが示唆された. カラゲニン誘発痛覚過敏モデルにおける鎮痛作用のED30値と,消化管粘膜障害試験で得られ た胃粘膜障害のUD50値の乖離は,既存のNSAID においては 1.4~3.8 倍であったが,セレコキ シブにおいては250 倍以上であった.また,既存の NSAID はラット及びヒトの血小板機能抑制 作用を示したが,セレコキシブにはそのような作用は認められなかった.安全性薬理試験にお いて,比較的低用量から睡眠及び腎機能に対する影響が認められ,COX 阻害作用との関連性が 示唆されたが,いずれも臨床試験おいては高度の有害事象として認められておらず,本薬の臨 床使用上問題になる可能性は低いと考えられた. 以上の結果より,セレコキシブが既存のNSAID とは異なり消化管粘膜障害や出血時間延長等 の副作用に関して高い安全性を有することが示唆された. 各種薬効薬理試験において,セレコキシブは臨床用量(1 回用量 100~200 mg,1 日用量 200 ~400 mg/day)に相当する,あるいは臨床用量に近い用量で抗炎症,鎮痛及び解熱作用を示し, 非臨床及び臨床の薬効用量に乖離は認められなかった.また,既存のNSAID は,薬効用量とほ ぼ同じ用量範囲で消化管粘膜障害,血小板機能抑制作用を示したが,セレコキシブは薬効用量 で消化管粘膜及び血小板機能に影響を及ぼさなかった.したがって,セレコキシブは臨床にお いて抗炎症,鎮痛作用を示す用量においても,既存のNSAID に比べ副作用の発現の可能性の低 い薬物であると考えられた.
2.6.2.2 効力を裏付ける試験
2.6.2.2.1 COX 阻害作用
2.6.2.2.1.1 組換えヒト COX に対する阻害作用
··· 添付資料 4.2.1.1-1アラキドン酸添加によるPGE2の産生を指標に,組換えヒトCOX-1 及び COX-2 に対するセレ
コキシブ及びインドメタシンの阻害活性を検討し,両薬物のCOX 阻害の選択性を評価した.セ レコキシブ(0.001~100 μM)は COX-1 及び COX-2 を濃度依存的に阻害し,その IC50値はそれ
ぞれ15 及び 0.042 μM であった.IC50値の比(COX-1/COX-2)は 360 であり,セレコキシブは
COX-2 に選択的な阻害作用を示した.一方,既存の NSAID であるインドメタシン(0.001~100 μM)の COX-1 及び COX-2 における IC50値は,それぞれ0.82 及び 1.8 μM であり,COX-2 に対
する選択性は認められなかった(表2.6.2.2).
表2.6.2.2 セレコキシブ及びインドメタシンの組換えヒト COX-1 及び COX-2 に対する阻害作用
(添付資料4.2.1.1-1:組換えヒト COX-1,組換えヒト COX-2,表 1 から抜粋) COX 阻害活性(IC50,μM) COX 阻害選択性
薬物
組換えヒトCOX-1 組換えヒトCOX-2 COX-1/2 比1)
セレコキシブ 15±2.4 0.042±0.0066 360 インドメタシン 0.82±0.14 1.8±0.43 0.46 IC50値はアラキドン酸を基質としたときのPGE2産生抑制曲線から求め,4 回の試験結果の平 均値±標準誤差で表示した. 1):COX-2 における IC50値に対するCOX-1 における IC50値の比を示す.
2.6.2.2.1.2 ヒト由来細胞の COX に対する阻害作用
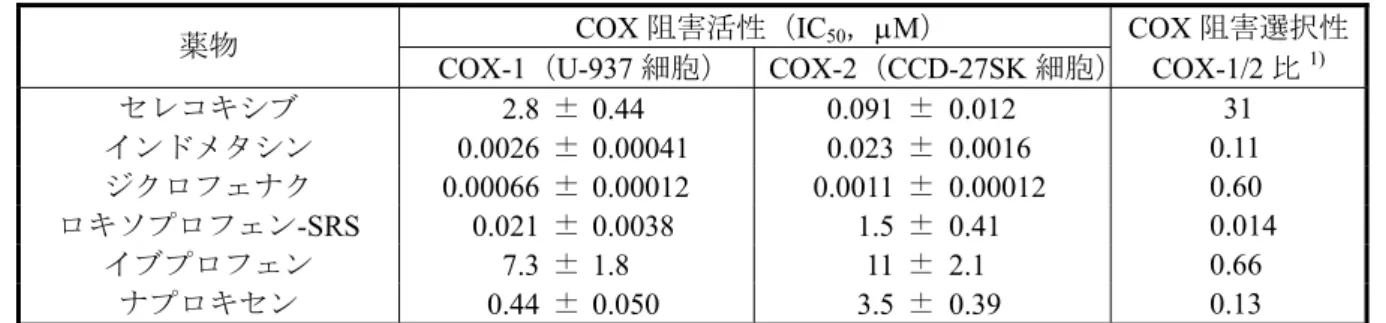
··· 添付資料 4.2.1.1-2,3セレコキシブ及び既存のNSAID の細胞における COX 阻害選択性を評価する目的で,COX-1 を構成的に発現している U-937 細胞及び組換えヒト IL-1βで刺激して COX-2 を発現させた CCD-27SK 細胞を用いて,PGE2産生を指標に薬物の作用を評価した.U-937 及び CCD-27SK 細 胞において,セレコキシブ(0.003~100 μM)は PGE2産生を濃度依存的に阻害し,そのIC50値 はそれぞれ2.8 及び 0.091 μM で,その比は 31 であった.組換えヒト COX と同様に,ヒト由来 細胞においてもセレコキシブは COX-2 に対して選択的な阻害作用を示した.一方,既存の NSAID [インドメタシン,ジクロフェナク,ロキソプロフェン-SRS(ロキソプロフェンはプロ ドラッグでありCOX 阻害活性を示さないため,その活性代謝物を用いた.),イブプロフェン及 びナプロキセン] は,いずれも COX-2 に対して阻害選択性を示さなかった(表 2.6.2.3).
表2.6.2.3 セレコキシブ及び各種 NSAID のヒト由来細胞の COX-1 及び COX-2 に対する阻害作用
(添付資料4.2.1.1-2, 4.2.1.1-3:U-937 細胞,CCD-27SK 細胞,4.2.1.1-2 表 1 を改変)
COX 阻害活性(IC50,μM) COX 阻害選択性
薬物
COX-1(U-937 細胞) COX-2(CCD-27SK 細胞) COX-1/2 比1)
セレコキシブ 2.8 ± 0.44 0.091 ± 0.012 31 インドメタシン 0.0026 ± 0.00041 0.023 ± 0.0016 0.11 ジクロフェナク 0.00066 ± 0.00012 0.0011 ± 0.00012 0.60 ロキソプロフェン-SRS 0.021 ± 0.0038 1.5 ± 0.41 0.014 イブプロフェン 7.3 ± 1.8 11 ± 2.1 0.66 ナプロキセン 0.44 ± 0.050 3.5 ± 0.39 0.13 IC50値はアラキドン酸を基質としたときのPGE2産生抑制曲線から求め,5 回の試験結果の平均値±標準誤差で表 示した. 1):COX-2 における IC50値に対するCOX-1 における IC50値の比を示す.
2.6.2.2.1.3
In vivo における COX 阻害作用
··· 添付資料 4.2.1.1-4In vivo におけるセレコキシブの COX-2 阻害選択性についてラットカラゲニン誘発空気嚢モデ
ルを用いて評価した.本モデルでは,背部皮下に空気を注入することによって作製した空気嚢 内にカラゲニンを注入して炎症を惹起する.炎症局所(空気嚢内滲出液中)のPGE2は主として
COX-2 に,胃粘膜の PGE2は主としてCOX-1 により生成されることが知られている1).したがっ
て,本モデルの炎症局所及び胃組織PGE2含量を測定することにより,薬物のin vivo における COX 阻害選択性を検討することができる. セレコキシブ(0.1~10 mg/kg)は炎症惹起前 2 時間に単回経口投与することにより,空気嚢 内滲出液PGE2含量を用量依存的に減少させ,ED50値は0.72 mg/kg であった.一方,胃組織 PGE2 含量に対しては10 mg/kg まで有意な抑制作用を示さなかったことから,セレコキシブは in vivo においてもCOX-2 を選択的に阻害することが示唆された(図 2.6.2.1).なお,セレコキシブ 200 mg/kg を経口投与したとき,胃組織 PGE2含量は約40%減少した. 40 30 20 10 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ PG E量(2 pg /m L) 空気嚢内 PG E量(2 pg /m g) 400 300 200 100 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) 40 30 20 10 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ PG E量(2 ) 空気嚢内 胃組織中 PG E量(2 pg /m g) 400 300 200 100 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) 40 30 20 10 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ PG E量(2 pg /m L) 空気嚢内 PG E量(2 pg /m g) 400 300 200 100 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) 40 30 20 10 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ PG E量(2 ) 空気嚢内 胃組織中 PG E量(2 pg /m g) 400 300 200 100 0 10 3 1 0.1 溶媒 セレコキシブ(mg/kg po) 図2.6.2.1 ラットカラゲニン空気嚢モデルの空気嚢内及び胃組織中 PGE2に対する セレコキシブの作用
カラゲニン空気嚢モデルの空気嚢内(炎症局所)の主にCOX-2 に由来する PGE2量と胃粘膜のCOX-1 に由来する
PGE2量を示した.
図中の値は6 例の平均値±標準誤差を示す.
∗∗:p<0.01(溶媒対照群に対する有意差,Dunnett の多重比較検定). (添付資料4.2.1.1-4:Lewis 系ラット,雄,図 1 を改変)
2.6.2.2.1.4 各種受容体及び酵素に対する作用
··· 添付資料 4.2.1.1-5(参) セレコキシブ10 μM の各種受容体及び酵素に対する作用を検討した.ドーパミン取り込みを 60%抑制した以外は,各種受容体に対するセレコキシブの作用は軽度であった(表 2.6.2.4).セ レコキシブの各種酵素 [アンジオテンシン変換酵素(ACE),アデニレートシクラーゼ,グアニ レートシクラーゼ,プロテインキナーゼC 及び上皮成長因子(EGF)-チロシンキナーゼ] に対 する阻害率は10%未満であった(表 2.6.2.5). 表2.6.2.4 セレコキシブの各種受容体との相互作用 [添付資料4.2.1.1-5(参考):ラット及びモルモット組織,ヒト,マウス及びラット細胞,表 1 から抜粋] 受容体 由来 10 μM の阻害率(%)セレコキシブ1) 対照薬 IC対照薬の 50(nM) アデノシンA1 r(c) <10 CPA 0.91 アデノシンA2 r(s) 12 NECA 70 α1アドレナリン(非選択的) r(c) <10 プラゾシン 0.50 α2アドレナリン(非選択的) r(c) <10 ヨヒンビン 52 β1アドレナリン r(h) <10 アテノロール 2590 ノルエピネフリン取り込み r(c) 16 プロトリプチリン 1.3 アンジオテンシンAT1 r(l) <10 サラプラズマ 4.3 BZD(中枢) r(c) <10 ジアゼパム 15 ブラジキニンB2 rh <10 NPC567 3.1 CCKA r(p) 26 CCK-8 0.81 ドーパミンD1 r(s) <10 SCH 23390 0.53 ドーパミンD2 r(s) <10 (+)ブタクラモール 7.7 ドーパミン取り込み r(s) 60 ノミフェンシン 63 エンドセリンETA rh <10 エンドセリン-1 0.59 GABA(非選択的) r(c) <10 GABA 36 NMDA r(c) <10 CGS 19755 402 ヒスタミンH1(中枢) g <10 ピリラミン 1.3 ムスカリン(非選択的) r(c) <10 アトロピン 0.36 NK1 U <10 [Sar9-Met(O2)11]-SP 1.9 NPY(非選択的) r(c) <10 ニューロペプチドY 1.0 N(中枢) r(c) <10 ニコチン 14 オピオイド(非選択的) r(c) <10 ナロキソン 2.2 PCP r(c) <10 MK 801 3.7 5-HT(非選択的) r(c) <10 セロトニン 1.3 5-HT1B r(c) <10 セロトニン 48 5-HT2A r(c) <10 ケタンセリン 3.0 5-HT 取り込み r(c) 17 ジメリジン 47 シグマ(非選択的) r(c) <10 ハロペリドール 157 グルココルチコイド L <10 デキサメタゾン 125 バソプレシンV1 A <10 V1-アンタゴニスト 0.93 1):セレコキシブの阻害率は溶媒対照群に対する阻害率(%)を示す. r(c):ラット大脳皮質,r(s):ラット線条体,r(h):ラット心臓,r(l):ラット肺臓,rh:組換えヒト 型(CHO 細胞由来),r(p):ラット膵臓,g:モルモット小脳,U:U-373MG 細胞(ヒト神経膠腫),L: L-929 細胞(マウス株化線維芽細胞),A:A7r5 細胞(ラット株化血管平滑筋細胞) BZD:ベンゾジアゼピン,CCKA:コレシストキニンA,GABA:ガンマアミノ酪酸,NMDA:N-メチル -D-アスパラギン酸,NK1:ニューロキニン 1,NPY:ニューロペプチド Y,N:ニコチン性アセチルコリ ン,PCP:フェンクリジン,5-HT:5-ヒドロキシトリプタミン,CPA:シクロペンチルアデノシン,NECA: 5'-N-エチルカルボキサミドアデノシン,NPC567:D-Arg-[Hyp3-D-Phe7]-ブラジキニン,CCK-8:コレシス トキニン オクタペプチド,[Sar9-Met(O 2)11]-SP:[Sar9-Met(O2)11]-サブスタンス P表2.6.2.5 セレコキシブの各種酵素との相互作用 [添付資料4.2.1.1-5(参考):ヒト臍帯静脈内皮細胞,ラット及びウシ組織,A-431 細胞,表 2 から抜粋] 酵素 由来 セレコキシブ 10 μM の阻害 率(%)1) 対照薬 対照薬のIC50 (μM) ACE HUVEC <10 カプトプリル 0.00040 アデニレートシクラーゼ ラット脳 <10 メチレンブルー 228 グアニレートシクラーゼ ウシ肺臓 <10 メチレンブルー 3.1 プロテインキナーゼC ラット脳 <10 スタウロスポリン 0.037 EGF-チロシンキナーゼ A-431 細胞 <10 PD 153035 0.0017/0.0039 1):セレコキシブの阻害率は溶媒対照群に対する阻害率(%)を示す. ACE:アンジオテンシン変換酵素,EGF:上皮成長因子,HUVEC:ヒト臍帯静脈内皮細胞,A-431 細胞: ヒト類表皮癌細胞
2.6.2.2.2 抗炎症作用
2.6.2.2.2.1 ラットカラゲニン誘発足浮腫モデル(単回投与)
··· 添付資料 4.2.1.1-6 ラット左後肢足蹠に1%カラゲニン懸濁液 50 μL を投与し急性炎症を惹起すると,3~4 時間 後にピークとなる足浮腫を生じる.このとき炎症局所にはCOX-2 蛋白が誘導されることが知ら れている2).このモデルにおいてセレコキシブ(0.3~30 mg/kg),インドメタシン(0.3~30 mg/kg), ジクロフェナク(0.28~28 mg/kg)及びロキソプロフェン(0.24~24 mg/kg)は,いずれもカラ ゲニン懸濁液投与前2 時間の単回経口投与により用量依存的に足浮腫を抑制するとともに,浮 腫足から得られた滲出液PGE2含量を減少させた(図2.6.2.2). 足 浮 腫( 足容 積変 化量 , mL ) ## # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ 足 浮 腫( 足容 積変 化量 , mL ) PGE 2( ng /足 ) ( ng /足 ) # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ Edema PGE 浮腫 PGE2 足 浮腫 (足容 積変 化量 , mL ) PGE 2( ng /足 ) 正常 溶媒 0.24 0.81 2.4 8.1 24 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ロキソプロフェン(mg/kg po) )) Edema PGE 浮腫 PGE2 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) PGE 2( ng /足 ) PGE 2( ng /足 ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 セレコキシブ(mg/kg po) 0.3 1 3 10 30 セレコキシブ(mg/kg po) 正常 溶媒 正常 溶媒 0.3 1 3 10 30 インドメタシン(mg/kg po) インドメタシン(mg/kg po) ( ng /足) PGE 2( ng /足) 足浮 腫( 足容 積変 化量 , mL ) 0 2 4 6 8 10 # # ## 0.3 1 3 10 30 ∗∗ 0.3 1 3 10 30 ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 2 4 6 8 10 # # ## 0.3 1 3 10 30 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 ∗∗∗∗ 0.3 1 3 10 30 ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ 正常 溶媒 Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 足 浮 腫( 足容 積変 化量 , mL ) ## # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ 足 浮 腫( 足容 積変 化量 , mL ) PGE 2( ng /足 ) ( ng /足 ) # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ Edema PGE 浮腫 PGE2 足 浮腫 (足容 積変 化量 , mL ) PGE 2( ng /足 ) 正常 溶媒 0.24 0.81 2.4 8.1 24 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ロキソプロフェン(mg/kg po) )) Edema PGE 浮腫 PGE2 足 浮 腫( 足容 積変 化量 , mL ) ## # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ 足 浮 腫( 足容 積変 化量 , mL ) PGE 2( ng /足 ) ( ng /足 ) PGE 2( ng /足 ) ( ng /足 ) # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗ 正常 溶媒 0.28 0.93 2.8 9.3 28 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 ジクロフェナク(mg/kg po) # # # # ∗ ∗ ∗ ∗ ∗ ∗ # # # # ∗ ∗ ∗ ∗ ∗ ∗ Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 足 浮腫 (足容 積変 化量 , mL ) PGE 2( ng /足 ) PGE 2( ng /足 ) 正常 溶媒 0.24 0.81 2.4 8.1 24 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # # # ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ロキソプロフェン(mg/kg po) )) Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) PGE 2( ng /足 ) PGE 2( ng /足 ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 セレコキシブ(mg/kg po) 0.3 1 3 10 30 セレコキシブ(mg/kg po) 正常 溶媒 正常 溶媒 0.3 1 3 10 30 インドメタシン(mg/kg po) インドメタシン(mg/kg po) ( ng /足) PGE 2( ng /足) 足浮 腫( 足容 積変 化量 , mL ) 0 2 4 6 8 10 # # ## 0.3 1 3 10 30 ∗∗ 0.3 1 3 10 30 ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 2 4 6 8 10 # # ## 0.3 1 3 10 30 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 ∗∗∗∗ 0.3 1 3 10 30 ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ 正常 溶媒 Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 # # ∗ # # ∗ ∗∗ ∗∗ ∗∗ 足浮 腫( 足容積 変化 量 , mL ) PGE 2( ng /足 ) PGE 2( ng /足 ) PGE 2( ng /足 ) PGE 2( ng /足 ) 0 0.2 0.4 0.6 0.8 1 1.2 0 2 4 6 8 10 セレコキシブ(mg/kg po) 0.3 1 3 10 30 セレコキシブ(mg/kg po) 正常 溶媒 正常 溶媒 正常 溶媒 正常 溶媒 0.3 1 3 10 30 インドメタシン(mg/kg po) インドメタシン(mg/kg po) ( ng /足) PGE 2( ng /足) ( ng /足) PGE 2( ng /足) 足浮 腫( 足容 積変 化量 , mL ) 0 2 4 6 8 10 # # ## 0.3 1 3 10 30 ∗∗∗∗ 0.3 1 3 10 30 ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ 2 4 6 8 10 # # ## 0.3 1 3 10 30 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 1.2 0 0.2 0.4 0.6 0.8 ∗∗∗∗ 0.3 1 3 10 30 ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗ ∗∗∗∗∗∗∗∗ 正常 溶媒 正常 溶媒 Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 Edema PGE 浮腫 PGE2 図2.6.2.2 ラットカラゲニン誘発足浮腫モデルに対するセレコキシブ及び NSAID の抑制作用 PGE2値は足組織滲出液中の濃度を測定し足組織あたりの量に換算して示した. 図中の値は8 例の平均値±標準誤差を示す. ##:p<0.01(正常群に対する有意差,Student の t 検定),∗:p<0.05,∗∗:p<0.01(溶媒対照群に対する有意差,Dunnett の多重比較検定). (添付資料4.2.1.1-6:SD 系ラット,雄,図 1 を改変)2.6.2.2.2.2 ラットアジュバント関節炎モデル(1 日 2 回 10 日間反復投与)
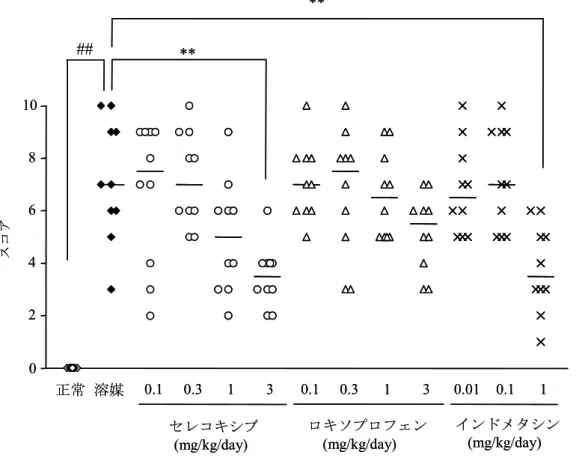
··· 添付資料 4.2.1.1-7 関節リウマチにみられる関節腫脹,骨破壊等の慢性炎症に対するセレコキシブの作用を検討 する目的でラットアジュバント関節炎モデルを用いて評価した.流動パラフィンに2%の濃度で M. butyricum を懸濁したアジュバント 50 μL をラットの左後肢足蹠に注入し,関節炎を惹起した. アジュバント投与後 14 日目にアジュバント非投与足の足容積の増加を確認して関節炎発症個 体を選出し,翌日からセレコキシブ(0.1~3 mg/kg/day),ロキソプロフェン(0.1~3 mg/kg/day) 及びインドメタシン(0.01~1 mg/kg/day)を 1 日 2 回 10 日間反復経口投与した.10 日目の投与 終了翌日にアジュバント非投与足の足容積を測定した結果,いずれの薬物も用量依存的に関節 炎症による足腫脹を抑制した.腫脹抑制率は,セレコキシブ(3 mg/kg/day)で 84%,インドメ タシン(1 mg/kg/day)で 83%と同程度であった(図 2.6.2.3).一方,ロキソプロフェンの抑制 率は3 mg/kg/day で 63%であった.腫脹抑制率から求めた ED50値は,セレコキシブ 0.42,ロキ ソプロフェン 1.7 及びインドメタシン 0.18 mg/kg/day であった.足容積の測定後,足組織を採 材し,病理組織学的評価を行った.足根関節部のX 線写真により骨膜炎及び骨破壊を,組織切 片により骨,軟骨組織像及び関節滑膜像を評価した.その結果,セレコキシブ及びインドメタ シンは炎症による骨膜炎,骨破壊を有意に抑制し,ロキソプロフェンは抑制する傾向を示した (図 2.6.2.4).組織切片像については,溶媒対照群では炎症像及び軟骨の破壊が認められたが, いずれの薬物も軟骨組織破壊には影響を与えなかった(図2.6.2.5). 0 1 2 3 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) セレコキシブ (mg/kg/day) ∗ ∗ ∗ ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 足容 積 ( mL ) 0 1 2 3 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン ( インドメタシン ( ロキソプロフェン ( ロキソプロフェン ( 0 1 2 3 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) ロキソプロフェン (mg/kg/day) セレコキシブ (mg/kg/day) セレコキシブ (mg/kg/day) ∗ ∗ ∗ ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 足容 積 ( mL ) 0 1 2 3 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン ( インドメタシン ( ロキソプロフェン ( ロキソプロフェン ( 図2.6.2.3 ラットアジュバント関節炎モデルにおけるセレコキシブ及び NSAID の腫脹抑制作用 図中の値は10 例の平均値±標準誤差を示す. ##:p<0.01(正常群に対する有意差,Student の t 検定),∗:p<0.05,∗∗:p<0.01(溶媒対照群に対する有意差,Dunnett の多重比較検定). (添付資料4.2.1.1-7:Lewis 系ラット,雄,図 1 を改変)図2.6.2.4 ラットアジュバント関節炎モデルにおける足根関節部の X 線写真による骨破壊の評価 X 線写真による骨破壊の程度の評価は骨膜炎,骨破壊それぞれについて,正常は 0,軽度は 1,中等度 1 は 2,中 等度2 は 3,重度は 4 及び最高度は 5 ポイントとしてスコア化した.骨破壊の程度は各項目の個体ごとのスコアの 和として示した.実線は10 例の中央値を示す. ##:p<0.01(正常群に対する有意差,Wilcoxon の順位和検定),∗∗:p<0.01(溶媒対照群に対する有意差,Steel 検定). (添付資料4.2.1.1-7:Lewis 系ラット,雄,図 4 を改変) 正常 溶媒 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 0 2 4 6 8 10 セレコキシブ (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) ∗∗ ∗∗ スコア ## 正常 溶媒 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 0 2 4 6 8 10 セレコキシブ (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) ∗∗ ∗∗ スコア ##
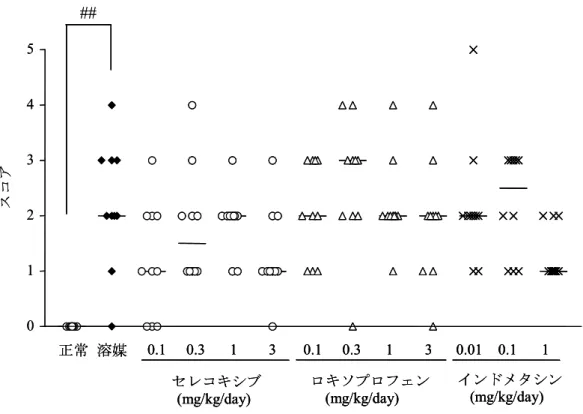
図2.6.2.5 ラットアジュバント関節炎モデルにおける足根関節部軟骨組織の組織切片評価 足根関節部の組織切片の評価は,軟骨細胞の変性・壊死,軟骨組織の剥離,破壊それぞれについて,異常なしは0, 軽度は1,中等度 1 は 2,中等度 2 は 3,重度は 4 及び最重度は 5 ポイントとしてスコア化した.軟骨破壊の程度 は各項目の個体ごとのスコアの和として示した.実線は10 例の中央値を示す. ##:p<0.01(正常群に対する有意差,Wilcoxon の順位和検定). (添付資料4.2.1.1-7:Lewis 系ラット,雄,図 7 を改変) 0 1 2 3 4 5 スコ ア ## 正常 溶媒 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 セレコキシブ (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) 0 1 2 3 4 5 スコ ア ## 正常 溶媒 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 セレコキシブ (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day) 正常 溶媒 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 セレコキシブ (mg/kg/day) インドメタシン (mg/kg/day) ロキソプロフェン (mg/kg/day)
2.6.2.2.3 鎮痛作用
2.6.2.2.3.1 ラットカラゲニン誘発痛覚過敏モデル(単回治療投与)
··· 添付資料 4.2.1.1-8 セレコキシブの急性炎症性疼痛に対する作用を検討する目的で,ラットカラゲニン誘発痛覚 過敏モデルを用いて評価した.ラットの左後肢足蹠に1%カラゲニン懸濁液 50 μL を注入し,急 性痛覚過敏を惹起した.セレコキシブ(0.3~30 mg/kg),インドメタシン(0.3~30 mg/kg),ジ クロフェナク(0.28~28 mg/kg),ロキソプロフェン(0.24~24 mg/kg)及びナプロキセン(0.3 ~30 mg/kg)を炎症惹起後 4 時間に単回経口投与し,その後 2 時間に温熱侵害刺激を与えて逃 避反応を示すまでの時間を測定し,疼痛閾値とした.いずれの薬物も投与後2 時間において用 量依存的に鎮痛作用を示し,ED30値はそれぞれ0.81,2.1,1.3,1.6 及び 2.8 mg/kg であった. 同動物の炎症局所(足組織)及び中枢(脳脊髄液)のPGE2含量を測定した結果,いずれの薬物 も両部位のPGE2含量を減少させた(図2.6.2.6). 鎮痛作用 足組織 PGE2抑制作用 脳脊髄液 PGE2抑制作用 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 0.3 1 3 10 30 0 2 4 6 8 10 12 14 セレコキシブ(mg/kg po ) ## ∗∗ ∗ ∗ 正常 溶媒 0.3 1 3 10 30 0 0.5 1 1.5 2 脳脊髄 液 PG E量(2 ng /m L) セレコキシブ(mg/kg po ) $ $$ $$ 正常 溶媒 0.3 1 3 10 30 疼痛 閾値( 秒) 正常 溶媒 0.3 1 3 10 30 セレコキシブ( ) 正常 溶媒 0.3 1 3 10 30 0 4 16 2 6 8 10 12 14 正常 溶媒 0.3 1 3 10 30 足組 織 PG E量(2 ng /足) セレコキシブ( ) ND †† 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po ) ## ∗∗ ∗ ∗ 正常 溶媒 0.3 1 3 10 30 脳脊髄 液 PG E量(2 ng /m L) セレコキシブ(mg/kg po ) $ $$ $$ $$ $$ 正常 溶媒 0.3 1 3 10 30 正常 溶媒 0.3 1 3 10 30 セレコキシブ( ) 正常 溶媒 0.3 1 3 10 30 正常 溶媒 0.3 1 3 10 30 足組 織 PG E量(2 ng /足) セレコキシブ( ) †† インドメタシン(mg/kg po ) 正常 溶媒0.3 1 3 10 30 10 12 14 インドメタシン(mg/kg po ) ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 正常 溶媒0.3 1 3 10 30 0 0.5 1 1.5 脳 脊髄液 PG E量(2 ng /mL ) ND $$ $$ $$ インドメタシン( ) 正常 溶媒0.3 1 3 10 30 0 4 8 2 インドメタシン( ) 正常 溶媒0.3 1 3 10 30 2 ND ND †† インドメタシン(mg/kg po ) 正常 溶媒0.3 1 3 10 30 2 6 インドメタシン(mg/kg po ) ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 正常 溶媒0.3 1 3 10 30 脳 脊髄液 PG E量(2 ng /mL ) ND $$ $$ $$ インドメタシン( ) 正常 溶媒 0.3 1 3 10 30 2 インドメタシン( ) 正常 溶媒0.3 1 3 10 30 ND ND †† 16 インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒 足組 織 PG E量( ng /足) インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒0.30.30.30.3 1111 3333 10101010 30303030 足組 織 PG E量( ng /足) 0 ∗∗ ∗∗ ∗∗ ∗ ## 疼 痛閾値 (秒) ∗∗ ∗∗ ∗∗ ∗ ## 4 2 6 8 10 12 14 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 0.3 1 3 10 30 0 2 4 6 8 10 12 14 セレコキシブ(mg/kg po ) ## ∗∗ ∗ ∗ 正常 溶媒 0.3 1 3 10 30 0 0.5 1 1.5 2 脳脊髄 液 PG E量(2 ng /m L) セレコキシブ(mg/kg po ) $ $$ $$ 正常 溶媒 0.3 1 3 10 30 疼痛 閾値( 秒) 正常 溶媒 0.3 1 3 10 30 セレコキシブ( ) 正常 溶媒 0.3 1 3 10 30 0 4 16 2 6 8 10 12 14 0 4 16 2 6 8 10 12 14 正常 溶媒 0.3 1 3 10 30 足組 織 PG E量(2 ng /足) セレコキシブ( ) ND †† 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po) ∗∗ ∗∗ ∗∗ ∗∗ ## 正常 溶媒 0.3 1 3 10 30 セレコキシブ(mg/kg po ) ## ∗∗ ∗ ∗ 正常 溶媒 0.3 1 3 10 30 脳脊髄 液 PG E量(2 ng /m L) セレコキシブ(mg/kg po ) $ $$ $$ $$ $$ $$ $$ 正常 溶媒 0.3 1 3 10 30 正常 溶媒 0.3 1 3 10 30 セレコキシブ( ) 正常 溶媒 0.3 1 3 10 30 正常 溶媒 0.3 1 3 10 30 足組 織 PG E量(2 ng /足) セレコキシブ( ) †† インドメタシン(mg/kg po ) 正常 溶媒 0.3 1 3 10 30 10 12 14 インドメタシン(mg/kg po ) ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 正常 溶媒0.3 1 3 10 30 0 0.5 1 1.5 脳 脊髄液 PG E2 量( ng /mL ) ND $$ $$ $$ インドメタシン( ) 正常 溶媒 0.3 1 3 10 30 0 4 8 2 インドメタシン( ) 正常 溶媒0.3 1 3 10 30 2 ND ND †† インドメタシン(mg/kg po ) 正常 溶媒 0.3 1 3 10 30 2 6 インドメタシン(mg/kg po ) ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 正常 溶媒0.3 1 3 10 30 脳 脊髄液 PG E量(2 ng /mL ) ND $$ $$ $$ インドメタシン( ) 正常 溶媒 0.3 1 3 10 30 2 インドメタシン( ) 正常 溶媒0.3 1 3 10 30 ND ND †† 16 インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒 足組 織 PG E量( ng /足) インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒0.30.30.30.3 1111 3333 10101010 30303030 足組 織 PG E量( ng /足) 0 ∗∗ ∗∗ ∗∗ ∗ ## 疼 痛閾値 (秒) ∗∗ ∗∗ ∗∗ ∗ ## 4 2 6 8 10 12 14 16 インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒 足組 織 PG E量( ng /足) インドメタシン(mg/kg po ) 正常 溶媒 インドメタシン( ) 正常 溶媒0.30.30.30.30.30.30.30.3 11111111 33333333 1010101010101010 3030303030303030 足組 織 PG E量( ng /足) 0 ∗∗ ∗∗ ∗∗ ∗ ## 疼 痛閾値 (秒) ∗∗ ∗∗ ∗∗ ∗ ## 4 2 6 8 10 12 14 ∗∗ ∗∗ ∗∗ ∗ ## 疼 痛閾値 (秒) ∗∗ ∗∗ ∗∗ ∗ ## 4 2 6 8 10 12 14 図2.6.2.6 ラットカラゲニン誘発痛覚過敏モデルにおけるセレコキシブ及び NSAID の作用(その 1)鎮痛作用 足組織 PGE2抑制作用 脳脊髄液 PGE2抑制作用 ∗∗ ∗∗ ∗∗ ## 疼痛 閾値(秒) 4 14 2 10 16 0 6 8 12 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 ## ∗∗ ∗∗ ∗∗ ∗∗ 足組 織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 $$ ND ND $$ †† $$ $$ 脳脊 髄液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 ND † $$ $$ † $$ $$ $$ $$ $$ $$ ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 脳脊髄 液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 ** ** ** ** ** ## 足組織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 ∗∗ ∗ ∗ ## 疼痛閾値 (秒) 4 14 2 10 16 0 6 8 12 ∗∗ ## ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ** ** ND †† $$ $$ $$ ∗∗ ## ∗∗ ∗∗ †† ∗∗ ## ∗∗ ∗∗ †† ∗∗ ## ∗∗ ∗∗ †† ND ナプロキセン(mg/kg po) 正常 溶媒0.3 1 3 10 30 ナプロキセン(mg/kg po) 正常 溶媒 0.3 1 3 10 30 ナプロキセン(mg/kg po) 正常 溶媒0.3 1 3 10 30 疼痛閾値(秒) 4 14 2 10 16 0 6 8 12 足組織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 脳脊髄液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 ∗∗ ∗∗ ∗∗ ## 疼痛 閾値(秒) 4 14 2 10 16 0 6 8 12 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 ## ∗∗ ∗∗ ∗∗ ∗∗ 足組 織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 $$ ND ND $$ †† $$ $$ 脳脊 髄液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 ジクロフェナク(mg/kg po) 正常 溶媒0.28 0.93 2.8 9.3 28 ND † $$ $$ † $$ $$ $$ $$ $$ $$ ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 脳脊髄 液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 ** ** ** ** ** ## 足組織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 ロキソプロフェン(mg/kg po) 正常 溶媒0.24 0.81 2.4 8.1 24 ∗∗ ∗ ∗ ## 疼痛閾値 (秒) 4 14 2 10 16 0 6 8 12 ∗∗ ## ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ** ** ND †† $$ $$ $$ ∗∗ ## ∗∗ ∗∗ †† ∗∗ ## ∗∗ ∗∗ †† ∗∗ ## ∗∗ ∗∗ †† ND ナプロキセン(mg/kg po) 正常 溶媒0.3 1 3 10 30 ナプロキセン(mg/kg po) 正常 溶媒 0.3 1 3 10 30 ナプロキセン(mg/kg po) 正常 溶媒0.3 1 3 10 30 疼痛閾値(秒) 4 14 2 10 16 0 6 8 12 足組織 PG E2 量( ng /足) 0 8 10 2 4 6 12 14 脳脊髄液 PG E2 量( ng /m L ) 0 1 1.5 0.5 2 図2.6.2.6 ラットカラゲニン誘発痛覚過敏モデルにおけるセレコキシブ及び NSAID の作用(その 2) 疼痛閾値は逃避反応を示すまでの時間(秒)で表した.PGE2含量は,足組織滲出液中及び脳脊髄液中の濃度を測 定し,前者は足組織あたりの量で,後者は濃度に換算して示した. 図中の各値は10 例(ジクロフェナク 0.28 mg/kg の脳脊髄液中 PGE2のみ9 例)の平均値±標準誤差を示す.ND は検出限界以下であったことを示す. ##:p<0.01(正常群に対する有意差,Student の t 検定),∗:p<0.05,∗∗:p<0.01(溶媒対照群に対する有意差,Dunnett の多重比較検定),††:p<0.01(正常群に対する有意差,Wilcoxon の順位和検定),$:p<0.05,$$:p<0.01(溶媒 対照群に対する有意差,Steel 検定). (添付資料4.2.1.1-8:SD 系ラット,雄,図 1,2 及び 3 を改変)
2.6.2.2.3.2 ラットアジュバント関節炎モデル(1 日 2 回 10 日間反復投与)
··· 添付資料 4.2.1.1-7 関節リウマチ等の慢性疼痛に対するセレコキシブの作用を検討する目的で,ラットアジュバ ント関節炎モデルを用いて評価した.流動パラフィンに2%の濃度で M. butyricum を懸濁したア ジュバント50 μL をラットの左後肢足蹠に注入し,関節炎を惹起した.アジュバント投与後 14 日目にアジュバント非投与足の足容積の増加を確認して関節炎発症個体を選出し,翌日からセ レコキシブ(0.1~3 mg/kg/day),ロキソプロフェン(0.1~3 mg/kg/day)及びインドメタシン(0.01 ~1 mg/kg/day)を 1 日 2 回 10 日間反復経口投与した.最終投与翌日に,痛覚過敏反応の指標と してアジュバント非投与足の足根関節の5 回屈曲による啼鳴頻度を測定した結果,セレコキシ ブは1 及び 3 mg/kg/day,ロキソプロフェンは 3 mg/kg/day 及びインドメタシンは 1 mg/kg/day に おいてそれぞれ啼鳴数を有意に減少させ,鎮痛作用を示した(図2.6.2.7). 図2.6.2.7 ラットアジュバント関節炎モデルにおけるセレコキシブ及び NSAID の鎮痛作用 疼痛評価は,ラットの足根関節部を5 回屈曲させることにより発する啼鳴数を計数した. 図中の値は各個体における5 回の関節の屈曲に対する啼鳴数を示す.実線は 10 例の中央値を示す. ##:p<0.01(正常群に対する有意差,Wilcoxon の順位和検定),∗:p<0.05,∗∗:p<0.01(溶媒対照群に対する有意 差,Steel 検定). (添付資料4.2.1.1-7:Lewis 系ラット,雄,図 2 を改変) ∗∗ 0 1 2 3 4 5 正常 溶媒 啼鳴 数( 回 ) ∗ ∗∗ ∗∗ 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン ロキソプロフェン セレコキシブ ## ∗∗ 0 1 2 3 4 5 正常 溶媒 啼鳴 数( 回 ) ∗ ∗∗ ∗∗ 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン ロキソプロフェン セレコキシブ ## 0 1 2 3 4 5 正常 溶媒 啼鳴 数( 回 ) ∗ ∗∗ ∗∗ 0.1 0.3 1 3 0.1 0.3 1 3 0.01 0.1 1 インドメタシン ロキソプロフェン セレコキシブ ##
2.6.2.2.4 代謝物の COX 阻害作用
2.6.2.2.4.1 セレコキシブの代謝物の COX 阻害作用
··· 添付資料 4.2.1.1-1 セレコキシブには 2 種類の代謝物(SC-60613 及び SC-62807)が確認されている.これら 2 種類の代謝物SC-60613 及び SC-62807 の組換えヒト COX-1 及び COX-2 に対する阻害活性を評 価した.その結果,いずれも100 μΜの濃度で両 COX に対して 50%以上の阻害を示さなかった (IC50>100 μΜ).2.6.2.2.5 消化管粘膜に対する作用
2.6.2.2.5.1 単回経口投与時の作用
··· 添付資料 4.2.1.1-9 セレコキシブ及び既存のNSAID の消化管粘膜に対する作用を検討した.セレコキシブ(1~ 200 mg/kg),インドメタシン(0.5~16 mg/kg),ロキソプロフェン(0.24~81 mg/kg),ジクロフェ ナク(0.28~93 mg/kg)及びナプロキセン(0.3~100 mg/kg)をラットに単回経口投与し,薬物 投与後 5 時間に胃,3 日目に小腸(十二指腸,空腸及び回腸)の粘膜障害発現率を求めた.セ レコキシブ投与群では,胃及び小腸のいずれにも粘膜障害は認められなかった.一方,インド メタシン,ロキソプロフェン,ジクロフェナク及びナプロキセン投与群では,消化管粘膜障害 が発現し,いずれの薬物においても,用量に依存して胃及び小腸粘膜障害の発現率が増加した. そのUD50値は,胃粘膜障害においてそれぞれ2.9,6.1,5.0 及び 4.7 mg/kg であり,小腸粘膜障 害においてそれぞれ5.7,8.0,12 及び 11 mg/kg であった(図 2.6.2.8).また,胃組織 PGE2含 量に対しては,セレコキシブは200 mg/kg まで影響しなかったが,既存の NSAID はいずれも胃 組織PGE2含量を用量依存的かつ有意に減少させた(図2.6.2.9). 胃粘膜障害 小腸粘膜障害 小腸粘 膜障 害発現 率( % ) 0.1 1 10 100 1000 用量(mg/kg po) 0 20 40 60 80 100 J P H J P B J PF F B B B J J J H H H H H F F F F P P P B セレコキシブ J インドメタシン H ロキソプロフェン ◆ ジクロフェナク P ナプロキセン 胃粘膜 障害 発現率 ( % ) 0 20 40 60 80 100 0.1 1 10 100 1000 用量(mg/kg po) J ◆ J J J J J H H H H H H ◆ ◆ ◆ ◆ P P P P P B B B B P J H ◆ ◆ ◆ ◆ ◆ P B J H ◆ P セレコキシブ インドメタシン ロキソプロフェン ジクロフェナク ナプロキセン 小腸粘 膜障 害発現 率( % ) 0.1 1 10 100 1000 用量(mg/kg po) 0 20 40 60 80 100 J P H J P B J PF F B B B J J J H H H H H F F F F P P P B セレコキシブ J インドメタシン H ロキソプロフェン ◆ ジクロフェナク P ナプロキセン B セレコキシブ J インドメタシン H ロキソプロフェン ◆ ジクロフェナク P ナプロキセン 胃粘膜 障害 発現率 ( % ) 0 20 40 60 80 100 0.1 1 10 100 1000 用量(mg/kg po) J ◆ J J J J J H H H H H H ◆ ◆ ◆ ◆ P P P P P B B B B P J H ◆ ◆ ◆ ◆ ◆ P B J H ◆ P セレコキシブ インドメタシン ロキソプロフェン ジクロフェナク ナプロキセン セレコキシブ インドメタシン ロキソプロフェン ジクロフェナク ナプロキセン 図2.6.2.8 セレコキシブ及び NSAID の消化管粘膜障害惹起作用 消化管障害の評価は,胃粘膜については胃体部粘膜にみられる出血斑,びらんの有無を,小腸は潰瘍,粘膜の穿 孔,膿瘍,出血性びまん性潰瘍,腸管の癒着及び腹水の有無を観察した. 図中の値は各群10 例あたりの胃粘膜又は小腸粘膜障害発現動物の割合を示す. (添付資料4.2.1.1-9:SD 系ラット,雄,図 2 及び 5 を改変)## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ∗∗ ## ∗ ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0 50 100 150 200 250 300 PG E2(pg /m g 組織 重量) セレコキシブ 溶媒 インド 1 10 (mg/kg po) 8 100 200 0 50 100 150 200 250 300 PG E2(p g/ m g 組織重量) ロキソプロフェン 溶媒 インド 0.81 2.4 (mg/kg po) 8 0.24 8.1 24 81 0 50 100 150 200 250 300 PG E2(pg /m g 組織重量 ) 溶媒 インドメタシン 2 4 (mg/kg po) 0.5 1 8 16 0 50 100 150 200 250 300 PG E2( pg/m g 組織重量 ) ジクロフェナク 溶媒 インド 0.93 2.8 (mg/kg po) 8 0.28 9.3 28 93 0 50 100 150 200 250 300 PGE 2(pg /m g 組織 重量) ナプロキセン 溶媒 インド 1 3 (mg/kg po) 8 0.3 10 30 100 ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ ## ∗∗ ∗∗ ∗∗ ∗∗ ## ∗ ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0 50 100 150 200 250 300 PG E2(pg /m g 組織 重量) セレコキシブ 溶媒 インド 1 10 (mg/kg po) 8 100 200 0 50 100 150 200 250 300 PG E2(pg /m g 組織 重量) セレコキシブ 溶媒 インド 1 10 (mg/kg po) 8 100 200 0 50 100 150 200 250 300 PG E2(p g/ m g 組織重量) ロキソプロフェン 溶媒 インド 0.81 2.4 (mg/kg po) 8 0.24 8.1 24 81 0 50 100 150 200 250 300 PG E2(p g/ m g 組織重量) ロキソプロフェン 溶媒 インド 0.81 2.4 (mg/kg po) 8 0.24 8.1 24 81 0 50 100 150 200 250 300 PG E2(pg /m g 組織重量 ) 溶媒 インドメタシン 2 4 (mg/kg po) 0.5 1 8 16 0 50 100 150 200 250 300 PG E2( pg/m g 組織重量 ) ジクロフェナク 溶媒 インド 0.93 2.8 (mg/kg po) 8 0.28 9.3 28 93 0 50 100 150 200 250 300 PGE 2(pg /m g 組織 重量) ナプロキセン 溶媒 インド 1 3 (mg/kg po) 8 0.3 10 30 100 図2.6.2.9 セレコキシブ及び NSAID の胃組織 PGE2含量に対する作用 PGE2含量は,胃粘膜組織中の濃度を測定し,胃粘膜組織重量あたりの量に換算して示した. 図中の各値は10 例の平均値±標準誤差を示す.インドはインドメタシン 8 mg/kg 投与群(陽性対照群)を示す. ##:p<0.01(溶媒群に対する有意差,Student の t 検定),∗:p<0.05,∗∗:p<0.01(溶媒群に対する有意差,Dunnett の多重比較検定). (添付資料4.2.1.1-9:SD 系ラット,雄,図 3 を改変)
2.6.2.2.5.2 反復投与時の作用
··· 添付資料 4.2.1.1-9 セレコキシブの反復投与時の消化管粘膜に対する作用を正常ラットを用いて検討した.セレ コキシブ(2~200 mg/kg/day)は 1 日 2 回 10 日間の反復経口投与において,肉眼的には小腸粘 膜に障害性を示さなかった.一方,インドメタシンは2 mg/kg/day 以上の経口投与で小腸粘膜障 害を惹起し,この小腸粘膜障害作用は4 mg/kg/day において有意であった(表 2.6.2.6).なお, 胃粘膜に対しては,両薬物の投与による障害作用は肉眼的には認められなかった. 表2.6.2.6 セレコキシブ及びインドメタシンの小腸粘膜障害発現率 (添付資料4.2.1.1-9:SD 系ラット,雄,表 3 を改変) セレコキシブ(mg/kg/day) インドメタシン(mg/kg/day) 溶媒 2 10 40 200 0.5 1 2 4 障害発現数 0/10 0/10 0/10 0/9 0/10 0/9 0/10 1/10 6/8## 消化管障害の評価は,小腸を摘出し障害の有無を肉眼的に観察した.障害発現数は各群例数あたりの小腸 粘膜障害発現個体数を示す. ##:p<0.0025[溶媒対照群に対する有意差,χ2検定(Bonferroni の方法を用いて有意水準を補正)].2.6.2.2.6 血小板機能に対する作用
2.6.2.2.6.1 ラット血液における TXB
2産生抑制作用(
ex vivo)
··· 添付資料 4.2.1.1-10 経口投与後のセレコキシブの血小板機能に与える影響をラットのex vivo の実験系において検 討した.ラットにセレコキシブ1,10 及び 100 mg/kg あるいはインドメタシン 1 mg/kg を単回経 口投与後 3 時間に採取した末梢血をカルシウムイオノフォアで刺激して産生される TXB2量を 測定した.ラット末梢血において,セレコキシブは TXB2 の産生に影響を及ぼさなかった.一 方,インドメタシンはTXB2産生を有意に抑制した(図2.6.2.10). 溶媒 インドメタシン 1 10 100 0 50 100 150 200 250 300 セレコキシブ ∗∗ ## TX B2 産生量( ng /m L) 1 ∗∗ ## (mg/kg po) インドメタシン セレコキシブ ∗∗ ## ∗∗ ## セレコキシブ ∗∗ ## ∗∗ ## ( セレコキシブ ∗∗ ## ∗∗ ## カルシウムイオノフォア 1 10 100 0 50 100 150 200 250 300 セレコキシブ ∗∗ ## 産生量( ng /m L) 1 ∗∗ ## (mg/kg po) セレコキシブ ∗∗ ## ∗∗ ## セレコキシブ ∗∗ ## ∗∗ ## ( セレコキシブ ∗∗ ## ∗∗ ## 溶媒 溶媒 インドメタシン 1 10 100 0 50 100 150 200 250 300 セレコキシブ ∗∗ ## TX B2 産生量( ng /m L) 1 ∗∗ ## (mg/kg po) インドメタシン セレコキシブ ∗∗ ## ∗∗ ## セレコキシブ ∗∗ ## ∗∗ ## ( セレコキシブ ∗∗ ## ∗∗ ## カルシウムイオノフォア 1 10 100 0 50 100 150 200 250 300 セレコキシブ ∗∗ ## 産生量( ng /m L) 1 ∗∗ ## (mg/kg po) セレコキシブ ∗∗ ## ∗∗ ## セレコキシブ ∗∗ ## ∗∗ ## ( セレコキシブ ∗∗ ## ∗∗ ## 溶媒 図2.6.2.10 ラット血液におけるセレコキシブ及びインドメタシンの TXB2産生抑制作用 薬物を単回経口投与したラットの末梢血をカルシウムイオノフォアで刺激し,産生されるTXB2量を測定した. 図中の値は,6 例の平均値±標準誤差を示す. ##:p<0.01[溶媒(カルシウムイオノフォア非処理)対照群に対する有意差,Student の t 検定]を示す. ∗∗:p<0.01[溶媒(カルシウムイオノフォア処理)対照群に対する有意差,Student の t 検定]を示す. (添付資料4.2.1.1-10:SD 系ラット,雄,図 1 を改変)2.6.2.2.6.2 ヒト末梢血血小板凝集に対する作用(in vitro)
··· 添付資料 4.2.1.1-11 ヒト血小板をアラキドン酸で刺激したときの血小板凝集反応に対するセレコキシブ,ロキソ プロフェン-SRS,インドメタシン,ジクロフェナク及びイブプロフェンの作用を検討した.セ レコキシブ(0.3~30 μM)は臨床推奨用量における血漿中未変化体濃度(3.1 μM:表 2.6.2.7) でアラキドン酸惹起ヒト血小板凝集を抑制しなかった.既存のNSAID は,臨床用量の血漿中未 変化体濃度(表2.6.2.7)を含む濃度範囲3~6),すなわちロキソプロフェン-SRS 及びインドメタ シンは0.3~30 μM で,ジクロフェナクは 0.3~10 μM で,イブプロフェンは 10~300 μM でそれ ぞれ濃度依存的に血小板凝集を抑制した(図2.6.2.11). 表2.6.2.7 臨床投与量における血漿中未変化体濃度 薬物 臨床投与量 (mg) 血漿中未変化体濃度 (μM) セレコキシブ 200 3.1 ロキソプロフェンナトリウム 60 3.41) インドメタシン 25 2.8 ジクロフェナクナトリウム 25 1.3 イブプロフェン 200 80 1):ロキソプロフェン-SRS としての濃度0 10 20 30 40 50 60 70 80 90 100 ∗∗ ∗∗ ∗∗ ∗∗ 3 10 30 100 300 イブプロフェン(μM) アラ キドン 酸誘発 血小板 凝集 ( %) 100 インドメタシン(μM ) 0 10 20 30 40 50 60 70 80 90 100 ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0.3 1 3 10 30 アラ キドン 酸誘発 血小 板凝集 ( %) ∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 溶媒 0 10 20 30 40 50 60 70 80 90 3 10 30 100 300 イブプロフェン(μM) アラ キドン 酸誘発 血小板 凝集 ( %) インドメタシン(μM ) 0 10 20 30 40 50 60 70 80 90 100 ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0.3 1 3 10 30 アラ キドン 酸誘発 血小 板凝集 ( %) ∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 溶媒 100 ジクロフェナク(μM) 0 10 20 30 40 50 60 70 80 90 ∗ ∗∗ ∗∗ ∗∗ 0.1 0.3 1 3 10 アラキ ドン 酸誘発 血小板 凝集 ( %) ∗∗ ∗∗ ∗∗ 溶媒 100 ジクロフェナク(μM) 0 10 20 30 40 50 60 70 80 90 ∗∗ ∗∗ ∗∗ 0.1 0.3 1 3 10 アラキ ドン 酸誘発 血小板 凝集 ( %) ∗∗ ∗∗ ∗∗ 溶媒 100 100 0.3 1 3 10 30 ロキソプロフェン-SRS(μM) 0 10 20 30 40 50 60 70 80 90 ア ラキ ドン酸 誘発血 小板凝 集 ( %) ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 0.3 1 3 10 30 ロキソプロフェン-SRS(μM) 0 10 20 30 40 50 60 70 80 90 ア ラキ ドン酸 誘発血 小板凝 集 ( %) ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 セレコキシブ(μM) 0 10 20 30 40 50 60 70 80 90 0.3 1 3 10 30 アラ キドン 酸誘発 血小板 凝集 ( %) 溶媒 セレコキシブ(μM) 0 10 20 30 40 50 60 70 80 90 100 0.3 1 3 10 30 アラ キドン 酸誘発 血小板 凝集 ( %) 溶媒 0 10 20 30 40 50 60 70 80 90 100 ∗∗ ∗∗ ∗∗ ∗∗ 3 10 30 100 300 イブプロフェン(μM) アラ キドン 酸誘発 血小板 凝集 ( %) 100 インドメタシン(μM ) 0 10 20 30 40 50 60 70 80 90 100 ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0.3 1 3 10 30 アラ キドン 酸誘発 血小 板凝集 ( %) ∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 溶媒 0 10 20 30 40 50 60 70 80 90 3 10 30 100 300 イブプロフェン(μM) アラ キドン 酸誘発 血小板 凝集 ( %) インドメタシン(μM ) 0 10 20 30 40 50 60 70 80 90 100 ∗ ∗∗ ∗∗ ∗∗ ∗∗ 0.3 1 3 10 30 アラ キドン 酸誘発 血小 板凝集 ( %) ∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 溶媒 100 ジクロフェナク(μM) 0 10 20 30 40 50 60 70 80 90 ∗ ∗∗ ∗∗ ∗∗ 0.1 0.3 1 3 10 アラキ ドン 酸誘発 血小板 凝集 ( %) ∗∗ ∗∗ ∗∗ 溶媒 100 ジクロフェナク(μM) 0 10 20 30 40 50 60 70 80 90 ∗∗ ∗∗ ∗∗ 0.1 0.3 1 3 10 アラキ ドン 酸誘発 血小板 凝集 ( %) ∗∗ ∗∗ ∗∗ 溶媒 100 100 0.3 1 3 10 30 ロキソプロフェン-SRS(μM) 0 10 20 30 40 50 60 70 80 90 ア ラキ ドン酸 誘発血 小板凝 集 ( %) ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 0.3 1 3 10 30 ロキソプロフェン-SRS(μM) 0 10 20 30 40 50 60 70 80 90 ア ラキ ドン酸 誘発血 小板凝 集 ( %) ∗∗ ∗∗ ∗∗ ∗∗ ∗∗ 溶媒 セレコキシブ(μM) 0 10 20 30 40 50 60 70 80 90 0.3 1 3 10 30 アラ キドン 酸誘発 血小板 凝集 ( %) 溶媒 セレコキシブ(μM) 0 10 20 30 40 50 60 70 80 90 100 0.3 1 3 10 30 アラ キドン 酸誘発 血小板 凝集 ( %) 溶媒 図2.6.2.11 ヒト血小板凝集に対するセレコキシブ及び NSAID の作用 ヒト末梢血から分離した多血小板血漿にアラキドン酸を添加して凝集を誘発した.結果は乏血小板血 漿の透過光を100%としたときの最大凝集率を示す.図中の各点は 5 例の平均値±標準誤差を示す. ∗:p<0.05,∗∗:p<0.01(溶媒対照群の最大凝集率に対する有意差,Dunnett の多重比較検定). (添付資料4.2.1.1-11:健常成人男性由来ヒト血小板,図 1 を改変)
![表 2.6.2.5 セレコキシブの各種酵素との相互作用 [添付資料 4.2.1.1-5 (参考) :ヒト臍帯静脈内皮細胞,ラット及びウシ組織, A-431 細胞,表 2 から抜粋] 酵素 由来 セレコキシブ 10 μM の阻害 率(%) 1) 対照薬 対照薬の IC 50(μM) ACE HUVEC <10 カプトプリル 0.00040 アデニレートシクラーゼ ラット脳 <10 メチレンブルー 228 グアニレートシクラーゼ ウシ肺臓 <10 メチレンブルー 3.1 プロ](https://thumb-ap.123doks.com/thumbv2/123deta/8042946.843819/14.892.134.764.166.342/アデニレートシクラーゼグアニレートシクラーゼメチレンブルー.webp)