Tel81358417520.Fax81358418166.Emailawatabe@mail.ecc.u-tokyo.ac.jp
受賞者総説
魚貝類筋肉タンパク質機能の多様性と分子機構
(平成 17 年度日本水産学会賞受賞)
渡
部
終
五
(東京大学大学院農学生命科学研究科)Functional diversity of muscle proteins from ˆsh and shellˆsh and molecular mechanisms involved
SHUGOWATABE
Graduate School of Agricultural and Life Sciences, The University of Tokyo, Bunkyo, Tokyo 1138657, Japan
1. は じ め に わが国では魚貝類が動物性タンパク質の半分近くを供 給しており,栄養学的にも重要な食資源となっている。 魚貝類の可食部のほとんどは筋肉によって占められてい る。したがって,筋肉に関する研究,とくにタンパク質 化学的研究は学術上のみならず,応用上重要である。 魚類を対象とした筋肉の化学的研究は古く,筋タンパ ク質の主要成分ミオシンについては 1940 年代のベル ギーの Hamoir による研究に始まる。その後,イギリス の Connell はミオシンやアクチンに関する生化学的研究 を詳細に行い,魚類ミオシンが畜肉のそれに比べて著し く不安定であることを明らかにした。1)また,貝類につ いてもイギリスの Bailey が二枚貝閉殻筋からパラミオ シンを 1940 年代に発見した。2)その後も,二枚貝閉殻 筋の低エネルギー消費の収縮,いわゆるキャッチに関す る研究が継続して行われてきた。 わが国の魚類筋タンパク質の研究には特殊事情が加わ っている。わが国では古来より魚肉をすり身にして加熱 ゲルを調製した加工食品,いわゆる蒲鉾を利用してき た。現在でも水産加工食品中,製品別では蒲鉾関連のも のが圧倒的に多くを占めている。この加熱ゲル化の機構 を明らかにするため魚肉タンパク質の研究が盛んに行わ れてきたが,ミオシンにアクチンが結合したアクトミオ シンを対象としたものがほとんどあった。1970 年代に 入って北大の新井らが魚類ミオシンの生化学的研究を精 力的に行い,魚類ミオシンの不安定性とともに魚種特異 性を明らかにし,貯蔵や加工に伴うミオシンの変性の問 題の解決に大きく貢献した。 しかしながら,魚類ミオシンはその不安定さのため, 構造や機能に不明な点が多く残されてきた。すなわち, 魚類ミオシンの不安定さの原因,また,魚肉の加熱ゲル 形成の分子機構についてもほとんどが明らかにされてい なかった。そこでわれわれは,1970 年代後半からこの 問題に取り組み,魚貝類筋タンパク質につき生化学的性 状を詳細に調べるとともに,最近では遺伝子工学的手法 をも導入し分子レベルの研究を行っている。この研究で は未だ全体のごく一部を明らかにしているにすぎない が,概略を紹介すると次の通りである。 魚類の血合筋からミオシンを精製してサブユニット構 成や ATPase 活性などの生化学的性状を調べ,この筋 組織が遅筋に分類されることを明らかにした。次に,低 温および高温に馴化したコイを対象に,普通筋(速筋) からミオシンを精製し,コイは温度依存的に異なるアイ ソフォームを発現することを明らかにした。一方,二枚 貝閉殻筋に特徴的な低エネルギー消費で長時間の収縮を 持続するキャッチ運動が,弾性タンパク質 twitchin の リン酸化で制御されていることを示した。さらに,応用 的側面にも検討を加え,蒲鉾原料として重要なスケトウ ダラおよびシログチ普通筋の一次構造と種々の分析手法 で調べた立体構造の特徴とを比較して魚肉加熱ゲル形成 の分子機構の一端を明らかにした。このほか,筋小胞体 Ca ポ ン プ , ミ ト コ ン ド リ ア ATP 合 成 酵 素 , 巻 貝 コ ラーゲンなどの研究も手がけた。 この総説では魚類の筋組織とミオシンの構造と機能を 解説するとともに,魚類の温度適応に伴うミオシンの構 造と機能の変化を中心にわれわれが行った研究の成果の 一部を紹介する。
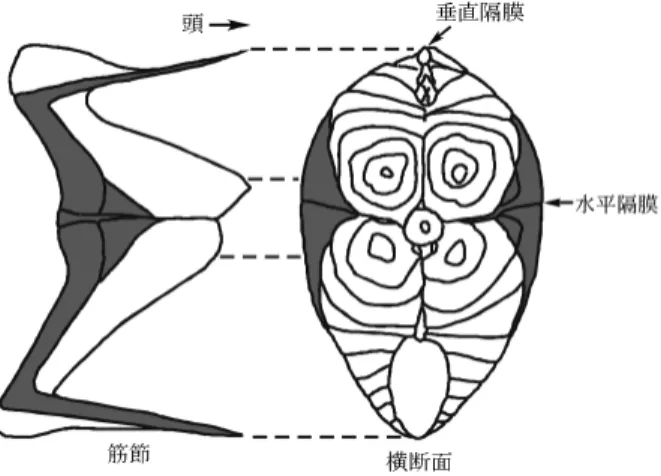
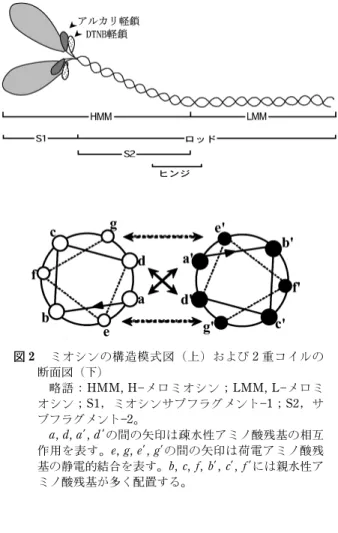
図 1 マサバ筋節の概観図(影部分は血合筋を表す)1) 2. 筋組織 動物とは文字通り,動くことのできる生物の総称であ る。動物の動きは一般に筋肉という組織を通じて行わ れ,この動きは生理学的には筋(肉)運動と呼ばれる。 魚類には他の脊椎動物と同様に,大きく分けて 2 種類 の筋組織,横紋筋と平滑筋が存在する。二枚貝などの軟 体動物にはこのほか,横紋筋と平滑筋の中間的な斜紋筋 が存在する。脊椎動物の横紋筋は機能的にみて,骨格を 動かす骨格筋と,常に運動し続ける心筋とに分かれる。 魚類筋肉の大部分は骨格筋型の横紋筋で,その特徴は, 他の脊椎動物とは異なり,中胚葉性の筋節が終生保持さ れているところにある。このことは魚肉を加熱すると W 状の身が容易に剥がれてくることからもわかる。こ れは加熱により,筋節を包んでいるコラーゲンがゼラチ ン化し,各筋節中の加熱凝固したタンパク質を一かたま りとして分離させるためである。その詳細は図 1 に示 すように,背側および腹側に一つづつ同心円上に折り重 なった筋節が,頭部から尾部の方向に円錐の先を突き出 すような形で配置している。3)さらに,魚類の骨格筋に は収縮速度の高低によって,哺乳類の速筋に相当する普 通筋と,遅筋に対応する血合筋に分けることができる。 血合筋は,とくにイワシ,サバ,ブリなどの回遊魚では 普通筋とはっきりと区別される位置に存在する。これら 表層に存在する血合筋のほか,沖合で大きな回遊を行う マグロやカツオでは,脊椎骨にまで達する深部血合筋と 呼ばれる遅筋も存在する。一方,沿岸の底棲魚であるタ イやヒラメでは表層血合筋でさえ発達していない。血合 筋の名前はその色から由来している。すなわち,血合筋 には筋肉色素で酸素貯蔵の機能をもつミオグロビンが存 在し,また,酸化還元反応で効率よく多量の ATP をエ ネルギー源として獲得する細胞小器官のミトコンドリア も多い。血合の名前が表すようにマグロやカツオの深部 血合筋では血液色素へモグロビンも含まれているが,そ の量はミオグロビンに比べて遥かに少ない。 魚類骨格筋の筋線維は,高等脊椎動物のものと同様 に,筋原線維と呼ばれる直径 1~2 mm,長さ 10~100 mm の細長い円筒状の線維から成り立つ多核細胞であ る。4)光学顕微鏡下で筋原線維を観察すると,明暗の紋 様がみられることも他の脊椎動物の骨格筋と同じであ る。これがいわゆる横紋筋の名の由来である。明るい部 分は光学的特性から I 帯と,一方,暗い部分は A 帯と 呼ばれる。I 帯には直径 5~7 nm の細いフィラメントの みがみられ,A 帯には細いフィラメントと直径 10~11 nm の太いフィラメントが重なり合う。筋肉の生理的作 用である運動は,2 つのフィラメントが互いに滑り合う ことによって行われる。細いフィラメントはアクチンを 主体とし,トロポミオシンやトロポニンなどを含む。一 方,太いフィラメントはミオシンが主成分である。二枚 貝の閉殻筋の太いフィラメントではパラミオシンのフィ ラメントを芯にその表面をミオシンが覆い,直径 70 nm 以上,長さ 25 mm 以上の巨大なフィラメントを形成し ている。この巨大なフィラメントが低エネルギー消費で 10 kg/cm2以上の最大張力を示すキャッチ運動を可能に する。 3. ミオシン重鎖の構造と機能 ミ オ シ ン は ATPase の 触 媒 活 性 , ア ク チ ン と の 結 合,および軽鎖サブユニットまたはカルモジュリンと結 合する性質を基本として,分子ファミリーを形成してい る。ミオシン・ファミリー分子の多くは遺伝子あるいは 組織化学的にその存在が証明されているに過ぎないが, ミオシンが筋収縮のみならず,細胞内の物質運搬,細胞 運動,細胞質分裂にも重要な役割を果たすことは明らか である。筋収縮に関与するミオシンは,他の分子ファミ リーと議論するときには,ミオシンと呼ばれる。ここ では,とくに断らない限りミオシンを単にミオシンと 呼ぶ。このミオシンは分子量約 50 万,長さ約 140 nm で,2 本の重鎖サブユニットと 4 本の軽鎖サブユニット が非共有結合で結ばれている(図 2)。3)魚類の筋原線維 では,約 60 をこのタンパク質が占める。 ミオシン分子は線維状のロッド部分と,西洋梨型の球 状部分のサブフラグメント1(S1)からなり,ロッド ではミオシン重鎖の a らせん部分 2 本が互いに絡み合 って 2 重コイル(coiled-coil)を形成する(図 2)。一方, S1 領域には軽鎖サブユニットが非共有結合で結ばれて おり,また,ATPase の触媒部位およびアクチン結合部 位もこの領域にある。S1 にアクチンが結合し,生理的 低イオン強度,Mg2+存在下,ATP が分解するときの エネルギーを利用して,ミオシンを主体とする太いフィ ラメントが,アクチンを主要成分とする細いフィラメン トの間に滑り込み,筋肉が収縮する。
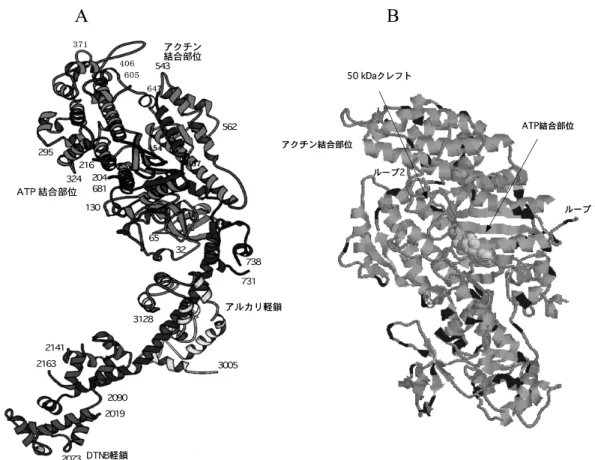
図 2 ミオシンの構造模式図(上)および 2 重コイルの 断面図(下) 略語HMM, HメロミオシンLMM, Lメロミ オシンS1,ミオシンサブフラグメント1S2,サ ブフラグメント2。 a, d, a′,d ′の間の矢印は疎水性アミノ酸残基の相互 作用を表す。e, g, e′,g′の間の矢印は荷電アミノ酸残 基の静電的結合を表す。b, c, f, b′, c′,f ′には親水性ア ミノ酸残基が多く配置する。 ミオシン分子は,タンパク質分解酵素の働きを受けや すい特定の領域があり,酵素の限定分解で S1 とロッド に容易に分けられる。ロッドはさらに,サブフラグメン ト2(S2)と Lメロミオシンに分けることができる。 条件によっては S1 および S2 を結合した Hメロミオシ ンを調製することもできる。現在いくつかの魚種でミオ シン重鎖の全長あるいは一部分の一次構造が cDNA ク ローニングによって決定されている。また,ゲノム解析 からも多くのミオシン遺伝子が同定されて一次構造が演 鐸されている。われわれも,コイ,メダカ,ソウギョ, スケトウダラ,シログチ,マエソ,ハクレンなどからミ オシン重鎖遺伝子全長を cDNA クローニングして一次 構造を演鐸した。後述するように,コイ普通筋は生息温 度に依存していくつかのミオシン重鎖アイソフォームを 発現するが,いずれのアイソフォームもアミノ酸残基数 は 1,931~1,935 である。 S1 部分はニワトリ速筋のものにつき立体構造が決定 されている(図 3)。5)S1 重鎖はタンパク質分解酵素ト リプシンによって,N 末端側から 25,50,および 20 kDa の 3 つのフラグメントに分かれる。20 kDa 成分は a らせん構造をとり,線維状のロッド部分とつながる。 各フラグメントをつなぐ部分はループを形成している。 ATP はこの 25 および 50 kDa フラグメントから形成さ れる立体的に窪んだ部分(クレフト,活性部位)に入り 込む。両フラグメントを結ぶループは ATP が入り込む ポケットの入り口に位置する。ATP はポケット内で加 水分解され,このエネルギーで生じた立体構造の変化が a らせんからなる 20 kDa フラグメントに伝えられる。 さらに,ロッドが重なり合って形成されるミオシンの太 いフィラメントにまでその力が及び,滑り運動が起こ る。 ロッドは前述のように a らせんの 2 重コイルを形成 している。ロッドのアミノ酸配列をみると,親水性およ び疎水性を基準にアミノ酸 7 残基(a, b, c, d, e, f, g)の 繰り返しが,また,これを 4 回繰り返した 28 残基の周 期が存在する(図 2)。3)このうち,a および d の位置に は疎水性アミノ酸が多く,b, c,および f の位置には電 荷をもったアミノ酸が多い。28 残基の周期性を保持す るために,いくつかの周期では 29 アミノ酸残基を 1 グ ループとするものが存在する。29 番目のアミノ酸は skip residue と呼ばれる。アミノ酸 7 残基のうち,2 つ の a らせんが隣り合う位置に疎水性アミノ酸が a らせ ん当たり 2 個,2 本の a らせんで計 4 個配位し,その疎 水結合で 2 重コイル構造が安定化される。親水性アミ ノ酸の並び方にも,正および負電荷のもので 7 および 28 残基の周期性がみられる。 前述のように,ミオシンは Mg2+存在下,生理的な 低イオン強度で ATPase 活性がアクチンによって賦活 され,このとき得られるエネルギーでミオシンの太いフ ィラメントとアクチンの細いフィラメントが滑り運動を おこす。筋肉の収縮や弛緩は Ca2+によって制御され, その濃度範囲は nM~mM である。 一方,ミオシン単独でも mM オーダーの Ca2+が存 在すると ATPase 活性を示すが,この濃度は生筋では みられない。Ca2+ATPase 活性は pH によって大きな 影響を受ける。1)普通筋ミオシンでは,pH 6 および 9 付 近に極大値を,さらに pH 7.5 付近に極小値を示す。一 方,血合筋ミオシンでは pH 9 付近の極大値がみられな い。両者の違いには未だ十分な説明はできていない。前 述のように,魚類のミオシンは著しく不安定であるが, ニジマス普通筋ミオシン Ca2+ATPase 活性の失活速度 が一次反応に従うことが最初に示された。この方法で算 出される変性速度恒数でミオシンの魚種間の安定性の違 いが定量的に比較できる。ウサギ速筋ミオシンに比べる と,魚類ミオシンは著しく不安定である。その中ではテ ィラピアやマグロ類など熱帯性や大型の回遊魚のミオシ ンは比較的安定である。一方,同じ回遊魚でも沿岸性の マサバのミオシンは不安定である。このような魚類普通 筋ミオシンの安定性の差は魚類の生息温度とよく相関す る。
図 3 ミオシン・サブフラグメント1(S1)の立体構造(Rayment ら5)より)(A)および S1 領域における 10°C および 30°C 型コ イ普通筋ミオシン重鎖のアミノ酸変異箇所(B) A のパネルの数字は N 末端からのアミノ酸残基数を表す。また,アルカリ軽鎖および DTNB 軽鎖の N 末端からアミノ酸 残基数は,それぞれ 2000 および 3000 台の番号で表す。 4. ミオシン軽鎖の構造と機能 図 2 に示したように,ミオシンの頭部球状の S1 領域 には軽鎖が重鎖に非共有結合で結ばれている。3)ミオシ ン 1 分子には頭部が 2 つあり,S1 分子 1 個当たり 2 本 の軽鎖が結合していることから,ミオシン 1 分子には 計 4 個の軽鎖が存在する。軽鎖サブユニットは 2 種類 存在し,その一つはミオシン分子をアルカリ処理すると 重鎖サブユニットから解離するもので,アルカリ軽鎖と 呼ばれる。この軽鎖は,ミオシン分子の ATPase 活性 の発現に必須と考えられてきたことから,必須軽鎖とも 呼ばれる。近年,この軽鎖はむしろミオシン重鎖の安定 化に寄与しているとされている。魚類を含めた脊椎動物 の速筋では,同一筋細胞中に分子量の異なる 2 種類の 必須軽鎖が含まれている。分子量の大きい順に A1 およ び A2 軽鎖と呼ぶ場合が多い。速筋ミオシン 1 分子は 2 個の S1 をもち,さらに各 S1 には 1 分子あたり 1 本の 必須軽鎖が存在する。また,後述する調節軽鎖は 1 種 類しかないことから,ミオシン分子には,同一の必須軽 鎖が結合したホモ型 2 種類と,異なった必須軽鎖を結 合したヘテロ型 1 種類の,計 3 種類が存在することが 考えられる。実際の筋肉でもこの 3 種類のミオシン・ アイソフォームが存在するようであるが,その生理的意 義は不明である。ミオシン分子中の A1 および A2 軽鎖 のモル比は必ずしも 11 にはならないが,これはミオ シンには同一の必須軽鎖を結合した 2 種類のアイソフ ォームが存在することによる。 必 須 軽 鎖 以 外 の 軽 鎖 は , SH 試 薬 5,5 ′ -dithio-bis-nitrobenzoic acid (DTNB) を用いた処理で重鎖から解 離することから,DTNB 軽鎖と呼ばれる。この骨格筋 の軽鎖と類似の構造をもつ平滑筋ミオシンの 20 kDa 軽 鎖は,リン酸化することによってアクチン存在下のミオ シン Mg2+ATPase 活性を賦活することから,両筋肉 の軽鎖は併せて調節軽鎖と呼ばれる。骨格筋の調節軽鎖 については,本来の機能は未だ明らかでない。調節軽鎖 は必須軽鎖とは異なり,同一筋細胞中には 1 種類しか ない。 必須および調節軽鎖とも,ミオシン S1 重鎖の C 末端 側のフラグメントで a らせん構造をとる 20 kDa 成分の S2 との境界領域付近に結合している(図 2,図 3)。5)必 須軽鎖はその N 末端側に,一方,調節軽鎖は C 末端側 に位置する。一般に A2 軽鎖の分子量は DTNB 軽鎖の それより小さいが,われわれは魚種によっては A2 軽鎖
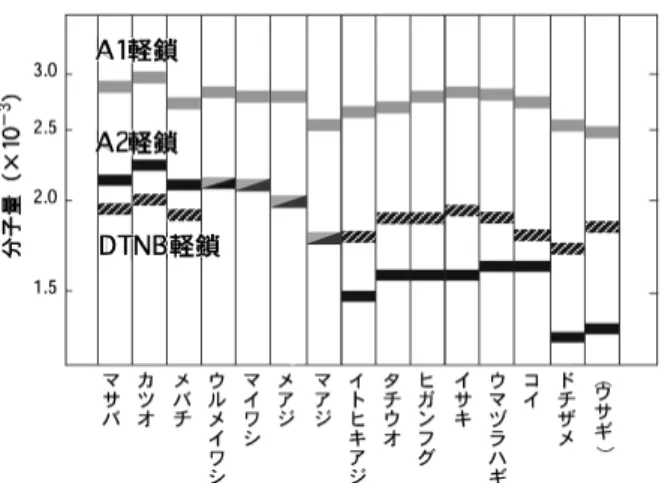
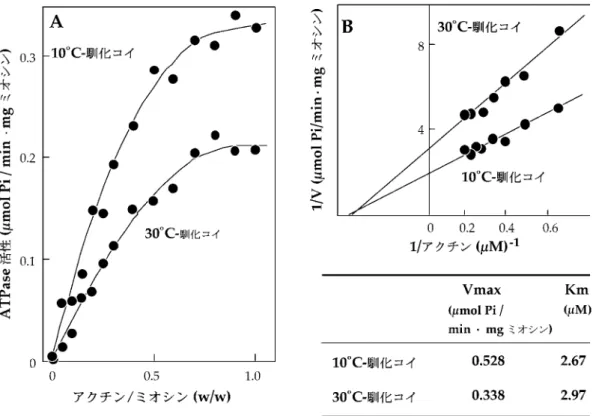
図 4 魚類普通筋ミオシン軽鎖の分子量の比較6) の分子量が DTNB 軽鎖のそれと同じか,さらにはそれ より大きくなることを明らかにした。6)興味深いこと に,マグロなどの外洋性の回遊魚では軽鎖の分子量が A1>A2>DTNB 軽鎖,マサバを含めた沿岸性の回遊魚 では A1>A2=DTNB 軽鎖,その他では哺乳類速筋の 場合と同様に A1>DTNB 軽鎖>A2 となる(図 4)。 なお,マサバ血合筋ミオシンでは同魚種の心筋ミオシ ンと同様に各 1 種類の普通筋ミオシンの必須軽鎖およ び調節軽鎖に相当するミオシン軽鎖しかなく,前述のよ うな表記法に従えば,A1=A2>DTNB 軽鎖となる。1) 免疫化学的性状を比較すると,血合筋および心筋ミオシ ン軽鎖は互いによく似るが,普通筋のものとは明らかに 相違する。したがって,大きい分子量の A2 軽鎖の構造 は恒常的に使う筋肉に好都合にできていることが示唆さ れるが,その分子機構は未だ不明である。 魚類普通筋ミオシンの必須軽鎖の一次構造につき,ボ ラでタンパク質レベルから,一方,われわれはコイで遺 伝子レベルから決定した。7)哺乳類やニワトリ速筋ミオ シンの場合と同様に,ボラやコイの A1 軽鎖は A2 軽鎖 に比べて N 末端側にアラニン,プロリン,リシンに富 む 約 40 残 基 の ペ プ チ ド , い わ ゆ る ``diŠerence pep-tide'' が付加されている。哺乳類の場合,A1 および A2 軽鎖は同一遺伝子の読み取り開始点の相違と選択的スプ ライシングにより生合成される。そのため,diŠerence peptide 領域付近のアミノ酸配列を除き,C 末端側の配 列は完全に一致する。一方,魚類普通筋ミオシンの A1 および A2 軽鎖ではアミノ酸の相違が全領域に及ぶ。魚 類の A1 および A2 軽鎖は異なった遺伝子から生合成さ れることが遺伝子解析から示された。果たして生物の進 化のどの段階でこのような必須軽鎖の遺伝子発現様式が 変化したのであろうか。少なくとも両生類カエルの軽鎖 遺伝子は恒温動物タイプであることがわかっている。わ れわれはさらに,コイ普通筋の DTNB 軽鎖についても 分子生物学的手法により一次構造の解析を行い,哺乳類 とほぼ同様の構造をもつことを明らかにした。 5. 筋運動の温度適応 恒温動物の体温である 37°C に比べると,水圏は一般 に低温の環境にあり,変温動物である魚類が低温でも 37°C と同じ機能を果たすためには,タンパク質の構造 をより柔軟に保つ必要がある。したがって,魚類のタン パク質は一般に恒温脊椎動物の同じ機能を果たすタンパ ク質に比べて不安定ということになる。しかしながら, 魚類の生息圏は氷点下から 40°C 近くまで,その幅は著 しく大きい。魚類には種に固有の生息水温があり,魚種 によって同じ機能をもつタンパク質でもその活性と構造 安定性は大きく異なる。一方,湖沼に生息するコイやフ ナなどの淡水魚は,生息地が地理的に隔離されている 上,季節的に水温が 0°C 付近から 30°C 以上と大きく変 動する。したがって,低温で機能を果たすべく構造を柔 軟にしているタンパク質は,体温が 30°C も上昇すれば 変性することも考えられる。逆に,高温で働くために触 媒活性を多少犠牲にしても構造を安定化しているタンパ ク質は,低温では機能できないであろう。すなわち,環 境水温の変化に対する何らかの補償機構がなければ,こ れらの広温域性淡水魚は生存することができない。 キンギョの遊泳運動の恒常性に関しては 1940 年代に ス タミナ ・ト ン ネルを 用い て詳 しい 解析 がさ れて い る。8)キンギョを種々の温度で馴化させ,次いでこの魚 につき種々の水温で巡航速度を測定したところ,低温馴 化したキンギョの遊泳能力は高温馴化の魚に比べて,低 水温では大きく,逆に高水温では小さい。温度馴化に伴 う運動能力の補償が明白に認められた。次いで,温度馴 化に伴って普通筋筋原線維 Mg2+ATPase が変化する ことが,1975 年イギリスの Johnston らによって報告さ れた。その後 1986 年,同じくイギリスの Heap らはコ イ普通筋筋原線維につき温度馴化に伴う Mg2+ATPase 活性の変化を示し,さらに,この変化が 4~5 週間程度 かけて可逆的に進行することを明らかにした。 6. 温度馴化コイのミオシンの構造と機能 われわれは,Johnston らの発見から約 15 年も経過し た 1980 年代の終わり頃に,10 および 30°C に 5 週間以 上,温度馴化させたコイ普通筋からミオシンの単離を試 みた。9)ミオシン Ca2+ATPase 活性には両馴化魚間で 差がみられなかったが,アクチン活性化ミオシン Mg2+ ATPase 活性は同一測定温度で比較すると,10°C 馴化 魚の活性は 30°C 馴化魚の約 1.5 倍高かった(図 5)。こ の差は,筋原線維 Mg2+ATPase 活性の差をよく反映 した。また,20°C に温度馴化したコイの普通筋から調 製したミオシンのアクチン活性化 Mg2+ATPase 活性
図 5 10°C および 30°C 馴化コイ普通筋ミオシンのアクチン活性化 Mg2+ATPase 活性(A)および反応速度論解析結果(B)9) は,10 および 30°C で馴化したコイ普通筋ミオシンのほ ぼ中間の値を示し,低温型および高温型普通筋ミオシ ン・アイソフォームの存在を示唆した。また,ミオシン Ca2+ATPase の熱安定性を調べると,10°C 馴化コイの ミオ シ ン は 30 °C 馴 化 の それ よ り 約 1.5 倍 安 定 で あ っ た。この変化は,魚類ミオシンがなぜ不安定かを分子レ ベルで解明するための格好のモデルとなることが考えら れた。 さらに,10,20,および 30°C 馴化コイから S1 を調 製し,陰イオン交換クロマトグラフィーに付し,S1 ア イソフォームを分離してみたところ,3 つの重鎖サブユ ニットが見いだされた。各温度馴化魚の普通筋における アイソフォームの組成から,10 および 30°C 馴化魚の普 通筋が必ずしも低温および高温型ミオシンのみから成り 立つわけではないことが明らかになった。 次に,遺伝子工学的手法を用いて低温および高温型ミ オシン重鎖をコードする cDNA をクローン化した。こ のクローニングの過程で,低温および高温型アイソフ ォームの中間的な配列を示す,中間型アイソフォームの 存在も明らかになった。なお,3 つの重鎖アイソフォー ムのアミノ酸配列を比較すると S2 領域で最も大きく異 なり,Lメロミオシン領域で最もよく類似した。S2 領 域の生理的機能は,他生物種のものも含めてよく理解さ れていない。演繹された S1 重鎖サブユニットのアミノ 酸配列を低温および高温型ミオシン間で比較すると,全 ての領域にわたって変異が観察されたが(図 3B),25 kDa および 50 kDa フラグメント間を結ぶループ 1,さ ら に は 50 kDa お よ び 20 kDa フ ラ グ メ ン ト 間 を 結 ぶ ループ 2 領域で変異が大きいことが明らかになった。 ウサギ速筋ミオシンや,遺伝子工学的解析が進んでいる 粘菌ミオシンなどの研究結果から,ループ 2 はアクチ ン活性化ミオシン Mg2+ATPase の最大反応初速度, すなわちミオシン頭部の首振り運動の速さ,筋肉の収縮 速度を決定する部位であることが示されている。一方, ループ 1 領域はアクチンとの結合部位の一つで,ミオ シン分子の力の発生を支配する領域であることが明らか にされている。このような重要な部位で低温および高温 型ミオシンの構造が大きく異なることは大変興味深い。 そこで,われわれはコイ低温および高温型ミオシン重鎖 のループ 1 およびループ 2 をコードする遺伝子を粘菌 ミオシン重鎖遺伝子に組み込み,アクチン活性化ミオシ ン Mg2+ATPase 活性や,ミオシンのアクチン・フィ
ラメント上の滑り運動を in vitro motility assay で調べ た と こ ろ , ル ー プ 2 領 域 の 変 異 の み の 効 果 が み ら れ た。10,11)したがって,温度馴化コイにおけるループ 1 領
域の変異,すなわちミオシンの滑り運動の変化には他の 部位のアミノ酸変異が関与していることになる(図 3B)。 軽鎖サブユニットについても,コイの温度馴化に伴う
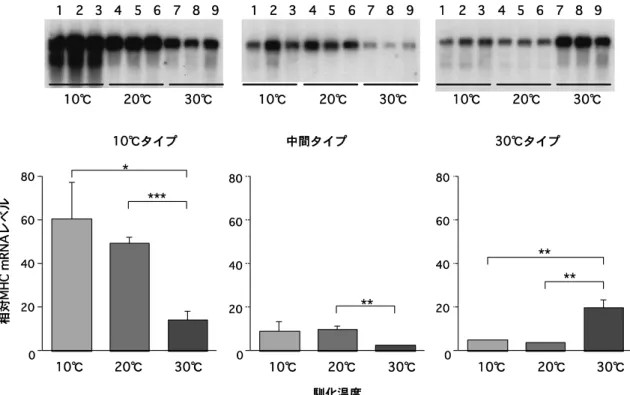
図 6 コイ普通筋 10°C 型,中間型および 30°C 型ミオシン重鎖(MHC)mRNA の 10°C,20°C および 30°C コイ普通筋における蓄 積量の比較9) 発現様式に変化がみられ,必須軽鎖では高温馴化で A1 と A2 軽鎖のモル比が明らかに減少した。また,調節軽 鎖では,複数存在する polyadenylation signal の使われ 方が変化し,高温馴化で小さいサイズの mRNA の比率 が多くなった。 7. 温度馴化によるミオシン重鎖遺伝子の発現調節 コイ普通筋からクローン化された 3 種類のミオシン cDNA は,3′端側の翻訳領域と,それに続く非翻訳領域 で塩基配列が大きく相違する。そこでこの領域をプロー ブに用いて,コイ普通筋が温度馴化に伴い各ミオシン重 鎖遺伝子の mRNA 蓄積量をどのように変化させるのか を Northern blot 解析法で調べてみた。結果は図 6 に示 すように,低温型は 10°C 馴化魚で,高温型は 30°C 馴 化魚で高く,ミオシン・アイソフォームの発現が転写レ ベルで制御されていることが明らかになった。9)予想外 に,中間型は,20°C 馴化魚よりも 10°C 馴化魚でより多 く発現し,低温型の一つのアイソフォームである可能性 もうかがわせた。 ゲノム遺伝子はタンパク質の一次構造の情報を担う構 造領域のほか,遺伝子の転写を調節する領域を構造遺伝 子の 5′上流域にもつ。したがって,コイ普通筋ミオシ ン遺伝子がその調節領域にどのような特徴をもっている のかに興味がもたれる。先のループ 2 付近をコードす る領域をプローブに用いて,コイ肝臓から構築したゲノ ム DNA ライブラリーをスクリーニングしたところ,こ のループ 2 領域が 2 つのエキソンにまたがってコード されていることが明らかになった。39 個の異なる塩基 配列,すなわち遺伝子がクローン化された。塩基配列を 演繹して一次構造を調べた結果,19 種類存在すること が示された。12)この一次構造を他の動物の構造と比較し て分子系統樹を作製すると,全て骨格筋に分類される が,その全てがタンパク質レベルで発現しているかどう かはわからない。さらに,ミオシン重鎖遺伝子ゲノムの 全配列を決定したところ,哺乳類の相同遺伝子の約半分 のサイズであったが,エキソン・イントロン構造および 各エキソンのサイズはよく類似し,イントロンのサイズ が両者で大きく異なることがわかった。13) コイはサケ類と同様に系統的 4 倍体種として知られ ており,染色体数が他の魚種とは異なり 46 である。そ こで 2 倍体種のソウギョから普通筋ミオシン重鎖をク ローニングしたところ,コイの場合と同じように低温お よび高温型遺伝子が得られた。14)したがって,馴化温度 依存的に発現するミオシン重鎖遺伝子は 4 倍体に由来 するものではなく,環境水温に適応する方法として広温 域性魚類が進化的に獲得したものであることが示唆され た。 なお,コイ普通筋ミオシン・アイソフォームの Lメ ロミオシンの部分を解析して分子系統樹を作製すると, コイ普通筋ミオシン重鎖と哺乳類のそれとは 4~5 億年
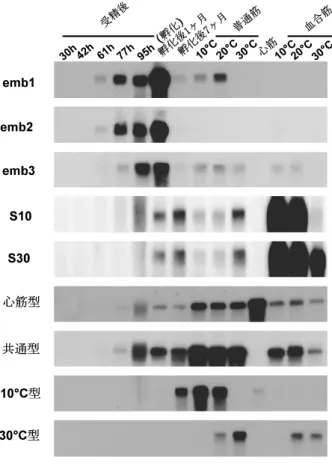
図 7 コイ骨格筋および心筋ミオシン重鎖 mRNA 蓄積量 の発生に伴う変動,組織分布および馴化温度に伴う変 動19)
emb1, emb2, emb3 は胚型ミオシン重鎖,S10 およ び S30 は 10°C および 30°C 馴化型血合筋ミオシン重 鎖,10°C 型および 30°C 型は 10°C および 30°C 馴化型 普通筋重鎖遺伝子を表す。19)図中,共通型は骨格筋ミ オシン重鎖遺伝子で保存された塩基配列をプローブに して分析したことを表す。 前に祖先遺伝子から分岐していることがわかり,これは 化石からの推定値とよく一致する。ちなみに,コイ普通 筋ミオシン・アイソフォーム同士では,分岐年代が約 8 千万年前と計算される。コイはこのときに,温度馴化の 機能を獲得したものと思われる。 コイ普通筋ミオシン重鎖遺伝子ゲノムクローンの一つ に,翻訳領域の塩基配列が低温型ミオシン cDNA のそ れにほぼ一致するものがみつかり,その調節領域の塩基 配列が決定された。この領域には基本転写因子の結合配 列 TATA box のほか,筋特異的遺伝子に多くみられる myocyte enhanncer factor 2 (MEF2) 結合サイト,E-box, cyclicAMP responsive element,などが存在し
た。15)この領域の下流にホタルの発光タンパク質である luciferase の遺伝子をレポーター遺伝子として結合さ せ,コイ普通筋に注入し飼育水槽の温度を 10 および 30 °C に変えたところ,数日後には低温条件の水槽のコイ でその遺伝子の発現が確認された。高温水槽でのコイで はこの遺伝子の発現は少ない。したがって,ここで用い た遺伝子調節領域のどこかに低水温の情報を担う転写調 節因子の結合サイトが存在することになる。詳しい解析 の結果,特定の領域がミオシン重鎖の温度依存的遺伝子 発現の制御に関係していることが明らかになった。しか しながら,魚類が感知した温度情報がどのようにミオシ ン重鎖遺伝子の発現調節にまで伝わるのか,未だ皆目見 当がつかない。 最近では,モデル魚であるメダカもコイと同様に馴化 温度依存的に異なる普通筋ミオシン重鎖遺伝子を発現す ることを見いだした。また,トラフグについては全ゲノ ムデータベースを利用してミオシン重鎖遺伝子の網羅的 解析を行い,ミオシン重鎖遺伝子の分子進化を明らかに しつつある。興味深いことにメダカ普通筋ミオシン重鎖 遺伝子の温度依存的発現調節は MEF2 結合配列を介し て制御されていること,偽遺伝子 3 個を含めて 11 個の 重鎖遺伝子がわずか 260 kbp ほどのゲノム領域にタン デムクラスターを形成して存在していることが明らかに なった。16)トラフグ普通筋ミオシン重鎖遺伝子では染色 体上の 3 箇所以上に分散してクラスターを形成して存 在し,いずれも 1 つのクラスターを形成している哺乳 類の速筋ミオシン重鎖遺伝子の染色体上の位置とは異な ることを見いだした。17,18)また,別途,普通筋型に分類 される胚型ミオシンの発生に伴う発現変動もコイやメダ カで明らかにしつつある(図 7)。19)筋分化の研究も残 されている大きな課題の一つである。 8. お わ り に 以上のように,魚類筋タンパク質の機能の多様性とそ の機能を発揮するための分子機構の一端が明らかになっ た。巨大な分子ファミリーを形成する魚類のミオシンの 研究はやっと緒に就いたような感さえする。今後もさら に,海産無脊椎動物も含めて,ミオシンの機能と多様性 の研究が進展するよう努力を続けたい。なお,この総説 では応用面に関する記述は省いたが,この方面の研究が 重要であることは無論である。また,二枚貝キャッチ筋 の研究も紙面の都合上省いたので,別途,既報の総説を 参照して頂きたい。20) 謝辞 本研究は橋本周久東京大学名誉教授はじめ多くの先生 方のご指導および当時の学生のおしみない協力のもとで 行われたもので,ここに記して感謝申し上げる。また, 研究費の多くの部分は文部科学省および日本学術振興会 の科学研究費補助金によって支援されたものであること にも記して感謝する。
文 献 1) 渡部終五.魚類のミオシンとアクチン.「水産動物筋肉タ ンパク質の比較生化学」(新井健一編)恒星社厚生閣,東 京.1989; 1930. 2) 渡部終五.パラミオシン.「水産動物筋肉タンパク質の比 較生化学」(新井健一編)恒星社厚生閣,東京.1989; 62 72. 3) 渡部終五.タンパク質.「水産利用化学」(鴻巣章二橋 本周久編)恒星社厚生閣,東京.1992; 4074. 4) 山口勝巳 .「水産生物化 学」東京大 学出版会,東 京. 1991; 1236.
5) Rayment I, Rypniewski WR, Schmidt-Base K, Smith R, Tomchick DR, Benning MM, Winkelmann DA, Wesen-ber G, Holden HM. Three-dimensional structure of myo-sin subfragment-1: a molecular motor.Science 1993;261: 5058.
6) Watabe S, Ochiai Y, Hashimoto K. Identiˆcation of 5,5′ -dithio-bis-2-nitrobenzoic acid (DTNB) and alkali light chains of piscine myoisn.Bull. Jpn. Soc. Sci. Fish. 1982; 48: 827832.
7) Hirayama Y, Kanoh S, Nakaya M, Watabe S. The two es-sential light chains of carp fast skeletal myosin, LC1 and LC3, are encoded by distinct genes and change their mo-lar ratio following temperature aclimation.J. Exp. Biol. 1997;200: 693701.
8) 渡部終五.魚類筋運動の温度馴化. 比較生理生化学 1992; 9: 1221.
9) Watabe S, Hirayama Y, Nakaya M, Kakinuma M, Kikuchi K, Guo X, Kanoh S, Chaen S, Ooi T. Carp ex-presses fast skeletal myosin isoforms with altered motor functions and structural stabillities to compensate for changes in environmental temperatures.J. Therm. Biol. 1998;22: 375390.
10) 平山 泰,柿沼 誠,渡部終五.ミオシンの構造と機 能.「魚貝類の筋肉タンパク質―構造と機能」(西田清義
編)恒星社厚生閣,東京.2000; 920.
11) Watabe S. Temperature plasticity of contractile proteins in ˆsh muscle.J. Exp.Biol. 2002;205: 22312236. 12) Kikuchi K, Muramatsu M, Hirayama Y, Watabe S.
Characterization of the carp myosin heavy chain mul-tigene family.Gene 1999;228: 189196.
13) Muramatsu-Uno M, Kikuchi K, Suetake H, Watabe S. The complete nucleotide sequence of carp myosin heavy chain gene.Gene 2005;349: 143151.
14) Tao Y, Kobayashi M, Liang C, Okamoto T, Watabe S. Temperature-dependent expression patterns of grass carp fast skeletal myosin heavy chain genes.Comp. Biochem. Physiol. Part B 2004;139: 649656.
15) Kobiyama A, Hirayama M, Muramatsu-Uno M, Watabe S. Functional analysis on the 5′‰anking region of carp fast skeletal myosin heavy chain genes for their expres-sion at diŠerent temperatures. Gene 2006;372: 8291. 16) Liang C, Kobiyama A, Nihei Y, Watabe S. cDNA cloning
and expression analysis of skeletal myosin heavy chain isoforms in medaka.Fish. Sci. 2002;68(Suppl.): 1030 1304.
17) Ikeda D, Clark MS, Liang C, Snell P, Yvonne JK Ed-wards, Elgar G, Watabe S. Genomic structural analysis of the puŠerˆsh (Takifugu rubripes) skeletal myosin heavy chain genes.Marine Biotechnol. 2004;6: S462S467. 18) Watabe S, Ikeda D. Diversity of the puŠerˆshTakifugu
rubripes fast skeletal myosin heavy chain genes. Comp. Biochem. Physiol. Part D 2006;1: 2834.
19) Nihei Y, Ikeda D, Ono Y, Kobiyama A, Ohara S, Cole NJ, Johnston IA, Watabe S. Molecular cloning and mRNA ex-pression analysis of carp embryonic, slow and cardiac my-osin heavy chain isoforms.J. Exp. Biol. 2005;209: 188 198.
20) 舩原大輔,渡部終五.キャッチ収縮.化学と生物 2004; 42: 224229.