■
はじめに
日本アイソトープ協会医学・薬学部会放射性医薬品安 全性専門委員会で毎年実施している副作用事例調査は回 を重ねて 45 回となった.この調査は核医学検査に用い られる放射性医薬品と治療の目的で用いられる131I-ヨウ 化ナトリウムカプセルの投与に関連して発生した副作 用(adverse reaction)事例,ならびに放射性医薬品の不良 (defective products)事例の発生頻度とその内容を調べて 報告するものである.第 44 回(2018 年度)までの調査結 果の概要は,これまで 41 報にわたって本誌に報告して きた1, 2).2019 年度には,1975 年度から 2017 年度まで の調査結果について,放射性医薬品別副作用報告件数, 投与件数,100,000 件あたりの発生率,95%信頼区間お よび重篤症例の症状を英文にてとりまとめた3). 今回は 2019 年 4 月 1 日から 2020 年 3 月 31 日までの 1年間に発生した事例について,2020 年に調査した結果 を報告する.■
調査方法
調査は従来通り,調査票を核医学診療施設に送付し て回答を求めるアンケート方式で実施した.2019 年 4 月に,「第 45 回放射性医薬品副作用事例アンケート調 査 放射性医薬品副作用・不良品事例調査票(2019 年度 対象)」を,全国の核医学診療施設に送付した.これは副 作用・不良品事例発生のつど連絡通知を受け,調査資料 とするためである.また,2019 年度に使用した放射性 医薬品の投与件数調査の依頼を 2020 年 6 月に行った. 報告された個々の事例について委員会で検討を行った.■
調査結果
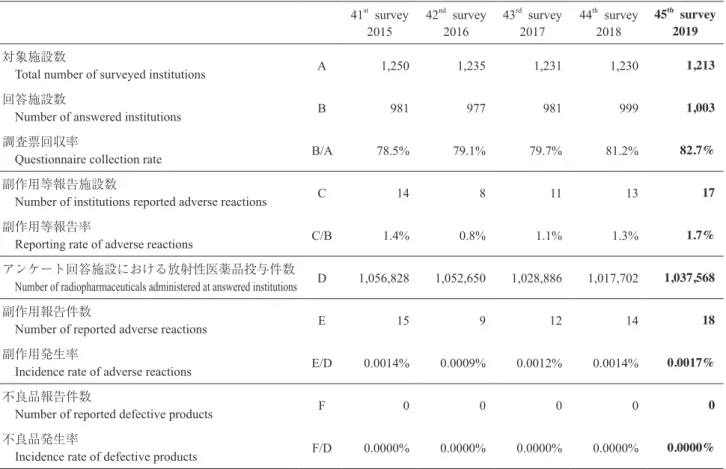
Table 1に今回の調査結果を示す.今回調査対象とし た 1,213 施設のうち,回答が得られたのは 1,003 施設 で,調査票回収率は 82.7%であった. 副作用事例は 17 施設より 18 件報告された.副作用 を報告した施設数は回答を寄せた 1,003 施設の 1.7%で あった.副作用の報告件数は前年度より 4 件多かった. 報告された放射性医薬品の全投与件数は 1,037,568 件 であるので,副作用の発生率は 0.0017%であり,投与 100,000件あたり 1.7 件,対前年度比は 1.3 となる.不良 品事例は前年度と同じく 0 件であった.過去 5 回の調査 結果を比較してみると,2015 年度以後の副作用発生率 は 0.0009∼0.0017%,不良品は 0.0000%である.今回の 副作用事例報告は,過去 5 年間の中で件数,発生率とも に最も多い. 2005∼2019 年度の間に報告された副作用等の発生件 数および頻度を 3 年ごとに区切り,その推移をみると, 副作用の発生頻度は 2005 年度から現在までに 100,000 要旨:本調査は,2019 年度に投与された放射性医薬品に関連して発生した副作用事例の発生頻 度とその内容を調べる目的で実施された.調査は,調査票を核医学診療施設に送付して回答を求め るアンケート方式で実施した.調査対象 1,213 施設のうち,1,003 施設より回答が得られ,回 答施設における放射性医薬品の投与件数は 1,037,568 件であった.副作用事例は 18 件報告さ れ,副作用発生率は 100,000 件あたり 1.7 件であった.不良品事例の報告はなかった. 核医学 58: 1–11, 2021放射性医薬品副作用事例調査報告 第 42 報
(2019 年度 第 45 回調査)
(公社)日本アイソトープ協会 医学・薬学部会 放射性医薬品安全性専門委員会
岡沢 秀彦
1上原 知也
2久慈 一英
3東 達也
4吉村 真奈
5【報 告】
1 福井大学高エネルギー医学研究センター 2 千葉大学大学院薬学研究院 3 埼玉医科大学国際医療センター核医学科 4 量子科学技術研究開発機構放射線医学総合研究所 5 東京医科大学放射線医学分野 連絡先:〒113-8941 東京都文京区本駒込2-28-45 (公社)日本アイソトープ協会 学術振興部学術課 医学・薬 学部会事務局件あたり 1.0∼1.8 件で大きな変化は見られない.不良品 については,100,000 件あたり 0.0∼0.2 件の発生頻度で ある(Table 2). 報告された副作用発現事例を使用した放射性医薬品別 にみると,メチレンジホスホン酸テクネチウム(99mTc) 注射液[99mTc-MDP]4 件,イオフルパン(123I)注射液[123 I-イオフルパン],ヒドロキシメチレンジホスホン酸テク ネチウム(99mTc)注射液[99mTc-HMDP]各 3 件,ヨウ化メ チルノルコレステノール(131I)注射液[131I-ヨウ化メチル ノルコレステノール],フルデオキシグルコース(18F) [18F-FDG]各 2 件,過テクネチウム酸ナトリウム(99mTc) 注射液[99mTc-パーテクネテイト],クエン酸ガリウム (67Ga)注射液[67 Ga-クエン酸ガリウム],ヘキサキス(2-メトキシイソブチルイソニトリル)テクネチウム(99mTc) 注射液[99mTc-MIBI],〔N,N'-エチレンジ-L-システイネー ト(3-)〕オキソテクネチウム(99mTc),ジエチルエステル 注射液[99mTc-ECD]各 1 件で,計 18 件であった(Table 3). 回答が得られた 1,003 施設での当該放射性医薬品総投 与件数(参考資料 1)を母数として算定した副作用発生頻 度は,131I-ヨウ化メチルノルコレステノール 0.1761%(検 Table 1 第 45 回放射性医薬品副作用等事例調査結果
The 45th survey of the adverse reactions to radiopharmaceuticals 41st survey 2015 42 nd survey 2016 43 rd survey 2017 44 th survey 2018 45 th survey 2019 対象施設数
Total number of surveyed institutions A 1,250 1,235 1,231 1,230 1,213 回答施設数
Number of answered institutions B 981 977 981 999 1,003 調査票回収率
Questionnaire collection rate B/A 78.5% 79.1% 79.7% 81.2% 82.7% 副作用等報告施設数
Number of institutions reported adverse reactions C 14 8 11 13 17 副作用等報告率
Reporting rate of adverse reactions C/B 1.4% 0.8% 1.1% 1.3% 1.7% アンケート回答施設における放射性医薬品投与件数
Number of radiopharmaceuticals administered at answered institutions D 1,056,828 1,052,650 1,028,886 1,017,702 1,037,568 副作用報告件数
Number of reported adverse reactions E 15 9 12 14 18 副作用発生率
Incidence rate of adverse reactions E/D 0.0014% 0.0009% 0.0012% 0.0014% 0.0017% 不良品報告件数
Number of reported defective products F 0 0 0 0 0 不良品発生率
Incidence rate of defective products F/D 0.0000% 0.0000% 0.0000% 0.0000% 0.0000%
Table 2 副作用・不良品事例報告の推移
Changes in reported cases with adverse reactions and defective products
2005–2007 2008–2010 2011–2013 2014–2016 2017–2019 調査票回収率(%)
Questionnaire collection rate (%) 79.0 75.4 79.2 79.1 81.2 副作用報告件数
Number of reported adverse reactions 62 58 33 33 44 不良品報告件数
Number of reported defective products 9 2 3 3 0 副作用発生頻度(10 万件あたり)
Incidence rate of adverse reactions (per 100,000) 1.7 1.8 1.0 1.0 1.4 不良品発生頻度(10 万件あたり)
査 100,000 対 176 件),99mTc-パーテクネテイト 0.0088% (同 9 件),67Ga-クエン酸ガリウム 0.0068%(同 7 件), 123I-イオフルパン 0.0063%(同 6 件),99mTc-MIBI0.0038% (同 4 件),99mTc-MDP 0.0032%(同 3 件),99mTc-HMDP 0.0024%(同 2 件),99mTc-ECD 0.0021%(同 2 件),18F-FDG 0.0009%(同 1 件)であった(Table 3). 従来からの副作用と比較するために,本委員会では症 例ごとに調査票の「副作用の症状」に基づき,副作用の種 類を血管迷走神経反応(V),発熱(F),アレルギー反応 (A),その他(O)に分類して検討した.2019 年度の副作 用発現症例の内容を列挙すると,血管迷走神経反応(V) が 9 件,アレルギー反応(A)が 7 件で,発熱(F),その 他(O)は各 1 件であった(Table 3,4). 個々の副作用事例について投与された放射性医薬品 との因果関係をみると,薬剤による可能性が“確実”が 2件(11%),“大”が 4 件(22%),“あり”が 12 件(67%) であった(Table 4,5).副作用の重篤度との関係では, “重篤”が 4 件(22%),“非重篤”が 14 件(78%)であった (Table 4,6).ただし,2019 年度調査では重篤度の定義 が曖昧であり,担当医の判断に基づいて判定された.こ のため,2020 年度からは例示した重篤な副作用の症状 から,“重篤”と判断した理由を選択してもらうこととし た. 2005∼2019 年度の間に報告された副作用症例を 3 年 ごとに区切り,種類別にまとめたものの推移をみると, 血管迷走神経反応(V),アレルギー反応(A),その他(O) は 100,000 件あたり各々0.5∼0.8 件,0.5∼1.0 件,0.0∼ 0.3件の発生件数であった.発熱(F)と分類された症例 はこの 15 年間で 3 件であった(Table 7).
米国核医学会(Society of Nuclear Medicine)の局方委員
会の報告4)では,18 施設で実施された 783,525 検査中 18
件の副作用事例が報告されており,頻度は 100,000 件 あたり 2.3 例であった.また,欧州核医学会(European Association of Nuclear Medicine)の報告5)では,100,000 件
Table 3 放射性医薬品別副作用事例(2019 年度)
Cases with adverse reactions to each radiopharmaceuticals (FY2019) 放射性医薬品*1 Radiopharmaceuticals 投与件数*2 Number of administered cases 副作用の種類*3
Types of adverse reactions 頻度 Incidence rate V F A O Total
131I-ヨウ化メチルノルコレステノール
[Iodinated (131I) Methylnorcholestenol Injection] 1,136 1 0 1 0 2 0.1761% 99mTc- パーテクネテイト
[Sodium Pertechnetate (99mTc) Injection] 11,368 1 0 0 0 1 0.0088% 67Ga- クエン酸ガリウム
[Gallium (67Ga) Citrate Injection] 14,755 0 0 1 0 1 0.0068% 123I-イオフルパン
[ioflupane (123I)] 47,878 2 0 0 1 3 0.0063% 99mTc-MIBI
[Technetium (99mTc) Hexakis (2-Methoxy-Isobutyl
Isonitrile) Injection] 26,404 1 0 0 0 1 0.0038% 99mTc-MDP [Technetium (99mTc) Methylenediphosphonate Injection] 126,575 1 0 3 0 4 0.0032% 99mTc-HMDP [Technetium (99mTc) Hydroxymethylenediphosphonate Injection] 122,577 3 0 0 0 3 0.0024% 99mTc-ECD [〔N,N -Ethylenedi-L-Cysteinate(3-)〕
Oxotechnetium (99mTc)-Diethyl Ester Injection] 46,533 0 1 0 0 1 0.0021% 18F-FDG
[Fludeoxyglucose (18F) Injection] 231,117 0 0 2 0 2 0.0009%
TOTAL 9 1 7 1 18
*1 慣用名表記([ ] 内は一般名)
Trivial name [general name]
*2 アンケート回答施設における投与件数(回収率 82.7%)
Number of radiopharmaceuticals administered at answered institutions (questionnaire collection rate 82.7%)
*3 副作用の種類:V;血管迷走神経反応,F;発熱,A;アレルギー反応,O;その他
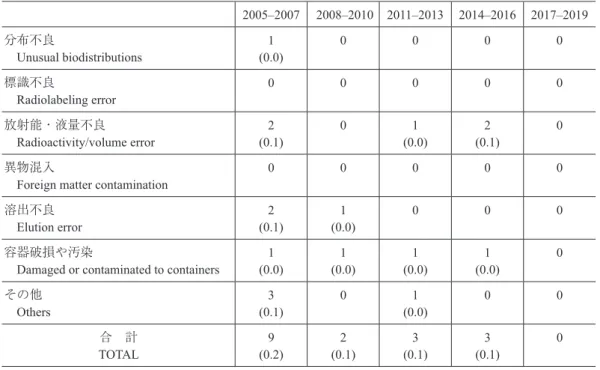
中 11 例であった.ただし,これらの調査では血管迷走 神経反応があらかじめ除外されている. 1975年度以降の放射性医薬品別副作用報告件数の推 移を Table 8 に示す. 院内製造の PET 製剤(18F-フルオロデオキシグルコー ス(FDG),15O-標識ガス剤および13N-アンモニア)の副 作用症例については,日本核医学会 PET 核医学委員会 が結果の解析にあたっている.2019 年度は院内製造の PET製剤投与に伴うと判断された副作用事例の報告は 0 件であった.投与件数については 122 施設から回答が得 られた.結果を参考資料 2 に示す. また,日本核医学会甲状腺 RI 治療委員会では,治療 目的で投与した131I-ヨウ化ナトリウムカプセルによる 副作用症例の調査を実施している.2019 年度は 2 件の 副作用事例が報告された.症状からの分類では,血管 迷走神経反応(V)と発熱(F)を併発した 1 件と,血管迷 走神経反応(V)を示した 1 件であった.なお,後者は 1,110 MBqアブレーション治療時の嘔吐であり,これに ついては外来で充分な対応ができるよう注意喚起が必要 と考える.投与件数については 248 施設から回答が得ら れた.結果を参考資料 3 に示す. 今回は不良品事例の報告はなかった.2005∼2019 年 度の間に報告された不良品事例の推移を 3 年ごとにまと めたものを Table 9 に示す.
■
利益相反
久慈一英は奨学寄付金,東達也は研究費・助成金を日 本メジフィジックス株式会社より受領している.その他 の著者に申告すべき利益相反はない.Table 4 副作用発現の症例(2019 年度) Cases with adverse reactions (FY2019) 放射性医薬品 Radiopharmaceuticals *
副作用の種類
Types of adverse reactions Severity of adverse reactions重 篤 度 Drug-induced possibilities因果関係 Adverse reactions副作用の症状
99mTc-パーテクネテイト[過テクネチウム酸ナトリウム (99mTc)注射液] (脳,甲状腺,唾液腺,異所性胃粘膜シンチグラフィ)
[Sodium Pertechnetate (99mTc) Injection]
V 非重篤Moderate to low 薬剤−可能性ありPossible 顔面のほてり感Hot flashes
99mTc-ECD[〔N,N'-エチレンジ-L-システイネート (3-)〕オキソテクネチウム(99mTc),ジエチルエステル注射液](局所脳血流シンチグラフィ)
[[N,N -Ethylenedi-L-Cysteinate(3-)] Oxotechnetium (99mTc)-Diethyl Ester Injection]
F 非重篤Moderate to low 薬剤−可能性ありPossible 発熱(37.7℃)Fever(37.7℃)
99m Tc-MDP[メチレンジホスホン酸テクネチウム (99m Tc)注射液] (骨シンチグラフィ) [Technetium (99m Tc) Methylenediphosphonate Injection] A 非重篤
Moderate to low 薬剤−可能性ありPossible くしゃみSneeze
A 重篤
High 薬剤−可能性大Probable 皮膚発赤,発疹,そう痒感 Skin redness, rash, itching [転帰:回復あり] V 重篤High 薬剤−可能性ありPossible 血圧低下,徐脈,悪心・嘔気,気分不良・不快感[転帰:回復あり] Lowering blood pressure, bradycardia, nausea, bad mood, discomfort
A 非重篤Moderate to low 薬剤−確実Definite 皮膚発赤,発疹,そう痒感Skin redness, rash, itching
99mTc-HMDP[ヒドロキシメチレンジホスホン酸テクネチウム (99mTc)注射液](骨シンチグラフィ)
[Technetium (99mTc) Hydroxymethylenediphosphonate Injection]
V 非重篤Moderate to low 薬剤−可能性ありPossible 血圧低下,めまい,顔面蒼白,発汗,悪心・嘔気Lowering blood pressure, dizziness, pallor, sweating, nausea
V 非重篤
Moderate to low 薬剤−可能性ありPossible 顔面紅潮Facial flushing
V 非重篤
Moderate to low 薬剤−確実Definite 頭痛Headache
99m
Tc-MIBI[ヘキサキス(2-メトキシイソブチルイソニトリル)テクネチウム (99m
Tc)注射液] (心筋血流シンチグラフィ) [Technetium (99m
Tc) Hexakis (2-Methoxy-Isobutyl Isonitrile) Injection]
V 非重篤
Moderate to low 薬剤−可能性ありPossible 悪心・嘔気Nausea
67Ga-クエン酸ガリウム[クエン酸ガリウム (67Ga)注射液](腫瘍,炎症シンチグラフィ)
[Gallium (67Ga) Citrate Injection]
A 非重篤Moderate to low 薬剤−可能性ありPossible 皮膚発赤Skin redness
123I-イオフルパン[イオフルパン(123I)注射液](ドーパミントランスポーターシンチグラフィ)
[ioflupane (123I)]
O 重篤High 薬剤−可能性大Probable 注射部疼痛 Injection site pain [転帰:回復あり]
V 重篤
High 薬剤−可能性大Probable 血圧低下,徐脈,失神,顔面蒼白 [転帰:回復あり]Lowering blood pressure, bradycardia, syncope, pallor
V 非重篤
Moderate to low 薬剤−可能性大Probable 頭痛Headache
131I-ヨウ化メチルノルコレステノール[ヨウ化メチルノルコレステノール (131I)注射液](副腎皮質シンチグラフィ)
[Iodinated (131
I) Methylnorcholestenol Injection]
V 非重篤Moderate to low 薬剤−可能性ありPossible 失神,顔面紅潮,発汗,悪心・嘔気Syncope, facial flushing, sweating, nausea A 非重篤Moderate to low 薬剤−可能性ありPossible 皮膚発赤,そう痒感Skin redness, itching
18F-FDG[フルデオキシグルコース (18F)注射液](腫瘍シンチグラフィ,心筋シンチグラフィ,脳シンチグラフィ)
[fludeoxyglucose (18F) Injection]
A 非重篤Moderate to low 薬剤−可能性ありPossible そう痒感,発疹Itching, rash
A 非重篤
Moderate to low 薬剤−可能性ありPossible 皮膚発赤Skin redness
* 慣用名表記([ ] 内は一般名)
Table 5 薬剤による影響の可能性
Possibilities of influence induced by radiopharmaceuticals 薬剤による可能性 Drug-induced possibilities 41 st survey 2015 42 nd survey 2016 43 rd survey 2017 44 th survey 2018 45 th survey 2019 確 実 Definite (13%)2 0 (8%)1 (7%)1 (11%)2 大 Probable (33%)5 (44%)4 (8%)1 (14%)2 (22%)4 あ り Possible (27%)4 (44%)4 (67%)8 (79%)11 (67%)12 小 Unlikely (7%)1 0 (8%)1 0 0 不 明 Uncertain (20%)3 (11%)1 (8%)1 0 0 報告件数合計
Total number of reported cases 15 9 12 14 18
Table 6 副作用事例の重篤度 Severity of adverse reactions
重篤度 Severity 41 st survey 2015 42 nd survey 2016 43 rd survey 2017 44 th survey 2018 45 th survey 2019 重 篤 High (13%)2 0 0 (7%)1 (22%)4 非重篤 Moderate to low (87%)13 (100%)9 (100%)12 (93%)13 (78%)14 報告件数合計
Total number of reported cases 15 9 12 14 18
Table 7 副作用事例種類別報告の推移
Changes in reported cases with different types of adverse reactions
2005–2007 2008–2010 2011–2013 2014–2016 2017–2019 血管迷走神経反応(V) Vasovagal reactions (V) (0.6)21 (0.7)21 (0.5)15 (0.5)15 (0.8)24 発 熱(F) Fever (F) 0 (0.1)2 0 0 (0.0)1 アレルギー反応(A)
Allergic reactions (A) (0.8)30 (1.0)32 (0.5)16 (0.6)18 (0.6)18 その他(O)
Others (O) (0.3)11 (0.1)3 (0.1)2 0 (0.0)1 合 計
TOTAL (1.7)62 (1.8)58 (1.0)33 (1.0)33 (1.4)44
注:( )の数値は,アンケート回答施設における投与件数を母数とした 10 万件あたりの発生件数 Note: Numerals within parentheses represent the incidence per 100,000 cases
Table 8 放射性医薬品別副作用報告件数(1975∼2019 年度)
Number of cases with adverse reactions to each radiopharmaceutical (1975–2019)
放射性医薬品*1 Radiopharmaceuticals 1 st–40th surveys 1975–2014 41 st survey 2015 42 nd survey 2016 43 rd survey 2017 44 th survey 2018 45 th survey 2019 累計 Cumulative cases 99mTc-MDP 39 1 (1) 1 (1) 3 (2) 4 (3) 48 99mTc-HMDP 64 4 (2) 1 (1) 2 (2) 3 (2) 74 123I-iofulpane 1 2 (6) 2 (5) 4 (10) 3 (7) 3 (6) 15 131I-iodomethylnorcholesterol 248 2 (137) 2 (170) 2 (176) 254 18F-FDG 13 3 (2) 1 (0) 3 (1) 2 (1) 22 99mTc-pertechnetate 19 1 (9) 20 99mTc-ECD 16 1 (2) 17 99mTc-MIBI 19 1 (4) 1 (4) 21 67Ga-gallium citrate 60 1 (5) 1 (7) 62 99mTc-tin colloid 4 4 99mTc-phytate 6 6 99mTc-MAA 15 15 99mTc-PYP 45 45 99mTc-HM-PAO 9 9 99mTc-DMSA 14 14 99mTc-DTPA 74 74 99mTc-HSA-DTPA 7 7 99mTc-PMT 1 1 99mTc-GSA 8 1 (12) 9 99mTc-tetrofosmin 9 1 (2) 10 99mTc-MAG 3 17 17 201Tl-thallium chloride 39 1 (1) 1 (1) 1 (1) 42
123I-sodium iodide capsule 3 3
123I-IMP 17 3 (3) 3 (3) 1 (1) 24 123I-MIBG 6 1 (3) 7 123I-BMIPP 15 15 123I-iomazenil 0 1 (69) 1 111In-indium chloride 1 1 111In-DTPA 12 12 99mTc-HSA*2 7 7 131I-sodium iodohippurate*2 243 243 131I-MIBG*2 3 3 131I-HSA*2 12 12 TOTAL 1,114 *1 慣用名表記 Trivial name *2 販売中止製品 Discontinued products 注:( )の数値は,アンケート回答施設における投与件数を母数とした 10 万件あたりの発生件数 Note: Numerals within parentheses represent the incidence per 100,000 cases
Table 9 不良品事例種類別報告の推移
Changes in reported cases with different types of defective products
2005–2007 2008–2010 2011–2013 2014–2016 2017–2019 分布不良 Unusual biodistributions (0.0) 1 0 0 0 0 標識不良 Radiolabeling error 0 0 0 0 0 放射能・液量不良 Radioactivity/volume error (0.1) 2 0 (0.0) 1 (0.1) 2 0 異物混入
Foreign matter contamination 0 0 0 0 0 溶出不良
Elution error (0.1) 2 (0.0) 1 0 0 0 容器破損や汚染
Damaged or contaminated to containers (0.0) 1 (0.0) 1 (0.0) 1 (0.0) 1 0 その他
Others (0.1) 3 0 (0.0) 1 0 0
合 計
TOTAL (0.2) 9 (0.1) 2 (0.1) 3 (0.1) 3 0
注:( )の数値は,アンケート回答施設における投与件数を母数とした 10 万件あたりの発生件数 Note: Numerals within parentheses represent the incidence per 100,000 cases
【文献】
1) 日本アイソトープ協会医学・薬学部会放射性医薬品安全 性専門委員会:放射性医薬品副作用事例調査報告.核医 学 1979; 16: 511–516.(第 2 回∼第 43 回調査結果も『核 医学』誌に掲載) 2) 日本アイソトープ協会医学・薬学部会放射性医薬品安全 性専門委員会:放射性医薬品副作用事例調査報告 第 41 報(2018 年度 第 44 回調査).核医学 2020; 57: 11–21. 3) Matsuda H, Uehara T, Okazawa H, Mizumura S, YokoyamaK, Yoshimura M; Subcommittee for Safety Issues of Radiopharmaceuticals, Medical Science and Pharmaceutical
Committee, Japan Radioisotope Association: Full report on a survey of adverse reactions to radiopharmaceuticals from 1975 to 2017 in Japan. Ann Nucl Med 2020; 34: 299–304.
4) Silberstein EB,Ryan J and the Pharmacopoeia Committee of the Society of Nuclear Medicine: Prevalence of adverse reactions in nuclear medicine. J Nucl Med 1996; 37: 185–192.
5) Hesslewood SR, Keeling DH and the Radiopharmacy Committee of the European Association of Nuclear Medicine: Frequency of adverse reactions to radiopharmaceuticals in Europe. Eur J Nucl Med 1997; 24: 1179–1182.
参考資料 1 アンケート回答施設における放射性医薬品投与件数(2019 年度)
Attached Table 1 Number of radiopharmaceuticals administered at answered institutions (FY2019) 放射性医薬品* Radiopharmaceuticals 投与件数 Number of administered cases 検査実施 施設数 Number of institutions performing testing 99mTc パーテクネテイト(甲状腺) pertechnetate (thyroid) 6,431 543 パーテクネテイト(唾液腺)
pertechnetate (salivary glands) 4,341 397 パーテクネテイト(異所性胃粘膜)
pertechnetate (Meckel's diverticulum) 543 253 パーテクネテイト(その他) pertechnetate (miscellaneous) 53 14 99mTcO 4− 小計 (subtotal) 11,368 665 スズコロイド tin colloid 1,467 62 フィチン酸 phytate 37,908 392 MAA 13,796 711 PYP 2,870 275 PYP(RBC 標識) PYP(RBC-labeled) 744 89 HM-PAO 2,008 47 ECD 46,533 611 MDP 126,575 664 HMDP 122,577 729 DMSA 6,521 430 DTPA 4,374 235 HSA-DTPA 3,417 412 PMT 629 164 GSA 8,536 368 MIBI(心筋) MIBI (myocardium) 20,660 272 MIBI(副甲状腺) MIBI (parathyroid) 5,744 637 テトロホスミン tetrofosmin 63,764 448 MAG3 8,685 542 テクネガス technegas 406 20 99mTc 合計 (TOTAL) 488,582 933 67Ga クエン酸ガリウム(腫瘍)
gallium citrate (tumors) 5,156 567 クエン酸ガリウム(炎症)
gallium citrate (inflammations) 9,599 669
67Ga 合計 (TOTAL) 14,755 801 201Tl 塩化タリウム (心筋)
thallium chloride (myocardium) 92,882 669 塩化タリウム (腫瘍)
thallium chloride (tumors) 2,394 237 塩化タリウム (副甲状腺)
thallium chloride (parathyroid) 158 36 塩化タリウム (その他)
thallium chloride (miscellaneous) 133 6
201Tl 合計 (TOTAL) 95,567 733 放射性医薬品* Radiopharmaceuticals 投与件数 Number of administered cases 検査実施 施設数 Number of institutions performing testing 123I NaI カプセル(甲状腺)
sodium iodide capsule (thyroid) 3,408 312 NaI カプセル(全身サーベイ)
sodium iodide capsule (whole-body scan) 79 20
IMP 85,981 724 MIBG(心筋) MIBG (myocardium) 34,601 796 MIBG(腫瘍) MIBG (tumor) 3,882 507 BMIPP 13,342 547 イオマゼニル iomazenil 1,057 139 イオフルパン ioflupane 47,878 754 123I 合計 (TOTAL) 190,228 910 131I NaI カプセル(甲状腺)
sodium iodide capsule (thyroid) 1,256 48 NaI カプセル(全身サーベイ)
sodium iodide capsule (whole-body scan) 781 81 NaI カプセル(甲状腺機能亢進症治療)
sodium iodide capsule (therapy of hyperthyroidism) 3,342 190 NaI カプセル(甲状腺癌及び転移巣治療)
sodium iodide capsule (therapy of thyroid cancer) 4,036 145 ヨウ化メチルノルコレステノール iodomethylnorcholestenol 1,136 319 131I 合計 (TOTAL) 10,551 413 111In 塩化インジウム indium chloride 226 88 DTPA(脳脊髄液腔)
DTPA (cerebrospinal fluid space) 830 134 ペンテトレオチド pentetreotide 1,961 300 111In 合計 (TOTAL) 3,017 392 81mKr 注射液 krypton injection 2 1 ガス krypton gas 3,101 208 81mKr 合計 (TOTAL) 3,103 209 18F フルデオキシグルコース fludeoxyglucose 231,117 291 フルテメタモル flutemetamol 457 16 フロルベタピル florbetapir 191 9 18F 合計 (TOTAL) 231,765 291 総合計 (TOTAL) 1,037,568 1,003 * 慣用名表記 Trivial names
参考資料 2 院内製造ポジトロン放出核種標識薬剤副作用等事例調査結果(2019 年度) Attached Table 2 Survey of the adverse reaction to in-house PET drugs (FY2019)
(1) 回収率等
Questionnaire collection rate 対象施設数
Total number of surveyed institutions A 151 回答施設数
Number of answered institutions B 122 調査票回収率
Questionnaire collection rate B/A 80.8% 副作用等報告施設数
Number of institutions reported adverse reactions C 0 副作用等報告率
Reporting rate of adverse reactions C/B ― 投与件数
Number of administered cases D 337,848 副作用報告件数
Number of adverse reactions E 0 副作用発生率
Incidence rate of adverse reactions E/D ― 不良品報告件数
Number of reported defective products F 0 不良品発生率
Incidence rate of defective products F/D ― (2) アンケート回答施設における院内 PET 薬剤投与件数
Number of administration at answered institutions 院 内 製 造 P E T 薬 剤
In-house PET drugs
投与件数
Number of administered cases
検査実施施設数
Number of institutions performing testing
18 F フルオロデオキシグルコース fluorodeoxyglucose 334,880 112 フルテメタモル flutemetamol 59 2 フロルベタピル florbetapill 15 2 フロルベタベン florbetaben 449 1 15O 標識ガス gas 386 9 13 N アンモニア ammonia 2,059 10 合 計 TOTAL 337,848 122
The 42nd Report on Survey of the Adverse Reaction to Radiopharmaceuticals
(The 45th Survey in 2019)
Subcommittee for Safety Issues of Radiopharmaceuticals, Medical Science and Pharmaceutical
Committee, Japan Radioisotope Association
Hidehiko OKAZAWA,
1Tomoya UEHARA,
2Ichiei KUJI,
3Tatsuya HIGASHI,
4Mana YOSHIMURA
5 1 Biomedical Imaging Research Center, University of Fukui2 Graduate School of Pharmaceutical Sciences, Chiba University
3 Department of Nuclear Medicine, Saitama Medical University International Medical Center
4 National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology 5 Department of Radiology, Tokyo Medical University
This survey was performed in order to investigate the incidence of adverse reactions to radiopharmaceuticals in FY2019 in Japan. It was based on responses to questionnaires sent to nuclear medicine institutions. Replies were obtained from 1,003 institutions out of 1,213 to which the questionnaire had been sent. A total of 1,037,568 radiopharmaceutical administrations were reported. Eighteen cases of adverse reactions were reported. The incidence of adverse reactions per 100,000 cases was 1.7. No case of defective products was reported.
Key words: adverse reactions, defective products, radiopharmaceuticals
参考資料 3 131I-ヨウ化ナトリウムカプセル(治療用)副作用事例調査結果(2019 年度)
Attached Table 3 Survey of the adverse reaction to 131I sodium iodine capsule for treatment (FY2019)
(1) 回収率等
Questionnaire collection rate 対象施設数
Total number of surveyed institutions A 290 回答施設数
Number of answered institutions B 248 調査票回収率
Questionnaire collection rate B/A 85.5% NaIカプセル(甲状腺機能亢進症治療)
sodium iodide capsule (hyperthyroidism) 3,342 NaIカプセル(甲状腺癌及び転移巣)
sodium iodide capsule (thyroid cancer) 4,036 投与件数合計
Total number of administered cases C 7,378 副作用報告件数
Number of adverse reactions D 2 副作用発生率
Incidence rate of adverse reactions D/C 0.0271% (2) 副作用発現の症例
Cases with adverse reactions 副作用の種類
Types of adverse reactions
重 篤 度
Severity of adverse reactions
因果関係 Drug-induced possibilities 副作用の症状 Adverse reactions V 非重篤 Moderate to low 薬剤−可能性あり Possible 悪心・嘔気,嘔吐 Nausea, vomiting V/F 非重篤 Moderate to low 薬剤−確実 Definite 発熱(38.0℃),悪心・嘔気,嘔吐 Fever (38.0℃), nausea, vomiting