飼
料
研
究
報
告
第42号
平成29年
Research Report
of
Animal Feed
Vol. 42
2017
独立行政法人
農林水産消費安全技術センター
Food and Agricultural Materials Inspection Center
(Incorporated Administrative Agency)
OIE Collaborating Centre for Animal Feed Safety and Analysis
Saitama, Japan
The OIE Collaborating Centre for Animal Feed Safety and Analysis
はしがき
独立行政法人農林水産消費安全技術センター(FAMIC)は、平成 19 年 4 月、肥料・飼料、農薬、 食品のそれぞれを担っていた3 つの検査・分析機関が、共通する科学的技術を基盤に統合し“農場 から食卓まで”の一貫した食の安全と消費者の信頼の確保を担う機関として新たな一歩を踏み出し ました。これまでの10 年の歩みは統合のメリットを打ち出し、それぞれの機関で蓄えてきた知見と 経験を合わせ、様々な課題に取り組んできました。10 年を経たこれからは、より質の高い技術力で 行政を支える第一線の検査分析機関として更に飛躍するべく努力を続ける所存です。 飼料及びペットフードについては、農林水産省等の関係府省が「飼料安全法」及び「ペットフー ド安全法」に基づく基準規格(残留農薬、有害物質、添加物など)を設定し、飼料等の関係事業者 がこの基準規格を遵守することにより、飼料等の安全確保が図られています。これらの法律に基づ く基準規格の設定に当たっては、先ずはその目的に応じた性能(選択性、検量線の直線性、真度、 精度、検出限界と定量限界など)を有する試験法により、科学的に信頼できるデータを得ることが 重要です。このため、FAMIC では飼料等の分析法の開発、改良等を行うとともに、分析法の妥当性 確認を行って、公定分析法を確立しています。また、確立した公定分析法を用いて飼料等のサーベ イランス・モニタリングを行い、有害物質による汚染実態の把握や基準規格の遵守状況の確認を行 うことを通じて、飼料等の安全確保に貢献しています。また、FAMIC の飼料部門は、国際獣疫事務 局(OIE)の「飼料の安全と分析」分野のコラボレーティング・センターとして、飼料の安全と分 析に関する技術情報の発信や研修等の実施などを通じて、安全な畜産物の国際取引の確保等に寄与 しています。 『飼料研究報告』は、FAMIC の飼料部門における飼料及び飼料添加物並びにペットフードの分析 及び鑑定技術の改善、検査手法・試験法の開発又は改良等を目指して実施した調査・研究成果や学 術雑誌等に投稿等して公表した研究成果を取りまとめたものです。これらの研究成果は「飼料分析 基準」(平成20 年 4 月 1 日付け 19 消安第 14729 号。農林水産省消費・安全局長通知)又は「愛玩動 物用飼料等の検査法」(平成21 年 9 月 1 日付け 21 消技第 1764 号。FAMIC 理事長制定)に収載され るほか、『飼料分析法・解説 -2009-』(飼料分析基準研究会編書)の改訂の際に掲載される予定 です。 最後に、本研究報告が飼料及び飼料添加物並びにペットフードの安全の確保の一助となることを 期待するとともに、関係各位の皆様には、FAMIC の技術レベルの更なる向上のために、引き続き、 御指導、御鞭撻を賜りますよう、お願い申し上げます。 平成29 年 9 月 理事長 木村 眞人謝 辞
本報告に掲載した分析法の開発及び報告書の作成に当たり、助言賜りました下記の飼料分析基準 検討会の各委員に感謝申し上げます。 平成28 年度飼料分析基準検討会委員 (敬称略。五十音順。役職は平成29 年 3 月現在。) 石黒 瑛一 一般財団法人日本食品分析センター 顧問 内田 一成 一般財団法人生物科学安全研究所 事業部 部長代行 永西 修 国立研究開発法人農業・食品産業技術総合研究機構 畜産研究部門 家畜代謝栄養研究領域 精密栄養管理ユニット 主席研究員 小田中 芳次 公益財団法人日本植物調節剤研究協会 研究所 技術顧問 小池 良治 農林水産省動物医薬品検査所 検査第二部 総括上席研究官 後藤 哲久 AOAC インターナショナルフェロー 中島 正博 名古屋市衛生研究所 食品部長 永山 敏廣 明治薬科大学 薬学部 教授 堀江 正一 大妻女子大学 家政学部 食物学科 教授 松井 徹 国立大学法人京都大学大学院 農学研究科 教授 松井 利郎 国立大学法人九州大学 農学研究院 教授 安井 明美 国立研究開発法人農業・食品産業技術総合研究機構 食品研究部門 アドバイザー目 次
1 稲発酵粗飼料中のベンフレセート及びシハロホップブチルの液体クロマトグラ
フタンデム型質量分析計による同時定量法の確立
佐藤 梢,新井 詠子,風間 鈴子 ··· 1技術レポート
1 飼料中のカルバリル,カルボフラン及びフェノブカルブの液体クロマトグラフタ
ンデム型質量分析計による同時定量法の開発
田中 里美,桑原 正良 ··· 202 飼料中の 3-OH カルボフランの液体クロマトグラフタンデム型質量分析計による
定量法の開発
保田 伊世,長久保 眞平 ··· 343 飼料中のイミダクロプリドの液体クロマトグラフ質量分析計による定量法の妥当
性確認
中村 哲,井上 智江 ··· 474 農薬のガスクロマトグラフ質量分析計による一斉分析法の妥当性確認
~ブロモブチド代謝物への適用~
榊原 良成,若宮 洋市 ··· 565 愛玩動物用飼料等の検査法収載法のスナック製品への適用のための妥当性確認
~有機塩素系農薬のガスクロマトグラフによる同時分析法~
鈴木 知華,奥富 幸,髙橋 亜紀子 ··· 696 とうもろこしサイレージ中のかび毒の定量法に関する検討
~アフラトキシン
B
1,ゼアラレノン及びデオキシニバレノール~
伊藤 千晶,佐藤 憲大 ··· 877 飼料を対象とするサルモネラ試験法の選択増菌培地液量の減量化に関する検討
奥村 寿章,加藤 まどか,関口 好浩,三枝 尚子, 宮野谷 杏,名塚 英一,内山 丈,千原 哲夫,橋本 亮 ··· 101精度管理
1 平成 28 年度飼料等の共通試料による分析鑑定について
鈴木 知華,船水 悦子,新井 詠子,加藤 まどか, 安田 紗紀恵,矢野 愛子 ··· 112調査資料
1 飼料中の有害物質等のモニタリング等の結果について(平成 28 年度)
肥飼料安全検査部 飼料鑑定第一課,飼料鑑定第二課 ···· 1402 特定添加物検定結果等について(平成 28 年度)
肥飼料安全検査部 飼料鑑定第二課 ··· 163他誌掲載論文(抄録)
1 Development and inter-laboratory study of a method for quantifying zearalenone in pet
foods
M. Nomura, T. Wada, T. Ishibashi, T. Komoriya, T. Nagahara, T. Chihara
CONTENTS
1 Development and Validation of Simultaneous Determination Method of Benfuresate and Cyhalofop-butyl in Whole-crop Rice Silage by LC-MS/MS
Kozue SATOU, Eiko ARAI and Reiko KAZAMA ··· 1
§ Technical report
1 Development of Simultaneous Determination Method of Carbaryl, Carbofuran and Fenobucarb in Feed by LC-MS/MS
Satomi TANAKA and Masayoshi KUWABARA ··· 20
2 Development of Determination Method of 3-Hydroxycarbofuran in Feed by LC-MS/MS
Iyo YASUDA and Shinpei NAGAKUBO ··· 34
3 Method Validation of the Determination Method of Imidacloprid by LC-MS for Wheat, Rice Straw and Whole-crop Rice Silage
Satoru NAKAMURA and Tomoe INOUE ··· 47
4 Validation Study on Analyte Expansion to the Simultaneous Determination Method of Pesticides in Feed by GC-MS for Debromo Metabolite of Bromobutide
Yoshinari SAKAKIBARA and Youichi WAKAMIYA ··· 56
5 Validation Study on Application of the Simultaneous Determination Method of Organochlorine Pesticides by GC to Snack Type Pet Food
Chika SUZUKI, Yuki OKUTOMI and Akiko TAKAHASHI ··· 69 6 Study of Determination Methods of Mycotoxins in Corn Silage
~ Aflatoxin B1, Zearalenone and Deoxynivalenol ~
Chiaki ITO and Norihiro SATO ··· 87
7 Improvement of Selective Enrichment for Detection Method of Salmonella in Feed ~ Reduction of the Volume of Selective Enrichment Broth ~
Toshiaki OKUMURA, Madoka KATO, Yoshihiro SEKIGUCHI, Naoko SAEGUSA,
Kyou MIYANOYA, Eiichi NAZUKA, Takeshi UCHIYAMA,
Tetsuo CHIHARA and Sayaka HASHIMOTO··· 101
§ Proficiency test
1 Proficiency Test (in the Fiscal Year 2016)
Chika SUZUKI, Etsuko FUNAMIZU, Eiko ARAI,
Madoka KATO, Sakie YASUDA and Aiko YANO ··· 112
§ Investigative report
1 Monitoring Results of Undesirable Substances in Feeds (in the Fiscal Year 2016)
Feed Analysis 1st Division and 2nd Division, Fertilizer and Feed
Inspection Department ··· 140
2 Results of Official Testing of Specified Feed Additives (in the Fiscal Year 2016)
Feed Analysis 2nd Division, Fertilizer and Feed Inspection Department ··· 163
§ Papers accepted in other journals (abstract)
1 Development and inter-laboratory study of a method for quantifying zearalenone in pet foods
M. Nomura, T. Wada, T. Ishibashi, T. Komoriya, T. Nagahara, T. Chihara
1 稲発酵粗飼料中のベンフレセート及びシハロホップブチルの液体クロ
マトグラフタンデム型質量分析計による同時定量法の確立
佐藤 梢*1,新井 詠子*1,風間 鈴子*2
Development and Validation of Simultaneous Determination Method of Benfuresate and Cyhalofop-butyl in Whole-crop Rice Silage by LC-MS/MS
Kozue SATOU*1, Eiko ARAI*1 and Reiko KAZAMA*2
(*1 Sendai Regional Center, Food and Agricultural Materials Inspection Center (FAMIC)
*2 Fertilizer and Feed Inspection Department, FAMIC)
An analytical method was developed to simultaneously determine the levels of benfuresate and cyhalofop-butyl in whole-crop rice silage (WCRS) using a liquid chromatograph-atmospheric pressure chemical ionization-tandem mass spectrometer (LC-APCI-MS/MS).
After adding water to the sample, benfuresate and cyhalofop-butyl were extracted with acetone and the extracted solutions were filtered. The filtrate was purified with two types of SPE
columns (InertSep K-solute, GL Sciences Inc.; Tokyo, Japan and ENVI-Carb/LC-NH2,
Sigma-Aldrich Co. LLC.; St. Louis, MO, USA), and injected into the LC-APCI-MS/MS to determine the levels of benfuresate and cyhalofop-butyl. LC separation was carried out on an ODS column (Inertsil ODS-3, 2.1 mm i.d. × 150 mm, 3 µm from GL Sciences Inc.) using a gradient with 0.1 v/v% formic acid aqueous solution and 0.1 v/v% formic acid methanol solution as a mobile phase. In the MS/MS analysis, positive mode atmospheric pressure chemical ionization (APCI+) was used.
Recovery tests were conducted on WCRS spiked with benfuresate at the levels of 0.009 or 0.2 mg/kg original matter and cyhalofop-butyl at the levels of 0.009 or 0.1 mg/kg original matter. The resulting mean recoveries ranged from 86.0 % to 101 % for benfuresate and 85.3 % to 93.2 %
for cyhalofop-butyl. The repeatability in terms of the relative standard deviations (RSDr) were
not more than 12 % for benfuresate and 14 % for cyhalofop-butyl.
A collaborative study was conducted in eleven laboratories using two kinds of WCRS. One WCRS was spiked with 0.2 mg/kg air-dry matter of benfuresate and 0.1 mg/kg air-dry matter of cyhalofop-butyl. The other of WCRS was spiked with 0.02 mg/kg air-dry matter of benfuresate
and cyhalofop-butyl. The resulting mean recoveries, RSDr, reproducibility in terms of the
relative standard deviations (RSDR), and HorRat, respectively for two kinds of spiked WCRS,
were 96.1 % and 94.7 %, 2.6 % and 3.7 %, 8.1 % and 10 %, and not more than 0.45 for benfuresate, and 92.7 % and 97.0 %, 2.7 % and 4.8 %, 22 % and 32 %, and not more than 1.5 for cyhalofop-butyl.
This method was validated and established for use in the inspection of benfuresate and cyhalofop-butyl in whole-crop rice silage.
Key words: benfuresate; cyhalofop-butyl; liquid chromatograph-tandem mass spectrometer (LC-MS/MS); atmospheric pressure chemical ionization (APCI); whole-crop rice silage; collaborative study
*1 独立行政法人農林水産消費安全技術センター仙台センター
キーワード:ベンフレセート;シハロホップブチル;液体クロマトグラフタンデム型質量 分析計;大気圧化学イオン化法;稲発酵粗飼料;共同試験
1 緒 言
ベンフレセートは,Schering Agrochemicals(英国)により開発されたベンゾフラニルアルキルス ルホン酸系除草剤であり,作用機構の詳細は解明されていないが,炭素数 18 以上の長鎖の脂肪酸 の合成阻害と考えられており,湛水処理及び土壌処理により殺草活性を示す 1).我が国では,1994 年より水稲,芝を対象に農薬登録されており,飼料中の管理基準値 2)として,稲わらで 0.3 mg/kg, 稲発酵粗飼料(以下「WCRS」という.)で 0.2 mg/kg が設定されている.シハロホップブチルは,The Dow Chemical Company(米国)により開発されたアリルオキシフェ
ノキシ構造を有する除草剤であり,その作用機構は,アセチル CoA カルボキシラーゼを阻害する ことによる脂肪酸の生合成の阻害である 3).我が国では 1996 年に水稲を対象に農薬登録されてお り,飼料中の管理基準値 2)として,稲わら及び籾米で 2 mg/kg,WCRS で 0.1 mg/kg が設定されて いる. 平成 24 年度に,筆者らは,財団法人日本食品分析センターが平成 22 年度飼料中の有害物質等分 析法開発委託事業において開発したガスクロマトグラフ質量分析計(以下「GC-MS」という.) による飼料中のシハロホップブチル及びベンフレセートの分析法 4)(以下「JFRL 法」という.) を基に,飼料用イネ(稲わら,稲発酵粗飼料及び籾米)を対象として飼料分析基準 5)への適用の可 否を検討し,稲わら及び籾米に適用可能な定量法(以下「GC-MS 法」という.)を確立した 6). その際,WCRS についても検討したが,回収率が高い傾向にあり,更なる検討が必要であった6). そこで,今回,GC-MS 法を基に,WCRS 中のベンフレセート及びシハロホップブチルの液体ク ロマトグラフタンデム型質量分析計(以下「LC-MS/MS」という.)による同時定量法を開発し, 飼料分析基準への適用の可否を検討したので,その概要を報告する. 参考にベンフレセート及びシハロホップブチルの構造式等を Fig. 1 に示した.
Benfuresate
2,3-dihydro-3,3-dimethylbenzofuran-5-yl ethanesulfonate C12H16O4S MW: 256.3 CAS No.: 68505-69-1
Cyhalofop-butyl
butyl (R)-2-[4-(4-cyano-2-fluorophenoxy)phenoxy]propionate C20H20FNO4 MW: 357.1 CAS No.: 122008-85-9
Fig. 1 Chemical structures of benfuresate and cyhalofop-butyl
2 実験方法
2.1 試 料 2 種類の WCRS を 60 °C 以下で 20 時間乾燥し,更に室内に静置して風乾した後,1 mm のスク リーンを装着した粉砕機で粉砕した. 2.2 試 薬 1) アセトン,酢酸エチル及びヘキサンは残留農薬・PCB 試験用を用いた.メタノールは液体ク ロマトグラフ用及びギ酸は液体クロマトグラフ用(約 99 %,和光純薬工業製)を用いた.水はMilli-Q Advantage(Merck Millipore 製)により精製した超純水(JIS K0211 の 5218 に定義
された超純水)を用いた. 2) ベンフレセート標準原液 ベンフレセート標準品(純度 99.8 %,和光純薬工業製)25 mg を正確に量って 50 mL の全量 フラスコに入れ,アセトンを加えて溶かし,更に標線まで同溶媒を加えてベンフレセート標準 原液を調製した(この液1 mL は,ベンフレセートとして 0.5 mg を含有する.). 3) シハロホップブチル標準原液 シハロホップブチル標準品(純度 99.7 %,和光純薬工業製)25 mg を正確に量って 50 mL の 全量フラスコに入れ,アセトンを加えて溶かし,更に標線まで同溶媒を加えてシハロホップブ チル標準原液を調製した(この液1 mL は,シハロホップブチルとして 0.5 mg を含有する.). 4) 農薬混合標準原液 ベンフレセート標準原液及びシハロホップブチル標準原液各 5 mL を 50 mL の全量フラスコ に正確に入れ,更に標線までアセトンを加えて,1 mL 中にベンフレセート及びシハロホップ
ブチルとしてそれぞれ50 µg を含有する農薬混合標準原液を調製した. 5) 検量線作成用農薬混合標準液 使用に際して,農薬混合標準原液の一定量を,水-メタノール(1+1)で正確に希釈し,1 mL 中にベンフレセート及びシハロホップブチルとしてそれぞれ 1.0,2.5,5.0,10,25,50, 75,100,125,150,175,200 ng を含有する各混合標準液を調製した. 2.3 装置及び器具 1) 粉砕機:SM-100 Retsch 製(1 mm スクリーン,回転数(仕様)1430 rpm) 2) 振とう機:レシプロシェーカーSR-2W タイテック製(使用時振とう数 300 rpm) 3) 多孔性ケイソウ土カラム:InertSep K-solute(5 mL,10 mL 及び 20 mL 保持用) ジーエル サイエンス製 4) グラファイトカーボン/アミノプロピルシリル化シリカゲル積層ミニカラム(以下「積層ミ ニカラム」という.):ENVI-Carb/LC-NH2(500 mg/500 mg) Sigma-Aldrich 製 5) LC-MS/MS: LC 部:Nexera X2 島津製作所製 MS/MS 部:LCMS-8040 島津製作所製 2.4 定量方法 1) 抽 出 分析試料 10.0 g を量って 200 mL の共栓三角フラスコに入れ,水 20 mL を加え,30 分間静 置後,更にアセトン 100 mL を加え,30 分間振り混ぜて抽出した.200 mL の全量フラスコを ブフナー漏斗の下に置き,抽出液をろ紙(5 種 B)で吸引ろ過した後,先の三角フラスコ及び 残さを順次アセトン 50 mL で洗浄し,同様に吸引ろ過した.更に全量フラスコの標線までア セトンを加えた.この液5 mL を 50 mL のなす形フラスコに正確に入れ,40 °C 以下の水浴で 約0.5 mL まで減圧濃縮し,カラム処理 I に供する試料溶液とした. 2) カラム処理 I 試料溶液を多孔性ケイソウ土カラム(5 mL 保持用)に入れ,試料溶液の入っていたなす形 フラスコを水4 mL で洗浄し,洗液をカラムに加えた後,10 分間静置した. 200 mL のなす形フラスコをカラムの下に置き,試料溶液の入っていたなす形フラスコをヘ キサン5 mL ずつで 2 回洗浄し,洗液を順次カラムに加え,液面が充てん剤の上端に達するま で流下して,ベンフレセート及びシハロホップブチルを溶出させた.更に,ヘキサン 90 mL をカラムに加え,同様に溶出させた. 溶出液を 40 °C 以下の水浴でほとんど乾固するまで減圧濃縮した後,窒素ガスを送って乾固 した.酢酸エチル2 mL を加えて残留物を溶かし,カラム処理 II に供する試料溶液とした. 3) カラム処理 II 積層ミニカラムを酢酸エチル 10 mL で洗浄した.50 mL のなす形フラスコをミニカラムの 下に置き,試料溶液をミニカラムに入れ,液面が充てん剤の上端に達するまで流下(自然流下 させ,必要に応じて流速が 1 mL/min 程度になるよう吸引した.以下同様.)してベンフレセ ート及びシハロホップブチルを流出させた.試料溶液の入っていたなす形フラスコを酢酸エチ ル2 mL ずつで 2 回洗浄し,洗液を順次ミニカラムに加え,同様に流出させた.更に,酢酸エ チル4 mL をミニカラムに加え,同様に流出させた.
流出液を 40 °C 以下の水浴でほとんど乾固するまで減圧濃縮した後,窒素ガスを送って乾固 した.水-メタノール(1+1)1 mL を正確に加えて残留物を溶かし,5000×g で 5 分間遠心分 離し,上澄み液をLC-MS/MS による測定に供する試料溶液とした. 4) LC-MS/MS による測定 試料溶液及び各検量線作成用農薬混合標準液各 10 µL を LC-MS/MS に注入し,選択反応検 出(以下「SRM」という.)クロマトグラムを得た.測定条件を Table 1 及び 2 に示した.
Table 1 Operating conditions of LC-MS/MS
Column Inertsil ODS-3 (2.1 mm i.d. × 150 mm, 3 μm), GL Sciences
Mobile phase 0.1 v/v% formic acid aqueous solution – 0.1 v/v% formic acid methanol solution (2:3) (hold for 1 min) → 12 min → (1:99) (hold for 20 min)
Flow rate 0.1 mL/min
Column temperature 40 °C
Ionization Atmospheric pressure chemical ionization (APCI)
Mode Positive
Nebulizer gas Air (4.4 L/min)
Drying gas N2 (20 L/min)
Interface temperature 350 °C Heat block temperature 300 °C Desolvation line temperature 300 °C
Collision gas Ar (230 kPa)
Table 2 MS/MS parameters
Precursor Collision ion Quantifier Qualifier energy (m /z) (m /z) (m /z) (eV) 163 - 11 - 121 22 256 - 11 - 120 28 Target Product ion Benfuresate 257 Cyhalofop-butyl 358 5) 計 算 得られた SRM クロマトグラムからピーク面積及び高さを求めて検量線を作成し,試料中の ベンフレセート量及びシハロホップブチル量を算出した. なお,定量法の概要を Scheme 1 に示した.
Sample 10.0 g (200 mL Erlenmeyer flask)
ENVI-Carb/LC-NH2 (500 mg/500 mg)
(prewash with 10 mL of ethyl acetate) wash with 5 mL of hexane (twice) elute with 90 mL of hexane evaporate to dryness under 40 °C
LC-APCI-MS/MS
evaporate to dryness under 40 °C dissolve in 1 mL of water–methanol (1:1) centrifuge for 5 min at 5000×g
place a receiver and apply sample solution wash with 2 mL of ethyl acetate (twice) elute with 4 mL of ethyl acetate
wash with 4 mL of water and allow to stand for 10 min wash with 50 mL of acetone
fill up to 200 mL with acetone
evaporate to about 0.5 mL under 40 °C
dissolve in 2 mL of ethyl acetate place a receiver
5 mL of sample solution (50 mL eggplant flask)
add 20 mL of water and allow to stand for 30 min add 100 mL of acetone and shake for 30 min
filtrate through filter paper (No. 5B of JIS P3801) under reduced pressure
InertSep K-solute (5 mL) apply sample solution
(receiver: 200 mL volumetric flask )
Scheme 1 Analytical procedure for benfuresate and cyhalofop-butyl in whole-crop rice silage (WCRS)
2.5 抽出定容液の分取液量の検討方法 WCRS 10.0 g を 2.4 の 1)に従って抽出,ろ過及び定容した液 5,10 及び 20 mL を 50 mL のなす 形フラスコに,40 mL を 100 mL のなす形フラスコに分取した.これにそれぞれベンフレセート として0.4 mg/kg 相当量,シハロホップブチルとして 0.2 mg/kg 相当量を添加した後,40 °C 以下 の水浴でそれぞれ約 0.5,1,2 及び 4 mL まで減圧濃縮し,分取液量 5 mL については保持容量 が5 mL,分取液量 10 mL については保持容量が 10 mL,分取液量 20 及び 40 mL については保 持容量が 20 mL の多孔性ケイソウ土カラムに,試料溶液及び試料溶液の入っていたなす形フラ スコを洗浄した水 4 mL を負荷した.分取液量 5 mL についてはヘキサン 100 mL で,分取液量 10,20 及び 40 mL についてはそれぞれヘキサン 80 mL で各農薬を溶出させた.ヘキサンによる 溶出後は 2.4 に従い定量し,回収率を求めた.なお,2.4 の 3)で得られた上澄み液の一部を水- メタノール(1+1)で,分取液量 10 mL については 2 倍,分取液量 20 mL については 4 倍,分取 液量40 mL については 8 倍に希釈して LC-MS/MS による測定を行った.
3 結果及び考察
3.1 予備検討 GC-MS 法では,GC-MS による測定において夾雑物の影響を受け,ベンフレセート及びシハロ ホップブチルともに回収率が 120 %を上回った.夾雑物による影響の低減を試みたが,GC-MS では良好な結果が得られなかった. ベンフレセート及びシハロホップブチルの LC-MS/MS による分析例として,岡本らが検討し た,LC-MS/MS(エレクトロスプレーイオン化法(以下「ESI」という.))による餃子中の残 留農薬一斉分析法 7)がある.この方法を参考に精製方法を検討した結果,飼料分析基準の農薬一 斉分析法でも使用されている積層ミニカラムによる精製が比較的良好な回収率が得られたが,シ ハロホップブチルの回収率は不十分であった.その要因として,イオン化阻害の影響が考えられ たため,イオン化法をイオン化阻害の影響が比較的少ないとされる大気圧化学イオン化法(以下 「APCI」という.)に変更して測定した結果,両成分ともに比較的良好な回収率が得られた. 予備検討の結果から,GC-MS 法を一部変更し,精製には積層ミニカラムを用い,LC-MS/MS (APCI)で測定する方法について以下詳細に検討をすることとした. 3.2 LC-MS/MS(APCI)の測定条件 液体クロマトグラフ条件については,岡本らの方法に準じ,オクタデシルシリル化シリカゲル カラム(内径2.1 mm,長さ 150 mm,粒径 3 µm)を用い,0.1 v/v%ギ酸溶液-0.1 v/v%ギ酸メタ ノール溶液のグラジェントの溶離液で測定したところ,測定液中のシハロホップブチルが流路に 残留し,次の測定液のクロマトグラムに検出されることがあった.このため,最初の溶離液組成 を0.1 v/v%ギ酸メタノール溶液 55 %から 60 %に変更し,100 %での送液時間を 10 分から 15 分 にしたところ,残留はなくなり,両成分とも良好なピークが得られた.また,流速を変えて標準 液を測定した結果,0.1 mL/min とした場合に感度が最も良かった. 質量分析条件については,ベンフレセート標準原液及びシハロホップブチル標準原液の一定量 をそれぞれ水-メタノール(1+1)で正確に希釈した各標準液から得られたマススペクトル(Fig. 2)及びプロダクトイオンスペクトル(Fig. 3)からモニターイオン等を Table 2 のとおり定めた. 次にインターフェイス温度の条件を検討した.標準液を繰り返し測定した結果,シハロホップ ブチルのピーク強度のばらつきが大きく,この原因がインターフェイス温度にあると考えられた. このため,インターフェイス温度を変えて標準液を測定した結果,350 °C で最も繰返し精度が 良好であったため,インターフェイス温度は350 °C とした.A B
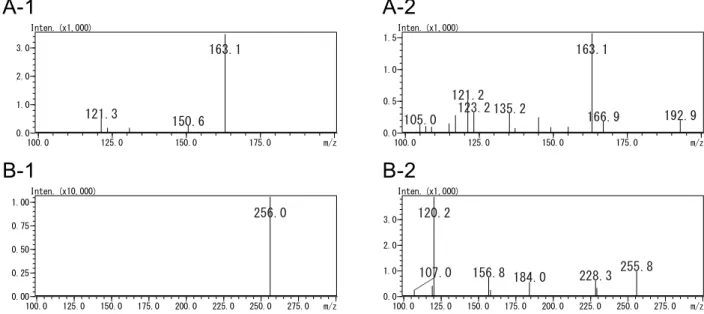
Fig. 2 Mass spectra of benfuresate (A) and cyhalofop-butyl (B)
200.0 225.0 250.0 275.0 m/z 0.0 2.5 5.0 7.5Inten. (x10,000) 257.1 205.1 274.2 219.2 259.1 200.0 225.0 250.0 275.0 300.0 325.0 350.0 375.0 m/z 0.0 0.5 1.0 1.5Inten. (x10,000) 358.2 297.2 256.1 279.3 302.1 219.3 385.3 341.3 267.2
A-1 A-2
B-1 B-2
Fig. 3 Product ion spectra of benfuresate and cyhalofop-butyl A-1: Benfuresate (precursor ion: m/z 257, collision energy: 11 eV)
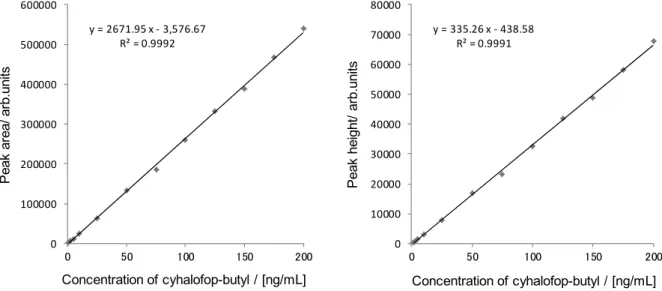
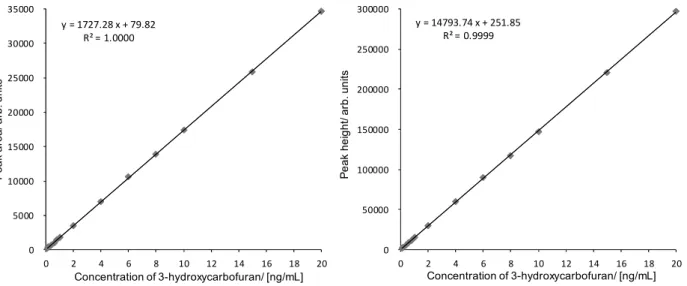
A-2: Benfuresate (precursor ion: m/z 257, collision energy: 22 eV) B-1: Cyhalofop-butyl (precursor ion: m/z 358, collision energy: 11 eV) B-2: Cyhalofop-butyl (precursor ion: m/z 358, collision energy: 28 eV) 3.3 検量線 2.2 の 5)により調製した各検量線作成用農薬混合標準液各 10 µL を LC-MS/MS に注入し,得ら れた SRM クロマトグラムからピーク面積及び高さを用いて検量線を作成した.得られた検量線 の一例は,Fig. 4-1 及び Fig. 4-2 のとおりであり,各 1~200 ng/mL(注入量として 0.01~2 ng 相当 量)の範囲で直線性を示した. なお,当該検量線の濃度範囲は,ベンフレセート及びシハロホップブチルを 0.004~0.8 mg/kg 含有する分析用試料を本法に従い調製した最終試料溶液中の各農薬濃度範囲に相当する.
Fig. 4-1 Calibration curves of benfuresate by peak area (left) and peak height (right)
100.0 125.0 150.0 175.0 m/z 0.0 1.0 2.0 3.0 Inten. (x1,000) 163.1 121.3 150.6 100.0 125.0 150.0 175.0 m/z 0.0 0.5 1.0 1.5 Inten. (x1,000) 163.1 121.2 123.2 135.2 192.9 166.9 105.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 275.0 m/z 0.00 0.25 0.50 0.75 1.00 Inten. (x10,000) 256.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 275.0 m/z 0.0 1.0 2.0 3.0 Inten. (x1,000) 120.2 255.8 156.8 184.0 228.3 107.0 y = 2005.38 x - 291.40 R² = 0.9994 0 100000 200000 300000 400000 500000 0 50 100 150 200 P ea k a re a/ a rb .u ni ts Concentration of benfuresate / [ng/mL] y = 212.47 x - 70.51 R² = 0.9993 0 10000 20000 30000 40000 50000 0 50 100 150 200 P ea k he ig ht / ar b. un its Concentration of benfuresate / [ng/mL]
Fig. 4-2 Calibration curves of cyhalofop-butyl by peak area (left) and peak height (right) 3.4 抽出定容液の分取液量の検討 GC-MS 法では分析試料 10.0 g を本法 2.4 の 1)に従って抽出,ろ過及び定容した液 40 mL を分 取し,保持容量が 20 mL の多孔性ケイソウ土カラムに供しているが,夾雑物低減を期待して, 多孔性ケイソウ土カラムに供する抽出定容液の分取液量について,2.5 に従って検討を行った. その結果,得られた回収率は Table 3 のとおりであった.そこで,比較的回収率の良好な分取液 量5 mL 及び 10 mL の場合について,最終試料溶液における各農薬のマトリックス効果を確認し たところ,分取液量10 mL についてはイオン化促進が見られたため,抽出定容液の分取液量は 5 mL とした.
Table 3 Effects of volume of sample solution for purification on recoveries
5 mL 10 mL 20 mL 40 mL
Benfuresate 0.4 95.8 116 120 116
Cyhalofop-butyl 0.2 98.3 106 86.3 44.6
Pesticides Spiked level
(mg/kg air-dry matter)
Recovery (%)
Volume of sample solution for purification
n = 1 3.5 多孔性ケイソウ土カラムからの溶出画分の確認 WCRS 10.0 g を本法 2.4 の 1)に従って抽出,ろ過及び定容し,得られた試料溶液 5 mL にベン フレセート及びシハロホップブチルとしてそれぞれ 0.4 及び 0.2 mg/kg 相当量(最終試料溶液中 で50 及び 25 ng/mL 相当量)を添加し,多孔性ケイソウ土カラムからの溶出画分を確認した.そ の結果は Table 4 のとおりであり,ベンフレセート及びシハロホップブチルは,0~60 mL の画分 に大部分が溶出し,シハロホップブチルについては 60~100 mL の画分においても溶出が認めら れたため,多孔性ケイソウ土カラムからのヘキサンでの溶出液量は100 mL とした. y = 2671.95 x - 3,576.67 R² = 0.9992 0 100000 200000 300000 400000 500000 600000 0 50 100 150 200 P ea k ar ea / a rb .u ni ts Concentration of cyhalofop-butyl / [ng/mL] y = 335.26 x - 438.58 R² = 0.9991 0 10000 20000 30000 40000 50000 60000 70000 80000 0 50 100 150 200 P ea k he ig ht / ar b. un its Concentration of cyhalofop-butyl / [ng/mL]
Table 4 Elution pattern of benfuresate and cyhalofop-butyl from InertSep K-solute 0~60 mL 60~80 mL 80~100 mL 100~120 mL Benfuresate 90 0 0 0 90 Cyhalofop-butyl 90 2 1 0 93 Pesticides Recovery (%) Hexane Total n = 1 3.6 積層ミニカラムからの流出画分の確認 WCRS 10.0 g を 2.4 の 1)及び 2)に従って調製し,得られた溶出液にベンフレセート及びシハロ ホップブチルとしてそれぞれ0.4 及び 0.2 mg/kg 相当量(最終試料溶液中で 100 及び 50 ng/mL 相 当量)を添加し,積層ミニカラムからの流出画分を確認した.その結果は Table 5 のとおりであ り,いずれの農薬も 0~10 mL の画分に流出し,その他の画分には流出は認められなかった.こ のことから,酢酸エチル10 mL で流出させることとした.
Table 5 Elution pattern of benfuresate and cyhalofop-butyl from ENVI-Carb/LC-NH2
0~10 mL 10~12 mL 12~14 mL Benfuresate 99 0 0 99 Cyhalofop-butyl 100 0 0 100 Pesticides Recovery (%) Ethyl acetate Total n = 1 3.7 妨害物質の検討 WCRS 2 検体を用い,本法により調製した試料溶液を LC-MS/MS に注入し,得られた SRM ク ロマトグラムを確認したところ,いずれの試料においてもベンフレセート及びシハロホップブチ ルの定量を妨げるピークは認められなかった. なお,得られた SRM クロマトグラムを Fig. 5 に示した. 3.8 マトリックス効果の確認 2.4 の 1)から 3)により調製した WCRS のブランク試料溶液にベンフレセートとして 0.02 及び 0.4 mg/kg 相当量(最終試料溶液中で 5 及び 100 ng/mL 相当量),シハロホップブチルとして 0.02 及び 0.2 mg/kg 相当量(最終試料溶液中で 5 及び 50 ng/mL 相当量)をそれぞれ添加した各 マトリックス標準液について,2.2 の 5)に従って調製した同濃度の各農薬標準液に対するピーク 面積比を確認したところ,Table 6 のとおりであり,各農薬は試料マトリックスによる大きな影 響を受けることなく測定可能であった.
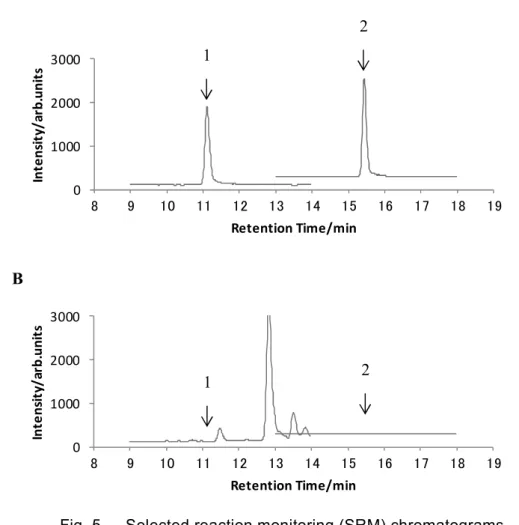
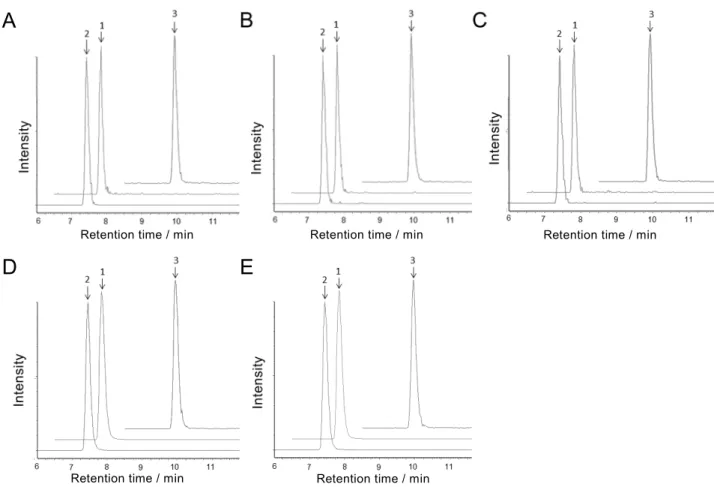
Fig. 5 Selected reaction monitoring (SRM) chromatograms of standard and blank sample solution
(LC-MS/MS conditions are shown in Tables 1 and 2. Arrows indicate the retention times of 1: benfuresate and 2: cyhalofop-butyl. The baselines are shifted for display.)
A: Standard solution (5 ng/mL: 50 pg as each pesticide) B: Sample solution of WCRS (blank)
Table 6 Results of matrix effect study in matrix standard in samplea)
solution (ng/mL) (mg/kg air-dry matter)
5 0.02 100 100 0.4 100 5 0.02 112 50 0.2 107 Matrix effectb) (%) Pesticides Benfuresate Cyhalofop-butyl Concentration of pesticides n = 1
a) Converted from the concentration in matrix standard solution
b) Ratio of peak area of pesticides in the presence of matrix to that in the absence of matrix 3.9 添加回収試験 2.2 の 2)~4)のベンフレセート標準原液及びシハロホップブチル標準原液をアセトンで正確に希 A 0 1000 2000 3000 8 9 10 11 12 13 14 15 16 17 18 19 In te ns it y/ ar b. un it s Retention Time/min 1 2 B 0 1000 2000 3000 8 9 10 11 12 13 14 15 16 17 18 19 In te ns it y/ ar b. un it s Retention Time/min 1 2
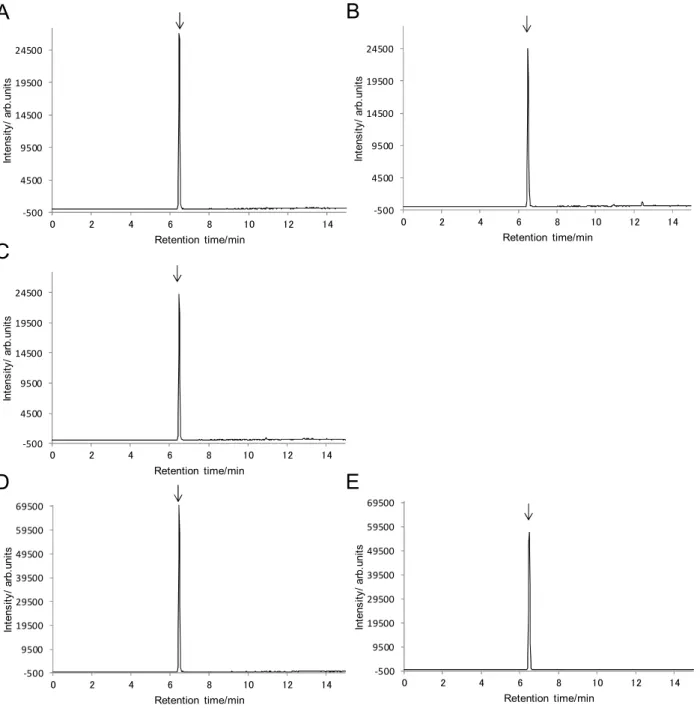
釈し添加に用いた. WCRS について,ベンフレセートとして,原物換算して 0.009 及び 0.2 mg/kg 相当量(最終試 料溶液中で5 及び 100 ng/mL),シハロホップブチルとして,原物換算して 0.009 及び 0.1 mg/kg 相当量(最終試料溶液中で 5 及び 50 ng/mL)になるようにそれぞれ添加してよく混合し,一夜 静置した後に本法に従って定量し,平均回収率及び繰返し精度を求めた. なお,添加は風乾物試料に対してベンフレセートとして 0.02 及び 0.4 mg/kg 相当量,シハロホ ップブチルとして0.02 及び 0.2 mg/kg 相当量になるよう行い,原物中濃度への換算は,原物中及 び風乾物中の水分含有量を60 %及び 10 %と想定して,原物(水分含有量 60 %)中濃度=風乾物 (水分含有量10 %)中濃度/2.25 の式により行った. その結果は Table 7 のとおり,ベンフレセートの平均回収率は 86.0~101 %,RSDrは,12 %以 下,シハロホップブチルの平均回収率は 85.3~93.2 %,その繰返し精度は RSDrとして 14 %以下 の成績が得られ,飼料分析基準の妥当性確認法ガイドライン 5)(以下「妥当性確認法ガイドライ ン」という.)に定められた真度及び併行精度の目標値を満たしていた. なお,得られた SRM クロマトグラムの一例を Fig. 6 に示した.
Table 7 Recoveries for benfuresate and cyhalofop-butyl
Recoveryb) RSDrc) Recoveryb) RSDrc) (%) (%) (%) (%) 0.009 86.0 6.4 91.1 12 0.2 89.2 11 101 2.7 0.009 93.2 7.7 85.3 14 0.1 87.0 11 91.0 5.4 Benfuresate Cyhalofop-butyl
Pesticides Spiked level
(mg/kg original matter)a)
Sample
WCRS 1 WCRS 2
a) Mean (n = 5)
b) Relative standard deviation of repeatability
c) The pesticides were spiked to air-dried WCRS samples one night prior to extraction. The spiked levels were 0.02 and 0.4 mg/kg air-dry matter for benfuresate and 0.02 and 0.2 mg/kg air-dry matter for cyhalofop-butyl, respectively. The levels of pesticides in original matter were calculated with following equation on the assumption that the moisture content of WCRS samples was 60 % for original matter and 10 % for air-dry matter.
The levels of pesticides in original matter (moisture 60 %)
Fig. 6 SRM chromatograms on recovery test
(LC-MS/MS conditions are shown in Tables 1 and 2. Arrows indicate the peaks of 1: benfuresate and 2: cyhalofop-butyl. The baselines are shifted for display.)
A: Standard solution (100 ng/mL: 1 ng as benfuresate and 50 ng/mL: 0.5 ng as cyhalofop-butyl) B: Sample solution of WCRS (spiked at 0.2 mg/kg original matter of benfuresate (as 100 ng/mL in
sample solution), and 0.1 mg/kg original matter of cyhalofop-butyl (as 50 ng/mL in sample solution)) 3.10 定量下限及び検出下限 ベンフレセート及びシハロホップブチル検量線が直線性を示した範囲,各 1~200 ng/mL の下端 付近となる濃度(WCRS 風乾物中で 0.02 mg/kg 相当量(最終試料溶液中で 5 ng/mL 相当量)) の添加回収試験の結果,得られたピークの SN 比が 10 以上であったため,ベンフレセート及び シハロホップブチルの定量下限の濃度は WCRS の風乾物中で 0.02 mg/kg とした.この濃度は, ベンフレセート及びシハロホップブチルの WCRS 中の管理基準値の風乾物中換算値(それぞれ 0.45 及び 0.225 mg/kg)に対してそれぞれ 1/22 及び 1/11 であり,妥当性確認法ガイドラインに定 められた目標を満たしていた. 本法の検出下限を確認するため,添加回収試験により得られたピークの SN 比が 3 となる濃度 を求めた.その結果,検出下限は風乾物中でベンフレセートは 0.006 mg/kg,シハロホップブチ ルは 0.0005 mg/kg であり,同様に妥当性確認法ガイドラインに定められた目標を満たしていた. なお,Table 7 に示したとおり,当該定量下限濃度における添加回収試験結果は良好であった. 3.11 共同試験 本法の室間再現精度を確認するため,濃度非通知,かつ非明示の 2 点反復で共通試料による共 A 0 10000 20000 30000 40000 8 9 10 11 12 13 14 15 16 17 18 19 In te ns it y/ ar b. un it s Retention Time/min 1 2 B 0 10000 20000 30000 40000 8 9 10 11 12 13 14 15 16 17 18 19 In te ns ity /a rb .u ni ts Retention Time/min 1 2
同試験を実施した. 共通試料としては,WCRS 1(風乾物)にベンフレセートとして 0.45 mg/kg 相当量及びシハロ ホップブチルとして0.225 mg/kg 相当量(分析用試料 10 g に対して 1 mL 中にベンフレセート 4.5 µg 及びシハロホップブチル 2.25 µg を含有する混合標準液 1 mL)を,WCRS 2(風乾物)にベン フレセート及びシハロホップブチルとしてそれぞれ0.045 mg/kg 相当量(分析用試料 10 g に対し て1 mL 中にベンフレセート及びシハロホップブチル各 0.45 µg を含有する混合標準液 1 mL)を, それぞれ各試験室にて分析開始の前日に添加して調製した試料を用いた. 参加試験室は,一般財団法人日本食品分析センター彩都研究所,一般財団法人化学物質評価研 究機構東京事業所,一般財団法人東京顕微鏡院食と環境の科学センター,フィード・ワン株式会 社研究所,株式会社島津製作所分析計測事業部グローバルアプリケーション開発センター,独立 行政法人農林水産消費安全技術センター肥飼料安全検査部,同札幌センター,同仙台センター, 同名古屋センター,同神戸センター及び同福岡センター(計 11 試験室)であった.結果の解析 については,国際的にハーモナイズされた共同試験に関する手順 8), 9)を参考に,Cochran 検定, 外れ値1 個の Grubbs 検定及び外れ値 2 個の Grubbs 検定を行い,外れ値の有無を確認した上で平 均回収率,繰返し精度(RSDr)及び室間再現精度(RSDR)を算出し,得られた RSDR から,修 正Horwitz 式10)を用いてHorRat を求めた. ベンフレセートの結果は Table 8 のとおりであり,WCRS 1 及び WCRS 2 について,平均回収 率は 96.1 及び 94.7 %,RSDrは2.6 及び 3.7 %,RSDRは8.1 及び 10 %,HorRat は 0.45 及び 0.45 であり,妥当性確認法ガイドラインに定められた室間再現精度の目標値を満たしていた.HorRat が0.5 をわずかに下回ったが,分析操作が比較的簡便であるためと考えられた. シハロホップブチルの結果は Table 9 のとおりであり,WCRS 1 及び WCRS 2 について,平均 回収率は92.7 及び 97.0 %,RSDrは2.7 及び 4.8 %,RSDRは22 及び 32 %,HorRat は 1.1 及び 1.5 であり,試験法の妥当性確認法ガイドラインに定められた室間再現精度の目標値を満たしていた. シハロホップブチルの RSDRは,ベンフレセートに比べ大きい傾向が認められたが,一部の試験 室からシハロホップブチルの感度が安定しないとの報告があったことから,LC-MS/MS 機体のコ ンディションによる影響を受けているものと考えられた. 参考のため,各試験室で使用した LC-MS/MS の機種等を Table 10 に示した.
Table 8 Collaborative study for benfuresate 1 0.426 0.420 0.0435 0.0407 2 0.398 0.397 0.0386 0.0394 3 0.459 0.437 0.0466 0.0512 4 0.444 0.408 0.0470 0.0456 5 0.403 0.390 0.0394 0.0375 6 0.480 0.483 0.0370 0.0379 7 0.442 0.445 0.0413 0.0409 8 0.485 0.509 0.0475 0.0482 9 0.383 0.394 0.0402 0.0375 10 0.444 0.435 0.0468 0.0458 11 0.420 0.415 0.0440 0.0409
Spiked level (mg/kg air-dry matter) Mean valuea) (mg/kg air-dry matter)
Mean recoverya) (%) RSDrb) (%) RSDRc) (%) PRSDRd) (%) HorRat 0.45 0.45 2.6 3.7 8.1 10 18 22 0.45 0.045 0.433 0.0426 96.1 94.7 Lab. No. Sample WCRS 1 WCRS 2
(mg/kg air-dry matter) (mg/kg air-dry matter)
a) n = 22
b) Relative standard deviation of repeatability within laboratory c) Relative standard deviation of reproducibility between laboratories
d) Predicted relative standard deviation of reproducibility between laboratories calculated from the modified Horwitz equation
Table 9 Collaborative study for cyhalofop-butyl 1 0.213 0.212 0.0444 0.0383 2 0.179 0.175 0.0337 0.0332 3 0.193 0.181 0.0324 0.0327 4 0.324 0.314 0.0708 0.0688 5 0.211 0.212 0.0561 0.0586 6 0.184 0.180 0.0368 0.0386 7 0.251 0.246 0.0643 0.0644 8 0.217 0.210 0.0399 0.0388 9 0.128 0.143 0.0260 0.0261 10 0.199 0.210 0.0399 0.0333 11 0.206 0.201 0.0419 0.0409
Spiked level (mg/kg air-dry matter) Mean valuea) (mg/kg air-dry matter)
Mean recoverya) (%) RSDrb) (%) RSDRc) (%) PRSDRd) (%) HorRat 1.1 1.5 2.7 4.8 22 32 20 22 0.225 0.045 0.209 0.0436 92.7 97.0 Lab. No. Sample WCRS 1 WCRS 2
(mg/kg air-dry matter) (mg/kg air-dry matter)
a) n = 22
b) Relative standard deviation of repeatability within laboratory c) Relative standard deviation of reproducibility between laboratories
d) Predicted relative standard deviation of reproducibility between laboratories calculated from the modified Horwitz equation
Table 10 Instruments used in the collaborative study LC column (i.d.×length, particle size)
LC: ACQUITY UPLC, Waters Inertsil ODS-3, GL Sciences
MS/MS: Quattro premier XE, Waters (2.1 mm×150 mm, 3 µm)
LC: Nexera X2, Shimadzu Inertsil ODS-3, GL Sciences
MS/MS: LCMS-8040, Shimadzu (2.1 mm×150 mm, 3 µm)
LC: Nexera X2, Shimadzu Inertsil ODS-3, GL Sciences
MS/MS: LCMS-8040, Shimadzu (2.1 mm×150 mm, 3 µm)
LC: ACQUITY UPLC, Waters Inertsil ODS-3, GL Sciences
MS/MS: ACQUITY TQD, Waters (2.1 mm×150 mm, 3 µm)
LC: ACQUITY UPLC, Waters ZORBAX Eclipse XDB-C18
MS/MS: ACQUITY TQD, Waters Agilent Technologies
(4.6 mm×150 mm, 3.5 µm)
LC: ACQUITY UPLC, Waters Mightysil RP-18GP
MS/MS: ACQUITY TQD, Waters Kanto Chemical
(2.0 mm×150 mm, 3 µm)
LC: Nexera XR, Shimadzu Inertsil ODS-3, GL Sciences
MS/MS: QTRAP 5500 AB SCIEX (2.1 mm×150 mm, 3 µm)
LC: Alliance 2695, Waters Inertsil ODS-3, GL Sciences
MS/MS: Quattro premier XE, Waters (2.1 mm×150 mm, 3 µm)
LC: Prominence Shimadzu Inertsil ODS-3, GL Sciences
MS/MS: QTRAP 5500 AB SCIEX (2.1 mm×150 mm, 3 µm)
LC: Nexera X2, Shimadzu Inertsil ODS-3 HP, GL Sciences
MS/MS: LCMS-8040, Shimadzu (2.1 mm×150 mm, 3 µm)
LC: 1200 Series Agilent Technologies Inertsil ODS-3, GL Sciences MS/MS: 6410 Triple Quadrupole LC/MS (2.1 mm×150 mm, 3 µm) Agilent Technologies 11 5 6 7 8 9 10 4 Lab.No LC-MS/MS 1 2 3
4 まとめ
WCRS に残留するベンフレセート及びシハロホップブチルについて,GC-MS 法を基に,LC-MS/MS を用いた同時定量法の飼料分析基準への適用の可否について検討したところ,抽出定容液 の分取液量の変更,多孔性ケイソウ土カラムの保持容量の変更,ゲル浸透クロマトグラフ及びエチ レンジアミン-N-プロピルシリル化シリカゲルミニカラムによる精製を積層ミニカラムによる精製 に変更並びにGC-MS による測定から LC-MS/MS(APCI)による測定に変更にすることで,以下の 結果が得られ,適用が可能であると考えられた. 1) 検量線はそれぞれ 1~200 ng/mL(注入量として 0.01~2 ng 相当量)の範囲で直線性を示した. なお,当該検量線の濃度範囲は,ベンフレセート及びシハロホップブチルを 0.004~0.8 mg/kg 含有する分析用試料を本法に従い調製した最終試料溶液中の各農薬濃度範囲に相当する. 2) WCRS について,本法に従って得られたクロマトグラムには,定量を妨げるピークは認められ なかった.3) 本法に従い得られた試料溶液についてマトリックス効果を確認した結果,ベンフレセート及び シハロホップブチルは試料マトリックスによる大きな影響を受けることなく測定可能であった. 4) 原物中に換算してベンフレセートとして 0.009 及び 0.2 mg/kg 相当量,シハロホップブチルと して 0.009 及び 0.1 mg/kg 相当量を添加し,本法に従って 5 点併行分析を実施し,回収率及び繰 返し精度を求めたところ,妥当性確認法ガイドラインに定められた真度及び併行精度の目標値を 満たす良好な結果が得られた. 5) 本法のベンフレセートの定量下限は風乾物中で 0.02 mg/kg,検出下限は 0.006 mg/kg,シハロホ ップブチルの定量下限は風乾物中で0.02 mg/kg,検出下限は 0.0005 mg/kg であった.設定した定 量下限及び検出下限は,妥当性確認法ガイドラインに定められた目標を満たしていた. 6) WCRS 1(風乾物)にベンフレセートとして 0.45 mg/kg 相当量及びシハロホップブチルとして 0.225 mg/kg 相当量を,WCRS 2(風乾物)にベンフレセート及びシハロホップブチルとしてそれ ぞれ 0.045 mg/kg 相当量を添加した試料を用いて 11 試験室において本法に従い共同試験を実施 したところ,妥当性確認法ガイドラインに定められた室間再現精度の目標値を満たす良好な結果 が得られた.
謝 辞
共同試験に参加していただいた一般財団法人日本食品分析センター彩都研究所,一般財団法人化 学物質評価研究機構東京事業所,一般財団法人東京顕微鏡院食と環境の科学センター,フィード・ ワン株式会社研究所及び株式会社島津製作所分析計測事業部グローバルアプリケーション開発セン ターにおける関係者各位に感謝の意を表します.文 献
1) 環境省中央環境審議会土壌農薬部会農薬小委員会(第 23 回):水質汚濁に係る農薬登録保留 基準の設定に関する資料,平成22 年 11 月 19 日 (2010). 2) 農林水産省畜産局長通知:飼料の有害物質の指導基準及び管理基準について,昭和 63 年 10 月 14 日,63 畜 B 第 2050 号 (1988). 3) 環境省中央環境審議会土壌農薬部会農薬小委員会(第 38 回):水産動植物の被害防止に係る 農薬登録保留基準として環境大臣が定める基準の設定に関する資料,平成 26 年 1 月 21 日 (2014). 4) 財団法人日本食品分析センター:平成 22 年度飼料中の有害物質等分析法開発委託事業 飼料 中の有害物質等の分析法の開発 (2010). 5) 農林水産省消費・安全局長通知:飼料分析基準の制定について,平成 20 年 4 月 1 日,19 消安 第14729 号 (2008). 6) 佐藤 梢,風間 鈴子:稲わら及び籾米中のベンフレセート及びシハロホップブチルのガスクロ マトグラフ質量分析計による同時定量法,飼料研究報告,38,108-125 (2013). 7) 岡本 葉,高取 聡,北川 陽子,起橋 雅浩,福井 直樹,村田 弘,住本 建夫,田中 之雄,尾 花 裕 孝 : LC-MS/MS に よ る 餃 子 中 の 農 薬 一 斉 分 析 法 の 検 討 , 食 品 衛 生 学 雑 誌 , 50 , 10-15 (2009).8) William Horwitz: Protocol for design, conduct and interpretation of method-performance studies, Pure & Appl. Chem., 67(2), 331-343 (1995).
9) George W. Latimer, Jr.: Official methods of analysis of AOAC INTERNATIONAL 20th edition, Appendix D, Guidelines for collaborative study procedures to validate characteristics of a method of analysis. Gaithersburg, MD, USA (2016) (ISBN: 978-0-935584-87-5).
10) Michael Thompson: Recent trends in inter-laboratory precision at ppb and sub-ppb concentrations in relation to fitness for purpose criteria proficiency testing, Analyst, 125, 385-386 (2000).
技術レポート
1 飼料中のカルバリル,カルボフラン及びフェノブカルブの液体クロマ
トグラフタンデム型質量分析計による同時定量法の開発
田中 里美*,桑原 正良*
Development of Simultaneous Determination Method of Carbaryl, Carbofuran and Fenobucarb in Feed by LC-MS/MS
Satomi TANAKA* and Masayoshi KUWABARA*
(* Kobe Regional Center, Food and Agricultural Materials Inspection Center)
An analytical method was developed to determine the levels of carbaryl, carbofuran and fenobucarb in feed using a liquid chromatograph-electrospray ionization-tandem mass spectrometer (LC-ESI-MS/MS).
After adding water to the sample, carbaryl, carbofuran and fenobucarb were extracted with acetone and the extracted solutions were filtered. The filtrate was then diluted with acetone to a volume of 200 mL. The sample solution was purified with a SPE column (InertSep Slim-J C18-B, GL sciences Inc.; Tokyo, Japan) and injected into the LC-MS/MS to determine the levels of carbaryl, carbofuran and fenobucarb. LC separation was carried out on an ODS column (ZORBAX Eclipse XDB-C18, 2.1 mm i.d. × 150 mm, 5 μm from Agilent Technologies Inc.; Santa Clara, CA, USA) using a gradient with 2 mmol/L ammonium acetate solution and acetonitrile as a mobile phase. In the MS/MS analysis, positive mode electrospray ionization (ESI+) was used.
Recovery tests were conducted on formula feed for finishing beef cattle, wheat, corn, milo and oaten hay. Formula feed for finishing beef cattle and corn were spiked with 0.01 or 0.1 mg/kg of carbaryl, 0.01 or 0.05 mg/kg of carbofuran and 0.01 or 0.3 mg/kg of fenobucarb. Wheat was spiked with 0.01 or 2 mg/kg of carbaryl, 0.01 or 0.2 mg/kg of carbofuran and 0.01 or 0.3 mg/kg of fenobucarb. Milo was spiked with 0.01 or 10 mg/kg of carbaryl, 0.01 or 0.1 mg/kg of carbofuran and 0.01 or 0.3 mg/kg of fenobucarb. Oaten hay was spiked with 0.1 or 250 mg/kg of carbaryl, 0.1 or 13 mg/kg of carbofuran and 0.1 or 10 mg/kg of fenobucarb. The mean recoveries ranged from 86.6 to 103 % for carbaryl, 91.3 to 105 % for carbofuran and 85.5 to 99.1 % for fenobucarb.
The relative standard deviations of repeatability (RSDr) were not more than 10 % for carbaryl,
7.4 % for carbofuran and 11 % for fenobucarb.
Key words: carbaryl; carbofuran; fenobucarb; liquid chromatograph-tandem mass spectrometer (LC-MS/MS); electrospray ionization (ESI); feed
キーワード:カルバリル;カルボフラン;フェノブカルブ;液体クロマトグラフタンデム 型質量分析計;エレクトロスプレーイオン化法;飼料
1 緒 言
カルバリルは,米国 Union Carbide 社が開発したカーバメート系の殺虫剤であり,我が国では 1959 年に国内登録されている 1).カルボフランは米国 FMC 社が導入したカーバメート系の殺虫剤 * 独立行政法人農林水産消費安全技術センター神戸センターであり,国内登録はされておらず,米国でも使用が中止されている 2).フェノブカルブはクミアイ 化学が開発したカーバメート系の殺虫剤であり,1968 年に国内登録されている1), 3). これらの農薬の我が国における飼料中の残留基準としては,飼料及び飼料添加物の成分規格等に 関する省令4)において,カルバリルはえん麦及びマイロで10 mg/kg,大麦及びライ麦で 5 mg/kg, 小麦で2 mg/kg,とうもろこしで 0.1 mg/kg 及び牧草で 250 mg/kg,カルボフランは,カルボフラン 及び 3-OH カルボフランをカルボフラン含量に換算したものの和と規定され 5),えん麦,マイロ及 びライ麦で0.1 mg/kg,大麦及び小麦で 0.2 mg/kg,とうもろこしで 0.05 mg/kg 及び牧草で 13 mg/kg, フェノブカルブはえん麦,大麦,小麦,とうもろこし,マイロ及びライ麦ともに 0.3 mg/kg の基準 値が設定されている.また,フェノブカルブは,飼料の有害物質の指導基準及び管理基準 6)におい て飼料用イネ(稲わら,稲発酵粗飼料及び籾米)の管理基準値が設定されている. 飼料(飼料用イネを除く.)中の当該 3 成分を含むカーバメート系農薬の同時定量法としては, 飼料分析基準 7)にポストカラム蛍光誘導体化液体クロマトグラフで定量する分析法が収載されてい る.しかし,この方法は上記基準値を念頭に置いた妥当性確認が実施されていない.また,測定機 器についても,より汎用性のあるものが望ましい. 榊原は,財団法人日本食品分析センターが平成 21 年度飼料中の有害物質等分析法開発委託事業 において開発した LC-MS/MS を用いた定量法 8)(以下「JFRL 法」という.)を基に,飼料用イネ 中の当該3 成分を含む 8 成分の同時定量法について飼料分析基準への適用の可否を検討し,稲わら, 稲発酵粗飼料及び籾米に適用可能な定量法 9)(以下「イネ法」という.)を確立した.今回,飼料 (飼料用イネを除く.)中のカルバリル,カルボフラン及びフェノブカルブについて,JFRL 法及 びイネ法を基に飼料分析基準への収載を目途とした同時定量法の開発等について検討したので,そ の概要を報告する. 参考にカルバリル,カルボフラン及びフェノブカルブの構造式等を Fig. 1 に示した.
Carbaryl Carbofuran Fenobucarb
1-naphthyl methylcarbamate 2,3-dihydro-2,2-dimethylbenzofuran- 7-yl methylcarbamate (RS)-2-sec-butylphenyl methylcarbamate C12H11NO2 MW: 201.2 CAS No.: 63-25-2 C12H15NO3 MW: 221.3 CAS No.: 1563-66-2 C12H17NO2 MW: 207.3 CAS No.: 3766-81-2
2 実験方法
2.1 試 料
成鶏飼育用配合飼料,種豚飼育用配合飼料,肉用牛肥育用配合飼料,えん麦,大麦,小麦,と
うもろこし,マイロ,ライ麦,アルファルファ乾草及びオーツ乾草はそれぞれ1 mm のスクリー
ンを装着した粉砕機で粉砕した.なお,検討に用いた配合飼料の配合割合をTable 1 に示した.
Table 1 Compositions of the formula feed
Proportion (%)
Grains 55 Corn, brown rice, milo
Oil seed meal 26 Soybean meal, rapeseed meal, corn gluten meal, sesame meal,
corn germ meal
Animal by-products 1 Meat-and-bone meal
Brans 2 Rice bran, corn gluten feed
Others 16 Calcium carbonate, animal fat, dried leftover, corn steep liquor,
calcium phosphate, salt, enzyme-treated copra meal, feed additives
Grains 65 Corn, milo, oat
Oil seed meal 13 Soybean meal
Animal by-products 3 Fish meal
Brans 8 Wheat bran, rice powder
Others 11 Alfalfa meal, bakery waste, calcium carbonate, calcium phosphate,
salt, feed additives
Grains 56 Barley, corn, corn starch, potato starch
Oil seed meal 5 Soybean meal
Brans 38 Wheat bran, hominy feed, soybean hulls, corn gluten feed, rice bran,
brewers grains
Others 1 Molasses, calcium carbonate, salt, lactic acid bacteria, brewers yeast,
butyric acid bacteria, saccharification bacteria, natural aluminum silicate, light silicic acid, galacto-oligosaccharide, glucose, zeolite, calcium propionate For finishing beef cattle Ingredient types Formula feed types Ingredients For breeding period chicken For breeding period pigs 2.2 試 薬 1) アセトンは残留農薬・PCB 試験用を用いた.アセトニトリルはカラム処理には残留農薬・ PCB 試験用を用い,標準液及び LC-MS/MS 溶離液には液体クロマトグラフ用を用いた.酢酸 アンモニウムは高速液体クロマトグラフ用(1 mol/L 溶液,和光純薬工業製)を用いた.水は
Millipore, DIRECT-Q UV 3(Merck Millipore 製)により精製した超純水(JIS K0211 の 5218 に 定義された超純水)を用いた. 2) カルバリル標準原液 カルバリル標準品(純度 99.8 %,関東化学製)25 mg を正確に量って 50 mL の全量フラスコ に入れ,アセトンを加えて溶かし,更に標線までアセトンを加えてカルバリル標準原液を調製 した(この液1 mL は,カルバリルとして 0.5 mg を含有する.). 3) カルボフラン標準原液 カルボフラン標準品(純度 99.8 %,関東化学製)25 mg を正確に量って 50 mL の全量フラス コに入れ,アセトンを加えて溶かし,更に標線までアセトンを加えてカルボフラン標準原液を 調製した(この液1 mL は,カルボフランとして 0.5 mg を含有する.).
4) フェノブカルブ標準原液 フェノブカルブ標準品(純度 98.4 %,関東化学製)25 mg を正確に量って 50 mL の全量フラ スコに入れ,アセトンを加えて溶かし,更に標線までアセトンを加えてフェノブカルブ標準原 液を調製した(この液1 mL は,フェノブカルブとして 0.5 mg を含有する.). 5) 混合標準液 各標準原液各 2 mL を 100 mL の全量フラスコに入れて混合し,更に標線までアセトンを加 えて混合標準原液を調製した(この液 1 mL は,カルバリル,カルボフラン及びフェノブカル ブとして各10 µg を含有する.). 使用に際して,混合標準原液の一定量を,アセトニトリル-水(3+2)で正確に希釈し,1 mL 中にカルバリル,カルボフラン及びフェノブカルブとして各 0.04,0.06,0.08,0.1,0.2, 0.4,0.6,0.8,1,2,4,6,8,10,20,40,60,80,100,200,400 及び 600 ng を含有する 混合標準液を調製した. 2.3 装置及び器具 1) 粉砕機: 粉砕機1(乾牧草以外用):ZM 200 Retsch 製(1 mm スクリーン,使用時回転数 14000 rpm) 粉砕機2(乾牧草用):SM 2000 Retsch 製(1 mm スクリーン,回転数(仕様)835 rpm) 2) 振とう機:MW-DRV 宮本理研工業製(使用時振とう数 300 rpm) 3) オクタデシルシリル化シリカゲルミニカラム:InertSep Slim-J C18-B(充てん剤量 500 mg) ジーエルサイエンス製にリザーバーを連結したもの 4) LC-MS/MS:
LC 部:ACQUITY UPLC System Waters 製 MS/MS 部:ACQUITY TQ Detector Waters 製 2.4 定量方法 1) 抽 出 分析試料 10.0 g を量って 300 mL の共栓三角フラスコに入れ,水 20 mL(乾牧草は 30 mL) を加え,30 分間静置後,更にアセトン 100 mL(乾牧草は 120 mL)を加え,30 分間振り混ぜ て抽出した.200 mL の全量フラスコをブフナー漏斗の下に置き,抽出液をろ紙(5 種 B)で 吸引ろ過した後,先の三角フラスコ及び残さを順次アセトン 50 mL で洗浄し,同様に吸引ろ 過した.更に全量フラスコの標線までアセトンを加えた.この液 2 mL(乾牧草については, この液の一定量をアセトンで正確に 10 倍希釈した液 2 mL)を 50 mL のなす形フラスコに正 確に入れ,水20 mL を加えて,カラム処理に供する試料溶液とした. 2) カラム処理 オクタデシルシリル化シリカゲルミニカラムをアセトニトリル 5 mL 及び水 5 mL で順次洗 浄した.試料溶液をミニカラムに入れ,流速 1 mL/min 程度で吸引して液面が充てん剤の上端 に達するまで流出させた.更に試料溶液の入っていたなす形フラスコを水-アセトニトリル (9+1)5 mL ずつで 2 回洗浄し,洗液を順次ミニカラムに加え,同様に流出させた.10 mL の 全量フラスコをミニカラムの下に置き,アセトニトリル-水(3+2)9 mL をミニカラムに加え, 同様に吸引して各農薬成分を溶出させた.全量フラスコの標線まで同溶媒を加え,この液の一 定量を5000×g で 5 分間遠心分離し,上澄み液を LC-MS/MS による測定に供する試料溶液とし
た.
3) LC-MS/MS による測定
試料溶液及び各混合標準液各 5 µL を LC-MS/MS に注入し,選択反応検出(以下「SRM」と
いう.)クロマトグラムを得た.測定条件をTable 2 及び 3 に示した.
Table 2 Operating conditions of LC-MS/MS
Column ZORBAX Eclipse XDB-C18 (2.1mm i.d. × 150 mm, 5 μm), Agilent Technologies Mobile phase 2 mmol/L ammonium acetate solution–acetonitrile (4:1)
→ 15 min → (1:9) (hold for 5 min)
Flow rate 0.2 mL/min
Column temperature 40 °C
Ionization Electrospray ionization (ESI)
Mode Positive Source temperature 120 °C Desolvation gas N2 (650 L/h, 350 °C) Capillary voltage 1 kV Cone gas N2 (50 L/h) Collision gas Ar (0.20 mL/h) Table 3 MS/MS parameters
Precursor Cone Collision
ion Quantifier Qualifier voltage energy
(m /z) (m /z ) (m /z) (V) (eV) 145 - 22 12 - 127 22 28 165 - 24 12 - 123 24 23 95 - 24 16 - 77 24 36 Product ion Target Fenobucarb 208 Carbaryl 202 Carbofuran 222 4) 計 算 得られた SRM クロマトグラムからピーク面積及び高さを求めて検量線を作成し,試料中の カルバリル,カルボフラン及びフェノブカルブ量を算出した. なお,定量法の概要を Scheme 1 に示した.
Sample 10.0 g (300 mL Erlenmeyer flask)
2 mL of sample solution (50 mL eggplant flask) InertSep Slim-J C18-B (500 mg)
LC-MS/MS
add 20 mL of water (grass hay: 30 mL) and allow to stand for 30 min add 100mL of acetone (grass hay: 120 mL) and shake for 30 min
fill up to 200 mL with acetone
dilute sample solution of grass hay 10-fold with acetone
fill up to 10 mL with acetonitrile–water (3:2) (receiver: 200 mL volumetric flask)
centrifuge for 5 min at 5000×g wash with 50 mL of acetone
filtrate through filter paper (No. 5B of JIS P3801) under reduced pressure
add 20 mL of water
(prewash with 5 mL of acetonitrile and 5 mL of water) apply sample solution
wash with 5 mL of water–acetonitrile (9:1) (twice) elute with 9 mL of acetonitrile–water (3:2) place a receiver (10 mL volumetric flask)
Scheme 1 Analytical procedure for carbaryl, carbofuran and fenobucarb in feed
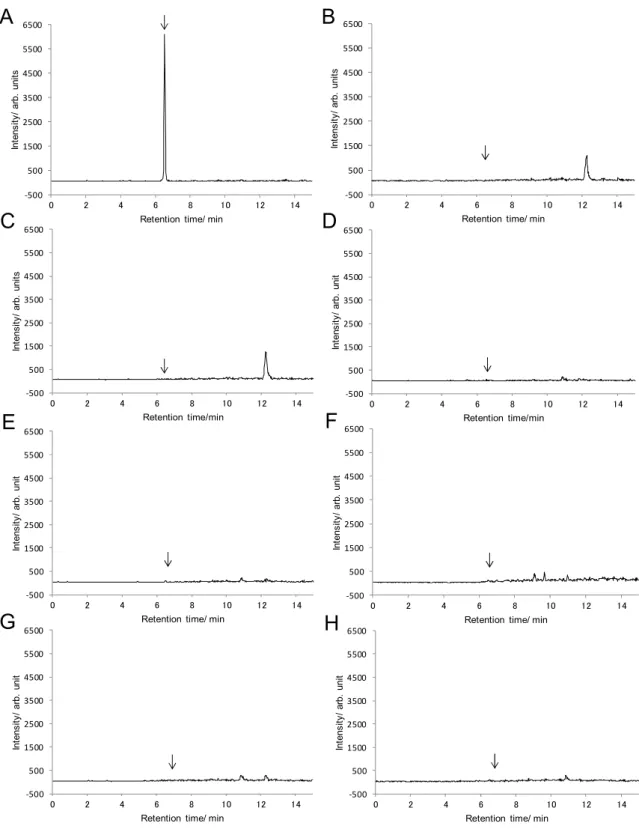
3 結果及び考察
3.1 検量線 2.2 の 5)に従って調製した各混合標準液各 5 µL を LC-MS/MS に注入し,得られた SRM クロマ トグラムからピーク面積及び高さを用いて検量線を作成した.得られた検量線の一例は,Fig. 2-1 から 2-3 のとおりであり,カルバリル,カルボフラン及びフェノブカルブは各 0.04~600 ng/mL (注入量として0.0002~3 ng)の範囲で直線性を示した. なお,当該検量線の濃度範囲は,カルバリル,カルボフラン及びフェノブカルブを 0.004~60 mg/kg 含有する分析用試料を本法に従い調製した最終試料溶液中のカルバリル,カルボフラン及 びフェノブカルブ濃度範囲に相当する.Concentration of carbaryl/ [µg/mL] P e a k a re a / a rb . u n its y = 325.81x + 816.04 R² = 0.9995 0 25000 50000 75000 100000 125000 150000 175000 200000 0 100 200 300 400 500 600 P e a k h e ig h t/ a rb . u n its Concentration of carbaryl/ [µg/mL] y = 1979.8x + 5983.2 R² = 0.9993 0 200000 400000 600000 800000 1000000 1200000 0 100 200 300 400 500 600
Fig. 2-1 Calibration curves of carbaryl by peak area (left) and peak height (right)
Concentration of carbofuran/ [µg/mL] P e a k a re a / a rb . u n its y = 800.89x + 1176.00 R² = 0.9997 0 50000 100000 150000 200000 250000 300000 350000 400000 450000 500000 0 100 200 300 400 500 600 Concentration of carbofuran/ [µg/mL] P e a k h e ig h t/ a rb . u n its y = 4927.5x + 9174.1 R² = 0.9997 0 500000 1000000 1500000 2000000 2500000 3000000 0 100 200 300 400 500 600
Fig. 2-2 Calibration curves of carbofuran by peak area (left) and peak height (right)
Concentration of fenobucarb/ [µg/mL] P e a k a re a / a rb . u n its y = 457.83x + 684.54 R² = 0.9997 0 50000 100000 150000 200000 250000 300000 0 100 200 300 400 500 600 Concentration of fenobucarb/ [µg/mL] P e a k h e ig h t/ a rb . u n its y = 2352.4x + 4318.0 R² = 0.9996 0 200000 400000 600000 800000 1000000 1200000 1400000 0 100 200 300 400 500 600
Fig. 2-3 Calibration curves of fenobucarb by peak area (left) and peak height (right) 3.2 抽出後の希釈操作について
飼料中のカルバリル等について最も低い基準値は,カルボフランのとうもろこしで 0.05 mg/kg
と定められている.イネ法は,アセトン抽出後 200 mL に定容し,更に 10 倍希釈(稲発酵粗飼
り低い濃度まで定量下限を下げる必要がある.そのため,基準値が高い乾牧草以外については, 抽出後の10 倍希釈を行わないこととして以後の検討を行った. 3.3 オクタデシルシリル化シリカゲルミニカラムからの溶出画分の確認 小麦を用い,2.4 の 1)により調製したカラム処理に供する試料溶液に,カルバリル,カルボフ ラン及びフェノブカルブとして 1 mg/kg 相当量(最終試料溶液中で 10 ng/mL 相当量)を添加し, オクタデシルシリル化シリカゲルミニカラムからの溶出画分を確認した.その結果は Table 4 の とおりであり,カルバリル,カルボフラン及びフェノブカルブはアセトニトリル-水(3+2) 0~9 mL の画分に溶出し,9~18 mL の画分には溶出が見られなかった.JFRL 法8)では10 mL で溶 出させているが,溶出液を受ける容器が 10 mL 全量フラスコであり標線を超えるおそれがある ことから,本法では、9 mL で溶出させた後,全量フラスコの標線まで同溶媒を加え LC-MS/MS による測定に供する試料溶液とした.
Table 4 Elution pattern of pesticides from InertSep Slim-J C18-B Water-acetonitrile Acetonitrile-water Acetonitrile-water
(9:1) (3:2) (3:2) 10 mL 0~9 mL 9~18 mL Carbaryl 0 97.0 0 97.0 Carbofuran 0 96.6 0 96.6 Fenobucarb 0 97.8 0 97.8 Mean recovery (%) Total Pesticides n = 3 3.4 妨害物質の検討 成鶏飼育用配合飼料,種豚飼育用配合飼料,肉用牛肥育用配合飼料,えん麦,大麦,小麦,と うもろこし,マイロ,ライ麦,アルファルファ乾草及びオーツ乾草各 1 検体を試料として,2.4 の 1)及び 2)により調製した試料溶液を LC-MS/MS に注入し,得られた SRM クロマトグラムを 確認したところ,いずれの試料においてもカルバリル,カルボフラン及びフェノブカルブの定量 を妨げるピークは認められなかった. なお,当該試料の SRM クロマトグラムを Fig. 3 に示した.