proteasome is an eukaryotic ATP-dependent protease responsible for selective degradation
of the polyubiquitin-tagged proteins in eukaryotic cells. It appears to act as an elegantly
organized apparatus designed for efficient and exhaustive hydrolysis of proteins, and can in
fact be regarded as a protein-destroying machinery. To date, there are growing lines of
evi-dence addressing the importance of the ubiquitin-proteasome system that catalyzes various
biological reactions rapidly, orderly, exhaustively, and unidirectionally. On the other hand,
autophagy (Greek for “self-eating”) is an evolutionarily conserved pathway in which the
cytoplasm and organelles are engulfed within double-membraned vesicles, known as
autophagosomes, which rapidly fuse with lysosomes and their contents together with the
inner membrane are degraded by a variety of lysosomal digestive enzymes. While
autoph-agy has been thought to contribute to bulk degradation non-selectively, but recent genetic
analaysis with mice reveals that ablation of autophagy leads to accumulation of
ubiquitin-positive inclusions, implying that the novel role of ubiquitin is to provide a signal that
shut-tles ubiquitinated proteins for autophagy. Currently, the roles of ubiqutin are expanding in
various fields of life science. In this review, I will review the ubiquitin-mediated proteolysis
pathway with a special reference to proteasomes and autophagy, focusing on how ubiquitin
is linked to the pathogenesis of neurodegenerative diseases.
Key words: autophagy, ubiquitin, proteasome, proteolysis, neurodegeneration.
1.はじめに ユビキチン(タンパク質の翻訳後修飾分子)は生命の謎 に迫るキープレイヤーとして生命科学のあらゆる領域にお いてその生物学的重要性が拡大の一歩を辿っている.2004 年ノーベル化学賞が「ユビキチン依存性タンパク質分解機 構の発見」のテーマに授与されたことは,その象徴的な出 来事である1).ユビキチンはそのパートナーであるプロテ アソーム(真核生物の ATP 依存性プロテアーゼ複合体)と 協同して選択的タンパク質分解を担っている.今日,この ユビキチン・プロテアソームシステム(UPS)が様々な生 体制御や細胞の恒常性維持に必須な役割を果たしているこ との報告は枚挙の暇がないほどに発展・膨張し続けている. そして近年の病態生理学研究における話題の一つは,ユビ キチン代謝系の破綻がアルツハイマー病やパーキンソン病 など様々な神経変性疾患発症の原因となってきつつあるこ とである.さらに驚いたことは,ユビキチンがこれまで全 く無関係と思われていたオートファジー・リソソームシス テムによるタンパク質分解機序においても重要な役割を果 たしていることが,ごく最近の遺伝学的研究から明確になっ てきたことである2).本稿では,ユビキチン・プロテアソー ム・オートファジーをキーワードとして拡大するユビキチ
Expanding world of ubiquitin: from basic science to pathophysiology. Keiji Tanaka; 東京都臨床医学総合研究所・先端研究センター
Correspondence address: Keiji Tanaka; Laboratory of Frontier Science, The Tokyo Metropolitan Institute of Medical Science, 3-18-22 Honkomagome, Bunkyo-ku, Tokyo 113-8613, Japan.
第 57 回日本電気泳動学会総会
生物物理化学 2007 ; 51 : 84 ンの世界について,基礎から病態に関わる問題を視野に入 れつつ概説したい. 2.ユビキチンとは? ユビキチンは 76 個のアミノ酸からなる小さなタンパク 質であり,長短 2 個の α ヘリックス構造と 5 個の β シート 構造が ββαββαβ の順に配位した二次構造をもっている(こ の構造はユビキチンフォールドと呼ばれ,多くのタンパク 質の機能ドメインを構成している).この熱安定性のタンパ ク質は酵母からヒトに至る全ての真核生物に普遍的に存在 し,その一次構造も進化的に高く保存されている.ユビキ チンは二つのタイプの興味深い遺伝子にコードされている. 一つは,ユビキチンとリボソームタンパク質の融合遺伝子 である(しかしこの融合遺伝子が存在する意義は現在なお 不明である).もう一つは,数個~ 10 数個のユビキチンが タンデムに連結したポリユビキチン遺伝子である.ポリユ ビキチン遺伝子は 1 回の転写・翻訳で多数のユビキチンを 合成することができる.またポリユビキチン遺伝子は熱 ショックなどのストレスに応答できる遺伝子でもある.こ の特有の遺伝子構造と発現調節機構は,細胞が環境ストレ スに曝されたとき,必要に応じて大量のユビキチンを迅速 に合成することができるシステムとして秀逸である3). ユビキチンは活性化酵素(E1)・結合酵素(E2)・リガー ゼ(E3)から構成された複合酵素系(ユビキチンシステム) によって標的タンパク質に共有結合(ユビキチンの C 末端 のグリシン残基のカルボキシル基とタンパク質中のリジン 残基の ε-アミノ基が縮合したイソペプチド結合)する翻訳 後修飾分子(モディファイヤー)である.そしてタンパク 質に結合したユビキチン内のリジン残基と新しいユビキチ ン分子内の C 末端のグリシン残基の間でイソペプチド結合 ができ,さらにユビキチン分子間での縮合反応を繰り返す ことによって,多数のユビキチン分子が枝状に伸長したポ リユビキチン鎖が形成される.ユビキチン分子には 7 個の リジン残基(K6, K11, K27, K29, K33, K48, K63)が存在し, それら全ての ε-アミノ基からユビキチンポリマーが伸張す る.また N 末端の α-アミノ基からユビキチンポリマーが 枝状もしくは直鎖状に伸張する例も知られている.これら の多様なユビキチン鎖の中でもとくに 48 番目のリジン残 基を介して形成されたポリユビキチン鎖は標的タンパク質 の分解シグナル,すなわちプロテアソームへのターゲッティ ングシグナルになることから,最も重要な役割を果たして いると考えられている(Fig. 1).他方,63 番目のリジン残 基を介して形成されたポリユビキチン鎖の重要性も生命科 学の広い分野で大きく広がっている.
E1/ユビキチン活性化酵素(Uba: Ub activating enzyme) は,ATP 依存的な adenylation を介してユビキチンと高エネ ルギーチオエステル結合し,ユビキチンを活性化する.ユ ビキチンを活性化する E1 は,全ての真核生物で 1 種類し か存在しない.E2/ユビキチン結合酵素(Ubc: Ub conjugating enzyme)は,E1 によって活性化されたユビキチンを高エ
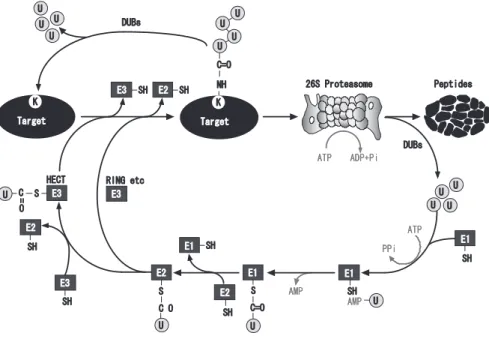
Fig. 1. The ubiquitin-proteasome system.
Ub, ubiquitin; E1 (Ub-activating), E2 (Ub-conjugating), and E3 (Ub-ligating) enzymes, DUB, deubiquitylating enzyme. E3s are classified into two groups: one HECT-type E3 and the other RING-type E3. The former E3 has a domain accepted to Ub as a thioester bond, termed “HECT”. The latter RING-type E3 is the general term for Ub-ligases with a RING-finger motif(s) capable of binding Zn2+. The 26S proteasome is an eukaryotic ATP-dependent, multi-subunit proteolytic complex. See text for details.
ネルギーチオエステル結合として受け取り,標的タンパク 質へ共有結合させる.E2 は単独でユビキチンを基質にイソ ペプチド結合させる反応を触媒することができるが,多く の場合,E3/ユビキチンリガーゼ(Ub protein-ligase)を必 要とする.E3 は,ユビキチンをチャージした E2(E2-ユビ キチン)と基質タンパク質の双方をトラップし,ユビキチ ンの受け渡しを触媒する酵素である.E3 は標的識別に関わ る酵素であるために,多様な分子種(ヒトでは 500 ~ 1000 種)から構成されている.E3 は活性中心の構造から HECT 型と RING 型に大別できる(Fig. 1).HECT 型 E3 は E2-ユ ビキチンからチオエステル結合によりユビキチンを受け取 り,基質に受け渡す酵素である.この場合には,E2 が連結 酵素(リガーゼ)となる.RING 型 E3 は E2- ユビキチンと 基質を同時に物理的に会合して,ユビキチンの受け渡しを 支援するプラットフォーム的役割を担っていることになる. この場合にイソペプチド結合を触媒する酵素は E2 となり, このときの RING-finger 構造などの触媒部位は,E2- ユビキ チンと相互作用するドメインを指すことになる4).さらに ユビキチンポリマーの形成を促進する酵素として E4(多く は U-box 型 E3 ドメインを有する)という概念も提案され ているが,多くの場合 E3 単独の作用でユビキチンポリマー が形成される. 興味深いことにユビキチン化反応は,リン酸化/脱リン 酸化に見られる修飾反応のように可逆的であり,細胞内に は,多数の脱ユビキチン酵素(deubiquitylating enzyme: DUB)あるいは USP(ubiquitin specific protease)が存在し,
大きな遺伝子ファミリーを形成している.これらは,少数 の UCH(ubiquitin-C-terminal hydrolase)型と多数の UBP (ubiquitin-specific processing protease)型に類別されてい る.UCH は,ユビキチン前駆体をプロセシングして成熟型 分子に転換する酵素であり,UBP はユビキチン化修飾され たタンパク質からユビキチンを解離させる酵素であるが, UBPが UCH 活性を併有している場合もある.ヒトゲノム には,約 80 種を越える DUB がコードされている.多数の DUBが存在することは,ユビキチンが再利用されることの みならずユビキチン化による翻訳後修飾が可逆的であるこ とを示唆している. 3.プロテアソームとは? 26Sプロテアソームは真核生物の ATP 依存性プロテアー ゼであり,触媒ユニットである 20S プロテアソーム(CP: core particle)の両端に調節ユニットである PA700(RP: regulatory particle)が会合した分子量 2.5 MDa の巨大な多 成分複合体である(Fig. 2)4).20S プロテアソームは α リ ングと β リング(各々7 種のサブユニットから構成)が αββα の順で会合した 750 kDa の円筒型粒子である.20S プロテ アソームはカスパーゼ型(β1),トリプシン型(β2),キモ トリプシン型(β5)の触媒活性,すなわち酸性,塩基性, 疎水性アミノ酸のいずれからも切断できる活性サブユニッ トを 2 個ずつ保有している.これらの 3 種の β 型サブユニッ トはいずれもスレオニンプロテアーゼであり,立体構造解 析からこれらの活性中心は β リングの内表面に露出してい
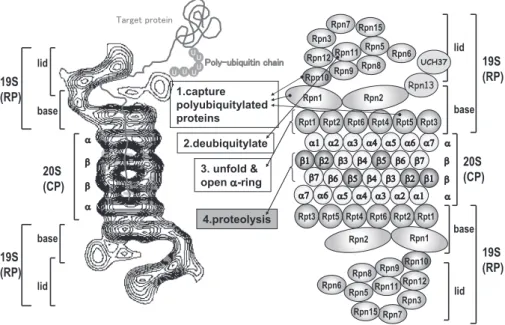
Fig. 2. Molecular organization of the 26S proteasome.
Left panel: Averaged image of the 26S proteasome complex based on electron micrographs. The α and β rings of the 20S proteasome are indicated. Photograph kindly provided by W. Baumeister. Right panel: Schematic drawing of the subunit structure. Ub, ubiquitin. CP; core particle (alias 20S proteasome); RP, 19S regulatory particle consisting of the base and lid subcomplexes; Rpn, RP non-ATPase; Rpt, RP triple-ATPase.
生物物理化学 2007 ; 51 : 86
ることが判明している.通常,20S プロテアソームの α リ ングは閉じているために,この触媒粒子は不活性型として 細胞内に存在している.PA700 は lid(蓋部)と base(基底 部)から構成されており,lid はユビキチン化タンパク質を 識別して捕捉する機能,base は 20S プロテアソームの α リ ングと結合してその中央部のゲートを開き,基質タンパク 質の通過を可能にさせる機能を有している.また 6 種の AAA 型 ATPase を含む base は,ATP の加水分解エネルギーを利 用してタンパク質の 3 次元構造を破壊(アンフォールディ ング)し,基質が α リングを通って β リングの内部に到達 できるようにするシャペロン機能を担っている. 26Sプロテアソームにおける PA700 の主要な役割をとし ては,ポリユビキチン鎖を結合できる Rpn10 サブユニット が存在して,標的タンパク質を捕捉していることが挙げら れる.実際我々は,Rpn10 欠損マウスが胎生致死になるこ とを突き止めると共にこの役割にポリユビキチン鎖との相 互作用ドメイン(UIM モチーフ)が必須であることを明ら かにした(濱崎ら,投稿中).また Rpn11 サブユニットは DUB活性を持ったメタロプロテアーゼ(JAMM 型酵素)で ある.さらに哺乳動物のプロテアソームには UCH37 と USP14/UBP6の二種の DUB(システインプロテアーゼ)が 会合している.ごく最近我々は,UCH37 が Rpn13 を介し て 26S プロテアソームの Rpn2 に会合していることを突き 止めた(Fig. 2 参照)5).Rpn11 はタンパク質に結合したポ リユビキチン鎖を根本から切断してポリユビキチン鎖を遊 離させるが,Uch37 と USP14 は遊離のポリユビキチン鎖に 作用しその末端からユビキチンを解離させる活性を有して いる. プロテアソーム研究の最新の話題は,この多成分複合体を 形成する分子集合機構の研究が著しく進展したことである. 哺乳動物 20S プロテアソームの分子集合機構においては, 我々がごく最近発見した Proteasome Assembling Chaperone (PAC)1–3 が中心的な働きを担っている.PAC1/2 はヘテ ロダイマーとして α リングの形成を支援し6),PAC3 はホ モダイマーとして α リングから β リングに至る過程での チェックポイント的な役割を担っている7).このように PAC1/2と PAC3/3 は α リングの分子集合に必須であり,こ れらの分子を欠損・低減させると α/β サブユニットの異常 な凝集体(α リングのダイマー:off-pathway 経路)を形成 するようになる.興味深いことに β サブユニット 7 種の中 の 5 種(β1, 2, 5, 6, 7)は前駆体タンパク質として生合成さ れる.これらの前駆体領域(プロペプチド)は,β1, 2, 5 の 触媒サブユニットの場合,不活性型に保つ役割(ランダム な破壊の阻止)があるが,その他に分子シャペロンとして β サブユニット群が逐次的に α リングへ会合するプロセスを 支援する働きを示すことが明らかとなりつつある4).これ ら PAC1-3 の作用とプロペプチドシャペロン作用で形成さ れたハーフ(half)- プロテアソーム(ワンコピーの α リン グとワンコピーの β リングから構成された複合体)は,も う一つのシャペロン分子である Ump18)の支援を受けて二 量体化するが,この過程でプロぺプチドが自己消化によっ て取り除かれると共に会合している PAC1/2 と Ump1 は分 解される(PAC3 は half- プロテアソームが形成される段階 で,解離し再利用される).実際,PAC1/2 と Ump1 は不安 定で短寿命(1 時間以内)であるが,PAC3 は安定なタンパ ク質である.このようにして成熟型 20S プロテアソームが 形成される機構を我々はシャペロン支援型逐次的多段階分 子集合モデル(Chaperone-assisted Multi-step Sequential Assembling Model)と呼ぶことを提唱している7). 4.オートファジーとは? オートファジー(自食作用)は,細胞外環境に応答して 出現した隔離膜が伸長して細胞質成分をランダムに取り囲 んだ脂質二重膜構造体(オートファゴソーム)が形成され る過程と,オートファゴソームにリソソーム(多数の加水 分解酵素を含むオルガネラでプロテアソームと並ぶ主要な 細胞内タンパク質分解装置)が融合して内容物を消化する 過程から構成されている(Fig. 3).即ち,オートファジー は,細胞質成分を非選択的に消化することができる真核生 物に保存されたタンパク質分解システムである.その研究 の歴史は古く 1955 年リソソームが発見された後の数年後 にオートファジーという用語が登場している.その後の研 究は,飢餓応答やホルモン制御を主とするもので,培養細 胞や肝還流装置を用いた研究であった.この半世紀におけ るオートファジー研究のほとんどは電子顕微鏡を用いた形 態学的観察に基づいて進められてきた.しかし近年,オー トファジーが不能になる約 16 種の酵母変異株が分離され, その原因となる遺伝子群が発見されると,状況は一変,オー トファジー研究は分子生物学的手法を動員して爆発的に進 展した9).これらの Atg(autophagy: auto =自己,phagy = 食べる)遺伝子群は全て非必須であったが,驚いたことに, それらの遺伝子群の約半分は,ユビキチンシステムと極め て類似した二つのタンパク質共有結合システムを構成して いた.Atg12 タンパク質結合システムと Atg8 タンパク質結 合システムである.Atg12 は E1(活性化酵素)様酵素 Atg7 で活性化され,E2(結合酵素)様酵素 Atg10 の作用により 標的分子 Atg5 にイソペプチド結合し,Atg8 は同じ Atg7 で 活性化された後,E2 様酵素 Atg3 の作用によりリン脂質に 共有結合した.これら二つの翻訳後修飾システムは,オー トファゴソームの形成に必須であり,酵母からヒトに至る 真核生物に普遍的に保存されている. 5.タンパク質分解の破綻と疾病 ユビキチン・プロテアソームシステム(UPS)は選択的
なタンパク質分解を実行することによって,細胞周期・ア ポトーシス・代謝調節・免疫応答・シグナル伝達・転写制 御・品質管理・ストレス応答・DNA 修復など生命科学の様々 な領域で中心的な役割を果たしている.近年とくに注目さ れているのは,21 世紀の高齢化社会を迎えて急増しつつあ る神経変性疾患(アルツハイマー病,パーキンソン病,ポ リグルタミン病,筋萎縮性側索硬化症,プリオン病等)が, UPSの破綻によって発症する可能性が明示されてきたこと である.この仮説は,これらの神経変性疾患の患者脳の残 存したニューロンにユビキチン抗体陽性の凝集体(封入体) が累積しているという多くの病理組織学的所見が根拠と なっていた.すなわち,これらの封入体はニューロン内に 生じた構造的に異常なタンパク質を適切に処理できなかっ たために生じたと推定されたのである.この仮説は,プロ テアソームの阻害剤で細胞を処理すると,ユビキチンを含 んだ封入体が蓄積することや易変性の性質をもった神経変 性疾患の原因遺伝子産物を過剰発現させると,プロテアソー ム活性が減弱,その結果としてアグレゾームと呼称される タンパク質の凝集体が蓄積することからも強く示唆されて きた10).決定的な出来事は,常染色体劣性若年性パーキン ソニスム(autosomalsomal recessive juvenile parkinsonisum: AR-JP)の原因遺伝子産物である Parkin がユビキチンリガー ゼであったことであり,この発見は神経変性疾患の発症機 構にユビキチン代謝系が関与していることを初めて直接的 に証明したことで世界に衝撃を与えた11).そして AR-JP は 常染色体劣性であることから,この病気が機能喪失(loss-of-function)で発症することは明確であり,Parkin の機能解 明がパーキンソン病の発症機構解明に大きなブレイクス ルーをもたらしたのである.即ち Parkin が E3 であること から,AR-JP ではユビキチン依存性のタンパク質分解機構 の破綻による異常タンパク質の蓄積がドーパミンニューロ ンの変性を引き起こすと推測された.これらの研究から, 現在,細胞内タンパク質の品質管理における UPS の重要性 は決定的となり,神経変性研究の中心的課題として国内外 で大きな関心を集めている. 他方,一般にオートファジーは栄養飢餓に陥った細胞に おいて激しく誘導されるバルク(大雑把)なタンパク質分 解経路であると考えられていたが,我々は条件的にオート ファジーが不能となるマウスを作製し,肝細胞やニューロ ンでオートファジーを欠損させると,栄養が十分に供給さ れている状態であってもタンパク質の凝集が大量に蓄積し 封入体を形成することを見出した12, 13).この基底レベルの オートファジーを我々は恒常的オートファジーと呼んでい る14).最近,この恒常的オートファジーが抗原提示(獲得 免疫)や細胞内に侵入してきた細菌の破壊(自然免疫)な どにおいて重要な役割を果たしていることが判明してきた (Fig. 3 参照).さらに我々は恒常的オートファジーの生理 的役割を個体レベルで解明するために,マウスを用いた遺 伝学的解析を進めた.例えば,中枢神経系特異的にオート ファジーを欠損させた変異マウスは,反射異常,協調運動 障害などの神経変性疾患様症状を示し,大脳皮質,海馬, 小脳顆粒層において激しい神経細胞死が誘導された13).こ の結果我々は,オートファジーの障害によって神経変性疾 患が発症することを世界で最初に証明した.さらにユビキ チン抗体を用いた免疫組織染色による観察から,変異マウ スにおいて大脳皮質・視床下部・海馬・扁桃体・橋・小脳
Fig. 3. Schematic representation of the physiological functions of autophagy.
Autophagy is induced in response to emergency states such as nutrient-starvation or bacterial infection, which results in the degradation of cytoplasmic components for amino acid supply (non-selective process) and the removal of bacteria that invade the cytoplasm ((non-selective process). Autophagy also contributes to processing viral proteins such as EBNA1 and certain cytosolic pro-teins (e.g., tumor antigens) for presentation onto major histocompatibility complex (MHC) class II molecules. Autophagy also occurs constitutively even under a nutrient-rich state and contrib-utes to global turnover of cellular components. It is an essential cellular process that maintains homeostasis in quiescent cells (e.g., hepatocytes and neurons).
生物物理化学 2007 ; 51 : 88 など広範囲のニューロンにおいてユビキチン抗体陽性の封 入体の出現が観察された.一方,オートファジーを欠損さ せたニューロンにおいてプロテアソームの質的・量的な異 常は,全く発生していないことが判明した.これらの研究 から,長い間プロテアソームのための分解シグナルと考え られてきたユビキチンが,オートファゴソームの中にタン パク質を取り込むための指標としても働いていること,即 ち,ユビキチン化タンパク質がプロテアソームとオートファ ジーの二つの経路で協調的に処理されることが示唆された (Fig. 4).オートファジーはその発見以来今日に至るまで常 に非選択なタンパク質分解に寄与すると考えられてきたが, これらの観察からオートファジーが選択タンパク質分解を も司ることが明確になってきた. 本研究の成果を神経変性疾患との関連で考えると,これ まで多くの家族性神経変性疾患で,責任遺伝子産物の異常 凝集がニューロン死の引き金になることが報告されてきた. 例えば,アルツハイマー病における tau タンパク質,パー キンソン病における α シヌクレイン,ハンチントン舞踏病 におけるハンチンチン,そして筋萎縮性側索硬化症におけ るスパーオキサイドディスムターゼ(SOD1)等である.し かし,これらのタンパク質の変異による異常構造,ひいて は凝集体の形成がなくても,オートファジーというタンパ ク質分解系の機能喪失のみによって神経変性が誘導される ことは,画期的な発見であった.即ち,弧発性の神経変性 疾患の発症にオートファジーが関与している可能性が示唆 されたのである.これらの結果は,オートファジーを誘導 する薬剤の開発が神経変性疾患の予防・治療に有効となる 可能性を示唆しており,今回の成果は,様々な神経変性疾 患の病態発症の原因解明に関する研究に大きく貢献するこ とが期待できる14). 6.おわりに 本稿で解説してきたようにユビキチンはプロテアソーム のみならずオートファジーを介したリソソームによるタン パク質分解においても必須な役割を果たしていることが明 確になった.近年,ユビキチンリガーゼや脱ユビキチン酵 素酵素を原因とするヒトの病気(遺伝性疾患)は,拡大の 一途を辿っている.また様々な疾患でオートファジーの破 綻を示唆する形態的な観察が急増している.そしてリソソー ムによる代謝異常を成因とする疾病,即ちリソソーム病は 数多く報告されている.さらに最近,PS-341/bortezomib(商 品名 Velcade)が,抗ガン剤として多発性骨髄腫などの治 療に有効であることが判明し,臨床的に大きな注目を浴び ている.このようにタンパク質分解の研究は,生命の謎に 迫るという新しい科学のフレームシフトに重要であるばか りでなく,病気の解明・治療・予防における病態医科学的 な見地からも重要であると思われる. 文 献 1) 田中啓二.ユビキチン発見からプロテアソームへ・小さ なタンパク質の大きな功績(特別インタビュー:2004 ノーベル化学賞のテーマ).実験医学 2005;23:290–297. 2) 田中啓二,大隅良典(編):ユビキチン・プロテアソー ム系とオートファジー:作動機構と病態生理.蛋白質核 酸酵素(Vol. 51, No. 10).共立出版,2006. 3) 田中啓二(編):ユビキチンがわかる(わかる実験医学 シリーズ).羊土社,2004.
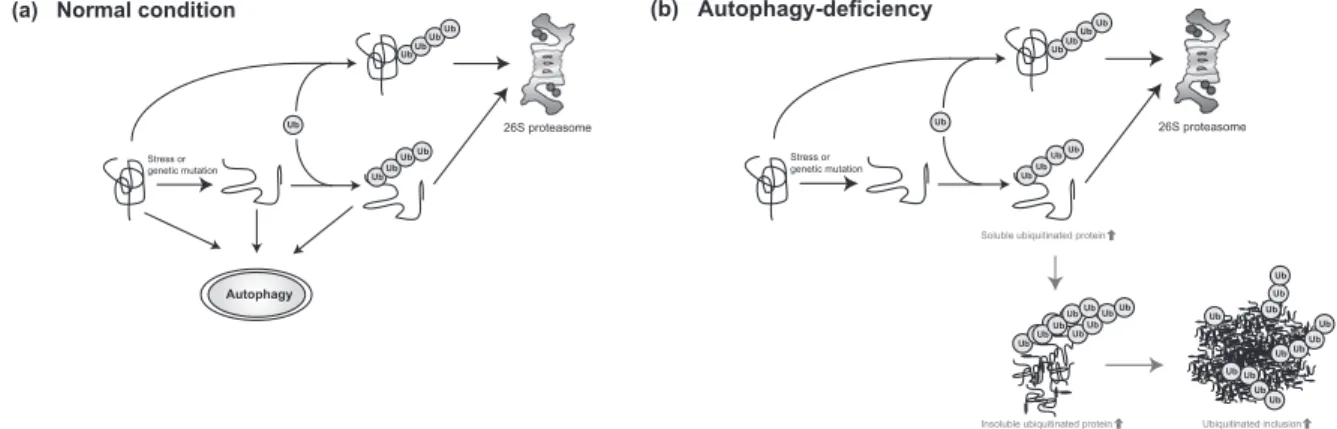
Fig. 4. A schematic diagram of protein destruction pathways mediated by the proteasome and autophagy.
The majority of cellular proteins, if not all, are polyubiquitylated prior to hydrolysis by the proteasome (an ATP-dependent proteolytic complex). Similarly, unfolded/misfolded proteins generated by environmental stresses or genetic mutations are discarded after polyubiquitination by the same proteolytic system (panel a). Aging-related decline in autophagic activity causes accumulation of highly ubiquitylated proteins, which are recovered as both soluble and insoluble forms (panel b). Since autophagy could feed both ubiquitylated and unubiquitylated protein(s), it is not clear at present whether polyubiqui-tylated aggregates/inclusions in autophagy-deficient neurons are formed consequent to impairment of degradation of unu-biquitylated proteins or aggressively polyuunu-biquitylated proteins. In addition, further work is needed to determine whether the two proteolytic systems (autophagy and proteasomes) work independently or cooperatively, and whether autophagy and the proteasome feed a similar set of normal and/or misfolded/unfolded proteins in general. Ub: ubiquitin.
S. Cooperation of multiple chaperones required for the assembly of mammalian 20S proteasomes. Mol Cell 2006;24:977–984.
8) Ramos PC, Hockendorff J, Johnson ES, Varshavsky A, Dohmen RJ. Ump1p is required for proper maturation of the 20S proteasome and becomes its substrate upon com-pletion of the assembly. Cell 1998;92:489–499.
9) Ohsumi Y. Molecular dissection of autophagy: two
ubiq-T, Koike M, Uchiyama Y, Kominami E, Tanaka K. Loss of autophagy in the central nervous system causes neurode-generation. Nature 2006;441:880–884.
14) Komatsu M, Ueno T, Waguri S, Uchiyama Y, Kominami E, Tanaka K. Constitutive autophagy: Vital role in clear-ance of unfavorable proteins in neurons. Cell Death and Differ 2007;14:887–894.