2.7.4.1 医薬品への曝露
2.7.4.1.1 総括的安全性評価計画及び安全性試験の記述
本剤の安全性に関する臨床データパッケージを表
2.7.4.1.1 に示す.
本剤の安全性に関する臨床データパッケージは,国内で実施した健常成人を対象とした
6 試
験及び慢性疼痛疾患(RA,OA,腰痛症,肩関節周囲炎,頸肩腕症候群及び腱・腱鞘炎)の患
者を対象とした
12 試験のデータに,外国で実施した特別な集団(慢性腎障害,肝障害,高齢者)
における薬物動態試験,薬物相互作用試験等を含む
26 試験及び RA 及び OA に対する長期投与
試験
1 試験のデータを加えて構成されている.
本臨床的安全性の概要では,国内で実施した慢性疼痛疾患患者を対象とした
12 試験の安全性併
合解析の結果及び
RA 及び OA に対する長期投与試験[024](外国)の結果を中心に記述する.
国内及び外国における薬物動態試験の安全性の成績は
2.7.4.5.9 国内健常成人試験及び 2.7.6
個々の試験のまとめに記載した.
表
2.7.4.1.1 本剤の安全性に関する臨床データパッケージ
分類
地域
試験
数
内容
試験番号
日本
6
健常成人対象第Ⅰ相試験
及び薬物動態試験
[400][401]
[AKi1][AKi2][AKi3][AKi4]
9
第Ⅰ相試験及び
薬物動態試験
[001][003][032][006][037]
[018][044][084][019]
3
特別な患者集団PK試験
[016][036][015]
P-Ⅰ及び
薬物動態試験
外国
14
薬物相互作用試験
[072][038][040][050][039]
[051][017][095][109][114]
[116][117][135][171]
RA
日本 4
初期第Ⅱ相試験(パイロット試験)
後期第Ⅱ相試験(プラセボ対照用量反応試験)
第Ⅲ相試験(実薬対照比較試験)
長期投与試験
[RPi1]
[RDS1]
[RCT1]
[RLN3]
OA
日本
4
初期第Ⅱ相試験(パイロット試験)
後期第Ⅱ相試験(プラセボ対照用量反応試験)
第Ⅲ相試験(実薬及びプラセボ対照比較試験)
長期投与試験
[
OPi1]
[
ODS1]
[
216]
[
OLN2]
腰痛症
日本 1 第Ⅲ相試験(実薬対照比較試験)
[217]
肩関節周囲炎
日本 1 一般臨床試験
[POP1]
頸肩腕症候群
日本 1 一般臨床試験
[COP1]
腱・腱鞘炎
日本
1 一般臨床試験
[
TOP1]
慢
性
疼
痛
疾
患
対
象
試
験
長期投与
安全性
外国 1
RA及びOAに対する長期投与試験
(継続長期投与)
[024]
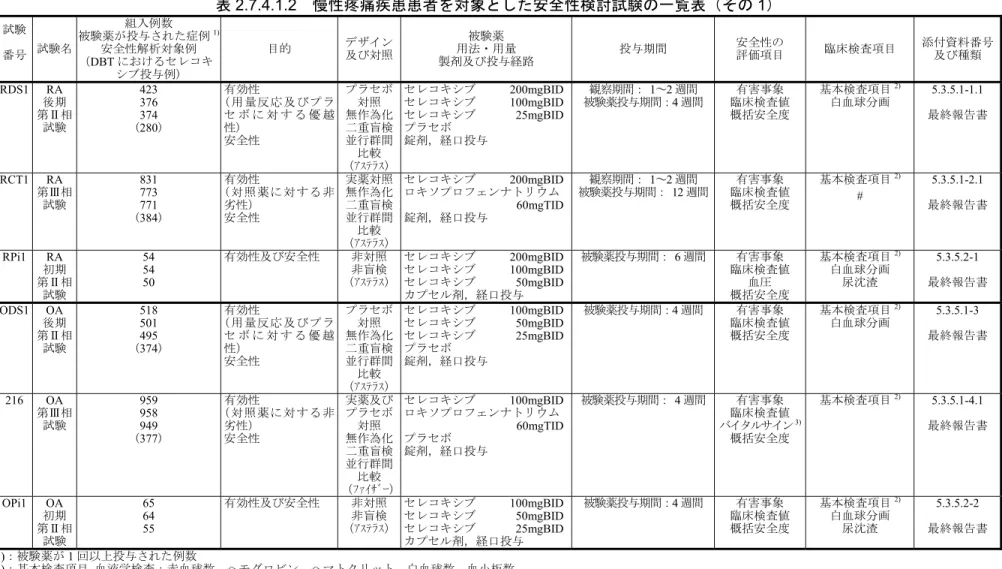
国内及び外国で実施された慢性疼痛疾患患者を対象とした安全性検討試験の一覧を表
2.7.4.1.2 に示す.
慢性疼痛疾患患者を対象とした臨床試験は,国内で実施した
RA に対する短期投与試験 3 試
験,OA に対する短期投与試験 3 試験,腰痛症,肩関節周囲炎,頸肩腕症候群及び腱・腱鞘炎
に対する短期投与試験
4 試験,RA 及び OA に対する長期投与試験 2 試験の合計 12 試験に,外
国で実施した
RA 及び OA に対する長期投与試験 1 試験を加えた 13 試験である.
表
2.7.4.1.2 慢性疼痛疾患患者を対象とした安全性検討試験の一覧表(その 1)
試験 番号 試験名 組入例数 被験薬が投与された症例1) 安全性解析対象例 (DBT におけるセレコキ シブ投与例) 目的 デザイン及び対照 用法・用量 被験薬 製剤及び投与経路 投与期間 安全性の 評価項目 臨床検査項目 添付資料番号 及び種類 RDS1 RA 後期 第Ⅱ相 試験 423 376 374 (280) 有効性 (用量反応及びプラ セ ボ に 対 す る 優 越 性) 安全性 プラセボ 対照 無作為化 二重盲検 並行群間 比較 (アステラス) セレコキシブ 200mgBID セレコキシブ 100mgBID セレコキシブ 25mgBID プラセボ 錠剤,経口投与 観察期間: 1~2 週間 被験薬投与期間:4 週間 臨床検査値 有害事象 概括安全度 基本検査項目2) 白血球分画 5.3.5.1-1.1 最終報告書 RCT1 RA 第Ⅲ相 試験 831 773 771 (384) 有効性 (対照薬に対する非 劣性) 安全性 実薬対照 無作為化 二重盲検 並行群間 比較 (アステラス) セレコキシブ 200mgBID ロキソプロフェンナトリウム 60mgTID 錠剤,経口投与 観察期間: 1~2 週間 被験薬投与期間: 12 週間 臨床検査値 有害事象 概括安全度 基本検査項目2) # 5.3.5.1-2.1 最終報告書 RPi1 RA 初期 第Ⅱ相 試験 54 54 50 有効性及び安全性 非対照 非盲検 (アステラス) セレコキシブ 200mgBID セレコキシブ 100mgBID セレコキシブ 50mgBID カプセル剤,経口投与 被験薬投与期間: 6 週間 有害事象 臨床検査値 血圧 概括安全度 基本検査項目2) 白血球分画 尿沈渣 5.3.5.2-1 最終報告書 ODS1 OA 後期 第Ⅱ相 試験 518 501 495 (374) 有効性 (用量反応及びプラ セ ボ に 対 す る 優 越 性) 安全性 プラセボ 対照 無作為化 二重盲検 並行群間 比較 (アステラス) セレコキシブ 100mgBID セレコキシブ 50mgBID セレコキシブ 25mgBID プラセボ 錠剤,経口投与 被験薬投与期間:4 週間 有害事象 臨床検査値 概括安全度 基本検査項目2) 白血球分画 5.3.5.1-3 最終報告書 216 OA 第Ⅲ相 試験 959 958 949 (377) 有効性 (対照薬に対する非 劣性) 安全性 実薬及び プラセボ 対照 無作為化 二重盲検 並行群間 比較 (ファイザー) セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID プラセボ 錠剤,経口投与 被験薬投与期間: 4 週間 有害事象 臨床検査値 バイタルサイン3) 概括安全度 基本検査項目2) 5.3.5.1-4.1 最終報告書 OPi1 OA 初期 第Ⅱ相 試験 65 64 55 有効性及び安全性 非対照 非盲検 (アステラス) セレコキシブ 100mgBID セレコキシブ 50mgBID セレコキシブ 25mgBID カプセル剤,経口投与 被験薬投与期間:4 週間 有害事象 臨床検査値 概括安全度 基本検査項目2) 白血球分画 尿沈渣 5.3.5.2-2 最終報告書 1):被験薬が 1 回以上投与された例数 2):基本検査項目 血液学検査;赤血球数,ヘモグロビン,ヘマトクリット,白血球数,血小板数血液生化学検査;総蛋白,総ビリルビン,A/G*,GOT,GPT,Al-P,LDH*,γ-GTP,CPK,総コレステロール*,BUN,クレアチニン,Na,K,Cl,Ca,無機リン
尿検査;蛋白,糖,ウロビリノーゲン*,潜血*,NAG*,β 2-マイクログロブリン*,尿クレアチニン(NAG,β2-マイクログロブリンの補正のために随時尿にて測定)* その他;便潜血*(*:RA 及び OA に対する長期投与試験[024](外国)では未実施) 3):バイタルサイン;血圧,脈拍,体重,体温*,呼吸数(*:RA 及び OA に対する長期投与試験[024](外国)では未実施) #:患者背景データとして,抗ヘリコバクターピロリ IgG 抗体価を測定
29
- -
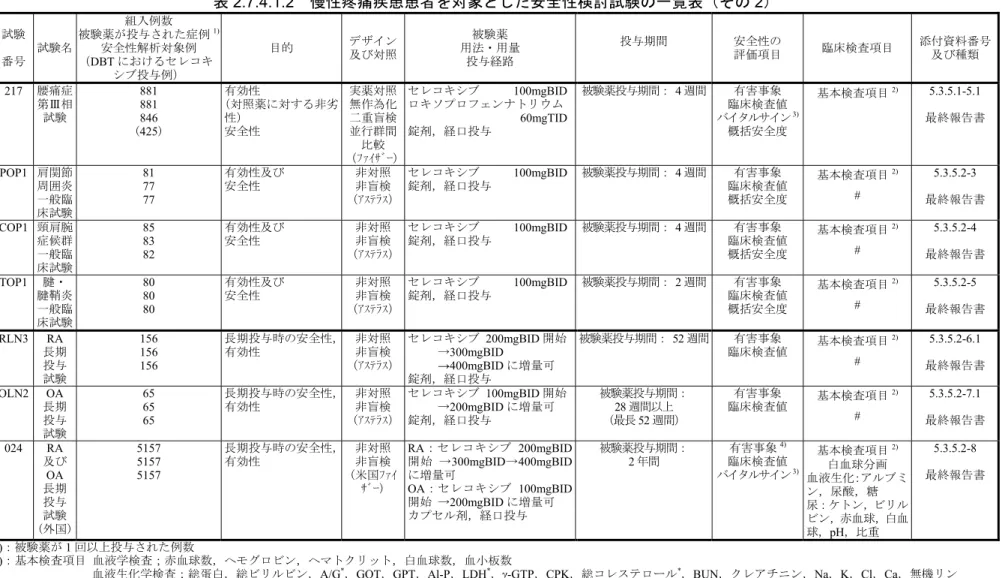
表
2.7.4.1.2 慢性疼痛疾患患者を対象とした安全性検討試験の一覧表(その 2)
試験 番号 試験名 組入例数 被験薬が投与された症例1) 安全性解析対象例 (DBT におけるセレコキ シブ投与例) 目的 デザイン及び対照 被験薬 用法・用量 投与経路 投与期間 安全性の 評価項目 臨床検査項目 添付資料番号 及び種類 217 腰痛症 第Ⅲ相 試験 881 881 846 (425) 有効性 (対照薬に対する非劣 性) 安全性 実薬対照 無作為化 二重盲検 並行群間 比較 (ファイザー) セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID 錠剤,経口投与 被験薬投与期間: 4 週間 有害事象 臨床検査値 バイタルサイン3) 概括安全度 基本検査項目2) 5.3.5.1-5.1 最終報告書 POP1 肩関節 周囲炎 一般臨 床試験 81 77 77 有効性及び 安全性 非対照 非盲検 (アステラス) セレコキシブ 100mgBID 錠剤,経口投与 被験薬投与期間: 4 週間 有害事象 臨床検査値 概括安全度 基本検査項目2) # 5.3.5.2-3 最終報告書 COP1 頸肩腕 症候群 一般臨 床試験 85 83 82 有効性及び 安全性 非対照 非盲検 (アステラス) セレコキシブ 100mgBID 錠剤,経口投与 被験薬投与期間: 4 週間 臨床検査値 有害事象 概括安全度 基本検査項目2) # 5.3.5.2-4 最終報告書 TOP1 腱・ 腱鞘炎 一般臨 床試験 80 80 80 有効性及び 安全性 非対照 非盲検 (アステラス) セレコキシブ 100mgBID 錠剤,経口投与 被験薬投与期間: 2 週間 臨床検査値 有害事象 概括安全度 基本検査項目2) # 5.3.5.2-5 最終報告書 RLN3 RA 長期 投与 試験 156 156 156 長期投与時の安全性, 有効性 非対照 非盲検 (アステラス) セレコキシブ 200mgBID 開始 →300mgBID →400mgBID に増量可 錠剤,経口投与 被験薬投与期間: 52 週間 有害事象 臨床検査値 基本検査項目 2) # 5.3.5.2-6.1 最終報告書 OLN2 OA 長期 投与 試験 65 65 65 長期投与時の安全性, 有効性 非対照 非盲検 (アステラス) セレコキシブ 100mgBID 開始 →200mgBID に増量可 錠剤,経口投与 被験薬投与期間: 28 週間以上 (最長52 週間) 有害事象 臨床検査値 基本検査項目 2) # 5.3.5.2-7.1 最終報告書 024 RA 及び 5157 5157 長期投与時の安全性, 有効性 非対照 非盲検 RA:セレコキシブ 200mgBID 開始 →300mgBID→400mgBID 被験薬投与期間: 2 年間 有害事象4) 臨床検査値 基本検査項目 2) 5.3.5.2-830
- -
2.7.4.1.1.1 臨床的安全性の評価方法
2.7.4.1.1.1.1 有害事象
被験薬が投与された被験者に生じるあらゆる好ましくない医療上の事象のうち,症状及び身
体徴候を有害事象と定義し,重症度,被験薬との関連性等の情報を収集した.ただし,いずれ
の試験においても,原疾患(対象疾患)の悪化については有害事象とはせず,有効性の評価に
おいて取り扱うこととした.
有害事象は,国際医薬品モニター制度で使用されている
WHO Adverse Reaction Terminology
(WHO ART)の基本語及び器官別大分類を用いて分類した.
2.7.4.1.1.1.2 重篤な有害事象
重篤な有害事象は「治験中に得られる安全性情報の取り扱いについて」(平成
7 年 3 月 20 日
薬審第
227 号)に従い,以下のように定義した.
・死に至るもの(死亡)
・生命を脅かすもの(生命)
・治療のため入院又は入院期間の延長が必要となるもの(入院)
・永続的又は顕著な障害・機能不全に陥いるもの(永続)
・先天異常を来すもの(先天)
・その他の医学的に重要な状態
※(その他)
※「副作用の重篤度分類基準」
(平成
4 年 6 月 29 日 薬安第 80 号)のグレード 3 を参
考に治験責任医師,治験分担医師が重篤な有害事象と判断したもの
被験薬投与期間中の重篤な有害事象に加え,第Ⅲ相試験以降の
8 試験([RCT1][RLN3][216]
[OLN2][217][POP1][COP1][TOP1])では,被験薬投与終了 14 日後([216]及び[217]では被
験薬投与終了
28 日後)までに発現した重篤な有害事象について調査した.これ以外の国内で
実施した試験では,被験薬投与終了後の重篤な有害事象の調査は実施しなかった.
2.7.4.1.1.1.3 臨床検査
国内で実施した
12 試験では,血液学検査(赤血球数,ヘモグロビン,ヘマトクリット,白血
球数,白血球分画,血小板数),血液生化学検査(総蛋白,A/G,総ビリルビン,GOT,GPT,
Al-P,LDH,γ-GTP,CPK,BUN,クレアチニン,総コレステロール,Na,K,Cl,Ca,無機リ
ン)及び尿・便検査(蛋白,糖,ウロビリノーゲン,潜血,NAG,β
2-マイクログロブリン,尿
沈渣,尿クレアチニン,便潜血)を行った.白血球分画(好中球,リンパ球,単球,好酸球,
好塩基球)は,RA 及び OA に対する初期及び後期第Ⅱ相試験のみで,尿沈渣は RA 及び OA に
対する初期第Ⅱ相試験のみで実施した.尿クレアチニンは,NAG,β
2-マイクログロブリンの補
正のために随時尿にて測定した.臨床検査は,
RA 及び OA に対する初期第Ⅱ相試験 2 試験を除
き,原則として
において集中測定を実施した.治験実施医療
機関で一部行われた臨床検査結果は,集中測定の結果と合わせて解析を行った.
RA 及び OA に
対する長期投与試験[
024](外国)の臨床検査は,全例を集中測定にて行った.
臨床検査値異常変動は,被験薬投与前後の推移から臨床的に有意に変動したものについて,
治験担当医師が異常変動の有無及び被験薬との関連性を判断した.
2.7.4.1.1.1.4 バイタルサイン
RA に対する初期第Ⅱ相試験[RPi1],OA に対する第Ⅲ相試験[216],腰痛症に対する第Ⅲ
相試験[
217]及び RA 及び OA に対する長期投与試験[024]
(外国)の
4 試験でバイタルサイ
ンを測定した.
RA に対する初期第Ⅱ相試験[RPi1]は血圧を,OA に対する第Ⅲ相試験[216]
及び腰痛症に対する第Ⅲ相試験[
217]では,血圧,脈拍,体重,体温及び呼吸数を,RA 及び
OA に対する長期投与試験[024](外国)では,血圧,脈拍,体重及び呼吸数を測定した.
2.7.4.1.1.2 臨床的安全性の解析
2.7.4.1.1.2.1 安全性の解析対象集団
国内及び外国の安全性検討試験において被験薬が投与された症例数を表
2.7.4.1.3 及び表
2.7.4.1.4 に示す.
国内で実施した
12 試験に組み入れられた被験者数は 4198 例であり,そのうち被験薬が 1 回
以上投与された被験者数は
4068 例(本剤 2440 例,プラセボ 415 例及びロキソプロフェンナト
リウム
1213 例)であった.
RA 及び OA に対する長期投与試験[024](外国)に組み入れられた被験者数は 5157 例であ
り,全例に本剤が投与された.
表
2.7.4.1.3 国内の安全性検討試験において被験薬が投与された症例数
セレコキシブ
対象疾患
試験名
投与
期間
1)プラ
セボ
25mg
BID
50mg
BID
100mg
BID
200mg
BID
合計
ロキソ
プロフェン
ナトリウム
合計
RA
初期第Ⅱ相試験[RPi1] 6 週
- - 19 17 18 54 - 54
後期第Ⅱ相試験[RDS1] 4 週
96 99 - 89 92
280 - 376
第Ⅲ相試験[
RCT1] 12 週
- - - -
384
384
389
773
OA
初期第Ⅱ相試験[OPi1] 4 週
- 22 24 18 - 64 - 64
後期第Ⅱ相試験[
ODS1] 4 週
127 130 126 118 - 374 - 501
第Ⅲ相試験[
216]
4 週
192 - - 382 - 382
384
958
腰痛症
第Ⅲ相試験[
217]
4 週
- - -
441
-
441
440
881
肩関節周囲炎 一般臨床試験[POP1] 4 週
- - - 77 - 77 - 77
頸肩腕症候群 一般臨床試験[COP1] 4 週
- - - 83 - 83 - 83
腱・腱鞘炎
一般臨床試験[
TOP1] 2 週
- - - 80 - 80 - 80
短期試験合計
415 251 169 1305
494 2219 1213 3847
RA(長期)
長期投与試験[
RLN3] 52 週
- - - -
(
156
45)
156 - 156
OA(長期)
長期投与試験[
OLN2]
28~
52 週
- - -
(10)
65
- 65 - 65
長期投与試験合計
- - -
(10)
65
(45)
156
221 - 221
合計
415 251 169 1370
650 2440 1213 4068
1):治験実施計画書で規定された投与期間 ( )は用量変更のあった症例数表
2.7.4.1.4 外国の安全性検討試験において被験薬が投与された症例数
セレコキシブ
対象疾患
試験名
投与
期間
1)OA
100mgBID
RA
200mgBID
合計
RA 又は OA
長期投与試験
[024]
2 年
2920
(2353)
2237
(1854)
5157
(4207)
1):治験実施計画書で規定された投与期間 ( )は用量変更のあった症例数本臨床的安全性の概要における安全性の解析には,各試験の安全性解析対象例を用いた.国
内の安全性検討試験における安全性解析対象例数を表
2.7.4.1.5 に示す.
国内の安全性検討試験における安全性解析対象例は,被験薬が
1 回以上投与された 4068 例(本
剤
2440 例,プラセボ 415 例及びロキソプロフェンナトリウム 1213 例)から,安全性評価除外
例
68 例(本剤 42 例,ロキソプロフェンナトリウム 23 例及びプラセボ 3 例)を除いた 4000 例
(本剤
2398 例,プラセボ 412 例及びロキソプロフェンナトリウム 1190 例)であった.
国内の試験における安全性評価除外例の除外理由を表
2.7.4.1.6 に示す.
除外された
68 例のうち 45 例に有害事象又は臨床検査値異常変動が認められた.これらの症
例は,症例報告書の記載データの一部が原資料から確認できなかった,同意取得前に治験行為
が実施されたあるいは治験責任医師が陳述後に治験報告書が修正された等の理由により解析完
全除外例とした.前述の
45 例の症例に認められた有害事象及び臨床検査値異常変動を表
2.7.4.1.7 及び付録 表 2.7.4.7.1 に示す.本剤又はロキソプロフェンナトリウムとの関連性が否
定されなかった症例の内訳は,本剤
16 件(左後頭~頭頂部打撲(ベットから転倒),発疹(体
幹部,首筋,四肢),便潜血陽性(+),尿蛋白(+),尿潜血(±),胃痛,下痢,皮疹,尿中 NAG13.3
と高値,β
2MG 尿上昇,顔全体に皮疹伴わないそう痒感,舌のあれ,WBC の減少,ぼんやりす
る,NAG 上昇,β2-マイクログロブリン値上昇),ロキソプロフェンナトリウム 22 件(白血球
減少,眠気,Al-P 上昇,下痢,CPK 上昇,浮腫,眠気,口渇,頸部の掻痒感伴う湿疹様の皮疹
あり,口渇あり,尿中β2MG-尿の上昇,GOT 上昇,GPT 上昇,γ-GTP 上昇,ALP の高値,便潜
血陽性,胃痛,
BUN 上昇,両眼瞼の腫れぼったさ(腫張感),後頭部違和感)であった.なお,
解析完全除外例に認められた重篤な有害事象を表
2.7.4.1.7.1 及び付録 表 2.7.4.7.1.1 に示した.
RA 及び OA に対する長期投与試験[024](外国)については,安全性評価除外例はなく,
本剤を
1 回以上投与されたすべての症例(5157 例)を安全性解析対象例とした.
表
2.7.4.1.5 国内の安全性検討試験における安全性解析対象例数
セレコキシブ
対象疾患
試験名
投与
期間
1)プラ
セボ
25mg
BID
50mg
BID
100mg
BID
200mg
BID
合計
ロキソ
プロフェン
ナトリウム
合計
RA
初期第Ⅱ相試験[RPi1] 6 週
- - 18 17 15 50 - 50
後期第Ⅱ相試験[RDS1] 4 週
95 98 - 89 92
279 - 374
第Ⅲ相試験[
RCT1] 12 週
- - - -
382
382
389
771
OA
初期第Ⅱ相試験[OPi1] 4 週
- 18 19 18 - 55 - 55
後期第Ⅱ相試験[
ODS1] 4 週
125 128 125 117 - 370 - 495
第Ⅲ相試験[
216]
4 週
192 - - 377 - 377
380
949
腰痛症
第Ⅲ相試験[
217]
4 週
- - -
425
-
425
421
846
肩関節周囲炎 一般臨床試験[POP1] 4 週
- - - 77 - 77 - 77
頸肩腕症候群 一般臨床試験[COP1] 4 週
- - - 82 - 82 - 82
腱・腱鞘炎
一般臨床試験[
TOP1] 2 週
- - - 80 - 80 - 80
短期試験合計
412 244 162 1282
489 2177 1190 3779
RA(長期)
長期投与試験[
RLN3] 52 週
- - - -
(
156
45)
156 - 156
OA(長期)
長期投与試験[
OLN2]
28~
52 週
- - -
(10)
65
- 65 - 65
長期投与試験合計
- - -
(10)
65
(45)
156
221 - 221
合計
412 244 162 1347
645 2398 1190 4000
1):治験実施計画書で規定された投与期間 ( )は用量変更のあった症例数表
2.7.4.1.6 安全性評価除外例の除外理由
試験名
試験識別番号
例
数
症例番号
理由
RA 初期第Ⅱ相試験
[RPi1]
4
403,1501,1503,1703
測定日のズレにより臨床検査データが不採用と
なったため
RA 後期第Ⅱ相試
験[RDS1]
2
1031,1034
1)症例報告書の記載データの一部が原資料から確
認できなかったため(完全除外)
RA 第Ⅲ相試験
[
RCT1]
2
2142,2143
別の患者に割り当てられた被験薬を重複して割
り当てたため(完全除外)
3
801,901,903
初回来院以降来院しなかったため(完全除外)
5
402,701,1601,1202,2501
測定日のズレにより臨床検査データが不採用と
なったため
OA 初期第Ⅱ相試
験[
OPi1]
1
1602
臨床検査を実施しなかったため
1
742
治験責任医師,治験分担医師以外が治験を実施し
たため(完全除外)
1
1395
別の患者に割り当てられた被験薬を重複して割
り当てたため(完全除外)
OA 後期第Ⅱ相試
験[ODS1]
4
362,563
1),724
1),793
被験薬投与中止から評価までの日数が離れてお
り,正確な概括安全度の判定が不能であったため
頸肩腕症候群
一般臨床試験
[COP1]
1
1804
被験薬投与開始後に急性リンパ性白血病の合併
が発覚し,被験薬の評価が困難と判断されたため
(完全除外)
1
9906A
2), 3)ベースライン時
Vital check にて BP 160/98 mmHg
と多少高値を示し本人が同意撤回したため
4
9601A
2), A505A
2), A707A,
A808A
治験責任医師の陳述後に症例報告書が修正され
ていたため
2
2013A
2), 3401A
2)同意取得前に治験行為が実施されたため(治験用
X 線を同意取得前に実施)
OA 第Ⅲ相試験
[
216]
3
4919A, 4920A, A605A
同意取得前に治験行為が実施されたため(便潜血
検体を同意取得前に採取)
9
5701L, 5703L
2), 5704L
2),
5705L, 5706L
2), 5707L,
5708L
2), 5709L, 5710L
2)治験カルテを紛失したため
2
21B0L, 5107L
2)治験責任医師の署名がなかったため
15
2102L, 21I2L
2), 21J1L,
2412L
2), 5501L, 6117L, 6203L,
6406L
2), 6501L
2), 6508L
2),
6512L
2), 6515L, 6607L
2),
7620L
2), 9505L
2)治験責任医師の陳述後に症例報告書が修正され
ていたため
1
5205L
治験中止時,未登録医師により
たため
VAS が評価され
5
8903L, 8904L, 8906L, 8907L
2),
8908L
2)署名印影一覧表に署名・印影が記載されていない
医師が治験を実施したため
1
2117L
2)同意取得前に治験行為が実施されたため(同意取
得前に治験実施のため鎮痛剤の投与を中止)
LBP 第Ⅲ相試験
[217]
2
2140L
2), 2167L
同意取得前に治験行為が実施されたため(便潜血
検体を同意取得前に採取)
1):プラセボ群 2):ロキソプロフェンナトリウム群 3):治験薬を投与しなかった.表
2.7.4.1.7 安全性評価除外例に認められた有害事象一覧(その 1)
試験名 試験識別番号 症例 番号 治験薬 投与量 投与 日数1) (日) 症例報告書上の 表記 発現 時期1) (日) 発現 期間1) (日) 程度 被験薬との 関連性 転帰 RA 初期第Ⅱ相試 験[RPi1] 403 セレコキシブ 200mgBID 5 風邪症候群 2~9 7 中等度 関連なし 消失 尿意頻回 -12~28 40 軽度 たぶん関連なし 消失 左肩かゆみ 21~28 7 軽度 たぶん関連なし 消失 咽頭不快 24~28 4 軽度 たぶん関連なし 消失 せき 24~28 4 軽度 たぶん関連なし 消失 RA 後期第Ⅱ相 試験[RDS1] 1031 セレコキシブ 25mgBID 28 左後頭~頭頂部 打撲:ベッドから 転倒 -1~ 不明 不明 軽度 不明 軽快 RA 第Ⅲ相試験 [RCT1] 2142 セレコキシブ 200mgBID 9 発疹(体幹部,首 筋,四肢) 4~41 37 高度 関連あり 消失 OA 初期第Ⅱ相 試験[OPi1] 1602 セレコキシブ 50mgBID 7 胃部不快感 4~6 2 軽度 たぶん関連なし 消失 724 プラセボ 2 感冒症状 2~39 37 中等度 関連なし 消失 793 セレコキシブ 25mgBID 10 膝関節血腫 11 ~不明 不明 中等度 関連なし 軽快 感冒 8~30 22 中等度 関連なし 消失 OA 後期第Ⅱ相 試験[ODS1] 362 セレコキシブ 100mgBID 8 β2-マイクログロ ブリン上昇 - - - 関連なし - 頸肩腕症候群 一般臨床試験 [COP1] 1804 セレコキシブ 100mgBID 2 急性リンパ性白 血病の悪化 0~ - 高度 関連なし 増悪 口内炎 4~13 9 軽度 関連なし 消失 2013A ロキソプロフェンナトリ ウム60mgTID 27 白血球減少 28~43 15 軽度 関連あり 消失 3401A ロキソプロフェンナトリ ウム60mgTID 27 眠気 0~3 3 軽度 関連あり 消失 9601A ロキソプロフェンナトリ ウム60mgTID 28 Al-P 上昇 28~ 120 92 軽度 関連あり 消失 下痢 9~12 3 軽度 関連あり 消失 CPK 上昇 28~73 45 軽度 関連あり 消失 A505A ロキソプロフェンナトリ ウム60mgTID 28 便潜血陽性 26 ~不明 不明 軽度 関連なし - 感冒 14~20 6 軽度 関連なし 消失 A605A セレコキシブ 100mgBID 28 胸やけ 16~17 1 軽度 関連なし 消失 A707A セレコキシブ 100mgBID 28 便潜血異常(+) 30~101 71 軽度 関連あり 消失 尿蛋白(+) 27 ~不明 不明 軽度 関連あり - OA 第Ⅲ相試験 [216] A808A セレコキシブ 100mgBID 27 尿潜血(±) 27 ~不明 不明 軽度 関連あり - 1):治験薬投与開始日を 0 日として計算 表2.7.4.7.1 引用表
2.7.4.1.7 安全性評価除外例に認められた有害事象一覧(その 2)
試験名 試験識別番号 症例 番号 治験薬 投与量 投与 日数1) (日) 症例報告書上の 表記 発現 時期1) (日) 発現 期間1) (日) 程度 被験薬との 関連性 転帰 2102L セレコキシブ 100mgBID 28 かぜ様症状(咳・鼻水) 14~22 8 軽度 関連なし 消失 2117L ロキソプロフェンナトリ ウム60mgTID 28 CPK 上昇 28~57 29 軽度 関連あり 消失 2167L セレコキシブ 100mgBID 28 かぜ様症状(咽頭 痛・鼻水) 25 ~不明 不明 軽度 関連なし - 痔核 1~4 3 中等度 関連なし 消失 軟便 7 ~不明 不明 軽度 関連なし - 口内炎 7 ~不明 不明 軽度 関連なし - 胃痛 26~32 6 軽度 関連あり 消失 21B0L セレコキシブ 100mgBID 28 便潜血陽性化 28 ~不明 不明 軽度 関連なし - 21I2L ロキソプロフェンナトリ ウム60mgTID 7 口内炎 4~14 10 中等度 関連なし 消失 全身に湿疹 9~26 17 中等度 関連なし 消失 21J1L セレコキシブ 100mgBID 28 下痢 25 ~不明 不明 軽度 関連あり - 胃痛 1~2 1 軽度 関連なし 消失 2412L ロキソプロフェンナトリ ウム60mgTID 27 浮腫 6~33 27 軽度 関連あり 消失 眠気 0~25 25 軽度 関連あり 消失 便秘 18 ~不明 不明 中等度 関連なし - 風邪 17 ~不明 不明 中等度 関連なし - 5107L ロキソプロフェンナトリ ウム60mgTID 23β
2MG 上昇 24 ~不明 不明 軽度 関連なし - 5205L セレコキシブ 100mgBID 1 皮疹 1~12 11 高度 関連あり 消失 5701L セレコキシブ 100mgBID 27 尿中NAG13.3 と 高値 28~36 8 軽度 関連あり 消失 5703L ロキソプロフェンナトリ ウム60mgTID 27 口渇 0~28 28 軽度 関連あり 消失 右下肢のつっぱ り感 12 ~不明 不明 軽度 関連なし - 5704L ロキソプロフェンナトリ ウム60mgTID 28 頸部の掻痒感伴 う湿疹様の皮疹 あり 23~32 9 軽度 関連あり 消失 胃部不快感(一過 性) 11~13 2 軽度 関連なし 消失 胃部不快感 24~26 2 軽度 関連なし 消失 咽頭痛 24~29 5 軽度 関連なし 消失 5705L セレコキシブ 100mgBID 28β
2MG 尿上昇 28~40 12 軽度 関連あり 消失 口渇あり 3~29 26 軽度 関連あり 消失 胃のムカつき 17~21 4 軽度 関連なし 消失 5706L ロキソプロフェンナトリ ウム60mgTID 28 尿中β2MG-尿の 上昇 29~51 22 軽度 関連あり 消失 顔全体に皮疹伴 わないそう痒感 11~27 16 軽度 関連あり 消失 5707L セレコキシブ 100mgBID 27 舌のあれ 19~22 3 軽度 関連あり 消失 5709L セレコキシブ 100mgBID 14 WBC の減少 37~52 15 軽度 関連あり 消失 5710L ロキソプロフェンナトリ ウム60mgTID 25 ぎっくり腰 14~22 8 軽度 関連なし 消失 LBP 第Ⅲ相試験 [217] 6203L セレコキシブ 100mgBID 28 感冒 10~30 20 軽度 関連なし 消失 1):治験薬投与開始日を 0 日として計算 表 2.7.4.7.1 引用表
2.7.4.1.7 安全性評価除外例に認められた有害事象一覧(その 3)
試験名 試験識別番号 症例 番号 治験薬 投与量 投与 日数1) (日) 症例報告書上の 表記 発現 時期1) (日) 発現 期間1) (日) 程度 被験薬との 関連性 転帰 GOT 上昇 24~33 9 軽度 関連あり 消失 GPT 上昇 24~33 9 軽度 関連あり 消失 6406L ロキソプロフェンナトリ ウム60mgTID 23γ
-GTP 上昇 24~33 9 軽度 関連あり 消失 ALP の高値 28~57 29 軽度 関連あり 消失 便潜血陽性 29~37 8 軽度 関連あり 消失 6501L ロキソプロフェンナトリ ウム60mgTID 28 感冒 25~28 3 軽度 関連なし 消失 6508L ロキソプロフェンナトリ ウム60mgTID 27 下痢 7~32 25 軽度 関連あり 消失 胃痛 1 ~不明 不明 高度 関連あり - 6512L ロキソプロフェンナトリ ウム60mgTID 13 BUN 上昇 14~29 15 軽度 関連あり 消失 6515L セレコキシブ 100mgBID 28 ぼんやりする 0~26 26 軽度 関連あり 消失 6607L ロキソプロフェンナトリ ウム60mgTID 27 下肢浮腫 13 ~不明 不明 軽度 関連なし - 7620L ロキソプロフェンナトリ ウム60mgTID 28 便秘 13~14 1 中等度 関連なし 消失 感冒 4~10 6 中等度 関連なし 消失 8903L セレコキシブ 100mgBID 27 水様性下痢 24~26 2 中等度 関連なし 消失 NAG 上昇 28~79 51 高度 関連あり 消失 8904L セレコキシブ 100mgBID 27β
2-マイクログロ ブリン値上昇 28~79 51 高度 関連あり 消失 感冒 21~23 2 軽度 関連なし 消失 8906L セレコキシブ 100mgBID 28 歯痛 23~25 2 高度 関連なし 消失 口唇ヘルペス 3~16 13 中等度 関連なし 消失 8907L ロキソプロフェンナトリ ウム60mgTID 26 左上眼瞼麦粒腫 6~14 8 軽度 関連なし 消失 両眼瞼の腫れ ぼったさ(腫張 感) 15~33 18 軽度 関連あり 消失 LBP 第Ⅲ相試験 [217] 8908L ロキソプロフェンナトリ ウム60mgTID 27 後頭部違和感 7~33 26 軽度 関連あり 消失 1):治験薬投与開始日を 0 日として計算 表 2.7.4.7.1 引用表
2.7.4.1.7.1 安全性評価除外例に認められた重篤な有害事象一覧
試験名 試験識別番号 症例 番号 治験薬 投与量 投与 日数1) (日) 症例報告書上の 表記 発現 時期1) (日) 発現 期間1) (日) 程度 被験薬との 関連性 転帰 第9 胸椎圧迫骨 折 29~79 50 高度 関連なし 後遺症を残 して回復 6512L ロキソプロフェンナトリ ウム60mgTID 13 背,腰,殿部挫創 29~79 50 高度 関連なし 消失 LBP 第Ⅲ相試験 [217] 8904L セレコキシブ 100mgBID 27 心不全(LDH 上昇,CPK 上昇) 34~79 45 高度 関連なし 消失 1):治験薬投与開始日を 0 日として計算 表2.7.4.7.1.1 引用2.7.4.1.1.2.2 安全性データの併合
国内の安全性検討試験における併合データセットの構成を表
2.7.4.1.8 及び図 2.7.4.1.1 に示す.
国内全試験の併合データセットは,国内で実施した慢性疼痛疾患患者に対する全
12 試験から
構成した.国内全試験を国内短期投与
10 試験と国内長期投与 2 試験に分け,それぞれデータセッ
トを作成した.また,国内で実施したロキソプロフェンナトリウムを対照とした
3 つの比較対
照試験(
RA に対する第Ⅲ相試験[RCT1],OA に対する第Ⅲ相試験[216]及び腰痛症に対す
る第Ⅲ相試験[
217])を併合して実薬対照 3 試験データセットを構成し,本剤とロキソプロフェ
ンナトリウムとの安全性の比較に用いた.更に,国内で実施したプラセボを対照とした
3 つの
比較対照試験(
RA に対する後期第Ⅱ相試験[RDS1],OA に対する後期第Ⅱ相試験[ODS1]
及び
OA に対する第Ⅲ相試験[216])を併合しプラセボ対照 3 試験データセットを構成し,本
剤とプラセボとの安全性の比較に用いた.
RA 及び OA に対する長期投与試験[024](外国)に関しては,国内の試験との併合は行わ
ず,個別の解析結果を記載した.
表
2.7.4.1.8 国内の安全性検討試験における併合データセットの構成
併合データセット
構成試験
国内全試験
(12 試験)
RA:[RPi1][RDS1][RCT1][RLN3]
OA:[OPi1][ODS1][216][OLN2]
腰痛症:[217]
肩関節周囲炎:[POP1]
頸肩腕症候群:[COP1]
腱・腱鞘炎:[TOP1]
国内短期投与
10 試験
RA:[RPi1][RDS1][RCT1]
OA:[OPi1][ODS1][216]
腰痛症:[
217]
肩関節周囲炎:[
POP1]
頸肩腕症候群:[
COP1]
腱・腱鞘炎:[
TOP1]
国内長期投与
2 試験
RA:[RLN3]
OA:[OLN2]
実薬対照
3 試験
RA:[RCT1]
OA:[216]
腰痛症:[217]
プラセボ対照
3 試験
RA:[RDS1]
OA:[ODS1][216]
RA初期第Ⅱ相試験[RPi1] 非対照非盲検 パイロット試験(6週間) セレコキシブ 50mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID RA後期第Ⅱ相試験[RDS1] プラセボ対照二重盲検 用量反応試験(4週間) プラセボ セレコキシブ 25mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID RA第Ⅲ相試験[RCT1] 実薬対照二重盲検 比較試験(12週間) セレコキシブ 200mgBID ロキソプロフェンナトリウム 60mgTID OA初期第Ⅱ相試験[OPi1] 非対照非盲検 パイロット試験(4週間) セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID OA後期第Ⅱ相試験[ODS1] プラセボ対照二重盲検 用量反応試験(4週間) プラセボ セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID OA第Ⅲ相試験[216] プラセボ・実薬対照二重盲検 比較試験(4週間) プラセボ セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID 腰痛症第Ⅲ相試験[217] 実薬対照二重盲検 比較試験(4週間) セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID 肩関節周囲炎一般臨床試験[POP1] 非対照非盲検(4週間) セレコキシブ 100mgBID 頸肩腕症候群一般臨床試験[COP1] OA長期投与試験[OLN2] 非対照非盲検試験(28週間以上) セレコキシブ 100mgBID RA長期投与試験[RLN3] 非対照非盲検試験(52週間) セレコキシブ 200mgBID 実薬対照3試験 プラセボ対照3試験 RA OA 初期第Ⅱ相 後期第Ⅱ相 第Ⅲ相 腰痛症 肩関節周囲炎 RA初期第Ⅱ相試験[RPi1] 非対照非盲検 パイロット試験(6週間) セレコキシブ 50mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID RA後期第Ⅱ相試験[RDS1] プラセボ対照二重盲検 用量反応試験(4週間) プラセボ セレコキシブ 25mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID プラセボ セレコキシブ 25mgBID セレコキシブ 100mgBID セレコキシブ 200mgBID RA第Ⅲ相試験[RCT1] 実薬対照二重盲検 比較試験(12週間) セレコキシブ 200mgBID ロキソプロフェンナトリウム 60mgTID RA第Ⅲ相試験[RCT1] 実薬対照二重盲検 比較試験(12週間) セレコキシブ 200mgBID ロキソプロフェンナトリウム 60mgTID セレコキシブ 200mgBID ロキソプロフェンナトリウム 60mgTID OA初期第Ⅱ相試験[OPi1] 非対照非盲検 パイロット試験(4週間) セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID OA後期第Ⅱ相試験[ODS1] プラセボ対照二重盲検 用量反応試験(4週間) プラセボ セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID プラセボ セレコキシブ 25mgBID セレコキシブ 50mgBID セレコキシブ 100mgBID OA第Ⅲ相試験[216] プラセボ・実薬対照二重盲検 比較試験(4週間) プラセボ セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID プラセボ セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID 腰痛症第Ⅲ相試験[217] 実薬対照二重盲検 比較試験(4週間) セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID セレコキシブ 100mgBID ロキソプロフェンナトリウム 60mgTID 肩関節周囲炎一般臨床試験[POP1] 非対照非盲検(4週間) 肩関節周囲炎一般臨床試験[POP1] 非対照非盲検(4週間) セレコキシブ 100mgBID セレコキシブ 100mgBID 頸肩腕症候群一般臨床試験[COP1] 頸肩腕症候群一般臨床試験[COP1] OA長期投与試験[OLN2] 非対照非盲検試験(28週間以上) OA長期投与試験[OLN2] 非対照非盲検試験(28週間以上) セレコキシブ 100mgBID セレコキシブ 100mgBID RA長期投与試験[RLN3] 非対照非盲検試験(52週間) RA長期投与試験[RLN3] 非対照非盲検試験(52週間) セレコキシブ 200mgBID セレコキシブ 200mgBID 実薬対照3試験 プラセボ対照3試験 RA OA 初期第Ⅱ相 後期第Ⅱ相 第Ⅲ相 腰痛症 肩関節周囲炎2.7.4.1.1.2.3 解析方法
2.7.4.1.1.2.3.1 有害事象
安全性併合解析では,臨床検査値異常変動を除く症状及び身体徴候を有害事象として集計し,
臨床検査値異常変動については有害事象とは別に集計した.なお,
RA 及び OA に対する長期投
与試験[
024](外国)では,臨床検査値異常変動を含む症状及び身体徴候を有害事象として集
計した.
また,有害事象について,被験薬との関連性を
4 段階(関連なし,たぶん関連なし,たぶん
関連あり,関連あり)で治験担当医師が判定し,
「関連あり」及び「たぶん関連あり」のいずれ
かに判定されたものを「被験薬との関連性が否定できない有害事象」と定義{
OA に対する第
Ⅲ相試験[
216],腰痛症に対する第Ⅲ相試験[217]については,被験薬との関連性を 2 段階
(関連なし,関連あり)で治験担当医師が判定し,「関連あり」と判定されたものを「被験薬と
の関連性が否定できない有害事象」と定義}し,被験薬との関連性が否定できない有害事象と
して,その発現率を集計した.なお,
RA 及び OA に対する長期投与試験[024](外国)につ
いては,被験薬との関連性を
3 段階(None,Uncertain,Probable)で治験担当医師が判定し,
「Uncertain」及び「Probable」のいずれかに判定されたものを「被験薬との関連性が否定できな
い有害事象」と定義し,被験薬との関連性が否定できない有害事象として,その発現率を集計
した.
有害事象は,WHO ART の基本語を用いて集計を行った.
2.7.4.1.1.2.3.2 器官別又は症候群別有害事象の解析
有害事象の器官別の集計は,WHO ART の器官別大分類を用いて集計した.更に,既存の非
ステロイド性抗炎症薬(NSAID)が上部消化管粘膜障害,腎機能障害,血小板凝集阻害等の作
用をもつことが知られているため,これらの作用に関連する有害事象群を新たに規定して集計
した.また,本剤の安全性を幅広く評価するため,心血管系事象,肝機能障害,皮膚障害に伴
う有害事象についても併せて評価した.
本剤の安全性の評価において,WHO ART 器官別大分類以外に新たに規定した有害事象群を
表
2.7.4.1.9 に示す.
「消化管潰瘍及び出血性事象」として,WHO ART の器官別大分類で消化管障害に分類される
事象のうち,胃潰瘍,十二指腸潰瘍,出血性胃潰瘍,胃腸出血及びメレナを規定した.
「腎機能障害」として,WHO ART 器官別大分類の泌尿器系障害に加え,自律神経系障害の高
血圧及び高血圧悪化,血管(心臓外)障害の脳血管障害,一般的全身障害の浮腫,末梢性浮腫,
顔面浮腫及び全身浮腫を規定した.
「浮腫事象」として,腎機能障害のうち,浮腫,末梢性浮腫,顔面浮腫及び全身浮腫を規定した.
「心血管系事象」として,WHO ART 器官別大分類の血小板・出血凝血障害,赤血球障害,血
管(心臓外)障害,心・血管障害(一般),心筋・心内膜・心膜・弁膜障害及び心拍数・心リズ
ム障害を規定した.このうち,血小板・出血凝血障害,赤血球障害及び血管(心臓外)障害を
「出血凝血障害」,心・血管障害(一般),心筋・心内膜・心膜・弁膜障害及び心拍数・心リズム
障害を「心臓障害」と規定した.
各器官別大分類(WHO ART)及び新たに規定した有害事象群の発現率に関して,実薬対照 3
試験及びプラセボ対照
3 試験の各併合データセットにおいて,Fisher の直接確率法による検定
(有意水準両側
5%)を行い,本剤とロキソプロフェンナトリウム及び本剤とプラセボとの間で
群間比較を行った.
表
2.7.4.1.9 WHO ART 器官別大分類以外に新たに規定した有害事象群
有害事象群
内容
消 化 管 潰 瘍 及 び 出 血 性
事象
胃潰瘍,十二指腸潰瘍,出血性胃潰瘍,胃腸出血,メレナ
腎機能障害
泌尿器系障害(
WHO ART 器官別大分類)
高血圧,高血圧悪化,脳血管障害,浮腫,末梢性浮腫,顔面
浮腫,全身浮腫
浮腫事象
浮腫,末梢性浮腫,顔面浮腫,全身浮腫
心血管系事象
血小板・出血凝血障害(WHO ART 器官別大分類)
赤血球障害(
WHO ART 器官別大分類)
血管(心臓外)障害(WHO ART 器官別大分類)
心・血管障害(一般)(
WHO ART 器官別大分類)
心筋・心内膜・心膜・弁膜障害(
WHO ART 器官別大分類)
心拍数・心リズム障害(WHO ART 器官別大分類)
出血凝血障害
血小板・出血凝血障害(
WHO ART 器官別大分類)
赤血球障害(WHO ART 器官別大分類)
血管(心臓外)障害(
WHO ART 器官別大分類)
心臓障害
心・血管障害(一般)(
WHO ART 器官別大分類)
心筋・心内膜・心膜・弁膜障害(WHO ART 器官別大分類)
心拍数・心リズム障害(
WHO ART 器官別大分類)
2.7.4.1.1.2.3.3 長期投与試験における用量別の有害事象の解析
国内の長期投与試験では,治験期間中の用量変更が可能なデザインであったため,全症例で
の有害事象の発現率に加え,有害事象発現時の用量別の発現率を集計した.この際,用量変更
を行った被験者は,経験したすべての用量(複数)の母数にそれぞれカウントし,国内全試験
を併合する際も,同様の方法で国内長期投与試験の有害事象を発現時の用量別で取り扱った.
2.7.4.1.1.2.3.4 長期投与試験における時期別の有害事象の解析
国内及び外国における長期投与試験では,投与時期(4 週)ごとの有害事象の発現率(Incidence)
と有病率(Prevalence)について解析した.
100
1%
×
−
−=
n
N
tn
t t)
(
発現率
n
t:期間
t にて該当する有害事象が発現した症例数
n
t-1:期間
t の被験薬投与例のうち期間 t-1 までに該当の有害事象が発現している症例数
N
t:期間
t の被験薬投与例数
100
%
=
×
N
n
t t)
(
有病率
n
t:投与期間ごとの有害事象期間
t にて有害事象を有している症例数
N
t:期間
t の被験薬投与例数
2.7.4.1.1.2.3.5 重篤な有害事象及び重要な有害事象
重篤な有害事象については,発現例数/件数を集計した.
重要な有害事象として,投与中止を引き起こした有害事象に関して,発現率及び器官別大分
類ごとの発現率を集計した.
2.7.4.1.1.2.3.6 臨床検査値異常変動
臨床検査値異常変動は,治験担当医師が異常変動ありと判断した事象について,上昇,下降,
変動(陽性)別の集計を行った.
また,臨床検査値異常変動について,被験薬との関連性を
4 段階(関連なし,たぶん関連な
し,たぶん関連あり,関連あり)で治験担当医師が判定し,
「関連あり」及び「たぶん関連あり」
のいずれかに判定されたものを「被験薬との関連性が否定できない臨床検査値異常変動」と定
義{
OA に対する第Ⅲ相試験[216],腰痛症に対する第Ⅲ相試験[217]については,被験薬と
の関連性を
2 段階(関連なし,関連あり)で治験担当医師が判定し,
「関連あり」と判定された
ものを「被験薬との関連性が否定できない臨床検査値異常変動」と定義}し,被験薬との関連
性が否定できない臨床検査値異常変動として,その発現率を集計した.
2.7.4.1.1.2.3.7 層別解析
有害事象及び臨床検査値異常変動の発現率について,本剤の安全性に対して影響を及ぼす可
能性のある因子として年齢(65 歳未満,65 歳以上),年齢(65 歳未満,65 歳以上 75 歳未満,
75 歳以上),性別,性別体重(男性:60kg 未満,60kg 以上,女性:50kg 未満,50kg 以上),概
括重症度(又は
Class),罹病期間(5 年未満,5 年以上),前治療 NSAID 有無,投与期間(~4
週,4~12 週,12 週~),合併症(消化器系疾患,腎疾患,肝疾患,血液疾患,心臓疾患,高血
圧)有無及び併用薬・併用療法(ステロイド,NSAID 以外の鎮痛剤,メトトレキサート(RA
のみ),DMARD(RA のみ),ACE 阻害剤,フロセミド,アンジオテンシンⅡ拮抗剤,利尿薬)
有無による層別解析を実施した.
2.7.4.1.1.2.3.8 臨床検査値平均変化量及びシフトテーブル
臨床検査値については,異常変動の他に各項目の被験薬投与前後の平均値の推移及び平均変
化量[投与前値と投与後値(最終時)の値の差の平均]について解析した.実薬対照
3 試験及
びプラセボ対照
3 試験の併合データセットにおいて,平均変化量に関する t 検定(有意水準両
側
5%)を行い,本剤とロキソプロフェンナトリウム及び本剤とプラセボとの間の群間比較を
行った.
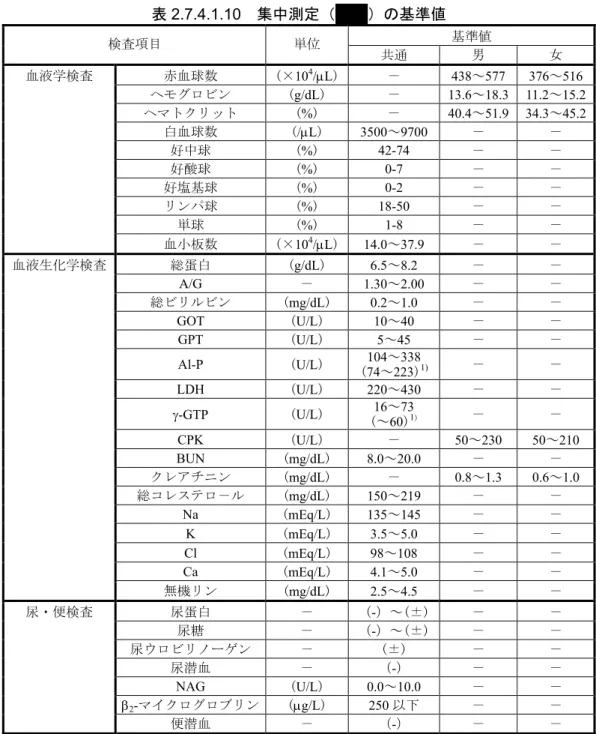
国内試験における臨床検査値の推移に関しては,集中測定(
)又は実施医療機関の基準
値を用いて,3 つのカテゴリー[基準域外低値(L),基準域内(N),基準域外高値(H)]に分
け,各項目の被験薬投与前後のシフトテーブルによる解析も行った.集中測定(
)の基準
値を表
2.7.4.1.10 に示す.
表
2.7.4.1.10 集中測定(
)の基準値
基準値
検査項目
単位
共通
男
女
赤血球数
(×
10
4/μL)
-
438~577 376~516
ヘモグロビン
(
g/dL)
-
13.6~18.3 11.2~15.2
ヘマトクリット
(%)
- 40.4~51.9 34.3~45.2
白血球数
(
/μL) 3500~9700
-
-
好中球
(
%)
42-74
-
-
好酸球
(%)
0-7
-
-
好塩基球
(
%)
0-2
-
-
リンパ球
(%)
18-50
-
-
単球
(
%)
1-8
-
-
血液学検査
血小板数
(×10
4/μL)
14.0~37.9
-
-
総蛋白
(g/dL) 6.5~8.2
-
-
A/G
-
1.30~2.00
-
-
総ビリルビン
(
mg/dL) 0.2~1.0
-
-
GOT
(U/L) 10~40
-
-
GPT
(
U/L)
5~45
-
-
Al-P
(
U/L)
(
74~223)
104~338
1)-
-
LDH
(
U/L) 220~430
-
-
γ-GTP
(U/L)
(~
16~73
60)
1)-
-
CPK
(U/L)
- 50~230 50~210
BUN
(
mg/dL) 8.0~20.0
-
-
クレアチニン
(mg/dL)
- 0.8~1.3 0.6~1.0
総コレステロ-ル
(
mg/dL) 150~219
-
-
Na
(
mEq/L) 135~145
-
-
K
(
mEq/L) 3.5~5.0
-
-
Cl
(mEq/L) 98~108
-
-
Ca
(
mEq/L) 4.1~5.0
-
-
血液生化学検査
無機リン
(mg/dL) 2.5~4.5
-
-
尿蛋白
-
(-)~(±)
-
-
尿糖
-
(
-)~(±)
-
-
尿ウロビリノーゲン
-
(±)
-
-
尿潜血
-
(-)
-
-
NAG
(
U/L) 0.0~10.0
-
-
β
2-マイクログロブリン
(
μg/L) 250 以下
-
-
尿・便検査
便潜血
-
(-)
-
-
1):RA 及び OA に対する後期第Ⅱ相試験([RDS1][ODS1])における基準値2.7.4.1.1.2.3.9 バイタルサイン
バイタルサインについては,データの併合は行わず,実施した個別試験([RPi1][216][217]
[024])ごとに被験薬投与前後の平均値の算出を行い,OA に対する第Ⅲ相試験[216],腰痛症
に対する第Ⅲ相試験[217]及び RA 及び OA に対する長期投与試験[024]
(外国)では,平均
変化量及び正常範囲からの大きな上昇又は下降の発現率についても解析した.大きな上昇又は
下降の基準として,血圧及び脈拍は被験薬投与前値からの
15%以上の上昇/下降,体重は被験薬
投与前値からの
5%以上の増加/減少と規定した.
2.7.4.1.2 全般的な曝露状況
本剤の国内短期投与
10 試験の安全性解析対象例における 1 日用量及び投与期間別曝露の状況
を表
2.7.4.1.11 に示す.申請推奨用法・用量である 100-200mg 1 日 2 回(BID)の投与を受けた被
験者は,国内短期投与
10 試験の全 2177 例中 1771 例(81.4%)であった.また,投与期間別曝
露については,4 週以上の曝露を経験した被験者が,2177 例中 1293 例(59.4%)であった.
表
2.7.4.1.11 国内短期投与 10 試験における 1 日用量及び投与期間別曝露(本剤群)
用量
全用量
合計
投与期間
25mg
BID
50mg
BID
100mg
BID
200mg
BID
推奨用量
100-200mg
BID
例数(
%)
期間
<2 週
15 16
75
24
99
130
(
6.0%)
2 週≦期間<4 週
58 29
630
37
667
754
(
34.6%)
4 週≦期間<12 週
171 117
577
198
775
1063
(48.8%)
12 週≦期間
0 0
0
230
230
230
(10.6%)
例数
244 162
1282
489
1771
合計
(すべての期間)(%)
(11.2%)
(7.4%)
(58.9%)
(22.5%)
(81.4%)
2177
国内の長期投与試験において,RA に対して 200mgBID から投与を開始し,300mgBID 及び
400mgBID までの増量を可能とした.OA に対しては,100mgBID から投与を開始し,200mgBID
までの増量を可能とした.国内の長期投与試験の被験薬の用量変更状況は
2.7.3 臨床的有効性
の概要の表
2.7.3A.3.27 及び表 2.7.3B.3.27 に記載した.
RA 及び OA に対する長期投与試験[024](外国)においては,RA に対して 200mgBID から
投与を開始し,400mgBID まで,OA に対して 100mgBID から投与を開始し,200mgBID までの
増量及び減量を可能とした.
RA 及び OA を対象として実施した国内及び外国の長期投与試験の安全性解析対象例におけ
る
1 日用量及び投与期間別曝露の状況を表 2.7.4.1.12 及び表 2.7.4.1.13 に示す.曝露状況の集
計において,用量変更を行った被験者は,経験したすべての用量(複数)の分母にそれぞれカ
ウントし,同じ用量を複数回に分けて服用した場合は,各服薬期間を合計して集計した.
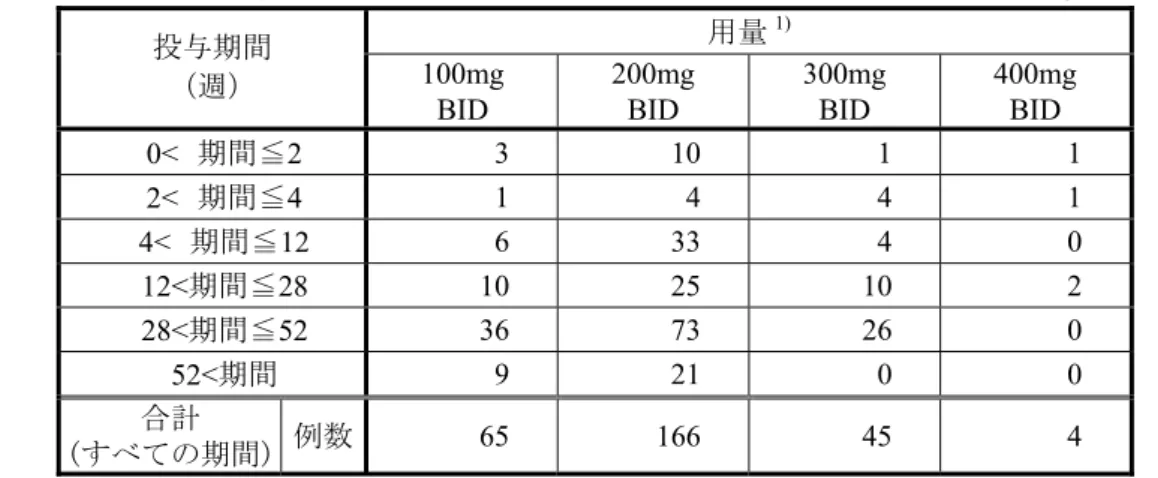
国内及び外国の長期投与試験において,申請用量である
100mgBID 及び 200mgBID の投与を
6 カ月(28 週)を超えて経験した症例は,100mgBID で国内 45 例及び外国 495 例(計 540 例),
200mgBID で国内 94 例及び外国 2094 例(計 2188 例)であった.このうち 1 年(52 週)を超え
る投与を経験した症例は,100mgBID で国内 9 例及び外国 334 例(計 343 例),200mgBID で国
表
2.7.4.1.12 国内の長期投与試験 2 試験における 1 日用量及び投与期間別曝露(本剤群)
用量
1)投与期間
(週)
100mg
BID
200mg
BID
300mg
BID
400mg
BID
0< 期間≦2
3 10 1 1
2< 期間≦4
1 4 4 1
4< 期間≦12
6 33 4 0
12<期間≦28
10 25 10 2
28<期間≦52
36 73 26 0
52<期間
9 21 0 0
合計
(すべての期間)
例数
65 166 45 4
1):当該用量を 1 回以上服薬した症例.用量を変更した症例では服薬した用量群すべての
分母にカウントした.同じ用量を複数回に分けて服用した場合は,服薬期間を合計し
て表示した.
表
2.7.4.1.13 RA 及び OA に対する長期投与試験[024](外国)における 1 日用量
及び投与期間別曝露(本剤群)
用量
1)投与期間
(週)
50mg
BID
100mg
BID
200mg
BID
300mg
BID
400mg
BID
その他
0< 期間≦2
48
1204
923
244
69
7
2< 期間≦4
42
277
287
370
50
3
4< 期間≦12
247
723
692
411
185
8
12< 期間≦28
83
603
728
278
240
3
28< 期間≦52
0
161
538
184
231
0
52<期間
0
334
1556
284
672
1
合計
(すべての期間)
例数
420
3302
4724
1771
1447
22
1):当該用量を 1 回以上服薬した症例.用量を変更した症例では服薬した用量群すべての分母
にカウントした.同じ用量を複数回に分けて服用した場合は,服薬期間を合計して表示し
た.
1 日 1 回投与,朝夕の用量が異なる用法・用量等,いずれの用量にも当てはまらない
ものはその他として集計した.
2.7.4.1.3 治験対象集団の人口統計学的特性及びその他の特性
国内で実施された
12 試験においては,以下の患者集団は,試験の対象から除外された.
・NSAID,スルホンアミドに対する薬物過敏症又はアスピリン喘息の既往・合併を有する患者
・消化管出血,消化管潰瘍を合併している患者
・重篤な肝・腎疾患を有する患者
・妊娠,授乳中の患者,妊娠している可能性のある患者又は妊娠を希望する患者
本剤が投与された被験者の国内全試験における人口統計学的特性を表
2.7.4.1.14 に対象疾患
別に示す.
国内全試験の対象疾患別の人口統計学的特性では,年齢の平均値,65 歳以上及び 75 歳以上
の割合が,OA において他の対象疾患に比べ高かった.性別は,腰痛症を除くいずれの対象疾
患でも女性の割合が高かった.体重の男女平均値,男性
60kg 未満及び女性 50kg 未満の割合は,
RA において他の対象疾患に比べ低かった.患者の重症度(概括重症度又は Class)では,いず
れの対象疾患においても中等度(又は
ClassⅡ)が最も多かった.罹病期間は,RA では 5 年以
上の割合が高く,他の疾患では
5 年未満の割合が高かった.合併症を有する被験者の割合は,
RA 及び OA で他の疾患に比べて高かった.合併症の内容では,RA では消化器系疾患を合併す
る被験者が他の対象疾患に比べ多く,OA 及び腰痛症では,腎疾患を合併する被験者が他の疾
患に比べ多かったが,肝疾患,血液疾患,心臓疾患,高血圧の合併に関しては対象疾患の間で
著しい差異は認められなかった.前治療
NSAID 及び併用薬・併用療法を有する被験者の割合は,
RA では他の対象疾患に比べ高かった.併用薬の内容では,ステロイドの併用割合が,RA では
他の対象疾患に比べ高かったが,それ以外の検討した薬剤の併用に関しては,対象疾患の間に
著しい差異は認められなかった.
国内及び外国の長期投与試験における被験者の年齢,性別,体重等の基本的な人口統計学的
特性を表
2.7.4.1.15 に示す.また,国内長期投与試験と外国長期投与試験の合併症(外国では
既往又は合併症)及び併用薬に関する人口統計学的特性を,表
2.7.4.1.16 及び表 2.7.4.1.17 に
示す.
国内及び外国の長期投与試験における被験者の基本的な人口統計学的特性では,体重の男女
平均値,男性
60kg 以上,女性 50kg 以上の割合が国内に比べ外国で高かったが,その他の項目
では,著しい差異は認められなかった.
国内の長期投与試験における合併症及び併用薬に関する人口統計学的特性では,前治療
NSAID 及びステロイド併用のある被験者の割合が,OA に比べ RA で高かったが,それ以外の
併用薬及び合併症に関しては,RA と OA の間に著しい差異は認められなかった.
外国の長期投与試験における合併症及び併用薬に関する人口統計学的特性では,既往又は合
併症では,高血圧の既往又は合併を有する被験者の割合が,
RA に比べ OA で高く,併用薬では
ステロイド併用のある被験者の割合が,
OA に比べ RA で高かった.それ以外の合併症及び併用
薬(通常
OA 患者に使用されないメトトレキサート及び DMARD を除く)に関しては,RA と
OA の間に著しい差異は認められなかった.
実薬対照
3 試験及びプラセボ対照 3 試験における被験者の人口統計学的特性を付録 表
2.7.4.7.2 及び付録 表 2.7.4.7.3 に示す.
実薬対照
3 試験及びプラセボ対照 3 試験における被験者の人口統計学的特性は,本剤推奨用
表
2.7.4.1.14 国内全試験における被験者の疾患別人口統計学的特性(本剤群)(その 1)
RA OA 腰痛症 肩関節 周囲炎 頸肩腕 症候群 腱・ 腱鞘炎 国内 全試験 25-400mg BID 25-200mgBID 100mgBID 100mgBID 100mgBID 100mgBID
25-400mg BID 症例数 計 867 867 425 77 82 80 2398 年齢(歳) 平均値 ±SD 範囲 58.78 ±11.124 20.00-94.00 64.10 ±10.680 21.00-91.00 49.35 ±15.807 20.00-86.00 51.38 ±15.323 22.00-86.00 50.20 ±14.348 25.00-78.00 48.56 ±13.014 20.00-76.00 58.16 ±13.549 20.00-94.00 <65 歳 588(67.8%) 398(45.9%) 337(79.3%) 61(79.2%) 66(80.5%) 70(87.5%) 1520(63.4%) 65 歳≦ <75 歳 226(26.1%) 336(38.8%) 70(16.5%) 9(11.7%) 10(12.2%) 9(11.3%) 660(27.5%) 75 歳≦ 53(6.1%) 133(15.3%) 18(4.2%) 7(9.1%) 6(7.3%) 1(1.3%) 218(9.1%) 性別 男 135(15.6%) 252(29.1%) 230(54.1%) 36(46.8%) 26(31.7%) 29(36.3%) 708(29.5%) 女 732(84.4%) 615(70.9%) 195(45.9%) 41(53.2%) 56(68.3%) 51(63.8%) 1690(70.5%) 体重(kg) 男 平均値 ±SD 範囲 59.18 ±9.919 37.00-95.00 66.71 ±9.449 45.50-118.00 67.21 ±9.047 40.10-100.00 64.94 ±8.861 45.00-84.50 67.41 ±10.929 49.00-96.70 67.06 ±9.842 52.40-96.00 65.40 ±9.903 37.00-118.00 <60 73(55.3%) 49(20.2%) 48(20.9%) 9(25.0%) 4(15.4%) 6(20.7%) 189(27.2%) 60≦ 59(44.7%) 194(79.8%) 182(79.1%) 27(75.0%) 22(84.6%) 23(79.3%) 507(72.8%) 女 平均値 ±SD 範囲 51.10 ±8.395 30.00-84.30 58.06 ±9.691 30.50-108.00 54.43 ±9.112 35.00-95.00 52.94 ±9.404 30.00-76.00 56.02 ±12.391 36.00-120.00 57.27 ±10.766 41.00-103.00 54.38 ±9.726 30.00-120.00 <50 325(45.0%) 105(17.7%) 54(27.7%) 15(36.6%) 14(25.0%) 10(19.6%) 523(31.6%) 50≦ 397(55.0%) 487(82.3%) 141(72.3%) 26(63.4%) 42(75.0%) 41(80.4%) 1134(68.4%) Class 1 103(11.9%) 103(11.9%) 2 587(67.7%) 587(67.7%) 3 172(19.8%) 172(19.8%) 4 5(0.6%) データなし データなし データなし データなし データなし 5(0.6%) 概括重症度 軽度 124(25.4%) 1(1.3%) 10(12.2%) 0 135(18.5%) 中等度 326(66.7%) 53(68.8%) 68(82.9%) 63(78.8%) 510(70.1%) 高度 データなし 39(8.0%) データなし 23(29.9%) 4(4.9%) 17(21.3%) 83(11.4%) 罹病期間(年) 平均値 ±SD 範囲 10.18 ±8.683 0.17-58.00 4.01 ±4.932 0.00-37.00 2.04 ±5.507 0.00-38.00 2.48 ±4.865 0.00-25.00 0.71 ±2.719 0.00-16.00 6.45 ±7.600 0.00-58.00 5 年未満 276(31.8%) 593(68.5%) 65(84.4%) 69(84.1%) 76(95.0%) 1079(54.7%) 5 年以上 591(68.2%) 273(31.5%) データなし 12(15.6%) 13(15.9%) 4(5.0%) 893(45.3%)
![表 2.7.4.1.3 国内の安全性検討試験において被験薬が投与された症例数 セレコキシブ 対象疾患 試験名 投与 期間 1) プラセボ 25mg BID 50mgBID 100mgBID 200mg BID 合計 ロキソ プロフェンナトリウム 合計 RA 初期第Ⅱ相試験[RPi1] 6 週 - - 19 17 18 54 - 54 後期第Ⅱ相試験[RDS1] 4 週 96 99 - 89 92 280 - 376 第Ⅲ相試験[ RCT1 ] 12 週 - - - - 38](https://thumb-ap.123doks.com/thumbv2/123deta/8044952.844142/7.892.105.796.150.538/セレコキシブプラセボロキソ゚ロフェンナトリウム合計初期第後期.webp)
![表 2.7.4.1.6 安全性評価除外例の除外理由 試験名 試験識別番号 例数 症例番号 理由 RA 初期第Ⅱ相試験 [RPi1] 4 403,1501,1503,1703 測定日のズレにより臨床検査データが不採用となったため RA 後期第Ⅱ相試 験[RDS1] 2 1031,1034 1) 症例報告書の記載データの一部が原資料から確認できなかったため(完全除外) RA 第Ⅲ相試験 [ RCT1 ] 2 2142 , 2143 別の患者に割り当てられた被験薬を重複して割り当てたため(完全除](https://thumb-ap.123doks.com/thumbv2/123deta/8044952.844142/9.892.126.776.150.1011/試験名測定日によりデータ不採用なっデータなかっ完全割り当て.webp)
![表 2.7.4.1.7 安全性評価除外例に認められた有害事象一覧(その 1) 試験名 試験識別番号 症例 番号 治験薬 投与量 投与 日数 1) (日) 症例報告書上の表記 発現 時期 1)(日) 発現 期間 1)(日) 程度 被験薬との 関連性 転帰 RA 初期第Ⅱ相試 験[RPi1] 403 セレコキシブ 200mgBID 5 風邪症候群 2~9 7 中等度 関連なし 消失 尿意頻回 -12~ 28 40 軽度 たぶん関連なし 消失 左肩かゆみ 21~28](https://thumb-ap.123doks.com/thumbv2/123deta/8044952.844142/10.892.114.786.147.860/試験名治験薬症例発現被験薬セレコキシブ中等度なしたぶんかゆみ.webp)


![表 2.7.4.1.8 国内の安全性検討試験における併合データセットの構成 併合データセット 構成試験 国内全試験 (12 試験) RA:[RPi1][RDS1][RCT1][RLN3] OA:[OPi1][ODS1][216][OLN2] 腰痛症:[217] 肩関節周囲炎:[POP1] 頸肩腕症候群:[COP1] 腱・腱鞘炎:[TOP1] 国内短期投与 10 試験 RA :[ RPi1 ][ RDS1 ][ RCT1 ]OA:[OPi1][ODS1][216]腰痛症:[217] 肩関節周囲炎](https://thumb-ap.123doks.com/thumbv2/123deta/8044952.844142/14.892.195.691.141.538/おけるデータセットデータセットOAOPiOLN腰痛投与試験RPiRDSRCTOAOPi囲炎.webp)