博士論文
アロ
MHC 遺伝子の転写ターゲティングによる
がん遺伝子治療の新しい戦略
-がん抗原遺伝子転写調節領域のがん治療への応用-
2015 年(平成 27 年)
桒田 恵里
目次 頁 略語 1 論文要旨 2 序論 8 第1 章:Q5遺伝子のがん細胞特異的発現解析 1.1 序論 10 1.2 方法 12 1.3 結果 15 1.4 考察 18 第2 章:Q5遺伝子発現の転写調節領域の同定 2.1 序論 25 2.2 方法 27 2.3 結果 34 2.4 考察 39 第3 章:Q5遺伝子の転写調節領域と免疫誘導機構を利用する遺伝子治療効果の検証 3.1 序論 51 3.2 方法 53 3.3 結果 56 3.9 考察 58 総合考察 63 引用文献 67 論文目録 74 謝辞 76
- 1 - 略語
ADA:adenosine deamiase
AML-1:acute myeloid leukemia 1 protein CD:cluster of differentiation cDNA:complementary DNA CR:complete remission CTL:cytotoxic T lymphocyte CY:cyclophosphamide DC:dendritic cell DNA:deoxyribonucleic acid EDTA:ethylenediaminetetraacetic acid FBS:fetal bovine serum
FCM, FACS:flow cytometer, fluorescence-activated cell sorting FITC:fluorescein isothiocyanate
HLA:human leukocyte antigen IFN-γ:interferon-gamma IgG:immunoglobulin G mAb:monoclonal antibody
MHC:major histocompatibility complex MOI:multiplicity of infection
NK:natural killer cell
PBMC:peripheral blood mononuclear cell PCR:polymerase chain reaction
RT:reverse transcription RNA:ribonucleic acid
- 2 - 論文要旨 アロMHC遺伝子の転写ターゲティングによるがん遺伝子治療の新しい戦略 -がん抗原遺伝子転写調節領域のがん治療への応用- 日本人の死亡原因の第1 位であるがんは、罹患者数、死亡者数ともに年々上昇を続 けている。がんの標準的な治療法は、外科治療、放射線治療、化学療法であるが、外 科治療や放射線治療は局所的な治療であるため、診断時に発見できなかったがんは治 療することが出来ず、すでに転移している場合には効果がない。また、化学療法は全 身的な治療ではあるが、正常な細胞にもダメージがあるために強い副作用があり、 QOL(Quality of Life:生活の質)を低下させる上に、効果が見られないケースが多 いことも知られている。 がんの発生には遺伝やウィルスの感染など様々な要因があり、その主な原因は紫外 線や化学物質等による DNA の損傷である。通常は DNA 修復酵素により修復される ことでがん化することはなく、修復が追い付かない場合でも免疫機構が働いて変異細 胞が排除される。しかし、免疫力が低下している場合には、がん化した細胞が排除さ れることなく増殖し、腫瘍を形成すると考えられている。 このような背景のもと、免疫力向上に着目した新しい治療法の1つとして注目され ているのが免疫療法である。免疫細胞療法は副作用がほとんどなく、全身的な治療が 可能なことで期待されている一方で、即効性がなく、効果がはっきりしないという課 題がある。また近年、がんが免疫から逃れようとする力、すなわち免疫抑制能力を持 っていることが解ってきており、免疫抑制による治療効果の低下が課題として残って いる。このように、これまで、そして現在でも世界中の多くの研究者によってがん治 療の研究が進められているものの、未だ決定的な治療法は確立されていない。 我々は、がんの効果的な治療法には、a. がん細胞特異的であること、b. 全身治療が 可能であること、c. 免疫反応を有効利用すること、d. 免疫抑制を解除し、免疫誘導機 構を効果的に利用すること、が必要であると考え、これらを解決した有効性の高いが ん治療法を提供することを目的として、本研究を行った。
- 3 - 1. Q5遺伝子のがん細胞特異的発現解析 がん細胞に特異性の高い治療を可能にするために、がん細胞特異的に発現する遺伝 子の発現調節機構を利用した遺伝子治療の可能性を考えた。がん細胞特異的な発現を する遺伝子の候補としては、Q5 抗原が様々ながん細胞表面に発現し、同系マウスに対 してがん抗原性を持っているという江川らのマウスにおける血清学的研究結果に着 目し、Q5遺伝子の発現機構を応用することを考えた。Q5 遺伝子は、マウス第 17 番 染色体に存在する H-2 複合体、MHC クラスⅠb の Q 遺伝子領域の 5 番目に存在し、 免疫学的に重要な機能を営む遺伝子群の中に存在している。江川らの報告は血清学的 試験の結果であったことから、Q5 遺伝子の発現ががん細胞特異的な転写によるもの かを確認する為、RT-PCR による遺伝子発現レベルでの解析をはじめに行った。 まず、様々な系統のマウスの、様々ながん細胞株でQ遺伝子群の発現について RT-PCR 法で調べた結果、Q5遺伝子のみが発現していることを確認した。正常細胞での 発現は生体マウス組織を使用して検討し、ほとんどの組織で発現は認められなかった ものの、例外的に一部の系統(k 型)のリンパ球と胸腺のみで Q5 遺伝子が発現して いることが示唆された。続いて、マウスにがん細胞を皮下移植した担がん状態での発 現について検討を行った結果、がんの組織では発現が認められた。また、k 型の正常 リンパ球と胸腺で認められた発現は担がん状態ではほぼ認められなくなり、担がん状 態では発現に抑制がかかり基本的にがん組織のみの発現である事が示唆された。 これらの結果から、Q5 遺伝子のがん細胞特異的な発現は転写レベルで制御されて いる可能性が見出され、その転写調節領域はがん細胞特異的遺伝子治療へ応用できる 可能性が示唆された。 2. Q5遺伝子発現の転写調節領域の同定 全身的な遺伝子治療に応用することを前提に Q5 遺伝子の転写調節領域の同定を行 い、導入効率が高く、安全性の高いベクターに組み込むことで、特異性の高いがん細 胞特異的発現誘導ベクターの作製が可能と考えた。これを実験的に検証する為に Q5 上流 DNA を単離し、3.9Kb の塩基配列を決定した。決定した配列はデータベースへ の登録申請を行った(2004 年 6 月登録)。また、PAPIA システムの転写因子検索プロ グラムを使用して、既知転写因子結合部位の確認を行った。Weiss 等の報告で既に知 られている-203 ベースまでの転写開始点上流には、免疫系で機能することが報告さ れているクラスI ・レギュラトリー・エレメント(CRE)と、インターフェロン・コ ンセンサス・シークエンス(ICS)を有することが確認できた。続いて、転写調節領域 を同定するために Q5 上流 DNA を様々な長さのフラグメントになるように調整し、
- 4 - それらの下流にluc(ルシフェラーゼ)をレポーターとして配した組換えプラスミド、 lacZをレポーターとして配した組換えアデノウィルスベクターの作製を行った。組換 えアデノウィルスベクターは染色体への組込み機構を持たず、遺伝子発現が一過性で 安全性が高いことから、治療用ベクターとして使用するには適していると考えて選択 した。 これらのプラスミドをin vitroでマウスの様々ながん細胞株にトランスフェクショ ンし、ルシフェラーゼアッセイで転写誘導活性を調べた。その結果、Q5上流DNA の 長さの違いによる特徴的な差異はみられなかったが、いずれも、どのがん細胞株にお いても高い活性を示した。正常組織はマウス生体を用いて確認した。Q5転写調節領域 を利用した組換えアデノウィルスを尾静脈から全身投与し、発現が最も高い 2 日目に 各臓器を採取して凍結切片を作製し、x-gal 染色した結果、どの長さも正常組織での発 現は認められなかった。続いて、がんの組織を調べるため、C57BL/6 マウスに絨毛が んである M5076 細胞を尾静脈から静注して肝転移させた担がんマウスを使用して検 討を行った結果、がん組織ではどのQ5上流DNA の長さでも発現が確認でき、in vitro だけでなく in vivo でも、レポーターの転写ががん細胞特異的であることが示唆され た。追加確認としてRT-PCR での確認も行い、これまでの結果と同様にがん組織のみ でlacZの発現を確認した。これらの結果から、Q5遺伝子の転写調節領域はがん細胞 特異的に機能することが証明された。さらに、ヒトでの応用が可能かを確かめるため に、ヒト細胞株でもルシフェラーゼアッセイで検討を行った。その結果、がん細胞株 ではQ5転写調節領域のどの長さでも高い転写が誘導された。正常2 倍体細胞株 TIG-114 を使用した結果では、Nco I(-829)からHind III(-2667)までの領域で転写 が抑えられることが判った。既に報告されていた-203 ベースまででは強く転写が誘 導されていることから、新たな発見となった。また、AML-1 結合部位が正常細胞での 転写活性低下に影響している可能性も示唆された。 これらの結果より、Q5 転写調節領域と組換えアデノウィルスを組み合わせること で、全身的ながん細胞特異的発現誘導ベクターとして、がん治療に利用できる可能性 が示唆された。 3. 免疫反応を有効利用する検証 有効性の高い治療を可能にするため、このがん細胞特異的発現誘導ベクターの Q5 転 写 調 節 領 域 下 流 に 配 置 す る 遺 伝 子 に つ い て 考 え た 。 我 々 は MHC ( major histocompatibility complex)主要組織適合遺伝子複合体に関する知見から、「MHC class Ia 抗原が古典的な移植抗原として作用し、不適合の場合には移植片の強力な拒
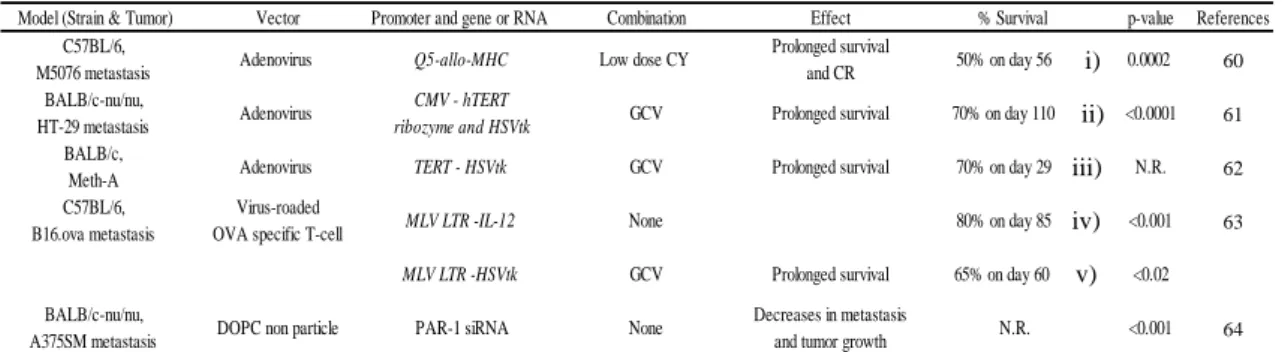
- 5 - 絶反応を示すこと」に着目をした。そして、このアロMHC 遺伝子を治療用ベクター に組み込んで投与し、がん細胞特異的に発現させることで人工的な拒絶反応を引き起 こさせる免疫遺伝子治療剤になる可能性があると考えた。 そこで、治療実験のモデルマウスに H-2b型、H-2k型を使用することを前提に、Q5 転写調節領域下流にはアロ MHC 遺伝子として BALB/c マウスの H-2Ddを配置した 組換えアデノウィルスベクターの作製(Ad/Q5-H-2Dd)を行った。組換えアデノウィ ルスを精製後、その発現は一過性であることを in vitroで確認した。 全身投与による治療実験は、H-2b型である C57BL/6 マウスに M5076 細胞 2×105 個を尾静脈から移植した肝転移モデルを利用した。がん移植5、7 日目に、治療群には 3×109 pfu の Ad/Q5-H-2Ddを投与して経過を観察した。その結果、無治療群は予備 実験通り14 日目までに、空ベクター投与群では 15 日目までに全例が死亡した。一方、 Ad/Q5-H-2Dd 投与群は有意な生存期間延長が認められた。そこで、治癒過程での免疫 反応を細胞レベルで確認するため、細胞傷害性試験で検討した。標的細胞には、M5076 ワイルドタイプと、M5076 に Ad/Q5-H-2Ddを感作させて H-2Ddを発現させた細胞 (M5076/H-2Dd)を使用した。その結果、正常マウス由来脾細胞はワイルドタイプに 対しても傷害性を示したが、M5076/H-2Ddに対しては有意に高い細胞傷害性を示し、 正常マウスはアロ MHC に対する反応が強いことが確認できた。次に、治療実験で生 存していたマウスから採取した脾細胞と担がんマウスの脾細胞を用い、無治療群が全 例死亡した時期の解析を行った結果、ワイルドタイプに対する細胞傷害性が、先の正 常マウスの結果よりも有意に低く、担がん状態では免疫能が低下していることが認め られた。一方、M5076/H-2Ddに対しては正常マウスと同程度であり、アロMHC に対 する免疫反応は、無治療群の担がん状態でも低下していないことが確認された。 これらの結果から、Q5転写調節領域下流にアロMHC 遺伝子を配置した Ad/Q5-H-2Ddの全身投与は、陰性対象群と比較して有意な生存期間延長を示し、その効果は最 強の免疫誘導機構である同種移植片拒絶反応(アロ MHC に対する反応)によるもの であることが確認された。 4. 免疫抑制解除の効果、および二次獲得免疫誘導の検証 Q5 転写調節領域とアロ MHC 遺伝子を利用した組換えアデノウィルスの全身投与 による遺伝子治療で有意な生存期間延長が認められたが、さらに治療効果を高めるこ とが可能と考えた。近年、担がん状態では免疫が抑制状態であり、がんの増大や治療 効果の低下の原因になっていることが示唆されている。この免疫抑制を解除すること が出来れば、より高い治療効果を得られる可能性がある。そこで、現在では免疫抑制
- 6 - に 関 わ る 抑 制 性 T 細 胞 ( Treg ) の 活 性 を 抑 制 す る こ と が 明 ら か に さ れ て い る Cyclophosphamide(CY)を、副作用の起こらない低用量を投与することで免疫抑制 を解除しつつ、Ad/Q5-H-2Dd との併用効果を検討した。M5076 肝転移モデルを利用 し、治療群はがん移植後 3 日目に通常の 1/10 量の CY を腹腔内投与、8、10 日目に Ad/Q5-H-2Ddの全身投与を行った。その結果、無治療群は 14 日目までに全例が死亡
し、CY 単独群も 15 日目までに全例が死亡した。一方、CY と Ad/Q5-H-2Dd併用群
では 70%のマウスが 35 日以上生存する有意な生存延長が認められ、併用の効果を確 認することが出来た。 ここで、組換えアデノウィルスが全てのがん細胞に導入されていないにも関わらず、 がんが治癒していることから、生存しているマウスには M5076 ワイルドタイプを拒 絶するメモリー細胞が誘導されていると考えた。そこで、併用の検証で 35 日目に生 存していたマウスにM5076 ワイルドタイプの再移植を行い、Ad/Q5-H-2Dd の投与は 行わず、腫瘍を拒絶することが可能か検証を行った。その結果、M5076 を再移植して 無治療にも関わらず、治療を行った時と同様の有意な生存期間延長が認められた。こ の治癒過程での免疫反応を確認するために、再移植約3 週間後に生存していたマウス
を用いて解析を行った。NK(Natural Killer)細胞や細胞傷害性 T 細胞(cytotoxic T lymphocyte : CTL)など細胞性免疫誘導の指標である IFN-γ、抗体産生等に関わる 液性免疫誘導の指標である IL-4、Treg 誘導等に関わる免疫抑制の指標である IL-10 の産生細胞について、各脾細胞を用いたELISpot assay で調べた。その結果、併用群 では細胞傷害性に関与する IFN-γ、及び IL-4 産生細胞が多く、IL-10 の産生細胞は 少ないことが確認出来た。この結果から、CY により Treg の活性が抑制され、誘導・ 獲得された免疫が効果的に働いているものと考えられた。続いて、細胞傷害性の検証 を行った。NK 細胞の表面マーカーである CD49、CTL が存在するかを確認するため のキラーT 細胞の表面マーカーである CD8a、其々のビーズで脾細胞の選別を行い、 標的細胞にM5076 ワイルドタイプを使用した。その結果、NK 細胞の細胞傷害性は正 常マウスと治癒マウス共に高く、有意差はなかった。一方、CD8+T 細胞の細胞傷害性 は治療マウスが有意に高く、ワイルドタイプが元々発現しているがん抗原を認識して いる、つまりCTL が誘導されているものと考えられた。 これらの結果から、がん細胞特異的アロMHC発現遺伝子治療剤の効果と、免疫抑 制解除による治療効果の増強が明らかとなった。その機序として、治療初期反応はが ん細胞特異的な同種移植片拒絶反応によるものであり、その後、二次的に誘導・獲得 されたがん抗原を標的とした抗腫瘍免疫反応の結果によるものであることが示唆さ れた。
- 7 - 総合考察 本研究により、がん細胞特異的な遺伝子発現機構と免疫反応の有効利用による新し い免疫遺伝子治療を考案し、それによって全身投与可能でがんの再移植も拒絶する高 い治療効果を示すことが出来た。特に、再移植したがん細胞を排除できたことから、 臨床における再発予防効果をも付与できる革新的な治療法になりうることが予想さ れる。現在では、遺伝子治療だけではなく、再生医療にも応用される安全性の高いウ ィルス由来高分子や、ナノテクノロジーに基づくさらに安全性の高い材料の DDS 開 発も精力的に進められていることから、将来、この新しい治療概念に基づく製剤が実 用化されることが期待される。
- 8 - 序論 2014 年の日本における死亡原因の第 1 位は悪性新生物、がんである。戦後より増加 を続け、1980 年に脳血管疾患と代わって死因の第 1 位となって以降、第 2 位の心疾 患の約2 倍である(厚生労働省発表)。また、がん罹患者数も様々ながん種で男女とも に年々増加し、2 人に 1 人はがんに罹患する(国立がんセンター発表)。がんの標準的 な治療法としては、手術による外科治療、放射線治療、抗がん剤などによる化学治療 の 3 手法が主体で行われているが、副作用や QOL の低下、治療効果、再発など様々 な課題がある。 がんの発生の主な原因は、紫外線や化学物質等によるDNA の損傷である。通常は、 DNA 修復酵素により修復されるために、細胞ががん化することはない。また、修復が 追い付かない場合には免疫機構により変異細胞が排除されるが、免疫力が低下してい る場合には排除されず増殖するために、腫瘍を形成すると考えられている。 このような背景から、近年、サイトカインやワクチン、細胞による免疫療法が新た な治療法として広がってきている。中でも、2011 年にノーベル賞受賞で話題となった 樹状細胞(1)を使用した樹状細胞療法がよく知られている。免疫療法は他の治療法と 比較して副作用が少ないため、負担の少ない治療法として期待されている一方で、効 果が緩やかなために安全性や有効性のエビデンスが少なく、普及に時間がかかること が課題となっている。また、がんの免疫治療で障害となっているのは、制御性 T 細胞 (Treg)の存在である。1995 年坂口らによって同定された Treg は、ヒト末梢血中 CD4+ 細胞に 5-10%程度しか存在しないが、免疫抑制機能を持つことが知られている (2)。特に、がん病巣が存在する場合には、Treg の活性が強調されることも報告され ている。このため、免疫療法の効果を十分に発揮させるためには、いかに免疫抑制を 解除するかが重要な課題である。一方、遺伝子治療は1990 年に ADA 欠損症に対する 治療として世界で初めて実施され、翌年にはがんに対しても治療研究が実施されてか ら、新しい治療法として期待されている。しかし、これまで、そして現在でも世界中 の多くの研究者によってがん治療の研究が進められているものの、未だに決定的な治 療法の確立はなされていない。 がんの治療で重要なことはがん細胞のみに細胞傷害を起こすことであり、遺伝子治 療でも同様であるため、がん細胞のみで発現する特異的プロモーターが必要である。 また、臓器移植で生着を妨げる最大の問題となる現象でもあり、最も強力な免疫反応 を生ずるのは同種異型(アロ)のMHC を認識した場合である。そして、このアロ MHC をがん細胞に特異的に発現させれば二次的に強力な抗腫瘍免疫反応をも誘導でき、転
- 9 - 移巣も含めた全身的な治療が可能になると仮説をたて、以下のように研究を進めた。 1) Q5遺伝子のがん細胞特異的発現解析 2) Q5遺伝子発現の転写調節領域の同定 3) Q5遺伝子の転写調節領域と免疫誘導機構を利用する遺伝子治療効果の検証 本研究では免疫抑制を解除しつつ、最強の免疫反応誘導機構を有効利用したがん細胞 特異的な遺伝子治療をマウスモデルで試みた。
- 10 - 第1 章 Q5遺伝子のがん細胞特異的発現解析 1.1 <序論> マウス主要組織適合抗原遺伝子(MHC)は、古典的遺伝子(クラスⅠa;H-2)、及 び非古典的遺伝子(クラスⅠb;Q 及び TL)で構成されている。クラスⅠb 遺伝子群 は、第17 番目染色体の Qa 及び Tla 遺伝子領域に分布している。Qa 領域は、クラス Ⅰa 遺伝子領域に隣接して配置している。クラスⅠa 遺伝子は高い多型性がある一方、 クラスⅠb 遺伝子は保存されている。C57BL/6(H-2b)マウスの場合、Qa 領域は 10 個の遺伝子(Q1~Q10、Q3が偽遺伝子である)を含有し、Tla 領域は 29 個の遺伝子 (TL1~TL29)を含有することが報告されている(3)。両遺伝子産物は原形質膜に存 在し、遺伝的に保存されたβ-2 ミクログロブリンとして知られている 1.2 kDa の軽鎖 と会合する、グリコシル化された3.7~4.1 kDa の重鎖を構成する。我々は、クラスⅠ b 遺伝子発現の調節とその産物の生理的役割に関して、限られたことしか知り得てい ない。 江川らはこれまでに、Qa-2 陰性 H-2kマウス由来の実験的がん細胞は、一般的に(す べてではないが、いくつかの Qa-2 特異的モノクローナル抗体(mAb)よって検出さ れる)細胞表面分子を発現することを報告している(4, 5)。Qa-2 抗原は、特定のマウ ス系統のリンパ球表面上に発現している正常アロ抗原である(6-8)。Qa-2 抗原の重鎖 は、1 つのヌクレオチドのみによって互いに異なる Q7 又は Q9 遺伝子の産物である (9, 10)。H-2kマウス(例えばC3H/He、AKR など)の Qa-2 領域におけるQ6~Q9 遺伝子を含むサブ領域は欠損し、5 つの Qa 遺伝子(Q1、Q2、Q4、Q5、Q10)とQ3 偽遺伝子だけ残っていることが報告されている(11, 12)。従って、Qa-2 特異的 mAb によって検出された H-2k マウス由来がん細胞表面上のいくつかの抗原は、少なくと も Q7 又は Q9 遺伝子の産物ではない。江川らは、そのような抗原分子の重鎖をコー ドする遺伝子がQ5遺伝子であることを示した(4)。 そして、がん細胞表面上のQ5遺伝子産物(Q5 抗原)は、同系腫瘍を有するマウス に対する液性免疫反応を引き起こすことが報告された(5)。また、Q5 抗原特異的免疫 は、Q5 抗原陽性がん細胞の移植と転移に対する防御をもたらした(13)。これらの結 果は、マウスが Q5 抗原に対して寛容ではないことを示唆している。そのため、少な くとも成体マウスにおいては、Q5 抗原の発現はがん細胞特異的であると思われた。一 方、Q5遺伝子転写産物は、正常な成体 AKR マウスから得られた胸腺細胞、及び末梢
- 11 -
血単核球細胞(Peripheral blood mononuclear cell: PBMC)で、ノーザンハイブリダ イゼーションや他の方法によって検出されたことが報告されている(14, 15)。
本研究では、逆転写ポリメラーゼ連鎖反応(Revers transcription-polymerase chain reaction: RT-PCR)による cDNA 増幅と、増幅産物の塩基配列の決定によって Q5遺 伝子の転写を調べることから始めた。また、様々な系統のマウスから樹立されたがん 細胞株と、様々なマウス系統から得た個々の臓器における Q5 転写を調べた。その結 果、Q5 遺伝子の転写産物は H-2kのマウスから得た胸腺細胞及び PBMC のみで検出 され、その転写産物は細胞株が由来するH-2 ハプロタイプに関わらず、試験したすべ てのがん細胞株において検出された。Q5の転写が検出されたAKR マウス PBMC の 表現型は、さらなる解析を試みた。
- 12 - 1.2 <方法>
1.2.1 動物、細胞株、及び種々の組織の単離
全てのマウスの研究は、株式会社メディネット動物実験委員会(メディネット先端 医学研究所、東京都)の承認の下、動物倫理指針に基づいて実施した。7 週齢雄の、 AKR(H-2k)、BALB/c(H-2d)、C57BL/6(H-2b)、C3H/He(H-2k)マウスはSLC 株 式会社(静岡県)から購入した。これらのマウスは生後 10~12 週齢で使用するまで、 標準的な実験用飼料と水を自由に与えて特定病原体フリー(SPF)の環境下で飼育し た。
血液はヘパリン処理シリンジを用いて、エーテル麻酔下で心臓穿刺により採取した。 末梢血リンパ球(PBMC)は Lymphoprep(Nycomed Pharma 社、Oslo、Norway) を用いて、採取した血液から調製した。 様々な担がん臓器は、採血後のマウスから摘出した。BW5147 胸腺腫細胞担がん AKR マウス、及び MH134 肝がん担がん C3H/He マウスの PBMC、及び組織は、10 週齢のマウスに 2×105 cells の各々のがん細胞を皮下接種し、その 7 日後に得た。 C3H/He マウス由来 L929 線維肉腫、MH134 細胞株は、山崎博士(帝京大学薬学部、 神奈川県)から譲り受けた。C3H/He マウス由来 MM2 乳がん、MH134 細胞株は、 C3H/He マウスでの継代によって維持した。BW5147 細胞株は、in vitro での培養で 維持した。W2K 細胞株は、C3H/He マウス由来 C3H.2K 腎線維芽細胞株を SV40 で 形質転換したもので、in vitroで悪性増殖を示す(16, 17)。この細胞株は、山口博士 (東京大学医科学研究所、東京都)から譲り受けた。L929 と W2K 細胞は、それぞれ 5%、または 10%ウシ胎児血清(FBS)を添加したダルベッコ最少必須培地(D-MEM) を用いて in vitro で維持し、3~4 日毎に継代した。C3H/He マウス由来 MBT2 膀胱
がん細胞株、BALB/c マウス由来 BALB-MC.E12 乳がん細胞株、WEHI-3 骨髄性単球 性白血病細胞株、Y-1 副腎がん細胞株は、日本セルリソースバンク(JCRB)から入手 した。MBT2、BALB-MC.E12、WEHI-3 は、10% FBS を添加した D-MEM で培養し た。Y-1 細胞は、10% FBS を添加した Ham’s F10 培地で培養した。 1.2.2 RNA の単離 上記のように調製した新鮮なPBMC は、遠心分離後、氷冷生理食塩水で洗浄した。 単離された新鮮な臓器は、0.5mM の EDTA を含有する氷冷生理食塩水で洗浄した。 全ての細胞からLSI Isogen 試薬(ニッポンジーン社、東京都)を使用して、製造業者 の説明書に記載の方法で、Total RNA を抽出した。これらの Total RNA 画分を、RNase
- 13 - を用いて精製した。
1.2.3 RT-PCR 解析
cDNA の合成は、以下のように製造業者の説明書に従って実施した。鋳型として total RNA を 200ng、プライマーとしてランダムヘキサマーまたは Oligo dT12-18、 SUPERSCRIPT ⅡRNase H-逆転写酵素(Gibco BRL 社、Gaithersburg、USA)を反 応液と混ぜた。この反応混合物を用いて、PCR 反応を行った(29)。マウスグリセル アルデヒド-3 -リン酸デヒドロゲナーゼ(G3PDH)と5 つの Q 遺伝子(Q1、Q2、Q4、 Q5及びQ10)のcDNA を検出するために使用したプライマーは、表 1 に示した。そ れらのプライマーは、アマシャムバイオサイエンス社(東京都)に合成依頼したもの である。cDNA の増幅は、ExTaq 酵素(タカラバイオ社、滋賀県)を用いて行った。 94℃で 1 分間の変性後、35 回の増幅サイクルを行った。1 サイクルは、60℃(G3PDH)、 64℃(Q1、Q2、Q4、Q10)、66℃(Q5)で1 分、72℃で 1 分、94℃で 30 秒とした。 1.2.4 PCR 増幅された DNA のクローニング、及び配列決定
増幅した DNA 断片を電気泳動したアガロースゲルから切り出し、Quantum Prep Freeze DNA Gel Extraction Spin Columns(BioRad 社、California, USA)を用いて DNA を抽出した。DNA を T4 DNA ポリメラーゼ、及び T4 ポリヌクレオチドキナー ゼで処理した後、Ligation Pack kit(ニッポンジーン社)を用いて pUC118 のSmaI
部位に挿入した。JM109 大腸菌は組換えプラスミドで形質転換し、形質転換細胞をク
ローン化した。プラスミド DNA をその大腸菌から抽出し、解析した。シーケンス解
析は、ABI PRISM BigDye Terminator Cycle Sequencing Ready Reaction kit と ABI PRISM 310 Genetic Analyzer (Applied Biosystems 社, California, USA) を用いて行 った。
1.2.5 細胞分画
T 細胞画分は、抗 CD45、抗 CD49b、抗 CD11b、抗 TER-119 モノクローナル抗体 が 結 合 した ビ ー ズ が 混 合 さ れ てい る Pan T 細胞単離キット(Miltenyi Biotec 社, Gladbach、Germany)を使用し、健常な AKR または C3H/He マウスから得た PBMC または胸腺細胞から調製した。T 細胞画分、及び非 T 細胞画分は、製造業者の説明書 に従って単離した。CD4+ 細胞、及びCD8+ 細胞は、抗マウスCD4(L3T4)または抗 マウスCD8a(Ly は-2)モノクローナル抗体と結合した磁気ビーズ(MACS システム、 Miltenyi Biotec 社)を用い、AKR マウスの PBMC から分画した。
- 14 -
1.2.6 フローサイトメトリー解析
リンパ球表面マーカー分子の発現の検出は、フローサイトメーター(Epics XL、 System Ⅱ)を用いて行った(Beckman Coulter 社、California、USA)。モノクロー ナル抗体は以下を使用した。FITC 結合抗マウス CD3- ɛモノクローナル抗体(hamster IgG1、k、BD Biosciences 社、California, USA)、アイソタイプ一致コントロールと してFITC 結合抗 TNP モノクローナル抗体(hamster IgG1、k、BD Biosciences 社)、 FITC 結合抗マウス CD4 モノクローナル抗体(rat IgG2b、Beckman Courter 社)、 アイソタイプ一致コントロールとして FITC 結合ラット IgG2b モノクローナル抗体 (Beckman Courter 社)、PE 結合抗マウス CD8 モノクローナル抗体(rat IgG2a、 Beckman Courter 社)、アイソタイプ一致コントロールとして PE 結合ラット IgG2a (Beckman Courter 社)。
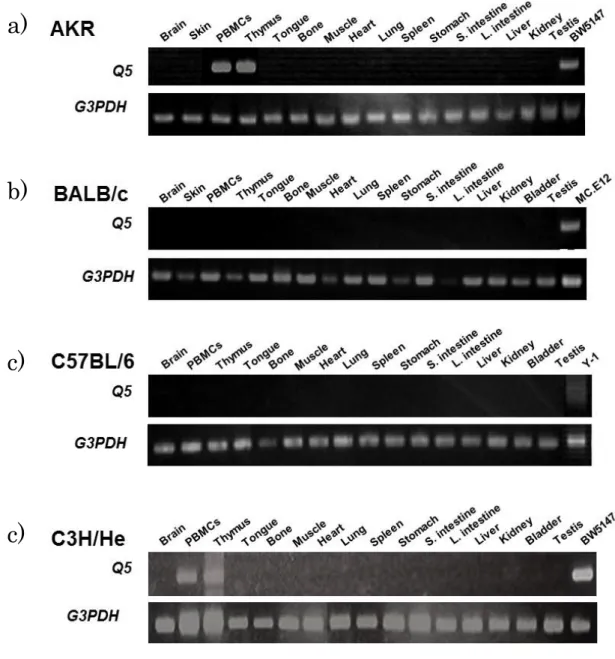
- 15 - 1.3 <結果> 1.3.1 がん細胞株におけるQ5遺伝子の転写 初めに Q5 遺伝子の転写が一般的に生じているかを示すために、様々なマウスのが ん細胞株においてQ1、Q2、Q4、Q5、Q10の遺伝子の発現を調べた。我々は、C3H/He マウスで報告されている遺伝子の DNA 配列に基づいて設計した特異的プライマー (表1)と各細胞株から抽出した RNA サンプルをテンプレートとして使用して、RT-PCR 解析を行った。がん細胞株には、6 種類の H-2k、1 種類の H-2b、1 種類の H-2d、 及び1 種類の H-2 不明のものを使用した。またそれらは、in vitroでの培養や、in vivo での継代によって維持していたものである。結果は図1. A に示すように、Q5遺伝子 の転写は Y-1 を除き、様々ながん細胞株において検出された。Q5 転写産物が検出さ れた細胞は、H-2 ハプロタイプの k と d のものを含んでいた。Q5 抗原分子のアミノ 酸配列は、マウスの様々な系統の間で保存されているが、Q5遺伝子のヌクレオチド配 列は、H-2 ハプロタイプによっていくつかの不均一性を有している。 我々は、文献にY-1 細胞の起源を追跡することができなかったが、H-2bマウスでQ5 転写産物を増幅するように設計されたプライマーを用いたところ、Q5転写物はY-1 細 胞で検出された(図1. B)。Q5の転写は全ての場合において、増幅 DNA の配列決定 により確認した。結果の塩基配列は、報告されている各H-2 ハプロタイプのマウスの 配列と一致した(Genebank:登録番号 X16423)。従って Q5 遺伝子の転写は、試験 した全てのがん細胞株において確認することが出来た。一方、Q1、Q2、Q4、Q10遺 伝子の転写は、試験した全ての細胞株において検出できなかった。 1.3.2 正常成体、担がんマウスからの様々な臓器、及び細胞における Q5遺伝子の転 写の検出 Q5 遺伝子の発現が転写調節下に生ずるか検討するために、様々な正常成体マウス から単離した各臓器から total RNA サンプルを調整し、RT-PCR によって解析した。 マウスには正常AKR、C3H/He、BALB/ c、C57BL/6 に加え、同系 BW5147 胸腺腫細 胞を移植したAKR、同系 MH134 肝がん細胞を移植した C3H/He を使用した。担がん マウスは、がん細胞を皮下移植し、腫瘍が直径 5-7mm に達したときに屠殺した。H-2k、H-2d、H-2b細胞内におけるQ5転写産物の存在は、H-2k、H-2d、H-2bマウス各々 の Q5 配列を検出するために設計したプライマーを用いて、各マウスから得られた RNA サンプルで調べた。正常成体での結果を、図 2 に示した。Q5転写産物は、AKR とC3H/He マウス(ともに H-2k)のPBMC、及び胸腺に由来する RNA サンプルのみ で検出された。さらに、増幅されたDNA の塩基配列を確認することで、Q5遺伝子の
- 16 - 転写産物であることを確認した。これらの細胞以外では、試験した臓器のいずれにお いてもQ5転写産物は検出されなかった。これらの結果から、Q5遺伝子の転写は、が ん細胞、胸腺細胞、及びPBMC に限定されることを明らかにした。従って、様々なが ん細胞の表面上Q5 抗原の発現は、転写制御の結果である。 さらに、担がんマウスでの確認を行った。Q5 転写産物は担がん AKR の PBMC で は検出されたが、担がんAKR の胸腺、担がん C3H/He の胸腺と PBMC では検出でき なかった(図3)。これらの結果は、担がん状態では、何らかの形でこれらの細胞にお けるQ5転写が妨げられることを示唆している。 1.3.3 Q5転写とAKR マウス PBMC の表現型 上記のように、Q5転写産物は、基本的に全てのがん細胞において検出された。正常 成体の臓器や細胞での唯一の例外は、AKR と C3H/He マウスの胸腺、及び PBMC だ けであった。AKR マウスは加齢により自発的な胸腺腫を生じ(19-22)、組織適合性ク ラスⅠb 胸腺白血病(TL)抗原の加齢に伴う発現が見られる(23)ことが知られてい る。我々が使用したAKR マウスはまだ病気を発症していなかったが、AKR マウス胸 腺における Q5の転写は、前胸腺腫細胞の可能性があり、AKR マウスの PBMC で検 出された転写産物は、血液中に前胸腺腫細胞が移動したものと推測している。 我々は、Q5の転写産物が検出されたAKR の PBMC の表現型を明確にし、AKR 由 来BW5147 胸腺腫細胞株のそれとの比較を試みた。AKR の PBMC を得て、CD45R+、 CD49b+、CD11b+、Ter-119+ 細胞を除くことによるネガティブセレクションで T 細胞 を得た。図4. A - a, b に示すように、T 細胞画分中の 96.4%の細胞が CD3+であり、非 T 細胞画分中の細胞の 96.1%が CD3- であった。得られた細胞は、RT-PCR によって Q5 転写産物の検出を行った。転写産物はT 細胞、及び非 T 細胞画分の両方で、ほぼ 同程度に検出された(図4. B)。一方、胸腺細胞から同じ方法で得た T 細胞、及び非 T 細胞分画は、両者とも CD3 強陽性細胞、CD3 弱陽性細胞、及び CD3 陰性細胞を含 有していた(図4. A-c, d)。 Q5転写産物は胸腺細胞の非T 細胞画分において検出さ れなかった(図4. E)。 また、CD4+ 細胞、及び CD8+ 細胞を、それぞれ CD4 特異的 mAb または CD8 特 異的mAb と結合した磁気ビーズを用いて、PBMC から単離した。図 5. A に示すよう に、Q5 転写産物は CD4+ 細胞(FCM 分析により 98.8%、データは示していない)、 またはCD8+ 細胞(FCM 分析により 99.7%、データは示していない)のいずれにおい ても検出されなかった。これらの結果は、Q5 の転写が T 細胞マーカーに関連してい ないことを示唆している。同様の実験で、AKR マウス由来胸腺腫細胞株 BW5147 は、
- 17 - CD3-、CD4-、CD8- 細胞であることが示された(図 5. B)。AKR マウス胸腺細胞と PBMC で Q5が転写される細胞は均質ではなく、おそらく CD3-4-8- 胸腺腫細胞に 関連する CD3-4-8- プレ胸腺腫であると思われる。細胞のさらなる特徴付けは、細 胞の量や Q5 抗原に対する適切な特異的 mAb が存在しておらず、この段階では成し 得なかった。 我々は、自発的な胸腺腫を産生しない別のH-2k、C3H/He マウスの様々な臓器、及び 細胞におけるQ5遺伝子の転写を調べた。 我々の予想に反して、Q5転写物は C3H/He マウスの胸腺と PBMC において検出された。この結果は仮説を支持しておらず、Q5 転写細胞は前胸腺細胞であり、この現象は多かれ少なかれ、マウスのH-2kハプロタイ プに関連していることを示唆している。胸腺、PBMC、その他の様々な臓器における Q5遺伝子転写は、同系腫瘍の皮下移植 7 日後の担がん AKR マウスや C3H/He マウ スでも検討した。この結果、AKR マウス胸腺だけでなく、C3H/He マウスの胸腺、及 びPBMC 中でもQ5の転写が行われなくなることが解った。このようなQ5転写調節 機構が重要であるか否かは、現時点では明確ではない。
- 18 - 1.4 <考察> これまでの論文では、Q5 転写産物は AKR マウス由来胸腺腫細胞株 BW5147 にお いて RT-PCR で検出され、AKR マウス胸腺では検出されていないと報告されている (4)。この結果は、AKR マウス胸腺に関して今回の結果とは異なっていた。この不一 致は、Q5 cDNA に使用されるプライマーの親和性の差による可能性が考えられる。 Q5 転写量が低い細胞では、親和性の高いプライマーを用いた場合に転写産物を検出 することができるが、 BW5147 では、低い親和性のプライマーを使用した時でさえ も十分検出されるようである。AKR マウスにおいてQ5の転写について示された報告 がある。Schwemmel らは、Q5転写産物はAKR がん細胞、AKR 胎児、及び若年 AKR の胸腺において検出されたことを報告している(14)。また Reyes-Engel らは、 Q5
転写産物はAKR のがん細胞、1-2 週齢 AKR マウスの胸腺、5-7 週齢 AKR マウスの精 巣で認められると報告している(15)。これらの結果は、ノーザンブロット法、または、 RNase protection assay により得られている。互いに高い相同性のある ClassⅠ遺伝 子は数が多いため、他のClassⅠ cDNA に使用されるプローブの交差反応性に起因す る可能性がある。こうした曖昧さが存在するため、上記に示した結果を得るために新 しくプライマーを設計し、より詳細に Q5の転写について検証した。また、我々は RT-PCR により増幅した cDNA の配列を確認することで Q5 遺伝子の転写を明確に示し た。 我々の結果は、Q5 遺伝子の転写が厳密にはがん細胞特異的でないことを示唆して いる。一方で、がん細胞の表面に発現した Q5 遺伝子産物は同系宿主に対する免疫原 性を持っていることが示されている。胸腺細胞とPBMC では転写後の制御があり、こ れらの正常細胞の表面に Q5 抗原分子が発現するのを阻害していると予測できる。し かし、Q5抗原に対する正確な特異性を有する mAb を得ることが困難なために、仮説 を明確にすることは、現時点では難しい。成体胸腺、及びPBMC におけるQ5遺伝子 の転写は、担がんマウスにおいては低下している。いくつかのがん化に関わる細胞環 境中のサイトカインの変化が転写に影響を与える可能性があるが、この現象を生ずる 機構は明確にされていない。AKR マウスの胸腺と PBMC だけではなく、C3H/He マ ウスの胸腺とPBMC におけるQ5遺伝子の転写は、調整した細胞における前胸腺腫細 胞の可能性よりも、むしろH-2kのハプロタイプに関係する事象であると、我々は推測 する。しかしながら、これらはまだ可能性に過ぎず、C3H/He マウス胸腺及び PBMC は前胸腺腫細胞を含有し、がん化を制御する何らかの理由があるのかもしれない。こ れが事実であった場合には、Q5遺伝子の転写は、がん細胞中、または前がん細胞中の いずれかで生ずるものであると言える。
- 19 -
表1. Q遺伝子の転写を検出する為のPCR で使用したプライマー
Table I. Primers for PCR.
Gene Sense Primer (5’ to 3’) Antisense Primer (5’ to 3’) Size
Q1k TGACCCTGACCAAAACCGGAG CCCTCCAGGTAGGTCCTGTG 499 Q2 k CCGGACCCAGAACCGAGCC CTTGTAATACTCTGCAGCACCAT 481 Q4 k AGTCGCCCAGACCCTGATCG CCCTCCAGGTAGGCCTTGCT 505 Q5 k CTCTGACCCAGACCCGCGCT TTCGCCTTTCAGGAAGTCCTC 509 Q5b TTCCAAGGGAGCCTGAGGACT TGCGACCTCCAGGTAGGCCC 270 Q10 k CCCGACCCAGACCCAGGCA CCACTTGCGTCGGGTGATAATC 450 G3PDH TCCACCACCCTGTTGCTGTA ACCACAGTCCATGCCATCAC 452
- 20 - 図1. RT-PCR を用いた様々ながん細胞株での解析 A. 種々ながん細胞株でのQ遺伝子の転写の検出 Q1k,Q2K,Q4k,Q5k,Q10kに特異的なプライマーを用いた。解析した細胞株は、図 の上部に示している。 B. Y-1 細胞株での Q5 遺伝子の転写の検出 Q5bに特異的なプライマーを使用した。「M」は分子量マーカーを表している。G3PDH 特異的プライマーは、酵素の転写を検出するポジティブコントロールとして使用した。
A.
B.
- 21 -
図 2. 各種マウス系統から得られた様々な臓器および細胞における RT-PCR による
Q5遺伝子の転写の検出
マウスは、a) AKR、b) BALB/c, c) C57BL/6、c) C3H/He を使用し、臓器を得た。そ れぞれ Q5k,Q5K,Q5b,Q5k 特異的なプライマーを使用した。臓器および細胞は、 図の上部に示した。BW5147、MC.E12(BALB-MC.E12)、Y-1 がん細胞株はポジティ ブコントロールとして使用した。また、G3PDH 特異的プライマーは、ポジティブコ ントロールとして使用した。
a)
c)
b)
c)
- 22 - 図 3. 担がんマウスから得られた様々な臓器および細胞における RT-PCR による Q5 遺伝子の転写の検出 担がんマウスは、a) BW5147 がん細胞株を移植した AKR、b) MH134 がん細胞株を 移植した C3H/He を使用し、Q5kに特異的なプライマーを使用した。G3PDH 特異的 プライマーは、ポジティブコントロールとして使用した。
a)
b)
- 23 - 図 4. AKR マウス PBMC 及び胸腺細胞から得られた T 及び非 T 細胞画分のフロー サイトメトリー解析と RT-PCR によるQ5遺伝子の転写検出 A. 各パネルは a) PBMC からの T 細胞画分、b) PBMC からの非 T 細胞画分、c) 胸腺 からの T 細胞画分、d) 胸腺からの非 T 細胞画分を示している。各細胞分画は、材料 および方法に記載したようにPan-T 細胞単離キットを用いて行った。得られた細胞は 抗CD3 モノクローナル抗体で染色し、フローサイトメトリー解析を行った。 B. PBMC からの T 細胞画分(レーン 1)、PBMC からの非 T 細胞画分(レーン 2)、 胸腺細胞からのT 細胞画分(レーン 3)、胸腺細胞からの非 T 細胞画分(レーン 4)を 示している。Q5k特異的なプライマーを用いた。 また、G3PDH 特異的プライマーは、 ポジティブコントロールとして使用した。
a)
c)
b)
d)
A.
B.
- 24 - 図5. AKR の PBMC から単離した CD4+および CD8+細胞の RT-PCR によるQ5遺伝 子の転写とBW5147 がん細胞株の表現型の検出 A. プライマーは、図 4 と同様の Q5k特異的なプライマーを用いた。 また、G3PDH 特異的プライマーは、ポジティブコントロールとして使用した。 B. 方法に記載のように、表現型をフローサイトメトリーによって解析した。
A.
B.
- 25 - 第2 章 Q5遺伝子発現の転写調節領域の同定 2.1 <序論> MHC Class Ⅰa 遺伝子は、ほとんどの正常細胞で発現しており、免疫反応における その役割がよく理解されている。一方、いくつかの class Ⅰb 遺伝子は組織特異的に 転写されるのみで、他の正常な成体組織において転写されない。その生理的な役割は 解明されていない。 Qa-2 抗原の重鎖は、Qa 遺伝子領域におけるQ7または Q9遺伝子の産物である(24, 25)。 Q7、及び Q9 遺伝子産物は、生化学的に互いに区別することができる。また、 Ped(着床前胚発生)遺伝子として報告されており、それらは胚発生において重要な 役割をしている(26)。Comisky らは、HLA-G は Ped 遺伝子産物の機能性ヒト相同 体(ホモログ)であることを提唱している(27)。いくつかの Qa-2 特異的 mAb によ って検出されたがん細胞表面分子は、Qa-2 抗原と同一ではない。そして、その分子の 重鎖はQ5遺伝子産物である(4)。このがん細胞分子(Q5抗原)は、担がんマウスに おける免疫応答を誘導し(5)、2 陽性共通マウス由来の 2 陽性リンパ球で Qa-2 陰性マウスを免疫すると、Qa-Qa-2 陰性かつQ5陽性腫瘍に対して免疫的保護が誘導さ れる(28)。これらの結果は、マウスが Q5抗原に寛容ではないことを示唆している。 江川らはこれらの知見に基づいて、少なくとも成体マウスにおいて、Q5抗原の発現は がん細胞特異的であると仮定した。 H-2bマウス Qa 領域は 10 個の遺伝子、すなわち Q1b~Q10bで構成されているのに 対して、H-2kマウスは6 個の遺伝子、すなわち Q1k、Q2k、Q3k、Q4k、Q5k、Q10kで 構成されている。Q3bとQ3kは擬似遺伝子であり、Q5k遺伝子は Q5k遺伝子の5’主要 部と Q9k分子と同一の C 末端アミノ酸配列をコードする推定上の Q9k遺伝子 3’部と の融合である。 Q5b、及びQ5k遺伝子の塩基配列は決定されている(11, 12)。 Q5転 写物は、成体マウス由来リンパ球、胎児、及び新生児マウスからの正常組織、及び細 胞において検出されている(14, 15)。これらの結果は AKR 系統のマウスのみの実験 結果であるため、我々は以前の論文(第1 章)で、他の系統の成体マウスにおけるQ5 遺伝子の転写を検討した。転写物は AKR と C3H/He マウス(共に H-2k)のPBMC、 及び胸腺が検出されたが、C57BL / 6(H-2b)、及びBALB / c(H-2d)マウスでは検出 されなかった。これらの系統の成体マウス由来正常器官や組織を調べた限り、転写産 物は全てにおいて検出されなかった(29)。これは、PBMC と胸腺における発現が本 当に系統特異的であったかどうか、または、これらの細胞の活性化状態に依存してい
- 26 - たかどうかは、明確にするには至っていない。 これまでに、Q5 上流 DNA による AKR マウスリンパ球でのQ5遺伝子発現調節に ついての研究が成されてきている。結果として、転写開始位置上流-203 及び -1 の間 の DNA 領域に含まれる配列は、遺伝子の発現に寄与していることが示唆されている (14)。この領域は、クラスⅠ・レギュラトリー・エレメント(CRE)、及び KFB1/H2TF1 が含まれ(30, 31)、NFκB は含まれていない(32)。- 203 よりも上流の DNA 配列が 遺伝子発現に関わっているのか、また、がん細胞での優勢な転写に寄与するかどうか は不明のままである。 本稿では、Q5 上流 DNA(位置-3904~+22)の配列特徴と in vitro で培養したマ ウスがん細胞、ヒトがん細胞、ヒト正常細胞を使用したルシフェラーゼレポーター遺 伝子アッセイによる-2667~+22 の領域の転写誘導活性の実験の結果を示す。また、 我々は、lacZ遺伝子がQ5 上流 DNA 断片の調節下に置かれた組換えアデノウィルス を構築した。正常、及び担がんマウスに組換えウィルスを投与後、様々な組織や細胞 におけるlacZ遺伝子の転写の有無をRT-PCR で、また、β ガラクトシダーゼの有無を 形態学的に検討した。さらに、Q5 上流 DNA の下流にルシフェラーゼレポーター遺 伝子を配した組換えレンチウィルスを調整し、ヒト正常 PBMC 構成細胞での転写活 性についても検討を行った。
- 27 - 2.2 <方法> 2.2.1 動物、及び細胞株 すべてのマウスの研究は、株式会社メディネット動物実験委員会の承認の下、動物 倫理指針に基づいて実施した。雄の AKR(H-2K)、C3H/He(H-2K )、C57BL/6(H-2b)マウスは、7 週齢で SLC 社から購入し、メディネット先端医学研究所内の動物実 験室にて、SPF の状態で維持した。これらのマウスは約 8 週齢で使用した。 BW5147 胸腺腫細胞株、及び M5076 卵巣胞体肉腫細胞株は、瀬尾博士(浜松医科 大学、皮膚科学、静岡県)から譲り受けた。MH134 細胞株、L929 線維肉腫は、山崎 博士(帝京大学薬学部)から譲り受けた。Colon-26、A4、及び RL7 細胞株は、東北 大学加齢研究所から購入した。A4 は変異 c-erb B-2 によって形質転換された細胞株で あり、RL7 は野生型 c-erb B-2 によって形質転換された細胞株である。DU145 ヒト前 立腺がん細胞株は東博士(東京大学 細胞療法移植医学、東京都)から譲り受けた。 MDA-MB-231 ヒト乳がん細胞株は、高橋博士(札幌医科大学 第一内科学、北海道) から譲り受けた。F9 胚性がん細胞株(JCRB0721)、及び WEHI-3 単球性白血病細胞 株(JCRB9093)は、ヒューマンサイエンス研究資源バンク(HSRRB、大阪府)から 購入した。HeLa 子宮頸がん細胞株、293 腎臓がん細胞株、WiDr 結腸がん細胞株、 TIG-114 正常線維芽細胞株、HT1080 線維肉腫細胞株(それぞれ JCRB 番号 9004、 9068、0224、0534、9113)は、HSRRB から入手した。293 FT 細胞株は Invitrogen 社から購入した。BW5147、MH134、M5076 は、それぞれ同系 AKR、C3H/He、C57BL/6 マウスの腹水継代によって維持した。L929、F9、WEHI-3 は、5%ウシ胎児血清(FBS) を添加したダルベッコ改変イーグル培地(DMEM)で、培養によって維持した。Colon-26 は、10% FBS を添加した RPMI-1640 培地で維持した。A4 及び RL7 は GIT 培地 で維持した。
2.2.2 ゲノムクローンの単離と塩基配列決定
特に明記しない限り、全ての酵素類はタカラバイオ社から購入した。ゲノム DNA は、Blin and Stafford 方法(33)により抽出した。Q5遺伝子の上流DNA は、鋳型 としてゲノムDNA を使用し、nested PCR 法(34)によって得た。
最初のPCR のプライマーセットは、Q4 exon 4、及びQ5 exon 2 の塩基配列に基づ き(図6. a)、以下のように設計した。
Q4 exon 4 : P1 5'-ATCCTCCAAAGGCACATGTGA CATG-3'
- 28 -
反応混合液は、テンプレートDNA(125ng)、各プライマー16 pmol、2.5u の LA Taq を含んでいる。PCR は、GC bufferⅠを用いてタカラバイオ社の説明書に従って行っ た。反応混合物は、95˚C で 1 分間インキュベートし、続いて 95˚C で 30 秒、及び 68℃ で 15 分を 25 サイクル行った。PCR 産物は、PCR モンタージュ遠心分離デバイス (Millipore 社)を用いて、製造業者の説明書に従って、限外濾過によって精製した。 第2 プライマーセットは、Q4 exon 5、及びQ5 exon 2 の配列に基づき、以下のよ うに設計した。 Q4 exon 5 : P3 5'-CGCGCACGGCTTCGCACTTGCATT-3' Q5 exon 2 : P2 5'-TCCACTGTCTCCAACATGGCGAACG-3' 2 番目の PCR は最初の PCR で得られた精製 DNA(生成物の 1/500)を鋳型とし、 LA Taq を使用して行った。その他の条件は、最初の PCR と同様である。生成物をア ガロースゲル電気泳動したところ、予想通りの 8.3kbp のバンドが検出された。この DNA は、ライゲーションパックキット(ニッポンジーン社)を用いて、pUC118 の SmaⅠ部位に挿入した。
続いて、BW5147 DNA と胸腺 DNA を含むプラスミドを調製した。BW5147 DNA を含むプラスミドは、エレクトロポレーションで大腸菌(JM109 大腸菌)への形質転 換を行い、3 つの DNA クローンを選択した。形質転換体から抽出されたプラスミド DNA は、SacⅠ消化後にセルフライゲーションさせ、再クローニングすることで Q4 exon を含む 4.2kbp の領域の除去を行った。その後、プラスミドの SalⅠ部位に Apa
Ⅰリンカーを挿入した。得られたプラスミドの塩基配列は、一方向欠失(SUD)法(35) によりサイズ分画して決定した。この目的のために、プラスミドを ApaⅠ と XbaⅠ (マルチクローニングサイト領域)で消化後、 5、10、15、20、25 分間エキソヌクレア ーゼⅢ(ExoⅢ)で消化した。消化した DNA 断片を mung bean nuclease と Klenow fragment で処理し、アガロースゲル電気泳動によって精製後にセルフライゲーショ ンし、大腸菌に導入した。様々なサイズの断片を挿入したプラスミドを形質転換後に 単離し、他に記載されているように(18)、重複しているヌクレオチド配列を DNA シ ーケンサー(GE Applied Biosystems 社、CA、USA)を用いて決定した。その結果、 3 つのクローンの DNA 配列が同一であることを確認した。そのクローンの 1 つを pUC/Sac-E2 と命名し、以後の実験で使用した。
2.2.3 レポータープラスミドの構築
- 29 -
ラーゼアッセイキットは、Promega 社から購入した。
PCR は、pUC/Sac-E2 DNA を鋳型として、以下のプライマーを用いて LA Taq シ ステムで行った。
pUC universal forward 5'-AGGGGATAACAATTTCACACAGGAAAC-3’ pUC universal reverse 5'-AATACGCGTGGGATCCGGTGCCTCTGAG-3’
反応混合物を94˚C で 1 分間インキュベートし、続いて 94˚C で 30 秒、56℃で 30 秒と68℃で 5 分を 25 サイクル行った。増幅された DNA は SacⅠ、及び MluⅠで消 化した。消化して得られた DNA 断片を精製し、レポーター遺伝子としてホタルルシ フェラーゼ遺伝子を含有する pGL3-Basic の SacⅠ-MluⅠ部位に挿入した。次に、 得られたクローン(pGL3/Q5.Sac-Mlu)をMluⅠ、及びHindⅢ、BstXⅠ、PvuⅡ、
NcoⅠのいずれかで消化した。そのDNA をセルフライゲーションさせた。得られたプ ラスミド(それぞれ pGL3/Q5.Hin、pGL3/Q5.Bst、pGL3/Q5.Pvu、pGL3/Q5.Nco) の配列の確認は、上述したように行った。
pGL3/Q5(-203)の構築は以下のように行った。 DNA 断片は、鋳型として pUC/Sac-E2、SacⅠ認識配列と -203 位置を含む以下のプライマーを使用して、PCR によって DNA 断片を増幅した。増幅された DNA をSacⅠ、及びMluⅠで消化し、pGL3-Basic のSacⅠ/MluⅠ部位に挿入した。
forward primer 5'-ATAGAGCTCCAGGCGGTGAGGTCAGG-3' reverse primer 5'-AATACGCGTGGGATCCGGTGCCTCTGAG-3’
さらに、次のように pGL3/Q5.NΔAML を構築した。鋳型として pGL3/Q5.Nco 、
Kpn Ⅰ 認識配列と2つの AML1a 部位の下流の配列を含む下記のプライマー、及び pGL3 vectors 用の reverse primer(Promega 社)を使用して、PCR により DNA 断 片を増幅した。
forward primer 5'-TATGGTACCGACATTTTGTGTGCAAAAACAAG-3'
増幅されたDNA は、KpnⅠ及びMluⅠで消化し、pGL3/Q5.Nco のKpnⅠ-MluⅠ 部 位 に 挿 入 し た 。pGL3/Q5.PΔAML を 構 築 す る た め 、PvuⅡ か ら NcoⅠ 断 片 を pGL3/Q5.Bst か ら 調 製 し た 。 こ の 断 片 は T4 DNA ポ リ メ ラ ー ゼ で 処 理 し た pGL3/Q5.Nco の KpnⅠ部位に挿入した。正しい方向で挿入されているプラスミドク ローンを選択した後、これらのプラスミドのDNA 配列も確認した。
- 30 -
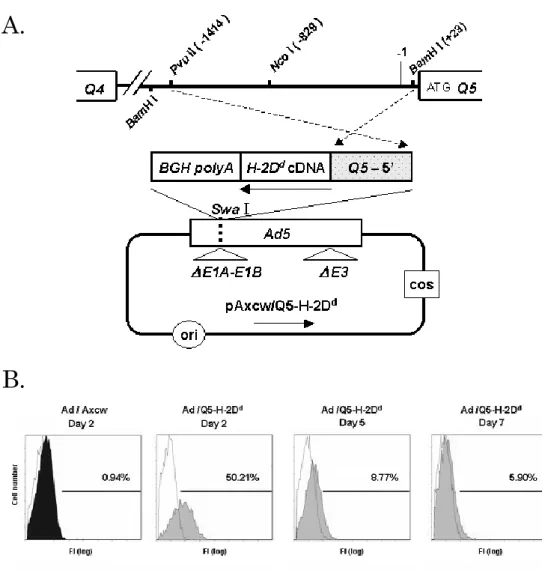
2.2.4 組換えアデノウィルスの作製
lacZ を含む HindⅢ-XbaⅠ断片を pZeoSV2/lacZ(Invitrogen 社)から単離し、 pRc/CMV(Invitrogen 社)の HindⅢ-XbaⅠ部位に挿入してサブクローニングし、 pRcCMV/ lacZ.を作製した。このプラスミドから、NruⅠからHindⅢ断片中に含まれ るCMV promoter を除いた。得られたベクター断片を T4 DNA ポリメラーゼで処理 した。一方、pGL3/Q5.SacⅠ-MluⅠをMluⅠ、及び HindⅢ、Bst XⅠ、PvuⅡ、Nco Ⅰのいずれかで消化した。得られた断片をT4 DNA polymerase と T4 polynucleotide kinase で処理し、上記のベクター断片に挿入した。正しい方向で挿入されたプラスミ ドを選択した後、SalⅠと NaeⅠで消化した。様々な長さの Q5上流DNA、lacZ、及 びポリA 部位を含んだSalⅠからNaeⅠ断片は、その後、E1A-、E1B-、及び E3 欠失 アデノウィルス5 型の配列を含んでいる pAxcw cosmid vector(タカラバイオ社)の
SwaⅠサイトに挿入した。Cosmid vector である pAxCAiLacZ(タカラバイオ社)は、 Ad / CAG-lacZ の生成に使用した。
組換えアデノウィルスは、製造業者の説明書(Adenovirus Expression Vector kit; タカラバイオ社)に従い、293 細胞株を用いた COS-TPC 法(36)により調製した。 得られた組換えアデノウィルス(Ad/Q5H-lacZ、Ad/Q5B-lacZ、Ad/Q5P-lacZ、Ad/Q5N-lacZ、Ad/ CAG-lacZ)を塩化セシウム密度勾配遠心分離で精製し(37)、ウィルスス トックの力価は、プラーク希釈アッセイ法(38)により決定した。 2.2.5 組換えレンチウィルスの作製
SV40 promoter と TK promoter DNA は、LA Taq と下記の特異的プライマーセッ トを使用して、pGL3- Basic や pRL-TK を鋳型として PCR により増幅した。
SV40 promoter SV40PF 5'-GCGATCTGCATCTCAATTAGTC-3' SV40PR 5'-TTTGCAAAAGCCTAGGCCTCC-3’ TK promoter TKpro-F 5’-AAATGAGTCTTCGGACCTCGCG-3’
TKpro-R 5’-AAATGAGTCTTCGGACCTCGCG-3’
異なる長鎖のQ5上流DNA は、LA Taq と下記の特異的プライマーセット(reverse プライマーは共通の Q5–5’R)と pGL3/Q5.Hin を鋳型として使用し、PCR によって 増幅した。
5Hind/ F 5'-GCTTAGGTTGTTTAGGACTCAAG-3' 5Bst/F 5'-GTCACATGGCAGAA TTTAGAATAG-3'
- 31 -
5Pvu/F 5'-AGCTGAGACCCTGGAGGGAC-3' 5Nco/F 5'-TGCACCATGGAAGTGCAGTCAC-3'
-203-F 5'-ATAGAGCTCCAGGCGGTGA GGTCAGG-3' Q5-5'R 5'-GGGATCCGGTGCCTCTGAG-3'
AML1a モチーフ欠失 Q5-5’上流 DNA は、LA Taq と下記の特異的プライマーセッ ト (reverse プ ラ イ マ ー は 共 通 の 上 記 Q5-5’R ) と 、 pGL3/Q5.PΔAML ま た は pGL3/Q5.NΔAML を鋳型として使用し、PCR により増幅した。
5Pvu/F 5'-AGCTGAGACCCTGGAGGGAC-3'
N-AML/F 5'-TATGGTACCGACATTTTGTGTGCAAAAACAAG-3'
これらのDNA 断片は、pENTR-5’-promoter entry plasmid である pENTR-5’/SV40, 5’/TK, 5’/Q5.Hin, 5’/Q5.Bst, 5’/Q5.Pvu, pENTR-5’/Q5.Nco, pENTR-5’/Q5.(–203), pENTR-5’/Q5.PΔAML, pENTR-5’/Q5.NΔAML.を構 築するために、製造業者の説明書にしたがって pENTR5-TOP(Invitrogen 社)に挿 入した。
レポーター遺伝子の luc+、及び Rluc は、LA Taq と下記の特異的プライマーセッ ト、鋳型としてpGL3-Basic や pRL-TK を使用し、PCR によって増幅した。
Luc/F 5'-ATGGAAGACGCCAAAAACATAAAG-3' LucpA/R 5'-GGATCCTTATCGATTTTACCAC-3' Rluc/F 5'-ATGACTTCGAAAGTTTATGATCCAG-3' RlucpA/R 5'-TACCACATTTGTA GAGGTTTTACTTG-3'
これらのDNA 断片は、pCR8 gene entry plasmid pCR8/luc と pCR8/Rluc を構築 するために、製造業者の指示に従って pCR8/GW/TOPO(Invitrogen 社)に挿入した。 各pENTR-5’-promoter entry plasmid (pENTR-5’/TK1 を除く) は、pCR8/luc と pLenti 6/R4R2/V5- DEST (Invitrogen 社)と共に LR Recombination reaction を使 用して、それぞれのpLenti6/R4R2/V5-DEST 生成を行った(39)。また、この反応は 別 の pLenti6/R4R2/V5-DEST 発 現 構 築 物 を 生 成 す る た め に pCR8/Rluc と pLenti6/R4R2/V5-DEST と共に、pENTR-5'/ TK を用いて行った。
293FT 細 胞 へ の ト ラ ン ス フ ェ ク シ ョ ン は 、 発 現 構 築 物 の 1 つ と ViraPower Promoterless Lentiviral Gateway Kits(Invitrogen 社)、ViraPower Packaging Mix (Invitrogen 社)を用いて、製造業者の説明書に従い、同時トランスフェクションに
- 32 - より行った。 得られたレンチウィルスストック(LV/SV40、LV/Q5.Hin、LV/Q5.Bst、LV/Q5.Pvu、 LV/Q5.Nco、LV/Q5(-203)、LV/Q5.PΔAML、LV/Q5.NΔAML、internal control の LV/TK-Rluc)の力価は、HT1080 細胞株を用いて決定した。 2.2.6 ルシフェラーゼレポーターアッセイ トランスフェクションの前に、1x105 cells/well の密度で細胞を 24 ウェルプレート に播種し、一晩培養した。トランスフェクションは、製造業者の説明書に従ってリポ フェクタミン 2000 トランスフェクション試薬(Invitrogen 社)を用いて行った。上 記いずれか1つの組換えプラスミド(0.6μg/culture)と導入効率の内部対照コントロ ールプラスミドとしてpRL-TK renilla luciferase vector(0.1μg/culture)を細胞に同 時にトランスフェクトした。レポーターレンチウィルスは、正常の CD3+、CD20+、 CD14+ 細胞、及びin vitroで分化させた樹状細胞(DC)へ(1000TU/1.5×105 cells) 導入した。レポーターレンチウィルスの1つと、ウミシイタケルシフェラーゼを発現 し形質導入効率の内部対照として使用する LV/ TK-Rluc(500TU/1.5×105 cells)を、 細胞に同時に形質導入した。導入 48 時間後に細胞を回収し、ルシフェラーゼの発現 を測定した。すべてのトランスフェクション、及び形質導入実験は duplicate で実施 し、少なくとも3 回繰り返した。 ホ タ ル ル シ フ ェ ラ ー ゼ 、 及 び ウ ミ シ イ タ ケ ル シ フ ェ ラ ー ゼ ア ッ セ イ は 、 Dual-Luciferase Reporter Assay System(Promega 社)を用いて行った。
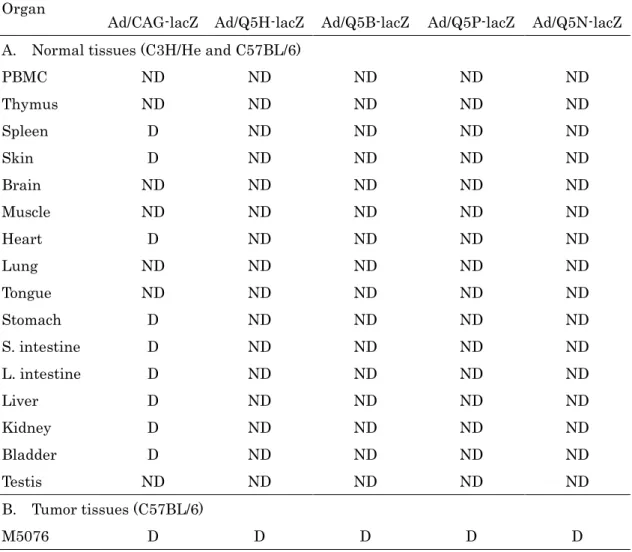
2.2.7 マウスモデル、及び組織学的検査 感染実験は、各マウスの尾静脈から精製組換えアデノウィルスを3×109 pfu 注射し た。正常マウスを用いた場合、ウィルス接種の3 日後に屠殺し、様々な組織を切除し た。担がんマウスを用いた実験のために、M5076 卵巣がん細胞の肝臓転移モデルを用 いた(40, 41)。M5076 細胞 2×105 cells を、尾静脈を介してそれぞれの C57BL / 6 マ ウスに移植した。ウィルス接種は 7 日後に行った。その 3 日後にマウスを屠殺した。 マウスから摘出した様々な臓器は、すぐに0.5 mM EDTA を含む氷冷生理食塩水で洗 浄した。 腫瘍の肝転移巣も同様にして得た。それらを凍結し、組織学的検査のために従来法 によって凍結切片を調製した。ギムザ染色は、製造業者の説明書に従って実施した (Diff- Quik ; シスメックス社、兵庫県)。X-gal 染色は、標準的な方法で行った(42)。
- 33 -
2.2.8 RT-PCR 解析
採取後に直ちに凍結した組織から、Isogen LS reagent(ニッポンジーン社)を用い て、製造業者の指定方法に従ってtotal RNA を抽出した。他の記載(18)と同様に、 cDNA を製造業者の説明書に従って合成した。反応液は、鋳型として 200ng の total RNA 、 プ ラ イ マ ー と し て oligo dT30-36、Super script Ⅱ RNaseH- 逆 転 写 酵 素 (Invitrogen 社 ) を 含 ま せ た 。 グ リ セ ル ア ル デ ヒ ド -3 -リ ン 酸 デ ヒ ド ロ ゲ ナ ー ゼ (G3PDH)、Q5、lacZ遺伝子を検出するために使用したプライマーは、次の通りであ る。 G3PDH/F 5'-TCCACCACCCTGTTGCTGTA-3' G3PDH/R 5'-ACCACAGTCCATGCCATCAC-3' Q5/F 5'-CTCTGACCCAGACCCGCGCT-3' Q5/R 5'-TTCGCCTTTCAGGAAGTCCTC-3' LacZ/F 5'-TACCCAACTTAATCGCCTTGC-3' LacZ/R 5'-CTGTAGCCAGCTTTCATCAAC-3' 2.2.9 ヒト末梢血単核球細胞、及び細胞画分の調製 健常人ボランティアからのヒト細胞を用いた研究は、メディネット社倫理委員会の承 認を得て行った。PBMC は、Lymphoprep システム(Nycomed Pharma 社)を用い て 密 度 勾 配 遠 心 分 離 に よ っ て 抹 消 血 液 か ら 調 製 し た 。PBMC からの CD3+ 細 胞 、 CD20+ 細胞、CD14+ 細胞の単離は、磁気ビーズソーティング法(MACS システム) により、それぞれ抗CD3-、抗CD20-、抗CD14- ビーズ(MiltenyiBiotec 社)を用い たネガティブ選択によって行った。単球(CD14+ 細胞)は、直ちに樹状細胞(DC)の 分化へも使用した(43, 44)。
- 34 - 2.3 <結果>
2.3.1 Q5上流DNA の単離とその配列特徴
Q5上流 DNA の発現調節の役割を解析するために、Q5上流SacⅠサイト(-3904) からQ5第2 exon をカバーしている DNA 領域をクローン化した。そして、BW5147 ゲノムDNA から増幅された DNA の制限酵素マップを構築した(図 6. a)。マップは、 AKR 胸腺細胞のゲノム DNA からも同様に得た。それらのマップを比較し、同一であ ることを確認した。BW5147 DNA 由来の 3 クローンの塩基配列を決定し、それらが 同一であることを確認した。また、その DNA 配列がQ5のexon と同一の配列を含ん でいることを確認した(GenomeNet 登録番号 X16423)。上記のように決定した塩基 配列は、2004 年 6 月にデータベースへ登録した(DDBJ 登録番号 AB182578)。その DNA 領域は、CdxA、AML1a、及び STATx のような転写因子の結合部位として報告 されている配列を含有していた(図 6. b)(45-47)。また、我々は Q5上流 DNA の-203 から-1 領域は、CRE、及びインターフェロン・コンセンサス・シークエンス(ICS) を含むプロモーター配列を有することを確認した(14)。これらの結果は、PAPIA(並 列タンパク質情報解析)システムの TFSEARCH(転写因子検索)プログラムを使用 して得られた(http://mbs.cbrc.jp/research/db/TFSEARCHJ.html)。
2.3.2 In vitro, in vivo でのマウス細胞における Q5上流DNA の転写誘導活性
Q5上流DNA の転写誘導活性を解析するために、7 つの組換えレポータープラスミ ド pGL3/Q5.Hin, pGL3/Q5.Bst, pGL3/Q5.Pvu, pGL3/Q5.Nco, pGL3/Q5.(-203), pGL3/Q5.PΔAML, pGL3/Q5. NΔAML を構築した。Q5上流 DNA 断片の下流には、 ルシフェラーゼ遺伝子を配置した(図6.c)。 これらのプラスミドを使用し、様々なマウス細胞株における上流 DNA 断片の転写 誘導活性を解析した。これまでの報告(第 1 章)では、L929、MH134、BW5147、 WEHI-3 マウスがん細胞株は、いずれもQ5遺伝子を発現することを示した(29)。そ の報告では、Q5 遺伝子の発現ががん細胞特異的であり、Q5 遺伝子発現調節は上流 DNA 領域に担われていると予想した。また、Colon-26、A4、RL-7、及び F9 マウス がん細胞株を、上記の細胞株に加えて使用した。新たに使用するこれらの細胞株も Q5 遺伝子を発現するかRT-PCR により調べた結果、発現が示された(図 7)。これらのマ ウス培養がん細胞株(L929、MH134、Colon-26、BW5147、WEHI-3、A4、RL7、F9) を使用し、細胞内へいずれか1つのプラスミドをトランスフェクションした後に、ル シフェラーゼ活性の試験を行った。ポジティブコントロールとして、SV40 プロモー ターの制御下に置かれたルシフェラーゼ遺伝子を有するpGL3-promoter を使用した。