海馬標本におけるフィールド電位記録
岡 田 隆
上智大学
Recording of field potentials in hippocampal preparations
Takashi Okada
Sophia University
The recording of field potentials in hippocampal slice preparations is widely used for the purpose of elucidating the biological basis of memory function, Since the hippocampus has a unique structure of cellular and fiber layers, not only action potentials but also postsynaptic potentials can be clearly recorded as field potentials using a glass electrode with a relatively large tip. That the mechanism of polarity of field potentials recorded from synaptic layers differs from that recorded from cell layers is explained by the concepts of current sink and source.
Keywords: extracellular recording, field potential, hippocampus, sink, source
1. 神経細胞における電気信号 脳の情報処理と行動との関係を知るための一つの方法 に「記録法」がある。これはおもに行動中の生体におけ る神経系や内分泌系に生じる変化を測定するものであ り,その中でも電気生理学的測定は,神経細胞の活動を ほとんど遅れなくリアルタイムに知る方法として,生理 心理学において人間の脳波記録や動物の神経応答記録な ど,いくつかの手法が用いられている。 神経細胞の電気信号とは何か。一つの神経細胞におけ る信号の流れは,細胞膜を挟んだ細胞内外の電位差(電 圧)の変化が,樹状突起や細胞体から軸索をへて軸索終 末部へと伝わっていくことである。他の神経細胞からの 入力部位であるシナプスにおいて,信号を出す側のシナ プス前膜から放出された神経伝達物質が,信号を受け取 る側のシナプス後膜の受容体に結合し受容体が活性化さ れる。すると,シナプス後膜を横切るイオンの流れ(さ まざまなイオンの透過しやすさ,透過性)に変化が生 じ,その結果,神経細胞の内部に局所的な電圧の変化が 生じる。細胞膜の外側を基準としたときの内側の電圧の ことを膜電位(membrane potential)といい,シナプス 入力のない静止状態の膜電位すなわち静止膜電位は −60 mV程度である。シナプス入力によるイオン透過性 の変化の結果として,シナプス後部の膜電位が静止膜電 位よりもプラス方向に変化した場合が興奮(excitation) であり(脱分極ともいう),マイナス方向に変化した場 合が抑制(inhibition)である(過分極ともいう)。一つ の神経細胞には一般に多数の(数百∼数万といった規模 の数の)シナプス入力があって,樹状突起や細胞体にお けるすべてのシナプス後部の膜電位変化が統合されて軸 索小丘(細胞体から軸索への移行部)に伝わる。軸索小 丘に伝わってくる膜電位変化は,シナプス入力の大きさ に応じてさまざまな振幅を示しうる連続的変化であり, このような受動的な電位のことを局所電位(localized potential)とよぶ。 軸索小丘に伝わってきた脱分極が,ある閾値を超える 大きさであった場合,活動電位(action potential)と呼ば れる一過性の興奮性膜電位変化がそこに生じる。活動電 位の発生に重要なイオンチャネルは,脱分極によって活 性化される膜電位依存性Na+(ナトリウムイオン)チャ ネルであって,このチャネルを通してNa+が細胞内に流 入することにより自己再生的にフルサイズの活動電位が 生じる。このチャネルは軸索小丘に高密度に存在すると 共に軸索の細胞膜にも引き続き存在していることから, 活動電位は軸索に沿って次々と発生し振幅を減衰させる ことなく軸索終末部に向かって伝導される。活動電位の Copyright 2014. The Japanese Psychonomic Society. All rights reserved. Corresponding address: Department of Psychology, Faculty
of Human Sciences, Sophia University, 7–1 Kioi-cho, Chiyo-da-ku, Tokyo 102–8554, Japan. E-mail: okadat@sophia.ac.jp
発生は全か無かの法則に従うため,発生した際の振幅は シナプス入力の大きさを反映しておらず一定だが,興奮 性入力が大きいほど活動電位の発生頻度が高くなるとい う関係があり,活動電位が高頻度であるほど軸索終末部 からの神経伝達物質放出も多くなる。以上のように,一 つの神経細胞が信号を受け取ってから他の神経細胞に信 号を出すまでの間,軸索小丘よりも前でみられる局所電 位と軸索小丘以降でみられる活動電位といった性質の違 いはあるものの,どちらも膜電位変化という電気信号が 神経細胞の活動の現れとして研究者の計測対象となるこ とに変わりはない。 神経細胞の活動の指標である膜電位は細胞内の電圧変 化であるから,電気生理学的測定の方法の一つは,神経 細胞の中に微小電極を刺入して膜電位を測定することで ある。この場合,高濃度(3 M) KCl (塩化カリウム)液 をつめた微小ガラス管電極を,組織標本や細胞標本の神 経細胞の細胞膜に刺し,細胞外に置いた基準となる電極 との電位差を測定する実験が行われる。また,人工細胞 内溶液を詰めたパッチ電極(ガラス管から作製した先端 径1 μm程度の電極)を細胞膜に押し当てて密着させて から陰圧をかけることによりホールセルクランプの状態 にし,パッチクランプアンプの電流固定モードで膜電位 の測定を行うことも可能である。ただしこれらの膜電位 測定法は神経細胞1個の電気的活動を記録する目的のも のであり,また生きた動物の脳では適用しにくい。一 方,記録電極を神経細胞の細胞膜の外に置いて神経細胞 の電気活動を記録する方法も多用されている。細胞外記 録の場合は,神経細胞の活動の指標である膜電位をその まま測定しているわけではなく細胞外の電極位置におけ る電圧記録という,直感的にややわかりにくい測定法だ が,たとえば海馬におけるシナプス応答を記録するため の太めの細胞外電極からは電極周辺の集合シナプス後電 位や集合活動電位が測定されるし,大脳皮質に刺入した 先端の細い細胞外電極からは単一細胞の活動電位が記録 される。人間の頭皮の上に貼付した皿電極から記録され る脳波も,細胞外電極による測定の一種である。本稿で は,細胞外電極によるいくつかの測定法の中から,記憶 機能の生物学的基礎を解明することを目的として多くの 研究が行われ基礎心理学者の目にも触れることの多い, 海馬スライス標本におけるシナプス応答の記録の例を紹 介する。細胞外電極によるフィールド電位記録は,興奮 性伝達が行われているのに応答波形がマイナス方向に変 化したり,その波形にさらに逆極性の一過性電位変化が 重畳していたりと,複雑な様相を呈するので,それを中 心に解説する。 2. 海馬CA1領域のシナプス応答 海馬スライス標本におけるシナプス応答を記録するま での手順を,ごく簡単に述べておく。動物(ラットやマ ウスなど)の脳から300∼400 μmの厚さの海馬スライス 標本を作製する。海馬標本の電気記録の場である,正立 型生物顕微鏡のステージ上に設置した透明のチャンバー 内には人工細胞外溶液を常に流し込み,その対角線上の 反対側付近から陰圧によってチャンバー内の液を吸い出 す仕組みにする。流し込む人工細胞外溶液内には酸素を 十分に与えておき,またチャンバー直前で液をヒーター に通して約 32℃にしてから供給する(細胞外溶液の組 成等の詳細はSuzuki & Okada (2012)を参照)。この状態 のチャンバー内に,海馬スライス標本を1枚置き,流れ てしまわないように白金線などを用いて海馬標本を上か ら軽く押さえつける。 シナプス応答を記録する実験を行うために必要な電極 は,入力線維を人工的に刺激して活動電位を生じさせる ような電流を供給する刺激電極と,シナプス応答を記録 するための記録電極である。筆者の研究室では刺激電極 として市販の双極電極(ユニークメディカル製同心円電 極TN-98156A)を用い,記録電極としては先端径5∼10 μm のガラス管電極をそのつど作製して用いている。記録電 極内には人工細胞外溶液を詰め,パッチクランプ用アン プに接続したヘッドステージに取り付けた電極ホルダー の銀塩化銀線を電極の後ろから差し込む形で電極内の液 に接触させる。また,チャンバー内の海馬から離れたと ころに,基準とするための電極(不関電極)を置き,こ の電極からの電線もヘッドステージの不関電極用端子に 接続する。電圧の測定であるため,パッチクランプ用ア ンプは電流固定(カレントクランプ)モードで使用する。 海馬CA3領域の錐体細胞からCA1領域に投射する軸索 であるシャファー側副枝(Schaffer collateral, SC)に対し 刺激電極から 100 μsの長さの電流を与えると,Figure 1 に示した波形のような電位変化が記録される。このと き,記録電極をどの層に置くかによって,シナプス応答 (Figure 1の*印)の極性が変わってくる。つまり,シャ ファー側副枝とCA1領域の錐体細胞の樹状突起とで形成 しているシナプス付近(放線層,stratum radiatum)に記 録電極を配置すると,シナプス応答の極性は負となり, 一方,記録電極を CA1領域の錐体細胞の細胞体が並ぶ 細胞層(cell layer)付近に配置すると,シナプス応答の 極性は正となる。なお,シナプス応答の波形に重畳して 一過性の変化が逆極性にみられることがあり(Figure 1 の○印),これは集合活動電位(population spike)がこ
の時点で生じていることを示す。同じシナプス入力によ る測定でありながら,細胞外電極の位置によって反対の 極性となる点について,次に考えてみたい。 3. 細胞膜の興奮時のシンクとソース Figure 2は,神経細胞の一部が興奮して電流が発生し ているときに細胞外電極によって記録される電位変化の 極性を表した模式図である。電圧の基準点は,神経細胞 から離れたところに置いた電極(不関電極,indifferent electrode)とする。細胞膜の興奮はイオンチャネルを介 して陽イオンが流入するか陰イオンが流出することに よって 生じるから,そのどちらの場合も興奮部位(Fig-ure 2の△印)では電流が細胞外から細胞内の向きに流 れる。このように,電流の流れ込む部位のことをシンク (sink)という。一方,電流は閉回路(流れ込んだ電流 はどこか別の所を通ってまた元に戻ってくる)となるか ら,そのとき興奮していない膜のさまざまな箇所から細 胞外を電流がシンクをめがけて流れることになる。それ らの,シンクに向けて電流を供給する形になる部分のこ とをソース(source)という。Figure 2では1カ所のソー スのみ示されているが,それ以外の静止膜状態の部分も 同様にソースとなる。シンクの部分に細胞外電極を置い た場合,不関電極に比べてシンクは電圧が低くなるた め,記録される波形は負の方向への変化となる(Figure 2の右波形)。一方,興奮していない膜におけるソース に細胞外電極を置いた場合,不関電極に比べて電圧が逆 に高くなるので,記録される波形は正の方向への変化と なる(Figure 2の左波形)。以上からわかるように,細胞 外記録の場合は電極の置かれた位置で電流が発生して初 めて電圧変化として記録されるのであるから,もし細胞 の膜電位が変化したとしてもそれが細胞全体で等電位を 保つような形で変わったのであればそこに電流は発生し ないため,細胞外電極では電圧の変化として検出できな いことになる(Lemon, 1984)。 4. 海馬シナプス伝達によるシンクとソース このことを念頭に置いたうえで,海馬のシナプス応答 に話を戻す。シャファー側副枝から CA1錐体細胞に向 けて放出される神経伝達物質グルタミン酸が,錐体細胞 の樹状突起にあるグルタミン酸受容体に結合するとシナ プス後部に興奮(脱分極)が生じ,これを興奮性シナプ ス後電位(excitatory postsynaptic potential, EPSP)という。 先端径の太い電極を用いた細胞外記録法では電極周辺の 複数のシナプス応答をまとめてフィールド電位として記 録しているので,記録される応答をフィールド興奮性シ ナプス後電位(field excitatory postsynaptic potential, fEPSP) と呼ぶ。fEPSPが発生したときの電流の流れを,Figure 3 の左図に示している。この場合,シナプス付近(海馬 Figure 1. Line drawing of coronal section of rat hippocampus and examples of synaptic responses at CA1 subregion. Schaffer
collaterals (SC) are stimulated with a bipolar electrode (shown by a black bar) and waveforms of synaptic responses are re-corded at cell layer (upper waveform) and stratum radiatum (lower waveform) with an extracellular electrode (shown by an open triangle). Asterisks in the waveforms show the initial slope of fEPSP, and open circles show the population spike. These waveforms were recorded from different slice preparations (scale: 5 ms, 0.5 mV). Each component of this figure is shown courtesy of Drs. Etsuko Suzuki and Yoshiyuki Takahashi.
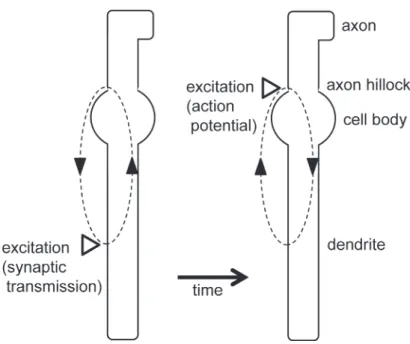
Figure 3. Diagram of current flow of CA1 pyramidal cell during synaptic transmission. Schaffer collaterals̶CA1 pyramidal cell synapses are located at the dendrite, and synaptic transmission induces the current flow from outside to inside (current sink) at the synapses, whereas it induces the current flow from inside to outside at the cell body (current source)(left dia-gram). When the excitatory synaptic input evokes the action potential at the axon hillock, the action potential induces the current flow in the opposite direction (right diagram). That is why the polarity of field potentials recorded from synaptic layers differs from that recorded from cell layers, and why the polarity of the population spike added on fEPSP is opposite to the polarity of fEPSP (see also Figure 1).
Figure 2. Diagram of current flow around the location of membrane excitation. When excitation occurs at a certain location on the cell membrane (indicated by an open triangle), this active region acts as a current sink. Current flows from other lo-cations, and each inactive region acts as a current source. Voltage is measured as the potential difference between a record-ing electrode (shown by a filled circle) and an indifferent electrode (shown by an open circle). Polarity of voltage change recorded from an extracellular electrode depends on the location of the recording electrode; the electrode near the current sink shows a negative response, and the electrode near the current source shows a positive response. Although only one location of electrode is drawn as a recording electrode for a current source in this diagram, any other location without excitation can be a current source.
CA1領域の放線層)においては電流が流れ込んでいるシ ンクである。一方それ以外の部分,たとえば CA1領域 の錐体細胞の細胞体付近では,電流が細胞内から細胞外 に流れ出ているソースとなっている。基準となる不関電 極は上述のように海馬スライス標本の外(海馬スライス を浸している細胞外溶液内)に配置しており,この基準 部位と比べるとソースでは電圧が高く,シンクでは電位 が低くなる(宮川・井上,1993)。以上のことから,もし 記録電極をシナプス付近に置いてシナプス応答を測定し た場合にはfEPSP測定時にシンクで電圧を測定している ことになるので,Figure 1の右下波形のようにfEPSPは 負の電位変化として記録される。一方,記録電極を錐体 細胞の細胞体付近に置いた場合にはソースで電圧を測定 していることになるので,Figure 1の右上波形のように fEPSPは正の電位変化として記録される。 これらのシナプス応答に重畳して逆極性にみられる一 過性の電位変化(Figure 1の波形の○印)は何であろう か。冒頭で述べたように,シナプス応答が十分に大きい と神経細胞に活動電位が発生する。活動電位は軸索小丘 (axon hillock)で生じ,その部位ではNa+流入による内 向き電流が発生するため,活動電位が生じる際にはシン クとソースの関係が先ほどとは逆になる(Figure 3右)。 したがって,シナプス付近に置いた電極の場合には集合 活動電位が正の方向の一過性電位変化としてfEPSPに重 畳し(Figure 1, 右下の波形),細胞体付近に置いた電極 の場合には集合活動電位が負の方向の一過性電位変化と してfEPSP に重畳することになる(Figure 1, 右上の波 形)。なお,個々の神経細胞レベルでは全か無かの法則 に従って活動電位が発生しているが,この記録法で測定 しているのは集合活動電位であるから,活動電位を発生 させている神経細胞の数に応じて集合活動電位はさまざ まな振幅を取りうる。なお集合活動電位が重畳した場 合,fEPSPの振幅を正確に測定することが困難なため, シナプス応答の大きさの変化を測定する場合などは, fEPSPの最初の立ち上がり部分(initial slope)の傾きの 変化を用いることが多い(Figure 1, 波形の*印)。 最後に,このようなフィールド電位としてfEPSPや集合 活動電位が鮮やかに記録されうるのは,海馬において同 種類の神経細胞の並びが層構造をなしているという独特 な解剖学的特徴に負うところが大きいことを指摘してお きたい(Andersen, Morris, Amaral, Bliss, & O’Keefe, 2007)。 たとえばCA1領域において,シャファー側副枝は放線層 を走り,錐体細胞も層をなして位置し,樹状突起の層, 細胞体の並ぶ層と明確に分かれている。したがって,細 胞外電極によってフィールド電位を記録した場合,さま ざまな種類の細胞における電位変化の要素が混交するこ となく,目的とする部位のシナプス応答を明確に記録す ることができる。(単一の神経細胞の応答を測定する細 胞外記録法の場合,活動電位のような大きな電流を発生 する電位変化は測定できるが,シナプス後電位のように 発生電流が微弱なものは明確な記録が困難である。)長 期増強,長期抑圧をはじめとするシナプス可塑性の研究 が海馬で著しく進んだ一因は,シナプス後電位がfEPSP として細胞外電極によって記録できるという特徴を海馬 が有しているからであると言えるだろう。 引用文献
Andersen, P., Morris, R., Amaral, D., Bliss, T., & O’Keefe, J. (2007). Field potentials and current source density analysis. In P. Andersen, R. Morris, D. Amaral, T. Bliss, & J. O’Keefe (Eds.), The hippocampal book. Oxford: Oxford University Press, pp. 28–29.
Lemon, R. (1984). Methods for neuronal recording in conscious
animals. Chichester: John Wiley & Sons, pp. 17–42.
宮川博義・井上雅司 (1993).ニューロンの生物物理 丸善 pp. 203–207.
(Miyakawa, H., & Inoue, M.)
Suzuki, E., & Okada, T. (2012). Stratum oriens stimulation-evoked modulation of hippocampal long-term potentiation involves the activation of muscarinic acetylcholine receptors and the inhibition of Kv7/M potassium ion channels.