戦略的創造研究推進事業 CREST
研究領域
「医療に向けた化学・生物系分子を利用した
バイオ素子・システムの創製」
研究課題
「生体分子間相互作用を連続的に検出するための
多機能型水晶発振子マルチセンサの設計と開発」
研究終了報告書
研究期間 平成13年10月~平成19年3月
研究代表者:岡畑 恵雄
(東京工業大学 フロンティア創造共同研究
1 研 究実施 の概要
本 プロジェクトでは、(A)生 体 内での複 雑で動的な分子 間 相互 作 用や反応 の定 量的 解 析、(B)そ のための多 機能でかつ高感 度な水晶発 振子 マイクロバランス法の開 発、を2本の柱として研 究を推 進 した。 水晶発振子は、電極上に物質が吸着することにより振動数が低下することが知られている。約 1 ng の物質が吸着すると 1 Hz 振動数が減少することからマイクロバランス(微量天秤)として、これまでは主 に気 相 中でガスセンサーとして使 われてきた。岡畑 らは、1990年 頃から水 晶 発 振 子マイクロバランス (QCM)を用 いて水 中 で生 体 分 子 間 相 互 作 用 を測 定 する研 究 を開 始 し、そのために水 晶 発 振 子 の 片面被覆や発振回路の改良を重ね、水中で±2 Hz の精度で測定できる装置を開発した。 図 1 水 晶 発 振 子 を用いる生 体 分子 間 相 互 作 用 の定 量 化 この装 置 を用 いて図 1に示 すように、細 胞 膜 などの糖脂 質 から水 面 単 分 子 膜 を作 製 し、水 晶 発 振 子を水平に押しつけることによりタンパク質(レクチン)の結合が振動数減少 (重量増 加)として見られる こと、QCM 基板上に1本鎖 DNA を固定化すると相補的な DNA の結合(ハイブリダイゼーション)が見 られること、二本 鎖を固 定化 したときには塩 基配 列選 択的なタンパク質(転写 因子 )の結 合が見られる こと、ペプチドを固定 化するとペプチドーペプチド間 相互 作 用がナノグラムレベルの重 量変 化として追 跡できること、などを明らかにしてきた。 本研究プロジェクトでは、従来の研究成果を基にして、単純で静的な1:1の分子認識ではなく、(A) 生体 内での複 雑で動 的な分子 間相 互 作用や反 応の定量 的な解 析 法を確 立する、(B)そのための多 機能でかつ高感 度な水 晶発 振子 マイクロバランス装 置を開 発する、という目標 を掲 げて研 究を推進し、 以下の成果を挙げた。 (A)複雑で動的な分子間相互作用や反応の定量的な解析制 限 酵 素 などが使 われてきたが、い ずれもその生 成 物 をR Iラベルしたゲ ルシフトアッセイから検 出 する方 法 が 主で、酵素反 応過程 を追跡した例は ほとんどなかった。 図 2に示 すように、DNA固 定 化 Q CMを用いれば、DNAポリメラーゼに よるテンプ レート鎖 に沿 ったDNA 伸 長 反 応 や、リガーゼによるDNA結 合 反 応 などが振 動 数 減 少 (重 量 増 加 ) として、観察できた。 ま た、Exo型 ヌ クレアーゼによるD NA鎖 先 端 からの加 水 分 解 反 応や、 制 限 酵 素 によ る部 位 特 異 的 な切 断 反 応 が振 動 数 増 加 (重 量 減 少 )と し て観 察 で きた。いずれも経 時 変 化 か ら 酵 素 の D N A 鎖 へ の 結 合 、 反 応 (伸長あるいは切断)、酵素の離脱の各反応速度を精度良く求めることが出来た。 (2)糖鎖上での酵素反応の解析 DNA上での酵素 反応は、DNAがポリアニオンであり、紫外領 域に吸 収を持つことからゲルシフトア ッセイや分 光法で反応 追 跡が可 能である。しかし糖鎖は紫外 吸 収が弱 く、酵 素反 応を連続 的に追 跡 することは難しく、これまでは生成物を比色定量するぐらいしか方法がなかった。 QCM 上にアミロペクチン糖鎖を固定化し、糖加水分解酵素であるグルコアミラーゼを加えると図2下 と同 じように、振 動 数 の増 加 (重 量 減 少 )が観 察 され糖 鎖 が切 断 されて いく過程が追跡できた。振動数 変化のカーブフィッティングを正確に行う ことにより、酵素の糖鎖への結合と解離速度(ko nと ko ff)および解離定数 (Kd)と糖 鎖 切 断 速 度 (kca t)が求 められた。これらの動 力 学 定 数 は従 来 の Michaelis-Menten 式では求められなかった値である。 (3)タンパク質上での酵素反応の解析 QCM 基板上にタンパク質としてミオグロビンを固定化し、タンパク質の C 末側から切断できるカルボキシペプチダーゼを加えると、図2下側と同 じような振動 数変 化が見られ、酵素 による切 断反 応が観察できた。DNA 図 3 QCM 上 に固 定 化し た KcSA カリウムイ オ ン チ ャ ネ ル へ の チャ ネルブ ロッ カー ペプチドの結 合 図 2 QCMに固 定 化 したDNA上 での酵 素 反応
や糖鎖に比べてタンパク質は3次元 構造があり、pH 変化などにより基質であるタンパク質の構 造が変 化すると反応性が大きく変化した。 (3)膜タンパク質上での分子認識 これまで膜 タンパク質 はリポソームなどに再 構 成 してその反 応 を見 るのが一 般 的 であったが、QCM を用いれば平面基板上に脂質膜に可溶化した(安定 化した)状態で固定化でき、膜タンパク質に対す る各種リガンドの結合を重量変化として追跡できた(図3)。 (4)リボソームでの翻訳過程の定量化 mRNA の遺 伝 情 報 に従 っ てリボソーム上でタンパク質に 翻訳される。翻訳開始過程に は 1 0 種 以 上 の タン パ ク 質 因 子 や 酵 素 が 関 与 し 、 複 雑 な 分 子 間 相 互 作 用 を 行 ってい る。QCM 上にmRNA を固定 化 し 、リ ボ ソ ー ム の結 合 過 程 や開 始 複 合 体 の生 成 過 程 を 観察した。従来は、70S リボソームは一度30S と50S に解離して30S がmRNA の Shine-Dargalno(SD) 配列に結合すると考えられていたが、別ルートとして、70S が解離せずにそのまま SD 配列に結合して 開 始 複 合 体を形 成する経 路があることが示 唆された(図 4)。これまでリボソーム翻訳 過 程は種々の分 子が複雑 に関与して定 量的な議論がなされてこなかったが、QCM 法を用 いることにより重 量変化とし て翻訳過程が解明される日も近い。 (5)生体分子の分子構造やコンフォメーション変化の定量化 これまでの QCM は、水晶発振子を発振回路で強制発振させたときの振動数変化を追跡したもので あったが、ネットワークアナライザー法 を用いて周波数 スキャンすることにより発振 ピークを解析して、周 波 数 シフト値 (ΔF)とエネルギー損 失 値 (ΔD)が同 時に求 められる。これらの値 から基 板 上に固 定 化 した分子の粘弾性や水和の状態が求められることがわかった。 (B)多機能でかつ高感度な水晶発振子マイクロバランス装置の開発 上で述べたような複雑で動的な生体分子間相互作用を定量的に解析するために、QCM 装置の安 定化(ドリフトの低 減)、高感 度化 (ノイズレベルの低 減 )、微 量サンプルの測定に適した低容 量化を実 図 4 mRNA 固 定 化 QCM 上 での翻 訳 開 始 複 合 体 の形 成過 程
第3世代ではバッチ式ではあるがセル容量を8 mL から 0.5 mL にし、一度に4個測定できる4チャネル 化した。第4世代ではマイクロ流路に QCM を組み込んで、セル容量を 10μL にしてフローセル化した。 この事によりノイズレベルが1/20になり、高感度化が達成できた。 図 5 QCM 装 置 開 発 の経 緯
2 研 究構想 及び実施体 制
(1) 研究構想 本 研 究 プロジェクトをスタートする前 に、我 々は水 晶 発振 子 マイクロバランス法 は水 溶 液 中で DNA やタンパク質 上での生体 分子間 相互 作用を定量出 来 る優 れた方 法であることを見出していた。図 1に 示したように脂質膜−タンパク質間、DNA-DNA 間、DAN-タンパク質間などの静的で単純な分子認識 がナノグラムレベルで定量できた。 表1に、これまでの生体分子間相互作用を測定する手 法をまとめた。従来のゲルシフトアッセイ法や ELISA法は定性的で、なおかつ生 体分子をRIや蛍 光分子で修飾する必要があった。近年は被 修飾 で定 量 的 に分 子 間 相 互 作 用 が検 出できる、マイクロカロリメトリ法や表 面 プラズモン共 鳴 (SPR)法 が 注目されるようになったが、QCM法は、これらに比べて結合量をナノグラムレベルで定量出 来る、経時 変 化から結合 の動 力学 が求 められるなどの特 徴がある。すなわち結合 の絶 対量 をナノグラムレベルで 検出でき、結合の経時変 化を追跡できるので、より複 雑で動的な生体分 子間相 互作用を定量的に解 析することが出来ると考えた。(A)動的な酵素反応の解析 動 的 な生 体 分子 間相 互 作用として、酵 素反 応を選んだ。下 式に示すように酵 素は基質 を取 り込ん で分 子内 で反 応し、基質 を放 出する。酵 素 反 応はこれまでは、反 応中 間 体である酵 素 ・基質 (ES)複 合 体 の 濃 度 を 直 接 に 求 め る の が 困 難 で あ っ た こ と か ら 、 生 成 物 ( P1 と P2 ) の 生 成 速 度 か ら Michaelis-Menten 式を用いた反応解析を行ってきた。生成物の追跡にはゲルシフトアッセイや分光学 的方 法が主に用いられてきたが、早い反応 や正 確な動力 学を求 めることは困難であった。QCM 法を 用いて基 板上に基質を固定 化すれば、酵素の基質への結合過 程は重 量増 加として検 出でき、ES複 合体内での基質の分解反 応は重量 減少として、反応 後の酵素の脱 離も重量 減少として追跡できるの で、酵 素反 応の各過 程を定量 的に解析 する方 法として適していると考えた。基質としてDNA、糖 鎖 、 タンパク質を選べば各基質上での酵素反応が解析できる(森グループ)。 (B)膜タンパク質上での分子認識 生 体 分子 間 相互 作用 の大 半は細 胞 膜上 の膜 タンパク質でおこっているが、膜タンパク質を界面 活 性剤を用いて単離することの困難さや脂 質膜との再 構 成の困難さなどのために、その機 能解析はほと んど進 行していない。水 晶発 振子基 板上に膜タンパク質を脂 質膜に可溶化して安 定に固 定化できれ ば、シグナル分 子の結 合 が重 量 変 化として検 出できる。この場 合 、QCM基 板 上 への膜 タンパク質 の
(C)タンパク質翻訳系での複雑な分子認識 mRNAの遺 伝上を基にしたタンパク質翻 訳系は分子 レベルでも解 析されるようになり、最 近は細胞 を用いずに細胞からの抽出成分のみの pure な系でタンパク質の発現が可能になってきた。mRNAに リボソームと多くの開始 因子が結合して開始複 合体が作製されて翻 訳が進行するのであるが、開始複 合体の形成メカニズムもまだ分子レベルで解明されてはいない。複雑な分子間相 互作用の解析として、 リボソーム翻 訳 系に注 目した。mRNAを発 振 子上 に固 定 化 すれば、リボソームや種 々の開 始 複合 体 の結 合 過 程 を重 量 変 化として解 析できると考 えた。これまでの教 科 書的 な開 始 経路 以 外 の経 路 も発 見できることを期待している(古澤グループ)。 (D)生体分子の粘弾性の測定 これまでのQCM装 置は発 振 回 路を用 いて発 振 子 を強 制 発 振 させ、物 質が吸 着したときの振 動 数 変 化から物質 の化 癒着 量を測 定してきた。水 晶 発振子 はネットワークアナライザーにつないで周 波 数 スキャンすると共振 周波数でコンダクタンスが最大になる。発振子上に硬い膜が乗った場 合にはピーク 形 状 を変えずに低 周 波 数側 にシフトするだけであるが(図 6左 )、柔 らかい膜が乗った場 合には、柔 ら かい膜 は発 振 子 と一 緒 に振 動 しないのでエ ネ ルギー損 失 がおこ る。こ のと きにピーク幅 が 広 が っ て 低 周 波 数 側 に シ フ ト す る ( 図 6 右)。この事を利用 すれば、発 振子 上の乗っ た分 子 の硬 さ ・柔 らかさ (粘 弾 性 )や反 応 に 伴 うタンパク質のコンフォメーション変 化が定 量 化 できる。ネットワークアナライザー法を用 いることにより、質 量 変 化 のみならず分 子 の コンフォメーション変 化 も追 跡 できることにな る(川崎グループ)。 (E)水晶発振子測定装置の開発 酵 素 反 応 や複 雑な生 体 分 子 間 相互 作 用 を解明 するためには、高 感 度で安定 性 の高い水 晶 発 振 子測定装置が必要である。 ATカットの水 晶 発振 子はズレ振 動していることから温度 に対しては敏 感で、これがしばしば発 振 子 の 安定性に影響を与えてきた。温度に対する安定性は水晶のカット角で決まり、これまでは AT カット発 振子は 35°15′のものが使われてきた。しかしこのカット角は空気中での温度安定性に優れたカット角で はあるが、水 中では必ずしも温度 安 定 性が良いわけではない。しかし発 振子 は数 十 万個 単 位で生 産 され、カット角を変えるのは数百万円のコストがかかり、これまでは 35°15′のカット角の発振子を水中で だましだまし使 ってきたのが現 状 である。水 中 でより安定 な水 晶 発 振 子 を得 るためには水 中の粘 度 と 図 6 ネットワークアナライザーを用 いた水 晶 発 振 子 の周 波 数 スキャン
密 度 の温 度 係数 を考慮した発振 子を設 計することが必 要である。コンピュータ解 析により水 中で安 定 なカット角が 35°59′付近にあることが予想できるようになったので、発振子メーカーの協 力を得て、35° 30′から 35°60′のカット角の異なる発振子を試作する事を計画した(吉嶺グループ)。 装置としては、これまで発振回 路やセル回りの温度 制 御などが手 作りであったために、安定 性やドリ フトなどに問題があった。発 振回路をワンチップ化する、周波数カウンターを基 盤にして装置 内に組み 込む、温度制御を±0.1°C から±0.01°C に向上 させる、セル容量を8 mL から 0.5 mL に低容量 化する、などの改 良を計画した。また、これまでのバッチ式から、マイクロ流路 に組み込んだフローセル 型の作成も計画した(吉嶺グループ)。 (2) 実施体制 ※このグループは、共同研究者(JSTの定義による)ではない。 当チームは、JSTの定義上は1グループ編成である。 森 俊明グループ 東京工業大学 生命理工学部 水晶発振子上での酵素反応を担当 川崎 剛美グループ 東京工業大学 生命理工学部 生体分子の粘弾性測定を担当 古澤 宏幸グループ 東 京 工 業 大 学 フロンティ ア研 究 センター 複 雑 な生 体 分 子 間 相 互 作 用 の測 定 担 研究代表者 岡畑 恵雄 水 晶 発 振 子 測 定 装 置 の開 発 を担 吉嶺 浩司グループ 東 京 工 業 大 学 フロンティ ア研 究 センター(科技振研究員)
3 研 究実施 内容 及び成 果
3.1 水晶発振子上での酵素反応の解析(森 俊明グループ) (1) 研究実施内容及び成果
(A)DNA 上での酵素反応解析:DNA ポリメラーゼの場合 <目的>
これまで DNA ポリメラーゼの反応は DNA を RI ラベルして伸長した DNA をゲルシフトアッセイで分析 してきた。しあこれでは生成物を追跡しているだけなので、酵素反応の反応機構は観察できていない。 水 晶 発 振 子 は電 極 上 でのナノグラムレ ベルの重量変 化を振 動数変 化として追 跡 で きるので、基 板 上 に突 出 末 端 をも つDNA二 本 鎖 を固 定 化 し 、ポ リ メラー ゼとモノマーを加えたときの振動 数の経 時 変 化 から酵 素 の結 合 と DNA鎖 の伸 長 反 応 と 酵 素 の 伸 長 鎖 か ら の 脱 離 の 各過程を追跡できる。 <実験方法> 27MHz 水晶発振子の金電極 表 面 に ビ オ チ ン - ア ビ ジ ン 法 を 用 いて図7に示す突 出末 端をも つ DNA 二本鎖を 120 ng(6 pmol /cm2)を電極面積の 15%に固定 化 し た 。 大 腸 菌 由 来 の ポ リ メ ラ ー ゼ ( Klenow fragment ) 、 つ い で モ ノマー(dATP と dGTP )を 水 溶 液 中 に加 え た時 の振 動 数 の経時的変化を追跡した。 <結果と考察> 突 出 末 端 をもつDNAを固 定 化 した水 晶 発 振 子の入った水 溶 液 中 にポリメラーゼを、ついでモノマ ーを添加したときに典型的な振動数変化を図8に示した。 酵素を添加したときの振動数の減少(重量 増 加 、step A)とモノマーを加えたときの振動 数の減少 (重量 増 加、step B)とそれに続 く振 動 数上 昇 (重量減少、step C)の 3 段階が観察できた。これらの挙動は以下のように解析でき、それを模式的に 図9に示した。
図 8 ポリメラーゼ、ついでモノマー(dATP と dGTP)加 えたときの 振 動 数 の 経 時 変 化 ( 10 mM Tris-HCl (pH 7.4), 10 mM MgCl2, 40 mM KCl, 30 ℃)
Polymerase, then monomers , dATP / dGTP
DNA = 120 ng cm -2 ( 6 pmol cm -2 )
c.a. 15% Area Coverage
C G T T T GA T T A C T G G C C T T GC G A T C T T TT C T T T T C T TT T C G C A A A CT A A T G A C C G G A A CG C T A G
図 7 水 晶 発 振 子 上 への固 定化 と実 験 方 法
Step A(酵素の結合過程):ポリメラーゼを加えたときの経時的な振動数の減少は酵素のDNA鎖へ の結合過程を反映している。平行に達したときの結合量は 140 ng cm- 2 = 2 pmol であり、固定化してい たDNA鎖が 6 pmol であったのでDNA鎖 3 本あたり 1 個の酵素が結合したことになる。突出末端の塩 基配列を変化させたときの酵素の結合と脱着の速度定数を求めた。突出末端をすべて G にしたとき以 外 は塩 基 配 列を変 えても酵素 の結 合と脱 離の速 度 定数 はほとんど変 化しなかった。これは酵 素の結 合過程は突出末端の塩基配列には依存しないことを表している。すべて G にしたときは突出末端が会 合しているために酵素の結合が妨げられていると考えられる。 Step B(伸 長反 応の動 力学 ):モノマーを加えたときの重量 変化はポリメラーゼによる伸長 反応 を反 映しており、30 ng cm- 2 = 6 pmol の重量増加が観察された。固定化されたDNA鎖と同じモル数の重量 増 加 が観 察 されたことからDNA鎖はすべて伸 長 していることがわかる。DNA鎖 の伸 長 反 応 における 突出末端の塩基配列の効果を調べた。突出末端の長さを 15 mer から 50 mer に長くすると伸長反応 による重量増加(Dm)は 3.5 に増加した。濃度変化から求めた Michaelis-Menten 定数(kcatと Km)は 塩基配列には依存せずにほぼ一定であった。このことは伸長反応も突出末 端の塩基 配列には依 存し ていないことを示している。 Step C(酵素の脱離過程):伸長が終了した直後から振動数が上昇(重量の減少)が観察され、これ は酵素が重合の終わったDNAから脱離していく過程と考えられる。このときの重量減少は 140 ng cm-2 = 2 pmol であり、結合した酵素量と同じであった。酵素が脱離した後に残った重量(D)は 30 ng cm- 2 = 6 pmol であり、これは固定 化しておいたDNAと同じモル数であり、反応後はDNA鎖の伸長 による重 量増加だけが残ることになる。 各素過程の動力学的解析
Binding to PrimerTerminus
DNA : Polymeras e = 3:1 140 ng cm-2 = 2 pmol cm-2ofPolymerase
A
120ngcm-2=6pmolcm-2 ofDNA D:Polymerized Amounts 30ngcm-2=6pmolcm-2 d A T P / d G T PB
Dissociation from DNA 140 ng cm-2 = 2 pmol cm-2 of Polymerase
C
DNAPolymerization
30ngcm-2= 6 pmolcm-2
と求められ,その結果,結合定数 Ka = 108 M- 1となった。一方,伸長が終わった DNA 鎖から酵素が離
れていく Step Cでは,それぞれkon = 104 M- 1 s- 1,koff’ = 10- 2 M-1 s- 1,Ka = 106 M- 1と求められた。結
合過程の方が 102も結合定数が大きいことは,酵素が重合が終わったDNA鎖から 102倍も離れやす
いことを表しており,図8の Step Cで酵素が離れていくこともよく理解できる。この 102倍の差は,酵素
の突出末端への結合は平滑末端への結合に比べて kon で 10 倍大きく koff で 10 倍小さいことで説明
できる。また,Step BのDNA鎖の伸長反応はモノマー(dATP/dGTP)に対して Michaelis-Menten 式に 従い,Km = 10- 5 M,kcat/Km = 106 M- 1 s- 1という値が得られ,これらの値はテンプレート部の塩基配列 には依 存しなかった。すなわち,基 質モノマーの選 択的 はテンプレート部との相補 的塩 基 対の形 成で 行われ,ポリメラーゼは基質特異性がなくテンプレート部に沿って重合していくことを反映している。 DNA ポリメラーゼの反応はこれまではゲルシフトアッセイを用いて行われており、酵素反応の各素過 程を定量的に1つのデバイスで測定できたのは初めてである。 (B)DNA上での酵素反応: ATP 依存型DNAヌクレアーゼの場合 27MHz 水晶発振子の金電極表面にビオチン-アビジン法を用いて DNA 二本鎖を 120 ng(6 pmol/cm2)
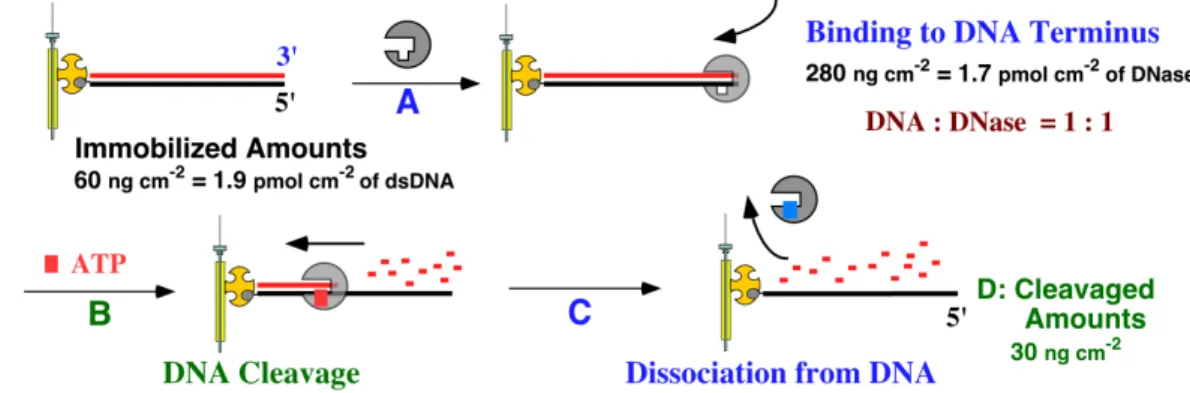
を電極面積の 15%に固定化した。DNA ヌクレアーゼ(Dnase)、ついで ATP を水溶液中に加えた時の 振動数の経時的変化を追跡した。 <反応の経時変化> 二本鎖 DNAを固定化し た水 晶 発 振 子 の入 っ た水 溶 液 中 に DNase 、 つ い で ATP を添加したときの典型 的な振動数変化を図 10 に 示 し た 。酵 素 を添 加 し たと きの振 動数 の減 少(重 量増 加、step A)と ATP を加えた と き の 最 初 の 振 動 数 の 上 昇(重量減少、step B)とそれに続く振動数の上昇(step C)の 3 段階が観察できた。これらの挙動は以 下のように解析でき、それを模式的に図 11 に示した。 Step A<酵素の結合過程>:Dase を加えたときの経時的な振動数の減少は酵素のDNA鎖への結 合過程を反映している。平行に達したときの結合量は 280 ng cm- 2 = 1.7 pmol であり、固定化していた DNA鎖が 60 ng cm-2 = 1.9 pmol であったのでDNA鎖 1 本あたり 1 個の酵素が結合したことになる。 Step B と C<加水分解と酵素の脱離過程>:ATP を加 えたときの最初の急激な重量減少はあTPが 図 10 DNA固 定 化 発 振 子 にヌクレアーゼ(DNase)、次 いで ATP を 添 加 したときの振 動 数 変 化
酵素に取り込まれて DNA 鎖の3’末端から加水分解が起こり、反応が終了すると酵素が一本鎖 DNA から離れる過程を反映している。反応終了後は開始時に比べて 30 ng cm- 2 = 1.9 pmol 分振動数が上
昇(重量減少、D)した。これは最初に固定化した DNA 鎖の半分であることから、Dnase は DNA の3’ 側のみを切断し結果的に一本鎖のみが発振子上に残ったことを反映している。
図 11 ATP 依 存 型 DNase の DNA 加 水 分 解 の反 応 機 構
<反応の動力学>
最 初 の酵 素 結 合 過 程では、DNase の濃 度 変 化をして酵 素 の結 合 速 度 定 数 (ko n)と脱 離 速度 定 数
(ko ff)求めた。加水分解過程では ATP 濃度変化を行い、Michaelis-Menten 式から DNA 鎖に結合し
ている酵素に第二の基質として ATP が取り込まれるときの Km値と加水分解速度定数 kcat値を求めて 図12にまとめた。 図 12 DNase 加 水 分 解 反 応 における各 反 応 過 程の動 力 学定 数 これまで、DNA上での酵素 反応はゲルシフトアッセイなどの定性 的な方 法に限 られていたが、水 晶 発振子マイクロバランス法を用いれば、動力学を正確 に求めることができ、これからの酵素反応 解析に 新しい手法を提供できる。
(C)DNA上での酵素反応の解析:EcoRV 制限酵素の場合 <目的> DNAの部位特異的に切断する制限酵素の反応はこれまではゲル電気泳動などの方法で解析され てきたが、酵 素 のDNA鎖 への結 合 、DNA鎖の切 断反 応 は個 別 にかなりの手 間 をかけて行 われてき た。DNA固定 化水 晶発振 子を用いることにより、DNA鎖への酵 素の結 合と切断 を重量 変化として経 時的に連続して追跡できると考えられる。 <実験方法> 27 MHz 水晶発振子の金電極上にビオチンアビジン法を用いて EcoRV の認識サイトを分子の中程 に持つ 55 base pair のDNA二本鎖を固定化した。DNAの固定化量は酵素の結合に影響を与えない ように基板表面積の約7%に抑えた。25 ℃, pH 7.5 (10 mM Tris buffer), 150 mM NaCl, 5 mM MgCl2
の条件下で EcoRV を加えたときの振動数変化を図13 に示した。
図 13 DNA二 本 鎖 固 定 化 水 晶 発 振 子 に制限 酵 素 EcoRV を加 えたときの振 動 数 変 化 (25℃, pH 7.5, 10 mM Tris buffer, 150 mM NaCl, 5 mM MgCl2)
<結果と考察> 図13 の酵素を加えた直後の振動数の減少(重量増加)は酵素のDNA鎖への結合課程を表してい る。それに続く振動数の上昇 (重量減少)はDNA鎖の加水分解反応を反映している。最初のDNA鎖 の固定化量は 129 ng cm- 2 (3.5 pmol cm- 2) であり、結果的に 60 ng cm-2 (3.5 pmol cm-2) の重量減 少 は固 定化 したDNA鎖 のすべてが切 断 部 位で切断されていることを反 映している。振動 数 変 化は, 酵素の結合、加水分解反応、酵素の脱離という連続的に進行する反応を重量変化として表している。
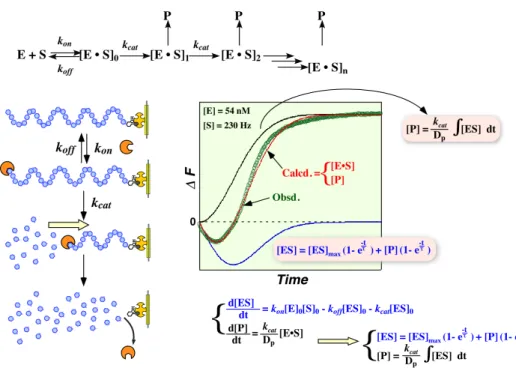
酵素—基質複合体の生成量は式(1)で表され、加水分解による生成物量は式(2)で表される。
[ES]
= [ES]
max(1
− e
−tτ)
+ [P](1− e
−t τ
)
(1)[P]
=
k
catD
p∫
[ES]dt
(2) 式(1)と(2)の連立方 程式を解くことによって実 際の反 応の経時変化をカーブフィッティングできる。 図14 には、式(1)と(2)の経時変 化と(赤と青色の実 線)、実際の反応の経 時変化 (黒線 )と、それに フィットするように酵素の糖鎖への結合 速度定 数(k1)、解離速度定 数(k- 1)、結合 定数(Ka)、ES複合 体 内 での加水 分 解 速 度 定 数 (kcat)の各 パラメーターを算 出 して求 めた曲 線を緑 色 で示 した。計 算 式 は実際の経時変化によくフィットしたので、これらの酵素反応の各反応パラメータ-を表2にまとめた。 表2に示すように、水晶発振子法を用いると、酵素の糖 鎖への結合と脱離の速度(k1 と k-1)および 結合定数(Ka = k1/k-1)、さらには切断速度定数(kcat)が同時に求まる。EcoRV は Mg2+イオン存在下で は 切 断 反 応 まで 触 媒 するが、Ca2 +イオ ン存 在 下 で は酵 素 の結 合 のみが起 こ るこ とが知 られている。 Ca2 +イオン存在下で酵素の結合過程だけを追跡したときのk 1, k- 1およびKaの値は Mg2 +イオン存 在 下 の加水分 解過程までを含めた求めた値と良い一 致を示した。これまではゲル電気 泳動などでDNA鎖 に放射性ラベルを施して観察していたのに比べ遙かに定量的に動力学定数が求まることがわかった。 図 14 EcoRV によるDNA切 断 の振 動 数 変 化のカーブフィッティングとその解析表 2 EcoRV によるDNA鎖 切 断の動 力 学 定 数 (D)糖鎖上での酵素反応:アミロペペクチンのグルコアミラーゼによる加水分解 <目的> 糖関連酵 素は、古くから食品産 業などを中心としてその加水分解 反応について検討されてきたが、 反応を追跡する手段が発色法や液体 クロマトグラフなどに限られてきたためにその反応メカニズムにつ いてはよくわかっていない場合が多い。反応を解析する手段としての Michaelis-Menten 法では、酵素 /基質複合 体の生成 量が追跡できないことが一つの理由である。水 晶発振 子マイクロバランス法を用 いれば、酵素/基質複合体の生成 量を直接重量変化 として追跡できるので、これまでに求められなか った正確な動力学解析ができると考えられ、新しい手段になることが期待される。 <実験方法> 27 MHz 水晶発振 子の金電極表 面にビオチン-アビジン法を用いてアミロペクチン糖鎖を固定化し た(図15)。アミロペクチンの固定化量は、酵素の結合 に影響を与えないように基板面積の18%(0.46 pmol/0.049 cm2)に抑えた。 図 15 アミロペクチンの固 定 化 水 晶 発 振 子にグルコアミラーゼを添 加 したときの 振 動 数 変 化 ( 25 °C, 20 mM 酢 酸 緩 衝 液 , pH 4.8, 100 mM NaCl, [amylopectin] =0.46 pmol/0.049 cm2, [glucoamilase] = 0.1 unit
図 16 酵 素 反 応 課 程 の反 応 解 析 とカーブフィッティング <結果と考察> 25 °C, 20 mM 酢酸緩衝液, pH 4.8, 100 mM NaCl の条件で、0.1 unit のグルコアミラーゼを加え たときの振動数変化を図15 に示した。酵素を加えた直後の振動数の減少(重量増加)は酵素の糖鎖 への結 合 課 程を表している。それに続 く振 動数 の上昇 (重 量 減 少 )は糖 鎖の加 水 分 解 反 応を反 映し ている。結果的に 140 ng/cm2の重量減少は、固定化したアミロペクチンがほとんど加水分解したことを 反 映 している。振 動 数 変化は,酵素 の結 合、加 水分解 反 応 、酵 素の脱 離という連 続 的に進行 する反 応を重量変化として表している。反 応のパターンとしては、上述のEcoRVによるDNA鎖の切断過程と 良 く似 ている。酵 素 -基 質 複 合 体 の生 成 量 は先に述べた式 (1)で表され、加 水 分 解 による生 成 物 量 は式(2)で表される。 先に述べたように、式(1)と(2)の連立方 程式を解くことによって実際 の反応の 経時変化 をカーブフィッティングできる(図 16)。カーブフィッティングから求めた酵素の糖 鎖への結合 速度 定数 (kon)、解離 速度 定数 (kof f)、解 離定 数(Kd)、ES複合 体内での加 水分 解速 度定 数(kca t)を 表3にまとめた。 表3に示すように、水晶発振子法を用いると、酵素の糖鎖への結合と脱離の速度(kon とkoff)および 解 離 定 数 (Kd = koff/kon) 、さ らには 加 水 分 解 定 数 (kcat) が同 時 に 求 ま る。 こ れま で は 水 溶 液 中 で Michaelis-Menten 式を用いて解析してきた。マルトペンタオースを基質にしたときのKm値とkcat値を表 3 にあわせて示した。Michaelis-Menten 式から求めたKm=1.2 x 10- 4 M と水晶発振子で求めたKd = 4 x 10- 9 M は 105倍も異なった。これは、Michaelis-Menten 式では、ES複合体の生成量を追跡できない
仮定をおいて Km値を算出している。水晶発振子法で求めた koffとkcatは各々、koff =9.3 x 10- 5 s- 1と
kcat =93 s- 1であり、あきらかにkoff < kcatであり、Michaelis-Menten 式が成り立たないことになる。すなわ
ちアミ ロペ クチ ンのグ ルコ アミ ラーゼに よる 加 水 分 解 反 応 で は 、koff > kcat の仮 定 が成 り 立 たな くて Michaelis-Menten 式では解離定数が求められないことになる。ちなみに kcat 値は両者で求めた値は 54 s- 1と 93 s- 1でほぼ一致した。すなわち、水晶発振子法を用いることによりこれまで Michaelis-Menten 法だけで解析してきた酵素反応の動力学に新しい方法論を展開できる可能性がある。 表 3 アミロペクチンのグルコアミラーゼによる加 水 分 解の反応 強 力 学 定 数 (E)糖 鎖 上 での酵 素 反 応 :デキス トランスクラーゼによる糖 鎖 伸 長反応 <目的> デキストランスクラーゼはスクロー スを基 質にしてグルコースをデキス ト ランの還 元 末 端 に結 合 さ せて糖 鎖 を伸 長 さ せるこ と が出 来 る糖 転 移 酵 素 の1種 で ある。デキスト ラン を水 晶 発 振 子 基 板 上 に固 定 化 す れば、ショ糖 を 基 質 にし て基 板 上 で 糖 鎖 伸 長 過 程 を 重 量 増 加 と し て観察できる。 図 17 デキストラン固 定 化 発 振 子 上 でのデキストランスクラーゼ添 加 に よる 糖 鎖 伸 長 反 応 の 観 察 ( [Dextransucrase]=18 nM, 10 mM Acetate Buffer (pH: 5.2), 25℃)
<結果と考察> デキストラン固定 化基 板にデキスト ランスクラーゼを添 加 すると、デキスト ランへの酵 素の結 合に伴 う微 少の重 量 増 加 (振 動 数 の減 少 )が観 察 さ れ た(図 17)。平 衡 に達 した後 にモノマ ー基 質 であるスクロースを添 加 すると 大 きな重 量 増 加 が認 められ、重 合 の 進 行 を 観 察 す る こ と がで き た 。 糖 鎖 加水分 解反 応と同じように、カーブフ ィッティングを行 うこ とにより、動 力 学 的 解 析 を行 ったとこ ろ、プライ マーで あるデキストランへの酵素の解離定数は Kd = 2.7 mM、スクロースに対するKm値は 0.11 mM,伸長の kcat値は 51 s- 1と求められた。 酵素を基板に固定化して,同様な実験を行い、その結果をまとめて図 18 に示した。酵素を固定して プライマーとモノマー基質を添加した系の場合にも動力学的パラメータ(Km値は 0.54 mM,kcat値は 10 s- 1)の大きな差異はなかったことから、いずれの方法での酵素反応が追跡できることもわかった。これは 酵素を基板上に固定化し生成物である糖鎖の伸長反応を直接観察した最初の例である。 (F)糖鎖上での酵素反応の解析: フォスフォリラーゼによる糖鎖の可逆的な分解と伸長反応の解析 <目的> フォスフォリラーゼは下式に示すようにリン酸存在下でα-1,4グルカン鎖を過リン酸分解できる酵素 であると同時に、グルコース-6-リン酸存 在下ではリン酸基を脱離しながら糖鎖の伸長がおこるという興 味深い酵素である。糖鎖の分解と伸長はいずれも質 量変化を伴う反応であるので、QCM 法ではその 反応過程を追跡できる。 + OH CH2OH O O H OH P O OH OH O OH CH2OH O OH O OH n-1 H OH CH2OH O OH O H OH CH2OH O OH O OH n-1 P HO OH OH O + ( -1,4-D-glucosyl)n Pi G1P ( -1,4-D-glucosyl)n-1 Phosphorolysis Polym erization 図 18 発 振 子 上 に基 質を固 定 化したときと酵 素を固 定 化 したとき の、デキストランスクラーゼによる糖 鎖 伸 長 反 応 の動 力 学 定 数
<結果と考察> 水 晶 発 振 子 の金 基 板 の表 面 にアビヂンを固 定 化 し還 元 末 端 をビオチン化 したアミロペクチンを固 定 化 した。図 19に示すように、フォスフォリラーゼを添加 すると振 動数 の減 少 (重 量 の増 加)が観 察さ れ、酵 素 が基 質 に結 合 する過 程 が観 察 できた。さらにリン酸 を加 えると大 きな振 動 数 の減 少 (質 量 の 増加)が見られた。これは基板上の糖鎖の分 解(加リン酸分解)を反映している。酵素が結 合した時点 でリン酸の代わりにグルコース-6−リン酸を加えると、重 量の増加が観 察され、基 板上での糖鎖の伸 長 反応が観察された。 振 動 数 の経 時 変 化 から酵 素 の糖 鎖 への結 合 時 における結 合 速 度 定 数 (ko n)、解 離 速 度 定 数 (ko f f) および解 離定 数 (Kd)が求められた。さらに、加リン酸 分解 反 応での触媒 速 度定 数 (kcat)、リン酸 基 質の 解 離 定 数 (Km)とみかけの二 次 速 度 定数 (kcat/Km)、さらには、糖 鎖伸 長 反 応における触媒 速 度 定 数 (kcat)、グルコース-6-リン酸 基質 の解 離 定数 (Km)とみかけの二次 速 度定 数 (kcat/Km)が求められた。 結果を表4にまとめた。 酵素の基質への親和性(Kd= 3.2 x 10- 7 M) は通常の糖鎖関 連酵 素とよく似た値であるが、 興 味 深 いのは、過 リ ン酸 分 解 速 度 における各 速 度 定 数 と 糖 鎖 伸 長 反 応 にお ける速 度 定 数 がほぼ同 じで ある点 で ある。フォスフォリ ラーゼ は酵 素 分 類 上 は分 解 酵 素 として分 類 されてい るが、じつは縮 合 活 性 が分 解 活 性 と同 程 度 持 っており、糖 転 移 酵 素 とし て分 類 さ れてもおか し くないことがわかった。こ れまで に、同 じ 反 応 条 件 で フォスフォリラーゼの加 リ ン酸 分 解 活 性 と糖 鎖 伸 長活 性 を定量 的 に求 めた例はなかっ たので、QCM 法 により定 量 的 にかつ網羅 的 に酵 素触 媒反 応 が求 められて初 めて明 らかになった。 表 4 フォスフォリラーゼによるアミロペクチンの加 リン酸 分 解と糖 鎖 伸 長 反 応 の動 力 学 定 数 図 19 アミロペクチン固 定 化 水 晶 発 振 子 上 での フ ォ スフ ォ リラー ゼに よる 可 逆 的 な糖 鎖 の分 解 (青 線 )と伸 長 (赤 線 )反 応
(G)糖鎖上での酵素反応の解析: 点変異イソマルトデキストラナーゼの反応解析 <目的> 糖加水分解酵素の活性の定量的評価法として,古くから Michaelis-Menten 速度論が用いられ、反 応生成物を定量することで,Kmと kcat値を算出している。近年,アミノ酸残基の役割についてより詳細 な知見を得るために変 異型酵素を作製し,その活性 評価や X 線結晶構 造解析などが盛んに検討さ れるようになってきているが,その際 に酵 素活 性が消 失してしまった場 合には、生成 物が得 られないの で Michaelis-Menten 法では解析が出来ない。そのために変異導入の影響についても議論できないこ とが多い。しかし、QCM 法を用いれば、酵素・基質複合体の生成量を振動数変化として追跡できるの で、酵素への点変異が基質結合過程か触媒過程に働いているのか、あるいは両者に有効なのかが解 析できると考えられる。 <結果と考察> イソマルトデキストラナーゼの X 線結晶構造解析はまだ行われていな いので、基 質 の結 合 や触 媒 作 用 に関 与 する残 基 をガラクトース加 水 分 解 酵 素 (GH)ファミリー27 に属 する酵素 のアミノ酸配列 ,結 晶構 造 など をもとに分 子モデリングを参 考 にして、活性 中 心近 傍に存 在すると推 測 される酸性アミノ酸残基 Asp198,266 および 313 に注目し,これらの残 基 をアスパラギンに変 換 した変 異 型 酵 素 をそ れぞれ作 製 した。変 異 型 酵素は,各種カラムクロマトを順次行なうことにより,電気泳動的に均一になるまで精製した。 水 晶 発 振 子 基 板 上 にデキストランを固 定 化 し、イソマルトデキストラナーゼのワイルドタイプ(WT)、 D313N, D198N, D266N を加えたときの振動数変化を図 20 に示した。Wild Type の時は酵素の添加と 共に振動数が上昇 (重量が減少 )し、基質が分解していることがわかる。一方、変異を入 れたいずれの 酵素も振動数が減少(重量が増加 )し、酵素が基 質に結合するが加 水分解 反応が起こっていないこと がわかる。振動数変化をカーブフィッティングして動力学解析したときの結果を表 5 にまとめた。
触 媒 活 性 (kcat 値 )についてはい ずれの ア スパ ラギ ン酸 (D) も重 要 な役 割 をし ていることがわか った。 D198 および D313 に関しては,ア スパラギン(N)に変 換 することで , 結 合 活 性 が低 下 していることが振 動 数 変 化 や Kd か らわか る。特 に D313N では親和力の低下が顕著 であり,本残基は触媒よりむしろ基質との結合に関与していることが推察される。 反応速度パラメータと、詳細な研究がなされているファミリー13 の Taka-アミラーゼの反応メカニズム をもとに,これら残基の役割を推察すると,D198 は基質との結合とオキソカルベニウムカチオン中間体 の安定化に、D266 は一般酸塩基触媒に,D313 は基質との結合・固定にそれぞれ寄与しているものと 推察される。このように QCM による反応速度解析と部位特異的変異導入法を組み合わせることにより, アミノ酸 残 基 の役 割 ,さらには触 媒 反 応 メカニズムの解 明 につながるものと考えられ、QCMは酵 素の 点変異解析に有効な武器になることが期待される。 (H)タンパク質の加水分解反応の解析 <目的> DNA や糖鎖と異なり、タンパク質は3次元構造があり基質としては酵素反応の制約を受けると考えら れる。ここでは、タンパク質基質としてミオグロビン(17 kDa)を選んだ。ミオグロビンは分子内に SS 結 合 がなく8本のαヘリックスのみからなる構造の単 純なタンパク質であり、プロテアーゼによる加 水分 解 には適した基質である。プロテアーゼとしては、C 末側からアミノ酸を1つずつ加水分解できる Exo 型の カルボキシペプチダーゼ P(CPP)を選んだ。Endo 型のプロテアーゼではタンパク質のどこを切断したの かが不 明であり、水 晶 発 振子 上での重 量 減 少から反応 を追 跡 するには解 析が困 難であるという理 由 で Exo 型酵素を選んだ。 <実験方法> ミオグロビンをビオチン化してアビジンで被覆した QCM 基板上に固定化し、カルボキシペプチダー ゼを添加したときの振動数変化を追跡した。 <結果と考察> ミオグロビンを固定化した水晶発振子に、カルボキシペプチダーゼ P(CPP)を添加したときの振動数 変化を図21に示した。CPP を添加すると基質への酵素の結合による振動数減少(重量増加)と、それ に引き続いておこる振動数増加(重量減少)が見られた(赤線)。一方、CPP の活性中心の Ser-OH 基 表 5 点 変 異 イソマルトデキストラナーゼによるデキストラン 加 水 分 解 反 応 の動 力 学 定 数
を共 有 結 合型 阻 害 剤でつぶした酵 素では、基 質 への結合 だけが見 られ、加水 分解 反 応は見 られなかった(青線)。CPP による加水分解では 固 定 化 したミオ グロビンの約 40%が加 水 分 解 された。 これまでの酵 素 反応 と同 様に振 動 数変 化 の カーブフィッティングから、CPP の基 質 への結 合 速 度 定 数 (ko n)、解 離 速 度 定 数(ko ff)、加 水 分解 速度 定数 (kcat)を求 めた。タンパク質 基質 の場 合 は 基 質 の3次 元 構 造 が加 水 分 解 速 度 に大 きな影 響 を与 え ると 考 え 、加 水 分 解 速 度 のpH 依存性についても調べた。各pH におけ るそれぞれの動 力 学 パラメーターを図 22 右 に まとめた。図 22左には同 条件での Z-Phe-Try ジペプチド基 質 の加 水 分 解 反 応 をニンヒドリン 反応で追跡し、Michaelis-Menten 式で解析し、Km値とkcat値を求めてその pH 依存性を示した。 ジペプチドの CPP による加水分解においては、Km値、kcat値ともにほとんどpH 依存性はなかった。 一方、QCM 法では基質への結合速度ではko ffはほとんどpH 依存性を示さなかったが、ko nはpH 3.7 付近で最大値を示した。また kcatはpH の低下と共に増大した。図22右下の青線に示したように基質 であるミオグロビンのαヘリックス含量はpH の低下と共に減少する。すなわち、CPP 酵素の kcatにはほ とんど pH 依存性はないが、pH が低下してミオグロビンの構造がランダムコイルになって行くに従い、見 かけ上kcat値が増加するように見える。CPP のkcatにpH 依存性がないことは図22左のジペプチドのkcat
のpH 依存性からもわかる。すなわちこの酵素のpH 依存性は酵素の基質への結合速度 kcatに表れて
いる。QCM 法ではko n、ko ff、Kd=ko ff/ko n、kcatのすべての動力学パラメーターが個別に求められる特 徴
がある。Michaelis-Menten 式から求められるKm値は[(kcat + ko ff)/ko n]で表され、kon、ko ff、kcat値から逆
算して図22右の黒線の pH 依存性で示した。ジペプチドの Km値のpH 依存性がないのに対して、ミオ グロビンの場合は低pH になるに従って Km値が増加するのは、基質のコンフォメーションが崩れるに従 って kcat値が増加するためである。結局、タンパク質の加水分解では、基質の3次元構造が加水分解 速度に大きく影響することがわかった。 これまで水溶液中での Michaelis-Menten 式を用いての加水分解反応では、基質のコンフォメーシ 図 21 ミオグロビン固 定 化 水 晶 発 振 子 にカルボ キシペプチダーゼ P(CPP)を添 加 したとき の振 動 数 変 化 (CPP の活 性 中 心 を阻 害 し た 酵 素 では 基 質 へ の 結 合 のみ が 見 ら れた)
Kd=ko ff/ko n 値と加水分解速 度のパラメーターkcat 値を分けて求められるので、タンパク質加水 分解に おける基質のコンフォメーションの影響が詳細に議論できる特徴がある。 図 22 (右 )ミオグロビンの水 晶 発 振 子 上 での加 水 分 解 速 度 のpH 依 存 性 、(左 ) Z-Phe-Try ジペプチドの水 溶 液 中 での加 水分 解 速 度 のpH 依 存 性 (2) 研究成果の今後期待される効果 水晶発振子法の大きな特徴は酵素反応における反応 中間体である ES コンプレックスの生成と分解 速度を重量変化として求めることにある。そのために、これまで測定することが困難であった、酵素の基 質への結合性のパラメーターである ko n、ko ff、Kd=ko ff/ko n値と触媒速度定数 kcat値を同時に求められ る。従来の生成物を追跡して Michaelis-Menten 式で Km値と kcat値を求める方法に取って代わると考 えられる。反応としても核酸 分解、糖鎖分 解と伸長 、タンパク質の分 解などいろいろな反 応に適 用でき ることも大きなメリットである。 3.2 膜タンパク質の固定化とシグナル分子の結合(古澤グループ) (1)研究実施内容及び成果 生 体 内 のタンパク質 の40%は生 体 膜上 にあると言われ、様 々な認 識 や反応 が行われている。膜 タ ンパク質上でおこる認 識や反応 を解 析するためには基板 上に脂 質膜 内に固定 化された膜タンパク質
を構築することが必要である。そのためには水晶発振子の金基板上を利用する方法が適している。 膜タンパク質としては、細菌 Streptomyces lividans 由来のK+イオンチャネルタンパク質であるKcs Aを選んだ。KcsA は図 23 に示すように、158 個のアミノ酸からなる2本の膜貫通型αヘリックスの4量 体から構成され、内部にカリウムイオンが通る穴が存在 する。KcsA は細菌由来であるので、164 番目 のリジンをアスパラギン酸に変えた R64D にはサソリ毒由来の Agitoxin2 ペプチドがチャネルブロッカー として結合することが知られている。 <膜タンパク質の基板上への固定化> 膜タンパクを基板上に固定化する方法としてリポソームに再 構 成 して基 板 上 に吸 着 させる方 法 が知 られているが、この方 法では、膜タンパクの固定化量が少ない、膜タンパクの配向が 制御できない、などの欠点がある。本 研究では図24 に示すよ うに、KcsAのC末 端 側に遺 伝 子 操 作 によりシステインを導 入 し、大 腸菌で発現した。界面 活性 剤で可 溶化 したKcsAの C 末端の SH 基をビオチン化試薬(PEO-Iodoacetyl Biotin)でビ オチン化し、アビジンを固 定化したQCM基板上に固 定化した。 こ れを基 板 上 で 混 合 ミ セル法 を用 いてリ ン脂 質 膜 (DOPE と DOPC)と置 換した。これらの操 作をQCM法で重さの変 化とし て追跡し、KcsA の固 定化量と脂質 膜で置換されたかどうかを確認した。ほかにも、ビオチン化 脂質を 一部導入したときには脂質膜の表面がアビジンで1層覆われること、蛍光脂質を導入したときには基盤 全体が蛍光で光ることから、KcsA の周りが脂質膜で置き換わったことを確認した。 図 24 QCM 基 板 上 への膜 タンパク質 KcsA の固 定 化 と脂質 膜 置 換 による膜 タンパク質の再 構 成 の模 式 図 <KcsA への Agitoxin2 ペプチドの結合過程の解析> QCM 基板 上に脂質 二分 子膜と共に固定化した Agitoxin2 チャネルブロッカーペプチドの結合は KcsA タンパク質に対してペプチドの分子量が小さいこともあって、これまで使っていた装置(AFFINIX 図 23 膜 タンパク質 としての KcsA イオンチャネルと R64D 変 異 体 へのチャネルブロッカー Agitoxin2 の結 合 の模 式 図
Hz、ドリフトを 0.5 Hz/h に低下した装置を作製した(図25)。
図 25 高 感 度 フローセル型 QCM 装 置 の模 式 図
測定結果を図26に示した。Wild type (WT)の細菌由来の KcsA にはサソリ毒の Agitoxin2 はほとん ど結合しないが、変異を入れた R64D 体を脂質膜に可溶化した系では Agitoxin2 は KcsA に対して1: 1で結合した。一方、R64D を界面活性剤で可溶化しただけの系では Agitoxin2 は過剰に結合した。こ れは界面活性剤で可溶化しただけでは KcsA は変性しやすく、Agitoxin2 が非特異吸着してしまうため である。振動 数 変化 のカー ブフィッティングか ら求 めた 結合のパラメーターはko n = 2.7 x 104 M- 1 s- 1、k o ff = 5.7 x 10- 4 s- 1、K a= 4.4 x 106 M- 1 であった。類 似 の測 定 値 がないので得 られた値 を 直接比 較することは出来な いが、Ka= 106 M- 1という結 合 定 数 はチ ャネルブ ロッカ ー の 結 合 定 数 と し て は 妥 当な値である。 (2)研究成果の今後期待される効果 QCM 基板上に膜タンパク質を脂質二分子膜と共に高密度に配向を保ちながら固定化でき、シグナ ル分 子 の結 合 の動 力 学 解 析 が出 来 たことは、今 後 の膜 レセプターへの種 々の薬 物の結 合 挙 動 を解 析する上に有用であり、今後の創薬分野への応用が期待できる。 図 26 QCM 上 に固 定 化 した WT の KcsA、脂 質 膜に固 定化 した R64D の KcsA、界 面 活 性 剤に可 溶 化 した R64D-KcsA への Agitoxin2 の結 合 挙 動 (50 mM Tris-HCl pH 8.0, 50 µM EDTA, 100 mM NaCl, 50 mM KCl, 0.1% DDM, 25 ℃, Flow Rate 25 mL/min)
3.3 リボソームでの翻訳過程の定量化(古澤グループ) (1)研究実施内容及び成果 <目的> mRNA の遺伝情報に基づきタンパク質に翻訳される過程は、近年リボソームの X 線結晶解析がなさ れたことにより急 速 に進 み、無 細 胞翻 訳 系などに実用化 されつつある。しかし、分 子 レベルでのメカニ ズムなどまだまだ解 明しなければならない課題 は多 い。例えば、翻 訳が開 始されるためには開 始複 合 体が形成されなければならないが、その過程すら不明 な点が多い。図27に示すように、教科書的には 70S リボソームは開始因子 IF3 の作用により30S リボソームと50S リボソームに解離し、SD 配列を認識 できる30S が最初に mRNA に結合し、ついで50S リボソームや fMet-tRNAi が結合して開始複合体が 作 製 さ れると提 唱 さ れている。リ ボソームは RNA とタンパク質 の巨 大 な複 合 体 であり、質 量 も大 きく QCM 法で測定するには適したターゲットである。
図 27 mRNA にリボソームが開 始 因 子 (IF1, IF2, IF3)や fMet-tRNA と共 に結 合 して開 始 複 合 体 が形 成 される過 程 の予想 図
<実験方法>
リボソームが特異的に結合する Shine-Dalgalno (SD)配列と tRNAi が結合する AUG 開始コドンを持 つmRNA を cDAN から逆転写により作製した。3’末端にビオチンを導入し、アビジン固定化 QCM 上 に固定化した。70S、50S、30S リボソームを添加した時の振動数変化を測定した。 <結果と考察> 図28にmRNA 固定化 QCM へのリボソームの結合挙動を示した。SD 配列を認識できる30S リボソ ームは mRNA に結合するが、50S リボソームにはほとんど結合しない。しかしこれまで結合しないと考え られていた70S リボソームが予想外にも mRNA に解離することなく結合することがわかった。結合過程 の振 動 数 変 化 から結 合 速 度 定 数 (ko n)、解 離 速 度 定 数 (ko f f)、結 合 定 数 (Ka)を求 めて表 6にまとめ た。 50S リボソームはmRNA にほとんど結合しないが、70S は30S と同じような結合定数と結合・解離速
異的な結合であることがわかる(Run 4 と 5)。mRNA の5’末 端を anti-UTR でブロックした mRNA には70S が結合できな いことから、70リボソームは5’末端から滑りながら mRNA に 結 合 す るので は なく 、 横 方 向 か ら 結 合 す ると 考 え られ る 。 AUG 開始コドンを認識する fMet-tRNAi 共存下では70S リ ボ ソ ームの結 合 定 数 (Ka)は 2倍 ほ ど上 昇 し たが、AUG を
UUG に置き換えた mRNA へのKaは1/3に低下した(Run 7
と 8)。 リボソームの片方を架橋して解離しないようにした70S は SD 配列を持つ mRNA には結合できなかった (Run 9)。しか し、AUG 開始コドンを5‘末端に持つ mRNA には結合速度 は遅くなるが、結合することがわかった(Run 10)。 表 6 種 々の mRNA へのリボソームの結 合 パラメーターa 図 28 (A)mRNA 固 定 化 QCM への(a)70S、 (b)30S、(c)50S リボソームの結 合 挙 動 と(B) (a)70S 、(b)30S リ ボソ ー ム の飽 和 結 合 挙 動 ( 10 mM HEPES-KOH, pH 7.3, 100 mM NH4Cl, 5 mM MgCl2, 0.5 mM CaCl2, 25 °C)
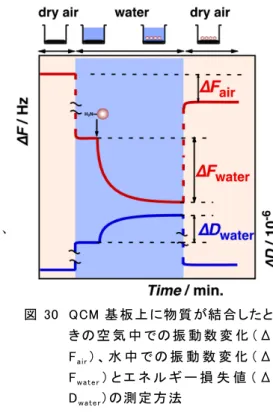
これらの結果は、70S リボソームは解離することなくmRNA の SD 配列に横から結合して、開始複合 体を形成できることを示している。これまで、70S は一度30S と50S に解離してから mRNA に結合する と考えられていたが、こういう通常の経路のほかにも解離しないでそのまま mRNA に結合する経路もあり 得るのではないかと言うことがわかった(図4参照)。 (2)研究成果の今後期待される効果 翻訳過程は多くの因子が複雑に絡み合ってmRNA の遺伝情報からタンパク質を発現している。これ まで知られていなかった新しいルートで開始 複合 体が形成されることが重量 変化として追跡 することで 明らかになった。今後、リボソームの伸長過程、解離過程についても検討する必要がある。 3.4 生体分子の粘弾性と水和の評価(川崎グループ) (1)研究実施内容及び成果 <目的> これまでの研究では水晶 発振 子を発 振回路を用いて強制発 振させ、物 質が吸 着したときの重量増 加 を振動 数 減少として検出していた。これとは別に水晶 発 振 子をネットワークアナライザーに接続 して 周 波 数を掃引 すると共 振周 波数 がコンダクタンスの最大 値 (Fs)として表 れる(図29)。基板 上に弾 性 体が吸着するとピークトップが低波数 側にシフトし、このシフト量は発 振回 路での振動 数変化と対 応す る。一方、基 板上に粘性 体が吸着すると振動エネルギーが粘性体に伝わりにくいためにエネルギー散 逸が起こり、ピークはブロード化して低波数側にシフトする。エネルギー散逸の程度は D = (F2-F1)/Fs のピークの広がりの度合いで表される。 タンパク質や DNA 鎖のような生体分子を QCM 基板上に固定化すれば、生体分子の水和により空 気中に比べて大きな振動数減少(ΔF)と、生体分子の柔らかさのためにエネルギー損失(ΔD)が大き くなることが予測される。すなわち水中で種々の生体分子が基板上に結合したときのΔF 値とΔD 値を 測定すれば、生体分子の水和の度合いと柔らかさが予測できる。
<実験方法> 図30に示すように、QCM の振動数 F とエネルギー損失 値 D を、空気中、水中に浸けた時、物質が結合した時、吸 気中に取り出して乾燥した時に測定し、空気 中で物質 が結 合したときの振 動 数変 化ΔFai r、水中で結合したときの振動 数変化ΔFwate rとエネルギー損失値ΔDwaterを求めた。 <結果と考察> QCM 基板上にポリスチレン高分子(PS)、BSA タンパク質、 二本鎖 DNA の固定化量を変化させたときの結果を図31に まとめた。PS はΔFairに対するΔFwate r の変化量は同 じ、す なわちΔFwater/ΔFai r の傾 きは1であり、空 気 中 と水 中 での 振 動 数 変 化は同じであり、疎 水 的な膜 なので水 和していな いことがわかる。また、単 位 質量 あたりのエネルギー損失 値 ΔDwater/ΔFai rはほとんど0であり、PS は硬い膜であることが
わかる。また、タンパク質である BSA を固定したときは、ΔFwate r/ΔFair=2.5 であり、空 気中に比べて
2.5 倍も水中で振動数変化が大きく、これは自重の[(ΔFwater/ΔFair)−1]=1.5 倍も水和していることを
表している。ΔDwater/ΔFai r=1.6 x 10- 6と少しエネルギ−損失があるが、このエネルギー損失は水和水
を振っているためである。一方、DAN 鎖を固定化したときは、ΔFwater/ΔFa ir=6.3 と共にΔDwater/ΔFair
=19 x 10- 6も非常に大きくなり、DNA 鎖は柔らかくて水和していることがわかった。
図 31 QCM 基 板 上 にポリスチレン(PS)、BSA タンパク質 、二 本 鎖 DNA を固 定 化 量 (ΔFair)を変 化 させて結 合し
たときの(左 )ΔFwate r と(右 )ΔDwate r の変 化 の度 合 い。各 々の直 線 の傾 きはそれぞれ水 和 量 とエネルギ ー損 失 量を表す。 図 30 QCM 基 板 上 に物 質 が結 合 したと き の 空 気 中 での 振 動 数 変 化 (Δ Fair) 、 水 中 で の 振 動 数 変 化 ( Δ Fwate r) と エ ネ ル ギ ー 損 失 値 ( Δ Dwate r)の測 定 方 法
種 々の生体 高 分 子を QCM 基 板上 に固定 化 し、ΔFwater/ΔFai r とΔDwater/ΔFai r を求 め、水 和 量
[(ΔFwater/ΔFair)−1]に対してエネルギー損失量ΔDwater/ΔFai rをプロットし、図 32 にまとめた。ポリス チレン(1.PS)や金 ナノ粒 子 (2.AuNP)は原点 付 近にプロットされ、水 和していなくて、エネルギー損 失 のない硬 い物 質であることがよくわかる。ポリジメチルシロキサン(3.PDMS)は疎 水的 なゴムであり、 水和はしていないが、少しエネルギー損失のある柔らかい膜であることがわかる。
ニュートラアビジン(4)、グルコースオキシダーゼ(5)、ミオシン(6)、ビオチン化 カルモジュリン(7. Bio−Calmodulin)、ビオチン化 BSA(8. Bio-BSA)は一本の直線上にプロットされた。この直線は、硬い 膜 が水 和 したときにそのエネルギー損 失が水 和 水 を振 動 させるときのみにおこると仮 定 した理 論 式 で ある。すなわち、タンパク質は各々水 和量は多 少異なるが、エネルギー損失のない硬い物 質であること がわかる。一方、ポリエチレングリコール鎖(10,11.PEG)、DNA 鎖(12.ssDNA、13.dsDNA)、プル ラン糖 鎖 (14−17)は直 線 から右 側 に大 きく外 れ(エネルギー損 失 が大 きくなり)、その度 合 いは分 子 量(長さ)と共に大きくなった。すなわち、DNA 鎖や糖鎖のようにひも状の分子は柔らかく、水中で振動 させたときにはエネルギー損失も大きく、水和量も多いことがわかった。 図 32 種 々の生 体 高分 子 の水 和 量 とエネルギー損 失の相関 関 係 。図 中 の直 線 は硬い膜 のエネ ルギー損 失 がその水 和 量 だけでおこると考 えたときの理 論式 から求 めたもの。 ΔF 値とΔD 値を同時に測定することにより基板上の物質の水和量やそれに伴う分子の硬さ・柔ら かさが予測できることがわかった。この事 を利 用 すれば、分 子のコンフォメーション変 化が予 測できる。
り硬いコンフォメーション(直 線 上のプロット)から右 上 方向、すなわち水 和量が増 大しエネルギー損失 も増大(柔らかくなる)する事がわかる。BSA の SS 結合 をヨード酢酸と反応させて SS 結合を切断すると BSA は完全に変性し、直線上のプロットから大きく右上に外れる。 図 33 (左 )タンパク質のコンフォメーション変 化(変 性 )と(右 )DNA 鎖 の伸縮 に対する水 和量 とエネル ギー損失 値 の変 化 DNA 鎖はスペルミジンなどのオリゴカチオンが結合すると収縮するといわれている。図 33 右に示すよ うに DNA にスペルミジンを加えるとそのプロットはタンパク質の直線上に乗るように変化した。すなわち DNA 鎖は伸びた構造をしているがオリゴカチオンが結 合する事により収縮し、脱 水和して硬い構 造に なり、結 果 的 には タンパク質 と 同 じ くらい硬 くなることがわか る。二 本 鎖 の dsDNA の方 が一 本 鎖 の ssDNA より伸びた構造をしており、収縮してもdsDNA の方が少し柔らかい構造になることもわかった。 (2) 研究成果の今後期待される効果 ネットワークアナライザー法を用いてΔF とΔD を同時に測定することにより QCM 基板上に結合した 生体分 子の水 和量と硬さが予 測できることがわかった。この方法 を展開 すれば、分 子の外 部刺 激によ るコンフォメーション変化が追跡できる。また、タンパク質が DNA 鎖に結合する時にはそのコンフォメー ションが大きく変化することが知られている。多くの酵 素 反応でも基質は反応の進行に伴い、酵 素の形 や柔らかさが変化するともいわれている。本法を発展させれば、反応の進行に伴うタンパク質や生体分 子の構造変化と定量的に追跡することが出来る。 3.5 多機能で高感度な水晶発振子装置の開発(吉嶺グループ) (1) 研究実施内容及び成果 酵 素 反 応 を動 的 に追 跡 したり、膜 タンパク質 上に小 さなシグナル分 子が結 合 するのを追跡 したり、
mRNA 上へのリボソームや開 始 因子 の結 合を観 察したりするためには、高 感度で安 定な測定 装 置が 必要である。 <装置の高感度化とフロー装置化> 我 々 は こ れ ま で 、 図 3 4 に 示 す よ う に 手 作 り の 第 1 世 代 の 装 置 、 製 品 化 し た 第 2 世 代 の 装 置 ( AFFINIX Q 、 セ ル 容 量 8 m L ) 、 セ ル 容 量 を 0.5 mL に し て 4 チ ャ ネ ル 化 し た 第 3 世 代 の 装 置 (AFFUINIX Q4)を開発してきた。いずれも水晶発振 子を固定化したセルにサンプル溶液をインジェク ションするバッチ式であり、測 定 時間 が長 くとれる、装置 化 が簡 単である、などの長 所 を持 つ反 面 、濃 いサンプル溶 液が必要 、セルがオープンであるので外部 からの影 響を受 けやすいなどの欠 点がある。 しかし、AFFINIX Q でも DNA 鎖へのタンパク質、酵素、リボソームのような比較的大きな分子の結合で あれば十分に測 定できた。一 方、レセプタータンパク質 への低分 子薬物 の結合 などの測定をするため には、10倍以上の高感度化が望まれる。 前出の図25 に示したように、セルと発振回路周辺の温度制御を±0.1℃から±0.001℃に精度を上 げ、発振回路を光カップラーで外部ノイズから遮断し、セル容量が 10μL の微少フローセル化すること で、従来のバッチ式の AFIINIX Q4 のノイズレベル±1 Hz、ドリフト巾 7 Hz/h が、ノイズレベル±0.05 Hz、ドリフト巾 0.5 Hz/h に大幅に向上した。3.2で述べた KcsA イオンチャネルへのチャネルブロッカ ーペプチチド Agitoxin2 の結合は、バッチ式の AFFINIX Q4 では正確に求められなかったが、新しく開 発 したフロー式で初めて正 確に測定できるようになった。高 感 度化 (実 際は低ノイズ化 )する事により、 これまで測定が困難であった大 きなタンパク質 レセプターへの低分子シグナル分子の結合が測定でき、 創薬化学に大きく貢献することが期待できる。 現在は、図 35 に示すようなフローセルをマイクロ流路に組み込んだ装置を開発中である。
<水晶板のカット角の変更> 別紙参照 (2) 研究成果の今後期待される効果 マイクロ流 路型測 定装 置はノイズレベル±0.05 Hz の高 感 度 なので、低 分 子 薬 物 の結 合 が観 察 でき、創 薬 分 野 に 利用できる。水晶発振子のカット角を改良する事により水中 での温度 依存 性が 1/100になったので、装 置の小 型 化に より手に持てるサイズになった。モバイル型のビオセンサとし て利用価値は高い。