熊本大学学術リポジトリ
Kumamoto University Repository System
Title ホスフィンアキシドを触媒とした連続的不斉アルドール
反応の開発
Author(s) 下田, 康嗣
Citation
Issue date 2013-03-25
Type Thesis or Dissertation
URL http://hdl.handle.net/2298/32581
平成24年度
ホスフィンオキシドを触媒とした連続的不斉アルドール反応の開発
熊本大学大学院薬学教育部
分子機能薬学専攻 創薬化学講座
分子薬化学分野
下田 康嗣
略語表 本論文において、以下の略語を使用した。 Ac acetyl aq. aqueous Ar aryl
BINAPO 2,2’-bis(diphenylphosphino)-1,1’-binaphthyl dioxide BINOL 1,1’-binaphthalene-2,2’-diol
BITIOPO 4,4’-bis(diphenylphosphino)-2,2’,5,5’-tetramethyl-3,3’-bithophenyl dioxide
Bn benzyl
Bu butyl
t
Bu tert-butyl
brsm based on recovered starting material bp boiling point
BQNO 3,3’-dimethyl-2,2’-biquinoline N, N’-dioxide Cp cyclopentadienyl
Cy cyclohexyl
DBU 1,8-diazabicyclo[5.4.0]undec-7-ene de diastereomeric excess
DIOPO 4,5-bis-[(diphenylphosphanylmethyl)]-2,2-dimethyl-[1,3]dioxolane dioxide DME 1,2-dimethoxyethane
DMF N, N-dimethylformamide
DMSO dimethyl sulfoxide dr diastereomeric ratio ee enantiomeric excess EI electron impact ionization eq equivalent
Et ethyl
Fab fast atom bombardment
hex hexane
c
Hex cyclohexyl
HOMO highest occupied molecular orbital HMPA hexamethylphosphroamide
HPLC high performance liquid chromatography HRMS high-resolution mass spectrum
Ipc isopinocamphenyl IR infrared ray KHMDS potassium hexamethyldisilazide LA Lewis acid LB Lewis base
LRMS low resolution mass spectrum LUMO lowest unoccupied molecular orbital
Me methyl
Mes 2,4,6-trimethylphenyl mp melting point
MS molecular sieves
NMR nuclear magnetic resonance
Ph phenyl PMB p-methoxybenzyl PPTS pyridinium p-toluenesulfonate Pr propyl i Pr isopropyl rac racemic Rf retention factor rt room temperature sat. saturated SEGPHOS 5,5’-bis(diphenylphosphino)-4,4’-bi-1,3-benzodioxole SM starting material Tf trifluoromethanesulfonyl THF tetrahydrofuran TIPS triisopropylsilyl
TLC thin layer chromatography
TMEDA N,N,N’,N’-tetramethylethylendiamine
目次
序論
1
本論
第一章
キラルなホスフィンオキシドを Lewis 塩基触媒とした分枝型
連続的アルドール反応の開発
第一節 背景 10 第二節 反応条件の検討 16 第三節 各種基質の検討 20 第四節 反応機構の考察 24第二章
直鎖型連続的アルドール反応による多不斉中心を有する
3-オキソ-1,5-ジオール構造の構築
第一節 背景 27 第二節 反応条件の検討 31 第三節 各種基質の検討 35 第四節 直鎖型および分枝型連続的アルドール反応の 位置選択性の制御に関する検討 37 第五節 反応機構の考察 40結語
44実験の部
45参考文献
94序論 1
序論
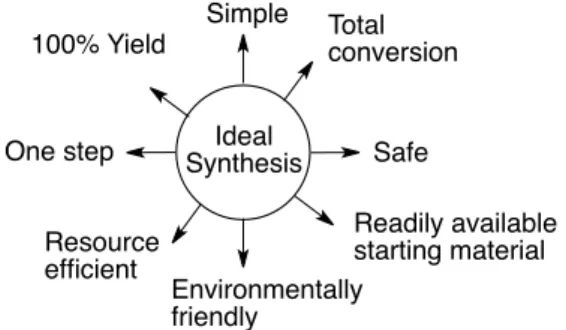
多成分連結反応 近年、石油資源の枯渇や、環境汚染等の諸問題に対する危機が強く叫ばれる中、環境に 負荷の少ない方法論により医薬品や生物活性物質等の機能性分子を合成する手法の開発が 強く望まれている1。Wender ら は 、「 理 想 の 合 成 (The ideal synthesis)」に必要なものとして、右記の8つの 要素を示している(Fig. 1)2。この要素の多くを 満足しうる反応の一つとして、連続的結合形成 反応が挙げられる。本法は複数の原子間の結合 を一挙に構築することにより、反応工程の短縮 が可能である。このため各工程の後処理や精製 段階に要する溶媒等の資源、さらには要する時間や費用を減じることが可能である。また、 段階的な反応においてしばしば用いられる保護基の着脱の工程を削減できることも多く、 環境負荷の少ない反応となる可能性を秘める。このため、連続的結合形成反応の開発は、 有機合成化学において非常に重要な課題である。 一般に、連続的結合形成反応は多成分連結反応とカスケード反応に大別される。このう ち、多成分連結反応は、1つの反応容器の中で始めから共存†する3つないしはそれ以上の 反応剤が連続的に反応し、1つの生成物を与える手法である(Scheme 1)3。この際、基質の 構造を変化させることで多様な骨格を1工程で合成することが可能であるため、医薬品等 の化合物ライブラリーの構築にも応用可能である。 これに対し、カスケード反応は分子内で1つの反応により生じた官能基がさらに新たな 反応を起こす形式のものをいう(Scheme 2)4。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †反応途中で新たな反応剤を加える手法はワンポット反応であり、多成分連結反応と厳密に区別されている5。 + + A B C A B C
Scheme 1. Concept of the Multicomponent Reaction.
Ideal Synthesis Simple Total conversion Safe Readily available starting material Environmentally friendly Resource efficient One step 100% Yield
Fig. 1. "The Ideal Synthesis" showed by Wender et al.
H
H H
OH
O H+
Scheme 2. Example of Cascade Reaction (Polyene Cyclization).
序論
2
これらの手法の中で、多成分連結反応の歴史は古く、その初の報告例は 1850 年の Strecker 反応に遡る。本反応は、アルデヒドとアンモニア、シアン化水素の3成分が縮合し、アミ
ノニトリルを経て α-アミノ酸を与える手法である(Scheme 3)6。
この他にも、Hantzsch ジヒドロピリジン合成7、Biginelli 反応8、Mannich 反応9、Passerini
反応 3b,c,10、Ugi 反応 3b,c,11、さらには Pauson-Khand 反応12など数多くの多成分連結反応の開 発例が報告され、今日ではその多くがいわゆる人名反応として広く認知されている(Scheme 4)13。 RCHO + NH3 + HCN R NH2 CN Scheme 3. Strecker Reaction.
R NH2 CO2H H+/H 2O R1 O + NH3 R3 H O
+ Hantzschdihydropyridine synthesis
NH2 O + R1CHO R2 O COOR3 N H NH R1 O R3OOC R2 Biginelli reaction R1 H N R2 + CH2O R5 O R3 + Mannich reaction + R4 R5 O R3 R4 N R1 R2 + R3 R2 O + Passerini reaction R4 H N O R1CO 2H R4NC O R1 O R2 R3 + R4 R3 O + Ugi reaction R5 H N N R1CO 2H R5NC O R1 O R3 R4 R2NH 2 + R2 + + Pauson-Khandreaction R2 R1 CO R3 R4 (transition metal) O R1 R2 R3 R4
Scheme 4. Examples of Multicomponet Reaction. R2 O N H R3 R1 R1 R2 R2 O O (2 equiv.)
序論
3
近年では、エナンチオ選択的な多成分連結反応も数多く報告されている14。例えば List
らによる有機分子触媒を用いたケトン、アルデヒド、アミンの3成分から反応系中でのイ
ミン形成を経て進行する不斉 Mannich 反応15や、Enders らによる二度の Michael 反応とそれ
に続くアルドール連続反応からなる六員環構築反応16などが報告されている(Scheme 5)。 このように、多成分連結反応は多様な官能基を有する複雑な骨格を短工程で合成できる ため、極めて有効な手法となる。ところが、連続的な Mannich 反応や Michael 反応のよう なカルボニル基への付加反応を経る多成分連結反応が数多く報告されているにも関わらず、 最も一般的な炭素–炭素結合形成反応の1つであるアルドール反応のみによる多成分連結 反応は、意外にもその報告例が極めて少ない。 O + CHO + NH2 MeO L-proline DMF O HN OMe 80% yield 93% ee List (2000) CHCl3, rt 65% yield >98% de, >99% ee Enders (2009) Ph CHO + MeNO2 N H Ph Ph OTMS NO2 Ph Ph CHO CHO Ph NO2 N Ph Ph OTMS Ph OHC Ph NO2 N OTMS Ph Ph Ph Michael additon Michael additon aldol reaction /dehydration N Ar H N CO2H +
序論 4 Lewis 塩基-塩化ケイ素複合体を基盤とする不斉反応 有機合成化学において、立体選択性の制御を指向した触媒と基質の相互作用の形式には、 イミニウムイオン17、各種金属等の Lewis 酸18、さらには Brønsted 酸19を介したカルボニル 基の活性化がその代表例として挙げられる。各活性化部位に不斉源を組み込むことで、い ずれの形式においても数多くのエナンチオ選択的な手法が開発されている(Fig. 2)。 これに対し、Lewis 塩基を触媒とする反応形式が近年注目を集めている20。Lewis 塩基は、 その電子供与能により、塩化ケイ素化合物のような Lewis 酸性化合物との相互作用による 反応を触媒する。 Lewis 塩基のような求核剤が反応することにより生じる高配位ケイ素中間体††は、求核部 位と求電子部位を併せ持つため、独特な反応性を呈する(Scheme 6)。 R1 R2 N R 4 R3 ∗ ∗ iminium R1 R2 O MLn ∗ ∗ Lewis acid R1 R2 O H B ∗ ∗ Brønsted acid
Fig. 2. Catalyst-substrate Interactions.
D L L L + Si X X XY D Si X X L L L Y X δ+ δ -silyl compound Lewis base
Scheme 6. Reactivity of Hypervalent Silicon Species.
hypervalent complex δ -enhanced electrophilic character enhanced nucleophilic character
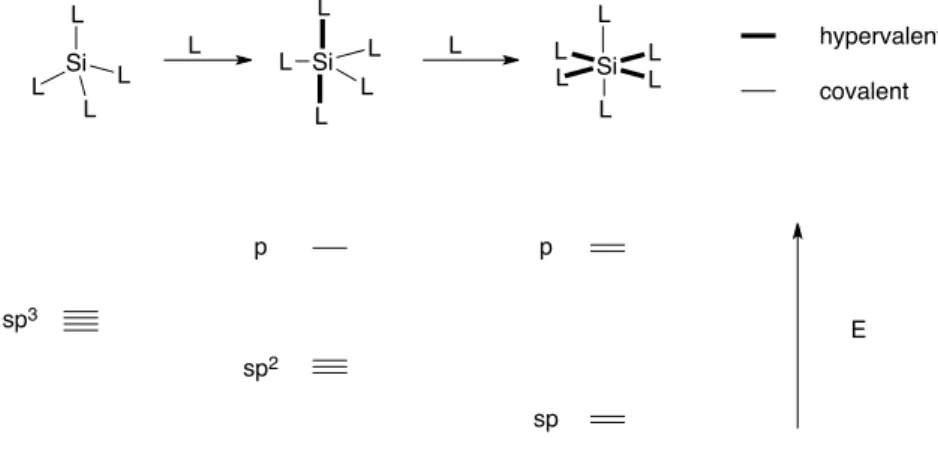
序論 5 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †† ケイ素原子は通常 sp3混成軌道をとり、4配位であるが、Lewis 塩基のような求核剤と反応すると容易に 原子価を拡張し、5配位または6配位の高配位ケイ素中間体を与える(Scheme 7)21。 ケイ素原子において、この原子価の拡張は、3d 軌道の関与ではなく、ケイ素原子の p 軌道と、配位性官能基 の間の三中心四電子結合の関与の結果であることが示唆されている。5配位中間体は、三方両錐型構造をと り、sp2混成軌道からなる共有結合3本と、アピカル位の一組の三中心四電子結合からなる。また、6配位中 間体は正八面体構造をとり、2本の sp 混成軌道と、二組の三中心四電子結合からなる。配位数が増えるにつ れ、ケイ素原子の軌道の s 性が高まり、Lewis 酸性が増大する。 また、ケイ素原子 p 軌道と配位性官能基の電子が相互作用し、三中心四電子結合22を形成する際、3つの混 成軌道を形成する(Fig. 3)。エネルギー準位の低い方から、結合性軌道、非結合性軌道、反結合性軌道であり、 その HOMO(最高被占軌道)は、非結合性軌道にある。この際、その電子は配位性官能基に局在化しており、 配位性官能基の Lewis 塩基性は増大する。 Si L L L L Si L L L L L Si L L L L L L L L hypervalent covalent sp3 p p sp2 sp E
Scheme 7. Model of Hypervalent Silicon Species.
HOMO
LUMO ψ3 antibonding
ψ2 nonbonding
ψ1 bonding
序論 6 この性質を利用し、高配位ケイ素中間体にキラルな Lewis 塩基触媒を作用させることで、 不斉触媒化を実現したのは Denmark らである。彼らは、キラルなホスホロアミドを Lewis 塩基触媒として用いることで、アリルトリクロロシランを用いたアリル化反応23や、トリク ロロシリルエノールエーテルを用いたアルドール反応24がエナンチオ選択的に進行するこ とを見出した。本反応系では、求核剤の塩化ケイ素化合物に Lewis 塩基が二座配位するこ とで、求電子剤のカルボニル化合物といす型環状遷移状態25を経て反応が進行するため、高 度な立体制御が可能であるという特徴を有する(Scheme 8)。 H O Me + SiCl3 N P N N O Me Me (25 mol%) CH2Cl2, –78 ˚C, 24 h OH Me Denmark (1994) 74% yield, 59% ee + N P N N O Me Me (10 mol%) CH2Cl2, –78 ˚C, 2 h Ph OH Denmark (1996) 95% yield, syn/anti = 1:65 93% ee (anti) OSiCl3 PhCHO Ph Ph O O Si O R3 R1 H R1 R3 R2 O R2 R2 OH R1 O Si O R3 H O R3 R2 O R2 R2 OH R1 R1 R1 (E)-enol ether (Z)-enol ether anti-adduct syn-adduct
Scheme 8. Lewis Base-mediated Reaction via 6-Membered Transition State Involving Hypervalent Silicate. LB : Lewis Base Cl Cl LB Cl LB Cl Cl -Cl -LB LB R3 H O R3 H O O SiCl3 SiCl3 LB LB
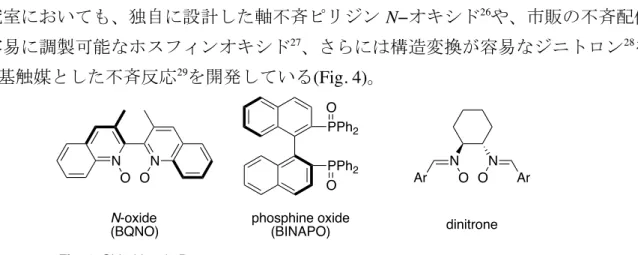
序論 7 当研究室においても、独自に設計した軸不斉ピリジン N−オキシド26や、市販の不斉配位 子から容易に調製可能なホスフィンオキシド27、さらには構造変換が容易なジニトロン28を Lewis 塩基触媒とした不斉反応29を開発している(Fig. 4)。 さらに当研究室では、トリクロロシリルエノールエーテルを用いたアルドール反応を、 より汎用性の高い直接的アルドール反応へと展開することに成功している。トリクロロシ リルエノールエーテルは高活性であるものの、水に触れると速やかに分解するため、取り 扱いに注意する必要がある。また、その調製の際、対応するケトンから2工程を経て合成 する必要があるため、その供給に問題を抱えていた(Scheme 9)30。 このため、Lewis 塩基存在下、カルボニル化合物に四塩化ケイ素を作用させることによ り、反応系中でトリクロロエノールエーテルを発生させ、求電子剤のアルデヒドと反応さ せる手法を開発した(Scheme 10)31†††。本反応系は報告例の少ない2つのアルデヒド間の 交差アルドール反応にも適用可能である。 PPh2 PPh2 O O N N O O N-oxide (BQNO) N N Ar O O Ar phosphine oxide (BINAPO) dinitrone
Fig. 4. Chiral Lewis Bases.
O OTMS Hg(OAc)2
SiCl4 CH2Cl2, rt
OSiCl3
Highly reactive but labile to H2O.
Scheme 9. Preparation of Trichlorosilyl Enol Ether.
+ (S)-BINAPO (10 mol %) SiCl4 (1.5 eq) iPr2NEt (5 eq) EtCN, rt, 0.5 h NaBH4 (1.5 eq) MeOH, rt, 0.5 h CHO Me Me CHO MeO OMe OH OH Me Me (1.5 eq) 99% yield, 58% ee O + (S)-BINAPO (10 mol %) SiCl4 (1.5 eq) iPr2NEt (10 eq) O OH Ph EtCN, 0 °C, 6 h PhCHO O O O O PPh2 PPh2 O O (S)-BINAPO 79% yield
syn / anti = 1:31, 73% ee (anti) (1.1 eq)
OSiCl3
O O
序論 8 また、当研究室では、Lewis 塩基触媒による還元的アルドール反応を開発している32。本 手法は、エノンにトリクロロシランを作用させることで、エノンの 1,4−還元が進行し、こ の際生じたトリクロロエノールエーテルのアルドール反応が進行する(Scheme 11)。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †††四塩化ケイ素とカルボニル化合物によるトリクロロシリルエノールエーテルの生成は、Lewis 塩基な しには進行しない。反応溶液の1H NMR 測定により、四塩化ケイ素およびアミンのみではカルボニル化合物 のエノール化は進行しないが、Lewis 塩基を加えることでエノール化が進行することを見出した(Scheme 12)。 これは、四塩化ケイ素に Lewis 塩基が配位することでケイ素原子の Lewis 酸性が増大し、カルボニル α 位の 酸性度が上昇したことで、3級アミンでも引き抜きが可能になったためであると考えられる。 また、最近当研究室では、四塩化ケイ素よりも Lewis 酸性が高いトリクロロシリルトリフラートを用いる ことで、低温下でもケトンのエノール化が進行し、高エナンチオ選択的にアルドール付加体が得られること を報告している(Scheme 13, Eq. 1)33。さらに、トリクロロシリルトリフラートを用いれば、通常求電子性が低 いケトンを求電子剤としたアルドール反応が進行することを見出している(Scheme 13, Eq. 2)34。 OSiCl3 O SiCl4 O amine Lewis base (LB) SiCl4, amine
Scheme 12. Generation of Trichlorosilyl Enol Ether Catalyzed by Lewis Base.
O SiCl4 O SiCl4 LB H H O + (S)-BINAPO (10 mol %) SiCl3OTf (2.0 eq)
Cy2NMe (10 eq) EtCN, –40 ˚C, 2 h O OH 84% yield syn / anti = 3:97 88% ee (anti) OHC Br Br O + (S)-BINAPO (10 mol %) SiCl3OTf (2.0 eq)
iPr 2NEt (5.0 eq) iPrCN, –60 ˚C, 24 h O OH 86% yield dr = 92:8 84% ee Ph Ph Me O Me
Scheme 13. Trichlorosilyl Triflate-mediated Aldol Reactions.
(1) (2) + (S)-BINAPO (10 mol %) HSiCl3 (2.0 eq) EtCN, –78 ˚C, 24 h O 70% yield, syn/anti = 94:6 91% ee (syn) Ph Ph O PhCHO Ph Ph Ph OH Ph Ph OSiCl3
triclorosilyl enol ether
序論
9
これら2つの手法は、反応系中でのトリクロロシリルエノールエーテルの生成およびア ルドール反応の双方の段階を Lewis 塩基が触媒している(Scheme 14)。このように、Lewis 塩基は多段階反応にも応用可能であり、複数の反応点を活性化することが必要な多成分連 結反応においても、有効な触媒となることが示唆された。 以上の背景を踏まえ、ホスフィンオキシドを Lewis 塩基触媒として用いることで、これ まで未開拓であったエナンチオ選択的な連続的アルドール反応を開発すべく研究を行った ので以下の順に述べたい。 1. キラルなホスフィンオキシドを Lewis 塩基触媒とした分枝型連続的アルドール反 応の開発 2. 直鎖型連続的アルドール反応による多不斉中心を有する 3-オキソ-1,5-ジオール構 造の構築 R1 O Lewis Base R1 OSiCl3 R2 R2 R3CHO R 1 O R2 R3 OH Lewis Base
Scheme 14. Successive Generation of Trichlorosilyl Enol Ether and Aldol Reaction Catalyzed by Lewis Base. trichlorosilyl enol ether
SiCl4 + amine R1 O R2 + + HSiCl3 or
第1章 第1節 10
本論
第1章 キラルなホスフィンオキシドを Lewis 塩基触媒とした分枝型連続的ア
ルドール反応の開発
第1節 背景 アルドール反応は、有機合成化学上最も重要な炭素−炭素結合形成反応の1つであり、こ れまでホウ素、ケイ素をはじめとして様々な金属を用いたものなど種々形式によるアルド ール反応が開発されている35。その代表的な例として、向山アルドール反応36や、Evans ア ルドール反応37が挙げられる(Scheme 15)。前者は、安定であり単離可能なシリルエノール エーテルをエノラート等価体として用い、Lewis 酸により活性化されたアルドール受容体 と反応させる手法である。また後者は、不斉補助基を有するアルドール供与体を用いるも のであり、酸素−ホウ素結合を含む強固な遷移状態を経るため、高度な立体制御が可能であ る。現在、これらの手法を基盤としたアルドール反応を利用することで、アルドール付加 体の高立体選択的な合成が可能であるが、シリルエノールエーテル等のエノラート等価体 の事前調製の必要がある点や、化学量論量の不斉補助基を必要とし、その着脱の工程が必 要であるなど未だ改善すべき点も多い。 この問題点を解決すべく、近年盛んに研究されている手法が、直接的アルドール反応38で ある。本手法は、シリルエノールエーテルなどのエノラート等価体を事前調製するのでな く、反応系中で発生させ、直接アルデヒドと反応させる手法をいう。このため、その反応 操作は非常に簡便であり効率的な手法となる。 Mukaiyama (1991) Cl CHO + OTMS SEtchiral diamine (1.1 eq) Sn(OTf)2 (1.0 eq) nBu 2Sn(OAc)2 (1.1 eq) CH2Cl2, –78 ˚C, 20 h SEt O OH Cl 96% yield syn only, >98% ee N Me N H chiral diamine Evans (1981) N O O O Me + H O N O O O Me OH Bu2BOTf (1.1 eq) iPr 2NEt (1.2 eq) CH2Cl2, –78 ˚C 78% yield, dr = > 500:1 O BR2 O H Me iPr H N O O iPr
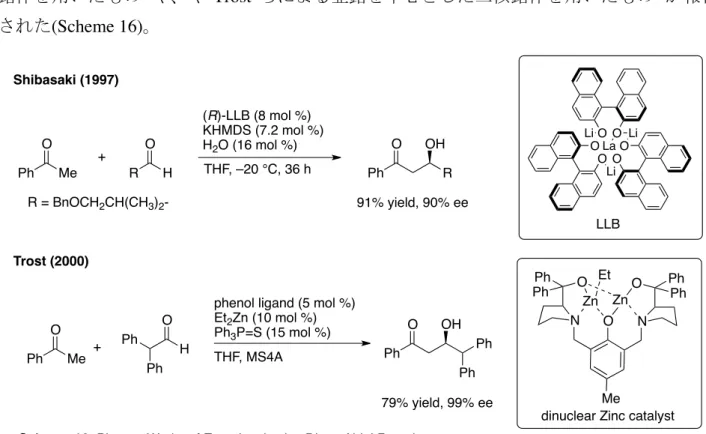
第1章 第1節 11 その先駆的な研究として、柴崎らによる BINOL とリチウムおよびランタンからなる複核 錯体を用いたもの39や、や Trost らによる亜鉛を中心とした二核錯体を用いたもの40が報告 された(Scheme 16)。 この報告を契機に、直接的アルドール反応の開発は、有機合成化学において一大潮流と なる。2000 年に、List, Barbas らは、プロリン等の第二級アミンを有機分子触媒として用い、 キラルなエナミンを求核剤とするアルドール反応を開発した(Scheme 17)41。 4243444546 その後、様々な修飾を施されたプロリン型触媒が開発され、直接的アルドール反応の開 発は隆盛の一途を辿っている(Fig. 5)47。 R H O R = BnOCH2CH(CH3)2 -+ Ph O Me (R)-LLB (8 mol %) KHMDS (7.2 mol %) H2O (16 mol %) THF, –20 °C, 36 h R OH Ph O 91% yield, 90% ee La O O O O O O Li Li Li LLB Shibasaki (1997) Ph O Me + O H
phenol ligand (5 mol %) Et2Zn (10 mol %) Ph3P=S (15 mol %) Ph Ph Ph O OH Ph Ph THF, MS4A Trost (2000) Me N O N Ph Ph O O PhPh Zn Zn Et
dinuclear Zinc catalyst 79% yield, 99% ee
Scheme 16. Pioneer Works of Enantioselective Direct Aldol Reaction.
O + O H N H CO2H (30 mol %) DMSO N CO2H O OH List, Barbas (2000) 97%, 96% ee L-proline
Scheme 17. Proline-mediated Direct Aldol Reaction.
N H NH NR2 N H N O Ph Ph Ph OTMS NH HN N N N NH R R
Fig. 5. Examples of Chiral Amine Catalysts.
第1章 第1節 12 当研究室でも前述のように、四塩化ケイ素およびアミン存在下、キラルなホスフィンオ キシドを Lewis 塩基触媒とすることで、環状ケトンがトリクロロシリルエノールエーテル を経てアルデヒドと反応することによる直接的アルドール反応を開発している 31 (Scheme 18)。 ところで、本反応の検討過程において、鎖状ケトンであるアセトフェノン(1a)を基質と したところ、想定していた単純なアルドール付加体はわずかに得られたのみで、アルドー ル付加体がさらにもう1分子のアルデヒドと反応した、分枝型のダブルアルドール付加体 が2つのジアステレオマー混合物として得られ、有意なエナンチオ選択性が観測されるこ とがわかった(Scheme 19)。 これまでに多くのアルドール反応が報告されているが、その大部分は、アルドール供与 体1分子とアルドール受容体1分子間の反応である。このように 3 分子以上の反応剤が連 続して反応する形式のものは副反応として進行することは知られているが、これを制御し た反応の開発例は極めて少ないのが現状であった。 (S)-BINAPO (10 mol %) SiCl4 (1.5 eq) iPr 2NEt (10 eq) Ph O + EtCN, 0 ˚C, 6 h PhCHO Ph Ph Ph HO OH O Ph Ph Ph HO OH O + meso-3a chiro-3a 76% (based on 2a)
chiro / meso = 2:1, 21% ee (chiro) Scheme 19. Unexpected Double Aldol Reaction.
1a 2a O + O OH Ph EtCN, 0 °C, 6 h PhCHO O O O O PPh2 PPh2 O O (S)-BINAPO 79% yield
syn / anti = 1:31, 73% ee (anti) (1.1 eq)
OSiCl3
O O
Scheme 18. Direct Aldol Reaction Catalyzed by Chiral Phosphine Oxide. (S)-BINAPO (10 mol %)
SiCl4 (1.5 eq) iPr
第1章 第1節 13 その数少ない連続的アルドール反応の一つとして、安孫子、正宗らによるホウ素トリフ ラートを用いた不斉補助基を有するエステル1分子とアルデヒド2分子による連続的アル ドール反応が挙げられる(Scheme 20)†, 48。 また、山本らは、独自に見出した嵩高いケイ素置換基(スーパーシリル基49)を有するア セトアルデヒド由来のシリルエノールエーテルを用いることで、シリルエノールエーテル が3度にわたり付加する連続的アルドール反応を開発している(Scheme 21)50。本反応は、 1度目のアルドール反応により生じたアルドール付加体のホルミル基に連続的にシリルエ ノールエーテルが反応する。この際、嵩高いスーパーシリル基を避けるべくシリルエノー ルエーテルが接近することで、極めて高いジアステレオ選択性が発現する。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †安孫子らは本反応の中間体として、二ホウ素エノラート I の生成を明らかにしている(Scheme 22)。エステル から二ホウ素エノラートがまず生成し、1分子目のアルデヒドと反応する。さらに、炭素−ホウ素エノラート II から酸素−ホウ素エノラートへ III の異性化が進行し、2 分子目のアルデヒドと反応することで生成物が得 られる。 RO O + iPr H O Cy2BOTf (2.5 eq) Et3N (3.0 eq) CHCl3, –78 ˚C RO O iPr OH HO iPr RO O iPr OH HO iPr 97 (80% de) 3 : Abiko, Masamune (2002) + Me N Bn S Ph Mes = 76% yield R O O
Scheme 20. Boron-mediated Double Aldol Reaction.
CHO OSi TfPhI (10 mol %)2NH (0.1 mol %)
+ CHO OSi OSi OSi CH2Cl2, –40 ˚C 81% yield dr = 81:9:8:<2 (5.0 eq) Si = Si(SiMe3)3 Yamamoto (2010) OSi H O
Scheme 21. Triple Aldol Reaction Using "Supersilyl" Group.
R1O O Cy2BOTf Et3N R1O OBCy2 R1O O BCy2 R2CHO Cy2BOTf Et3N R1O OBCy2 BCy2 R1O O BCy2 OBCy2 R2 R1O O O R2 Cy2B BCy2 R2CHO R1O O R2 OH HO R2
Scheme 22. Plausible Mechanism for Boron-mediated Double Aldol Reaction.
I
第1章 第1節 14 また、ごく最近 Murugesu らは、系中調製したマンガン錯体を用いることで、その立体選 択性に関する記述はないものの、アセトンとバニリン誘導体からの連続的アルドール反応 が進行することを報告している(Scheme 23)51。 このように、連続的アルドール反応は、一挙に 1,3-ジオール構造を有する骨格を立体選 択的に構築することができる非常に有用な手法となりうるが、その報告例は極めて少なく、 本反応形式を不斉触媒化した例はない。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− なお、エナミンを経由したエナンチオ選択的な連続的 Mannich 反応が List らにより報告されている(Scheme 24)52。 また、向山らは、段階的な手法ではあるものの、別途調製したアルドール付加体にスズトリフラート存在下、 アルデヒドを作用させることで同様の付加体が高ジアステレオ選択的に得られることを報告している (Scheme 25)53。 CHO OH MeO MnCl2 Et4NOH MeOH acetone, rt, 3-4 days OH MeO OH O OH OH OMe 66% yield Murugesu (2012) O + (solvent)
Scheme 23. Manganese Complex-mediated Double Aldol Reaction.
H O Me + H N Boc NH CO2H (20 mol %) L-proline MeCN S HNBoc S NH Boc S CHO 93% yield, dr = >99:1 >99% ee List (2008)
Scheme 24. Enantioselective Double Mannich Reaction.
Ph O iPr OH + Ph CHO Sn(OTf)2 (1.1 eq) DBU (2.0 eq) CH2Cl2, –78 ˚C O iPr OH Ph HO Ph Mukaiyama (2003) 81% yield, dr = 99:1
第1章 第1節 15 このため筆者は、ホスフィンオキシドをLewis 塩基触媒とすることで連続的アルドー ル付加体が得られるという知見をもとに、エナンチオ選択的な連続的アルドール反応の一 般化および反応機構の解明を目指し、検討を開始した。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †本章に述べる反応系で得られる連続的アルドール付加体には、以下に示す4つの異性体が存在する(Fig. 6)。 このうち、主生成物の2つはエナンチオマーの関係にある。本論文においてはこの種の化合物をイノシトー ルの表記に倣い chiro と表記する。また、meso 化合物はジアステレオマーの関係にある2種類が想定される が、本反応系では meso-3a のみが生成し、meso’-3a は観測されなかった。なお、meso-3a の構造はジオールを 対応するアセトナイドへと導き、1H NMR における下図中に示す H aと Hbのカップリング定数(J = 3.2 Hz)から 決定した(Scheme 26)。 Ph Ph Ph HO OH O Ph Ph Ph HO OH O meso-3a d-chiro-3a Ph Ph Ph HO OH O meso'-3a (not observed) Ph Ph Ph HO OH O l-chiro-3a Ph Ph Ph HO OH O meso-3a PPTS (5 mol %) 2,2-dimethoxypropane (5 eq) DMF, rt, 12 h O O Me Me Hb Ph Ph Ha H Ph O JHa-Hb = 3.2 Hz
Fig. 6. Assumed Stereoisomers of 3a.
第1章 第2節 16 第2節 反応条件の検討 直接的アルドール反応 31 の条件を参考に、アセトフェノン(1a)およびベンズアルデヒド (2a)を基質として、反応条件の最適化から検討を開始した(Table 1)。まず溶媒検討を行った。 (S)-BINAPO を Lewis 塩基触媒として用い、プロピオニトリル中、–40 ˚C にて反応させた場 合は、反応性が低く化学収率は低調ではあるものの、良好なエナンチオ選択性で連続的ア ルドール付加体 3a が得られた(entry 1)。溶媒にジクロロメタンを用いたところ、エナンチ オ選択性がわずかに低下したものの、高い化学収率で付加体 3a を与えた(entry 2)。トルエ ンもしくは THF を用いたところ、反応が全く進行しなかった(entries 3 and 4)。これは、ト ルエン中におけるホスフィンオキシドの溶解性の低さおよび、THF の Lewis 塩基性のため、 四塩化ケイ素が失活したことがそれぞれ原因として考えられる。このため、反応性が良好 なジクロロメタンおよび、エナンチオ選択性が良好なプロピオニトリルの混合溶媒を用い ることとした。2つの溶媒の比率を検討したところ、1:1の比率で混合した際に、化学 収率およびエナンチオ選択性のバランスが良いことから、ジクロロメタンとプロピオニト リルの1:1の混合溶媒を以降用いることとした† (entry 5)。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− † エントリー2とエントリー5の結果に大差はないが、–60 ˚C にて反応を行った際にジクロロメタンのみ用 いた場合の生成物のエナンチオ選択性は 61% ee とほとんど変化がなかったのに対し、ジクロロメタンとプロ ピオニトリルの混合溶媒を用いた場合は 70% ee に向上した。後者の方が、エナンチオ選択性が向上したため、 エントリー5の条件を最適条件とした。 Ph Me O + PhCHO (S)-BINAPO (10 mol%) SiCl4 (4 eq) iPr 2NEt (5 eq) solvent, –40 ˚C, 24 h Ph O OH Ph HO Ph Ph O OH Ph HO Ph + chiro-3a meso-3a 1a 2a (2.2 eq) Table 1. Screening of Solvents
entry 1 2 3 4 5 6 7 solvent EtCN CH2Cl2 toluene THF CH2Cl2/EtCN (1:1) CH2Cl2/EtCN (1:4) CH2Cl2/EtCN (4:1) yield, %a) 12 90 NR NR 71 62 78 chiro/mesob) 73:27 81:19 -77:23 75:25 80:20 ee, % (chiro)c) 70 60 -61 65 59 a) Isolated yield. b) Determined by 1H NMR analysis. c) Determined by HPLC analysis.
PPh2
PPh2 O
O (S)-BINAPO
第1章 第2節 17 続いて、各種アミンの検討を行った(Table 2)。ジイソプロピルエチルアミン†、ジシクロ ヘキシルメチルアミン、さらにはペンピジンのような嵩高く、十分な塩基性を有するアミ ンを用いた場合に良好な結果が得られた (entries 1, 4 and 5)。2,6-ルチジンはその塩基性の低 さのため、また、トリエチルアミンは立体障害の少なさにより四塩化ケイ素と直接結合し 四塩化ケイ素が失活したため、それぞれ反応が進行しなかったと考えられる (entries 2, 3)。 安価かつ良好な化学収率で付加体が得られたジシクロヘキシルメチルアミンを用い、反応 温度を–60 ˚C にすることで、エナンチオ選択性は 70% ee にまで向上した(entry 6)。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †ジイソプロピルエチルアミンを用いた場合に化学収率が低下した原因は、副反応にアルデヒドが消費された ためである。嵩高いアミンに四塩化ケイ素を作用させることでヒドリドが生じ、アルデヒドの還元および、 生じたエナミンのアルデヒドへの付加が進行し、ベンジルアルコールおよびシンナムアルデヒドが生成する (Scheme 27)。ジシクロヘキシルメチルアミンはイミニウムからエナミンのへ異性化が起こらないため、アル デヒドの副反応への消費が少ない。なお、当研究室では本結果を利用し、より嵩高いアミンおよびトリクロ ロシリルトリフラートを用いることで、エノンの 1,4-還元が定量的に進行することを報告している54。 Ph Me O + PhCHO (S)-BINAPO (10 mol%) SiCl4 (4 eq) amine (5 eq) CH2Cl2/EtCN, –40 ˚C 24 h Ph O OH Ph HO Ph Ph O OH Ph HO Ph + chiro-3a meso-3a 1a 2a (2.2 eq) Table 2. Screening of Amines
entry 1 2 3 4 5 6 amine iPr 2NEt 2,6-lutidine Et3N pempidine Cy2NMe Cy2NMe yield, %a) 71 NR NR 72 95 86 chiro/mesob) 77:23 -77:23 77:23 78:22 ee, % (chiro)c) 61 -64 61 70 a) Isolated yield. b) Determined by 1H NMR analysis.
c) Determined by HPLC analysis. d) at –60 ˚C. d) N Me Me N Me Me Me Me Me 2,6-lutidine pempidine N SiCl3X H N N PhCHO Ph OH NiPr 2 Ph O –HX +HX
Scheme 27. Reduction of Aldehyde by Hydride Generated from Sterically Congested Amine.
X -Ph H O Ph H OSiCl3 H H
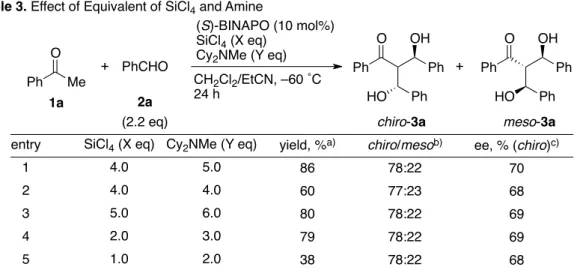
第1章 第2節 18 四塩化ケイ素およびジシクロヘキシルメチルアミンの当量の詳細な検討を行った(Table 3)。アミンを四塩化ケイ素と同じ4当量用いたところ、反応性が低下した(entry 2)。本反応 系は、アミンによるプロトンの引き抜きが必要であるため、反応系中を塩基性に保つこと が重要であると考えられる。四塩化ケイ素およびアミンの当量を増加しても、これ以上の 反応の加速効果は見出されなかった(entry 2)。四塩化ケイ素を減量したところ、2当量まで は若干の化学収率の低下が見られたのみであったが、1当量のみ用いた場合は反応が完結 せず、化学収率が半減した(entries 4,5)。このことから、本反応では 2 分子の四塩化ケイ素 が関与していることが示唆される。なお、以降の検討には反応性を維持すべく、四塩化ケ イ素4当量、ジシクロヘキシルメチルアミン5当量の条件を用いることとした。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− この他に、溶媒の濃度、試薬の添加順序、他の塩化ケイ素試薬(Fig. 7)の検討を行ったが、これまでの条件を 上回る結果は得られなかった。 Ph Me O + PhCHO (S)-BINAPO (10 mol%) SiCl4 (X eq) Cy2NMe (Y eq) CH2Cl2/EtCN, –60 ˚C 24 h Ph O OH Ph HO Ph Ph O OH Ph HO Ph + chiro-3a meso-3a 1a 2a (2.2 eq)
Table 3. Effect of Equivalent of SiCl4 and Amine
entry 1 2 3 4 5 SiCl4 (X eq) 4.0 4.0 5.0 2.0 1.0 yield, %a) 86 60 80 79 38 chiro/mesob) 78:22 77:23 78:22 78:22 78:22 ee, % (chiro)c) 70 68 69 69 68 a) Isolated yield. b) Determined by 1H NMR analysis. c) Determined by HPLC analysis.
Cy2NMe (Y eq) 5.0 4.0 6.0 3.0 2.0
Fig. 7. Other Silylating Reagents.
第1章 第2節
19
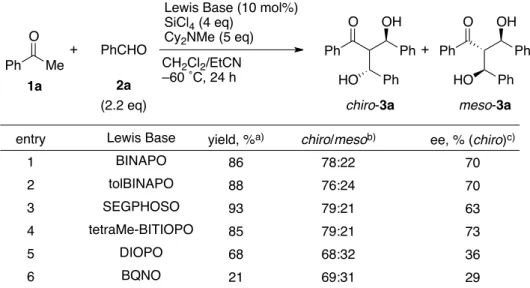
続いて、各種 Lewis 塩基のスクリーニングを行った(Table 4)。ビアリール骨格を有する
BINAPO 誘導体や、SEGPHOSO、さらには tetraMe-BITIOPO55を用いた場合は良好な結果を
与えた(entries 1-3)。ビアリール骨格を有さない DIOPO や、N-オキシドである BQNO は化 学収率、立体選択性ともに低調であった(entries 4,5)。最も良好な立体選択性を与えたのは tetraMe-BITIOPO であったが、汎用性の観点†から、以降の検討には引き続き BINAPO を用 いることとした。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †tetraMe-BITIOPO は市販のビチオフェンをホスホニル化、酸化した後、光学分割を経て調製する必要があっ た(Scheme 28)56。 Ph Me O + PhCHO
Lewis Base (10 mol%) SiCl4 (4 eq) Cy2NMe (5 eq) CH2Cl2/EtCN –60 ˚C, 24 h Ph O OH Ph HO Ph Ph O OH Ph HO Ph + chiro-3a meso-3a 1a 2a (2.2 eq)
Table 4. Screening of Chiral Lewis Bases
entry 1 2 3 4 5 6 yield, %a) 86 88 93 85 68 21 chiro/mesob) 78:22 76:24 79:21 79:21 68:32 69:31 ee, % (chiro)c) 70 70 63 73 36 29 a) Isolated yield. b) Determined by 1H NMR analysis. c) Determined by HPLC analysis.
Lewis Base BINAPO tolBINAPO SEGPHOSO tetraMe-BITIOPO DIOPO BQNO PAr2 PAr2 O O Ar = Ph: BINAPO Ar = 4-tolyl: tolBINAPO PPh2 PPh2 O O O O O O SEGPHOSO O O PPh2 PPh2 O O DIOPO N N O O BQNO S S PPh2 PPh2 O O tetraMe-BITIOPO S S PPh2 PPh2 O O S S PPh2 PPh2 S S 1) tBuLi 2) Ph2PCl 1) Oxidation 2) Optical resolution
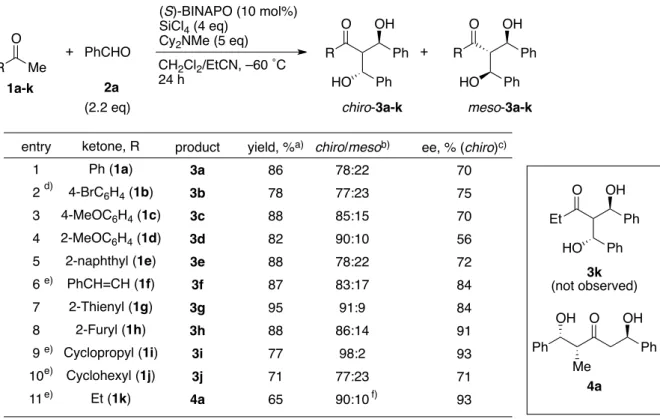
第1章 第3節 20 第3節 各種基質の検討 ここまでの条件を用いて、各種ケトン(1a-l)とベンズアルデヒド(2a)との連続的アルドー ル反応を行った。電子求引性置換基を有する p-ブロモアセトフェノン(1b)を用いた場合は、 反応性が低下し、反応の完結に長時間を要した(entry 2)。オルト位に置換基を有するケトン 1d では立体選択性が低下したものの(entry 4)、様々な芳香族ケトンを用いた場合に良好な 立体選択性が観測された(entries 1-3,5)。また、エノン構造を有するベンザルアセトン(1f)に おいても反応は円滑に進行した(entry 6)。特に、芳香環上にヘ テロ原子を有するケトン 1g および 1h では高いエナンチオ選 択性が観測された(entries 7,8)。これは、芳香環上のヘテロ原子 と四塩化ケイ素とのキレーションにより、強固な遷移状態を形 成しているためであると考えられる(Fig 8)。 アセチルシクロプロパン(1i)や、アセチルシクロヘキサン(1j)のような脂肪族ケトンは反応 性が低く、溶媒にジクロロメタンのみを用いる必要があったが、高立体選択的に連続的ア ルドール付加体が得られた(entries 9,10)。メチルエチルケトン(1k)を用いた場合は、分枝型 付加体 3k は全く得られず、カルボニル基両側の反応点でそれぞれ1分子ずつのアルデヒド と反応した直鎖型の連続的アルドール付加体 4a が立体選択的に得られた(entry 11)。その詳 細は第2章にて述べる。 R Me O + PhCHO (S)-BINAPO (10 mol%) SiCl4 (4 eq) Cy2NMe (5 eq) CH2Cl2/EtCN, –60 ˚C 24 h R O OH Ph HO Ph R O OH Ph HO Ph + chiro-3a-k meso-3a-k 1a-k 2a (2.2 eq)
Table 5. Double Aldol Reaction between Various Ketones (1a-k) and Benzaldehyde (2a).
entry 1 2 3 4 5 6 7 8 9 10 11 ketone, R Ph (1a) 4-BrC6H4 (1b) 4-MeOC6H4 (1c) 2-MeOC6H4 (1d) 2-naphthyl (1e) PhCH=CH (1f) 2-Thienyl (1g) 2-Furyl (1h) Cyclopropyl (1i) Cyclohexyl (1j) Et (1k) yield, %a) 86 78 88 82 88 87 95 88 77 71 65 chiro/mesob) 78:22 77:23 85:15 90:10 78:22 83:17 91:9 86:14 98:2 77:23 90:10 ee, % (chiro)c) 70 75 70 56 72 84 84 91 93 71 93 a) Isolated yield. b) Determined by 1H NMR analysis. c) Determined by HPLC analysis. d) 48 h. e) Reaction was carried out in CH2Cl2 instead of CH2Cl2/EtCN.
f) Ratio of major diastereomer and minor diastereomer. d) e) e) e) e) f) O Ph Me Ph OH OH product 3a 3b 3c 3d 3e 3f 3g 3h 3i 3j 4a 4a Et O OH Ph HO Ph 3k (not observed) O Si O Ph * O=P O=P Cl Cl Cl -O
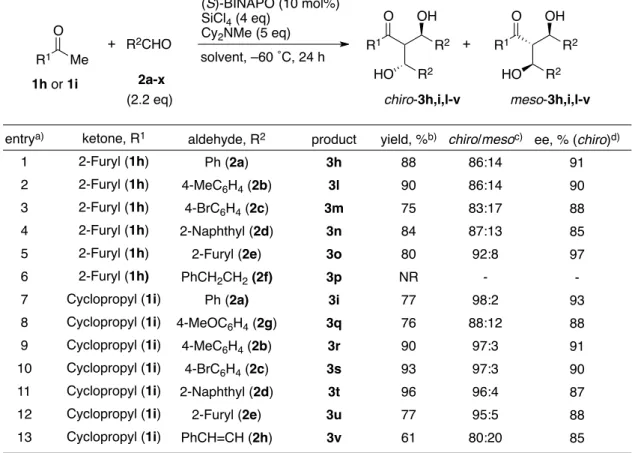
第1章 第3節 21 続いて、良好な結果を与えた 2-アセチルフラン(1h)およびアセチルシクロプロパン(1i)を 用いて、各種アルデヒドとの連続的アルドール反応の検討を行った(Table 6)。2-アセチルフ ラン(1h)と各種アルデヒドとの反応は円滑に進行し、高エナンチオ選択的に付加体を与え た(entries 1-5)。特に、フルフラール(2e)との反応では本反応系で最高の 97% ee が観測され た(entry 5)。一方、非共役アルデヒドであるヒドロシ ンナムアルデヒド(2f)を用いたところ、反応が全く進 行しなかった(entry 6)。本反応系において非共役アル デヒドは、四塩化ケイ素より生じた塩化物イオンの付加により生じるクロロヒドリンとな るため、求電子性が低下したためであると考えられる(Fig 9)57。 アセチルシクロプロパン(1i)を用いた場合にも良好な化学収率で付加体が得られ、いずれも 高いエナンチオ選択性が観測された(entries 7-13)。 R1 Me O + R2CHO (S)-BINAPO (10 mol%) SiCl4 (4 eq) Cy2NMe (5 eq) solvent, –60 ˚C, 24 h R 1 O OH R2 HO R2 R1 O OH R2 HO R2 + chiro-3h,i,l-v meso-3h,i,l-v 1h or 1i 2a-x (2.2 eq)
Table 6. Double Aldol Reaction between 2-Acetylfuran (1h) or Acetylcyclopropane (1i) with Various Aldehyde (2a-h).
entrya) 1 2 3 4 5 6 7 8 9 10 11 12 13 ketone, R1 2-Furyl (1h) 2-Furyl (1h) 2-Furyl (1h) 2-Furyl (1h) 2-Furyl (1h) 2-Furyl (1h) Cyclopropyl (1i) Cyclopropyl (1i) Cyclopropyl (1i) Cyclopropyl (1i) Cyclopropyl (1i) Cyclopropyl (1i) Cyclopropyl (1i) yield, %b) 88 90 75 84 80 NR 77 76 90 93 96 77 61 chiro/mesoc) 86:14 86:14 83:17 87:13 92:8 -98:2 88:12 97:3 97:3 96:4 95:5 80:20 ee, % (chiro)d) 91 90 88 85 97 -93 88 91 90 87 88 85 a) The reaction of 1h was conducted in CH2Cl2/EtCN (1:1), whereas the reaction of 1i was conducted in CH2Cl2. b) Isolated yield. b) Determined by 1H NMR analysis. c) Determined by HPLC analysis. d) Reaction was carried out in CH2Cl2 instead of CH2Cl2/EtCN.
product 3h 3l 3m 3n 3o 3p 3i 3q 3r 3s 3t 3u 3v aldehyde, R2 Ph (2a) 4-MeC6H4 (2b) 4-BrC6H4 (2c) 2-Naphthyl (2d) 2-Furyl (2e) PhCH2CH2 (2f) Ph (2a) 4-MeOC6H4 (2g) 4-MeC6H4 (2b) 4-BrC6H4 (2c) 2-Naphthyl (2d) 2-Furyl (2e) PhCH=CH (2h) Ph H O SiCl4 Ph H Cl OSiCl3
第1章 第3節 22 続いて、本反応系の適用範囲の拡大を目指し、Danishefski ジエン58の前駆体として知られ る 4-メトキシ-3-ブテン-2-オン(1l)に本反応を適用することとした。本化合物を用いること で、連続的アルドール反応が進行した後、分子内環化反応が進行し、2,3-ジヒドロ-4-ピラ ノン誘導体が得られることを期待した(Scheme 29)。 実際に、ジクロロメタンとプロピオニトリルの混合溶媒中、 –40 ˚C にてベンズアルデヒド(2a)と反応させたところ、環化反 応まで連続して進行したジヒドロピラノン誘導体 3w が良好な 化学収率で得られた(Scheme 30)。主に3つのジアステレオマー が生成し、主生成物は良好なエナンチオ選択性を示した。なお、 本化合物の相対立体配置は、X 線結晶構造解析により決定した (Fig. 10)。 本反応で得られた3つのジアステレオマーのうち、3w と 3w’は同程度のエナンチオ選択 性が観測され、3x”にはエナンチオ選択性は観測されなかった。このことから、3w および 3w’は立体選択的に得られた chiro 体が環化したもので、3w”は meso 体が環化したものであ ると考えられる。 本手法は、3つの連続する不斉中心を有する 2,3-ジヒドロ-4-ピラノン骨格を1工程で構 築できるものであるため、ピラン骨格構築の有効な手法となりうる。 O + (S)-BINAPO SiCl4 amine
Double Aldol Reaction
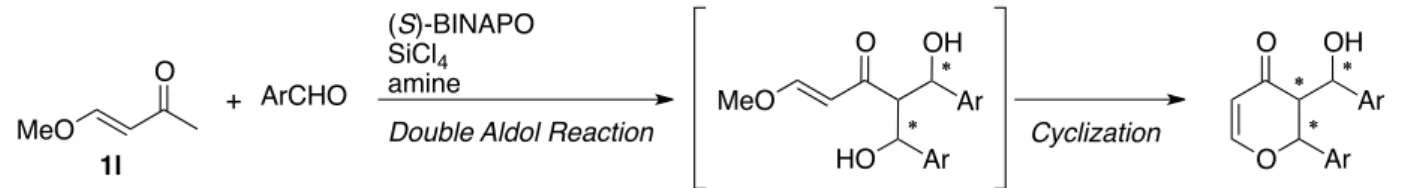
O ∗ ∗ ∗ ∗ OH HO Ar Ar MeO ArCHO MeO O ∗ ∗ ∗ ∗ O ∗ ∗ Ar OH Ar Cyclization
Scheme 29. Synthesis of 2,3-Dihydro-4-pyranone by Successive Double Aldol Reaction and Cyclization. 1l O + (S)-BINAPO (10 mol %) SiCl4 (3 eq) iPr 2NEt (5 eq) CH2Cl2/EtCN (1:1) –40 ˚C, 4 h MeO PhCHO O O Ph OH Ph
Scheme 30. Construction of 2,3-Dihydro-4-pyranones via Double Aldol Reaction. O O Ph OH Ph O O Ph OH Ph + + H H H H H H 3w' 3w" 60% yield, 3w : 3w' : 3w" = 84 : 5 : 11 80% ee (3w) 3w 1l 2a (3.0 eq)
第1章 第3節 23 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 本反応で用いる 4-メトキシ-3-ブテン-2-オン(1l)は、安定性に乏しく、反応中において副反応が進行してい る。このため、最近当研究室では 4-メトキシ-3-ブテン-2-オンのメトキシ基をフェノキシ基へと変換すること で、円滑に反応が進行することを見出している(Scheme 31)。 O + (S)-BINAPO (10 mol %) SiCl4 (3 eq) iPr 2NEt (5 eq) CH2Cl2/EtCN (1:1) –60 ˚C, 24 h O PhCHO O O Ph OH Ph H H 3w 1l' 2a (3.0 eq) EtO 76% yield, dr = 84 : 5 : 11 83% ee (3w)
第1章 第4節 24 第4節 反応機構の考察 本反応は二度にわたるアルドール反応が進行しているが、その反応機構の詳細は不明で あった。本反応の反応機構を解明すべく検討を行ったので以下に述べる。まず、2段階目 のアルドール反応における Lewis 塩基の関与の有無を調査すべく、別途調製したアルドー ル付加体 5a に、BINAPO 非存在下、四塩化ケイ素のみを作用させた。この結果、反応が全 く進行せず、アルドール付加体が脱水したカルコンが得られるのみであった(Scheme 32, Eq. 1)。一方、R または S 配置の立体化学を有する光学活性なアルドール付加体 5a59に、S 配置 の BINAPO 存在下、アルドール反応を行ったところ、若干のマッチ-ミスマッチ効果は見ら れるものの出発物質の立体化学を反映した付加体 3a が得られることがわかった(Scheme 32, Eqs. 2,3)。また、ラセミ体の BINAPO を用いて、R 配置のアルドール付加体 5a と反応させ たところ、同様の結果が得られた(Scheme 32, Eq. 4)。これらの結果より、本反応の選択性 発現には、1段階目のアルドール反応における選択性が大きく寄与していることが示唆さ れた。 以上のように、BINAPO は2段階目のアルドール反応の進行には必要不可欠であるもの の、立体選択性には寄与せず、2段階目の選択性発現には1段階目のアルドール反応にお ける選択性が大きく寄与している。 Ph O Ph Ph Ph HO OH O Ph OH (R)-5a 67% ee (R) 58% yield (77% brsm) chiro / meso = 88:12 64% ee (chiro, R, R) Ph O (S)-BINAPO (10 mol %) SiCl4 (4 eq) Cy2NMe (5 eq) Ph Ph Ph HO OH O CH2Cl2, –60 ˚C, 24 h Ph OH (S)-5a 68% ee (S) 56% yield (76% brsm) chiro / meso = 84:16 70% ee (chiro, S, S) (S)-BINAPO (10 mol %) SiCl4 (4 eq) Cy2NMe (5 eq) CH2Cl2, –60 ˚C, 24 h Ph O SiCl4 (4 eq) Cy2NMe (5 eq) Ph Ph Ph HO OH O CH2Cl2, –60 ˚C, 24 h Ph OH No reaction + PhCHO + PhCHO + PhCHO rac-5a 2a (1.2 eq) 2a (1.2 eq) 2a (1.2 eq) Ph O Ph Ph Ph HO OH O Ph OH (R)-5a 67% ee (R) 59% yield (78% brsm) chiro / meso = 88:12 70% ee (chiro, R, R) rac-BINAPO (10 mol %) SiCl4 (4 eq) Cy2NMe (5 eq) CH2Cl2, –60 ˚C, 24 h + PhCHO 2a (1.2 eq) (1) (2) (3) brsm = based on recovered starting material Scheme 32. Investigation of Reaction Mechanism.
(4) 3a
(R,R)-3a
(S,S)-3a
第1章 第4節 25 さらに、本反応系の条件検討の段階において、四塩化ケイ素が2当量関与している可能 性が示唆されたことから、2段階目のアルドール反応は四塩化ケイ素単独ではなく、より Lewis 酸性が強い四塩化ケイ素-Lewis 塩基錯体により活性化されていると考えられる (Scheme 33)。 以上の実験結果および、これまでに報告されているトリクロロシリルエノールエーテル のアルドール反応25の反応機構を参考に、反応機構は以下のように考察した。 まず、アミン存在下、四塩化ケイ素-ホスフィンオキシド錯体により活性化されたメチル ケトンからトリクロロシリルエノールエーテルが生じ、アルデヒドと六員環いす型遷移状 態を経て1段階目のアルドール反応が進行する。この際、キラルなホスフィンオキシドに よりエナンチオ選択性が発現する(Scheme 34)。 ここからアミンによりプロトンが引き抜かれ、エノールエーテルが生成する(Scheme 35)†。 本反応系において、2 分子の四塩化ケイ素が関与していることが示唆されることから、こ のようなエノールエーテルの生成を想定している。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †モノアルドール付加体 5a のエノール化の進行を NMR により確認したところ、アミンを加えない条件ではエ ノール化は進行しないものの、アミンを加えると速やかにエノール化が進行することを確認している。 P L L L + Si Cl Cl ClCl P Si Cl Cl L L L Cl Cl δ+ phosphine oxide
Scheme 33. Activation of SiCl4 in the Presence of Phosphine Oxide. hypervalent complex δ -enhanced electrophilic character O O R1 Me O BINAPO R2CHO SiCl4 O Si O R2 R1 Cl Cl O O P P O Si O ∗ ∗ R2 R1 Cl Cl O O P P R1 O R2 O Cl3 Si amine
Scheme 34. Reaction Mechanism for 1st Aldol Reaction.
R1 O R2 O Cl3 Si SiCl4 amine R1 O R2 O Cl3 Si Cl3Si
第1章 第4節 26 このエノールエーテルとホスフィンオキシド-四塩化ケイ素錯体により活性化されたア ルデヒドが以下に示す2環性の環状遷移状態を経て反応することで、主生成物である chiro 体が生成していると考えられる(Scheme 36)。また、アルデヒドの置換基がアキシアル方向 に位置したまま反応することで、ジアステレオマーである meso 体が生成する。本反応では、 出発物質のケトンよりも、アルドール付加体からのプロトン引き抜きが早いため、2段階 目のアルドール反応の進行が早く、連続的アルドール付加体が主生成物として得られる。 以上筆者は、キラルなホスフィンオキシドを Lewis 塩基触媒とする分枝型連続的アルド ール反応を開発した60。このような反応形式を初めて不斉触媒化したものであり、今後の更 なる応用が期待される。 R1 O R2 O Cl3 Si Cl3Si O Si Cl3 O R2 R1 Si R2 H O LB Cln O Si Cl3 O R2 R1 Si R2 H O LB Cln Ph Ph Ph HO OH O Ph Ph Ph HO OH O R2CHO LB = Lewis base (phosphine oxide) chiro meso Scheme 36. Proposed Reaction Mechanism for the 2nd Aldol Reaction.
第2章 第1節 27
第2章 直鎖型連続的アルドール反応による多不斉中心を有する
3-オキソ
-1,5-ジオール構造の構築
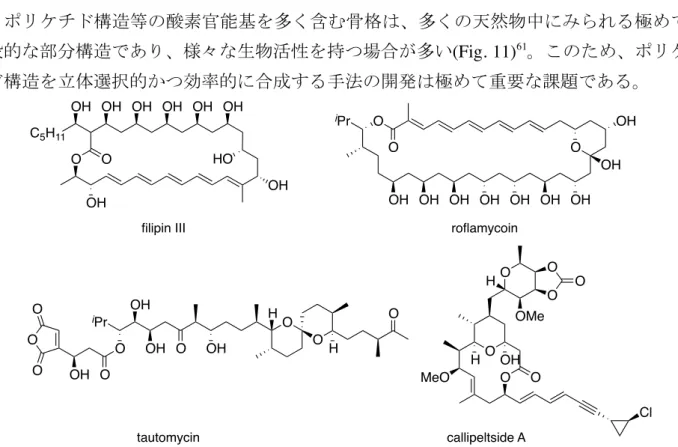
第1節 背景 ポリケチド構造等の酸素官能基を多く含む骨格は、多くの天然物中にみられる極めて一 般的な部分構造であり、様々な生物活性を持つ場合が多い(Fig. 11)61。このため、ポリケチ ド構造を立体選択的かつ効率的に合成する手法の開発は極めて重要な課題である。 このうち、1,5-ジオール構造を有する化合物の全合成は多数報告されているものの、ヒド ロキシケトン構造を有する基質を用いたアルドール反応62や、オレフィン等の他の官能基の 構造変換、カルボニル基の還元等で新たにヒドロキシ基を導入する手法などを用いる例が その大部分を占める(Scheme 37)。これらの手法はジアステレオ選択的かつ段階的な手法が 多く、1工程で 1,5-ジオール構造をエナンチオ選択的に構築した例は極めて少ない。Scheme 37. Synthetic Approach for 1,5-diols.
R2 OH OH R1 R2 OR' OR R1 O H + aldol reaction R2 O O R1 reduction R2 OH R1 dihydroxylation or hydroboration R2 OH OH R1 O C5H11 O O OH OH OH OH OH OH OH OH HO filipin III OH OH OH OH OH OH OH O OH OH O iPr O roflamycoin iPr O O OH OH O OH H O H O O OH O O O tautomycin O O O O O O H OMe OH H MeO O Cl callipeltside A
第2章 第1節 28 前述のようにアルドール反応によるジアステレオ選択的な 1,5-ジオール構造の構築は、 β-ヒドロキシケトンをアルドール供与体として用いることにより可能である。しかし、分 子内に既存の立体中心と反応点が遠いため、その立体制御は困難である場合が多い。この ような反応を研究した例として、Denmark らのトリクロロシリルエノールエーテルを用い たアルドール反応63や、Dias らによるホウ素エノラートを介した反応系64が報告されている (Scheme 38)。 さらに、最近山本らによりスーパーシリル基を有するヒドロキシケトンを用いたアルド ール反応が報告されている(Scheme 39)65。本手法は用いるエノール化試薬により異なる遷 移状態を経るため、望みの立体配置を有する付加体を作り分けることが可能であり、有用 性が高い。 Denmark (2005) Me OSiCl3 TIPSO
+ PhCHO phosphoramide (10 mol %)
CH2Cl2, –78 ˚C Me O Me Ph OH TIPSO Me 84% yield relative dr (1vs2): syn/anti = >19:1 internal dr (2vs5): syn/anti = 1:16 1 2 5 NP N Ph Ph Me Me O phosphoramide Dias (2008) O + PhCHO cHex2BCl Et3N CH2Cl2, –78 ˚C O Ph OH 70% yield syn/anti = 96:4 O O2N PMB O2N O PMB
Scheme 38. Diastereoselective Aldol Reactions of Hydroxy Ketone.
Yamamoto (2010) tBu O OTMS (Me3Si)3Si + tBuCHO Tf2NH (0.2 mol %) toluene, –78 ˚C t Bu O O (Me3Si)3Si tBu OH 82% yield, syn/anti = 3:97 tBu O OTMS (Me3Si)3Si + tBuCHO LHMDS (1.2 eq) DMF, –60 ˚C t Bu O O (Me3Si)3Si tBu OH 82% yield, syn/anti = 96:4 TMSO H H O Si SiMe3 SiMe3 Me3Si R1 H O H R2 SiMe3 Li O O R2 H DMF DMF H H O Si SiMe3 SiMe3 Me3Si R1 H
Transition state for acid-mediated reaction Transition state for Lithium-mediated reaction Scheme 39. Diastereoselective Aldol Reactions of Hydroxy Ketone Containing "Supersilyl" Group.
第2章 第1節 29 これら数例の手法が報告されているものの、いずれもキラルなヒドロキシケトンを用い たジアステレオ選択的な反応であり、エナンチオ選択的に行った例はない†。 ところで筆者は前章において分枝型連続的アルドール反応を開発し、連続的アルドール 付加体を立体選択的に得ることに成功した。本反応系において、カルボニル基両端の反応 点においてエノール化が可能であるケトンを用い、それぞれでアルデヒドと反応すれば、 3つの不斉中心を有する 1,5-ジオール構造が構築可能であると考えられる(Scheme 40)。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †エナンチオ選択的な1工程での 1,5-ジオール構造の構築法として、Kagan らによる 1,5-ジケトンの還元66や、 Barrett らによる C2対称キラルアリルボランを中間体としたアルデヒドのダブルアリル化反応67などの例が知 られている(Scheme 41)。 R1 Me O R1 O ∗ ∗ R2 OH Me O ∗∗ ∗ ∗ O ∗ ∗ R2 OH R1 R2∗∗ OH R1 R2CHO R2CHO R1 ∗ ∗ O ∗ ∗ O R1 R 2CHO R2CHO ∗ ∗ R2 R2 OH OH ∗ ∗ R2 HO ∗ ∗ Branched-type Double Aldol Reaction (Chapter 1)
Linear-type Double Aldol Reaction (Chapter 2)
Scheme 40. Classification of the Double Aldol Reaction.
three-stereocenters Ph O O Ph N B H O H Ph Ph (10 mol%) BH3•SMe2 (2.5 eq) THF, 0 ˚C, 1 h Ph OH OH Ph 87% de, 93% ee Kagan (2003) B B 2 2 1) nBuLi, TMEDA 2) (+)-Ipc2BCl 1) PhCHO 2) H2O2 Ph OH OH Ph 55% yield, dr = 84:16 >95% ee Barrett (2000)
第2章 第1節
30
エチルメチルケトン(1k)を用いると、前述のように、分枝型連続的アルドール付加体 3k は全く得られず、直鎖型連続的アルドール付加体 4a が中程度の化学収率かつ高立体選択的
に得られた†
(Scheme 42, 第1章第3節, Table 5, entry 12)。
得られた化合物は3つの不斉中心を持つ3-オキソ-1,5-ジオール構造を有するため、新た なエナンチオ選択的 1,5-ジオールの構築法となりうる。このため、筆者は本反応形式の一 般化および反応機構の解明に向けた検討を開始した。 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− †本反応系で得られる連続的アルドール付加体は3つの不斉中心を有するため、4つのジアステレオマーが生 成可能である。このうち、本反応系では2つのジアステレオマーが生成し、主生成物は 1,2-syn-1,5-anti 構造 であることを X 線結晶構造解析により明らかにした。詳細およびその X 線結晶構造は後述する。 O (S)-BINAPO (10 mol %) SiCl4 (4.0 equiv.) iPr 2NEt (5.0 equiv.) O Ph OH Me Ph OH Me + PhCHO (3.0 equiv.) CH2Cl2, –60 ˚C, 24 h O Ph OSiCl3 65% yield, Dr = 90:10 93% ee PhCHO PPh2 PPh2 O O (S)-BINAPO Et O ∗2 ∗2 Ph OH ∗2 ∗2 Ph HO not observed
Scheme 42. Linear-type Double Aldol Reaction.
1k 2a
第2章 第2節 31 第2節 反応条件の検討 まず、エナンチオ選択性を向上させるべく、アセトン(1m)とベンズアルデヒド(2a)の反 応を用いて本反応に最適な触媒の探索を行った(Table 7)。なお、アセトンとの反応では C2 対称ジオール 4b のみが生成し、meso-ジオールは全く得られない。BINAPO を用いた場合 には高い化学収率およびエナンチオ選択性で付加体が得られた(entry 1)。tolBINAPO は、ホ スフィンオキシド周囲の嵩高さが増したため、反応性が低下したと考えられる(entry 2)。 BINAPO の 4,4’位に TMS 基を置換したホスフィンオキシド 68や、SEGPHOSO は高活性を 示したものの、若干のエナンチオ選択性の低下が認められた(entries 3,4)。ビフェニル骨格 を有さない DIOPO や、小笠原らが開発したらせん構造を有するホスフィンオキシドを用い た場合には化学収率およびエナンチオ選択性の低下が見られた(entries 5,6)。これらの触媒 では十分な不斉空間を構築できなかったと考えられる。 Me Me O + PhCHO
Lewis Base (10 mol%) SiCl4 (4 eq) iPr 2NEt (5 eq) CH2Cl2, –60 ˚C, 24 h O OH Ph 1m 2a (3.0 eq)
Table 7. Screening of Chiral Lewis Bases
entry 1 2 3 4 5 6 yield, %a) 84 65 96 97 26 74 ee, %b) 91 91 86 89 67 83 a) Isolated yield. b) Determined by HPLC analysis.
Lewis Base BINAPO tolBINAPO 4,4'-bisTMSBINAPO SEGPHOS dioxide DIOPO
Helical Phosphine Oxide
PAr2 PAr2 O O PPh2 PPh2 O O O O O O SEGPHOSO O O PPh2 PPh2 O O DIOPO Ph OH 4b PPh2 PPh2 O O Ar = Ph: BINAPO Ar = 4-tolyl: tolBINAPO
Helical Phosphine Oxide PPh2 PPh2 O O TMS TMS 4,4'-bisTMSBINAPO O OH Ph Ph OH meso-4b (not observed)
第2章 第2節 32 −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 4,4’位に TMS 基が置換したホスフィンオキシドは、BINAP の 4,4’位に臭素を導入後、リチオ化を経て合成 可能である(Scheme 43)68。 らせん構造を有するホスフィンオキシドは、小笠原らにより以下のスキームを経て合成されている(Scheme 44)。 本触媒は、アリルトリクロロシランを用いたアリル化反応において触媒量の低減が可能である(Scheme 45)69。 PPh2 PPh2 Br2 pyridine PPh2 PPh2 Br Br BuLi TMSBr PPh2 PPh2 TMS TMS oxidation PPh2 PPh2 TMS TMS O O
Scheme 43. Synthesis of 4,4'-bisTMSBINAPO
SiCl3
PhCHO + Helical phosphine oxide (0.1 mol %) Ph
OH CH2Cl2, –78 ˚C, 24 h
86% yield, 86% ee
Scheme 45. Low-loading Helical Phosphine Oxide Catalyzed Allylation.
Me Me Cp2ZrCl2 Mg ZrCp2 Me Me CuCl Ph2PCl PPh2 PPh2 PPh2 PPh2 O O optical resolution oxidation
第2章 第2節 33 続いて、メチルエチルケトン(1k)とベンズアルデヒド(2a)の反応を用いて、各種アミンの 種類および当量の検討を行った(Table 8)。ジイソプロピルエチルアミンを用いた場合には、 アミンを増量しても化学収率は中程度であった(entry 2)。前述のとおり副反応であるアルデ ヒドの還元が進行し、アルデヒドが消費されたことが原因と考えられる。アミンをジシク ロヘキシルメチルアミンに変更したところ、若干の化学収率の改善が見られた(entry 3)。反 応時間を 48 時間に延長しても、化学収率の大幅な改善は認められなかった (entry 4)。この 他に塩基性が高い DBU や、ピペリジン誘導体を用いたが、反応は全く進行しなかった (entries 6-8)。これは前章の場合と同様に、アミンの立体障害が少ないため、四塩化ケイ素 のケイ素原子と窒素原子が反応し、四塩化ケイ素が失活したためであると考えられる。 O + PhCHO (S)-BINAPO (10 mol %) SiCl4 (4 eq) amine (X eq) CH2Cl2, –60 ˚C, 24 h O Ph OH (3.0 eq) Ph OH Me entry 1 2 3 4 5 6 7 8 amine (X eq) iPr 2NEt (5 eq) iPr 2NEt (10 eq) Cy2NMe (5 eq) Cy2NMe (5 eq) Cy2NMe (10 eq) DBU (5 eq) N-ethylpiperidine (5 eq) N-methylpiperidine (5 eq) yield, %a) 65 65 71 73 70 NR NR NR ee, %c) 93 92 95 94 95 -Table 8. Screening of Amines.
PPh2 PPh2 O O (S)-BINAPO Drb) 90:10 90:10 91:9 91:9 91:9
-a) Isolated yield. b) The ratio of the major isomer to the minor isomer was determined by 1H NMR analysis. c) The ee (major isomer) was determined by HPLC analysis. d) For 48 h.
1k
2a
4a
第2章 第2節 34 続いて、溶媒および反応温度の検討を行った(Table 9)。第1章の場合と同様に、ジクロロ メタンを用いた場合は化学収率が高く、プロピオニトリルを用いた場合はエナンチオ選択 性が高い傾向にある(entries 1-3)。このため、これら2つの溶媒の 1:1 の混合溶媒を用いる こととした(entry 4)。さらに、反応温度を−40 ˚C とすることで化学収率が向上した(entry 5)。 O + PhCHO (S)-BINAPO (10 mol %) SiCl4 (4 eq) Cy2NMe (5 eq) 24 h O Ph OH Ph OH Me Me entry 1 2 3 4 yield, %a) 71 16 40 86 ee, %c) 95 97 95 91 solvent CH2Cl2 EtCN CH2Cl2/EtCN (1:1) CH2Cl2/EtCN (1:1) Drb) 91:9 89:11 91:9 90:10 temp., ˚C –60 –60 –60 –40
a) Isolated yield. b) The ratio of the major isomer to the minor isomer was determined by 1H NMR analysis. c) The ee (major isomer) was determined by HPLC analysis.
(3.0 eq)
Table 9. Optimization of Reaction Temperature and Solvent.
1k 4a