ソホスブビル
第
2 部 CTD の概要
2.7 臨床概要
2.7.1 生物薬剤学試験及び関連する分析法
目次
頁 略号一覧表 ... 4 1 背景および概観 ... 5 1.1 製剤開発 ... 6 1.2 溶出性 ... 6 1.3 生体試料中薬物濃度分析法 ... 6 1.3.1 ヒト血漿中SOF、GS-566500 及び GS-331007 の定量法 ... 6 1.3.2 ヒト血漿、全血及び尿中の併用薬剤の定量法 ... 7 2 個々の試験結果の要約 ... 8 3 全試験を通しての結果の比較と解析 ... 9 4 参考文献 ... 10 5 付録 ... 12 5.1 付録一覧 ... 12 5.2 生物薬剤学試験の要約 ... 12 5.3 各試験で用いた生体試料中薬物濃度分析法の要約 ... 13 5.4 長期保存安定性 ... 14 5.5 ヒト血漿中の併用薬剤の定量法 ... 16表目次
頁 表 1 社で実施したヒト血漿中SOF、GS-566500 及び GS-331007 の分析法バリデーション 結果( 86-0938 試験報告書 [CTD 5.3.1.4.1]) ... 7 表 2 社で実施したヒト血漿中SOF、GS-566500 及び GS-331007 の分析法バリデーション 結果( 60-1323 試験報告書 [CTD 5.3.1.4.2]) ... 7略号一覧表
略号 英語 日本語
AASLD American Association for the Study of Liver Diseases
米国肝臓病学会
CSR clinical study report 治験総括報告書 CV coefficient of variation 変動係数 EASL European Association for the Study of
the Liver
欧州肝臓学会
EU European Union 欧州連合
Gilead Gilead Sciences, Inc. ギリアド・サイエンシズ社 HCC hepatocellular carcinoma 肝細胞癌
HCV hepatitis C virus C 型肝炎ウイルス HIV human immunodeficiency virus ヒト免疫不全ウイルス IDSA Infectious Diseases Society of America 米国感染症学会
IFN interferon インターフェロン
LC-MS/MS liquid chromatography/tandem mass spectrometry
液体クロマトグラフィー・タンデム 質量分析法
LTSS long-term storage stability 長期保存安定性 Peg-IFN pegylated-interferon ペグインターフェロン
社
RBV ribavirin リバビリン
RE relative error 相対誤差
RNA ribonucleic acid リボ核酸
SOF sofosbuvir (Sovaldi®, GS-7977) ソ ホ ス ブ ビ ル ( ソ バ ル デ ィ®錠 、 GS-7977)
SVR, SVRxx sustained virologic response, sustained virologic response at “xx” weeks following completion of all treatment
持続的ウイルス陰性化、投与終了後 XX 週での持続的ウイルス陰性化
1
背景および概観
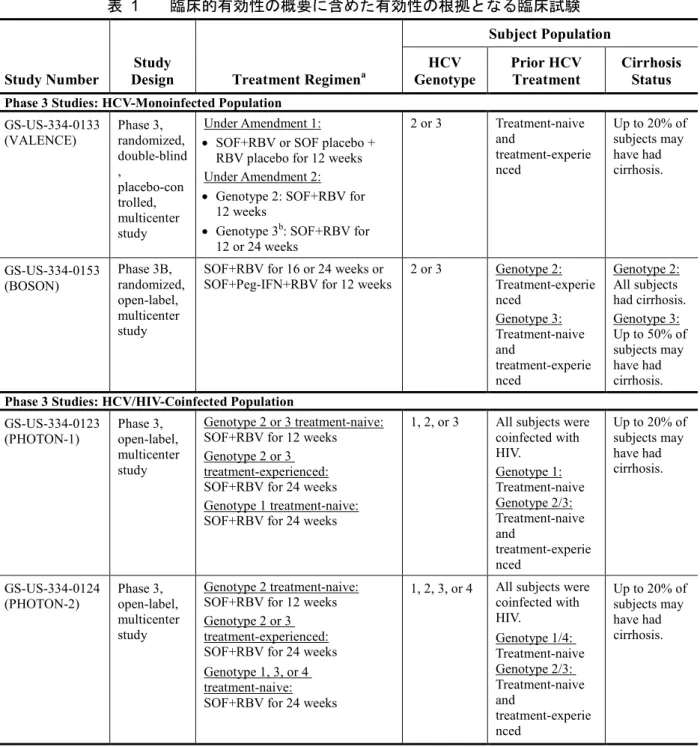
C 型肝炎ウイルス(HCV)はフラビウイルス科に属する一本鎖 RNA ウイルスであり、主に血 液又は血液製剤を介して感染する 3。HCV の複製は主に肝細胞で行われ、肝細胞が HCV 感染に 対する免疫を介した生体応答の標的となる12。免疫系及びウイルスによる持続的な肝細胞の損傷 の結果、感染から 20~30 年かけて進行性の肝疾患に至る 10, 18。HCV は遺伝的多様性を有し、6 種類のジェノタイプ(ジェノタイプ1~6)に大別され、各ジェノタイプはさらにサブタイプ(a、 b、c 等)に細分されるが、それらジェノタイプ及びサブタイプにより、インターフェロン(IFN) ベースの治療に対する反応性が異なることが示されている。日本国内では主にジェノタイプ1 及 び2 の HCV 感染者が多く、慢性期感染症ではそれぞれ約 70%及び 30%を占める4。しかし、国内 でジェノタイプ1 及び 2 以外の HCV ジェノタイプも一部確認されており、そのうち、ジェノタ イプ3 は輸入血液製剤を介した感染9, 13, 11, 19, 7、ジェノタイプ4、5 又は 6 は主に海外での感染歴 等によるものとされる。 国内でのジェノタイプ3 の慢性 HCV 感染者数は公表文献から約 2,800 人と推定される19, 7, 8, 16, 11, 17。ジェノタイプ3 の HCV 感染は主に輸入血液製剤の使用歴のある血液凝固異常の患者でみられ、 それゆえ、これらの患者は高い割合でヒト免疫不全ウイルス(HIV)に重複感染している。 HIV 重複感染患者では HCV 感染に続発する肝線維化及び肝硬変への進行がさらに早まること が報告されており 2、肝線維化及び肝硬変が進行した患者では肝の非代償性や肝細胞癌(HCC) へとさらに進展するリスクが高くなる。現在、国内では、C 型非代償性肝硬変患者に対して承認 された治療法はなく、HCC による年間死亡者数約 20,000 人のうち 75%が HCV 感染症に由来する ものである。したがって、重度肝疾患への進行リスクの高いこれら HCV/HIV 重複感染患者では 特に、HCV 感染による疾病負担の軽減に寄与する安全かつ有効な抗 HCV 治療薬に対する喫緊の アンメットメディカルニーズが存在する。 現在、国内におけるジェノタイプ 3 の HCV 感染症に対する治療選択肢はペグインターフェロ ン(Peg-IFN)+リバビリン(RBV)の 24 週間併用投与のみであるが、その持続的ウイルス陰性 化(SVR)率は十分ではなく、約 80%と報告されている。また、投与禁忌又は忍容性の問題によ り、本治療法を受けることができない患者も多く存在する。日本国内のこれら患者集団に対する 安全かつ有効なIFN フリーの治療法が早急に必要とされている。 米国及び欧州連合等の海外諸国では、ジェノタイプ 3 の慢性 HCV 感染症に対する治療法が既 に承認されており、ソバルディ錠®(ソホスブビル[SOF]、GS-7977)と RBV の 24 週間併用投 与も治療選択肢に含まれる。この投与レジメンは米国肝臓病学会/米国感染症学会(AASLD/IDSA) 及び欧州肝臓学会(EASL)の HCV 治療ガイドラインでも推奨されている1, 5。ソホスブビルの添 付文書及びガイドラインでのジェノタイプ 3 の慢性 HCV 感染症に対する推奨内容は、海外で実 施された4 つの第 3 相試験成績に基づいている。これらの 4 つの第 3 相試験でジェノタイプ 3 の 慢性HCV 感染患者に SOF+RBV を 24 週間併用投与したときの SVR 率は 84~94%であり、一貫 して高い有効性、並びに良好な安全性及び忍容性プロファイルが認められている20, 15, 14, 6。 本文書は、本邦でのソホスブビルのジェノタイプ 3 の慢性 HCV 感染症に対する効能追加のた めの承認事項一部変更承認申請を裏付ける資料として提出するもので、ジェノタイプ3 の成人 C 型慢性肝炎又はC 型代償性肝硬変に対する治療として SOF+RBV の 24 週間併用投与が検討された4 つの臨床試験で用いた分析法について要約する。 本モジュールでは、海外で実施された以下のソホスブビル第3相試験4試験について考察する。 ● HCV 単独感染患者を対象とした第 3 相試験 2 試験: GS-US-334-0133(VALENCE)試験及び GS-US-334-0153(BOSON)試験 ● HCV/HIV 重複感染患者を対象とした第 3 相試験 2 試験: GS-US-334-0123(PHOTON-1)試験及び GS-US-334-0124(PHOTON-2)試験 これらの試験では、HIV との重複感染例を含むジェノタイプ 3 の HCV 感染被験者を対象とし てSOF+RBV の 24 週間併用投与が検討され、未治療及び既治療いずれの被験者も対象とされた。 個々の試験の詳細な要約は、臨床的有効性(CTD 2.7.3、2 項)に記載した。 本申請に含まれるソホスブビルの第3 相試験 4 試験で用いたヒト血漿中の SOF 及びその代謝物 の定量に用いられた生体試料中薬物濃度分析法に関する要約を、各分析法の最新版のバリデーシ ョン報告書へのリンクとともに1.3.1 項に示す。 本申請に含まれる臨床試験の一覧(生体マトリックス、被験物質、生体試料中薬物濃度分析に 用いた最新版のバリデーション報告書、生体試料中薬物濃度分析法、定量範囲、生体試料中薬物 濃度分析報告書へのリンク[各治験総括報告書[CSR]の付録 16.1.10])を付録 5.3 に示す。 SOF 及びその代謝物の長期保存安定性(LTSS)データの要約、及び臨床試験ごとの詳細な要約 (生体マトリックス、被験物質、試料採取日、試料分析日、試料の最大経過時間[最初の試料採 取日から最後の試料分析日までの期間]、LTSS を裏付けるデータ、LTSS データを含む最新版のバ リデーション報告書、生体試料中薬物濃度分析報告書へのリンク)を付録5.4 に示す。
1.1
製剤開発
提出すべき新たな情報はない。1.2
溶出性
提出すべき新たな情報はない。1.3
生体試料中薬物濃度分析法
本報告書に記載したすべての被験物質について、最新版のバリデーション報告書(初版からこ れまでのすべての版を含む)の要約を以下に記述した。各治験総括報告書で引用されているバリ表 1 社で実施したヒト血漿中SOF、GS-566500 及び GS-331007 の分析法バリデーシ ョン結果( 86-0938 試験報告書 [CTD 5.3.1.4.1])
Parameter SOF GS-566500 GS-331007
Calibrated range (ng/mL) 5 to 5000 10 to 5000 10 to 5000 Interassay precision range (%CV)a 1.3 to 7.4 3.3 to 9.1 0.8 to 5.6 Interassay accuracy range (%RE)a −3.3 to 8.2 −5.2 to 5.9 −0.1 to 7.5 Studies Supported GS-US-334-0133, GS-US-334-0123
= ; SOF = sofosbuvir
a Intraday ranges are reported.
The most current validation report is listed. Validation reports included in the corresponding CSRs were those in effect at the time of final approval of the CSR.
Source: 86-0938, Amendment 10
表 2 社で実施したヒト血漿中SOF、GS-566500 及び GS-331007 の分析法バリデーシ ョン結果( 60-1323 試験報告書 [CTD 5.3.1.4.2])
Parameter SOF GS-566500 GS-331007
Calibrated range (ng/mL) 5 to 2500 10 to 5000 10 to 5000 Interassay precision range(%CV)a 2.4 to 9.7 5.1 to 7.7 2.5 to 7.2 Interassay accuracy range (%RE)a –5.1 to 3.4 –2.2 to 2.9 –1.0 to 2.5 Studies Supported GS-US-334-0153, GS-US-334-0124
= ; SOF = sofosbuvir
a Interday ranges are reported.
The most current validation report is listed. Validation reports included in the corresponding CSRs were those in effect at the time of final approval of the CSR.
Source: 60-1323, Amendment 5
1.3.2
ヒト血漿、全血及び尿中の併用薬剤の定量法
2
個々の試験結果の要約
提出すべき新たな情報はない。3
全試験を通しての結果の比較と解析
提出すべき新たな情報はない。4
参考文献
1 AASLD-IDSA. Recommendations for testing, managing, and treating hepatitis C. Updated 25 April 2016. Available at: http://www.hcvguidelines.org/ Accessed: 21 June, 2016.
2 Benhamou Y, Bochet M, Di Martino V, Charlotte F, Azria F, Coutellier A, et al. Liver fibrosis progression in human immunodeficiency virus and hepatitis C virus coinfected patients. The Multivirc Group. Hepatology 1999;30 (4):1054-8.
3 Centers for Disease Control and Prevention. National Hepatitis C Prevention Strategy - A Comprehensive Strategy for the Prevention and Control of Hepatitis C Virus Infection and its Consequences. 2001.
4 Chung H, Ueda T, Kudo M. Changing trends in hepatitis C infection over the past 50 years in Japan. Intervirology 2010;53 (1):39-43.
5 EASL. Recommendations on Treatment of Hepatitis C 2015. J Hepatol 2015;63 (1):199-236.
6 Foster GR, Pianko S, Brown A, Forton D, Nahass RG, George J, et al. Efficacy of Sofosbuvir Plus Ribavirin With or Without Peginterferon-Alfa in Patients With Hepatitis C Virus Genotype 3 Infection and Treatment-Experienced Patients With Cirrhosis and Hepatitis C Virus Genotype 2 Infection. Gastroenterology 2015;149 (6):1462-70.
7 Fujimura Y, Ishimoto S, Shimoyama T, Narita N, Kuze Y, Yoshioka A, et al. Genotypes and multiple infections with hepatitis C virus in patients with haemophilia A in Japan. J Viral Hepat 1996;3 (2):79-84.
8 Hayashi K, Fukuda Y, Nakano I, Katano Y, Toyoda H, Yokozaki S, et al. Hepatitis C virus genotypes in hemphiliacs with chronic hepatitic C [Japanese]. Liver 2002;43 (1):11-7.
9 Hayashi K, Fukuda Y, Nakano I, Katano Y, Toyoda H, Yokozaki S, et al. Prevalence and characterization of hepatitis C virus genotype 4 in Japanese hepatitis C carriers. Hepatol Res 2003;25 (4):409-14.
10 Hoofnagle JH, Seeff LB. Peginterferon and ribavirin for chronic hepatitis C. N Engl J Med 2006;355 (23):2444-51.
17 Tanaka J. Trends in Hepatitis virus carrier at [Japanese]. 12th Council for Promotion of Hepatitis Measures 2014.
18 World Health Organization (WHO). Hepatitis C Fact sheet N°164. Available at: http://www.who.int/mediacentre/factsheets/fs164/en/print.html. Accessed: 25 May, 2007. 2000.
19 Yotsuyanagi H, Kikuchi Y, Tsukada K, Nishida K, Kato M, Sakai H, et al. Chronic hepatitis C in patients co-infected with human immunodeficiency virus in Japan: a retrospective multicenter analysis. Hepatol Res 2009;39 (7):657-63.
20 Zeuzem S, Dusheiko GM, Salupere R, Mangia A, Flisiak R, Hyland RH, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N Engl J Med 2014;370 (21):1993-2001.
5
付録
5.1
付録一覧
Appendix Number Appendix Title
5.2 生物薬剤学試験の要約 5.3 各試験で用いた生体試料中薬物濃度分析法の要約 5.4 長期保存安定性 5.5 ヒト血漿中の併用薬剤の定量法
5.2
生物薬剤学試験の要約
本申請に含まれる生物薬剤学試験の要約表はCTD 2.7.3、付録 7.1 に示した。5.3
SOF の臨床開発プログラムを裏付けるために実施された各試験の生体試料中薬物濃度分析法、分析法バリデーション報告書及び生体試料分析報 告書の要約を以下に示す。
Study No. Matrix Analytes Validation ReportCurrent a Bioanalytical Technique Calibrated Range Sample Analysis Report
GS-US-334-0133
(VALENCE) Human Plasma GS-566500 SOF Amendment 10 86-0938, LC-MS/MS 10 to 5000 ng/mL 5 to 5000 ng/mL Amendment 1 60-12105,
GS-331007 10 to 5000 ng/mL
GS-US-334-0153
(BOSON) Human Plasma GS-566500 SOF Amendment 5 60-1323, LC-MS/MS 10 to 5000 ng/mL 5 to 2500 ng/mL 60-1501
GS-331007 10 to 5000 ng/mL
GS-US-334-0123
(PHOTON-1) Human Plasma SOF Amendment 10 86-0938, LC-MS/MS 5 to 5000 ng/mL Amendment 1 60-12104A
GS-566500 10 to 5000 ng/mL
GS-331007 10 to 5000 ng/mL
GS-US-334-0124
(PHOTON-2) Human Plasma SOF Amendment 5 60-1323, LC-MS/MS 5 to 2500 ng/mL 60-1321
GS-566500 10 to 5000 ng/mL
GS-331007 10 to 5000 ng/mL
LC-MS/MS=liquid chromatography/tandem mass spectrometry; = ; SOF=sofosbuvir
5.4
長期保存安定性
付録表 1 ヒト血漿中SOF、GS-566500 及び GS-331007 の長期保存安定性
Analyte Matrix LTSS Data Available Most Current Validation Report
SOF Human Plasma 174 days at –20°C
813 days at –70°C 60-1323 Amendment 5 GS-566500 Human Plasma 174 days at –20°C
747 days at –70°C 60-1323 Amendment 5 GS-331007 Human Plasma 174 days at –20°C
813 days at –70°C 60-1323 Amendment 5
Study No. Matrix Analyte
Sample Collection
Dates Analysis Dates Sample Sample Maximum Transpired Timea Supporting LTSS Data
Most Current Validation
Reportb Sample Analysis Report GS-US-334-0133
(VALENCE) Human Plasma SOF through 20
20
20 through
20
316 days at −70°C 174 days at –20°C
813 days at –70°C Amendment 1086-0938, Amendment60-12105, 1
Human Plasma GS-566500 174 days at –20°C
747 days at –70°C
Human Plasma GS-331007 174 days at –20°C
813 days at –70°C GS-US-334-0153
(BOSON) Human Plasma SOF through 20
20 20 through 20 441 days at –70°C 174 days at –20°C 813 days at –70°C Amendment 560-1323, 60-1501
Human Plasma GS-566500 174 days at –20°C
747 days at –70°C
Human Plasma GS-331007 174 days at –20°C
813 days at –70°C GS-US-334-0123
(PHOTON-1) Human Plasma SOF through 20
20
20 through
20
409 days at –70°C 174 days at –20°C
813 days at –70°C Amendment 1086-0938, Amendment 160-12104A
Human Plasma GS-566500 174 days at –20°C
747 days at –70°C
Human Plasma GS-331007 174 days at –20°C
813 days at –70°C GS-US-334-0124
(PHOTON-2) Human Plasma SOF through 20
20 20 through 20 372 days at –70°C 174 days at –20°C 813 days at –70°C Amendment 560-1323, 60-1321
Human Plasma GS-566500 174 days at –20°C
747 days at –70°C
Human Plasma GS-331007 174 days at –20°C
813 days at –70°C
LTSS = long-term storage stability; = ; SOF = sofosbuvir
a Sample maximum transpired time is the calculated maximum time between the date of the first sample collection and the date of the last sample analysis. b Current validation/LTSS reports are listed. Validation reports listed in the corresponding CSRs were those in effect at the time samples were analyzed.
5.5
ヒト血漿中の併用薬剤の定量法
提出すべき新たな情報はない。ソホスブビル
第
2 部 CTD の概要
2.7 臨床概要
2.7.2 臨床薬理試験
目次
頁 略号一覧表 ... 5 1 背景および概観 ... 6 1.1 生体試料分析法 ... 7 2 個々の試験結果の要約 ... 8 3 全試験を通しての結果の比較と解析 ... 9 3.1 吸収・分布・代謝・排泄 ... 9 3.2 薬物動態 ... 9 3.2.1 内因性要因 ... 9 3.2.2 外因性要因 ... 9 3.3 薬物動態/薬力学 ... 9 4 特別な試験 ... 10 4.1 非臨床ウイルス学的試験 ... 10 4.1.1 臨床試験で検出されたNS5B 変異の In Vitro 感受性試験 ... 10 4.2 臨床ウイルス学的試験 ... 10 4.2.1 投与関連変異 ... 11 4.2.2 GS-US-334-0133(VALENCE)試験 ... 12 4.2.2.1 試験デザイン及びウイルス学的応答 ... 12 4.2.2.2 GS-US-334-0133(VALENCE)試験:ウイルス学的治療不成功例におけ るHCV シークエンス解析 ... 12 4.2.2.3 GS-US-334-0133(VALENCE)試験:結論 ... 13 4.2.3 GS-US-334-0153(BOSON)試験 ... 13 4.2.3.1 試験デザイン及びウイルス学的応答 ... 13 4.2.3.2 GS-US-334-0153(BOSON)試験:ウイルス学的治療不成功例における HCV シークエンス解析 ... 14 4.2.3.3 GS-US-334-0153(BOSON)試験:結論 ... 15 4.2.4 GS-US-334-0123(PHOTON-1)試験... 156 付録 ... 21 6.1 臨床薬理試験の概要 ... 21
表目次
頁 表 1 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者におけるウイルス学的結果(投与終了後24 週時点まで)(最大の解析対 象集団) ... 11 表 2 GS-US-334-0133(VALENCE)試験:SOF+RBV を 24 週間併用投与され、ウイルス 学的治療不成功となった時点でNS5B NI TEV が検出されたジェノタイプ 3 の HCV 感染被験者一覧 ... 13 表 3 GS-US-334-0153(BOSON)試験:SOF+RBV を 24 週間併用投与され、NS5B NI TEV が検出されたジェノタイプ3 の HCV 感染被験者一覧 ... 15 表 4 GS-US-334-0124(PHOTON-2)試験:SOF+RBV を 24 週間併用投与され、ウイルス 学的治療不成功となった時点でNS5B NI TEV が検出されたジェノタイプ 3 の HCV 感染被験者一覧 ... 17 表 5 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者‐投与終了後24 週時までに NS5B NI TEV が検出された被験者数(最大 の解析対象集団) ... 18
略号一覧表
略号 英語 日本語
AASLD American Association for the Study of Liver Diseases
米国肝臓病学会
ARV antiretroviral 抗レトロウイルス
EASL European Association for the Study of the Liver
欧州肝臓学会
EC50 half-maximal effective concentration 50%有効濃度
FTC emtricitabine エムトリシタビン
Gilead Gilead Sciences, Inc. ギリアド・サイエンシズ社 HCC hepatocellular carcinoma 肝細胞癌
HCV hepatitis C virus C 型肝炎ウイルス HIV human immunodeficiency virus ヒト免疫不全ウイルス IDSA Infectious Diseases Society of
America
米国感染症学会
IFN interferon インターフェロン
NDA new drug application 新薬承認申請 NI nucleoside inhibitor ヌクレオシド阻害薬
NS (5A/5B) nonstructural protein (5A/5B) 非構造タンパク質(5A/5B) Peg-IFN pegylated-interferon ペグインターフェロン
PK pharmacokinetic(s) 薬物動態
RBV ribavirin リバビリン
RNA ribonucleic acid リボ核酸
SOF sofosbuvir (Sovaldi®, GS-7977) ソホスブビル(ソバルディ錠®、GS- 7977)
SVR、SVRxx sustained virologic response, sustained virologic response at “xx” weeks following completion of all treatment
持続的ウイルス陰性化、投与終了 後 XX 週での持続的ウイルス陰性 化
TDF tenofovir disoproxil fumarate テノホビル ジソプロキシルフマ ル酸塩
TEV treatment-emergent variant 投与関連変異
1
背景および概観
C 型肝炎ウイルス(HCV)はフラビウイルス科に属する一本鎖 RNA ウイルスであり、主に血 液又は血液製剤を介して感染する 3。HCV の複製は主に肝細胞で行われ、肝細胞が HCV 感染に 対する免疫を介した生体応答の標的となる12。免疫系及びウイルスによる持続的な肝細胞の損傷 の結果、感染から 20~30 年かけて進行性の肝疾患に至る 10, 18。HCV は遺伝的多様性を有し、6 種類のジェノタイプ(ジェノタイプ1~6)に大別され、各ジェノタイプはさらにサブタイプ(a、 b、c 等)に細分されるが、それらジェノタイプ及びサブタイプにより、インターフェロン(IFN) ベースの治療に対する反応性が異なることが示されている。日本国内では主にジェノタイプ1 及 び2 の HCV 感染者が多く、慢性期感染症ではそれぞれ約 70%及び 30%を占める4。しかし、国内 でジェノタイプ1 及び 2 以外の HCV ジェノタイプも一部確認されており、そのうち、ジェノタ イプ3 は輸入血液製剤を介して9, 13, 11, 19, 7、ジェノタイプ4、5 又は 6 は主に海外での感染歴等に よるものとされる。 国内でのジェノタイプ3 の慢性 HCV 感染者数は公表文献から約 2,800 人と推定される19, 7, 8, 16, 11, 17。ジェノタイプ3 の HCV 感染は主に輸入血液製剤の使用歴のある血液凝固異常の患者でみられ、 それゆえ、これらの患者は高い割合でヒト免疫不全ウイルス(HIV)に重複感染している。 HIV 重複感染患者では HCV 感染に続発する肝線維化及び肝硬変への進行がさらに早まること が報告されており 2、肝線維化及び肝硬変が進行した患者では肝の非代償性や肝細胞癌(HCC) へとさらに進展するリスクが高くなる。現在、国内では、C 型非代償性肝硬変患者に対して承認 された治療法はなく、HCC による年間死亡者数約 20,000 人のうち 75%が HCV 感染症に由来する ものである。したがって、重度肝疾患への進行リスクの高いこれら HCV/HIV 重複感染患者では 特に、HCV 感染による疾病負担の軽減に寄与する安全かつ有効な抗 HCV 治療薬に対する喫緊の アンメットメディカルニーズが存在する。 現在、国内におけるジェノタイプ 3 の HCV 感染症に対する治療選択肢はペグインターフェロ ン(Peg-IFN)+リバビリン(RBV)の 24 週間併用投与のみであるが、その持続的ウイルス陰性 化(SVR)率は十分ではなく、約 80%と報告されている。また、投与禁忌又は忍容性の問題によ り、本治療法を受けることができない患者も多く存在する。日本国内のこれら患者集団に対する 安全かつ有効なIFN フリーの治療法が早急に必要とされている。た4 つの臨床試験で得られた臨床薬物動態(PK)及び臨床ウイルス学的データについて要約する。 本モジュールでは、海外で実施された以下のソホスブビル第3相試験4試験について考察する。 ● HCV 単独感染患者を対象とした第 3 相試験 2 試験: GS-US-334-0133(VALENCE)試験及び GS-US-334-0153(BOSON)試験 ● HCV/HIV 重複感染患者を対象とした第 3 相試験 2 試験: GS-US-334-0123(PHOTON-1)試験及び GS-US-334-0124(PHOTON-2)試験 これらの試験では、HCV 療法の未治療及び既治療いずれの被験者も対象とされた。 SOF 及びそのヌクレオシド代謝物 GS-331007 のポピュレーション PK 解析には、GS-US-334-0123 (PHOTON-1)試験のデータを用いた。ポピュレーション PK 解析の結果を第 3 項に記載する。 ジェノタイプ 3 のレプリコンを用い、非構造タンパク質(NS)5B の種々の部位特異的変異株 のSOF に対する in vitro 感受性を評価した非臨床ウイルス学的試験(PC-334-2027 試験)の結果の 要約を4.1.1 項に示す。 独立行政法人 医薬品医療機器総合機構(PMDA)と事前合意したとおり(申請前相談# 議事録[20 年 月 日付])、本申請パッケージにはPC-334-2028 試験報告書が含まれている が、この試験の結果はジェノタイプ1 に対する NS5B 領域の関連変異を検討したものであり、ジ ェノタイプ3 の HCV 感染症には該当しないため、本文書中では詳述しなかった。 臨床ウイルス学的データは、ジェノタイプ3 の HCV 感染患者に対する SOF+RBV 24 週間併用 投与を行った上記4 試験の解析結果に基づくものである。臨床ウイルス学的統合解析の結果を 4.2 項に示す。 PK データ及び臨床ウイルス学的解析データが得られた試験に関するその他の情報については、 臨床的有効性における個々の試験結果の要約(CTD 2.7.3、2 項)及び臨床試験の概要(CTD 2.7.3、 付録7.1)に記載した。
1.1
生体試料分析法
SOF 及びその代謝物のヒト血漿中濃度の定量に用いた生体試料分析法については CTD 2.7.1 の 1.3.1 項に記載した。個々の臨床試験で用いた SOF 及びその代謝物のバリデートされた分析法の 要約はCTD 2.7.1 の付録 5.3 に記載した。2
個々の試験結果の要約
GS-US-334-0133(VALENCE)試験、GS-US-334-0153(BOSON)試験、GS-US-334-0123(PHOTON-1) 試験及びGS-US-334-0124(PHOTON-2)試験の個々の要約については、CTD 2.7.3 の 2.1、2.2、2.3 及び2.4 項にそれぞれ記載した。
3
全試験を通しての結果の比較と解析
3.1
吸収・分布・代謝・排泄
提出すべき新たな情報はない。
3.2
薬物動態
海外で実施された第3 相 GS-US-334-0123(PHOTON-1)試験では、次に挙げる HIV 抗レトロウ イルス(ARV)レジメンで治療中の HCV/HIV 重複感染患者を対象に、SOF+RBV を 12 又は 24 週間併用投与したときのSOF 及び GS-331007 の PK を評価した:非ヌクレオシド系逆転写酵素阻 害薬含有レジメン(例:エムトリシタビン[FTC]/テノホビル ジソプロキシルフマル酸塩[TDF] +エファビレンツ又はリルピビリン)、インテグラーゼ阻害薬含有レジメン(例:ラルテグラビル +FTC/TDF)、又はプロテアーゼ阻害薬含有レジメン(例:アタザナビル/リトナビル又はダルナ ビル/リトナビル+FTC/TDF)。血漿中濃度が測定可能であった全被験者を対象に、以前に構築し たポピュレーション PK モデル(ソホスブビルの初回申請 CTD 2.7.2、3.4.3 項)を用いて、SOF 及びGS-331007 の曝露量パラメータを算出した。 SOF 及び GS-331007 の曝露量は投与レジメン(SOF+RBV の 12 又は 24 週間併用投与)及び HCV ジェノタイプ(1、2 又は 3)を通じて同程度であった。 PK 解析及び結果の詳細については、治験総括報告書(GS-US-334-0123 試験、CTD 5.3.5.1.1、 10 項)に記載した。
3.2.1
内因性要因
HCV/HIV 重複感染 HCV/HIV 重複感染被験者における SOF 又は GS-331007 の曝露量パラメータは、米国の承認申 請に用いた第2 相及び 3 相試験における HCV 単独感染被験者での値と比較して、臨床的に重要 な差は認められなかった。3.2.2
外因性要因
SOF 又は GS-331007 の曝露量は、評価した種々の ARV レジメン及び ARV 薬を使用していなか った被験者で同程度であった。
3.3
薬物動態/薬力学
SOF 及び GS-331007 の曝露量パラメータは、投与終了後 12 週時点での SVR(SVR12)を達成 した被験者とウイルス学的再燃が認められた被験者で同程度であり、曝露-応答関係に相関性は 認められなかった。
4
特別な試験
4.1
非臨床ウイルス学的試験
4.1.1
臨床試験で検出された
NS5B 変異の In Vitro 感受性試験
ジェノタイプ3 のレプリコンを用い、26 の NS5B 部位特異的変異株について、ソホスブビルに 対する感受性に与える影響について検討した(PC-334-2027 試験 [CTD 4.2.1.1.1])。SOF の 50%有 効濃度(EC50)値に変化が認められたのはS282T 変異株(3.5 倍)のみであった。その他の NS5B 変異株(S96T、N142T 及び L159F/V321A 変異株等)では SOF の EC50値に変化は認められなかっ た。これらの結果は、ソホスブビルの初回承認申請資料で提出した、NS5A 及び NS5B 変異レプ リコンに対するSOF の抗ウイルス活性に関する報告内容(PC-334-2006 試験)と一致する。4.2
臨床ウイルス学的試験
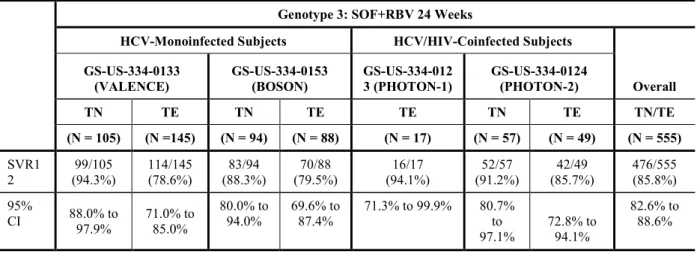
海外で実施した第3 相試験 4 試験のデータを用いて、ジェノタイプ 3 の HCV 感染被験者につ いての臨床ウイルス学的解析を行った。SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者における主なウイルス学的結果の要約を表 1 に示し、それぞれの試験の結果を 4.2.2~4.2.5 項に記載する。各試験でのウイルス学的耐性解析に関する詳細は各治験総括報告書に おいて示し、個々の試験結果の要約はCTD 2.7.3 の 2 項に記載した。表 1 GS-US-334-0133 試験、GS-US-334-0153 試験、GS-US-334-0123 試験及び GS-US-334-0124 試験:SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者
におけるウイルス学的結果(投与終了後24 週時点まで)(最大の解析対象集団) Genotype 3: SOF+RBV 24 Weeks
HCV-Monoinfected Subjects HCV/HIV-Coinfected Subjects GS-US-334-0133
(VALENCE) GS-US-334-0153 (BOSON) GS-US-334-0123 (PHOTON-1) GS-US-334-0124 (PHOTON-2) TN/TE
(N = 250) (N = 182) TN/TE (N = 17) TE (N = 106) TN/TE SVR24 211/250 (84.4%) 151/182 (83.0%) 15/17(88.2%) 93/106 (87.7%)
95% CI 79.3% to 88.7% 76.7% to 88.1% 63.6% to 98.5% 79.9% to 93.3% Overall Virologic Failure 37/250 (14.8%) 29/182 (15.9%) 2/17 (11.8%) 12/106 (11.3%) Relapsea 36/249 (14.5%) 26/178 (14.6%) 2/17 (11.8%) 11/105 (10.5%) On-Treatment Virologic
Failure 1/250 (0.4%) 3/182 (1.6%) 0/17 1/106 (0.9%) Other 2/250 (0.8%) 2/182 (1.1%) 0/17 1/106 (0.9%)
CI = confidence interval; LLOQ = lower than the limit of quantitation; SVR24 = sustained virologic response at 24 weeks posttreatment; TE = treatment experienced; TN = treatment naive
a The denominator for relapse was the number of subjects with HCV RNA < LLOQ at their last on-treatment assessment.
For Studies GS-US-334-0133, GS-US-334-0123, and GS-US-334-0124, HCV RNA was analyzed using the Roche TaqMan V 2.0 assay for use with the High Pure System with a limit of quantitation 25 IU/mL. For Study GS-US-334-0153, HCV RNA was analyzed using Roche COBAS TaqMan V2.0 assay with a lower limit of quantitation of 15 IU/mL.
Relapse = confirmed HCV RNA ≥ LLOQ during the posttreatment period, after having had HCV RNA < LLOQ at the last on-treatment visit.
On-Treatment Virologic Failure = Breakthrough (confirmed HCV RNA≥ LLOQ after having had HCV RNA < LLOQ while on treatment), Rebound (confirmed > 1 log10 IU/mL increase in HCV RNA from nadir while on treatment), or Nonresponse (HCV RNA persistently ≥ LLOQ through 8 weeks of treatment). Other = Subject who did not achieve SVR24 and did not meet criteria for virologic failure.
The exact 95% CI for the proportion within treatment group was based on the Clopper-Pearson method. Source:
GS-US-334-0133, Section 15.1, Table 9 and Table 11; Appendix 16.2, Listings 8.2, 8.3, and 8.4 GS-US-334-0153, Section 15.1, Table 8.3, Table 11.3, and Table 13.3
GS-US-334-0123, Section 15.1, Table 5 and Table 6 GS-US-334-0124, Section 15.1, Table 5 and Table 6
4.2.1
投与関連変異
全被験者を対象にベースライン時及びウイルス学的治療不成功となった時点(該当する場合) においてHCV NS5B 遺伝子のディープシークエンス解析を実施した。ベースライン時及び投与終 了後のNS5B 変異検出のためのディープシークエンス解析のアッセイカットオフ値は 1%とした。 本臨床薬理試験の概要文においては、以下のNS5B ヌクレオシド阻害薬(NI)投与関連変異(TEV) について検討した。 ● NS5B NI TEV:S96T、N142T、L159F、S282T、S282 位のその他の変異、M289 L/I、L320F 及びV321A4.2.2
GS-US-334-0133(VALENCE)試験
4.2.2.1 試験デザイン及びウイルス学的応答 GS-US-334-0133(VALENCE)試験は、第 3 相、ランダム化、二重盲検、プラセボ対照試験で あり、未治療又は既治療のジェノタイプ2 又は 3 の慢性 HCV 感染患者を対象に、SOF+RBV を併 用投与したときの有効性、安全性及び忍容性を評価した。 SOF+RBV 24 週間投与群にランダム割り付けされたジェノタイプ 3 の HCV 感染被験者 250 例 中145 例(58.0%)が HCV 治療の既治療例であり、そのほとんどはウイルス学的再燃/ブレーク スルー(64.8%、145 例中 94 例)又は無効(28.3%、145 例中 41 例)による治療不成功であった (GS-US-334-0133 試験、CTD 5.3.5.1.3、15.1 項、Table 3)。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者の 85.2%(250 例中 213 例)がSVR12 を達成した(GS-US-334-0133 試験、CTD 5.3.5.1.3、15.1 項、Table 11)。SVR12 を 達成しなかった37 例(14.8%、250 例中 37 例)のうち 34 例が再燃、2 例が SVR12 評価不能(い ずれも追跡不能)、1 例が投与中のウイルス学的治療不成功(治験薬の服薬不遵守と考えられた) であった(GS-US-334-0133 試験、CTD 5.3.5.1.3、9.2.1 項、Appendix 16.2、Listing 3 及び 8.3)。SVR12 を達成したジェノタイプ 3 の HCV 感染被験者 2 例において、投与終了後 24 週時点で再 燃が認められた(GS-US-334-0133 試験、CTD 5.3.5.1.3、9.2.2 項、Appendix 16.2、Listing 8.4)。 4.2.2.2 GS-US-334-0133(VALENCE)試験:ウイルス学的治療不成功例における HCV シークエンス解析 SOF+RBV 24 週間投与群のジェノタイプ 3 の HCV 感染被験者で投与終了後 12 週時点までにウ イルス学的治療不成功となった35 例中 34 例が再燃、1 例が投与中のウイルス学的治療不成功で あった。被験者番号1257-2042 は、投与中の Week 12 以降のすべての来院時点で GS-331007(循 環血液中のSOF の主要代謝物)の血漿中濃度が検出できず、SOF の服薬不遵守であることが確認 された。ベースライン時及びウイルス学的治療不成功となった時点の検体でNS5B 領域のディー プシークエンス解析(アッセイカットオフ値1%)を実施し、35 例全例から NS5B 塩基配列が得 られた。 これらのウイルス学的治療不成功例の35 例では、既に特定されている SOF の TEV である S282T 変異は検出されなかったが、L159F 又は V321A 変異がウイルス学的治療不成功例 35 例中 7 例
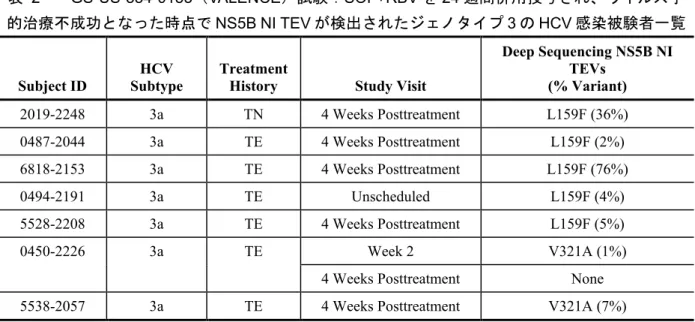
表 2 GS-US-334-0133(VALENCE)試験:SOF+RBV を 24 週間併用投与され、ウイルス学 的治療不成功となった時点でNS5B NI TEV が検出されたジェノタイプ 3 の HCV 感染被験者一覧
Subject ID Subtype HCV Treatment History Study Visit
Deep Sequencing NS5B NI TEVs (% Variant) 2019-2248 3a TN 4 Weeks Posttreatment L159F (36%) 0487-2044 3a TE 4 Weeks Posttreatment L159F (2%) 6818-2153 3a TE 4 Weeks Posttreatment L159F (76%) 0494-2191 3a TE Unscheduled L159F (4%) 5528-2208 3a TE 4 Weeks Posttreatment L159F (5%) 0450-2226 3a TE Week 2 V321A (1%)
4 Weeks Posttreatment None 5538-2057 3a TE 4 Weeks Posttreatment V321A (7%)
TE = treatment experienced; TN = treatment naive; TEV = treatment-emergent variant Source: GS-US-334-0133, Appendix 16.2, Virology Listings 1 and 2
4.2.2.3 GS-US-334-0133(VALENCE)試験:結論 ジェノタイプ3 の HCV 感染被験者において S282T 変異の出現は認められなかった。HCV NS5B TEV(L159F 又は V321A 変異)が 1%以上認められた被験者は、投与終了後 24 週時点までにウイ ルス学的治療不成功となった被験者の 18.9%であったが、これらの変異と表現型の薬剤耐性との 関連は認められなかった。
4.2.3
GS-US-334-0153(BOSON)試験
4.2.3.1 試験デザイン及びウイルス学的応答 GS-US-334-0153(BOSON)試験は、現在実施中の第 3b 相、多施設共同、非盲検試験であり、 未治療及び既治療のジェノタイプ 3 の慢性 HCV 感染患者(肝硬変の有無を問わず)並びに既治 療 の ジ ェ ノ タ イ プ 2 の 慢 性 HCV 感 染 患 者 ( 肝 硬 変 あ り ) を 対 象 に SOF+RBV 及 び SOF+Peg-IFN+RBV を併用投与したときの有効性、安全性及び忍容性を評価する。 SOF+RBV 24 週間投与群にランダム割り付けされたジェノタイプ 3 の HCV 感染被験者 182 例 のうち約半数がHCV 治療の既治療例(48.4%、182 例中 88 例)であり、そのほとんどがウイルス 学的再燃/ブレークスルー(76.1%、88 例中 67 例)又は無効(23.9%、88 例中 21 例])による治 療不成功であった(GS-US-334-0153 試験、CTD 5.3.5.1.4、15.1 項、Table 4.3)。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者の 84.1%(182 例中 153 例)がSVR12 を達成した(GS-US-334-0153 試験、CTD 5.3.5.1.4、15.1 項、Table 8.3)。SVR12 を 達成しなかった29 例(15.9%)のうち 24 例が再燃、3 例が投与中のウイルス学的治療不成功(2 例が有効性の欠如による早期中止、1 例が追跡不能)、2 例が SVR12 評価不能(1 例が同意撤回、 1 例が有害事象による治験薬投与中止)であった(GS-US-334-0153 試験、CTD 5.3.5.1.4、9.2.1 項 及び15.1 項、Table 11.3)。被験者は2 例であった(GS-US-334-0153 試験、CTD 5.3.5.1.4、9.2.2 項)。 4.2.3.2 GS-US-334-0153(BOSON)試験:ウイルス学的治療不成功例における HCV シ ークエンス解析 SOF+RBV 24 週間投与群のジェノタイプ 3 の HCV 感染被験者 182 例のうち 27 例が、投与終了 後12 週時点までにウイルス学的治療不成功となり、2 例が投与終了後 24 週時点でウイルス学的 治療不成功となった。これら29 例中 26 例が再燃、3 例が投与中のウイルス学的治療不成功であ った。 上記29 例中 28 例(再燃 26 例、投与中のウイルス学的治療不成功 2 例)では投与開始前の完全 なNS5B 塩基配列が得られたが、残る 1 例では、ウイルス学的治療不成功となった時点での HCV RNA 量が 1000 IU/mL 未満であったため、シークエンス解析を実施しなかった。投与終了後 12 週 時点までにウイルス学的治療不成功となった27 例中 25 例及び投与終了後 24 週時点で再燃が認め られた2 例中 2 例において投与終了後の NS5B 塩基配列が得られた。 投与開始前のNS5B NI TEV が 28 例中 1 例(3.6%)に認められた(V321A 変異、総ウイルス中 の3.8%)。しかし、当該被験者では、投与終了後の NS5B 断片のポピュレーションシークエンス 解析において、ウイルス学的治療不成功となった時点でV321A 変異は検出されず、ディープシー クエンス解析は失敗し結果は得られなかった。 投与終了後12 週時点までにウイルス学的治療不成功となった 27 例では、投与終了後の NS5B NI TEV が 24%(25 例中 6 例)で認められ、その内訳は L159F 変異が 4 例(各被験者の総ウイルス 中の1.2%、1.4%、48.6%及び 99%超)、V321A 変異が 2 例(各被験者の総ウイルス中の 2.5%及び 35.1%)であった(表 3)。 投与終了後24 週時点で再燃が認められた 2 例のうち 1 例(被験者番号:2493-11197)において NS5B NI TEV L159F 変異が 99%超検出された。
表 3 GS-US-334-0153(BOSON)試験:SOF+RBV を 24 週間併用投与され、NS5B NI TEV が検出されたジェノタイプ3 の HCV 感染被験者一覧
Subject ID Subtype HCV Treatment Group
NS5B NI TEVs (1% cutoff) Pretreatment Posttreatment 2493-11197 3a SOF+RBV 24 Weeks None L159F (> 99%) 3312-11436 3a SOF+RBV 24 Weeks None L159F (> 99%) 5283-11372 3a SOF+RBV 24 Weeks None L159F (1.2%) 8665-11256 3a SOF+RBV 24 Weeks None L159F (1.4%) 2029-11573 3a SOF+RBV 24 Weeks None L159F (48.6%) 5283-11225 3a SOF+RBV 24 Weeks V321A (3.8%) N/A 5665-11002a 3a SOF+RBV 24 Weeks None V321A (2.5%)
4001-11117 3a SOF+RBV 24 Weeks None V321A (35.1%)
N/A = not applicable; TEV = treatment-emergent variant a Subject experienced on-treatment virologic failure. Source: GS-US-334-0153, Appendix 16.2, Virology Listings 1 and 2
4.2.3.3 GS-US-334-0153(BOSON)試験:結論 ジェノタイプ3 の HCV 感染被験者において S282T 変異の出現は認められなかった。HCV NS5B TEV の L159F 及び V321A が 1%以上検出された被験者は、投与終了後 24 週時点までにウイルス 学的治療不成功例で塩基配列データが得られた被験者のそれぞれ 27 例中 7 例(25.9%)及び 27 例中2 例(7.4%)であったが、これらの変異と表現型の薬剤耐性との関連は認められなかった。
4.2.4
GS-US-334-0123(PHOTON-1)試験
4.2.4.1 試験デザイン、ベースライン特性及びウイルス学的応答 GS-US-334-0123(PHOTON-1)試験は、第 3 相、非盲検、多施設共同試験であり、未治療及び 既治療のジェノタイプ1、2 又は 3 の慢性 HCV 及び HIV-1 の重複感染患者を対象に SOF+RBV を 併用投与したときの安全性、忍容性及び有効性(抗ウイルス効果)を評価した。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者 17 例全例が HCV 治療 の既治療例であり、そのほとんどはウイルス学的再燃/ブレークスルー(64.7%、17 例中 11 例) 又は無効(17.6%、17 例中 3 例)による治療不成功であった(GS-US-334-0123 試験、CTD 5.3.5.1.1、 15.1 項、Table 2)。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者の 94.1%(17 例中 16 例)がSVR12 を達成した。SVR12 を達成しなかった 1 例(5.9%、17 例中 1 例)で再燃が認めら れた(GS-US-334-0123 試験、CTD 5.3.5.1.1、15.1 項、Table 5)。 SVR12 を達成したジェノタイプ 3 の HCV 感染被験者 1 例において、投与終了後 24 週時点で再 燃が認められた(GS-US-334-0123 試験、CTD 5.3.5.1.1、9.2.2 項、Appendix 16.2、Listing 9)。4.2.4.2 GS-US-334-0123(PHOTON-1)試験:ウイルス学的治療不成功例における HCV シークエンス解析 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者 1 例(被験者番号 0031-8718)において投与終了後 12 週時点で再燃が認められた。当該被験者において、ベースラ イン時及び投与終了後にHCV の NS5B NI TEV は検出されなかった。 投与終了後24 週時点で再燃が認められた被験者(被験者番号:0057-8734)では NS5B NI TEV は検出されなかった。 4.2.4.3 GS-US-334-0123(PHOTON-1)試験:結論 再燃が認められた被験者においてNS5B NI TEV は検出されなかった。
4.2.5
GS-US-334-0124(PHOTON-2)試験
4.2.5.1 試験デザイン、ベースライン特性及びウイルス学的応答 GS-US-334-0124(PHOTON-2)試験は、第 3 相、非盲検、多施設共同試験であり、未治療及び 既治療のジェノタイプ1、2、3 又は 4 の慢性 HCV 及び HIV-1 の重複感染患者を対象に SOF+RBV を併用投与したときの安全性、忍容性及び有効性(抗ウイルス効果)を評価した。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者 106 例の約半数(46.2%、 106 例中 49 例)が HCV 治療の既治療例であり、そのほとんどはウイルス学的再燃/ブレークス ルー(51.0%、49 例中 25 例)又は無効(26.5%、49 例中 13 例)による治療不成功であった (GS-US-334-0124 試験、CTD 5.3.5.1.2、15.1 項、Table 2)。 SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者の 88.7%(106 例中 94 例)がSVR12 を達成した(GS-US-334-0124 試験、CTD 5.3.5.1.2、15.1 項、Table 6)。SVR12 を達 成しなかった12 例(11.3%、106 例中 12 例)のうち 10 例が再燃、1 例が投与開始 50 日後の同意 撤回、1 例が投与中のウイルス学的治療不成功(有効性の欠如による治験薬投与中止)であった (GS-US-334-0124 試験、CTD 5.3.5.1.2、9.2.1 項)。 SVR12 を達成したジェノタイプ 3 の HCV 感染被験者 1 例において、投与終了後 24 週時点で再 燃が認められた(GS-US-334-0124 試験、CTD 5.3.5.1.2、Appendix 16.2、Listing 9)。それ以降の評価時点では検出されなかった。残りの 1 例では再燃時に TEV の L159F 変異(99% 超)が検出された。全体的に、これら3 例中 2 例における TEV の L159F 変異は低レベルであっ た(総ウイルスの1~5%)。ジェノタイプ 3a レプリコンでは、L159F 単一部位特異的変異による SOF に対する EC50値の変化は野生型の1.2 倍であった。 投与終了後 24 週時点で再燃が認められた被験者(被験者番号:0369-1780)では、ウイルス学 的治療不成功となった時点でのHCV NS5B のシークエンス解析が失敗し結果は得られなかった。 表 4 GS-US-334-0124(PHOTON-2)試験:SOF+RBV を 24 週間併用投与され、ウイルス学 的治療不成功となった時点でNS5B NI TEV が検出されたジェノタイプ 3 の HCV 感染被験者一覧
Subject ID Subtype TreatmentHCV a Visit Visit Date HCV RNA (IU/mL)
Deep Sequencing: NS5B NI TEVs
(% Variant) 7750-1687 3a SOF+RBV
24 Weeks Week 1 Week 1 26 April 2013 03 May 2013 4460 1700 None N/A Week 4 17 May 2013 1760 L159F (5%); S282N
(3.41%); V321A (2.44%) FU-4 02 August 2013 382,000 None FU-12 27 September 2013 304,000 None 7714-1727 3a SOF+RBV
24 Weeks Week 4 Week 8 10 June 2013 12 July 2013 13,500 27,100 L159F (2.21%) None Week
12 12 August 2013 1,380,000 None ET 02 September 2013 843,000 None 2746-1781 3a SOF+RBV
24 Weeks FU-4 02 January 2014 208,000 L159F (> 99%)
ET = early termination; N/A = not applicable; TEV = treatment-emergent variants a All 3 subjects were treatment-experienced.
Source: GS-US-334-0124, Appendix 16.2, Virology Listings 1 and 2
4.2.5.3 GS-US-334-0124(PHOTON-2)試験:結論 HCV の NS5B 領域に L159F 及び V321A 変異が総ウイルスの 1%以上で検出された被験者は、ウ イルス学的治療不成功例のうち、それぞれ11 例中 3 例(27.3%)及び 11 例中 1 例(9.1%)であ った。
4.2.6
全体的要約及び結論
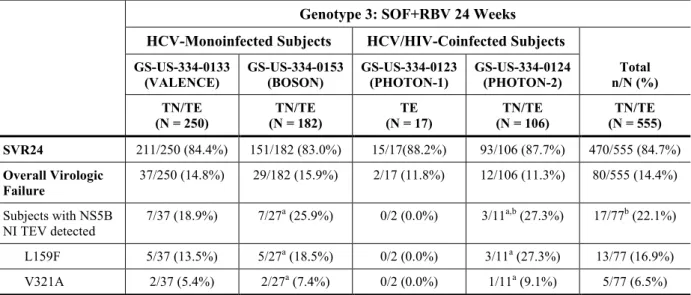
上記4 試験を通して、HCV の NS5B NI TEV(L159F 及び V321A 変異)が総ウイルスの 1%以上 で認められた被験者は、投与終了後24 週時点までにウイルス学的治療不成功となり、かつ、NS5B 塩基配列が得られた被験者の22.1%(77 例中 17 例)及び投与された全被験者の 3.1%(555 例中 17 例)であった。また、上述のウイルス学的治療不成功となり、かつ、NS5B 塩基配列が得られ た被験者において、L159F 及び V321A 変異はそれぞれ 16.9%(77 例中 13 例)及び 6.5%(77 例 5 例)で出現した(表 5)。これらの NS5B 変異により in vitro での SOF の感受性に顕著な変化はみられなかった。臨床試験4 試験を通して NS5B 領域に S282T 変異が出現した被験者はいなか った。
表 5 GS-US-334-0133 試験、GS-US-334-0153 試験、GS-US-334-0123 試験及び GS-US-334-0124 試験:SOF+RBV を 24 週間併用投与されたジェノタイプ 3 の HCV 感染被験者
‐投与終了後24 週時までに NS5B NI TEV が検出された被験者数(最大の解析対象集団) Genotype 3: SOF+RBV 24 Weeks
HCV-Monoinfected Subjects HCV/HIV-Coinfected Subjects
Total n/N (%) GS-US-334-0133
(VALENCE) GS-US-334-0153 (BOSON) GS-US-334-0123 (PHOTON-1) GS-US-334-0124 (PHOTON-2) TN/TE
(N = 250) (N = 182) TN/TE (N = 17) TE (N = 106) TN/TE (N = 555) TN/TE SVR24 211/250 (84.4%) 151/182 (83.0%) 15/17(88.2%) 93/106 (87.7%) 470/555 (84.7%) Overall Virologic Failure 37/250 (14.8%) 29/182 (15.9%) 2/17 (11.8%) 12/106 (11.3%) 80/555 (14.4%) Subjects with NS5B NI TEV detected 7/37 (18.9%) 7/27 a (25.9%) 0/2 (0.0%) 3/11a,b (27.3%) 17/77b (22.1%) L159F 5/37 (13.5%) 5/27a (18.5%) 0/2 (0.0%) 3/11a (27.3%) 13/77 (16.9%) V321A 2/37 (5.4%) 2/27a (7.4%) 0/2 (0.0%) 1/11a (9.1%) 5/77 (6.5%)
NI = nucleoside inhibitor; NS5B = nonstructural protein 5B; TE = treatment experienced; TN = treatment naive
a NS5B sequencing was unsuccessful in 2 subjects from BOSON and 1 subject from PHOTON-2 at the time of virologic failure.
b One subject (Subject 7750-1687) from PHOTON-2 had both L159F and V321A detected; this subject is counted only once in the total number of subjects with NS5B NI TEVs detected.
5
参考文献
1 AASLD-IDSA. Recommendations for testing, managing, and treating hepatitis C. Updated 25 April 2016. Available at: http://www.hcvguidelines.org/ Accessed: 21 June, 2016.
2 Benhamou Y, Bochet M, Di Martino V, Charlotte F, Azria F, Coutellier A, et al. Liver fibrosis progression in human immunodeficiency virus and hepatitis C virus coinfected patients. The Multivirc Group. Hepatology 1999;30 (4):1054-8.
3 Centers for Disease Control and Prevention. National Hepatitis C Prevention Strategy - A Comprehensive Strategy for the Prevention and Control of Hepatitis C Virus Infection and its Consequences. 2001.
4 Chung H, Ueda T, Kudo M. Changing trends in hepatitis C infection over the past 50 years in Japan. Intervirology 2010;53 (1):39-43.
5 EASL. Recommendations on Treatment of Hepatitis C 2015. J Hepatol 2015;63 (1):199-236.
6 Foster GR, Pianko S, Brown A, Forton D, Nahass RG, George J, et al. Efficacy of Sofosbuvir Plus Ribavirin With or Without Peginterferon-Alfa in Patients With Hepatitis C Virus Genotype 3 Infection and Treatment-Experienced Patients With Cirrhosis and Hepatitis C Virus Genotype 2 Infection. Gastroenterology 2015;149 (6):1462-70.
7 Fujimura Y, Ishimoto S, Shimoyama T, Narita N, Kuze Y, Yoshioka A, et al. Genotypes and multiple infections with hepatitis C virus in patients with haemophilia A in Japan. J Viral Hepat 1996;3 (2):79-84.
8 Hayashi K, Fukuda Y, Nakano I, Katano Y, Toyoda H, Yokozaki S, et al. Hepatitis C virus genotypes in hemphiliacs with chronic hepatitic C [Japanese]. Liver 2002;43 (1):11-7.
9 Hayashi K, Fukuda Y, Nakano I, Katano Y, Toyoda H, Yokozaki S, et al. Prevalence and characterization of hepatitis C virus genotype 4 in Japanese hepatitis C carriers. Hepatol Res 2003;25 (4):409-14.
10 Hoofnagle JH, Seeff LB. Peginterferon and ribavirin for chronic hepatitis C. N Engl J Med 2006;355 (23):2444-51.
11 Ikeda K, Chayama K, Saitoh S, Koida I, Suzuki Y, Tsubota A, et al. Hepatitis C virus subtype 3b infection in a hospital in Japan: epidemiological study. J Gastroenterol 1996;31 (6):801-5.
12 Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med 2001;345 (1):41-52.
13 Ministry of Health, Labour and Welfare. Guideline for co-infected patients with HIV-HCV. March, 2005.
14 Molina JM, Orkin C, Iser DM, Zamora FX, Nelson M, Stephan C, et al. Sofosbuvir plus ribavirin for treatment of hepatitis C virus in patients co-infected with HIV (PHOTON-2): a multicentre, open-label, non-randomised, phase 3 study. Lancet 2015;385 (9973):1098-106.
15 Sulkowski MS, Naggie S, Lalezari J, Fessel WJ, Mounzer K, Shuhart M, et al. Sofosbuvir and Ribavirin for Hepatitis C in Patients With HIV Coinfection. JAMA 2014;312 (4):353-61.
16 Taki M. Japanese Foundation for AIDS Prevention: Report of National Survey on Coagulation Disorder. March, 2015.
17 Tanaka J. Trends in Hepatitis virus carrier at [Japanese]. 12th Council for Promotion of Hepatitis Measures 2014.
18 World Health Organization (WHO). Hepatitis C Fact sheet N°164. Available at: http://www.who.int/mediacentre/factsheets/fs164/en/print.html. Accessed: 25 May, 2007. 2000.
19 Yotsuyanagi H, Kikuchi Y, Tsukada K, Nishida K, Kato M, Sakai H, et al. Chronic hepatitis C in patients co-infected with human immunodeficiency virus in Japan: a retrospective multicenter analysis. Hepatol Res 2009;39 (7):657-63.
20 Zeuzem S, Dusheiko GM, Salupere R, Mangia A, Flisiak R, Hyland RH, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N Engl J Med 2014;370 (21):1993-2001.
6
付録
Appendix Number Appendix Title
6.1 臨床薬理試験の概要
6.1
臨床薬理試験の概要
ソホスブビル
第
2 部 CTD の概要
2.7 臨床概要
目次
頁 略号一覧表 ... 4 1 背景および概観 ... 6 1.1 背景 ... 6 1.2 臨床的有効性の概観 ... 7 1.3 有効性評価項目 ... 9 2 個々の試験結果の要約 ... 10 2.1 GS-US-334-0133(VALENCE)試験 ... 10 2.2 GS-US-334-0153(BOSON)試験 ... 12 2.3 GS-US-334-0123(PHOTON-1)試験 ... 14 2.4 GS-US-334-0124(PHOTON-2)試験 ... 16 3 全試験を通しての結果の比較と解析 ... 18 3.1 試験対象集団 ... 18 3.1.1 被験者の内訳 ... 18 3.1.2 人口統計学的特性及びベースラインの疾患特性 ... 19 3.1.3 治験薬への曝露期間 ... 23 3.2 全有効性試験の結果の比較検討 ... 24 3.2.1 有効性の結果 ... 24 3.2.1.1 SVR12 ... 25 3.2.1.2 ウイルス学的転帰 ... 25 3.2.1.3 SVR4 及び SVR24 ... 27 3.2.1.4 SOF+RBV 投与期間中の HCV RNA 量 ... 27 3.2.1.4.1 治験薬投与期間中にHCV RNA 量が定量下限未満となった被験者 の割合(来院別) ... 27 3.2.1.4.2 投与開始後8 週までの HCV RNA 量及びベースラインからの変化 量 ... 29 3.2.2 耐性解析 ... 32 3.3 部分集団における結果の比較 ... 32 3.3.1 サブグループ解析方法 ... 32 3.3.2 海外第3 相臨床試験の部分集団での試験結果の比較 ... 32 4 推奨用法・用量に関する臨床情報の解析 ... 35 4.1 用量の選択 ... 35 4.2 用法・用量の根拠 ... 35 5 効果の持続、耐薬性 ... 37 6 参考文献 ... 38 7 付録 ... 40 7.1 有効性評価での臨床試験の概要 ... 41 7.2 有効性追加解析 ... 45表目次
頁 表 1 臨床的有効性の概要に含めた有効性の根拠となる臨床試験 ... 8 表 2 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
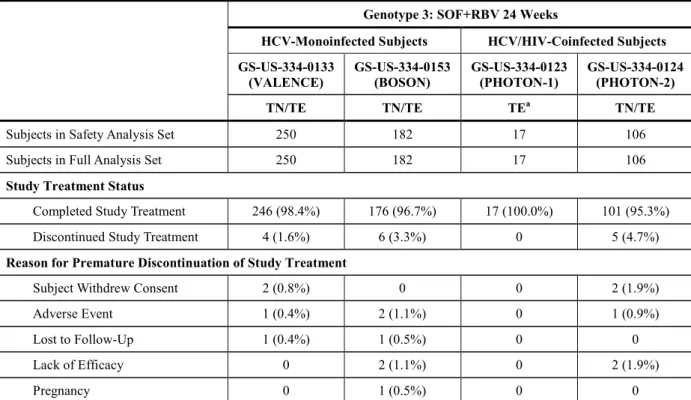
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者の内訳(スクリーニングされた被験者) ... 19 表 3 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
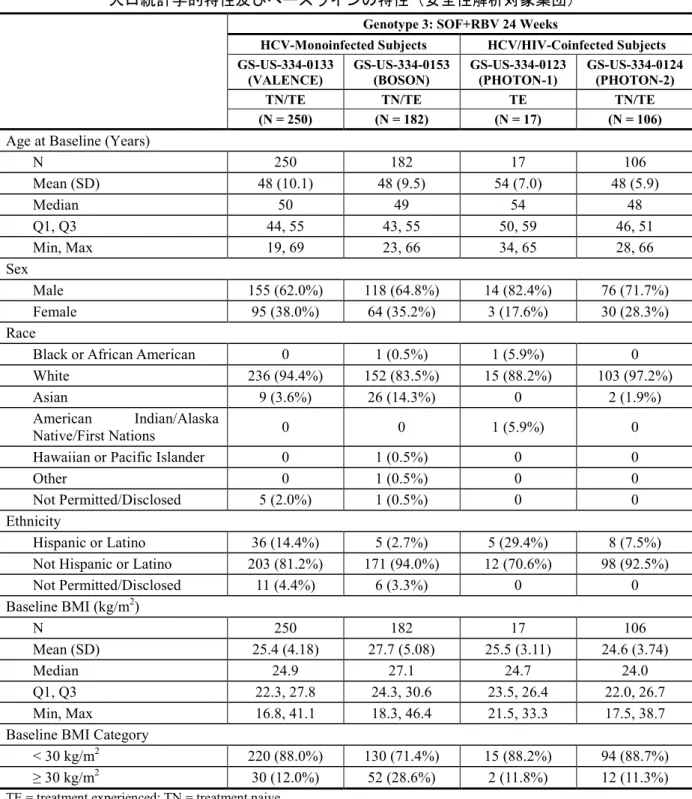
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者の人口統計学的特性及びベースラインの特性(安全性解析対象集団) ... 20 表 4 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
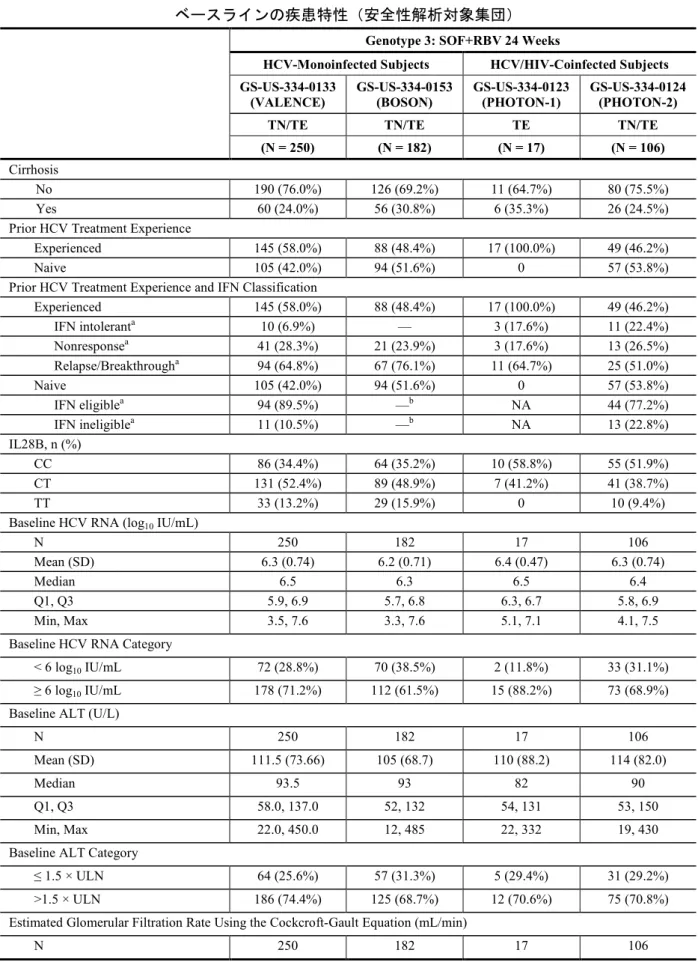
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者のベースラインの疾患特性(安全性解析対象集団) ... 22 表 5 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
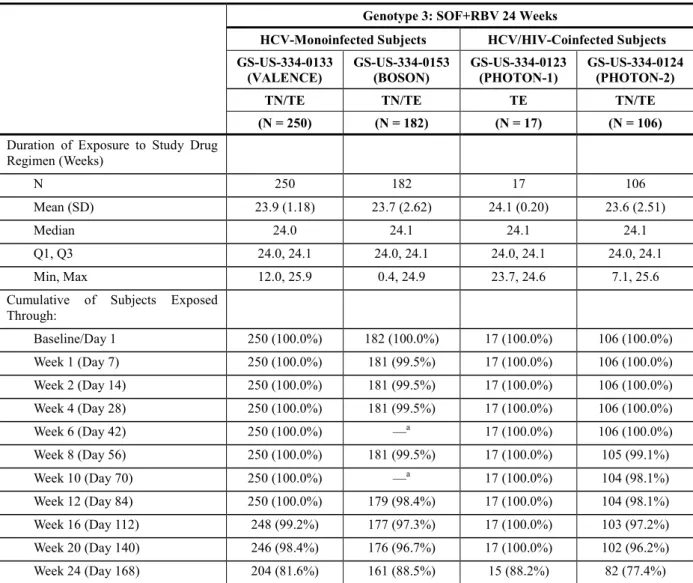
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者での治験薬への曝露期間(安全性解析対象集団) ... 24 表 6 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者でのSVR12(最大の解析対象集団) ... 25 表 7 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者での投与終了後12 週までのウイルス学的転帰(最大の解析対象集団) ... 26 表 8 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者でのSVR4 率、SVR12 率及び SVR24 率(最大の解析対象集団) ... 27 表 9 GS-US-334-0133 試 験 、 GS-US-334-0153 試 験 、 GS-US-334-0123 試 験 及 び
GS-US-334-0124 試験:24 週間の SOF+RBV 投与を受けたジェノタイプ 3 の HCV 感 染被験者でのHCV RNA 量が定量下限未満となった被験者の割合(投与期間中の来 院別)(最大の解析対象集団) ... 28
略号一覧表
略号 英語 日本語
AASLD American Association for the Study of Liver
Diseases
米国肝臓病学会
ALT alanine aminotransferase アラニンアミノトランスフ
ェラーゼ
ARV antiretroviral 抗レトロウイルス
BID twice daily 1 日 2 回
BMI body mass index 体格指数
CD cluster determinant 白血球分化抗原
CI confidence interval 信頼区間
CSR clinical study report 治験総括報告書
EASL European Association for the Study of the Liver 欧州肝臓学会
Emax maximum (pharmacodynamic) effect -
GT genotype ジェノタイプ
HCV hepatitis C virus C 型肝炎ウイルス
HIV human immunodeficiency virus ヒト免疫不全ウイルス
IDSA Infectious Diseases Society of America 米国感染症学会
IFN interferon インターフェロン
IL28B IL28B gene IL28B 遺伝子
LLOQ lower limit of quantitation 定量下限値
N or n number of subjects in a population (N) or subset
(n)
被験者数
NA not applicable 適用せず
NS (3/4A/5A/5B) nonstructural protein (3/4A/5A/5B) 非構造蛋白(3/4A/5A/5B)
Peg-IFN pegylated interferon ペグインターフェロン
PK pharmacokinetic(s) 薬物動態
Q1, Q3 first quartile, third quartile 第1 四分位数、第 3 四分位数
RAV resistance-associated variant 耐性関連変異
RBV ribavirin リバビリン
RNA ribonucleic acid リボ核酸
SAP statistical analysis plan 統計解析計画
SD standard deviation 標準偏差
SOF sofosbuvir (Sovaldi®, GS-7977) ソホスブビル(ソバルディ®
錠、GS-7977)
SVR, SVRxx sustained virologic response, sustained virologic
response at “xx” weeks following completion of all treatment
持続的ウイルス陰性化、投与
終了後XX 週での持続的ウイ
ルス陰性化
略号 英語 日本語
TN treatment naive 未治療の、前治療のない
TND target not detected 検出せず
ULN upper limit of the normal range 基準値上限
1
背景および概観
1.1
背景
C 型肝炎ウイルス(HCV)はフラビウイルス科に属する一本鎖 RNA ウイルスであり、主に血 液や血液製剤を介して感染する 5。HCV の複製は主に肝細胞で行われ、肝細胞が HCV 感染に対 する免疫を介した生体応答の標的となる 16。免疫系及びウイルスによる持続的な肝細胞の損傷の 結果、感染から20~30 年かけて進行性の肝疾患に至る14, 28。HCV は遺伝的多様性を有し、6 種 類のジェノタイプ(ジェノタイプ1~6)に大別され、各ジェノタイプはさらにサブタイプ(a、b、 c 等)に細分されるが、それらジェノタイプ及びサブタイプにより、インターフェロン(IFN)ベ ースの治療に対する反応性が異なることが示されている。日本国内では主にジェノタイプ1 及び 2 の HCV 感染者が多く、慢性期感染症ではそれぞれ約 70%及び 30%を占める6。しかし、国内で ジェノタイプ1 及び 2 以外の HCV ジェノタイプも一部確認されており、そのうち、ジェノタイ プ3 は輸入血液製剤を介した感染13, 20, 15, 29, 11、ジェノタイプ4、5 又は 6 は主に海外での感染歴等 によるものとされる。 国内でのジェノタイプ3 の慢性 HCV 感染者数は公表文献から約 2,800 人と推定される29, 11, 12, 25, 15, 26。ジェノタイプ3 の HCV 感染は主に輸入血液製剤の使用歴のある血液凝固異常の患者でみら れ、それゆえ、これらの患者は高い割合でヒト免疫不全ウイルス(HIV)に重複感染している。 HIV 重複感染患者では HCV 感染に続発する肝線維化及び肝硬変への進行がさらに早まること が報告されており 4、肝線維化及び肝硬変が進行した患者では肝の非代償性や肝細胞癌へとさら に進展するリスクが高くなる。現在、国内では、C 型非代償性肝硬変患者に対して承認された治 療法はなく、肝細胞癌による年間死亡者数約20,000 人のうち 75%が HCV 感染症に由来するもの である。したがって、重度肝疾患への進行リスクの高いこれらHCV/HIV 重複感染患者では特に、 HCV 感染による疾病負担の軽減に寄与する安全かつ有効な抗 HCV 治療薬に対する喫緊のアンメ ットメディカルニーズが存在する。 現在、国内におけるジェノタイプ 3 の HCV 感染症に対する治療選択肢はペグインターフェロ ン(Peg-IFN)+リバビリン(RBV)の 24 週間併用投与のみであるが、その持続的ウイルス陰性 化(SVR)率は十分ではなく、約 80%と報告されている。また、投与禁忌又は忍容性の問題によ り、本治療法を受けることができない患者も多く存在する。日本国内のこれら患者集団に対する 安全かつ有効なIFN フリーの治療法が早急に必要とされている。 米国及び欧州連合等の海外諸国では、ジェノタイプ 3 の慢性 HCV 感染症に対する治療法が既 に承認されており、ソバルディ錠®(ソホスブビル[SOF]、GS-7977)と RBV の 24 週間併用投 与も治療選択肢に含まれる。この投与レジメンは米国肝臓病学会/米国感染症学会(AASLD/IDSA) 及び欧州肝臓学会(EASL)の HCV 治療ガイドラインでも推奨されている1, 8。SOF の添付文書及 びガイドラインでのジェノタイプ3 の慢性 HCV 感染症に対する推奨内容は、海外で実施された 4 つの第3 相試験成績に基づいている。これらの 4 つの第 3 相試験でジェノタイプ 3 の慢性 HCV 感染患者にSOF+RBV を 24 週間併用投与したときの SVR 率は 84%~94%であり、一貫して高い 有効性、並びに良好な安全性及び忍容性プロファイルが認められている30, 24, 21, 10。 本文書は、本邦でのSOF のジェノタイプ 3 の慢性 HCV 感染症に対する効能追加のための承認事項一部変更承認申請を裏付ける資料として提出するもので、ジェノタイプ3 の成人 C 型慢性肝 炎又はC 型代償性肝硬変に対する SOF+RBV の 24 週間併用療法が検討された 4 つの海外臨床試 験の臨床的有効性の概要を示す。