目次
略号一覧 ... 4 2.6.4 薬物動態試験の概要文 ... 5 2.6.4.1 まとめ ... 5 2.6.4.2 分析法 ... 5 2.6.4.3 吸収 ... 10 2.6.4.4 分布 ... 31 2.6.4.5 代謝(動物間の比較) ... 31 2.6.4.6 排泄 ... 31 2.6.4.7 薬物動態学的薬物相互作用 ... 31 2.6.4.8 その他の薬物動態試験 ... 31 2.6.4.9 考察及び結論 ... 31 2.6.4.10 図表 ... 32 参考文献一覧 ... 32表
表 2.6.4-1 Summary of validation data for FVIII activity by chromogenic method in E17 FVIII ko mouse, rat and cynomplgus plasma samples in study RD_VB_040901 ... 7表 2.6.4-2 Summary of validation data for rFVIII-bound PEG by ELISA method in E17 FVIII ko mouse, rat and cynomplgus plasma samples in studies RD_PPD_070902, RD_PPD_011001 and RD_PPD_070901, respectively ... 8
表 2.6.4-3 Summary of validation data for FVIII antigen by ELISA method in rat plasma sample in study RD_VB_041003 ... 9
表 2.6.4-4 The FVIII activity dose-adjusted AUC0-tlast, MRT and t1/2terminal of the mouse study PV2460907 ... 10
表 2.6.4-5 The FVIII antigen dose-adjusted AUC0-tlast, MRT and t1/2terminal of the rat study PV2440905 ... 12
表 2.6.4-6 The rFVIII-bound PEG dose-adjusted AUC0-tlast, MRT and t1/2terminal of the rat study PV2440905 ... 13
表 2.6.4-7 Dose levels and schedule of the escalating dose / PK phase of the cynomolgus monkey study 1933-017 ... 14
表 2.6.4-8 The FVIII activity AUC0-tlast, MRT and t1/2terminal of the cynomolgus monkey study 1933-017 ... 15
表 2.6.4-9 AUC0-tlast and dose proportionality for the PK phase of the cynomolgus monkey study 1933-017 ... 16
表 2.6.4-11 Average concentrations of radioactivity in blood and plasma from rats (Study
8201148, Group 2) ... 19 表 2.6.4-12 PK parameters for radioactivity in blood and plasma from rats (Study 8201148, Group
2) ... 19 表 2.6.4-13 Average blood:plasma concentration ratios of radioactivity in blood and plasma from
rats (Study 8201148, Group 2) ... 20 表 2.6.4-14 Average concentrations of radioactivity in blood, plasma and tissues from rats (Study
8201148, Group 2) ... 21 表 2.6.4-15 Average percent and average concentration of radioactivity for [3H] PEG-rFVIII
( ) and metabolites in plasma samples from rats (Study 8201148, Group 2) ... 25 表 2.6.4-16 Mean percent of sample radioactivity and mean percent of radioactive dose for
metabolites in 0- to 576-hour pooled urine from rats (Study 8201148, Group 1) ... 26 表 2.6.4-17 Mean percent of sample radioactivity and mean percent of radioactive dose for
metabolites in 0- to 504 (male)/408 (female)-hour pooled feces from rats (Study 8201148,
Group 1)... 26 表 2.6.4-18 Percent and concentration of radioactivity for [3H] PEG-rFVIII
( ) and metabolites in kidney from rats (Study 8201148, Group 2) ... 27 表 2.6.4-19 Percent and concentration of radioactivity for [3H] PEG-rFVIII
( ) and metabolites in liver from rats (Study 8201148, Group 2) ... 28 表 2.6.4-20 Percent and concentration of radioactivity for [3H] PEG-rFVIII
( ) and metabolites in lung from rats (Study 8201148, Group 2) ... 29 表 2.6.4-21 Mean percent of radioactive dose in urine, feces, cage rinse, cage wash and cage wipe
from rats (Study 8201148, Group 1)... 29
図
図 2.6.4-1 Whole-body autoradiograph for female animal at 168 hours (Study 8201148, Group 3) ... 23 図 2.6.4-2 Excretion data of male and female rats (Study 8201148, Group 1) ... 30
略号一覧
略号 英語 日本語
ADME absorption, distribution, metabolism and
excretion 吸収,分布,代謝及び排泄
AUC area under the curve 曲線下面積
AUC0- ∞ area under the curve from 0 to infinity 時間0 から無限大時間までの曲線下面積
AUC0-tlast area under the curve from 0 to the last
quantifiable sampling time point 時間の曲線下面積0 から測定可能な最終採血時点まで
C0 initial concentration 初期濃度
CHO cells Chinese hamster ovary cells チャイニーズハムスター卵巣細胞
CI confidence interval 信頼区間
CL clearance クリアランス
Cmax maximum concentration 最高濃度
ELISA enzyme-linked immunosorbent assay 酵素標識免疫吸着測定法
Eq equivalent 当量
FVIII factor VIII 血液凝固第VIII 因子
FIXa activated factor IX 活性型血液凝固第IX 因子
FX factor X 血液凝固第X 因子
FXa activated factor X 活性型血液凝固第X 因子
GLP Good Laboratory Practice 医薬品の安全性に関する非臨床試験の実
施の基準
HPLC high-performance liquid chromatography 高速液体クロマトグラフィー ICH International Conference on Harmonisation 日米EU 医薬品規制調和国際会議
IU international unit 国際単位
IVR in vivo recovery 生体内回収率
ko knock out ノックアウト
LLOQ lower limit of quantification 定量下限
MRT mean residence time 平均滞留時間
NOAEL no observed adverse effect level 無毒性量
PEG polyethylene glycol ポリエチレングリコール
PK pharmacokinetic 薬物動態
rFVIII recombinant factor VIII 遺伝子組換え型ヒト血液凝固第VIII 因子
SD standard deviation 標準偏差
t1/2 half-life 半減期
t1/2terminal terminal half-life 終末相半減期
Tmax maximum drug concentration time 最高血中濃度到達時間
Vss volume of distribution at steady state 定常状態の分布容積
2.6.4
薬物動態試験の概要文
2.6.4.1
まとめ
本項では,3 種類の in vitro 分析法のバリデーション結果及び 4 種類の in vivo モデルにおける BAX 855(以下,「本剤」)の薬物動態試験成績をまとめる. マウス,ラット及びサル血漿試料のFVIII 活性,マウス,ラット及びサル血漿試料の PEG-rFVIII 抗原,並びにラット血漿試料のFVIII 抗原について測定法のバリデーション試験を実施した. 本剤の薬物動態プロファイルをE17 FVIII ko マウス,並びに正常ラット及びカニクイザルにお いて評価した.ラットでは放射性標識した本剤のADME に関する更なる情報が得られた. E17 FVIII ko マウス(エクソン 17 ノックアウトマウス, 系統, )は,ヒト患者 集団を適切に反映するモデルであるため選択した.本マウスでは,エクソン17 の にネオマイ シンカセットが挿入されており,これはエクソンスキッピングを誘導する.このエクソンの変異 は重症血友病A(FVIII の残存活性 1%未満)を引き起こす.ラットは,動物薬物動態試験及び毒 性動物試験で広く用いられているため選択した.ラットは本目的のための適切な動物種として, 規制当局により一般的に認識されている.カニクイザルは,霊長類とヒトの血液凝固系が極めて 類似しており,ヒト血液凝固たん白質の試験に関する適切な動物種であると考えられるため選択 した.これら3 種類の動物種における本剤の薬理作用は in vitro 又は in vivo 試験で示されている (2.6.2.2 項,2.6.6.2.1 項及び 2.6.6.3.2 項を参照).ラットは薬物動態試験に,カニクイザルは薬 理試験及び毒性試験にも使用した.E17 FVIII ko マウスにおいて 200 IU FVIII/kg の用量で臨床的に意義のある有効性が確認された 本剤の薬理試験成績に基づき(2.6.2.2.2 項を参照,WH0210 試験及び WH0110 試験),E17 FVIII ko マウス及びラットにおける薬物動態プロファイルを評価するため,200 IU FVIII/kg の目標用量を 選択した.カニクイザルに投与した低用量(350 IU FVIII/kg)は,活性測定において血漿中濃度が 技術的に測定可能な最低用量であった. 薬物動態試験に用いた処方(溶解後に静脈内投与する凍結乾燥製剤)は,すべての非臨床薬理 及び毒性試験に用いた処方と同一であった.本剤の特性データ(3.2.P.5.4 項を参照)から,臨床 試験用及び市販予定の本剤は構造及び機能において非臨床試験で用いた本剤と同等であることが 示されている. 放射性標識した本剤のラット試験を除く薬物動態試験は,GLP に準拠して実施した.これらの 分析結果から,本剤は単回静脈内投与後に非修飾型rFVIII(アドベイト)と比較して循環時間を 改善し,曝露時間を延長することが示された.
2.6.4.2
分析法
FVIII 活性発色測定法,PEG-rFVIII 抗原測定法及び FVIII 抗原測定法(報告書 RD_VB_040901, RD_PPD_070902,RD_PPD_011001,RD_PPD_070901 及び RD_VB_041003 を参照)を,本剤とア
法及びFVIII 抗原測定法では,非修飾型 rFVIII(アドベイト)及び PEG-rFVIII(本剤)の両方が 検出された.PEG-rFVIII 抗原の PEG 化に基づく測定法では,予想通りアドベイトは検出されなか ったが,本剤の測定可能シグナルが示された. 2.6.4.2.1 FVIII活性発色測定法 FVIII 活性は発色測定法で測定した.試料をカルシウム含有緩衝液中でトロンビン,FIXa,リン 脂質及びFX と混合した.FVIII はトロンビンにより活性化され,リン脂質,FIXa 及びカルシウム イオンと複合体を形成した.この複合体はFX を活性化して FXa とし,発色基質である FXa-1 を 開裂した.遊離パラニトロアニリンの経時的変化をマイクロプレートリーダーを用いて405 nm で 測定した.
反応の傾きは試料中のFVIII 活性に比例した.試料中の FVIII 活性は,直近の WHO 標準品を基
準として較正した社内標準品と比較して算出した.結果はIU FVIII/mL で示した. FVIII 活性発色測定法は,血漿試料の事前の高倍率希釈が可能であるため動物血漿のマトリック ス効果を排除できることから選択した. E17 FVIII ko マウス,ラット(反復投与毒性試験 8202366 で本測定法を使用,2.6.6.3.1 項)及び カニクイザル血漿試料のFVIII 活性発色測定法のバリデーションデータを表 2.6.4-1 にまとめる. バリデーションは概して,ICH Q2(R1)ガイドライン,分析法バリデーションに関するテキスト (実施項目及び実施方法)に従って実施した.
表 2.6.4-1 Summary of validation data for FVIII activity by chromogenic method in E17 FVIII ko mouse, rat and cynomplgus plasma samples in study RD_VB_040901
Parameter Acceptance criterion E17 FVIII ko Result
mouse plasma Rat plasma monkey plasma Cynomolgus
Accuracy In vitro recovery : 80-120%
72% (0.1 IU FVIII/mL), 83-111% (0.2-10.0 IU FVIII/mL) 58% (0.5 IU FVIII/mL), 67% (1.0 IU FVIII/mL), 81% (3.0 IU FVIII/mL), 98% (10.0 IU FVIII/mL) 96-117% Intermediate precision Relative standard deviation : ≤20% 6.8-16.9% 7.7-11.4% 8.0-13.4%
Repeatability Relative standard deviation
: ≤20% 2.2-4.0% 2.9-3.6% 2.0-3.7% Linerarity (Range investigated) Coefficient of correlation : ≥0.99 0.9990 (0.1-10.0 IU FVIII/mL) 0.9985 (0.5-10.0 IU FVIII/mL) 0.9990 (1.0-16.1 IU FVIII/mL) LLOQ The lowest concentration for acceptable recovery and precision
0.2 IU FVIII/mL 3.0 IU FVIII/mL 1.0 IU FVIII/mL
Robustness Bench top stability and freeze-thaw stability 2 hours at room temperature (82-100%) and 3 freeze-thaw cycles (88-93%) 1 hour at room temperature (85-97%) and 3 freeze-thaw cycles (87-100%) 1 hour at room temperature (86-90%) and 3 freeze-thaw cycles (89-94%)
本測定法は,天然FVIII と PEG-rFVIII の活性を区別しないため,PEG-rFVIII を特異的に検出し
ない.また,本測定法は,異なる動物種のFVIII 活性も区別しないため,ラット及びカニクイザ
ルにおいて,内因性FVIII 活性が検出された.このベースライン値は,本剤の投与により加算さ
れるPEG-rFVIII の活性を算出するために,添加した血漿試料の FVIII 測定値から減じた.E17 FVIII ko マウスの血漿から FVIII 活性は検出されなかったため,本測定法は E17 FVIII ko マウス血漿に
おけるFVIII を選択的に測定できる.
以上のように,本測定法はE17 FVIII ko マウス,ラット及びカニクイザルの血漿における本剤
のFVIII 活性の測定に適切である.
2.6.4.2.2 PEG-rFVIII抗原測定法
本剤はELISA 法で測定した.簡潔に記載すると,プレート結合抗 PEG 抗体を用いて PEG 部分
を介して試料中のPEG-rFVIII を捕捉した.洗浄後,捕捉した PEG-rFVIII 量をポリクローナル抗 FVIII ペルオキシダーゼ複合体で測定した.具体的には,結合ペルオキシダーゼ活性を発色基質で
較正を行った.試料中PEG-rFVIII 抗原量は rFVIII 結合 PEG 濃度として算出した.本測定法は PEG-rFVIII を特異的に測定及び検出し,それ以外のシグナルは示さなかった.結果は ng rFVIII 結 合PEG/mL で示した.
E17 FVIII ko マウス,ラット及びカニクイザル血漿試料の ELISA 法による rFVIII 結合 PEG のバ
リデーションデータを表 2.6.4-2 にまとめる.バリデーションは概して,ICH Q2(R1)ガイドラ
イン,分析法バリデーションに関するテキスト(実施項目及び実施方法)に従って実施した.バ
リデーションで得られたデータの評価にはFindlay ら[2]が推奨する許容基準を適用した.
表 2.6.4-2 Summary of validation data for rFVIII-bound PEG by ELISA method in E17 FVIII ko mouse, rat and cynomplgus plasma samples in studies RD_PPD_070902,
RD_PPD_011001 and RD_PPD_070901, respectively Parameter Acceptance criterion
Result E17 FVIII ko mouse
plasma (RD_PPD_070902) Rat plasma (RD_PPD_011001) Cynomolgus monkey plasma (RD_PPD_070901) Accuracy Mean recovery : 80-120% (75-125% at the limit of quantification) 81.0-100.4% 87.8-100.4% 86.1-99.2% Intermediate precision Relative standard deviation : ≤20% (≤25% at the limit of quantification) 6.8-17.5% 5.6-12.5% 6.7-22.7%
Repeatability Relative standard deviation 5.0-5.7% 5.9-8.5% 3.4-8.7% Linerarity (Range investigated) Coefficient of correlation : ≥0.99 1.0000 (5-400 ng rFVIII-bound PEG/mL) 0.9999 (5-400 ng rFVIII-bound PEG/mL) 1.0000 (5-400 ng rFVIII-bound PEG/mL) Specificity No reaction with native, non-PEGylated FVIII
The E17 FVIII ko mouse plasma did not
elicit false positive signals.
The rat plasma did not elicit false positive signals.
The cynomolgus monkey plasma did
not elicit false positive signals. LLOQ The lowest concentration for acceptable recovery and precision 5 ng rFVIII-bound
PEG/mL 5 ng rFVIII-bound PEG/mL 5 ng rFVIII-bound PEG/mL
Robustness Freeze-thaw stability 4 freeze-thaw cycles (108.0%) 4 freeze-thaw cycles (89.0%) 4 freeze-thaw cycles (101.4%)
以上のように,バリデーションデータは,本測定法がE17 FVIII ko マウス,ラット及びカニク
2.6.4.2.3 FVIII抗原測定法 製剤及び血漿試料中のFVIII は,プラスチック製マイクロプレートウェルの内壁にコーティン グしたマウスモノクローナル抗ヒトFVIII 抗体で捕捉した.次に,西洋ワサビペルオキシダーゼ を結合したマウスモノクローナル抗ヒトFVIII 抗体を,捕捉した FVIII の残存する遊離抗原決定基 に結合させた.結合ペルオキシダーゼ酵素を3,3’,5,5’-テトラメチルベンジジン基質との反応に基 づいて定量した.強酸による反応停止後,発色強度は血漿試料中に予め存在するFVIII 濃度に正 比例した.結果はIU FVIII/mL で示した.既知濃度の FVIII を含む標準血漿を用いて作製した標準 曲線により測定法の較正を行った.本測定法ではモノクローナル抗ヒトFVIII 抗体を用いたため,
ヒトFVIII に選択的であり,ラット FVIII 抗原とは交差しなかった.本測定法は,抗ヒト FVIII 抗
体とカニクイザルFVIII との高い交差反応性のため,カニクイザルの血漿試料には使用できなか った. ELISA 法によるラット血漿試料中の FVIII 抗原測定のバリデーションデータを表 2.6.4-3 にまと める.バリデーションは概してICH Q2(R1)ガイドライン,分析法バリデーションに関するテキ スト(実施項目及び実施方法)に従って実施した.バリデーションで得られたデータの評価には Findlay ら[2]が推奨する許容基準を適用した.
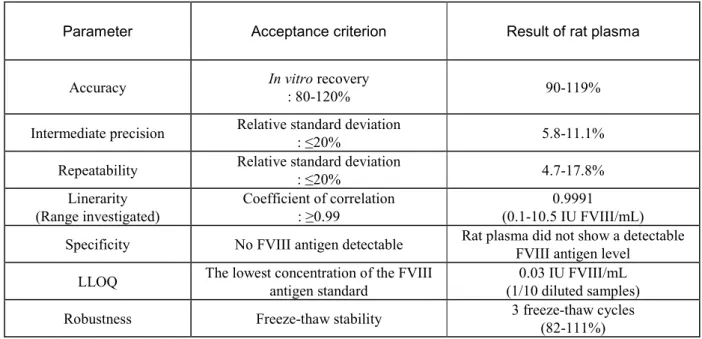
表 2.6.4-3 Summary of validation data for FVIII antigen by ELISA method in rat plasma sample in study RD_VB_041003
Parameter Acceptance criterion Result of rat plasma
Accuracy In vitro recovery : 80-120% 90-119%
Intermediate precision Relative standard deviation : ≤20% 5.8-11.1% Repeatability Relative standard deviation : ≤20% 4.7-17.8%
Linerarity
(Range investigated) Coefficient of correlation : ≥0.99 (0.1-10.5 IU FVIII/mL) 0.9991 Specificity No FVIII antigen detectable Rat plasma did not show a detectable FVIII antigen level
LLOQ The lowest concentration of the FVIII antigen standard (1/10 diluted samples) 0.03 IU FVIII/mL Robustness Freeze-thaw stability 3 freeze-thaw cycles (82-111%)
以上のように,本測定法はラット血漿における本剤のFVIII 抗原の測定に適切であることが確
2.6.4.3
吸収
本項では,E17 FVIII ko マウス,ラット及びカニクイザルにおいてアドベイトと比較した本剤の
循環時間を評価するため,主にAUC0-tlast,MRT 及び t1/2terminalについて記載する.ラット及びカニ
クイザルにおける本剤の用量比例性についてもAUC0-tlastに基づいて記載する.検討したすべての 薬物動態パラメータは表 2.6.5-3 に示す. AUC は循環血液中の薬物量に比例する代表的な指標であり,また,MRT は薬物が循環血液中 に滞留する平均時間であることから,これらはバイオアベイラビリティに関する情報が得られる 主要な薬物動態変数である.また,消失期において血漿中薬物濃度が半減するまでに要する時間 であるt1/2terminalも重要な変数である.
2.6.4.3.1 E17 FVIII koマウスにおける本剤の薬物動態(PV2460907 試験)
目的: 本試験の目的は,本剤の非臨床用2 ロット及びアドベイトの市販用 1 ロットを E17 FVIII ko マ ウスに静脈内ボーラス投与(目標表示用量200 IU FVIII/kg)し,薬物動態プロファイルを評価す ることであった.本剤2 ロットの薬物動態プロファイルに明らかな差異がなかったため,2 ロッ トの結果を統合した. 方法: 本試験はマウスを順次屠殺するデザインで実施した.被験物質又は対照物質の静脈内投与後, 10 評価時点(5 分,1,3,6,9,16,24,32,40 及び 48 時間後)においてそれぞれマウス 8 匹(雌 雄各4 匹)から心穿刺により採血した.また,ベースライン値解析のため,無処置動物 8 匹から
も採血した.すべての血漿試料についてFVIII 活性及び rFVIII 結合 PEG を分析した. 結果及び結論:
FVIII 活性について,用量補正 AUC0-tlast,MRT 及び t1/2terminalを表 2.6.4-4 に示す.
表 2.6.4-4 The FVIII activity dose-adjusted AUC0-tlast, MRT and t1/2terminal of the mouse study PV2460907
Item Nominal dose (IU FVIII/kg) n
Point estimate [95% CI] Dose-adjusted AUC0-tlast
(h·IU FVIII/mL / IU FVIII/kg)
MRT
(hours) t1/2terminal (hours)
BAX 855 200 16a 0.0797
[0.0760 to 0.0833] [7.4 to 8.4] 7.9 [5.2 to 6.3] 5.9
ADVATE 200 8b 0.0421
[0.0387 to 0.0458] [4.4 to 5.6] 4.9 [3.8 to 5.0] 4.3 a: 8 males and 8 females (The results of two lots were pooled.)
本剤群の用量補正AUC0-tlastの点推定値(h·IU FVIII/mL /IU FVIII/kg)は 0.0797 であり,アドベ イト群(0.0421)の 1.9 倍であった.本剤群の MRT の点推定値(時間)は 7.9 であり,アドベイ ト群(4.9)の 1.6 倍であった.この延長は本剤群の t1/2terminalの点推定値(時間)である5.9 にも反 映され,アドベイト群(4.3)の 1.4 倍であった.本傾向は,両投与群における他のすべての薬物 動態変数で同様であり(表 2.6.5-3 を参照),PEG 化により rFVIII の循環時間が改善することが 本モデルで示された.
また,本剤群のrFVIII 結合 PEG を分析し,比較可能なパラメータについて FVIII 活性の測定値
を確認した.FVIII 活性及び rFVIII 結合 PEG の MRT(7.9 vs. 8.0 時間),t1/2terminal(5.9 vs. 6.1 時間), CL(12.2 vs. 16.9 mL/h/kg),IVR(56.3 vs. 62.5%)及び Vss(96.1 vs. 135.2 mL/kg)はそれぞれ類 似していた(表 2.6.5-3 を参照).アドベイト投与では rFVIII 結合 PEG は検出されなかった. 以上のように,本試験から,ヒトrFVIII の PEG 化により血管内循環時間が延長し,結果として 曝露時間が増大することが示された. 2.6.4.3.2 ラットにおける本剤の薬物動態(PV2440905 試験) 目的: 本試験の目的は,本剤の非臨床用2 ロット及びアドベイトの市販用 1 ロットをラットに静脈内 ボーラス投与(目標表示用量200 IU FVIII/kg)し,薬物動態プロファイルを評価することであっ た.また,ラット毒性試験用情報を収集するため,本剤の非臨床用1 ロットのより高い 2 用量(350 及び700 IU FVIII/kg)を検討した.本剤 2 ロットの薬物動態プロファイルに明らかな差異がなか ったため,2 ロットの結果を統合した. 方法: 単一動物デザインを採用し,各群8 匹(雌雄各 4 匹)の動物を用いた.投与後,8 評価時点(5 分,並びに1,4,8,12,22,32 及び 48 時間後)で試料を採取した. 製剤中及び血漿中のFVIII 活性を測定した.ただし,本測定法では,内因性ラット FVIII と投与
したヒトrFVIII 又は PEG-rFVIII とは区別されない.ラット FVIII 活性ベースライン値との相互作
用を回避するため,ヒトFVIII に対して選択性を有しラット FVIII 抗原との交差反応を示さない
FVIII 抗原を用い,すべての血漿試料について FVIII 抗原及び rFVIII 結合 PEG を分析した.
本剤3 用量の用量比例性を以下のステップアップ法により検討した.最初に低用量と中用量の,
次に低用量と高用量の同等性を検定した.用量補正AUC0-tlastに関する幾何平均値の比の90% CI
が基準範囲内0.8~1.25[1]にある時,同等と判断した. 結果及び結論:
FVIII 抗原について,本試験で得られた用量補正 AUC0-tlast,MRT 及び t1/2terminalを表 2.6.4-5 に示
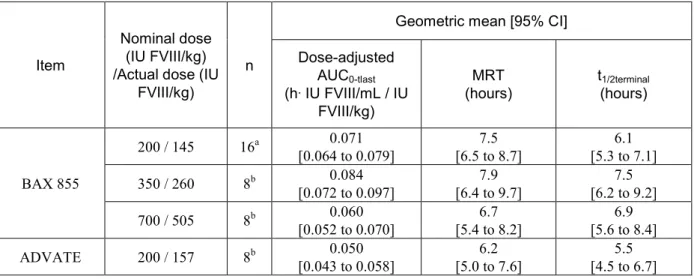
表 2.6.4-5 The FVIII antigen dose-adjusted AUC0-tlast, MRT and t1/2terminal of the rat study PV2440905
Item
Nominal dose (IU FVIII/kg) /Actual dose (IU
FVIII/kg)
n
Geometric mean [95% CI] Dose-adjusted
AUC0-tlast (h·IU FVIII/mL / IU
FVIII/kg)
MRT
(hours) t1/2terminal (hours)
BAX 855 200 / 145 16a 0.071 [0.064 to 0.079] [6.5 to 8.7] 7.5 [5.3 to 7.1] 6.1 350 / 260 8b 0.084 [0.072 to 0.097] [6.4 to 9.7] 7.9 [6.2 to 9.2] 7.5 700 / 505 8b 0.060 [0.052 to 0.070] [5.4 to 8.2] 6.7 [5.6 to 8.4] 6.9 ADVATE 200 / 157 8b 0.050 [0.043 to 0.058] [5.0 to 7.6] 6.2 [4.5 to 6.7] 5.5 a: 8 males and 8 females (The results of two lots were pooled.)
b: 4 males and 4 females
本剤の低用量群では,用量補正AUC0-tlastの幾何平均値(h·IU FVIII/mL /IU FVIII/kg)は 0.071 で あり,アドベイト群のAUC0-tlast(0.050)の 1.4 倍であった.また,MRT の幾何平均値(時間)で ある7.5 はアドベイト群(6.2)の 1.2 倍であり,t1/2terminalの幾何平均値(時間)である6.1 はアド
ベイト群(5.5)の 1.1 倍であった.本傾向は,これら投与群における他のすべての薬物動態変数
で同様であり(表 2.6.5-3 を参照),PEG 化により rFVIII の循環時間が改善することが本モデル で示された.
本剤の中用量群では,用量補正AUC0-tlastの幾何平均値(h·IU FVIII/mL /IU FVIII/kg)は 0.084 で あり,本剤の低用量群(0.071)の 1.2 倍,本剤の高用量群(0.060)の 1.4 倍であった.
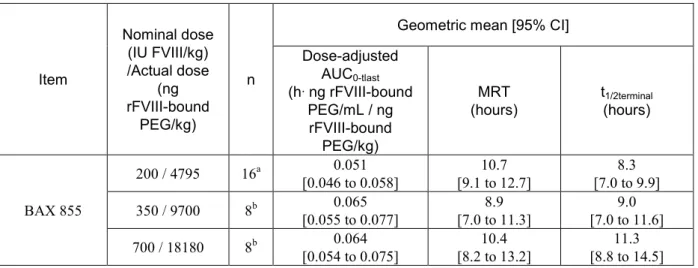
rFVIII 結合 PEG について,本試験で得られた用量補正 AUC0-tlast,MRT 及び t1/2terminalを表 2.6.4-6
表 2.6.4-6 The rFVIII-bound PEG dose-adjusted AUC0-tlast, MRT and t1/2terminal of the rat study PV2440905 Item Nominal dose (IU FVIII/kg) /Actual dose (ng rFVIII-bound PEG/kg) n
Geometric mean [95% CI] Dose-adjusted AUC0-tlast (h·ng rFVIII-bound PEG/mL / ng rFVIII-bound PEG/kg) MRT
(hours) t1/2terminal (hours)
BAX 855 200 / 4795 16a 0.051 [0.046 to 0.058] [9.1 to 12.7] 10.7 [7.0 to 9.9] 8.3 350 / 9700 8b 0.065 [0.055 to 0.077] [7.0 to 11.3] 8.9 [7.0 to 11.6] 9.0 700 / 18180 8b 0.064 [0.054 to 0.075] [8.2 to 13.2] 10.4 [8.8 to 14.5] 11.3 a: 8 males and 8 females (The results of two lots were pooled.)
b: 4 males and 4 females
本剤低用量群では,用量補正AUC0-tlastの幾何平均値(h·ng rFVIII 結合 PEG/mL /ng rFVII 結合 PEG/kg)は 0.051 であり,本剤の中用量群及び高用量群の用量補正 AUC0-tlast(それぞれ0.065 及び
0.064)の約 80%であった.
本剤の用量比例性は統計学的に検出されなかった.FVIII 抗原については,用量補正 AUC0-tlast の低用量:中用量の比は0.851(90% CI:0.732~0.989),低用量:高用量の比は 1.188(90% CI: 1.022~1.381)であり,rFVIII 結合 PEG については,用量補正 AUC0-tlastの低用量:中用量の比は
0.784(90% CI:0.664~0.926),低用量:高用量の比は 0.805(90% CI:0.681~0.951)と,0.8~ 1.25 の基準範囲[1]に基づく用量比例性は示されなかった.
本剤の低用量投与後,rFVIII 結合 PEG の薬物動態プロファイルは,FVIII 抗原の薬物動態プロ
ファイルと類似するパターンを示した(表 2.6.5-3 を参照).主な差異は,FVIII 抗原の MRT が 7.5 時間及び t1/2terminalが6.1 時間であったのに対し,rFVIII 結合 PEG の MRT が 10.7 時間及び t1/2terminal
が8.3 時間と長かった点であった.したがって,rFVIII と PEG の結合により循環時間が延長する. 以上のように,本剤の用量比例性は,統計学的に検出されなかったが,本動物モデルでは起こ り得る範囲内であった.本試験から,ヒトrFVIII の PEG 化により循環時間が延長し,結果として 曝露時間が増大することが明らかにされた. 2.6.4.3.3 カニクイザルにおける薬物動態を含む本剤の用量漸増及び予備的4 週間反 復静脈内投与毒性試験(1933-017 試験) 目的: 本試験の目的は,カニクイザルに本剤2 ロットを静脈内投与して薬物動態プロファイルを評価 し,NOAEL,臨床用量に対する安全域及び反復投与に適した用量を検討することであった.本試 験における安全性の結果及び考察は毒性の2.6.6.3.2 項に記載する.
方法:
カニクイザルに本剤2 ロットを 350,700 又は 1,500 IU FVIII/kg の表示用量で,アドベイトを 350 IU FVIII/kg の表示用量で静脈内投与した(表 2.6.4-7 を参照).
表 2.6.4-7 Dose levels and schedule of the escalating dose / PK phase of the cynomolgus monkey study 1933-017
Group
No. Group descriptiona Nominal dose (IU FVIII/kg) Day of study Male Number of animals Female
1 BAX 855 lot 1 700 1500 1 8 22 b 22 b 2 BAX 855 lot 2 700 1500 1 8 22 b 22 b 3 BAX 855 lot 1 BAX 855 lot 2 350 350 1 8 22 c 22 c 4 ADVATE 350 1 2 2
a: lot 1 refers to BAX 855 lot and lot 2 refers to BAX 855 lot . b: Same animals as for 700 IU FVIII/kg (Day 1)
c: Same animals as for 350 IU FVIII/kg BAX 855 lot 1 (Day 1)
投与前,並びに1 及び 8 日目の投与後 5 及び 30 分,並びに 2,6,12,24,48,60,72,96, 108 及び 120 時間の時点で,すべての動物(1~4 群)から採血した.血漿試料中の FVIII 活性及
びrFVIII 結合 PEG を分析し,それぞれについて薬物動態を解析した.
FVIII 活性測定では,内因性のサル FVIII 活性とヒト rFVIII 活性は区別されない.したがって,
被験物質の投与前にすべてのサルでベースラインFVIII 活性が検出された.本剤又はアドベイト
の投与後,カニクイザルにおけるFVIII 活性は上昇し,続いて経時的に低下した.
本剤のロット毎に冪乗則モデル[3]を用いて,用量比例性を AUC0-tlastに基づき探索的に評価した.
結果及び結論:
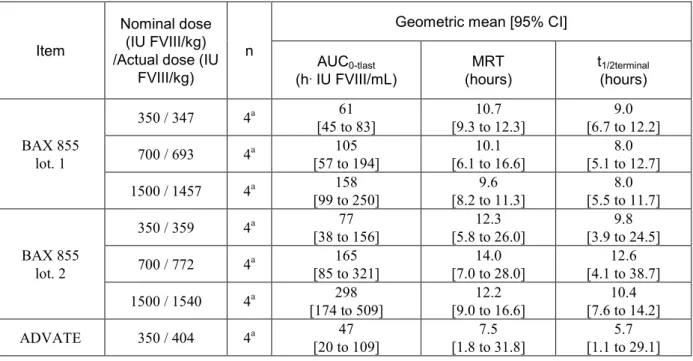
FVIII 活性について,本試験で得られた AUC0-tlast,MRT 及び t1/2terminalを表 2.6.4-8 に示す.低用
量(表示用量:350 IU FVIII/kg)において,AUC0-tlastの幾何平均値(h·IU FVIII/mL)は,本剤の
ロット1 で 61,本剤のロット 2 で 77 及びアドベイトで 47 であった.MRT の幾何平均値(時間) は,本剤のロット1 で 10.7,本剤のロット 2 で 12.3 及びアドベイトで 7.5 であった.t1/2terminalの幾 何平均値(時間)は,本剤のロット1 で 9.0,本剤のロット 2 で 9.8 及びアドベイトで 5.7 であっ た.これらの値に基づいて,本剤の各薬物動態パラメータをアドベイトと比較すると,ロット1 及び2 で AUC0-tlastの幾何平均値はそれぞれ1.3 及び 1.6 倍大きく,また,MRT の幾何平均値はそ れぞれ1.4 及び 1.6 倍,t1/2terminalの幾何平均値はそれぞれ1.6 及び 1.7 倍長かった.
表 2.6.4-8 The FVIII activity AUC0-tlast, MRT and t1/2terminal of the cynomolgus monkey study 1933-017
Item
Nominal dose (IU FVIII/kg) /Actual dose (IU
FVIII/kg)
n
Geometric mean [95% CI]
AUC0-tlast
(h·IU FVIII/mL) (hours) MRT t1/2terminal (hours)
BAX 855 lot. 1 350 / 347 4a 61 [45 to 83] [9.3 to 12.3] 10.7 [6.7 to 12.2] 9.0 700 / 693 4a 105 [57 to 194] [6.1 to 16.6] 10.1 [5.1 to 12.7] 8.0 1500 / 1457 4a 158 [99 to 250] [8.2 to 11.3] 9.6 [5.5 to 11.7] 8.0 BAX 855 lot. 2 350 / 359 4a 77 [38 to 156] [5.8 to 26.0] 12.3 [3.9 to 24.5] 9.8 700 / 772 4a 165 [85 to 321] [7.0 to 28.0] 14.0 [4.1 to 38.7] 12.6 1500 / 1540 4a 298 [174 to 509] [9.0 to 16.6] 12.2 [7.6 to 14.2] 10.4 ADVATE 350 / 404 4a 47 [20 to 109] [1.8 to 31.8] 7.5 [1.1 to 29.1] 5.7 a: 2 males and 2 females
予想通り,対照試料(アドベイト群)ではrFVIII 結合 PEG は検出されず,本剤を投与したすべ
ての動物の血漿試料ではrFVIII 結合 PEG が測定された.また,rFVIII 結合 PEG 濃度は経時的に 低下し,高用量の本剤を投与した動物ほど高濃度が検出された.
表 2.6.4-9 AUC0-tlast and dose proportionality for the PK phase of the cynomolgus monkey study 1933-017
Item ADVATE BAX 855 lot 1 BAX 855 lot 2
Nominal dose (IU FVIII/kg) 350 350 700 1500 350 700 1500 FVIII activity Actual dose (IU FVIII/kg) 404 347 693 1457 359 772 1540 Geometric mean of AUC0-tlast (h·IU FVIII/mL) [95% CI] 47 [20 to 109] 61 [45 to 83] 105 [57 to 194] 158 [99 to 250] 77 [38 to 156] 165 [85 to 321] 298 [174 to 509] Doubling of dose increased AUC [95% CI] - 1.51x [1.33 to 1.72] 1.85x [1.51 to 2.27] rFVIII-bound PEG Actual dose (ng rFVIII-bound PEG/kg) - 8570 17100 38500 10600 20900 45600 Geometric mean of AUC0-tlast (h·ng rFVIII-bound PEG/mL) [95% CI] - [1106 to 1420 1823] 2984 [1948 to 4572] 4651 [2901 to 7456] 2463 [1275 to 4756] 5571 [4488 to 6916] 12107 [8216 to 17842] Doubling of dose increased AUC [95% CI] - 1.47x [1.35 to 1.60] 2.00x [1.66 to 2.40]
n=4 (2 males and 2 females) -: not applicable
用量を2 倍にした時の AUC0-tlastの増加は,FVIII 活性についてはロット 1 で 1.51(95% CI:1.33 ~1.72),ロット 2 で 1.85(95% CI:1.51~2.27),rFVIII 結合 PEG についてはロット 1 で 1.47 (95% CI:1.35~1.60),ロット 2 で 2.00(95% CI:1.66~2.40)と推定された.ロット 1 の FVIII 活性及びrFVIII 結合 PEG 共に両側 95% CI の上限が 2 よりも小さかったことから,用量比例性を 下回る増加は有意水準5%で統計学的に有意であった. これらの結果から,検討した用量範囲において,ロット2 では用量に比例した AUC0-tlastの増加 が,ロット1 では用量比例性を下回る増加が示された.試験結果のばらつきは,カニクイザルの 内因性FVIII 活性レベルのため,予想されるものであった. 以上のように,カニクイザルを用いた本試験から,ヒトrFVIII の PEG 化により循環時間が延長 することが明らかにされた. 2.6.4.3.4 ラット静脈内投与後の[3H] PEG-rFVIII ( )の吸収,代謝, 分布及び排泄(8201148 試験) 目的:
本試験の目的は,ラットに[3H] PEG-rFVIII ( )を単回静脈内投与後の[3H] PEG-rFVIII に由来する放射能の薬物動態,並びに吸収,分布及び消失の程度を評価することであ
った.[3H] PEG-rFVIII ( )及びその代謝物の代謝プロファイルも特定試料におい
て検討した. 方法:
[3H] PEG-rFVIII はトリチウム化した[3H] PEG 試薬の結合により合成し,rFVIII に結合した PEG
骨格ではいくつかの水素[1H]がトリチウム原子[3H]により交換された.本剤の標識体は,他の非臨 床試験で用いた本剤の非標識体と同等の有効成分を生産する,類似の工程で調製された. [3H] PEG-rFVIII の比活性は,他の非臨床 in vivo 試験で用いた非臨床用 4 ロットの比活性の範囲 (3,691.6~4,355.7 IU FVIII/mg たん白質)を下回っていた.予測される放射性分解による経時的な 活性の漸減を制限するために,本試験のin vivo 部分は標識体合成後可能な限り速やかに開始する ようにデザインした.したがって,放射性標識体は標準的設備を備えていない別施設( ) で調製しなければならなかった.調製の違いにもかかわらず,保持された放射活性は小規模なバ ッチとしては妥当な高さであると考えられた.したがって,FVIII 活性に認められた差異は[3H] PEG-rFVIII の分布に影響を及ぼさないと判断された.
雌雄のSprague Dawley 系ラットに[3H] PEG-rFVIII ( )を単回静脈内投与して
放射活性の吸収,分布,代謝及び消失を検討した.排泄物及び血液採取用動物に,目標容量0.68 mL/kg で表示用量 1 mg/kg の[3H] PEG-rFVIII を単回静脈内投与した.全身オートラジオグラフィ 用の動物には,目標容量1.36 mL/kg で表示用量 2 mg/kg を単回静脈内投与した.両用量共に,用 いた検出方法(液体シンチレーション計測法,オートラジオグラフィ)で6 週にわたり十分に高 い放射活性が測定可能であった.試験デザインを表 2.6.4-10 に示す.比活性が 2,088 IU FVIII/mg の時,これらの単回投与量(1 又は 2 mg/kg)はそれぞれ FVIII 活性の表示用量 2,088 又は 4,176 IU FVIII/kg に相当する.
表 2.6.4-10 Design of the rat ADME study 8201148 Group
No.
Number
of animals (mg/kg)/Actual Nominal dose dosea (mg/kg)
Target dose volume
(mL/kg) Samples collected
Male Female
1 3 3 1/0.997 0.68 Urine, Feces, Tissues, and Carcass
2 16 16 1/1.00 0.68 Blood, Tissues, and Carcass
3 4 4 2/2.05 1.36 Whole-Body AutoradiographyBlood and Carcasses for a: The radioactivity dose for Groups 1 and 2 was μCi/kg and µCi/kg for Group 3.
試料の採取手順を以下に記載する. <第1 群>
放射活性の排泄及びマスバランス分析のため,第1 群の動物から以下の試料を採取した.尿は 投与後0~8 時間及び 8~24 時間,並びに投与後 1,008 時間まで 24 時間間隔で採取した.糞は投 与後1,008 時間まで 24 時間間隔で採取した.投与後 336 及び 672 時間を除き,984 時間までの各 24 時間の採取間隔毎にケージを約 30 mL の水で洗浄した.各試料の重量を記録した.投与後 336 及び672 時間の時点では,排泄物採取後に動物を清潔なケージに移した.投与後 336 及び 672 時 間,並びに最後の排泄物採取後,ケージを1%リン酸三ナトリウム水溶液で洗浄し,ガーゼで拭き 取った.ケージ洗浄液及びガーゼを回収し,重量を記録した.各動物から組織を摘出し,適宜, 生理食塩液で洗浄して水分を拭き取り,重量を測定した. <第2 群> 投与後0.083,0.25,0.5,1,3,5,8,12,24,48,72,168,336,504,672 及び 1,008 時間の 各時点で雌雄各2 匹の動物の頸静脈から血液(約 1.5 mL)を採取し,3.8%クエン酸ナトリウム緩 衝液を含む試験管に移した.動物一匹からの採血は2 時点のみとした(1 及び 2 回目の採血時間 の組合せ:0.083/1,0.25/8,0.5/24,3/168,5/336,12/504,48/672,72/1,008 時間).血液は,放 射能測定用に分取するまで氷上に置き,血漿を得るために遠心分離した.投与後1,8,24,168 及び672 時間の 2 回目の採血に続いて,プロファイリング用にイソフルラン麻酔下で心穿刺によ り血液(約4.5 mL)を採取した.組織を摘出し,適宜,生理食塩液で洗浄して水分を拭き取り, 重量を測定した. <第3 群> 投与後1,8,24 及び 168 時間の各時点で雌雄各 1 匹の動物の頸静脈から血液(約 2 mL)を採 取し,3.8%クエン酸ナトリウム緩衝液を含む試験管に移した.試料は分取するまで氷上に置き, 血漿を得るために遠心分離した.各動物を過量のイソフルラン麻酔により屠殺し,直ちにヘキサ ン/ドライアイス中で約5 分間凍結し,全身オートラジオグラフィに供した. 採取試料における放射活性濃度は,液体シンチレーション計測法又は全身オートラジオグラフ ィにより測定した.代謝物プロファイルはHPLC により測定した. 結果及び結論: [吸収] 最初の採取時点における血液中及び血漿中放射活性の最高平均濃度は,雄ではそれぞれ17,800 及び24,200 ng Eq/g,雌ではそれぞれ 16,900 及び 23,300 ng Eq/g であった(表 2.6.4-11).
表 2.6.4-11 Average concentrations of radioactivity in blood and plasma from rats (Study 8201148, Group 2) Collection time point (hours) ng Eq [3H] PEG-rFVIII ( )/g Blood Plasma
Male Female Male Female
0.083 17800 16900 24200 23300 0.25 13500 13100 18550 17650 0.5 14100 12500 20000 16500 1 12800 13600 16100 16600 3 8360 9850 NS 10400 5 8470 8610 12700 13400 8 6860 6770 9480 9090 12 5240 6050 NS 8800 24 3520 3440 4850 4550 48 1610 1900 2440 2770 72 902 910 1300 1230 168 56 142 86 200 336 10 10 17 16 504 9 6 13 8 672 7 5 11 7 1008 6 2 8 3 2 animals/sex/time point NS: no sample 放射活性は,血液及び血漿から雄ではそれぞれ827 及び 655 時間,雌ではそれぞれ 306 及び 276 時間のt1/2を以て消失した.血液中及び血漿中平均AUC0-∞値は,雄ではそれぞれ307,000 及び 448,000 h⋅ng Eq/g,雌ではそれぞれ 327,000 及び 447,000 h⋅ng Eq /g であった(表 2.6.4-12).
表 2.6.4-12 PK parameters for radioactivity in blood and plasma from rats (Study 8201148, Group 2)
Matrix Sex (hours) Tmax (ng Eq/g) C0 (ng Eq/g) Cmax (hours) t1/2 AUC0-t (h⋅ng Eq/g)
AUC0-∞ (h⋅ng Eq/g) Blood Female Male 0.083 0.083 20400 19200 17800 16900 827 306 300000 326000 307000 327000 Plasma Female Male 0.083 0.083 27600 26700 24200 23300 655 276 440000 446000 448000 447000
血液中及び血漿中濃度データ(表 2.6.4-11),並びに薬物動態パラメータ(表 2.6.4-12)にはわ ずかに性差があり,雄で見かけのt1/2が長かったが,[3H] PEG-rFVIII 由来放射活性への曝露量は同
程度であった.雄での長いt1/2は,主に1,008 時間後の濃度が高かったためと考えられる(表
2.6.4-11).血液:血漿中濃度比の平均値(表 2.6.4-13)から,[3H] PEG-rFVIII 由来放射活性と血
表 2.6.4-13 Average blood:plasma concentration ratios of radioactivity in blood and plasma from rats (Study 8201148, Group 2)
Collection time point
(hours) Male Blood:Plasma Concentration ratios Female
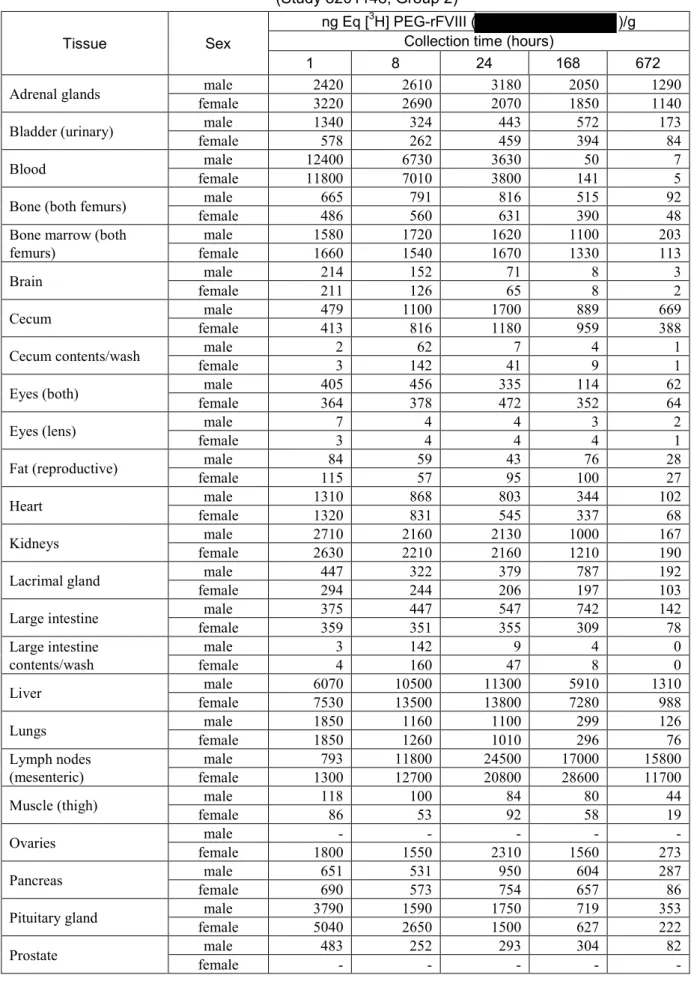
0.083 0.736 0.727 0.25 0.728 0.744 0.5 0.706 0.751 1 0.806 0.826 3 NS 0.824 5 0.668 0.645 8 0.734 0.744 12 NS 0.688 24 0.726 0.758 48 0.661 0.689 72 0.696 0.740 168 0.654 0.712 336 0.545 0.665 504 0.681 0.688 672 0.620 0.703 1008 0.709 0.807 2 animals/sex/time point NS: no sample 低濃度のトリチウム水が,雌雄ラットの血漿おいて複数の時点で認められた.トリチウム水は, PEG 構造中の放射性トリチウム(T)と水中の非放射性水素(H)の置換を示す.この置換は PEG のトリチウム化の安定性に関連する.投与後1,008 時間までの放射活性の平均パーセンテージと して表した血漿試料中トリチウム水は,雄では0.0~11.4%,雌では 0.0~12.6%であった.最高レ ベルのトリチウム水は概して遅い時点で認められた.ただし,トリチウム水の見かけの増加は低 濃度の放射活性で最も顕著であり,試験期間を通して血漿中トリチウム水の実質的な時間依存性 の増加は明らかでなかった. [分布] [3H] PEG-rFVIII 由来放射活性の分布は雌雄共に広範であり,血液及び血漿,並びにすべての分 析マトリックスにおいて放射活性が定量可能であった.組織における放射活性のCmaxは1,8,24 及び168 時間後の採取時に観察された.放射活性の最高濃度は,血漿,血液及び腎臓では雌雄共 に投与後1 時間,副腎では 1(雌)又は 24(雄)時間,脾臓及び肝臓では雌雄共に 24 時間,並び に腸間膜リンパ節では24(雄)又は 168(雌)時間の時点で認められた(表 2.6.4-14).
表 2.6.4-14 Average concentrations of radioactivity in blood, plasma and tissues from rats (Study 8201148, Group 2)
Tissue Sex
ng Eq [3H] PEG-rFVIII ( )/g
Collection time (hours)
1 8 24 168 672
Adrenal glands female male 2420 3220 2610 2690 3180 2070 2050 1850 1290 1140 Bladder (urinary) female male 1340 578 324 262 443 459 572 394 173 84 Blood female male 12400 11800 6730 7010 3630 3800 141 50 7 5 Bone (both femurs) female male 665 486 791 560 816 631 515 390 92 48 Bone marrow (both
femurs) female male 1580 1660 1720 1540 1620 1670 1100 1330 203 113
Brain female male 214 211 152 126 71 65 8 8 3 2
Cecum female male 479 413 1100 816 1700 1180 889 959 669 388 Cecum contents/wash female male 2 3 142 62 41 7 4 9 1 1 Eyes (both) female male 405 364 456 378 335 472 114 352 62 64
Eyes (lens) female male 7 3 4 4 4 4 3 4 2 1
Fat (reproductive) female male 115 84 59 57 43 95 100 76 28 27 Heart female male 1310 1320 868 831 803 545 344 337 102 68 Kidneys female male 2710 2630 2160 2210 2130 2160 1000 1210 167 190 Lacrimal gland female male 447 294 322 244 379 206 787 197 192 103 Large intestine female male 375 359 447 351 547 355 742 309 142 78 Large intestine
contents/wash female male 3 4 142 160 47 9 4 8 0 0
Liver female male 6070 7530 10500 13500 11300 13800 5910 7280 1310 988 Lungs female male 1850 1850 1160 1260 1100 1010 299 296 126 76 Lymph nodes
(mesenteric) female male 1300 793 11800 12700 24500 20800 17000 28600 15800 11700 Muscle (thigh) female male 118 86 100 53 84 92 80 58 44 19
Ovaries female male 1800 - 1550 - 2310 - 1560 - 273 -
Pancreas female male 651 690 531 573 950 754 604 657 287 86 Pituitary gland female male 3790 5040 1590 2650 1750 1500 719 627 353 222
表 2.6.4-14 Average concentrations of radioactivity in blood, plasma and tissues from rats (Study 8201148, Group 2)(続き)
Tissue Sex
ng Eq [3H] PEG-rFVIII ( )/g
Collection time (hours)
1 8 24 168 672
Plasma female male 16200 15100 8540 8390 4470 4490 72 69 11 6 Salivary glands female male 398 428 241 348 251 349 266 352 117 73 Skin (dorsal, shaved) female male 204 154 247 141 331 260 422 329 273 100 Small intestine female male 504 478 1140 847 1410 1160 1010 873 333 168 Small intestine
contents/wash female male 62 97 28 42 20 7 3 5 1 0 Spleen female male 3140 3940 9140 8730 11700 11700 8980 8060 1460 898 Stomach female male 436 527 398 345 357 341 199 256 54 34
Stomach contents/wash female male 28 2 5 7 1 1 0 0 0 0
Testes female male 268 - 351 - 321 - 299 - 165 -
Thymus female male 191 385 596 385 196 532 215 480 104 121 Thyroid female male 1150 1220 1260 1090 1640 984 845 594 310 93
Uterus female male 457 - 1070 - 519 - 668 - 122 -
2 animals/sex/time point -: not applicable
図 2.6.4-1 の全身オートラジオグラフィは,ラットに 4,176 IU FVIII/kg の表示用量を単回投与後 168 時間(1 週間)の[3H] PEG-rFVIII の分布を図示する.
図 2.6.4-1 Whole-body autoradiograph for female animal at 168 hours (Study 8201148, Group 3)
全身オートラジオグラフィにより分析した脾臓における放射活性は,ほとんどが赤色脾髄内の 斑紋状放射活性像を呈した.トリチウム水の分布は血漿と組織の間で一致すると推測される.し たがって,トリチウム水の存在が試験期間を通じて血漿に対する組織中放射活性濃度比又は分布 結果に影響を及ぼすことは推測し難い. [代謝] 血漿,尿,糞,腎臓,肝臓及び肺試料について,親化合物及びその代謝物のプロファイリング を行った. <血漿> クロマトグラフィーは,[3H] PEG-rFVIII,高分子量代謝物 1 か所及び低分子量代謝物 4 か所の 放射活性画分を示した.親化合物の溶出時間より早期に認められた画分は親化合物よりも分子量 が大きい可能性がある.最終画分(画分5)の保持時間は,[3H] PEG-rFVIII を生成する PEG 化試 薬である 及び加水分解された と一致する.[3H] PEG-rFVIII 合成中に 基が開裂するため,この物質は の加水分解物と考えられ, 基 を含まない.放射活性のうち[3H] PEG-rFVIII が占める平均パーセンテージは長時間にわたりほぼ 一定であり,雄で37.1(1 時間)~41.3(12 時間)%,雌で 30.6(3 時間)~39.2(12 時間)%で あった.投与後1 時間における[3H] PEG-rFVIII 濃度は,雌雄共に平均 6,020 ng Eq/g であった.投 与後48 時間までに親化合物の平均濃度は,雄及び雌でそれぞれ 953 及び 907 ng Eq/g まで低下し た(表 2.6.4-15).
表 2.6.4-15 Average percent and average concentration of radioactivity for [3H] PEG-rFVIII ( ) and metabolites in plasma samples from rats (Study 8201148,
Group 2) Peak Retenti on time (min) Proposed identificatio n Sex Percent of radioactivity injected (% of run) Concentration (ng Eq [3H] PEG-rFVIII ( )/g)
Collection time (hours)
1 3 12 48 1 3 12 48
1 11.25-11.42 Metabolites female male 6.0 6.4 0.0 10.8 0.0 6.8 2.0 0.0 1160 1080 1010NS a 175 NS 0 0 Parent 11.92-12.25 Parent female 36.3 30.6 39.2 33.1 6020 male 37.1 40.6 41.3 38.8 6020 3890NS a 3460 NS 953 907
2 12.75-13.75 Metabolites female 23.1 32.0 26.6 35.4 3760 male 23.7 28.1 17.2 32.4 3700 2430NS a 2330 NS 785 991 3 15.25-16.42 Metabolites female male 7.2 8.2 6.2 6.3 7.0 6.5 5.8 7.1 1110 1360 520NS a 611 NS 141 195 4 20.08-20.92 Metabolites female male 6.8 7.9 6.6 6.5 6.8 6.2 5.3 4.6 1080 1290 631NS a 596 NS 129 128 5 26.58-27.58 Metabolites female 17.9 17.7 18.4 19.7 2980 male 19.0 18.3 18.1 17.6 3070 1900NS a 1620 NS 428 543 Total female 99.8 99.8 99.9 99.9 16600 10400 8790 male 99.8 99.9 99.9 99.8 16100 NS NS 2440 2760 2 animals/sex/time point
Parent: [3H] PEG-rFVIII ( ) NS: peak not detected or below the limit of quantitation.
a: n=1 because peak not detected or below the limit of quantitation for one animal.
<尿> プールした尿のプロファイリングは,[3H] PEG-rFVIII 由来放射活性が 3 か所の幅広い画分とし て溶出し,親化合物よりも低分子量の物質と一致することを示した.[3H] PEG-rFVIII に近似する 保持時間を示す画分はなかった.放射活性の最終の幅広い画分は, 及び加水 分解された に類似する保持特性を示した.前述のように, 基は[3H] PEG-rFVIII の合成で失われたため,この物質は の加水分解物の可能性がある. 雄では3 か所の画分は平均してそれぞれ 7.9,28.8 及び 63.1%を占め,投与量の 3.5,13.0 及び 28.4% に相当した.雌では3 か所の画分は平均してそれぞれ 6.2,21.5 及び 71.6%を占め,投与量の 3.0, 10.7 及び 35.4%に相当した(表 2.6.4-16).
表 2.6.4-16 Mean percent of sample radioactivity and mean percent of radioactive dose for metabolites in 0- to 576-hour pooled urine from rats (Study 8201148, Group 1) Peak Retenti on time (min) Proposed identificatio n Sex Percent of radioactivity
injected (% of run) Percent of radioactive dose (%) Pool time 0-576 hours
Mean SD Mean SD
1 17.08-18.25 Metabolites female male 7.9 6.2 0.8 1.6 3.5 3.0 0.2 0.5 2 19.75-20.42 Metabolites female male 28.8 21.5 0.6 2.5 13.0 10.7 0.9 2.2 3 25.42-26.25 Metabolites female male 63.1 71.6 1.2 0.3 28.4 35.4 2.7 3.3 Total female male 99.7 99.3 0.4 0.8 44.9 49.2 3.6 5.0 3 animals/sex <糞> プールした糞試料は放射活性が非常に低かった.プールした糞のプロファイリングは,親化合 物よりも低分子量の物質と一致する保持時間を有する,1 か所の[3H] PEG-rFVIII 由来放射活性画 分を示した.この放射活性物質の画分は の加水分解物と同じ保持特性を有し ていた.雄及び雌からの糞は,この画分がそれぞれ80.2 及び 82.5%を占め,投与量の 6.9 及び 10.7% に相当することを示した(表 2.6.4-17).
表 2.6.4-17 Mean percent of sample radioactivity and mean percent of radioactive dose for metabolites in 0- to 504 (male)/408 (female)-hour pooled feces from rats (Study 8201148,
Group 1) Peak on time Retenti
(min)
Proposed
identification Sex
Percent of radioactivity
injected (% of run) Percent of radioactive dose (%) Pool time 0-504 (male)/408 (female) hours
Mean SD Mean SD
1 26.25-27.58 Metabolites female male 80.2 82.5 11.7 2.9 10.7 6.9 1.4 2.1 3 animals/sex <腎臓> 投与後1 時間における雌雄の腎臓プロファイルは,低濃度の[3H] PEG-rFVIII 由来放射活性を示 した.親化合物の放射活性はそれぞれ14.9 及び 17.5%を占め,その濃度は 333 及び 384 ng Eq/g で あった.画分4 は の加水分解物に近似する保持特性を示し,雄及び雌でそれ ぞれ27.9 及び 27.4%を占め,その濃度は 625 及び 599 ng Eq/g であった.投与後 24 時間の腎臓試 料では,雄及び雌で[3H] PEG-rFVIII がそれぞれ 10.1 及び 9.0%を占め,その濃度は 145 及び 192 ng Eq/g であり,画分 4 がそれぞれ 26.8 及び 31.2%を占め,その濃度は 385 及び 664 ng Eq/g であった.
投与後168 時間の腎臓試料では,雄及び雌で[3H] PEG-rFVIII がそれぞれ 2.6 及び 2.3%を占め,そ の濃度は23 及び 23 ng Eq/g であり,画分 4 がそれぞれ 28.3 及び 28.3%を占め,その濃度は 254 及 び289 ng Eq/g であった(表 2.6.4-18).
表 2.6.4-18 Percent and concentration of radioactivity for [3H] PEG-rFVIII ( ) and metabolites in kidney from rats (Study 8201148, Group 2) Peak on time Retenti
(min) Proposed identification Sex Percent of radioactivity injected (% of run) Concentration (ng Eq [3H] PEG-rFVIII ( )/g)
Collection time (hours)
1 24 168 1 24 168
Parent 11.75-12.25 Parent female male 14.9 17.5 10.1 9.0 2.6 2.3 384 333 192 145 23 23 1 13.75-13.92 Metabolites female male 52.8 49.8 59.1 55.8 65.9 65.5 1090 1180 1190 849 591 670 2 16.08-16.25 Metabolites female male 1.8 1.9 1.6 1.6 1.6 1.8 41 40 33 22 14 19 3 20.25-21.25 Metabolites female male 2.5 3.3 2.4 2.3 1.6 1.6 73 56 48 35 15 16 4 25.58-26.75 Metabolites female male 27.9 27.4 26.8 31.2 28.3 28.3 599 625 664 385 254 289
Total female male 99.8 99.9 99.9 99.8 100.0 99.6 2240 2190 1440 2130 1020 896 1 animal/sex/time point Parent: [3H] PEG-rFVIII ( ) <肝臓> 投与後1 時間における雌雄の肝臓プロファイルは,低濃度の[3H] PEG-rFVIII 由来放射活性を示 した.親化合物の放射活性はそれぞれ7.0 及び 1.7%を占め,その濃度は 221 及び 80 ng Eq/g であ った.画分4 は の加水分解物に近似する保持特性を示し,雄及び雌でそれぞ れ27.6 及び 30.9%を占め,その濃度は 867 及び 1,430 ng Eq/g であった.投与後 24 時間の肝臓試 料では,雄及び雌で[3H] PEG-rFVIII がそれぞれ 1.5 及び 0.4%を占め,その濃度は 111 及び 41 ng Eq/g であり,画分4 がそれぞれ 29.3 及び 31.8%を占め,その濃度は 2,160 及び 3,030 ng Eq/g であった. 投与後168 時間の肝臓試料では,雄及び雌で[3H] PEG-rFVIII がそれぞれ 2.7 及び 0.8%を占め,そ の濃度は119 及び 41 ng Eq/g であり,画分 4 がそれぞれ 26.9 及び 32.4%を占め,その濃度は 1,200 及び1,570 ng Eq/g であった(表 2.6.4-19).
表 2.6.4-19 Percent and concentration of radioactivity for [3H] PEG-rFVIII ( ) and metabolites in liver from rats (Study 8201148, Group 2)
Peak Retention time (min) Proposed identification Sex Percent of radioactivity injected (% of run) Concentration (ng Eq [3H] PEG-rFVIII ( )/g)
Collection time (hours)
1 24 168 1 24 168
Parent 11.75-12.25 Parent female male 7.0 1.7 1.5 0.4 2.7 0.8 221 80 111 41 119 41 1 13.42-13.75 Metabolites female male 57.3 47.3 58.8 43.9 62.8 53.1 2180 1800 4180 4340 2800 2570 2 15.75-17.58 Metabolites female male 13.6 4.3 16.3 5.9 3.5 7.1 626 134 1550 437 155 346 3 19.42-21.75 Metabolites female male 3.8 6.4 4.4 7.4 4.2 6.5 296 118 706 326 185 315 4 25.58-26.58 Metabolites female male 27.6 30.9 29.3 31.8 26.9 32.4 1430 867 3030 2160 1200 1570
Total female male 100.0 99.9 100.0 99.9 100.0 4610 99.9 3140 7380 9510 4460 4840 1 animal/sex/time point Parent: [3H] PEG-rFVIII ( ) <肺> 投与後1 時間における雌雄の肺プロファイルは,低濃度の[3H] PEG-rFVIII 由来放射活性を示し た.親化合物の放射活性はそれぞれ14.2 及び 12.3%を占め,その濃度は 170 及び 163 ng Eq/g であ った.画分4 は の加水分解物に近似する保持特性を示し,雄及び雌でそれぞ れ23.6 及び 23.9%を占め,その濃度は 283 及び 316 ng Eq/g であった.投与後 24 時間の肺試料で は,雄及び雌で[3H] PEG-rFVIII がそれぞれ 14.1 及び 18.6%を占め,その濃度は 118 及び 123 ng Eq/g であり,画分4 がそれぞれ 23.4 及び 22.0%を占め,その濃度は 195 及び 146 ng Eq/g であった.投 与後168 時間の肺試料では,雄及び雌で[3H] PEG-rFVIII がそれぞれ 4.7 及び 4.2%を占め,その濃 度は15 及び 12 ng Eq/g であり,画分 4 がそれぞれ 23.4 及び 26.0%を占め,その濃度は 73 及び 77 ng Eq/g であった(表 2.6.4-20).
表 2.6.4-20 Percent and concentration of radioactivity for [3H] PEG-rFVIII ( ) and metabolites in lung from rats (Study 8201148, Group 2) Peak Retention time
(min) Proposed identification Sex Percent of radioactivity injected (% of run) Concentration (ng Eq [3H] PEG-rFVIII ( )/g)
Collection time (hours)
1 24 168 1 24 168
Parent 11.58-12.08 Parent female male 14.2 12.3 14.1 18.6 4.7 4.2 170 163 118 123 15 12 1 13.42-13.75 Metabolites female male 51.5 52.6 55.3 52.3 65.8 61.9 696 616 348 462 205 183 2 16.25-18.25 Metabolites female male 5.8 5.4 3.5 3.8 3.3 3.9 72 69 26 29 10 11 3 19.42-20.75 Metabolites female male 4.8 5.6 3.6 3.1 2.8 3.1 74 58 20 30 9 9 4 25.75-27.25 Metabolites female male 23.6 23.9 23.4 22.0 23.4 26.0 316 283 146 195 73 77
Total female male 99.9 99.8 100.0 99.8 100.0 99.0 1200 1320 834 664 312 293 1 animal/sex/time point Parent: [3H] PEG-rFVIII ( ) [排泄] 静脈内投与後,放射活性は主に尿を介して消失した.投与後1,008 時間における尿,糞及び毎 日のケージ洗液には,雄で投与量のそれぞれ51.9,38.4 及び 4.0%,雌で投与量のそれぞれ 55.7, 44.9 及び 3.5%が認められた.雄及び雌での総回収率の平均値は,それぞれ 97.4 及び 107.0%であ った(表 2.6.4-21,図 2.6.4-2).
表 2.6.4-21 Mean percent of radioactive dose in urine, feces, cage rinse, cage wash and cage wipe from rats (Study 8201148, Group 1)
Sample Male Percent of radioactivity dose (%) Female
Mean SD Mean SD Urine 51.9 3.8 55.7 4.7 Feces 38.4 2.8 44.9 3.1 Cage rinse 4.0 0.9 3.5 1.1 Cage wash 1.0 0.2 1.0 0.2 Cage wipe 2.0 0.5 1.6 0.4 Total 97.4 1.4 107.0 1.0 3 animals/sex
Group 1 Males Time (Hours) 0 72 144 216 288 360 432 504 576 648 720 792 864 936 1008 Per cen t o f R ad io act iv e D os e 0 20 40 60 80 100 Urine Feces Cage Rinse Total Group 1 Females Time (Hours) 0 72 144 216 288 360 432 504 576 648 720 792 864 936 1008 Per cen t o f R ad io act iv e D os e 0 20 40 60 80 100 Urine Feces Cage Rinse Total
図 2.6.4-2 Excretion data of male and female rats (Study 8201148, Group 1)
いずれの採取間隔においても,尿中には放射活性の平均パーセンテージとして表した低濃度の
トリチウム水が認められ,その値の範囲は雄で1.5~10.2%,雌で 1.5~17.9%であった.投与後 0
~1,008 時間の尿においてトリチウム水として排泄された用量の総パーセンテージは,雄で 3.5%,
以上のように,本試験結果から,放射性標識した本剤は細胞性血液成分に結合することなく分
析した組織に分布し,放射活性は尿及び糞を介して6 週以内に定量的に排泄されることが示され
た.
2.6.4.4
分布
8201148 試験において,[3H] PEG-rFVIII ( )の分布を雌雄 Sprague Dawley ラッ トに単回静脈内投与後に検討した(2.6.4.3.4 項を参照).
2.6.4.5
代謝(動物間の比較)
8201148 試験において,[3H] PEG-rFVIII ( )の代謝を雌雄 Sprague Dawley ラッ
トに単回静脈内投与後に検討した(2.6.4.3.4 項を参照).
2.6.4.6
排泄
8201148 試験において,[3H] PEG-rFVIII ( )の消失を雌雄 Sprague Dawley ラッ
トに単回静脈内投与後に検討した(2.6.4.3.4 項を参照).
2.6.4.7
薬物動態学的薬物相互作用
本剤は単独投与されるため薬物動態学的薬物相互作用試験は実施しなかった.2.6.4.8
その他の薬物動態試験
その他の薬物動態試験は実施しなかった.2.6.4.9
考察及び結論
本剤の薬物動態プロファイルをE17 FVIII ko マウス,並びに正常ラット及びカニクイザルでア ドベイトと比較評価した.また,ラット及びカニクイザルの主要毒性試験にトキシコキネティク ス評価を含め,これらの結果を2.6.6.3 項にまとめる. 薬物動態試験の主要評価項目は,本剤のバイオアベイラビリティを評価するためのAUC0-tlast, 血液中循環時間の延長の可能性を検討するためのMRT とし,消失期における血漿中薬物濃度半減 期であるt1/2terminalも重要な変数として評価した.E17 FVIII ko マウスにおける FVIII 活性については,本剤群の用量補正 AUC0-tlastの点推定値はア
ドベイト群の1.9 倍であり(それぞれ,0.0797 及び 0.0421 h·IU FVIII/mL /IU FVIII/kg),MRT の 点推定値はアドベイト群の1.6 倍であり(それぞれ,7.9 及び 4.9 時間),t1/2terminalの点推定値はア ドベイト群の1.4 倍に延長することが示された(それぞれ,5.9 及び 4.3 時間). ラット及びカニクイザルのような止血機能が正常な動物モデルでは,ヒトFVIII 活性の測定値 は内因性FVIII 濃度の影響を受ける.そのため,ラットではこの影響を回避するため,FVIII 抗原 測定法を採用した.本測定法はラットFVIII と交差反応性を示さないため,ラットにおいてヒト FVIII 及び本剤を選択的に測定可能であった.しかしながら,本測定法はカニクイザル FVIII と反 応するためヒトFVIII を選択的に測定できなかったことから,カニクイザルでは FVIII 活性測定法