44
4. 設計検証及び妥当性確認文書の概要
4.1. 機器の設計検証及び妥当性の確認の概要 本品の設計検証及び妥当性確認のために実施した試験の要約を以下に示す。 なお、各試験は本品と同一の機器で実施したものとその直前の前世代品(以下、単に「前世代品」と記 す。)で実施したものがある。本品と前世代品の差分については、本資料第1 項の開発の経緯に示す。45 図表 4-1 機器の設計検証及び妥当性確認結果 試験項目 試験方法 試験検体 試験結果 実施施設 別添資料 4.1.1 物理的、化学的特性 当該原材料の特性が、医療機器の本質に係るものではないため、本項の記載を省略する。 4.1.2 電気的安全 性及び電磁 両立性 電気的安全性 IEC 60601-1:2005 +CORR1:2006 +CORR2:2007+A1: 2012 本品及び 前世代品 適合 テュフラインランド ジャパン株式会社 ロ-1~2 IEC 60601-1:2005 +CORR1:2006 +CORR2:2007 AC アダプタ ロ-3 電磁両立性 IEC 60601-1-2: 2014 本品 適合 三菱電機エンジニア リング株式会社 ロ-4 4.1.3 生物学的安 全性 細胞毒性 ISO10993-5:2009 本品と同一とな るよう調製され た試料 適合 一般社団法人食品薬 品安全センター ロ-5 感作性 ISO10993-10:2010 ISO10993-12:2012 ロ-6 刺激性 ISO10993-10:2010 ISO10993-12:2012 ロ-7 4.1.4 放射線に関する安全 性 IEC 60825-1: 2007 前世代品 適合 テュフラインランド ジャパン株式会社 ロ-1 Annex D 消費生活用製品安全法適合性検査 前世代品 適合 株式会社UL Japan ロ-8 FDA 21CFR1040.10 前世代品 クラスI レーザ 株式会社UL Japan ロ-9 4.1.5 機械的安全性 IEC 60601-1-11:2015 本品 適合 テュフラインランド ジャパン株式会社 ロ-2 Annex B ISO 15004-1:2006 本品及び 前世代品 適合 テュフラインランド ジャパン株式会社 ロ-10、11 4.1.6 安定性及び耐久性 本品は特定の貯蔵方法によらなければその品質を確保することが困難であるもの又は経時的に品質の低下 をもたらすものではないため、有効期間を設定していない。
46 試験項目 試験方法 試験検体 試験結果 実施施設 別添資料 4.1.7 性能 レーザ出力 全白画像を表示させ、光パワーメータ により出力を測定する。 本品 適合 ミツミ電機株式会社 ロ-12、13 ホワイトバラ ンス 全白画像を表示させ、光パワーメータ によりホワイトバランスを測定する。 本品 適合 ミツミ電機株式会社 ロ-14、15 画角 青画面を表示させ、投影画像取得用カ メラにより画角、アスペクト比を測定 する。 前世代品 適合 ミツミ電機株式会社 ロ-16、17 投影解像度 オシロスコープにより、投影画像の同 期信号(ピクセルクロック、水平同期 信号、垂直同期信号)の周波数を測定 する。 本品 適合 ミツミ電機株式会社 ロ-18、19 カメラ信号解 像度 オシロスコープにより、カメラ撮像信 号の同期信号(ピクセルクロック、水 平同期信号、垂直同期信号)の周波数 を測定する。 本品 適合 ミツミ電機株式会社 ロ-20、21 4.1.8 使用方法 IEC 60601-1-6: 2010+A1: 2013 本品 適合 テュフラインランド ジャパン株式会社 ロ-2 Annex A 4.1.9 ソフトウェアライフサ イクルプロセス IEC 62304: 2006 本品 適合 テュフラインランド ジャパン株式会社 ロ-2 Annex C ロ-22
47 4.1.1. 物理的、化学的特性
48 4.1.2. 電気的安全性及び電磁両立性
別添資料:ロ-1~4 総括
本 品 の 電 気 的 安 全 性 及 び 電 磁 両 立 性 を 評 価 す る た め 、IEC 60601-1:2005+CORR1:2006+ CORR2:2007+A1:2012(以下、IEC 60601-1:2012 と表記)、IEC 60601-1:2005+CORR1:2006+ CORR2:2007(以下、IEC 60601-1:2005 と表記)及び IEC 60601-1-2:2014 に準拠した試験を実施し た。 IEC 60601-1:2012 は JIS T 0601-1:2017「医用電気機器-第 1 部:基礎安全及び基本性能に関する一 般要求事項」に、IEC 60601-1-2:2014 は JIS T 0601-1-2:2018「医用電気機器-第 1-2 部:安全に関す る一般的要求事項-電磁両立性-要求事項及び試験」に対応する国際規格であり、現時点における科 学・技術知識の水準に照らし、実施した試験項目での電気的安全性及び電磁両立性の評価は必要かつ 十分であると判断した。 試験項目 試験方法 試験結果 実施施設 別添資料 電気的安全性試験 IEC 60601-1:2012 及び IEC 60601-1:2005 適合 テュフラインランド ジャパン株式会社 ロ-1~3 電磁両立性試験 IEC 60601-1-2:2014 適合 三菱電機エンジニア リング株式会社 ロ-4 上記のとおり、本品が電気的安全性及び電磁両立性に関する上記規格に適合していることを確認し、 本品の電気安全性及び電磁両立性が担保されていると判断した。 なお、試験実施施設であるテュフラインランドジャパン株式会社は、工業標準化法(昭和24 年法律 第185 号)第 57 条第 1 項に基づく登録(JNLA 登録)を受けた機関であり、電気安全性試験(IEC60601-1:2012)については、CB スキームによる適合証明を受けている。別添資料として適合証明書を添付 し、参考として試験成績書も添付する。
三 菱電 機エン ジニ アリン グは 、アジ ア太 平洋試 験所 認定協 力機 構(Asia Pacific Laboratory Accreditation Cooperation, APLAC)に加盟する認定機関である株式会社電磁環境試験所認定センタ ー(VLAC)により、国際標準化機構の定める試験所並びに校正機関の能力に関する一般要求事項(ISO 17025)への適合が確認されている。
49 4.1.2.1. 電気的安全性 別添資料:ロ-1~3 本品の電気的安全性を確認するため、IEC 60601-1:2012 に準拠した試験を実施した。なお、本試験は 機械的安全性に関する項目を含むが、本項にまとめて記載する。 試験は本品の前世代品を用いて実施(別添資料:ロ-1)したのち、本品と同一の機器を用いて改めて 試験を行っている(別添資料:ロ-2)。ただし、一部の項目については前世代品との差分なしとの判断の 元、実施を省略した。本品と同一の機器を試験していることから、検体の選択として妥当であると判断し た。 電気的安全性の試験項目及び試験結果を以下に示す。 図表 4-2 電気的安全性に関する試験項目と試験結果 試験項目 試験方法 試験検体 結果 別添資料 4.11 電源入力 IEC 60601-1:2012 本品 適合 ロ-2 5.7 湿度前処理 IEC 60601-1:2012 本品 適合 ロ-2 7.1.2 表示の見やすさ IEC 60601-1:2012 本品 適合 ロ-2 7.1.3 表示の耐久性 IEC 60601-1:2012 本品 適合 ロ-2 8.7.4.6 接触電流 IEC 60601-1:2012 本品 適合 ロ-2 8.7.4.7 患者漏れ電流 IEC 60601-1:2012 本品 適合 ロ-2 8.7.4.8 患者測定電流 IEC 60601-1:2012 本品 適合 ロ-2 8.8.3 耐電圧 IEC 60601-1:2012 前世代品 適合 ロ-1 8.8.4.1 ボールプレッシャ試験 IEC 60601-1:2012 前世代品 適合 ロ-1 9.4.2.1 輸送姿勢時の不安定性 IEC 60601-1:2012 本品 適合 ロ-2 9.4.2.2 輸送時以外の不安定性 IEC 60601-1:2012 前世代品 適合 ロ-1 11.1 医用電気機器における過度の温度 IEC 60601-1:2012 本品 適合 ロ-2 11.6.5 水又は微粒子状物質の侵入 IEC 60601-1:2012 本品 適合 ロ-2 11.6.6 清掃及び消毒 IEC 60601-1:2012 前世代品 適合 ロ-1 11.8 電源供給の遮断 IEC 60601-1:2012 本品 適合 ロ-2 13.2.2 電気的単一故障状態 IEC 60601-1:2012 本品 適合 ロ-2 15.3.2 押付け試験 IEC 60601-1:2012 前世代品 適合 ロ-1 15.3.3 衝撃試験 IEC 60601-1:2012 前世代品 適合 ロ-1 15.3.4 落下試験 IEC 60601-1:2012 本品 適合 ロ-2 15.3.6 成形応力解放試験 IEC 60601-1:2012 前世代品 適合 ロ-1 AC アダプタの電気的安全性に関しては、同品の IEC 60601-1:2005 への適合証明書(別添資料:ロ- 3)および試験成績書に基づき、本試験(別添資料:ロ-1)の中で IEC60601-1:2012 により確認されて いる。 AC アダプタに関する試験項目と試験結果を以下に示す。
50 図表 4-3 AC アダプタに関する試験項目と試験結果 試験項目 試験方法 結果 8.4.3 プラグの残留電圧 IEC 60601-1:2005 適合 8.7.4.6 接触電流 IEC 60601-1:2005 適合 8.8.3 耐電圧 IEC 60601-1:2005 適合 8.8.4.1 ボールプレッシャ試験 IEC 60601-1:2005 適合 13.2 単一故障状態 IEC 60601-1:2005 適合 15.3.2 押付け試験 IEC 60601-1:2005 適合 15.3.3 衝撃試験 IEC 60601-1:2005 適合 15.3.4 落下試験 IEC 60601-1:2005 適合 15.3.6 成形応力解放試験 IEC 60601-1:2005 適合 15.5.1.2 変圧器、短絡試験 IEC 60601-1:2005 適合 15.5.1.3 変圧器、過負荷試験 IEC 60601-1:2005 適合 15.5.2 変圧器、耐電圧 IEC 60601-1:2005 適合 以上の結果より、本品は医用電気機器に求められる電気的安全性の規格に適合し、電気的安全性が担 保されていることを確認した。
51 4.1.2.2. 電磁両立性 別添資料:ロ-4 本品の電磁両立性を確認するため、IEC 60601-1-2:2014 に準拠した試験を実施した。試験は本品と同 一の機器で実施した。 試験項目と結果を以下に示す。本品は医用電気機器に求められる電磁両立性の規格に適合し、電磁両 立性が担保されていることを確認した。 図表 4-4 エミッション 試験項目 試験方法 試験結果 別添資料 放射妨害 CISPR 11:2009+A1:2010 適合 ロ-4 伝導妨害 CISPR 11:2009+A1:2010 適合 ロ-4 電圧変動/フリッカ IEC 61000-3-3:2013 適合 ロ-4 図表 4-5 イミュニティ 試験項目 試験方法 試験結果 別添資料 静電気放電 IEC 61000-4-2:2008 適合 ロ-4 放射RF 電磁界 IEC 61000-4-3:2006+A1:2007 +A2:2010 適合 ロ-4 電源周波数磁界 IEC 61000-4-8:2009 適合 ロ-4 電気的高速過渡現象/バースト IEC 61000-4-4:2012 適合 ロ-4 サージ(ライン間/ライン-接地間) IEC 61000-4-5:2005 適合 ロ-4 RF 電磁界によって誘導される伝導妨害 IEC 61000-4-6:2013 適合 ロ-4 電圧ディップ、短時間中断及び電圧変動 IEC 61000-4-11:2004 適合 ロ-4
52 4.1.3. 生物学的安全性 別添資料:ロ-5~7 総括 本品は患者の血液、体液、粘膜への接触は意図しておらず、健常皮膚のみへの接触を意図する。しか しながら本品は装着型の機器であるため、皮膚に接触する可能性がある部位について生物学的安全性 を評価することとし、ISO 10993-1:2009 に準拠した試験を実施した。 本品は皮膚に対する表面接触機器であり、接触期間は長期的接触である。これより、細胞毒性、感作 性、刺激性を評価することとした。 ISO 10993-1:2009 は、JIS T 0993-1:2012「医療機器の生物学的評価-第 1 部:リスクマネジメン トプロセスにおける評価及び試験」に対応する国際規格であり、「医療機器の製造販売承認申請等に必 要な生物学的安全性評価の基本的考え方について(厚生労働省医薬食品局、薬食機発0301 第 20 号、 平成24 年 3 月 1 日)」の中で示されている規格であることから、現時点における科学・技術知識の水 準に照らし、実施した試験項目での生物学的安全性の評価は必要かつ十分であると判断した。 試験項目 試験方法 試験結果 実施施設 別添資料 細胞毒性試験 ISO 10993-5:2009 適合 一般社団法人食品薬品安 全センター 秦野研究所 ロ-5 感作性試験 ISO 10993-10:2010 ISO10993-12:2012 適合 一般社団法人食品薬品安 全センター 秦野研究所 ロ-6 刺激性試験 (皮内反応試験) ISO 10993-10:2010 ISO10993-12:2012 適合 一般社団法人食品薬品安 全センター 秦野研究所 ロ-7 上記のとおり、本品に細胞毒性、感作性、刺激性は確認されず、本品の生物学的安全性が担保されて いることを確認した。 なお、試験実施施設である一般社団法人食品薬品安全センター 秦野研究所は、独立行政法人医薬 品医療機器総合機構により、「医療機器の安全性に関する非臨床試験の実施の基準に関する省令」(平 成 17 年厚生労働省第 37 号)への適合が確認されている。また、動物を用いた試験については、 ISO10993-2 等に基づき、動物福祉に配慮して実施された。
53 4.1.3.1. 試験試料について 細胞毒性、感作性、刺激性の各試験は、本品の装着時において常に皮膚に触れる可能性がある部位(身 体装着部)について、接触面積比に応じて調製した試料を用いて実施した。 身体装着部とした部位を以下に示す。 図表 4-6 身体装着部 各部位を接触部位の表面積比を反映するよう混合した。これらの混合比は接触面積の比率と比較して ±5%の誤差に収まっており、本品を装着した際の接触を十分に反映していると判断した。
54 図表 4-7 試料調製に用いた部品と混合比 表面積 (mm2) 比率 (接触面積比率±5%以内) 写真 ① COVER.TEMPLE-L 3703 12% ② COVER.TEMPLE-R 3703 12% ③ TEMPLE-L (半分にカット) 2230 7% ④ TEMPLE-R (半分にカット) 2230 7% ⑤ NOSE.PAT 366 1% ⑥ EAR.HOOK-BASE 612 2% ⑦ EAR.HOOK 694 2% ⑧ COVER.REFLECTOR (半分にカット) 1125 4% ⑨ FILM 378 1% ⑩ CASE.TRANSMITER (半分にカット) 2396 8% ⑪ CASE.UNIT (半分にカット) 2387 8% ⑫ COVER.FILTER 375 1% ⑬ SEAL BLINDFOLD 133 1% ⑭ CABLE φ4.8×20cm 6032 19% ⑮ FERRITE CORE (1.5個) 4976 16% 材料名
55 4.1.3.2. 細胞毒性試験の要約 別添資料:ロ-5 細胞毒性試験はISO 10993-5:2009 を参照し、V79 細胞を用いて実施した。試験試料は皮膚に接触する 部位の部品を接触面積比に応じて混合したものを細断し、M05 培地で抽出した。試験試料は最終製品で の皮膚接触を反映しており、またV79 細胞を用いる抽出法で一般的な手法を用いていることから、妥当 であると判断した。 試験の概要と結果を下表に示す。試験試料は、細胞のコロニー形成能を半減させるような細胞毒性を 示さなかったことから、本品の装用において細胞毒性に関する生物学的安全性は担保されていると考え る。 図表 4-8 細胞毒性試験の概要 項目 内容 試験試料 皮膚に接触する部位の部品を接触面積比に応じて混合したものを細断 陰性及び陽性対照試料 陰性対照試料:高密度ポリエチレンシート(ロット番号:C-121D) 陽性対照試料A:0.1%ジエチルジチオカルバミン酸亜鉛(ZDEC)含有ポリ ウレタンフィルム(ロット番号:A-152K) 陽性対照試料 B:0.25%ジブチルジチオカルバミン酸亜鉛(ZDBC)含有ポ リウレタンフィルム(ロット番号:B-161K) 試料及び対照試料の滅 菌方法 エチレンオキサイドガス(EOG、40℃、6 時間) 試験方法 ISO10993-5 に準拠し、抽出法によるコロニー形成法を用いた。試験試料を 血清添加培地で抽出し、播種した細胞に添加し、培養後のコロニー形成能を 評価した。各条件は以下の通り。 使用した細胞:V79 細胞 培地:10%ウシ胎児血清添加イーグル最小必須培地 抽 出 液 の 調 製 方 法 :5% ウ シ 胎 児 血 清 お よ び ピ ル ビ ン 酸 ナ ト リ ウ ム (1mmol/L)添加イーグル最小必須培地で抽出 試料/培地比:6 cm2/mL(試験試料)、0.1 g/mL(対照試料) 抽出時間:24 時間(炭酸ガス培養器中、37℃) 試験結果 試験試料および陰性対照試料のIC50:阻害なし 陽性対照試料A の IC50:1.4% 陽性対照試料B の IC50:49% 陽性対照物質(ZDBC)の細胞毒性強度:3.1 µg/mL その他、試験成立条件をすべて満たした 結論 試験試料は、細胞のコロニー形成能を半減させるような細胞毒性を示さなか った。
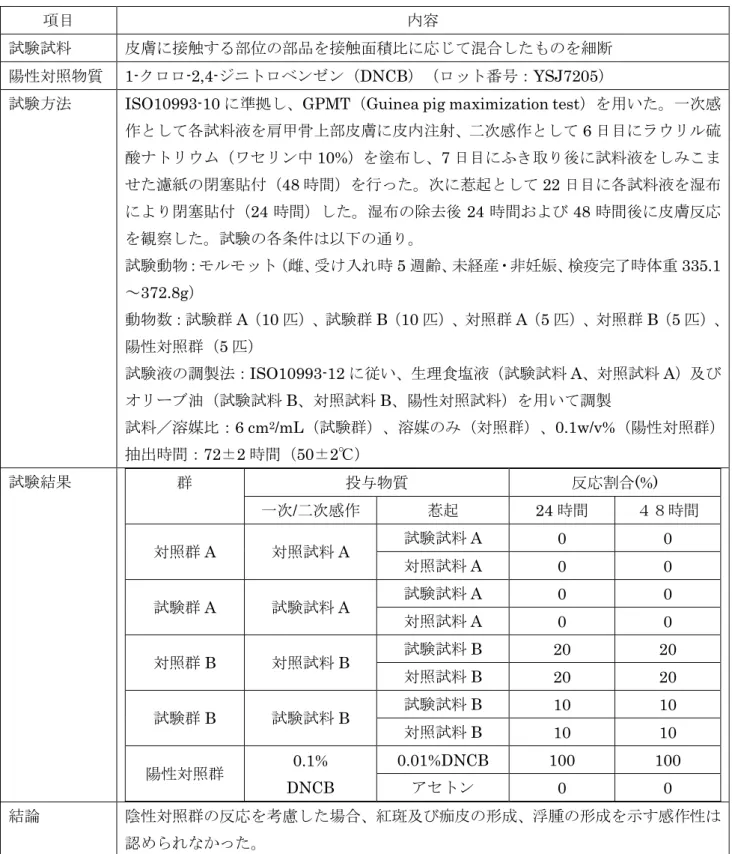
56 4.1.3.3. 感作性試験の要約
別添資料:ロ-6 感作性試験は、ISO 10993-10:2010 を参照し、GPMT(Guinea pig maximization test)によって実施 した。試験試料は皮膚に接触する部位の部品を接触面積比に応じて混合したものを細断し、ISO 10993-12:2012 を参照して調製した。試験試料は最終製品での皮膚接触を反映していることから、妥当であると 判断した。 試験の概要と結果を図表 4-9 に示す。試験試料は、対照群の反応を考慮した場合、紅斑及び痂皮の形 成、浮腫の形成を示す感作性は認められなかったと考えられることから、本品の装用において感作性に 関する生物学的安全性は担保されていると考える。
57
図表 4-9 感作性試験の概要
項目 内容
試験試料 皮膚に接触する部位の部品を接触面積比に応じて混合したものを細断 陽性対照物質 1-クロロ-2,4-ジニトロベンゼン(DNCB)(ロット番号:YSJ7205)
試験方法 ISO10993-10 に準拠し、GPMT(Guinea pig maximization test)を用いた。一次感 作として各試料液を肩甲骨上部皮膚に皮内注射、二次感作として6 日目にラウリル硫 酸ナトリウム(ワセリン中10%)を塗布し、7 日目にふき取り後に試料液をしみこま せた濾紙の閉塞貼付(48 時間)を行った。次に惹起として 22 日目に各試料液を湿布 により閉塞貼付(24 時間)した。湿布の除去後 24 時間および 48 時間後に皮膚反応 を観察した。試験の各条件は以下の通り。 試験動物:モルモット(雌、受け入れ時5 週齢、未経産・非妊娠、検疫完了時体重 335.1 ~372.8g) 動物数:試験群A(10 匹)、試験群 B(10 匹)、対照群 A(5 匹)、対照群 B(5 匹)、 陽性対照群(5 匹)
試験液の調製法:ISO10993-12 に従い、生理食塩液(試験試料 A、対照試料 A)及び オリーブ油(試験試料B、対照試料 B、陽性対照試料)を用いて調製 試料/溶媒比:6 cm2/mL(試験群)、溶媒のみ(対照群)、0.1w/v%(陽性対照群) 抽出時間:72±2 時間(50±2℃) 試験結果 群 投与物質 反応割合(%) 一次/二次感作 惹起 24 時間 48時間 対照群A 対照試料A 試験試料A 0 0 対照試料A 0 0 試験群A 試験試料A 試験試料A 0 0 対照試料A 0 0 対照群B 対照試料B 試験試料B 20 20 対照試料B 20 20 試験群B 試験試料B 試験試料B 10 10 対照試料B 10 10 陽性対照群 0.1% DNCB 0.01%DNCB 100 100 アセトン 0 0 結論 陰性対照群の反応を考慮した場合、紅斑及び痂皮の形成、浮腫の形成を示す感作性は 認められなかった。
58 4.1.3.4. 刺激性試験の要約 別添資料:ロ-7 刺激性試験は、ISO 10993-10:2010 を参照し、皮内反応試験によって実施した。試験試料は皮膚に接 触する部位の部品を接触面積比に応じて混合したものを細断し、ISO 10993-12:2012 を参照して調製し た。試験試料は最終製品での皮膚接触を反映していることから、妥当であると判断した。 試験の概要と結果を下表に示す。試験試料は、紅斑及び痂皮の形成、浮腫の形成を示す刺激性は認めら れなかったことから、本品の装用において刺激性に関する生物学的安全性は担保されていると考える。 図表 4-10 刺激性試験(皮内反応試験)の概要 項目 内容 試験試料 皮膚に接触する部位の部品を接触面積比に応じて混合したものを細断 試験方法 ISO10993-10 に従い、皮内反応試験を用いた。試験試料から生理食塩水及び 植物油を用いて抽出した試験液を、6 匹(各群 3 匹)のウサギの背部に皮内 投与し、投与部位を 72 時間後まで観察して組織障害性や炎症誘発性の有無 を確認した。各条件は以下の通り。 試験動物:日本白兎(雄、受け入れ時 17 週齢、検疫完了時体重 2.729~ 3.010kg) 動物数:試験/対照群A(3 匹)、試験/対照群 B(3 匹) 試験液の調製法:ISO10993-12 に従い、生理食塩液(試験/対照群 A)及び ゴマ油(試験/対照群B)を用いて調製 試料/溶媒比:6 cm2/mL 抽出時間: 72±2 時間(50±2℃) 試験結果 いずれの試験液においても皮内反応は観察されず(1 時間後、24 時間後、48 時間後、72 時間後) 結論 紅斑及び痂皮の形成、浮腫の形成を示す刺激性は認められなかった。
59 4.1.4. 放射線に関する安全性 別添資料:ロ-1(ANNEX D)、ロ-8、9 総括 本品は、特性として非電離放射線であるレーザ光を目に向かって長時間照射することを意図した装 置である。このレーザ光の安全性について評価を行うため、IEC 60825-1: 2007 に準拠した試験を実施 した。 IEC 60825-1: 2007 は JIS C 6802:2011「レーザ製品の安全基準」に対応する国際規格であり、現時 点における科学・技術知識の水準に照らし、実施した試験項目でレーザ製品の安全性に関する評価は 必要かつ十分であると判断した。 加えて本品は、消費生活用製品安全法における携帯用レーザ応用装置として同法への適合が必要と なることから、適合性検査を実施した。 さらに、米国FDA によるレーザ規制である 21CFR1040.10 は、IEC 60825-1 と同様に波長と使用 時間に応じたレーザ出力の最大値を設定しているが、その数値がIEC 60825-1 と異なる(小さい)。 そのため、同規制におけるクラス分類についても確認した。 試験項目 試験方法 試験結果 実施施設 別添資料 放射線に関す る安全性 IEC 60825-1: 2007 適合 テュフラインランド ジャパン株式会社 ロ-1 (ANNEX D) 消費者生活用製品安全法 適合性検査 適合 株式会社UL Japan ロ-8 FDA 21CFR1040.10 ク ラ ス I レーザ 株式会社UL Japan ロ-9 上記のとおり、本品はIEC60825-1 におけるクラス 1 レーザ機器に分類され、合理的に予見可能な 条件下で安全性が担保されていることを確認した。本規格への適合は CB 証明書に含まれる。また、 消費者生活用製品安全法(携帯用レーザ応用装置)について第三者機関により適合性が確認され、PSC マークを表示している。さらに、IEC60825-1 よりも厳しい規準である FDA 21CFR1040.10 において もクラスI レーザに分類されることを確認した。 以上により、本品の放射線に関する安全性は担保されていると判断した。
60 4.1.4.1. レーザ製品に関する安全性試験(IEC 60825-1) 別添資料:ロ-1(Annex D) 放射線に関する安全性に係る試験をIEC 60825-1: 2007 に準拠して実施した。同規格の最新版は IEC 60825-1:2014 であるが、IEC 60601-1:2012 において参照される規格が IEC 60825-1: 2007 であるため、 こちらを参照した。クラス1 レーザに関する要求事項や被ばく放出限界は両規格で同一であることから、 本規格の参照は現時点における科学・技術知識の水準を反映していると判断した。なお、後述する消費生 活用製品安全法の適合性検査において、IEC 60825-1:2014 に相当する JIS C 6802:2014 にも適合してい ることを確認している。 試験は本品の前世代品を用いて実施した。前世代品と本品においてレーザモジュールやレーザドライ バの仕様、レーザ駆動に関する電気回路は同一であり、これらに影響を与える変更はなかったことから、 検体の選択として妥当であり、前世代品の結果は本品へ外挿可能であると判断した。 試験と要求事項の項目および結果を以下に示す。レーザ製品の安全基準に適合したことを確認し、放 射線に関する安全性が担保されていると判断した。 図表 4-11 レーザ製品に関する安全性試験(IEC 60825-1: 2007)の概要 試験項目 結果 4. 技術的仕様 4.1 一般注意 適合 4.2 保護きょう体 適合 4.10 観察用光学装置 適合 4.11 走査に対する安全防御 適合 4.13 環境条件 適合 4.14 その他の危険性に対する保護 適合 5. ラベル表示 5.1 一般事項 適合 5.2-6 説明ラベル上の表記 適合 5.8 放射出力及び規格情報 適合 6. その他の情報に関する要求事項 6.1 使用者に対する情報 適合 7. 特定のレーザ製品に関する追加要求事項 7.2 医用レーザ製品 適合 8. クラス分け 8.2 クラス分けに対する責任 適合 8.3 クラス分けの規則 適合 9. 被ばく放出レベルの決定 9.2 レーザ放射の測定 適合 9.3 測定光学系 適合
61 4.1.4.2. 消費者生活用製品安全法における適合性検査(携帯用レーザ応用装置) 別添資料:ロ-8 消費生活用製品安全法では、一般消費者の生命又は身体に対する危害の発生の防止を図るため、特定 製品の製造及び販売を規制している。本品は携帯用レーザ応用装置として同法の特別特定製品にあたり、 第三者の登録認証機関による適合性検査に合格する必要がある。適合性検査では、製品が経済産業省関 係特定製品の技術上の基準等に関する省令に定められた基準に合致するか(例えば、レーザ光を目に向 かって長時間照射することを意図した装置ではJIS C 6802:2014 におけるクラス 1 レーザであることが 求められる)のほか、検査設備や品質管理についても基準を満たす必要がある。 試験は本品の前世代品を用いて実施した。前世代品はレーザの出力およびその他レーザの安全に関す る仕様はまったく同一であり、適合性検査の結果は現在においても有効である。そのため、検体の選択と して妥当であると判断した。 下表に、本品の型式区分および製品に関する試験結果を示す。 図表 4-12 本品の携帯用レーザ応用装置としての型式の区分 要素 区分 種類 装置の設計上又は機能上長時間レーザ光を目に向け て照射することを目的として設計したもの 形状 その他のもの 全長(本体最長部分) 8 センチメートル以上のもの レーザ光が放出状態にあることを確認できる機 能 ないもの 放出状態維持機能 あるもの レーザ光の種類 パルスのもの レーザ光の色 その他のもの 表示する文字または図形 振動装置を用いて点以外の図形を表示できるもの 図表 4-13 試験結果 放射接続時間 最悪条件における放射パワー クラス1 の被ばく放出限界 青色 3 x 104 sec P = 9.22 x 10-6 W P = 8.15 x 10-5 W 緑色 3 x 104 sec P = 4.56 x 10-6 W P = 3.9 x 10-4 W 赤色 3 x 104 sec P = 4.79 x 10-6 W P = 3.9 x 10-4 W クラス1 の被ばく放出限界に対しての複数波長の重畳性 Σ(各波長におけるレーザ放射量の AEL に対する比率)= (9.22 x 10-6 W) / (8.15 x 10-5 W) + (4.56 x 10-6 W) / (3.9 x 10-4 W) + (4.79 x 10-6 W) /(3.9 x 10-4 W)= 0.137 < 1 複数波長の重畳性を考慮したうえで、単一故障模擬による最悪状態でも、放射パワーは、クラス1の 被ばく放出限界を下回っている。この試験結果を含めて消費生活用製品安全法への適合が確認され、本 体にはPSC マークを表示している。
62 4.1.4.3. 米国 FDA におけるレーザ規制(21CFR1040.10) 別添資料:ロ-9 米国においては、FDA(食品医薬品局)がレーザ製品に関する規制を担っている。規制の内容を定め た21CFR1040.10 では、IEC60825-1 等と同様にレーザの種類、波長や使用方法、使用時間などに基づ きAEL(被ばく放射限界)が定められ、それに基づくクラス分けが行われるが、そのクラスの定義や AEL の算出方法などは異なっている。特に、クラスIIa/II の定義においては、"chronic viewing hazard"とし て慢性的な危険を考慮しており、長期的に使用することを意図している本品では同規制も考慮すべきで あると考えた。なお、FDA におけるクラスの定義は次の通りとなる。
図表 4-14 米国 FDA の規制(21CFR1040.10)におけるクラスの定義
クラス 定義
クラスI Class I levels of laser radiation are not considered to be hazardous. (クラスI のレーザ放射は危険とはみなさない)
クラスIIa Class IIa levels of laser radiation are not considered to be hazardous if viewed for any period of time less than or equal to 1 * 103 seconds but are considered to
be a chronic viewing hazard for any period of time greater than 1 * 103 seconds.
(クラスIIa のレーザ放射は 1,000 秒以下の暴露では危険とはみなさないが、それ を上回る場合は慢性的危険があるとみなす)
クラスII Class II levels of laser radiation are considered to be a chronic viewing hazard. (クラスII のレーザ放射は慢性的危険があるとみなす) 21CFR1040.10 のクラス分けについては、前世代品を用いて消費生活用製品安全法の適合性検査を実 施した際の試験結果を基に実施した。測定結果及び算出結果は以下の通りである。 図表 4-15 本品に関する測定/算出結果 項目 値 走査パラメータ 水平 タイムサイクル µsec オン時間 µsec デューティー比 垂直 タイムサイクル msec オン時間 msec デューティー比 計測出力パワー 青(波長:466nm) nW 緑(波長:521nm) nW 赤(波長:634nm) nW 放射時間 単一パルス sec 垂直走査あたり sec 最大放射時間 sec
63 これらの数値を基に算出した被ばく放出(AE)と定められた被ばく放出限界(AEL)を次の表に示す。 図表 4-16 各放射時間による被ばく放出と被ばく放出限界 放射時間 AE AEL 安全率 青 単一パルス Q = 2.00 x 10-7 J 垂直走査あたり Q = 2.57 x 10-5 J 最大放射時間 P = 3.9 x 10-7 W 緑 単一パルス Q = 2.00 x 10-7 J 垂直走査あたり Q = 2.57 x 10-5 J 最大放射時間 P = 3.9 x 10-7 W 赤 単一パルス Q = 2.00 x 10-7 J 垂直走査あたり Q = 2.57 x 10-5 J 最大放射時間 P = 3.9 x 10-7 W 以上の結果において、各色の重畳効果を考慮した場合( + + = 0.847)においてもク ラスI の被ばく放出限界を超えないことを確認した。
64 4.1.5. 機械的安全性 別添資料:ロ-2(ANNEX B)、ロ-10、11 総括 本品の機械的安全性を評価するため、IEC 60601-1-11:2015 及び ISO 15004-1:2006 に準拠した試 験を実施した。 IEC 60601-1-11:2015 はホームヘルスケア環境で使用する医用電気機器に関する国際規格であり、 ISO 15004-1:2006 は JIS T 15004-1:2013「眼光学機器−基本的要求事項及びその試験方法−第 1 部: 全ての眼光学機器に適用される一般的要求事項」に対応する国際規格である。現時点における科学・技 術知識の水準に照らし、実施した試験項目での機械的安全性の評価は必要かつ十分であると判断した。 試験項目 試験方法 試験結果 実施施設 別添資料 機 械的安 全性 ホームヘルスケア環境で用いられる医用 電気機器 IEC 60601-1-11:2015 適合 テ ュ フ ラ イ ン ラ ン ド ジ ャ パ ン株式会社 ロ-2 (Annex B) 眼用光学機器 ISO 15004-1:2006 適合 テ ュ フ ラ イ ン ラ ン ド ジ ャ パ ン株式会社 ロ-10、11 上記のとおり、本品が機械的安全性に関する上記規格に適合していることを確認し、本品の機械的 安全性が担保されていると判断した。なお、IEC60601-1-11 への適合は IEC60601-1 に関する CB 証 明書に含めて確認されている。
65 4.1.5.1. ホームヘルス環境で用いられる医用電気機器 別添資料:ロ-2 (Annex B) 機械的安全性の評価を行うため、ホームヘルス環境で用いられる医用電気機器に求められる安全性と して IEC60601-1-11:2015 に準拠した試験を実施した。IEC 60601-1-11:2015 には使用方法に関する項 目も含まれるが、本項でまとめて記載する。 IEC60601-1-11 の試験は IEC60601-1 の一部として実施されており、本品の前世代品を用いて実施し たのち(別添資料:ロ-1 Annex C)、すべての項目を本品と同一の機器で再試験している(別添資料: ロ-2 Annex B)。本品と同一の機器を試験しており、検体の選択として妥当であると判断した。 試験項目と結果を以下に示す。 図表 4-17 IEC 60601-1-11 の試験項目と結果 試験項目 試験条件 結果 4.2.2 使用から次の使用までの輸送環境及び保管 環境の条件 - 適合 4.2.3.1 環境的操作条件/連続的な操作条件 - 適合 8.3.1 ME 機器の中への水または粒子状物質の侵入 IEC 60529:1989 +AMD1:1999+AMD2:2013 適合 10.1.2 移動中操作可能でない ME 機器の機械的強度に対する要求事項 10.1.2 a 衝撃試験 IEC 60068-2-27:2008 適合 10.1.2 b 広帯域不規則振動試験 IEC 60068-2-64:2008 適合 以上より、本品はホームヘルス環境で用いられる医用電気機器の規格に適合したことを確認した。
66 4.1.5.2. 眼用光学機器 別添資料:ロ-10、11 機械的安全性の評価を行うため、眼用光学機器に求められる安全性としてISO 15004-1:2006 に準拠し た試験を実施した。ISO 15004-1:2006 には電気的安全性に関する項目他も含まれるが、本項でまとめて 記載する。 ISO 15004-1 の試験は、本品の前世代品を用いて実施(別添資料:ロ-10)したのち、本品と同一の機 器で改めて実施した(別添資料:ロ-11)。ただし、一部の項目については前世代品との差分なしとの判 断の元、改めての実施を省略した。本品と同一の機器を試験しており、検体の選択として妥当であると判 断した。 試験項目と結果を以下に示す。 図表 4-18 ISO15004-1 の試験項目 試験項目 結果 別添資料 4.1 概要 適合 ロ-11 4.2 設計 適合 ロ-10 4.3 性能 適合 ロ-10 4.5 材料 適合 ロ-10 4.6 汚染物からの保護 適合 ロ-10 4.7 目盛及び表示 適合 ロ-11 4.8 熱的ハザード 適合 ロ-11 4.9 機械的ハザード 適合 ロ-11 5.1 使用環境条件 適合 ロ-11 5.2 保管条件 適合 ロ-11 5.3 輸送条件 適合 ロ-10 6.1 電気的安全性 適合 ロ-11 6.2 IEC60601-1 の不適用条項 適合 ロ-10 7.1 可燃性 適合 ロ-10 7.2 表面温度 適合 ロ-10、11 7.3 環境条件 適合 ロ-11 7.4 電気的安全性の確認 適合 ロ-10、11 8.1 附属文書 適合 ロ-10、11 8.2 表示 適合 ロ-10、11 以上より、本品は眼用光学機器に求められる安全性の規格に適合したことを確認した。
67 4.1.6. 安定性及び耐久性 本品を構成する制御ボックス及びアイウェア投影部の安定性について以下に示す。 制御ボックスおよびアイウェア投影部のうち電気機器部分については、特定の貯蔵方法によらなけれ ばその品質を確保することが困難である機器又は経時的に品質の低下をもたらす機器ではないため、有 効期間を設定していない。 アイウェア投影部のうち、身体接触部である樹脂加工品は、一般名レベルにおいて安定性についての知 見がある原材料を使用しており、樹脂劣化特性の試験(ヒートサイクル試験)を実施した結果、劣化が見 られなかったことから、自己宣言書の通り、有効期間は設定していない。
68 4.1.7. 性能に関する試験 別添資料:ロ-12~21 総括 本品の性能については、参照可能な規格・基準等が存在しないため、現時点における科学・技術知識 の水準に照らし定めた社内規格に基づき試験を実施した。 本品の性能について実施した設計検証の結果を下表に示す。 試験項目 試験方法 試験結果 実施施設 別添資料 性能 レーザ出力 全白画像を表示させ、光パ ワーメータにより出力を測 定する。 適合 ミツミ電機株式会社 ロ-12、13 レーザ波長 及びホワイ トバランス 全白画像を表示させ、光パ ワーメータによりホワイト バランスを測定する。 適合 ミツミ電機株式会社 ロ-14、15 画角 青画面を表示させ、投影画 像取得用カメラにより画 角、アスペクト比を測定す る。 適合 ミツミ電機株式会社 ロ-16、17 投影解像度 オシロスコープにより、プ ロジェクタ駆動の同期信号 (ピクセルクロック、水平 同期信号、垂直同期信号) の周波数を測定する。 適合 ミツミ電機株式会社 ロ-18、19 カメラ信号 解像度 オシロスコープにより、カ メラ撮像信号の同期信号 (ピクセルクロック、水平 同期信号、垂直同期信号) の周波数を測定する。 適合 ミツミ電機株式会社 ロ-20、21 上記のとおり、本品の性能に関する上記規格に適合していることを確認し、本品の性能が担保され ていると判断した。 なお、本品には上記のほかにレーザ仕様に関する規格を定めているが、これらは製品仕様により担 保されている。
69 4.1.7.1. レーザ出力 別添資料:ロ-12、13 目的: 画像を投影するために適正な範囲のレーザ出力が得られていることを確認する。 試験方法および適合基準(社内規格): 外部入力モードを用いて全白画面を表示し、光パワーメータによりレーザ出力を測定する。RGB3 波長 合計の出力が環境温度5℃および 39℃において 0.316µW+15%/-30%の範囲内に入っていることを検証 する。なお、外部入力モードは試験や製造のためのモードであり、患者は操作できない。 試験検体: 本品と同一の機器(シリアル番号:SAMPLE021、SAMPLE034、SAMPLE041)を用いて実施した。 試験結果: 試験結果は下表のとおりである。いずれも規格範囲内であり、結果は適合であった。 図表 4-19 レーザ出力に関する試験結果 シリアル番号 計測結果(5℃) 計測結果(39℃) 結果 SAMPLE021 0.299µW 0.305µW 適合 SAMPLE034 0.297µW 0.320µW 適合 SAMPLE041 0.346µW 0.317µW 適合
70 4.1.7.2. レーザ波長及びホワイトバランス 別添資料:ロ-14、15 目的: 画像を投影するために(レーザ波長によらず)適正なホワイトバランスが得られていることを確認する。 試験方法および適合基準(社内規格): レーザ波長については、下記の規格範囲内にあることを仕様により担保している。 図表 4-20 レーザ波長の規格 ピーク発振波長(nm) 最小 最大 赤色 631 641 緑色 513 523 青色 460 470 外部入力モードを用いて全白画面を表示し、光パワーメータによりホワイトバランスを測定する。環境 温度5℃および 39℃において X: 0.33±0.08、Y: 0.33±0.08 の範囲内に入っていることを検証する。な お、外部入力モードは試験や製造のためのモードであり、患者は操作できない。 試験検体: 本品と同一の機器(シリアル番号:SAMPLE021、SAMPLE034、SAMPLE041)を用いて実施した。 試験結果: 試験結果は下表のとおりである。いずれも規格範囲内であり、結果は適合であった。 図表 4-21 ホワイトバランスに関する試験結果 シリアル番号 計測結果(5℃) 計測結果(39℃) 結果 SAMPLE021 X: 0.339 Y: 0.312 X: 0.306 Y: 0.308 適合 SAMPLE034 X: 0.362 Y: 0.309 X: 0.354 Y: 0.322 適合 SAMPLE041 X: 0.377 Y: 0.323 X: 0.334 Y: 0.323 適合
71 4.1.7.3. 画角 別添資料:ロ-16、17 目的: 画像を投影する際に適正な画角(水平視野角およびアスペクト比)が得られていることを確認する。 試験方法および適合基準(社内規格): 外部入力モードを用いて全青画面を表示させ、投影画像取得用カメラにより画角、アスペクト比を測定 する。大気圧下および減圧状態(800hPa 以下)で計測し、画角(水平視野角)、アスペクト比 16:9 が適 合基準の範囲内に入ることを検証する。なお、外部入力モードは試験や製造のためのモードであり、患者 は操作できない。 画角及びアスペクト比は圧力によって変化するため、常圧時と減圧時のそれぞれにおいて基準を定めた。 図表 4-22 画角の基準値 常圧 減圧(800hPa) 画角 26°±10% 26°±15% アスペクト比(16:9) 1.78±10% 1.78±20% 試験検体: 本品の前世代品(シリアル番号:#240、#241、#242)を用いて実施した。投影機能に関する仕様は全く 同一であり、検体の選択は妥当であると判断した。 試験結果: 試験結果は下表のとおりである。試験前/試験後が常圧、試験開始時/終了時が減圧の状態である。いず れも規格範囲内であり、結果は適合であった。 図表 4-23 画角(水平視野角)に関する試験結果 シリアル番号 試験前/試験後 試験開始時/終了時 判定 #240 26.16 / 26.13 27.75 / 27.83 適合 #241 26.13 / 26.33 28.10 / 27.91 適合 #242 26.22 / 26.27 28.13 / 27.95 適合 図表 4-24 画角(アスペクト比)に関する試験結果 シリアル番号 試験前/試験後 試験開始時/終了時 判定 #240 1.77 / 1.80 1.95 / 1.96 適合 #241 1.77 / 1.77 1.94 / 1.95 適合 #242 1.78 / 1.78 1.96 / 1.97 適合
72 4.1.7.4. 投影解像度 別添資料:ロ-18、19 目的: 画像を投影するにあたり、適正な解像度が得られることを確認する。 試験方法と適合基準(社内規格): オシロスコープにより、プロジェクタ駆動の同期信号(ピクセルクロック、水平同期信号、垂直同期信号) の周波数を測定し、投影画像解像度の規格値を上回っている(表示に十分な解像能力を有している;フレ ームレートについては50 fps を上回っている)ことを検証する。 図表 4-25 投影解像度の規格項目 項目 算出方法 規格値 水平解像度 水平同期信号の周期/ピクセルクロックの周期 1280 dot 垂直解像度 垂直同期信号の周期/水平同期信号の周期 720 line フレームレート 垂直同期信号の周期 60 fps 試験検体: 本品と同一の機器(シリアル番号:SAMPLE021、SAMPLE034、SAMPLE041)を用いて実施した。 試験結果: 試験結果は下表のとおりである。いずれも適合基準を満たし、結果は適合であった。 図表 4-26 投影解像度に関する試験結果 シリアル番号 温度 水平解像度 垂直解像度 フレームレート 判定 SAMPLE021 0℃ 1824.8 928.2 61.99 適合 39℃ 1836.7 922.9 61.93 適合 SAMPLE034 0℃ 1817.2 927.6 62.30 適合 39℃ 1825.4 924.1 62.25 適合 SAMPLE041 0℃ 1821.6 928.0 62.12 適合 39℃ 1821.0 929.0 62.06 適合
73 4.1.7.5. カメラ信号解像度 別添資料:ロ-20、21 目的: 画像を投影するにあたり、映像の元となるカメラの撮像が適正な解像度であることを確認する。 試験方法と適合基準: オシロスコープにより、カメラ撮像信号の同期信号(ピクセルクロック、水平同期信号、垂直同期信号) の周波数を測定し、水平解像度(水平同期信号の周期/ピクセルクロックの周期)、垂直解像度(垂直同 期信号の周期/水平同期信号の周期)が以下の規格値を満たす(これらを満たす十分な解像度がある)こ とを検証する。 図表 4-27 カメラ信号解像度の規格値 カメラ倍率 フレームレート 水平解像度 垂直解像度 0.5 倍 30 fps±2% 1280 dot 720 line 1.0 倍 15 fps±2% 1280 dot 720 line 2.0 倍 15 fps±2% 640 dot 360 line 試験検体: 本品と同一の機器(シリアル番号:SAMPLE021)を用いて実施した。 試験結果: 試験結果は下表のとおりである。いずれも適合基準を満たし、結果は適合であった。 図表 4-28 カメラ信号解像度に関する試験結果 倍率 フレームレート 水平解像度 垂直解像度 判定 0.5 倍 29.6 1296.0 720.50 適合 1.0 倍 15.24 1296.0 720.05 適合 2.0 倍 15.24 1296.0 720.05 適合
74 4.1.7.6. その他のレーザに関する規格 本品の光源であるレーザの仕様について、下表に示す規格を設定した。これらの項目はレーザモジュ ールを含めた製品仕様により担保されている。 図表 4-29 レーザ仕様に関する規格 項目 内容 レーザ発振動作 パルス発振 レーザの種類の分類 半導体レーザ 照射動作モード 連続照射 変調方式 直接変調
75 4.1.8. 使用方法 別添資料:ロ-2(ANNEX A) 総括 本品の使用方法について問題がないか評価するため、IEC 60601-1-6:2010+A1:2013 に準拠した試 験を実施した。 IEC 60601-1-6 は JIS T 0601-1:2017「医用電気機器-第 1 部:基礎安全及び基本性能に関する一般 要求事項」から引用される国際規格であり、現時点における科学・技術知識の水準に照らし、実施した 項目での使用方法の評価は必要かつ十分であると判断した。 試験項目 試験方法 試験結果 実施施設 別添資料 使用方法 IEC 60601-1-6:2010+A1:2013 適合 テュフラインランド ジャパン株式会社 ロ-2 (ANNEX A) 上記のとおり、本品が使用方法に関する上記規格に適合していることを確認し、本品の使用方法に 問題はないと判断した。 使用方法の評価を行うため、IEC 60601-1-6:2010+A1:2013 に準拠した試験を実施した。同規格は IEC62366:2007+A1:2014 を参照しており、ユーザビリティエンジニアリングの結果を確認するものであ る。なお、試験は文書の確認のみで実施された。 評価はIEC 60601-1:2012 の試験と同時に行い、本品の前世代品を用いて実施したのち(別添資料:ロ -1 Annex B)、すべての項目を本品と同一の機器で再評価している(別添資料:ロ-2 Annex A)。
図表 4-30 IEC60601-1-6 の要求事項と試験結果 項番 要求事項 結果 4.2 ユーザビリティエンジニアリングプロセスが IEC62366 に適合してい ること ・ユーザビリティエンジニアリングプロセスの確立 ・ユーザビリティのための受容限界の設定 ・受容限界を満たしていることの確認 適合 5 IEC62366 による要求事項の置換 適合 規格の要求事項をすべて満たすことを確認したことから、本品の使用方法に問題はないと判断した。 なお、IEC60601-1-6 への適合は IEC60601-1 に関する CB 証明書に含めて確認されている。
76 4.1.9. ソフトウェアライフサイクルプロセス 別添資料:ロ-2(ANNEX C)、ロ-22 総括 本品には機能制御のためのソフトウェアが組み込まれており、ソフトウェアのライフサイクルプロ セスを評価するため、IEC 62304:2006 に準拠した検討を実施した。 IEC 62304: 2006 は JIS T 2304:2012「医療機器ソフトウェア−ソフトウェアライフサイクルプロセ ス」に対応する国際規格であり、現時点における科学・技術知識の水準に照らし、実施した試験項目で ソフトウェアのライフサイクルプロセスの評価は必要かつ十分であると判断した。 試験項目 試験方法 試験結果 実施施設 別添資料 ソフトウェアライフ サイクルプロセス IEC 62304:2006 適合 テュフラインランド ジャパン株式会社 ロ-2 (ANNEX C) ロ-22 上記のとおり、本品のソフトウェアライフサイクルプロセスが IEC 62304:2006 の要求事項に適合 したことで、本品のソフトウェアライフサイクルプロセスは妥当であり、薬生機審発0517 第 1 号(平 成 29 年 5 月 17 日)に示される基本要件基準の第 12 条第 2 項の規定への適合が確認されたと判断し た。 ソフトウェアに由来する性能および安全性の評価を行うため、ソフトウェアライフサイクルプロセス の要求事項を規定したIEC 62304:2006 に準拠した試験を実施した。なお、試験は文書の確認のみで実施 された。 評価はIEC 60601-1:2012 の試験と同時に行い、本品の前世代品を用いて実施したのち(別添資料:ロ -1 Annex E)、すべての項目を本品と同一の機器で再評価している(別添資料:ロ-2 Annex C)。ソフ トウェアの一覧を示す(別添資料:ロ-22)。 図表 4-31 制御ソフトウェア一覧 制御ソフトウェア バージョン 組み込み部位 LEW-R01 QLEWR1-#ES2.0 Version: 5.100 56-L301 PWB Assy 制御ボックス内基板 画像処理(歪み補正)IC Ver.3.4.8 GW3200 制御ボックス内基板 カメラモジュール Ver.160715-160729 CMF-85EX アイウェア投影部内基板 次ページの表に示す通り、規格の要求事項をすべて満たすことを確認したことから、本品のソフトウ ェアライフサイクルプロセスに問題はないと判断した。なお、IEC62304 への適合は IEC60601-1 に関す るCB 証明書に含めて確認されている。
77 図表 4-32 IEC62304: 2006(ソフトウェアライフサイクルプロセス)の実施状況 試験項目 結果 4. 一般的要求事項 適合 5. ソフトウェア開発プロセス 適合 6. ソフトウェア保守プロセス 適合 7. ソフトウェアリスクマネジメントプロセス 適合 8. ソフトウェア構成管理プロセス 適合 9. ソフトウェア問題解決プロセス 適合