<翻訳>GVLとGVHDを分離させる新しい戦略
宮崎有紀、池田奈未、小島裕人
公益財団法人 HLA研究所
E. H. Warren & H. J. Deeg
Dissecting graft-versus-leukemia from graft-versus-host-disease using
novel strategies
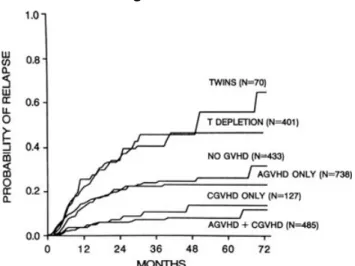
Tissue Antigens, 2013, 81, 183–193 Abstract 同種異系造血幹細胞移植(HCT)の本質的な抗白血病効果は、ドナーとレシピエントの遺伝的相 違に依存し、移植片対宿主病(GVHD)と密接に関与しており、ドナー造血細胞に含まれるか、そ れに由来するリンパ球によってもたらされる。30 年の尽力にもかかわらず、GVHD を引き起こす同 種免疫反応と移植片対白血病(GVL)効果をはっきりと分ける臨床戦略はまだ見つかっていない。 造血幹細胞移植を必要とし、2 座かそれ以上の HLA-A、-B、-C、-DR 座が一致するドナー候補が いる患者には、ドナーとレシピエントの主要組織適合遺伝子複合体(MHC)内外の遺伝子型さら には遺伝子座の考慮によって、GVHD を起しにくく、強力なGVL効果をもたらすドナー(候補)の 選択が可能かも知れない。従来のドナーリンパ球輸注もまた工夫次第で移植後再発の予防や、再 発治療の改善が見込める。しかし、allo-HCT の抗白血病効果を選択的に増強する最も有望な方 法は、ホストに対するドナーアロ免疫を利用するよりむしろ予防接種や養子細胞移植で腫瘍特異 的免疫を高める事のようである。特に、腫瘍特異的活性を有する遺伝子を導入したドナーT 細胞の養子移植は、GVHD を起こさず抗腫瘍免疫だけを増強することで allo-HCT の常識を変え る可能性を秘めている。 Introduction 少なくとも 3 つの独立したエビデンスが、同種異系造血幹細胞移植(HCT)によって誘導される移 植片対白血病(GVL)効果の存在を示している。1つ目、allo-HCT 後の再発や腫瘍残存の患者 で、免疫抑制剤の中止による悪性疾患の完全寛解(CR)が時々報告されている。2 つ目、難治性 もしくは再発性の悪性腫瘍の患者において HCT 後のドナーリンパ球輸注での完全寛解がしばし ば観察されている。3 つ目、直接的な抗腫瘍活性はほとんどなしでミニ移植(低強度)を施行してド ナー造血幹細胞の生着が得られ、悪性腫瘍の部分的もしくは完全退縮が見られた患者は、おそら く GVL 効果を裏付けるもっとも明白で説得力のある証拠であろう。過去 20 年にわたり GVL 効果の解明研究の焦点は主に細胞や分子であった、このような今までの研究成果が、移植片対宿 主病(GVHD)の誘発や重症化のない選択的な GVL 効果の強化法の開発を容易にしている。Defining characteristics of the GVL effect in human allogeneic HCT GVL の最初の不可欠な特徴づけは 早期、または進行期の白血病でHLA 一致同胞間骨髄移植における再発率 の解析によってなされた(1,2,3)。こ の研究ではGVHD なし、急性 GVHD のみ、慢性GVHD のみ、両方ありの 区分により再発率の比較が解析され、 その結果からGVHD と GVL 効果が 強く関連していることがわかった (Figure1)。さらに、慢性骨髄性白 血病(CML)における移植症例の解析 から、GVL 効果の強さが GVHD の 発症や重症度と一致していることが わかった(4)。急性、慢性 GVHD を 起こさなかった HLA 一致同種ドナ ーからの移植と同系(一卵性双生児)からの移植における再発率の比較から、移植自体に おける抗腫瘍効果と臨床的にみられる GVHD とは独立していることがわかった。最後に、 MHC 一致ドナーの移植においてドナーT 細胞除去を施行している症例と、していない症例 の再発率の比較から、T 細胞除去が抗腫瘍効果を減少させることが証明された。
Genetic determinants, effector cells, and target molecules of the GVL effect
GVL 効果は患者とドナーの遺伝子的な相違が必要であり、まずはドナー移植片に含まれる、 もしくは単離したリンパ球に依存する。GVL 効果の本質的な(包括的、理論的)理解は知 られていないが、20 年以上にわたって多くの研究施設から重要な遺伝的因子、エフェクタ ー細胞、GVL 効果の標的分子が同定されている。GVL 効果は、単純で同一の現象がみられ るわけではなく、多くの場合は患者とドナーの遺伝的相違の数や種類、移植片のソース、 構成、ドナー造血細胞の処理方法、患者の腫瘍タイプに依存する。同種造血幹細胞移植の 適応範囲が―1980 年から 1990 年代にかけては唯一移植適応であった―AML、ALL、CML から拡大し、MDS、骨髄増殖性障害、CLL、Hodgkin リンパ腫、non-Hodgkin リンパ腫、 多発性骨髄腫などの血液系腫瘍性疾患への適用も増えた、それと共に GVL 効果と GVHD の発症率と重症度がすべての腫瘍で同一ではない事が明らかになった。確かに、1998 年か ら 2007 年までの EBMT の 48,111 例の移植データにおいて、―再発率から推測すると― GVL 効果は CML と ALL では GVHD と最も強く関連しており、MDS とリンパ腫はそれ ほどでもなく、AML と形質細胞異常は関連があまりなかった(5)。この結果から、allo-HCT 後のGVL のメカニズムは GVHD のそれとは完全に同じではないことがいえる。
Figure 1 Actuarial probability of relapse among 2254 recipients of
allogeneic bone marrow transplants (BMT) from human leukocyte antigen-identical sibling donors transplanted for chronic myeloid leukemia in first chronic phase, acute lymphoblastic leukemia in first remission, or acute myelogenous leukemia in first remission, according to the type of graft and the development of acute or chronic graft-versus-host disease. Reproduced with permission from Horowitz et al. (3)
ドナー由来のT リンパ球とナチュラルキラー(NK)細胞が移植後 GVL を誘発する主要因 子であるのは明らかである。T 細胞除去をしない MHC 一致ドナーの移植において、ドナー CD4+CD8+T細胞は患者細胞表面のMHC-ペプチド複合体を認識することにより GVL効果 を誘発する。しかし、蓄積された証拠から、T 細胞除去をしない MHC 一致ドナーの移植に おいてはドナーNK 細胞も GVL に重要な役割を果たしている。対照的に、ハプロ半合致移 植、複数ローカスミスマッチ移植、致死的なGVHD を予防するためにドナーT 細胞除去を in vivo もしくは in vitro でおこなった移植ではドナーNK 細胞は患者細胞に対する他のリ ガンドと同様に、MHC-ペプチド複合体を認識することによって、GVHD を誘発する主要 因子となる。
GVL in multiple HLA antigen-mismatched and HLA-haploidentical HCT
ペルージャのグループによる開拓的研究によると、ハプロ半合致、複数ローカスミスマッ チ移植において T 細胞除去における白血病細胞の根絶は、大部分がドナーNK 細胞による ものであるとしている(6)。ハプロ半合致移植後の患者から単離されたドナーNK 細胞の機 能的解析によって、ドナーNK 細胞は、患者の造血細胞以外の細胞認識はあったとしても少 ないが、リンパ球、樹状細胞、骨髄白血芽球(リンパ球ではない)に対しては潜在的に細胞傷 害性を持つことが明らかになった。患者とドナーのMHC と KIR(第 19 番染色体長腕)の 遺伝子相異の解析によって、移植後の白血病細胞根絶とin vitro での NK 細胞傷害活性の両 方は、ドナーにはない患者MHC クラスⅠアリルが重要となるドナーNK アロ反応の‘ミッ シングセルフ’モデルによって説明できる事が示された。ペルージャグループは最初の臨 床的データから、‘ミッシングセルフ’モデルから予想されるNK のアロ反応性―臨床的な GVL 効果―は GVHD の発症とは親密には一致しなかったと結論づけているが、十分なフ ォローアップ証拠は得られなかった(7)。ハプロ半合致移植におけるドナーNK のアロ反応 がGVL 効果に重要であることは多くの研究によって広く確かめられており、ドナーNK 活 性をより正確に予想するための他のモデルが多く提案されている。‘ミッシングリガンド’ モデルとして一般的に参考にされる最も有名な二者択一モデルは、患者とドナーの MHC クラスⅠ遺伝子型の差異とドナーのもつKIR 遺伝子とそのハプロタイプの組み合わせを重 要視する。いくつかのモデルが提唱されているが、ハプロ半合致移植においてドナーNK 活 性をもっとも正確に予想できるモデルは定まっていない。 ハプロ半合致移植後の AML、MDS の再発例から単離された芽球の解析から、患者の非 共有ハプロタイプの産物に対する特異性をもったドナーリンパ球がGVL 効果に大きな役割 を果たしていることがわかった。ハプロ半合致移植後にドナーT 細胞輸注を施行し、再発し た 17 名の患者を解析した結果は驚くべきものであり、17 名中 5 名の患者由来の芽球はド ナーと非共有のMHC ハプロタイプ全体を欠落していた(8)。MHC ハプロタイプの欠損は 有糸分裂の際におこる組み換えが原因で、第 6 番染色体短腕が同一の親由来の 2 倍体にな
が得られ、6pUPD は血縁者間 HLA ハプロ半合致移植後に AML の再発をきたした子供の 3
分の2 にみられた(9)。
GVL in T-replete MHC-identical or –closely matched HCT
MHC 一致同胞血縁(3)、または MHC 一致非血縁間(10)移植において移植片の T 細胞除去を 行った場合に再発率が上がることから、ドナーT 細胞が HLA 一致ドナーからの移植におい て重要な役割をしていることが証明された。これは、ドナーの CD8+(11,12,13)T 細胞と CD4+(14,15)T 細胞の両方が GVL 効果に関与していることの十分な証拠でもある。しかし、 これらはドナーとレシピエントのMHC と KIR 遺伝子型からの推論でしかなく直接的な証 明ではないため、骨髄腫瘍患者の血縁もしくは非血縁間 MHC 一致移植後においてはドナ ーNK 細胞のアロ反応性が GVL 反応に関与していると考えることもできる。最近のコンセ ンサスはドナーT 細胞の方が、ドナーNK 細胞よりも GVL に対してより重要で活性が強い とされるが、ドナーのT 細胞と NK 細胞の GVL 活性は患者とドナーの免疫関連遺伝子の相 違、移植ソース、処理方法、その他の移植片の特徴、患者の治療レジメン、GVHD 予防法、 腫瘍の性質によるところが大きいように思える。
Miner histocompatibility antigens as targets for GVL responses
MHC 一致移植において、最初、もしくは優先的かもしれないが、CD4+T 細胞と CD8+T 細胞の標的はマイナー組織適合性抗原で、この抗原は患者の MHC クラスⅠ、クラスⅡを 含む MHC 領域とは別の領域に存在し、遺伝子には広大な配列と構造によって多型性があ る。マイナー抗原はMHC 一致移植後の患者において CD4+細胞か CD8+T 細胞のどちらか に認識され、その遺伝子はヒトゲノム上に広範に分布し、2012 年後半までに少なくとも 49 の遺伝子か判明している(Figure 2)。これらの遺伝子の大部分は常染色体に存在し、ほと んどすべての染色体を網羅しているが、少なくとも6 種類の遺伝子は Y 染色体上に存在し、 ドナーが女性、患者が男性のときにドナーT 細胞応答を引き出す因子となる男性特有のマイ ナー抗原となる。常染色体(12,13)や Y 染色体(16)上にコードされるマイナー抗原に対する T 細胞応答が GVL 効果を発揮することには確証がある。腫瘍細胞を含む造血細胞に選択的、 もしくは排他的に発現している HA-1(17)のようなマイナー抗原に対する T 細胞応答は GVL 効果を選択的に誘導し、造血細胞のみならず、それ以外にも発現がみられる HA-8(18) のようなマイナー抗原に対するT 細胞応答は GVL 効果と GVHD の両方に関与すると仮定 されている。この仮定を実験的に正確に証明したとしても、造血細胞特異的発現をしてい るマイナー抗原は多く存在するため、臨床応用をするには困難が生じるかもしれない。 すでに多くのマイナー抗原が同定されているが、もっと多くのマイナー抗原がヒトゲノ ム上に広範に分布していると考えられる(19,20)。実際、同定されているマイナー抗原のほ とんどが非同義一塩基置換(nsSNPs)であり、1,000 人ゲノムプロジェクト(19)のパイロ ットフェイズによると 2 人の非血縁間では 10,000-11,000 の nsSNPs の相違があると思
われる。そこにはドナーが homozygote で患者が heterozygote のような相違も含めた、 UGT2B17 のような構造上の相違も数多く存在する(21)。それゆえに allo-HCT において T 細胞応答を誘導するマイナー抗原の総数は多く、結果的に生物学的関係を考慮にいれない、 いかなる移植においても患者とドナーには多くのマイナー抗原ミスマッチがあるだろう。 Nonpolymorphic GVL targerts 患者に対するドナーT 細胞は患者マイナー抗原に加え、MHC 一致移植において患者の骨髄、 もしくはリンパ白血病細胞に発現される、過剰または異常の多型性のない抗原に対しても 応答し、GVL 活性に働いていると思われる。HLA-A*02:01 拘束性 CD8+T 細胞はプロティ ナーゼ-3 と好中球エラスターゼ遺伝子によって発現される PR1 ペプチドに特異的に働き、 MHC 一致移植後に寛解に至った HLA-A*02:01 を持つ CML 患者の多くの血中で増加傾向 がみられた(22)。ミエロブラスチンとして知られるプロティナーゼ-3 とエラスターゼはどち らともAML と CML 芽球と同様に、アズール顆粒と前骨髄球にも発現しており主要成分で ある。WT-1 腫瘍タンパク由来ペプチド(23)に対する CD8+T 細胞応答、NY-ESO-1 (24)や MAGE ファミリー (25)のような CT 抗原(精巣抗原)に対する CD4+と CD8+T 細胞応答 なども急性白血病と多発性骨髄腫におけるMHC 一致 allo-HCT 後に検出された。腫瘍特異 的抗原に対するドナーT 細胞応答は造血幹細胞移植後に固形腫瘍をきたした患者でも増加 している。MHC 一致ミニ移植施行後に持続的な完全寛解に至った転移性腎細胞癌患者から、 ヒト内在性レトロウイルス(HERV)E 型由来の抗原性ペプチドに対する優れた腫瘍特異的
Figure 2 Map of genetic loci that can influence histocompatibility in the allogeneic hematopoietic cell transplantation (HCT) setting. The chromosomal location of the major histocompatibility complex (MHC), and of two other multigene clusters, the natural killer complex (NKC) and the KIR locus, are indicated by red labels and arrowheads to the left of the corresponding chromosomes. The chromosomal locations of genes that have been shown to encode T lymphocyte-defined minor histocompatibility antigens are indicated by labels and arrowheads to the right of the corresponding chromosomes; genes that encode class I MHC-restricted minor H antigens recognized by CD8+T cells are indicated by black labels, those that
encode class II MHC-restricted minor H antigens recognized by CD4+T cells are indicated by green labels, and those that encode both class I- and
CD8+T 細胞応答がみられた(26)。
Contributions to GVL from NK and B cells
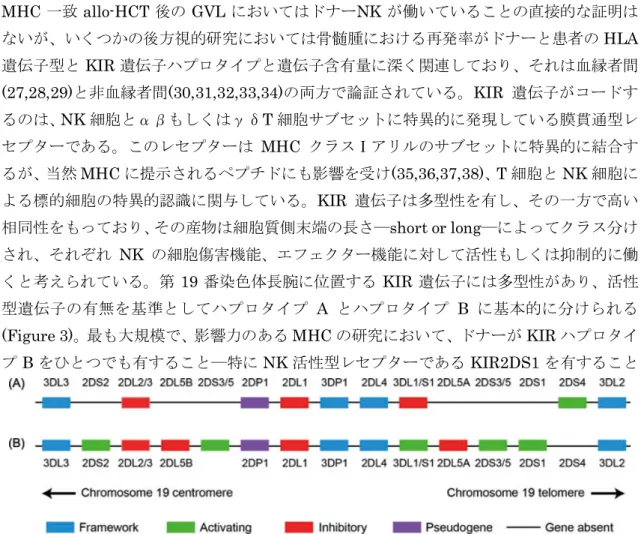
MHC 一致 allo-HCT 後の GVL においてはドナーNK が働いていることの直接的な証明は ないが、いくつかの後方視的研究においては骨髄腫における再発率がドナーと患者のHLA 遺伝子型とKIR 遺伝子ハプロタイプと遺伝子含有量に深く関連しており、それは血縁者間 (27,28,29)と非血縁者間(30,31,32,33,34)の両方で論証されている。KIR 遺伝子がコードす るのは、NK 細胞とαβもしくはγδT 細胞サブセットに特異的に発現している膜貫通型レ セプターである。このレセプターは MHC クラスⅠアリルのサブセットに特異的に結合す るが、当然MHC に提示されるペプチドにも影響を受け(35,36,37,38)、T 細胞と NK 細胞に よる標的細胞の特異的認識に関与している。KIR 遺伝子は多型性を有し、その一方で高い 相同性をもっており、その産物は細胞質側末端の長さ―short or long―によってクラス分け され、それぞれ NK の細胞傷害機能、エフェクター機能に対して活性もしくは抑制的に働 くと考えられている。第 19 番染色体長腕に位置する KIR 遺伝子には多型性があり、活性 型遺伝子の有無を基準としてハプロタイプ A とハプロタイプ B に基本的に分けられる (Figure 3)。最も大規模で、影響力のある MHC の研究において、ドナーが KIR ハプロタイ プB をひとつでも有すること―特に NK 活性型レセプターである KIR2DS1 を有すること ―が AML と他の骨髄腫瘍に対する非血縁造血幹細胞移植における再発率の低下と強く関 係していることがわかった(32,33,34)。移植後早期にドナーNK の割合が高いこともミニ移 植における再発率の低下に関与している(39)。まとめると、これらの結果からわかることは ドナーNK のアロ反応は骨髄腫に対する非血縁間、血縁間 HLA 一致ドナーからの移植にお けるGVL 活性に重要な役割を果たしていることである。 ドナーB 細胞もまた、特定の造血幹細胞移植患者においては GVL に関与するかもしれな い。HLA 一致移植後に再発し、最終的には DLI によって寛解に至った CML(40)、多発性 骨髄腫(41)の患者において腫瘍特異的抗体反応がみられた。DLI 後に検出される抗体に認識 されるタンパクは細胞内に存在し、細胞表面に発現していなかったが、多発性骨髄腫に対 してDLI を施行して反応があった患者には、細胞外ドメインを有する細胞膜貫通型タンパ
クであるBCMA(B-cell maturation antigen)に対する抗体がみられた(41)。BCMA に対
Figure 3 Basic organization and gene content of the humanKIR locus on chromosome 19q. Two hypothetical haplotypes are illustrated: an A (top) and a B (bottom) haplotype. Framework genes (which can be coding genes or pseudogenes) are illustrated in blue; nonframework activating genes are in green, inhibitory genes in red, and pseudogenes in purple. Adapted from http://www.ebi.ac.uk/ipd/kir/sequenced_haplotypes.html.
する抗体を含む血清は、補体を介する細胞溶解と、BCMA を発現している骨髄腫細胞を想 定して人工的に作製されたBCMA 遺伝子を形質導入した腫瘍細胞に抗体依存的細胞毒性を 誘導することができた。この結果からBCMA は DLI によって誘導される抗骨髄腫作用の標 的となっているかもしれない。ドナーCD4+T 細胞と CD8+T 細胞に認識され、多発性骨髄 腫患者の造血幹細胞移植後にみられる NY-ESO-1 のような腫瘍特異的抗原に対する抗体も 検出されるが(24)、この抗体が移植後の抗骨髄腫作用を有するのか、単純に腫瘍特異的抗原 に対するマーカーとして存在しているだけなのかは知られていない。 Strategies for enhancing GVL and preventing GVHD
GVHD の重症化を起こさずに allo-HCT による抗腫瘍効果を選択的にコントロールするた めの臨床的な戦略の発展は、造血幹細胞移植研究において優先度が最も高いもののひとつ である。最近の焦点は、本質的なGVL 活性の増強か、GVL 効果を減じることなく GVHD を回避できるようなドナー決定を戦略的に行うことである。GVHD の発症と重症度が移植 前処置レジメンの強さと相関しているという認識に基づいて、最適で毒性のないレジメン を設計することは、再発予防や再発治療のためにより効果的で毒性の少ない移植後DLI を 行うための戦略を設計することにもつながるため活発な研究分野の一つである。記述する 程でもないかもしれないが、最近の移植研究における最も注目されている分野はアロ免疫 に依存しないワクチンや養子免疫による腫瘍特異的免疫療法である。
Improved donor selection for enhanced GVL and less GVHD
第6染色体単腕は3.3Mb以上の遺伝子に数百ものタンパク質がコードされており、造血幹細 胞移植においてHLA一致ドナーを選択する際には、患者のMHC領域の特定の座位を一致さ せることに焦点があたっている。NMDPでは最近、患者とドナー候補のHLA-DRB1遺伝子 のexon2と同じように、HLA-A、-B、-C遺伝子のexon2、exon3のマッチングを推奨している (42)。しかしながら大規模な後方視的研究によると、MHC領域の他のローカス―特にDPの ヘテロダイマーを構成するα鎖とβ鎖をコードする遺伝子(43,44,45)―をドナーとレシピ エントでマッチさせることで、重症GVHDの発症率が低下し移植成績を向上させたのかもし れないと述べている。しかし、非血縁間のallo-HCT予定で移植後の再発の危険性が高い患者 においてはDPの意図的なミスマッチが有用であることが証明されており、このような戦略 は移植後の再発リスクを低下させるため有益と証明されている(44,46,47)。また、最近のラ ンダム試験の結果では(48)、HLA-A、-B、-C、-DRB1遺伝子一致非血縁ドナーからの移植に おいては造血幹細胞のタイプ(PB or BM)もまたGVHDリスクに影響を与え、その重要性 や臨床的有益性は白血病早期か晩期患者かによっても異なると報告している。 MHC 領域外の遺伝子型の考慮は、特に骨髄性白血病の患者において GVL 効果を選択的 に引き出すことができるかもしれない。骨髄性白血病の患者においては、少なくともひと つのKIR ハプロタイプ B (32,33)―もしくはハプロタイプを特徴づける KIR2DS1 のような
KIR 遺伝子(34)―を持ったドナーからの移植が再発率を低下させることから、HLA-A、-B、 -C、-DRB1 遺伝子のうち 2 座もしくはそれ以上の一致ドナー候補に対して KIR タイピング は最適条件のドナーを選択するのに有用であるかもしれない。骨髄性白血病において移植
成績の向上と再発率の低下に関与しているドナーのKIR ハプロタイプ B の構成を理解する
ことは優先度の高い課題である。
Lowering risk of GVHD through optimization of transplant conditioning
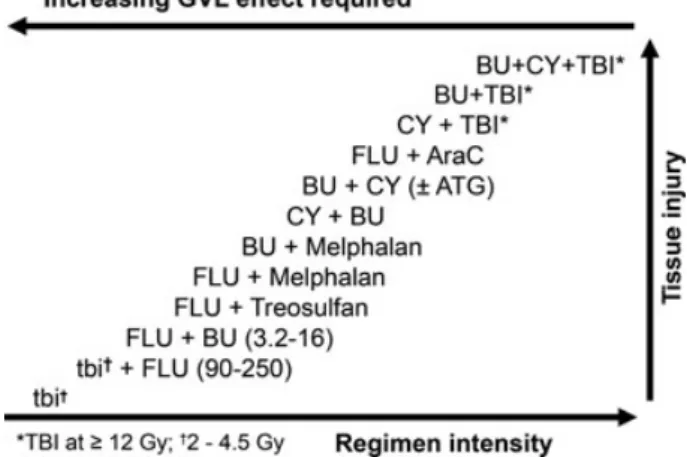
患者に対する移植前処置のレジメンは移植片の入る環境を変化させるため、患者とドナー 細胞との相互作用が起きると考えられる。ランダム試験を含む多くの研究では、GVHD 特 に急性の場合の発症率と重症度が、照射量の高い TBI などの強い前処置によって高まると 示した(49,50)。これは、ドナー細胞由来のシグナルが加わって起こる組織傷害と炎症性サ イトカイン前駆体の遊離が関与してお り、「サイトカインストーム」と呼ばれ る状態を引き起こす。GVHD の兆候は 古典的な免疫反応に加え、炎症にも関 与している。移植前処置のレジメン (Figure 4)については患者の疾患、移 植片幹細胞の種類、全身状態などを加 味して多くの組み合わせが使用されて いる。低強度(ミニ移植)のレジメン が急性 GVHD の重症度と、もしかす ると発症率の低下にも関与していると いう証拠はある(51)。;が、GVHD が 高強度レジメンよりも遅くに起こって いる可能性があり、慢性 GVHD との 区別は難しいかもしれない(51)。 最近の興味深い報告で、スタチン含有薬(脂質異常症:高脂血症に用いられる)が患者 (移植前)か、ドナー(幹細胞採取前)、もしくは両方で投与されていた場合に GVHD の 発症が抑えられるという内容があった(52,53)。特に処置前のドナー群では明らかに重症急 性GVHD の頻度が下がった。特筆すべきはこの現象が GVHD 予防としてタクロリムスを 用いている患者には起きず、シクロスポリンを用いている患者にのみ起きているところで ある。現在、これらの後方視的研究で得られたデータを前方視的研究で確認をしていると
ころである。移植前レジメンにおける anti-thymocyte globulin (ATG)の使用は、慢性
GVHD の頻度を減らすと報告されているが(54)、ミニ移植においては最近のデータでまだ
議論中である(55)。
移植前のレジメンの変更だけではGVHD を予防するのは難しいと思われる。しかし、前
Figure 4 Reciprocal relationship between the intensity of conditioning regimens that have been used for allogeneic hematopoietic cell transplantation and the required anti-leukemic contribution from the graft-versus-leukemia effect to achieve a comparable rate of post-transplant relapse. The relative degree of tissue injury typically observed with each regimen is also indicated. TBI and tbi, total body irradiation; BU, busulfan; CY, cyclophosphamide; FLU, fludarabine; AraC, cytarabine; ATG, anti-thymocyte globulin.
処置に関連する毒性を減らすことで、GVHD の悪化や誘発の原因となる要素をなくす、も しくは減らすことができるかもしれない。
Engineering DLI for improved anti-leukemic activity and less toxicity
DLI は限られた抗白血病効果しかなく頻繁に毒性がみられるが、移植後の再発予防もしく は治療に一般的な方法とされている。免疫機構のチェックポイントの阻害剤を含むアジュ バント療法は DLI の抗白血病効果を増強する有力な戦略のひとつである。パイロットスタ ディでは、移植後再発患者における抗白血病効果を評価するためにイピリムマブ (CTLA4 に対するモノクローナル抗体)の単回投与を行い、その免疫機構チェックポイント阻害の 研究がなされた(56)。29 名の患者についてはイピリムマブによる GVHD の悪化は認められ なかったが、4 名については臓器特異的に免疫反応による有害事象がみられ、3 名は目的の 効果が得られた(うち、2 名は完全奏功、1 名は部分奏功)。イピリムマブの治療で末梢血 のCD4+CD25+FOXP3+の細胞数の顕著な変化は見られなかった(57)。最近、PD-1/PD-L1
経路のシグナルをモノクローナル遮断抗体(blocking monoclonal antibodies)で阻害する
ことで、進行性固形がんの持続的縮小がみられたという報告があり(58,59) 、このような医 薬品でPD-1/PD-L1 シグナル伝達を阻害する事は、DLI 効果も同時に強める可能性がある と 考 え ら れ る 。DLI 前に 患者 リ ンパ 球 を除 去す る しな い にか かわ ら ず DLI 中 の CD4+CD25+細胞を除去するパイロットスタディもあり(60)、無処理(CD4+CD25+細胞を 除去していない)DLI で反応が見られなかった患者に、GVHD を伴う持続的な GVL 効果 がみられた。
Tumor-specific immunotherapy with vaccination or adoptive cell transfer
「本質的な」GVH 反応の抗白血病作用は 30 年にわたって分析されてきたが、臨床的な GVHD と GVL をはっきりと分ける事ができるものの解明には至っていない。従って、最 近の研究ではアロ免疫に手を加えるよりはむしろ腫瘍関連もしくは腫瘍特異的抗原に対す る免疫性を高める治療法に頼る傾向がある。実際、allo-HCT 後の免疫療法のターゲットと して研究されてきた抗原が、自己由来細胞のワクチン療法や養子免疫療法のターゲットと してすでに広く再評価されている。 この頃、allo-HCT 後にワクチンを利用して抗腫瘍免疫を活性化する様々な方法が研究さ れている。HCT 患者に免疫活性をつける上で難しい点は、ドナーが患者に感作される必要 がある点で、健康なドナーに腫瘍特異的免疫をつける安全な方法は一般的にまだ確立され ていない。しかし注目すべき例外として、多発性骨髄腫の患者において MHC 一致同胞ド ナーから精製されたイディオタイプ(個特異的抗原)のタンパク質からワクチン化ができ たといういくつかの報告がある(61,62,63)。これらの研究では骨髄移植、1 症例はリンパ球 移植だが、患者におけるイディオタイプ特異的免疫反応同様、ドナーにおける細胞性、液 性のイディオタイプ特異的免疫反応が報告され、精製されたイディオタイプタンパクから
のワクチン化は重篤な毒性がないことが示唆された。しかし、最近のワクチン研究では患 者特異的免疫反応とは反対に、多くの患者が共通して有する腫瘍特異的抗原に対する反応 を引き出すことに最も焦点があたっている。合成PR1 ペプチド(プロティナーゼ-3 もしく は好中球エラスターゼ由来)やWT1 の配列を含むペプチド、BCR-ABL ペプチドを用いた ワクチンは移植しない場合において広く評価されている。これらのペプチドワクチンは CD8+と CD4+T 細胞応答を誘導できるが、この反応は特に PR1 ワクチンにおいては相対的 に活性が弱く、通常は持続力に乏しい。驚くべきことではないが、ワクチン研究における 試行でみられる臨床的な免疫応答は、より複雑であるallo-HCT に対しては、同様の結果が 得られる十分な保証はできていない。PR1/HLA-A*02:01 複合体を認識するマウスモノクロ ーナル抗体の最近の研究によって、この複合体が通常の造血幹細胞や、骨髄芽球、単核球(64) の表面に割りと明確に発現しており、このことはHLA-A*02:01 を有する患者でワクチン療 法がうまくいかない理由が HLA-A*02:01 拘束性の PR1 特異的 CD8+T 細胞応答の親和性 の弱さであることを説明しているかもしれない。 患者特異的細胞性ワクチンはallo-HCT 後の患者に有効であり、安全で免疫原性があるこ とがわかってきた。例えば、IL2 遺伝子や CD40LG(CD40 のリガンド)遺伝子(65)を形質 導入した皮膚線維芽細胞と放射線照射を実施した患者白血病幼弱細胞の混合ワクチンや、 CSF2(GMCSF)遺伝子を形質導入した患者白血病幼弱細胞ワクチンなどがある(66)。こ れらのワクチンの試行は単発的であり、GVL 活性の絶対的な評価をすることはできないが、 過去の例と比較するとどちらの試行も患者の移植成績は改善されている。加えて、allo-HCT 後の腫瘍特異的免疫反応に対して、有望なアプローチとなり得る。 進行中の鍵となる 2 分野の研究―allo-HCT 後のウイルス治療のための養子細胞治療と、 特異性を変える遺伝子を導入したT 細胞療法―これらは allo-HCT 後の抗ウイルス、抗白血 病効果を活性化するための養子移植の戦略を変える新世代の研究である。allo-HCT 後のド ナー由来T 細胞の養子治療は、この 20 年間で移植後の CMV 予防、EBV 関連リンパ増殖 症(EBV-LPD)のコントロールのために、ドナー由来の CMV 特異的 T 細胞(67)、もしく はEBV 特異的 T 細胞(68)を用いる研究で開拓された。これらの研究ではドナー由来の T 細 胞が用いられているが、注入しても患者はGVHD の誘発や悪化することがなかった。結果 的に臨床研究ではドナー由来のEBV 特異的 T 細胞株を養子移植しても驚くほど安全で、移 植後のEBV-LPD に対する治療と予防に長期的な有効性を発揮し、GVHD 誘発、悪化をさ せないことが確認された。より最近では多種のウイルス―CMV、EBV、アデノウイルス― に対して特異的な細胞治療産物を作製法が成人末梢血(69)、臍帯血(70)のどちらともにおい て研究され、作製産物が安全で抗ウイルス作用があることを複数のグループで確認してい る。
細胞治療方法として次に挙げられるのはT-cell receptors(TCRs)や chimeric antigen
receptors(CARs)での遺伝子修飾によって T 細胞の抗原特異性を変化させる技術であり、 allo-HCT 後の GVL 効果を選択的に高める2つめの重要な発展である。TCRs(71)や
CARs(72,73)はドナーT 細胞の遺伝子操作によって得られ、養子移植後に GVHD が起きな いことが利点として挙げられるが、これは通常のTCR 自体が自己抗原よりもウイルスに対 して特異性をもつためであり、原理的には白血病細胞表面に選択的もしくは特異的に発現 している分子のみに働くような有効性と抗腫瘍特異的活性をもったエフェクター細胞群を 形成する。自己由来のCD19 に対する CARs が CD19+ B 細胞リンパ腫においてすでに広く 試験されており、総合的にかなり見込みのある結果で、いくつかは劇的な結果が得られて いる(74,75,76,77,78)。ドナー由来の CD19 特異的な CAR 導入 T 細胞でも一例、allo-HCT 後の進行 CLL 患者に施行され、結果的に劇的な病状の改善が認められている(79)。ポリク ローナルなTCR もしくは CAR 導入ドナーT 細胞の養子移植において、GVHD の危険を最 小に抑える方法は、T 細胞に内在する TCRα鎖とβ鎖の発現を抑えることを目的として zinc finger 核酸分解酵素を用いる新しいアプローチがあり(80)、遺伝子導入された T 細胞 受容体の特異性や機能を悪化させることなくドナー本来のTCR の細胞表面上への発現を完 全に抑制する。 Conclusion 最初に後方視的研究によってallo-HCT における GVL 効果が提唱されて以来、30 年間に渡 って多くの遺伝子座、エフェクター細胞、標的分子などの細胞や分子の研究がなされ、驚 くべき免疫反応の可能性を感じた―が、未だにGVHD の毒性が問題として残ったままであ る。ほとんどの患者におけるGVL 活性は、T 細胞、NK 細胞、あるいは B 細胞もかもしれ ないが、患者のアロ抗原を焦点とする幅広い抗原特異性を有する多様性に起因する。ヒト ゲノムを特徴づける多くの遺伝子配列と構造の多様性―これは 1 世代の血縁者間のゲノム を比較すると明らかである―それがゆえに、患者とドナーの間の遺伝子的な相違を選択的 に利用してGVHD を悪化させることなく GVL を誘導することについては挑戦し続けるこ とになるだろう。移植後のアロ免疫よりも特異的な抗腫瘍免疫を誘導する方向性のほうが、 将来のallo-HCT の成績向上により大きな衝撃を与えるだろう。 References
1. Weiden PL, Flournoy N, Thomas ED et al. Antileukemic effect of graft-versus-host disease in human recipients of allogeneic-marrow grafts. N Engl J Med 1979: 300: 1068–73.
2. Weiden PL, Sullivan KM, Flournoy N, Storb R, Thomas ED. Antileukemic effect of chronic graft-versus-host disease: contribution to improved survival after allogeneic marrow transplantation. N Engl J Med 1981: 304: 1529–33.
3. Horowitz MM, Gale RP, Sondel PM et al.Graft-versus-leukemia reactions after bone marrow transplantation. Blood 1990: 75: 555–62.
HLA-identical sibling transplantations for chronic myeloid leukemia. Blood 2002: 100: 3877–86.
5. Stern M, de Wreede LC, Brand R et al. Impact of graft-versus-host disease on relapse after allogeneic hematopoietic stem cell transplantation, an EBMT megafile study.
ASH Annual Meeting Abstracts 2012: 120: 469.
6. Ruggeri L, Capanni M, Urbani E et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science 2002: 295: 2097–100. 7. Ruggeri L, Mancusi A, Capanni M et al. Donor natural killer cell allorecognition of
missing self in haploidentical hematopoietic transplantation for acute myeloid leukemia: challenging its predictive value. Blood 2007: 110: 433-440
8. Vago L, Perna SK, Zanussi M et al. Loss of mismatched HLA in leukemia after stem-cell transplantation. N Engl J Med 2009: 361: 478–88.
9. Villalobos IB, Takahashi Y, Akatsuka Y et al. Relapse of leukemia with loss of mismatched HLA resulting from uniparental disomy after haploidentical hematopoietic stem cell transplantation. Blood 2010: 115: 3158–61.
10. Wagner JE, Thompson JS, Carter SL, Kernan NA. Effect of graft-versus-host disease prophylaxis on 3-year disease-free survival in recipients of unrelated donor bone marrow (T-cell Depletion Trial): a multi-centre, randomised phase II-III trial.
Lancet 2005: 366: 733–41.
11. Zorn E, Wang KS, Hochberg EP et al. Infusion of CD4+ donor lymphocytes induces the expansion of CD8+ donor T cells with cytolytic activity directed against recipient hematopoietic cells. Clin Cancer Res 2002: 8: 2052–60.
12. Kircher B, Stevanovic S, Urbanek M et al. Induction of HA-1-specific cytotoxic T-cell clones parallels the therapeutic effect of donor lymphocyte infusion. Br J Haematol
2002: 117: 935–9.
13. Marijt WA, Heemskerk MH, Kloosterboer FM et al. Hematopoiesis-restricted minor histocompatibility antigens HA-1- or HA-2-specific T cells can induce complete
remissions of relapsed leukemia. Proc Natl Acad Sci U S A 2003: 100: 2742–7. 14. Giralt S, Hester J, Huh Y et al. CD8-depleted donor lymphocyte infusion as
treatment for relapsed chronic myelogenous leukemia after allogeneic bone marrow transplantation. Blood 1995: 86: 4337–43.
15. Alyea EP, Soiffer RJ, Canning C et al. Toxicity and efficacy of defined doses of CD4(+) donor lymphocytes for treatment of relapse after allogeneic bone marrow transplant. Blood 1998: 91: 3671–80.
16. Takami A, Sugimori C, Feng X et al. Expansion and activation of minor
response. Bone Marrow Transplant 2004: 34: 703–9.
17. den Haan JM, Meadows LM, Wang W et al. The minor histocompatibility antigen HA-1: a diallelic gene with a single amino acid polymorphism. Science 1998: 279: 1054–7.
18. Brickner AG, Warren EH, Caldwell JA et al. The immunogenicity of a new human minor histocompatibility antigen results from differential antigen processing. J Exp Med 2001: 193: 195–206.
19. 1000 Genomes Project Consortium. A map of human genome variation from population-scale sequencing. Nature 2010: 467: 1061–73.
20. Warren EH, Zhang XC, Li S et al. Effect of MHC and non-MHC donor/recipient genetic disparity on the outcome of allogeneic HCT. Blood 2012: 120: 2796–806. 21. Murata M, Warren EH, Riddell SR. A human minor histocompatibility antigen
resulting from differential expression due to a gene deletion. J Exp Med 2003: 197: 1279–89.
22. Molldrem JJ, Lee PP, Wang C et al. Evidence that specific T lymphocytes may participate in the elimination of chronic myelogenous leukemia. Nat Med 2000: 6: 1018–23.
23. Rezvani K, Yong AS, Savani BN et al. Graft-versus-leukemia effects associated with detectable Wilms tumor-1 specific T lymphocytes following allogeneic stem cell
transplantation for acute lymphoblastic leukemia (ALL). Blood 2007: 110: 1924–32. 24. Atanackovic D, Arfsten J, Cao Y et al. Cancer-testis antigens are commonly
expressed in multiple myeloma and induce systemic immunity following allogeneic stem cell transplantation. Blood 2007: 109: 1103–12.
25. McLarnon A, Piper KP, Goodyear OC et al. CD8(+) T-cell immunity against cancer-testis antigens develops following allogeneic stem cell transplantation and reveals a potential mechanism for the graft-versus-leukemia effect. Haematologica
2010: 95: 1572–8.
26. Takahashi Y, Harashima N, Kajigaya S et al. Regression of human kidney cancer following allogeneic stem cell transplantation is associated with recognition of an HERV-E antigen by T cells. J Clin Invest 2008: 118: 1099–109.
27. Verheyden S, Schots R, Duquet W, Demanet C. A defined donor activating natural killer cell receptor genotype protects against leukemic relapse after related
HLA-identical hematopoietic stem cell transplantation. Leukemia 2005: 19: 1446–51. 28. Hsu KC, Keever-Taylor CA, Wilton A et al. Improved outcome in HLA-identical
sibling hematopoietic stem-cell transplantation for acute myelogenous leukemia predicted by KIR and HLA genotypes. Blood 2005: 105: 4878–84.
29. Stringaris K, Adams S, Uribe M et al. Donor KIR Genes 2DL5A, 2DS1 and 3DS1 are associated with a reduced rate of leukemia relapse after HLA-identical sibling stem cell transplantation for acute myeloid leukemia but not other hematologic
malignancies. Biol Blood Marrow Transplant 2010: 16: 1257–64.
30. Hsu KC, Gooley T, Malkki M et al. KIR ligands and prediction of relapse after unrelated donor hematopoietic cell transplantation for hematologic malignancy. Biol Blood Marrow Transplant 2006: 12: 828–36.
31. Miller JS, Cooley S, Parham P et al. Missing KIR ligands are associated with less relapse and increased graft-versus-host disease (GVHD) following unrelated donor allogeneic HCT. Blood 2007: 109: 5058–61.
32. Cooley S, Trachtenberg E, Bergemann TL et al. Donors with group B KIR haplotypes improve relapse-free survival after unrelated hematopoietic cell transplantation for acute myelogenous leukemia. Blood 2009: 113: 726–32.
33. Cooley S, Weisdorf DJ, Guethlein LA et al. Donor selection for natural killer cell receptor genes leads to superior survival after unrelated transplantation for acute myelogenous leukemia. Blood 2010: 116: 2411–9.
34. Venstrom JM, Pittari G, Gooley TA et al. HLA-C-dependent prevention of leukemia relapse by donor activating KIR2DS1. N Engl J Med 2012: 367: 805–16.
35. Peruzzi M, Wagtmann N, Long EO. A p70 killer cell inhibitory receptor specific for several HLA-B allotypes discriminates among peptides bound to HLA-B*2705. J Exp Med 1996: 184: 1585–90.
36. Rajagopalan S, Long EO. The direct binding of a p58 killer cell inhibitory receptor to human histocompatibility leukocyte antigen (HLA)-Cw4 exhibits peptide selectivity. J Exp Med 1997: 185: 1523–8.
37. Boyington JC, Motyka SA, Schuck P, Brooks AG, Sun PD. Crystal structure of an NK cell immunoglobulin-like receptor in complex with its class I MHC ligand. Nature
2000: 405: 537–43.
38. Fan QR, Long EO, Wiley DC. Crystal structure of the human natural killer cell inhibitory receptor KIR2DL1-HLA-Cw4 complex. Nat Immunol 2001: 2: 452–60. 39. Baron F, Petersdorf EW, Gooley T et al. What is the role for donor natural killer
cells after nonmyeloablative conditioning? Biol Blood Marrow Transplant 2009: 15: 580–8.
40. Wu CJ, Yang XF, McLaughlin S et al. Detection of a potent humoral response associated with immune-induced remission of chronic myelogenous leukemia. J Clin Invest 2000: 106: 705–14.
multiple myeloma is associated with antibody response to BCMA, a plasma-cell membrane receptor. Blood 2005: 105: 3945–50.
42. Bray RA, Hurley CK, Kamani NR et al. National marrow donor program HLA matching guidelines for unrelated adult donor hematopoietic cell transplants. Biol Blood Marrow Transplant 2008: 14: 45–53.
43. Kawase T, Morishima Y, Matsuo K et al. High-risk HLA allele mismatch
combinations responsible for severe acute graft-versus-host disease and implication for its molecular mechanism. Blood 2007: 110: 2235–41.
44. Shaw BE, Gooley TA, Malkki M et al. The importance of HLA-DPB1 in unrelated donor hematopoietic cell transplantation. Blood 2007: 110: 4560–6.
45. Fleischhauer K, Shaw BE, Gooley T et al. Effect of T-cell-epitope matching at HLA-DPB1 in recipients of unrelated-donor haemopoietic-cell transplantation: a retrospective study. Lancet Oncol 2012: 13: 366–74.
46. Kawase T, Matsuo K, Kashiwase K et al. HLA mismatch combinations associated with decreased risk of relapse: implications for the molecular mechanism. Blood 2009: 113: 2851–8.
47. Shaw BE, Mayor NP, Russell NH et al. Diverging effects of HLA-DPB1 matching status on outcome following unrelated donor transplantation depending on disease stage and the degree of matching for other HLA alleles. Leukemia 2010: 24: 58–65. 48. Anasetti C, Logan BR, Lee SJ et al. Peripheral-blood stem cells versus bone marrow
from unrelated donors. N Engl J Med 2012: 367: 1487–96.
49. Deeg HJ, Spitzer TR, Cottler-Fox M, Cahill R, Pickle LW. Conditioning-related toxicity and acute graft-versus-host disease in patients given
methotrexate/cyclosporine prophylaxis. Bone Marrow Transplant 1991: 7: 193–8. 50. Clift RA, Buckner CD, Appelbaum FR et al. Allogeneic marrow transplantation in
patients with chronic myeloid leukemia in the chronic phase: a randomized trial of two irradiation regimens. Blood 1991: 77: 1660–5.
51. Mielcarek M, Martin PJ, Leisenring W et al. Graft-versus-host disease after
nonmyeloablative versus conventional hematopoietic stem cell transplantation. Blood
2003: 102: 756–62.
52. Rotta M, Storer BE, Storb R et al. Impact of recipient statin treatment on graft-versus-host disease after allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant 2010: 16: 1463–6.
53. Rotta M, Storer BE, Storb RF et al. Donor statin treatment protects against severe acute graft-versus-host disease after related allogeneic hematopoietic cell
54. Deeg HJ, Storer BE, Boeckh M et al. Reduced incidence of acute and chronic graft-versus-host disease with the addition of thymoglobulin to a targeted
busulfan/cyclophosphamide regimen. Biol Blood Marrow Transplant 2006: 12: 573–84. 55. Soiffer RJ, Lerademacher J, Ho V et al. Impact of immune modulation with
anti-T-cell antibodies on the outcome of reduced-intensity allogeneic hematopoietic stem cell transplantation for hematologic malignancies. Blood 2011: 117: 6963–70. 56. Bashey A, Medina B, Corringham S et al. CTLA4 blockade with ipilimumab to treat
relapse of malignancy after allogeneic hematopoietic cell transplantation. Blood 2009: 113: 1581–8.
57. Zhou J, Bashey A, Zhong R et al. CTLA-4 blockade following relapse of malignancy after allogeneic stem cell transplantation is associated with T cell activation but not with increased levels of T regulatory cells. Biol Blood Marrow Transplant 2011: 17: 682–92.
58. Topalian SL, Hodi FS, Brahmer JR et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012: 366: 2443–54.
59. Brahmer JR, Tykodi SS, Chow LQ et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012: 366: 2455–65.
60. Maury S, Lemoine FM, Hicheri Y et al. CD4 + CD25+ regulatory T cell depletion improves the graft-versus-tumor effect of donor lymphocytes after allogeneic hematopoietic stem cell transplantation. Sci Transl Med 2010: 2: 41–52. 61. Kwak LW, Taub DD, Duffey PL et al. Transfer of myeloma idiotype-specific
immunity from an actively immunised marrow donor. Lancet 1995: 345: 1016–20. 62. Cabrera R, Diaz-Espada F, Barrios Y et al. Infusion of lymphocytes obtained from a
donor immunised with the paraprotein idiotype as a treatment in a relapsed myeloma.
Bone Marrow Transplant 2000: 25: 1105–8.
63. Neelapu SS, Munshi NC, Jagannath S et al. Tumor antigen immunization of sibling stem cell transplant donors in multiple myeloma. Bone Marrow Transplant 2005: 36: 315–23.
64. Sergeeva A, Alatrash G, He H et al. An anti-PR1/HLA-A2 T-cell receptor-like antibody mediates complement-dependent cytotoxicity against acute myeloid leukemia progenitor cells. Blood 2011: 117: 4262–72.
65. Rousseau RF, Biagi E, Dutour A et al. Immunotherapy of high-risk acute leukemia with a recipient (autologous) vaccine expressing transgenic human CD40L and IL-2 after chemotherapy and allogeneic stem cell transplantation. Blood 2006: 107: 1332–41.
GM-CSF-secreting leukemia cell vaccines early after allogeneic stem cell transplantation. Proc Natl Acad Sci U S A 2009: 106: 15825–30.
67. Riddell SR, Watanabe KS, Goodrich JM, Li CR, Agha ME, Greenberg PD.
Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science 1992: 257: 238–41.
68. Rooney CM, Smith CA, Ng CY et al. Use of gene-modified virus-specific T
lymphocytes to control Epstein-Barr-virus-related lymphoproliferation. Lancet 1995: 345: 9–13.
69. Leen AM, Myers GD, Sili U et al. Monoculture-derived T lymphocytes specific for multiple viruses expand and produce clinically relevant effects in
immunocompromised individuals. Nat Med 2006: 12: 1160–6.
70. Hanley PJ, Cruz CR, Savoldo B et al. Functionally active virus-specific T cells that target CMV, adenovirus, and EBV can be expanded from naive T-cell populations in cord blood and will target a range of viral epitopes. Blood 2009: 114: 1958–67.
71. Heemskerk MH, Hoogeboom M, Hagedoorn R, Kester MG, Willemze R, Falkenburg JH. Reprogramming of virus-specific T cells into leukemia-reactive T cells using T cell receptor gene transfer. J Exp Med 2004: 199: 885–94.
72. Cooper LJ, Al-Kadhimi Z, Serrano LM et al. Enhanced antilymphoma efficacy of CD19-redirected influenza MP1-specific CTLs by cotransfer of T cells modified to present influenza MP1. Blood 2005: 105: 1622–31.
73. Micklethwaite KP, Savoldo B, Hanley PJ et al. Derivation of human T lymphocytes from cord blood and peripheral blood with antiviral and antileukemic specificity from a single culture as protection against infection and relapse after stem cell
transplantation. Blood 2010: 115: 2695–703.
74. Kochenderfer JN, Wilson WH, Janik JE et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 2010: 116: 4099–102.
75. Savoldo B, Ramos CA, Liu E et al. CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients. J Clin Invest 2011: 121: 1822–6.
76. Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen
receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med 2011: 365: 725–33.
77. Brentjens RJ, Riviere I, Park JH et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood 2011: 118: 4817–28.
78. Kochenderfer JN, Dudley ME, Feldman SA et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood 2012: 119: 2709–20.
79. Kochenderfer JN, Dudley ME, Maric I et al. Dramatic regression of chronic lymphocytic leukemia in the first patient treated with donor-derived
genetically-engineered anti-CD19-chimeric-antigen-receptor-expressing T cells after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant
2011: 17: S158.
80. Provasi E, Genovese P, Lombardo A et al. Editing T cell specificity towards leukemia by zinc finger nucleases and lentiviral gene transfer. Nat Med 2012: 18: 807–15.