ラット多臓器発がんモデルにおけるプロポリスの発がん修飾作用
武
下
正
憲
大阪市立大学大学院医学研究科 分子病理学
Modifying Effects of Brazilian Green Propolis in a Rat Multi-organ Carcinogenesis Bioassay
Masanori Takeshita(Department of Molecular Pathology, Osaka City University Graduate School of Medicine)
Abstract
[Objective] Propolis has widely been used in holistic medicine worldwide and has also drawn attention as a health
food. In the present study, post-initiation modifying effects and mechanisms of action of the ethanol-extracted Brazilian green propolis (EEP) in multiple organs were investigated using a rat medium-term multi-organ carcinogenesis bioassay.
[Materials and Methods] A total of 104, 6-week-old male Fisher 344 rats were treated with 5 carcinogens
(diethylnitrosamine, DEN; N-methyl-N-nitrosourea, MNU; N-butyl-N-(4-hydroxybutyl) nitrosamine, BBN;
1,2-dimethylhydrazine, DMH; and N-bis (2-hydroxypropyl) nitrosamine, DHPN; DMBDD) to initiate carcinogenesis in
multiple organs during the first 4 weeks. One week after the initiation treatments, EEP was administered to rats at different doses (0%, 0.04%, 0.2%, 1%) in their basal diet for 30 weeks.
[Results] Tumor incidence and multiplicity of colorectal tumors were significantly decreased in rats treated with EEP
at doses of 0.2% and above compared with the controls. Expression levels of NFκB were significantly reduced in colorectal tumors in rats treated with EEP at doses of 0.04% and above. GST-P positive foci, a preneoplastic lesion in rat livers, were singnificantly increased in rats treated with EEP at doses of 0.2% and above. Incidence and the multiplicity of bladder tumor were significantly increased in rats treated with 1% EEP. No carcinogenic modifying effects of EEP were observed in other organs.
[Conclusions] These results suggested that EEP is a useful chemopreventive agent in rat colon carcinogenesis and it
exerts anti-tumor effects through anti-inflammatory effects. Since EEP is carcinogenic to liver and urinary bladder in our previous 2-year carcinogenicity study in rats and the promotion effects of EEP on bladder is rat-specific, the promoting effects of EEP in the present studies are not likely relevant to humans.
要 約
【目的】プロポリスはサプリメントなどの健康食品や化粧品の原料として広く使用されている.本研究では,ラット 中期多臓器発がん性試験法を用いてブラジル産エタノール抽出グリーンプロポリス(EEP)の発がん修飾作用およびそ の機序について検討を行った.
【対象と方法】動物は 6 週齢雄性 F344 ラット 104 匹を用いた.実験開始時より 4 週間で,5 種類の発がん性物質 (diethylnitrosamine, DEN; N-methyl-N-nitrosourea, MNU; N-butyl-N-(4-hydroxybutyl) nitrosamine, BBN;
1,2-dimethylhydrazine, DMH; N-bis (2-hydroxypropyl) nitrosamine, DHPN; DMBDD)を投与する DMBDD 処置を おこない,1 週間の休薬期間の後,0%,0.04%,0.2%,1% の用量で EEP 粉末を混餌投与した.動物は,35 週時に吸 入麻酔下で屠殺され,全身諸臓器に対する post-initiation 期における発がん修飾作用を検索した. 【結果】大腸において,0.2% 以上の EEP 投与群にて腫瘍発生頻度と発生個数の有意な抑制を認めた.更に EEP 投与 群の大腸腫瘍では,0.04% 以上の EEP 投与群で炎症性マーカーである NFκB の発現の有意な抑制が認められた.一方, 肝臓において,0.2% 以上のプロポリス投与群にて肝前がん病変の指標である GST-P 陽性細胞巣の有意な増加がみられ 受付 平成 29 年 1 月 19 日,受理 平成 29 年 4 月 18 日
諸
言
プロポリスは,植物が新芽や新葉の傷口を保護するため に分泌される滲出物を,ミツバチが唾液と混合したもので あり,ミツバチの巣の隙間を塞いで寒気の侵入を防ぎ,巣 の無菌状態を保つ働きをする.プロポリスの構成要素は, 植物に由来する滲出物や気候,地理的条件によって大きく 異なり,その化学組成も地域によって千差万別である1-3). 一方,民間薬としてのプロポリスは紀元前 300 年頃から 心臓病や炎症性疾患などに対して用いられており3,4),現在 でもわが国をはじめ,アメリカ,ヨーロッパ,ブラジルに おいて健康食品として,あるいは病気の治療薬として幅広 く使用されている5,6). プロポリスおよびその成分には,抗菌作用7-9),抗ウイル ス作用10,11),抗酸化作用12,13),抗炎症作用14,15)などがあり, その他にも免疫調節機能16),抗腫瘍作用17,18)など様々な生 物学的および薬理学的活性が報告されている.現在ではサ プリメントや機能性食品のみではなく,化粧品や医薬品等 への応用が期待されている. 低木種キク科バッカリス属のアレクリン・ド・カンポ (Baccharis dracunculifolia DC)の新芽を起源とするブラ ジル産プロポリスは,その色からグリーンプロポリスとし て広く知られている19,20).構成成分として,エタノール抽 出グリーンプロポリス(ethanol-extracted green propolis;EEP)ではプレニル化桂皮酸誘導体であるアルテピリン C,バッカリン,ドゥルパニンなど桂皮酸誘導体が多く含 まれており21),水抽出グリーンプロポリスではクロロゲン 酸,カフェオイルキナ酸,クマル酸が多く含まれている22). EEP は,水性抽出プロポリスよりもフラボノイドの濃度 が高く,フェノール酸およびフラボノイド,特にアルテピ リン C が豊富である.アルテピリン C は,抗真菌活性を 促進させ,抗酸化活性も高いと報告されている3,23). 農薬,医薬品,および化学物質の発がん性を含めた毒性 評価をするために,主にげっ歯類を用いた 2 年間の発がん 性試験が行なわれてきた.この試験法は多大なコストと 時間がかかり,また多数の動物が必要で動物愛護の観点 からも問題があるため,代替可能なラット中期多臓器発 がん性試験法(発がん物質 N- ニトロソジエチルアミン (diethylnitrosamine; DEN),N- メチル -N- ニトロソ尿素 (N-methyl-N-nitrosourea; MNU),N-n- ブチル -N- ブタ ン -4- オール - ニトロソアミン(N-butyl-N-(4-hydroxybutyl) nitrosamine; BBN),1,2- ジメチルヒドラジン二塩酸塩 (1,2-dimethylhydrazine; DMH)およびジイソプロパノー ルニトロソアミン(N-bis (2-hydroxypropyl) nitrosamine;
DHPN)(DMBDD)を投与する DMBDD モデル)が開 発された24).この方法では 5 種類の発がん物質を投与し, その後被検物質を様々な用量で post-initiation 期に投与 することで,前がん病変のみならず腫瘍発生そのものを生 体マーカーとして評価できる利点があり,発がん促進系の みならず発がん抑制系の全身臓器における検出に有効であ る25,26).本研究では,ブラジル産 EEP の発がん抑制作用 およびその機序について,げっ歯類を用いた動物実験にて 明らかにすることを目的として DMBDD モデルを用い, その post-initiation 期における発がん修飾作用を検索し た.同時に,ラットにおける生体毒性を病理学的,血液生 化学的に評価した.
対 象 と 方 法
1.化学物質 DMBDD モデルには,5 種類の発がん物質として,DEN, DMH,BBN(Tokyo Chemical Industry Co., Ltd., Tokyo, Japan),MNU(Wako Pure Chemical Industries, Ltd., Osaka, Japan),DHPN(Nacalai Tesque Inc., Kyoto, Japan)を使用Key Word: Propolis,Chemoprevention,Colon carcinogenesis,NFκB,Rat
略語: EEP; ethanol-extracted Brazilian green propolis,DEN; diethylnitrosamine,MNU; N-methyl-N-nitrosourea,
BBN; N-butyl-N-(4-hydroxybutyl) nitrosamine,DMH; 1,2-dimethylhydrazine,DHPN; N-bis (2-hydroxypropyl)
nitrosamine,DMBDD; multiple initiation regimen of DEN, MNU, BBN, DMH, and DHPN,PN; papillary or nodular,PCNA; proliferating cell nuclear antigen,NFκB; nuclear factor kappa B,iNOS; inducible nitric oxide synthase,TUNEL; terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,GST-P; glutathione S-transferase placental form
た.また,膀胱においては,1% プロポリス投与群にて膀胱がんの発生頻度と発生個数ともに対照群に比較して有意な 増加がみられた.その他全身諸臓器における発がん修飾作用は認められなかった. 【結論】本研究により EEP のラット大腸に対する発がん抑制効果が明らかとなった.そのメカニズムとして EEP に よる抗炎症作用の関与が示唆された.ラット肝臓および膀胱において発がん促進作用がみられたが,これまでの研究で EEP によるラットに対する発がん作用はみられていないこと,さらに EEP による膀胱発がん促進機序についてはラッ ト特異的であることから,EEP による発がん促進作用についてはヒトへの外挿性はないと考えられた.
した.ブラジル産 EEP およびデキストリンはアピ株式会社 (API Co., Ltd., Gifu, Japan)より供与されたものを使用した.
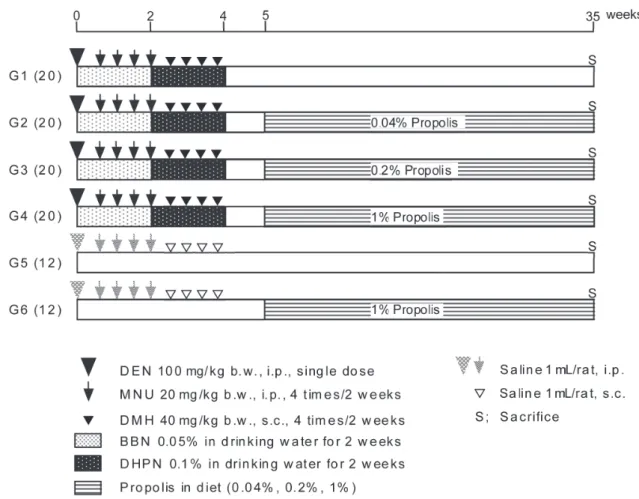
2.実験動物および実験プロトコール
実験動物として,5 週齢の雄性 F344 ラット(Charles river laboratories Japan, Inc., Kanagawa, Japan)計 104 匹を用い た.動物は,紙の床敷を入れたプラスチック製ケージに 3 匹ず つ無作為に分け,室温 24±2℃,湿度 60±10%,明期 12 時間の 照明条件,自由飲水下で飼育した.実験プロトコールを Figure 1 に示す.動物搬入後 7 日間を馴化期間とし,水道水とデキスト リン 1% 含有の MF 粉末飼料を基礎食として与えた.実験開始 8 日目に,平均体重がほぼ同一になるように,第 1 から第 4 群 を DMBDD 処置群(20 匹ずつ)として,第 5,6 群を非 DMBDD 処置群(12 匹ずつ)として無作為に計 6 群に分けて試験に供 した.実験開始日から 4 週間,第 1 から第 4 群には DEN(処 置開始日に単回腹腔内投与:100 mg/kg 体重),MNU(開始後 第 5,8,12,15 日 に 腹 腔 内 投 与:20 mg/kg 体 重×4 回 ), BBN(第 1 から第 2 週に飲水投与:0.05%(v/v)),DMH(第 19,22,26,29 日に pH7 に調整後,皮下投与:40 mg/kg 体重 ×4 回 ) お よ び DHPN( 第 3,4 週 に 飲 水 投 与:0.1%(v/v)) からなる多臓器イニシエーション処置(DMBDD 投与)を行っ た.第 5,6 群は対照群とし,DEN,MNU,DMH 投与の代 わ り に 0.9% 生 理 食 塩 水(Otsuka Pharmaceutical Factory, Inc., Tokushima, Japan)を腹腔内投与,または皮下投与した(1
mL/ラット).1 週間の休薬期間の後,第 1 から第 4 群には 0%, 0.04%,0.2%,1% の EEP を 混 餌 投 与 し た. 第 5,6 群 に は 0% ならびに 1% の EEP を混餌投与した.試験開始から第 35 週まで毎週飲水量,摂餌量,体重を測定し,一般状態の観察も 併せて行った.第 35 週時に吸入麻酔下にて腹部大動脈より採 血を各群 7 匹ずつ行い,放血による安楽殺を行った.残りの動 物についても同様に腹部大動脈放血による安楽殺を実施した. 食道,胃十二指腸,小腸(空腸および回腸),盲腸,脾臓,甲 状腺,肺,胸腺,肝臓,腎臓を採取して腫瘍性病変の有無につ いて肉眼的に観察し,また腫瘍性病変について病理組織学的検 索を行った. 肝臓および腎臓では臓器重量測定を実施した後に組織を切り 出し,ホルムアルデヒドを含む中性リン酸緩衝 10% ホルマリ ン液で固定した.肺,消化管および膀胱はホルマリンで膨らま せた.なお,大腸は周囲の脂肪組織などを除去した後に,長軸 方向に切り開いて腸管内を生食で洗浄後濾紙にはさみ,ホルマ リンで 3 日間固定を行った. なお動物の取り扱いは,大阪市立大学動物実験管理規定およ び社団法人日本実験動物学会の動物取り扱い規約に準拠して 行った. 3.血液検査の分析 動脈採血した血液分析には,自動血球分析装置 Sysmex XE- 2100(Sysmex Corporation, Hyogo, Japan)を用い,白血球数,
Fig. 1 Experimental protocol on rat multi-organ carcinogenesis. DEN, diethylnitrosamine; MNU, N-methyl-N- nitrosourea; BBN,
赤血球数,ヘモグロビン,ヘマトクリット,血小板数,MCV, MCH,MCHC を測定した.総蛋白,アルブミン,AST(GOT), ALT(GPT),ALP,γ-GTP,総ビリルビン,直接ビリルビン, 間接ビリルビン,血清アミラーゼ,クレアチニン,尿酸,尿素 窒素,中性脂肪,総コレステロール,ナトリウム,カリウム, クロールの生化学データについては,㈱三菱化学メディエンス に測定を依頼し検査結果を得た. 4.病理組織学的検索 ホルマリン固定を実施した臓器についてパラフィン切片を作 製し,ヘマトキシリン・エオジン(Hematoxylin Eosin; HE) 染色したのちに,光学顕微鏡 BX50(Olympus Corporation, Tokyo, Japan)を用いて,毒性病理用語・診断基準国際統一化 事業(International Harmonization of Nomenclature and Diagnostic Criteria(INHAND)Project)27-31)に則り腫瘍性病 変について病理組織学的検索を行った.
5.大腸粘膜上皮における免疫組織学的検索
細胞増殖の指標である増殖細胞核抗原(proliferating cell nuclear antigen; PCNA),炎症および免疫関連転写因子である nuclear factor kappa B(NFκB),酸化的ストレスの指標であ る inducible nitric oxide synthase(iNOS)の免疫組織化学染 色をそれぞれ行った.染色に用いた各抗体は,抗 PCNA ウサギ モノクローナル抗体(DAKO Co., Copenhagen, Denmark),抗 NFκB p65 ウサギモノクローナル抗体(Santa Cruz Biotechnology Inc, CA, USA)および抗 iNOS ウサギモノクローナル抗体(BD Biosciences, New Jersey, USA)である.PCNA 染色について は腫瘍上皮細胞における陽性率について,iNOS 染色について は腫瘍間質細胞における陽性率について評価した.NFκB 染色 については腫瘍の上皮細胞および間質細胞における強弱 2 段階 の染色レベルに分け評価した.すなわち,レベル 1(+):染色 陽性細胞の割合が 0%~25%,レベル 2(++):染色陽性細胞の 割合が 25% 以上とした.アポトーシスについて評価するため に ApopTag® Peroxidase In Situ Apoptosis Detection Kit
S7100(EMD Millipore Corporation, CA, USA) を 用 い た terminal deoxynucleotidyl transferase-mediated dUTP nick- end labeling(TUNEL)法により,腫瘍上皮細胞における陽 性率を検討し評価を行った.
6.肝臓における GST-P 陽性細胞巣の定量的評価
肝臓に対する EEP の発がん修飾作用について明らかにする ために肝前がん病変の指標である胎盤型グルタチオン S- 転移 酵 素(glutathione S-transferase placental form; GST-P) の
免疫組織学染色32)を実施し,画像解析装置(IPAP)(Sumika
Technoservice Corporation, Osaka, Japan)を用いて,直径 0.2 mm 以上(面積 0.0314 mm2以上)のものを選択し,肝単位面
積(1 cm2)当たりの個数および面積の定量的解析を行った.
7.統計学的分析
統計解析には Windows ソフトウェアの GraphPad Prism5 (GraphPad Software, Inc., CA, USA)を用い,2 群間の比較 には等分散性について F-test を行い,等分散の場合は t-test を,不等分散の場合は Welch’s t-test を用いて有意差検定を 行った.また,DMBDD 処置の 4 群間の比較には等分散性に ついて Bartlett 検定を行い,等分散の場合は Dunn test を, 不等分散の場合は Dunnett’s test を用いて有意差検定を行っ た.グループ間の病変発生率の差異の有意性は,Fisher’s
exact probability test により評価した.いずれの場合も,p<
0.05 未満を統計学的有意とみなした.
結
果
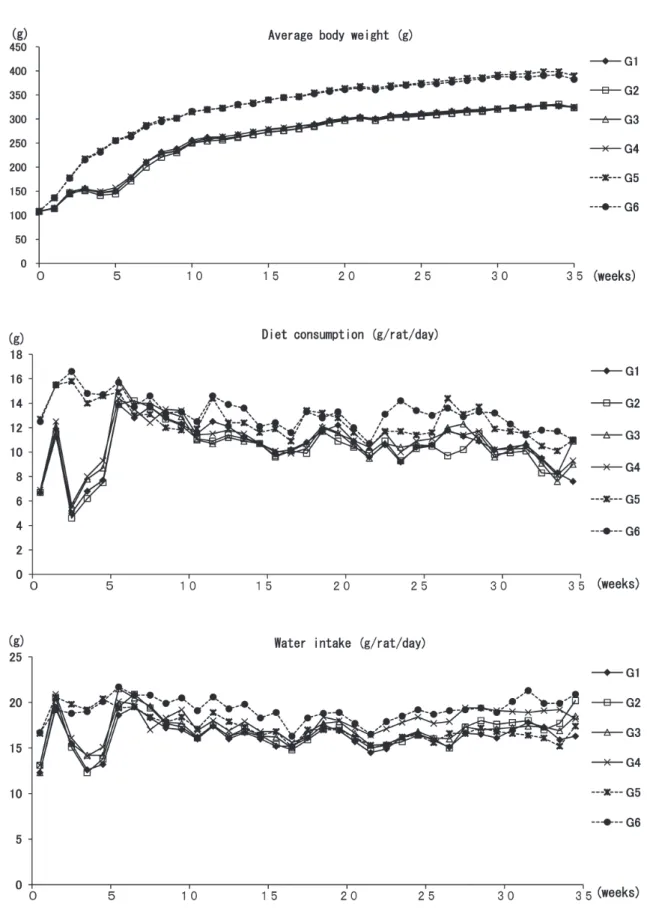
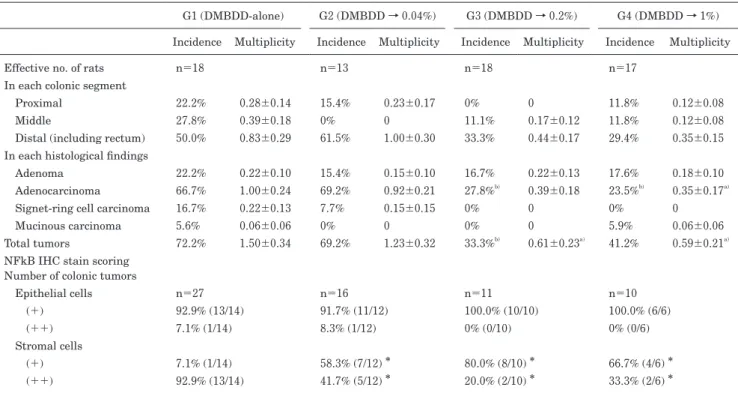
1.一般状態 本試験において実験終了時までに,合計 14 匹の動物が中途 死亡した.途中死亡数および生存数についての DMBDD 処置 群間および非 DMBDD 処置群間のそれぞれの群内間での差は なく,また EEP 投与による死亡数の増加はみられなかった. 解剖による死因検索の結果,64.3%(9 匹)が巨大腫瘍による 死であり,特に腎臓,肺,胸腺などに致死的腫瘍が形成されて いた.21.4%(3 匹)は両側性の高度な肺出血を認め,一部気 管内も血液に満たされていたが,これらのラットに明らかな腫 瘍は認めなかった.残りの 2 匹については原因不明であった. なお,これら中途死亡例の取り扱いに関しては,腫瘍の定性的 評価には使用可能だが,前がん病変の評価や,多数切片上での 定量的解析の評価には不向きであり,原則的に最終堵殺ラット における定量解析データからは除外した. 各群の体重推移,摂餌量および飲水量を Figure 2 に示した. 実験期間を通じて,体重推移,摂餌量において EEP 投与群は 各コントロール群と同様の推移を示した.また,6 週から 35 週の飲水量については,DMBDD および非 DMBDD 処置群と もに,EEP 非投与の各コントロール群と比較して各 1% EEP 投与群で有意な増加がみられた.しかし,EEP 投与の用量相 関性はみられなかった. 2.最終体重,臓器重量と EEP 摂取量 各群平均の最終体重,臓器重量と EEP 摂取量を Table 1 に 示した. 最終体重については,EEP 投与による有意な体重変化はみ られず,用量相関性もなかった.相対肝重量は DMBDD 単独 群と比較して DMBDD 処置 1% EEP 投与群で有意に増加し た. そ の ほ か の 臓 器 に つ い て,DMBDD 処 置 群 お よ び 非 DMBDD 処置群ともに EEP 投与による有意な変化はみられな かった. 3.血液検査データ 1)血球系:血球パラメータに関しては,DMBDD 処置群なら びに非 DMBDD 処置群において EEP による有意な変動は認め なかった(Table 2). 2)生化学系:非 DMBDD 処置群においては,無処置群に比較 し て,1% EEP 単 独 投 与 群 で は,GOT/GPT/ALP お よ び triglyceride が有意に低下した.アミラーゼについても無処置 群 に 比 較 し て,1% EEP 単 独 群 で 有 意 に 増 加 し た. 一 方, DMBDD 処置群においては,EEP 投与による有意な変動はみ られなかった(Table 2). 4.大腸における腫瘍性病変,免疫組織学的およびアポトーシ スの評価 大腸における腫瘍性病変の発生頻度と発生個数を Table 3 に 示した.Distal segment には直腸が含まれている.全ての印 環細胞がん(signet-ring cell carcinoma)と粘液がん(mucinous carcinoma)は,proximal のリンパ組織近傍から発生していた. DMBDD 処置群において,コントロール群に比して 0.2% 以上 の EEP 投与群にて,大腸における腫瘍発生は有意に抑制され ていた.大腸腫瘍細胞における PCNA 免疫組織学的評価および iNOS 免疫組織学的評価では,EEP の投与の如何にかかわらず,群 間に有意な差はみられなかった(Fig. 3).しかし,NFκB 染 色については,腫瘍間質細胞に有意な発現の抑制がみられた (Table 3).また,大腸粘膜上皮におけるアポトーシスの評価 のための TUNEL 染色については,EEP の投与の如何に関わ らず,群間に有意な差はみられなかった(Fig. 3).
Table 1 Average body, organs weights and propolis consumption Groups (treatment) Effective no. of rats Final body weights (g)
Relative organ weights (% body weights) Food consumption Propolis intake Liver Kidneys Spleen (g/kg BW /day)Average (g/60 kg BW /day)Average G1 (DMBDD-alone) n=18 324.5±31.7 2.60±0.40 0.79±0.14 0.28±0.05 19.41±1.60 0 G2 (DMBDD → 0.04% Propolis) n=13 323.5±27.5 2.73±0.14 0.77±0.09 0.29±0.06 18.57±1.39 0.445±0.033 G3 (DMBDD → 0.2% Propolis) n=18 324.2±20.0 2.67±0.14 0.71±0.10 0.26±0.04 19.18±0.82 2.301±0.16 G4 (DMBDD → 1% Propolis) n=17 325.6±20.7 2.81±0.09 * 0.73±0.10 0.28±0.11 19.46±1.92 11.67±1.15 G5 (Vehicle-alone) n=12 390.1±25.9 ** 2.54±0.15 0.54±0.03 0.18±0.02 21.80±1.59 0 G6 (Vehicle → 1% Propolis) n=12 382.5±26.3** 2.59±0.14 0.56±0.05 0.17±0.01 22.23±1.37 13.34±0.80
Values are expressed as mean±SD. *
Significantly different from G1 at p<0.05. **
Significantly different from G1-4 at p<0.05. BW,
body weight; and DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine.
Table 2 Hematologic and serum biochemical values
Groups (Treatment) G1 (DMBDD-alone) G2 (DMBDD →0.04% Propolis) G3 (DMBDD →0.2% Propolis) G4 (DMBDD →1% Propolis) G5 (Vehicle-alone) G6 (Vehicle →1% Propolis) Effective no. of rats n=7 n=7 n=7 n=7 n=7 n=7
Complete blood count
WBC (/μL) 2314±641 2829±1538 2543±991 2943±1182 1943±346 2243±378 RBC (×104 /μL) 801±73 834±49 771±123 802±30 853±20 828±22 Hb (g/dL) 13.5±0.6 13.4±0.7 12.0±2.7 12.7±0.7a) 14.4±0.2 14.0±0.3b) Hematocrit (%) 41.7±2.2 42.0±1.6 38.5±7.1 40.3±2.2 44.8±1.0 43.2±0.8b) Platelet count (×104/μL) 55.8±4.8 61.0±9.6 67.6±23.3 68.6±16.1 57.7±2.7 65.0±2.7b) Serum biochemistry Total protein (g/dL) 6.4±0.3 6.4±0.2 6.0±0.5 6.3±0.2 6.4±0.1 6.4±0.2 Albumin (g/dL) 3.1±0.1 3.1±0.1 3.0±0.3 3.0±0.2 3.1±0.1 3.1±0.1 T-bil (mg/dL) 0.2±0.0 0.2±0.0 0.2±0.0 0.2±0.0 0.2±0.0 0.2±0.0 GOT (IU/L) 106±30 116±10 105±17 112±31 123±19 85±8b) GPT (IU/L) 85±38 99±22 82±21 81±23 90±19 44±5b) ALP (IU/L) 556±85 812±217a) 569±141 730±332 585±48 507±52b) γ-GTP (IU/L) 1.9±0.7 3.0±1.3 1.7±0.8 3.6±4.6 1.3±0.5 1.1±0.4 Amylase (IU/L) 662±51 665±62 680±43 650±94 740±17 771±19b) BUN (mg/dL) 20±2 21±2 22±2 22±3 22±1 21±2 Creatinine (mg/dL) 0.29±0.02 0.30±0.03 0.35±0.08 0.35±0.09 0.34±0.02 0.35±0.03 Uric acid (mg/dL) 0.7±0.2 1.0±0.2a) 1.1±0.4a) 1.0±0.5 1.2±0.4 1.0±0.4 Total cholesterol (mg/dL) 75±6 83±8 78±10 73±8 76±6 70±9 Triglyceride (mg/dL) 34±8 29±6 49±38 31±20 60±7 45±13b) Na (mEq/L) 143±1 144±1 144±1 144±1 144±1 143±1 K (mEq/L) 4.0±0.4 4.0±0.2 4.2±0.4 4.3±0.5 4.1±0.3 4.3±0.3 Cl (mEq/L) 103±2 102±1 103±1 101±1 102±1 102±1
Values are expressed as mean±SD. a)p<0.05 vs G1. b)p<0.05 vs G5. WBC, white blood cell count; RBC,red blood cell count; Hb,
hemoglobin; T-bil, Total bilirubin; GOT, glutamic oxaloacetic transaminase; GPT, glutamic pyruvic transaminase; ALP, alkaline phosphatase; γ-GTP, γ-glutamyltranspeptidase; BUN, blood urea nitrogen; and DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine.
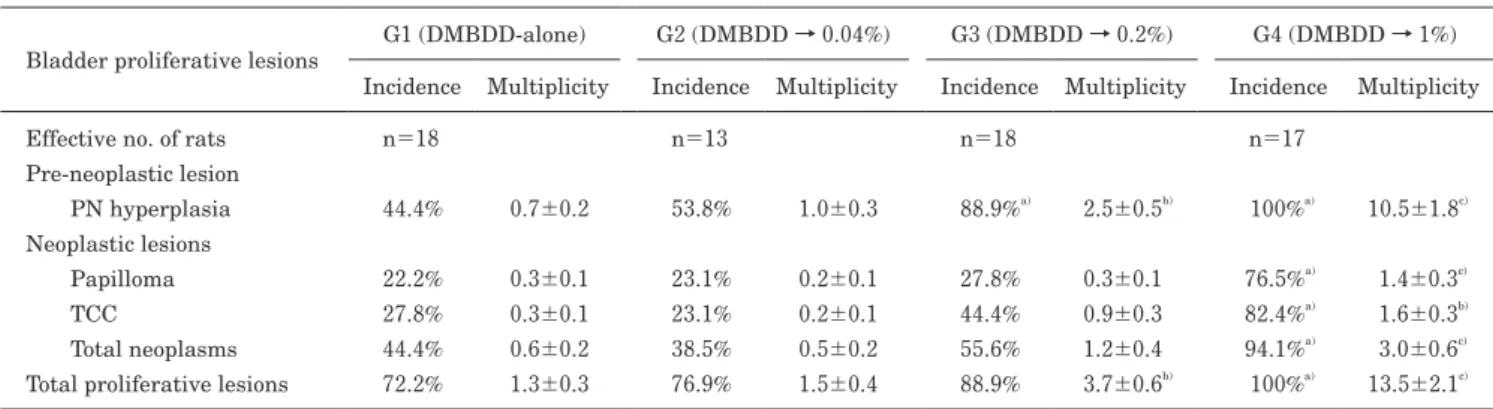
5.膀胱粘膜における増殖性病変
DMBDD 処置群において,膀胱粘膜における増殖性病変発生 頻度と発生個数を Table 4 に示した.膀胱粘膜上皮にける増殖 性病変の頻度と個数は,0.2% 以上の EEP 投与群にて有意かつ 用量依存性に増加し,特に 1% プロポリス投与群にて,乳頭腫 (papilloma)および移行上皮がん(transitional cell carcinoma;
TCC)の全腫瘍(total tumor)の発生頻度と発生個数ともにコ ントロール群に対し有意な増加がみられた.なお,非 DMBDD 処置群において腫瘍の発生は認められなかった. 6.肺における腫瘍性病変 切り出した肺組織の腫瘍性病変の発生頻度ならびに個数と組 織学的診断の結果を Table 5 にまとめた.DMBDD 処置によ り肉眼的に肺の表面には多数の白色結節性の病変が形成されて いたが,その個数(肺右葉,左葉,全体)において EEP 投与 による有意な変化は認められなかった.しかし,病変のサイズ に関しては,1% EEP 投与により 3 mm 以上の大型の個数が減 少傾向にあった.一方,DMBDD 処置群のミクロ所見では, 腺 腫(adenoma)(100%) お よ び 腺 が ん(adenocarcinoma) (82.4%~88.9%)の発生頻度に,有意差は認められず,肺の腫 瘍性病変における EEP での修飾作用は認められなかった. 7.肝における GST-P 陽性細胞巣および腫瘍性病変 非 DMBDD 処置群では肝 GST-P 陽性細胞巣の発生は認めら れなかった.また,DMBDD 処置群ではその個数と面積におい てコントロール群に対し,0.2% および 1% EEP 投与群にて有 意に増加した(Fig. 4).コントロール群と 0.04% EEP 投与群 では全く有意差はなかった.
Table 3 Incidences (%) and multiplicities (numbers/rat) of colorectal tumors in DMBDD-treated rats
G1 (DMBDD-alone) G2 (DMBDD → 0.04%) G3 (DMBDD → 0.2%) G4 (DMBDD → 1%) Incidence Multiplicity Incidence Multiplicity Incidence Multiplicity Incidence Multiplicity Effective no. of rats n=18 n=13 n=18 n=17
In each colonic segment
Proximal 22.2% 0.28±0.14 15.4% 0.23±0.17 0% 0 11.8% 0.12±0.08
Middle 27.8% 0.39±0.18 0% 0 11.1% 0.17±0.12 11.8% 0.12±0.08
Distal (including rectum) 50.0% 0.83±0.29 61.5% 1.00±0.30 33.3% 0.44±0.17 29.4% 0.35±0.15
In each histological findings
Adenoma 22.2% 0.22±0.10 15.4% 0.15±0.10 16.7% 0.22±0.13 17.6% 0.18±0.10 Adenocarcinoma 66.7% 1.00±0.24 69.2% 0.92±0.21 27.8%b) 0.39±0.18 23.5%b) 0.35±0.17a)
Signet-ring cell carcinoma 16.7% 0.22±0.13 7.7% 0.15±0.15 0% 0 0% 0
Mucinous carcinoma 5.6% 0.06±0.06 0% 0 0% 0 5.9% 0.06±0.06
Total tumors 72.2% 1.50±0.34 69.2% 1.23±0.32 33.3%b) 0.61±0.23a) 41.2% 0.59±0.21a)
NFkB IHC stain scoring Number of colonic tumors
Epithelial cells n=27 n=16 n=11 n=10 (+) 92.9% (13/14) 91.7% (11/12) 100.0% (10/10) 100.0% (6/6) (++) 7.1% (1/14) 8.3% (1/12) 0% (0/10) 0% (0/6) Stromal cells (+) 7.1% (1/14) 58.3% (7/12) * 80.0% (8/10) * 66.7% (4/6) * (++) 92.9% (13/14) 41.7% (5/12) * 20.0% (2/10) * 33.3% (2/6) *
Values are expressed as mean±SD or N (%). a,b, *Significantly different from G1 at p<0.05. For immunohistochemical evaluation of NFκB,
tumors were divided into epithelial and stromal areas and scored respectively as based on the current criterion under which the positively-stained cells were defined as follows: (+) , stained less than 25% cells; and (++) ,stained more than 25% cells. NFκB, nuclear factor kappa B; IHC, Immunohistochemical; and DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine,
1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine.
Fig. 3 Immunohistochemically positive cells indices (%) in colorectal tumors. PCNA, proliferating cell nuclear antigen; iNOS, inducible
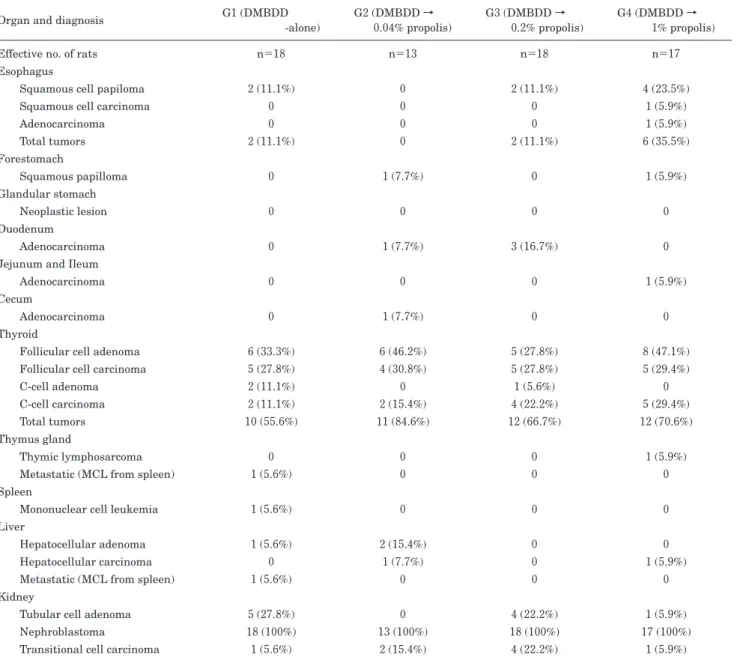
腫瘍性病変については,DMBDD 処置群において肝細胞腺 腫(hepatocellular adenoma; HCA)がコントロール群および 0.04% EEP 投与群にそれぞれ 1 個(5.6%),2 個(15.4%)み られ,肝細胞がん(hepatocellular carcinoma; HCC)は 0.04% および 1% EEP 投与群にそれぞれ 1 個(7.7%),1 個(5.9%) みられた(Table 6).いずれも発生数は少なく,各群間の有意 差はなかった. 8.その他,諸臓器における腫瘍性病変 DMBDD 処置群において,食道,前胃,十二指腸,小腸, 腎臓,甲状腺および胸腺では散発的に腫瘍の発生がみられた が,EEP 投与による有意な変化はみられなかった(Table 6). 非 DMBDD 処置群では腫瘍性病変の発生は皆無であり,1% EEP 単独投与にても,組織学的に明らかな病変はなかった.
考
察
本研究では,生理活性が強いとされるブラジル産 EEP を 用 い, ラ ッ ト 中 期 多 臓 器 発 が ん 性 試 験 法 で の post-initiation 期における発がん修飾作用を検討した.その結 果,EEP 投与群において大腸腫瘍の発生は用量相関性に 低下した.また,大腸腫瘍の炎症反応や細胞増殖に関わる NFκB の発現に抑制がみられたことから,EEP による大 腸腫瘍抑制作用のメカニズムに抗炎症作用が関与すること が示唆された.EEP における大腸の発がん抑制効果につ いてはいくつの報告があり33-38),その主たる生理活性物質 はカフェイン酸,アルテピリン C である.これまでに, EEP は pre-initiation 期のラット大腸において DMH 誘 発 DNA 損傷と前がん病変マーカーの異常腺窩巣(aberrantcrypt foci; ACF)の形成を抑制し,細胞増殖の調節による
早期大腸発がんの化学予防能力を有するなどの発がん抑制 作用が報告されている.
一方,膀胱の粘膜上皮においては増殖性病変が,0.2%
Table 4 Incidences (%) and multiplicities (average numbers/rat) of bladder proliferative lesions in DMBDD-treated rats
Bladder proliferative lesions G1 (DMBDD-alone) G2 (DMBDD → 0.04%) G3 (DMBDD → 0.2%) G4 (DMBDD → 1%) Incidence Multiplicity Incidence Multiplicity Incidence Multiplicity Incidence Multiplicity Effective no. of rats n=18 n=13 n=18 n=17
Pre-neoplastic lesion PN hyperplasia 44.4% 0.7±0.2 53.8% 1.0±0.3 88.9%a) 2.5±0.5b) 100%a) 10.5±1.8c) Neoplastic lesions Papilloma 22.2% 0.3±0.1 23.1% 0.2±0.1 27.8% 0.3±0.1 76.5%a) 1.4±0.3c) TCC 27.8% 0.3±0.1 23.1% 0.2±0.1 44.4% 0.9±0.3 82.4%a) 1.6±0.3b) Total neoplasms 44.4% 0.6±0.2 38.5% 0.5±0.2 55.6% 1.2±0.4 94.1%a) 3.0±0.6c)
Total proliferative lesions 72.2% 1.3±0.3 76.9% 1.5±0.4 88.9% 3.7±0.6b) 100%a) 13.5±2.1c)
Values are expressed as mean±SD or N (%). a) Significantly different from the control group 1 at p<0.05. b) Significantly different from groups
1 and 2 at p<0.05. c) Significantly different from groups 1, 2, and 3 at p<0.05. DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea,
N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine; PN, papillary or nodular; and TCC, transitional cell carcinoma.
Table 5 Macroscopic and microscopic lesions in the lungs of rats administerd propolis after DMBDD-initiation
G1 (DMBDD-alone) G2 (DMBDD → 0.04%) G3 (DMBDD → 0.2%) G4 (DMBDD → 1%) Effective no. of rats n=18 n=14 n=18 n=17
Average number of whitish nodular lesions/rat
Left lobe 37.6±2.2 38.6±1.4 38.9±1.2 39.8±1.1 Right lobes 57.1±3.1 57.1±3.2 59.2±2.7 61.4±2.2 Whole lungs 94.7±5.0 95.7±4.3 98.1±2.8 101.2±2.5 Diameter of lesions ≧3-<5 mm 17.3±1.6 15.0±1.5 15.5±1.1 13.5±1.0 ≧5-<10 mm 1.9±0.4 1.6±0.4 1.9±0.4 1.6±0.3 ≧10 mm 0 0.2±0.1 0 0
Incidences (%) and multiplicities of lung tumors
Adenoma (100%) 7.0±0.8 (100%) 6.4±0.7 (100%) 7.2±0.5 (100%) 6.4±0.4 Adenocarcinomaa) (83.3%) 2.4±0.4 (85.7%) 1.8±0.3 (88.9%) 1.8±0.3 (82.4%) 1.9±0.3
Total tumors (100%) 9.4±0.9 (100%) 8.1±0.8 (100%) 9.0±0.7 (100%) 8.4±0.7
Values are expressed as mean±SD or N (%). a) Adenocarcinoma includes adenosquamous carcinoma and squamous component.
DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine.
以上の EEP 投与群にて有意かつ用量依存性に増加したこ とから,膀胱発がん促進作用を有することが示された.こ のことは,以前の当研究室での EEP の膀胱発がん修飾作 用に関する研究39)において明らかにしてきたことと同じ結 果であり,ラット多臓器発がん性試験法が有効であること を証明している.その研究により,膀胱発がん促進作用の 機序として,EEP は用量相関性に尿沈殿物を増加させ, それの物理的刺激により膀胱粘膜の細胞増殖を増強させ, アポトーシスを阻害することが明らかになっている39).こ の膀胱発がんを促進する現象はラットに特異的で,ヒトに は外挿性がないことは明らかにされており40,41),よって EEP のラット膀胱発がん促進はヒトには外挿性がないこ とが示されている39). また,肝前がん病変の指標である GST-P 陽性細胞巣は, 0.2% 以上の EEP 投与群で有意に増加しているが,腫瘍 の発生は認められていない.Wistar Hannover ラットを 用いた EEP の 2 年間発がん性試験では,ラットに対して の肝発がん性はないことが明らかにされており42) ,今回の GST-P 陽性細胞巣の増加の意味は不明である.さらにこ の 2 年間発がん性試験では,自然発生のリンパ腫を抑制す るとともに生存率を伸ばすことが明らかにされており, ラットにおいては抗がん作用を示す食品と考えられた.ま た,EEP はラット体重に対する影響,臓器重量ならびに 血液データに,明らかな毒性を示さなかったことより,通 常使用量において,大腸発がんを抑制するとともに毒性が ほとんどみられない健康食品であることが明らかとなっ た.なお,本研究での有効性が認められた作用量は,ヒト 摂取の推奨用量(公益財団法人 日本健康・栄養食品協会 のプロポリス規格基準である 1 日の摂取目安量上限 500 mg43))に相当する 0.04% 以上であり,当該量の EEP に よる大腸発がんの抑制効果が期待された.
結
論
DMBDD モデルを用い,EEP の post-initiation 期にお ける発がん修飾作用を検索したところ,EEP のラット大 腸に対する発がん抑制効果が明らかとなった.そのメカニ ズムとして EEP による抗炎症作用の関与が示唆された. ラット肝臓および膀胱において発がん促進作用がみられた が,これまでの研究で EEP によるラットに対する発がん 作用はみられていないこと,さらに EEP による膀胱発が ん促進機序についてはラット特異的であることから,EEP による発がん促進作用についてはヒトへの外挿性はないと 考えられた. 謝 辞 本研究の遂行にあたり,懇切なる御指導,御高閲を賜りました大阪 Fig. 4 Quantitative analysis for GST-P positive cell foci (≧0.2 mm in diameter) per liver area (/cm2). *
Significantly different from the control group 1 at p<0.05. **
Significantly different from the control group 1 at p<0.01. DMBDD, diethylnitrosamine,
N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine; and GST-P, glutathione S-transferase placental form.
市立大学大学院医学研究科分子病理学の鰐渕英機教授に深謝いたしま す.また,御協力をいただいた諸先生方ならびに各研究室員に心より 感謝いたします.
文
献
1) Marcucci MC. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie 1995;26: 83-99.
2) Ghisalberti EL. Propolis: a review. Bee World 1979;60: 59-84.
3) Banskota AH, Tezuka Y, Adnyana IK, et al. Cytotoxic, hepatoprotective and free radical scavenging effects of propolis from Brazil, Peru, the Netherlands and China.
J Ethnopharmacol 2000;72:239-246.
4) Grunberger D, Banerjee R, Eisinger K, et al. Preferential cytotoxicity on tumor cells by caffeic acid phenethyl ester isolated from propolis. Experientia 1988;44:230-232. 5) Aga H, Shibuya T, Sugimoto T, et al. Isolation and
identification of antimicrobial compounds in Brazilian propolis. Biosci Biotechnol Biochem 1994;58:945-946. 6) Marcucci MC, De Camargo FA, Lopes CMA. Identification
of amino acids in Brazilian propolis. Z Naturforsch 1996; 51:11-14.
7) Bankova V, Marcucci MC, Simova S, et al. Antibacterial diterpenic acids from Brazilian propolis. Z Naturforsch C 1996;51:277-280.
Table 6 Incidences (%) of tumors in various organs in rats initiated with DMBDD-treatment
Organ and diagnosis G1 (DMBDD -alone) G2 (DMBDD → 0.04% propolis) G3 (DMBDD → 0.2% propolis) G4 (DMBDD → 1% propolis)
Effective no. of rats n=18 n=13 n=18 n=17
Esophagus
Squamous cell papiloma 2 (11.1%) 0 2 (11.1%) 4 (23.5%)
Squamous cell carcinoma 0 0 0 1 (5.9%)
Adenocarcinoma 0 0 0 1 (5.9%) Total tumors 2 (11.1%) 0 2 (11.1%) 6 (35.5%) Forestomach Squamous papilloma 0 1 (7.7%) 0 1 (5.9%) Glandular stomach Neoplastic lesion 0 0 0 0 Duodenum Adenocarcinoma 0 1 (7.7%) 3 (16.7%) 0
Jejunum and Ileum
Adenocarcinoma 0 0 0 1 (5.9%)
Cecum
Adenocarcinoma 0 1 (7.7%) 0 0
Thyroid
Follicular cell adenoma 6 (33.3%) 6 (46.2%) 5 (27.8%) 8 (47.1%) Follicular cell carcinoma 5 (27.8%) 4 (30.8%) 5 (27.8%) 5 (29.4%)
C-cell adenoma 2 (11.1%) 0 1 (5.6%) 0
C-cell carcinoma 2 (11.1%) 2 (15.4%) 4 (22.2%) 5 (29.4%)
Total tumors 10 (55.6%) 11 (84.6%) 12 (66.7%) 12 (70.6%)
Thymus gland
Thymic lymphosarcoma 0 0 0 1 (5.9%)
Metastatic (MCL from spleen) 1 (5.6%) 0 0 0
Spleen
Mononuclear cell leukemia 1 (5.6%) 0 0 0
Liver
Hepatocellular adenoma 1 (5.6%) 2 (15.4%) 0 0
Hepatocellular carcinoma 0 1 (7.7%) 0 1 (5.9%)
Metastatic (MCL from spleen) 1 (5.6%) 0 0 0
Kidney
Tubular cell adenoma 5 (27.8%) 0 4 (22.2%) 1 (5.9%)
Nephroblastoma 18 (100%) 13 (100%) 18 (100%) 17 (100%)
Transitional cell carcinoma 1 (5.6%) 2 (15.4%) 4 (22.2%) 1 (5.9%)
Values are expressed as mean±SD or N (%). Other organs: there were a few sporadic tumors in whole body including tongue, adrenal grand, prostate, Zymbal’s gland, and metastatic tumors were also seen in the lymph nodes. DMBDD, diethylnitrosamine, N-methyl-N-nitrosourea, N-butyl-N-(4-hydroxybutyl) nitrosamine, 1,2-dimethylhydrazine, and N-bis (2-hydroxypropyl) nitrosamine; and MCL, mononuclear cell leukemia.
8) Drago L, Mombelli B, De Vecchi E, et al. In vitro antimicrobial activity of propolis dry extract. J Chemother 2000;12:390-395.
9) Steinberg D, Kaine G, Gedalia I. Antibacterial effect of propolis and honey on oral bacteria. Am J Dent 1996;9: 236-239.
10) Bankova V, Christov R, Kujumgiev A, et al. Chemical composition and antibacterial activity of Brazilian propolis. Z Naturforsch C 1995;50:167-172.
11) Steinberg D, Kaine G, Gedalia I. Antibacterial effect of propolis and honey on oral bacteria. Am J Dent 1996;9: 236-239.
12) Krol W, Czuba Z, Scheller S, et al. Anti-oxidant property of ethanolic extract of propolis (EEP) as evaluated by inhibiting the chemiluminescence oxidation of luminol. Biochem Int 1990;21:593-597.
13) Pascual C, Gonzalez R, Torricella RG. Scavenging action of propolis extract against oxygen radicals. J Ethnopharmacol 1994;41:9-13.
14) Mizoeva OK, Calder PC. The effect of propolis and its components on eicosanoid production during the inflammatory response. Prostaglandins Leukot Essent Fatty Acids 1996;55:441-449.
15) Salatino A, Teixeira EW, Negri G, et al. Origin and chemical variation of Brazilian propolis. Evid Based Complement Alternat Med 2005;2:33-38.
16) Scheller S, Gazda G, Pietsz G, et al. The ability of ethanol extract of propolis to stimulate plaque formation in immunized mouse spleen cells. Pharmacol Res Commun 1988;20:323-328.
17) Chen CN, Weng MS, Wu CL, et al. Comparison of radical scavenging activity, cytotoxic effects and apoptosis induction in human melanoma cells by Taiwanese propolis from different sources. Evid Based Complement Alternat Med 2004;1:175-185.
18) Matsuno T. Isolation and characterization of the tumoricidal substance from Brazilian propolis. Honeybee Science 1992;13:49-54.
19) Park YK, Alencar SM, Aguiar CL. Botanical origin and chemical composition of Brazilian propolis. J Agric Food Chem 2002;50:2502-2506.
20) Kumazawa S, Yoneda M, Shibata I, et al. Direct evidence for the plant origin of Brazilian propolis by the observation of honeybee behavior and phytochemical analysis. Chem Pharm Bull (Tokyo) 2003;51:740-742.
21) Inokuchi Y, Shimazawa M, Nakajima Y, et al. Brazilian green propolis protects against retinal damage in vitro and in vivo. Evid Based Complement Alternat Med 2006; 3:71-77.
22) Mishima S, Narita Y, Chikamatsu S, et al. Effects of propolis on cell growth and gene expression in HL-60 cells. J Ethnopharmacol 2005;99:5-11.
23) Nakajima Y, Tsuruma K, Shimazawa M, et al. Comparison
of bee products based on assays of antioxidant capacities. BMC Complement Altern Med 2009;9:4.
24) Doi K, Wanibuchi H, Salim EI, et al. Revised rat multi-organ carcinogenesis bioassay for whole-body detection of chemopreventive agents: modifying potential of S-methylcysteine. Cancer Lett 2004;206:15-26.
25) Ito N, Imaida K, Tsuda H, et al. Wide-spectrum initiation models: possible applications to medium-term multiple organ bioassays for carcinogenesis modifiers. Jpn J Cancer Res 1988;79:413-417.
26) Doi K, Sakai K, Tanaka R, et al. Chemopreventive effects of 13alpha, 14alpha-epoxy-3beta-methoxyserratan-21beta-ol (PJJ-34), a serratane-type triterpenoid, in a rat multi-organ carcinogenesis bioassay. Cancer Lett 2010;289:161-169.
27) Renne R, Brix A, Harkema J, et al. Proliferative and nonproliferative lesions of the rat and mouse respiratory tract. Toxicol Pathol 2009;37:5S-73S.
28) Thoolen B, Maronpot RR, Harada T, et al. Proliferative and nonproliferative lesions of the rat and mouse hepatobiliary system. Toxicol Pathol 2010;38:5S-81S. 29) Mann PC, Vahle J, Keenan CM, et al. International
harmonization of toxicologic pathology nomenclature: an overview and review of basic principles. Toxicol Pathol 2012;40:7S-13S.
30) Frazier KS, Seely JC, Hard GC, et al. Proliferative and nonproliferative lesions of the rat and mouse urinary system. Toxicol Pathol 2012;40:14S-86S.
31) N o l t e T, B r a n d e r- We b e r P, D a n g l e r C , e t a l . Nonproliferative and proliferative lesions of the gastrointestinal tract, pancreas and salivary glands of the rat and mouse. J Toxicol Pathol 2016;29:1S-125S. 32) Russell SE, Pearson C, Kelly M, et al. Long-term dosing
studies using mutagenic carcinogens indicate a highly significant correlation between elevations in the level of rat glutathione S-transferase P messenger RNA and liver tumors of hepatocellular origin. Biochem J 1988; 249:105-109.
33) Tazawa S, Warashina T, Noro T. On the chemical evaluation of propolis. Natural Medicines 2000;54:306-313. (In Japanese)
34) Shimizu K, Ashida H, Matsuura Y, et al. Antioxidative bioavailability of artepillin C in Brazilian propolis. Arch Biochem Biophys 2004;424:181-188.
35) Rao CV, Desai D, Simi B, et al. Inhibitory effect of caffeic acid esters on azoxymethane-induced biochemical changes and aberrant crypt foci formation in rat colon. Cancer Res 1993;53:4182-4188.
36) Shimizu K, Das SK, Baba M, et al. Dietary artepillin C suppresses the formation of aberrant crypt foci induced by azoxymethane in mouse colon. Cancer Lett 2006;240: 135-142.
Inhibitory effects of Baccharis dracunculifolia on 1,2-dimethylhidrazine-induced genotoxicity and preneoplastic lesions in rat colon. Eur J Cancer Prev 2014;23:240-245.
38) Yasui Y, Miyamoto S, Kim M, et al. Aqueous and ethanolic extract fractions from the Brazilian propolis suppress azoxymethane-induced aberrant crypt foci in rats. Oncol Rep 2008;20:493-499.
39) Xie XL, Gi M, Fujioka M, et al. Ethanol-extracted propolis enhances BBN-initiated urinary bladder carcinogenesis via non-mutagenic mechanisms in rats. Food Chem Toxicol 2015;83:193-200.
40) Cohen SM, Fisher MJ, Sakata T, et al. Comparative analysis of the proliferative response of the rat urinary
bladder to sodium saccharin by light and scanning electron microscopy and autoradiography. Scanning Microsc 1990;4:135-142.
41) Takayama S, Sieber SM, Adamson RH, et al. Long-term feeding of sodium saccharin to nonhuman primates: implications for urinary tract cancer. J Natl Cancer Inst 1998;90:19-25.
42) Kakehashi A, Ishii N, Fujioka M, et al. Ethanol-extracted Brazilian propolis exerts protective effects on tumorigenesis in Wistar Hannover rats. PLoS One 2016; 11:e0158654.
43) 〔http://www.jhnfa.org/pr-1.html〕 (英文校正者: Daniel Mrozek)