「例題で学ぶ基礎化学」
サンプルページ
この本の定価・判型などは,以下の URL からご覧いただけます.
http://www.morikita.co.jp/books/mid/024211
i
本書は,専門学校・高専および大学の低学年生のための一般化学の教科書である.2003 年 に発刊され,好評を得た『やさしく学べる基礎化学』に大幅に手を加えて新たに編纂し直した ものである.内容を吟味厳選し,前著以上に理解しやすいように詳細な解答をつけた例題を追 加し,さらに読みやすさに配慮して2色刷とした.独習が可能なようにわかりやすく記述した ので,化学をもう一度学びたいと思う社会人の方々の参考書としても役立つものと思われる. 本書の章立ては,まず「第1章 物質の構成と結合」において物質の構成要素である原子に ついて原子の構造,元素の周期性と電子配置,化学結合などを学び,続いて「第2章 物質の 状態」と「第3章 物質の変化」において原子の集合状態や代表的な化学反応である酸・塩基 反応,酸化・還元反応,反応熱を学び,そしてこれらの知識をベースにして第4章以下で無機 物質,有機化合物,高分子化合物など具体的な化合物を理解するという流れになっている. 化学を学ぶうえでは,物質の分類や性質を知ると同時に,量的な計算を通じてさまざまな概 念を身につけることが大切である.本書では,例題を解きながら読み進めることで,その両方 を身につけられるように配慮した.また,身近な物質や現象を取り上げたコラムや,化学を創 りあげてきた人物たちの紹介をところどころに挿入した.化学は,既成知識を暗記する科目と して受け取られることもあるが,本来はおもしろく,役に立つ学問であるということを本書で 実感していただければ幸いである. 現代の私たちは,科学と関わりをもたざるをえない時代を生きている.とりわけ,本書で学 ぶ化学は,物質の理解と創造を可能にする学問であり,私たちの生活に密接に結びついている. 化学は,今後も物理学や生物学などとともに,あらゆる自然科学の基礎としての重要さが増し, ますます最先端の技術分野と密接してそれを支えていくと考えられる.どの分野を目指す学生 にとっても,それを学ぶ意義は大きいといえるだろう.本書を読んで,技術者・研究者への一 歩を踏み出していただきたい.最後に,森北出版の大橋貞夫,丸山隆一の両氏には大変にお世 話になった.ここに厚くお礼申し上げる. 2013 年5月 著者を代表して 笹本 忠ま え が
き
目
次
第1章 物質の構成と結合 1.1 物質とは何か 1 1.1.1 物質の分類 1 1.1.2 物質の変化 2 1.1.3 元素と元素記号 3 1.1.4 原子・分子・イオン 4 1.2 原子の構造とその性質 7 1.2.1 原子の構造 7 1.2.2 イオンの形成 9 1.2.3 元素の周期表 10 1.2.4 放射性元素 11 1.3 化学結合 12 1.3.1 イオン結合 12 1.3.2 分子をつくる結合 13 1.3.3 電気陰性度 14 1.3.4 金属結合 15 1.4 物質量の化学式 18 1.4.1 原子量・分子量・式量 18 1.4.2 物質量 19 1.4.3 化学反応式における量的関係 20 演習問題1 21 第2章 物質の状態 2.1 物質の三態 23 2.1.1 固体・液体・気体 23 2.1.2 三態間の変化 24 2.2 気体の性質 29 2.2.1 気体の体積 29 2.2.2 気体の状態方程式 33 2.2.3 混合気体の分圧 34 2.2.4 気体の分子量 37 2.3 溶液 39 2.3.1 溶解のしくみ 39 2.3.2 溶解度と濃度 43 2.3.3 希薄溶液の性質 48 2.3.4 コロイド溶液 54 演習問題2 58 第3章 物質の変化 3.1 化学反応と熱 59 3.1.1 反応熱と物質のもつエネルギー 59 3.1.2 熱化学方程式とヘスの法則 60 3.2 化学反応の速さと化学平衡 64 3.2.1 化学反応の速さ 65 3.2.2 化学平衡 68 3.3 酸と塩基の反応 74 3.3.1 酸・塩基 75 3.3.2 中和と塩 82 3.4 酸化還元反応 87 3.4.1 酸化還元 88 3.4.2 化学電池 94 3.4.3 電気分解 97 演習問題3 101 第4章 無機物質 4.1 典型非金属元素の単体と化合物 103 4.1.1 水素 103 4.1.2 14 族元素:炭素とケイ素 105 4.1.3 15 族元素:窒素とリン 108 4.1.4 16 族元素:酸素と硫黄 111 4.1.5 17 族元素(ハロゲン) 113 4.1.6 希ガス 116 4.2 典型金属元素の単体と化合物 116 4.2.1 アルカリ金属 117 4.2.2 2族元素 119 4.2.3 12~14 族典型金属元素 121 4.3 遷移金属元素の単体と化合物 123 4.3.1 遷移金属の特徴 123 4.3.2 クロム,マンガン,鉄 124 4.3.3 銅と銀 126 4.4 無機化合物の工業的製法 128 4.4.1 鉄の製錬 128 4.4.2 アルミニウムの製錬 129 4.4.3 アンモニアの製法(ハーバー┻ボッシュ 法) 130 4.4.4 炭酸ナトリウムの製法 131 演習問題4 131iii
第5章 有機化合物 5.1 炭化水素 133 5.1.1 アルカン類とアルキル基 133 5.1.2 アルカンの命名法と異性体 133 5.1.3 アルカンの燃焼 135 5.1.4 メタンの置換反応 136 5.1.5 シクロアルカン類 136 5.2 アルケン類 136 5.2.1 アルケンの付加反応 137 5.2.2 アルケンの付加重合反応 138 5.3 アルキン類とアセチレン 138 5.4 官能基による化合物の分類 139 5.5 アルコール 140 5.5.1 アルコールの種類 140 5.5.2 分子中のヒドロキシ基の数 141 5.5.3 水素結合 141 5.5.4 アルコールの反応 142 5.5.5 アルコールの脱水反応とエーテル 142 5.6 アルデヒド 143 5.6.1 アルデヒドの性質と酸化 143 5.6.2 アルデヒドによる銀鏡反応とフェーリ ング反応 144 5.7 ケトン 144 5.8 カルボン酸 145 5.8.1 酢酸とギ酸 145 5.8.2 酸無水物 146 5.8.3 高級脂肪酸 146 5.8.4 セッケン 147 5.9 エステル 148 5.9.1 油脂のけん化価とヨウ素価 148 5.9.2 硬化油 149 5.10 分子量の決め方と構造式 149 5.11 芳香族化合物 150 5.11.1 ベンゼンの反応は置換反応 151 5.11.2 フェノール類 152 5.11.3 アニリン 153 5.11.4 芳香族カルボン酸 154 5.11.5 複素環化合物 155 演習問題5 155 第6章 高分子化合物 6.1 糖類 157 6.1.1 グルコース 157 6.1.2 二糖類 158 6.1.3 多糖類,デンプン 159 6.1.4 多糖類,セルロース 160 6.2 タンパク質 161 6.2.1 アミノ酸 161 6.2.2 アミノ酸と分子内塩,双性イオン 162 6.2.3 タンパク質の構造 163 6.2.4 酵素 163 6.2.5 タンパク質の変性 164 6.2.6 アミノ酸とタンパク質の検出反応 164 6.3 核酸 165 6.4 合成高分子化合物 166 6.4.1 付加重合による合成高分子 166 6.4.2 縮合重合による高分子化合物 169 6.4.3 プラスチック 170 6.4.4 接着剤 170 演習問題6 172 解答・付録 付録A 原子の構成 174 付録B 化合物命名法 178 付録C 試薬溶液の調整法・弱酸・弱塩基の電離定数・気体等の検出法 181 演習問題の解答 185 索 引 190化学に関係の深いできごとの年表
年代 できごと 人 名 1662 ボイルの法則 ボイル(英) 1756 二酸化炭素の発見 ブラック(英) 1766 水素の発見 キャベンディッシュ(英) 1772 酸素の発見 シェーレ(典) 1774 塩素の発見 シェーレ(典) 1774 酸素の発見(シェーレとは別に) プリーストリー(英) 1774 質量保存の法則 ラボアジエ(仏) 1777 燃焼理論の提唱 ラボアジエ(仏) 1780 動物電気の発見 ガルバーニ(伊) 1783 空気の組成決定 キャベンディッシュ(英) 1787 シャルルの法則 シャルル(仏) 1791 炭酸ナトリウムの工業的製法 ルブラン(仏) 1799 定比例の法則 プルースト(仏) 1800 ボルタ電池の発明 ボルタ(伊) 1800 水の電気分解 ニコルソン(英) 1801 分圧の法則 ドルトン(英) 1803 原子説の提唱 ドルトン(英) 1803 ヘンリーの法則 ヘンリー(英) 1807 ナトリウム,カリウムを電解 により発見 デイビー(英) 1808 気体反応の法則 ゲイ = リュサック(仏) 1811 アボガドロの法則 アボガドロ(伊) 1811 ヨウ素の発見 クールトア(仏) 1818 過酸化水素の発見 テナール(仏) 1825 ベンゼンの発見 ファラデー(英) 1826 異性体の提唱 リービッヒ(独) 1826 臭素の発見 バラール(仏) 1828 尿素の合成 ウェーラー(独) 1833 電気分解の法則 ファラデー(英) 1836 ダニエル電池 ダニエル(英) 1837 舎密開宗(化学書) 宇田川榕菴(日) 1840 ヘスの法則の提唱 ヘス(スイス) 1844 ゴムの加硫法 グッドイヤー(米) 1848 絶対温度目盛の提唱 ケルビン(英) 1856 合成染料モーブの発明 パーキン(英) 1860 アボガドロの仮説を国際会議 で紹介 カニッツァーロ(伊) 1865 ベンゼンの構造決定 ケクレ(独) 1866 アンモニアソーダ法(ソルベ ー法) ソルベー(ベルギー) 1866 ダイナマイトの発明 ノーベル(典) 1869 元素の周期律の提唱 メンデレーエフ(ロ) 1873 実在気体の状態方程式を提唱 ファンデルワールス(蘭) 1874 炭素四面体説の提唱 ファントホッフ(蘭), ルベル(仏) 1882 凝固点降下の法則 ラウール(仏) 1884 平衡移動の法則 ルシャトリエ(仏) 1884 電離説の提唱 アレニウス(典) 1887 希薄溶液の理論 ファントホッフ(蘭) 1893 金属錯体の配位説 ウェルナー(スイス) 1894 アルゴンの発見 レイリー,ラムゼー(英) 1895 X線の発見 レントゲン(独) 1896 放射能の発見 ベクレル(仏) 1886 アルミニウムの工業的製法 ホール(米),エルー(仏) 1897 電子の発見 J. J. トムソン(英) 1898 ラジウムの発見 キュリー夫妻(仏) 年代 できごと 人 名 1900 アドレナリンの抽出 高峰譲吉(日) 1902 放射性元素の崩壊説の提唱 ラザフォード,ソディー (英) 1904 原子の土星モデルの提唱 長岡半太郎(日) 1908 アンモニアの工業的製法 ハーバー(独) 1909 ベークライトの発明 ベークライド(米) 1909 うま味調味料の工業生産 池田菊苗(日) 1912 ウルシオールの化学構造決定 眞島利行(日) 1913 水素スペクトルの解析(原子 モデル) ボーア(デ) 1913 アンモニア合成の工業化 ハーバー,ボッシュ(独) 1917 KS鋼の発明 本多光太郎(日) 1923 酸・塩基の新しい定義 ブレンステッド(デ), ローリー(英) 1925 回転異性体の発見 水島三一郎(日) 1928 ペニシリン発見 フレミング(英) 1930 高分子概念の確立 シュタウディンガー(独) 1932 中性子の発見 チャドウィック(英) 1932 電気陰性度の決定 ポーリング(米) 1932 重水素の発見 ユーリー(米) 1935 66ナイロンの発明 カローザス(米) 1935 中間子の理論 湯川秀樹(日) 1939 ビニロンの発明 桜田一郎(日) 1951 タンパク質の a┻へリックス の解明 (米)ポ ー リ ン グ,コ ー リ ー 1952 フロンティア軌道理論 福井謙一(日) 1953 ポリエチレンの新合成法 チーグラー(独) 1953 DNA二重らせん構造の提唱 ワトソン(米), クリック(英) 1954 ポリプロピレンの合成 ナッタ(伊) 1955 人造ダイヤモンドの製造 GE社(米国) 1955 インシュリンのアミノ酸配列 の決定 サンガー(英) 1959 炭素繊維の開発 進藤昭男(日) 1960 アモルファス金属の合成 デュエイ(米) 1961 12Cが原子量の基準となる 1961 素粒子(物質を構成する最小 単位)に関する対称性の破れ の機構の発見 南部陽一郎(日) 1962 緑色蛍光タンパク質の発見 下村 脩(日) 1962 キセノン化合物の合成 バートレット(米) 1966 触媒不斉合成反応に成功 野依良治(日) 1973 素粒子に関する対称性の破れ の起源の発見 小林 誠,益川敏英(日) 1974 液晶理論の確立 ドジャンヌ(仏) 1976 根岸カップリング反応の発見 根岸英一(日) 1976 伝導性ポリマーの合成 白川英樹(日) 1977 抗体生成の遺伝的原理の解明 利根川 進(日) 1979 鈴木カップリング反応の発見 鈴木 章(日) 1987 生体高分子の解析 田中耕一(日) 1987 ニュートリノ(素粒子の1 つ)の検出 小柴昌俊(日) 1991 カーボンナノチューブの発見 飯島澄男(日) 1995 不斉水素化反応の発見 野依良治(日) アメリカ(米),イギリス(英),イタリア(伊),オランダ(蘭),カナダ(カ),ギリシア(ギ),スウェーデン(典),デンマーク(デ),ドイツ(独), 日本(日),ノルウェー(ノ),フランス(仏),ロシア(ロ)1
物質とは何か
1.1.1
物質の分類 私たちの身のまわりには,気体の空気や二酸化炭素,液体の水や油,固体の 石や金属などの物質がいろいろな状態で存在する.物質はそれを構成している 成分によって,図1.1
に示すように,純物質と混合物に分類できる. 図1.1 物質の構成 (1) 純物質 純物質は,1種類の成分からなる物質で,以下で述べるように単体と化合物 とがある.一定の元素組成をもち,沸点・融点・密度・屈折率などの物理的性 質がその物質に固有の値を示す. 純物質でただ1種類の元素からできているものを単体といい,2種類以上の 元素からなる物質を化合物という.たとえば,水素ガス,銅金属やネオンガス は,それぞれ水素元素,銅元素,ネオン元素の1種類の元素から成り立ってい るので単体である.一方,水 H2 Oは水素 H と酸素 O から,塩化ナトリウム NaClはナトリウム Na と塩素 Cl から,また,エタノール C2 H5 OHは炭素 C, 水素 H,酸素 O からというように,複数の元素からできているので化合物であ る. また,酸素 O2とオゾン O3は同じ元素である酸素 O からできているが,性1.
元素 「元素」という用語は,物質を 構成する基本的な成分を表す名 称である(p. 3 の傍注も参照の こと).第
1
章
物質の構成と結合
自然界には数え切れないほど多種多様な物質が存在している.これらすべての物質は原子・分子・ イオンなどの基本的な粒子から構成されている.この章では,原子・分子・イオンなどの構造やこれ らの粒子から物質ができるしくみ,粒子と物質の質量関係,および化学変化などを通して物質量の表 し方について学ぶ.また,元素の周期律をもとに,原子の電子配置の共通点や一般的性質についても 学習する.質が異なる.このような単体を互いに同素体という.そのほかの同素体の例と 性質を表
1.1
に示す. 表1.1 同素体の例 元 素 同素体 性 質 炭 素 ダイヤモンド 無色透明,非常に硬い,八面体結晶,融点 3600 ℃ 黒 鉛 灰黒色,はがれやすい,板状結晶,融点 3367 ℃(昇華) 酸 素 酸 素 無色,無臭,融点 -218 ℃,沸点 -183 ℃ オゾン 淡青色,特有な臭気,融点 -193 ℃,沸点 -111 ℃ リ ン 黄リン 淡黄色,ろう状固体,有毒性,融点 44 ℃,発火点 50 ℃ 赤リン 暗赤色,無毒,融点 590 ℃,発火点 260 ℃ 硫 黄 斜方硫黄 淡黄色,常温で安定,多面体結晶,S8環状分子,融点 113 ℃ 単斜硫黄 黄色,常温で不安定,針状結晶,S8環状分子,融点 119 ℃ ゴム状硫黄 褐色,常温で不安定,弾性体,無定形固体,融点 400 ℃付近 例題1.1
つぎの各物質を,単体と化合物に分けよ. (1)水素 (2)ショ糖 (3)ダイヤモンド (4)塩化カルシウム (5)メタン (6)鉄 (7)ヘリウム (8)食塩 解 単体:(1)H2 (3)C (6)Fe (7)He 化合物:(2)C12 H22 O11 (4)CaCl2 (5)CH4 (8)NaCl (2) 混合物 混合物は,純物質が混じりあったものである.混じりあっている純物質の割 合によって,融点,沸点などの性質も変わってくる.混合物を分離して純物質 を得る方法としては,ろ過,蒸留,昇華,再結晶,透析① ,クロマトグラフィ ー② などがある.混合物から純物質を分離することを,物質の精製という. 自然界にみられる物質の大部分は,混合物として存在している.混合物には, 液体と固体の混合だけではなく,気体・液体・固体のいろいろな組み合わせか らなるものがある.均一に混じっている混合物(均一混合物)は溶体とよばれ, 溶体が液体のときには溶液,固体のときには固溶体という.空気は混合気体, 食塩水は溶液,ステンレス鋼のような合金は固溶体である.一方,混合物のな かには,花こう岩,どろ水,ぼく汁,などの不均一混合物が数多く存在する. しかし,均一混合物と不均一混合物との境界をはっきりと決めることは難しい. 例題1.2
つぎのものを,純物質と混合物とに分類せよ.混合物の場合は, 構成する純物質を述べよ. (1)空気 (2)水蒸気 (3)アルミニウム (4)砂糖水 (5)水素 解 純物質:(2),(3),(5) 混合物:(1)酸素と窒素,(4)砂糖と水.1.1.2
物質の変化 物質に生じる変化は,物理変化と化学変化の2つに大別される. 同素体(炭素の例) ① 透析については,2.3.4 項 参照. ② シリカゲル,アルミナ,紙 などの吸着剤を用いた分離法. 溶液や気体中の物質の分離,精 製,検出に広く応用されている.1
.1
物質とは何か 3 第 1 章 物 質 の 構 成 と 結 合 水を電気分解すると,水とは性質の異なる水素と酸素に分かれる.このよう に,もとの物質とまったく別の物質に変わる変化を化学変化という.化学変化 のうち,1種類の物質から2種類以上の物質に分かれることを分解といい,逆 に,2種類以上の物質から1種類の新しい物質ができることを化合という.一 方,水は温度変化にともなって,固体,液体,気体と変化する.このように, 物質そのものは変わらず,物質の状態が変わる変化を物理変化という. 例題1.3
つぎの現象を物理変化と化学変化に分けよ. (1)鉄釘がさびて褐色になった (2)水を加熱すると,水蒸気になった (3)砂糖を水に入れてかき混ぜたら溶けた (4)水を電気分解すると,水素 と酵素が発生した 解 物理変化:(2),(3) 化学変化:(1),(4)1.1.3
元素と元素記号 現在では 100 種類あまりの元素が発見されている.それぞれ元素は表1.2
に 示すように,人名・国名・地名あるいは神話などにもとづいて名づけられてい る.元素を表す記号を元素記号といい,おもに元素のラテン語名の頭文字を大 文字で記す.もし,同じ頭文字の元素が2つ以上ある場合は,元素名のつづり 字のなかから頭文字以外の適当な1字をとり,その小文字を添えて区別する. 表1.2 元素名と元素記号 元素名 元素記号 英語名 名称由来 水 素 H hydrogen 水をつくるもの ヘリウム He helium 太陽 炭 素 C carbon 炭 窒 素 N nitrogen 硝石を生じるもの 酸 素 O oxygen 酸をつくるもの フッ素 F fluorine 流れる,とけやすい ネオン Ne neon 新しい ナトリウム Na sodium 固体 マグネシウム Mg magnesium マグネシア(地名) ケイ素 Si silicon 石英 リ ン P phosphorus 光るもの 硫 黄 S sulfur 火のもと 塩 素 Cl chlorine 黄緑色 アルゴン Ar argon 怠けもの カリウム K potassium 海そう灰 カルシウム Ca calcium 石灰 スカンジウム Sc scandium スカンジナビア半島(地名) チタン Ti titanium ギリシア神話の巨人 クロム Cr chromium 色 例題1.4
つぎの各元素の元素記号を書け. (1)炭素 (2)硫黄 (3)塩素 (4)亜鉛 (5)鉄 (6)ナトリウム (7)白金 (8)銅 (9)スズ (10)アルミニウム 元素(element)と原子 (atom) 「元素」と「原子」という用 語はほとんど同じ意味に使われ ているが,歴史的には異なる起 源をもつ.元素はその英語名 (element)から推測できるよう に,化学的方法ではこれ以上分 解することができない物質の根 源的な要素(成分)とされた. 一方の原子(atom)は,古代ギ リシア時代に物質の究極の不分 割粒子(a + tom = 分けること ができない)として唱えられ, 19世紀末以降の物理学により その構造が明らかにされてきた. 現在,元素は「陽子数(原子番 号)が同じ原子の総称」と定義 され,元素と原子とが関係づけ られている.たとえば,水素原 子は,水素‒1(1 1H),水素‒2(21H), 水素‒3(3 1H)などの陽子を1つ もつ原子(同位体)の集団を指 す.このような背景から,元素 記号はそのまま原子を表す記号 として用いられている.解 (1)C (2)S (3)Cl (4)Zn (5)Fe (6)Na (7)Pt (8)Cu (9)Sn (10)Al
1.1.4
原子・分子・イオン (1) 原 子 原子は,その中心に正の電荷をもつ原子核と,そのまわりに負の電荷をもつ 電子からなる.原子核はさらに正の電荷をもつ陽子と,電荷をもたない中性子 からなる.電気的に中性の原子は,そのなかに同数の電子と陽子をもつ(表1.3
参照).このように,1つの原子において,原子核のまわりの電子の数は, その原子に含まれる陽子の数に等しいので,原子全体としては,電気的に中性 となっている. 表1.3 原子を構成する粒子 粒子の種類 電気量[C] 電荷数 質 量[kg] 電子(e:エレクトロン) -1.6 × 10-19 -1 9.109 × 10-31 陽子(p:プロトン) +1.6 × 10-19 +1 1.673 × 10-27 中性子(n:ニュートロン) 0 0 1.675 × 10-27 原子核中の陽子の数を原子番号という.電気的に中性状態の原子においては 原子番号は電子の数に等しく,その電子の数は原子の化学的性質を決めるので, 原子番号は元素を表す番号ともいえる.たとえば,原子番号2の原子といえば ヘリウム原子のことであり,その原子核には陽子2個が,そして,そのまわり には2個の電子が存在する.陽子の質量と中性子の質量はほぼ等しく,電子の 質量は陽子の質量の約 1840 であるから,原子の質量は陽子の数と中性子の数1 によってほぼ決まる. 同じ元素の原子すなわち陽子数が同じ原子のなかにも,中性子の数が異なる 原子がある.このような原子どうしを,互いに同位体(アイソトープ)といい, その例を表1.4
に示す.たとえば,自然界に存在する炭素 C の同位体には,そ の原子核が6個の陽子と6個の中性子からできているものと,6個の陽子と7 個の中性子からできているものとがある.原子核中の陽子の数と中性子の数の 和を質量数という.原子の原子番号と質量数を表記するときは,それぞれの元 素記号の左下と左上に記す. 例題1.5
つぎの原子の中の陽子,中性子および電子の数をそれぞれ記せ. (1)2 113Na (2)3175Cl (3)5266Fe (4)6294Cu 解 (1)陽子 11,中性子 12,電子数 11 (2)陽子 17,中性子 18,電子数 17 (3)陽子 26,中性子 30,電子数 26 (4)陽子 29,中性子 35,電子数 29 例題1.6
炭素の同位体1 6 2C,1 6 3C,1 6 4Cの中性子の数はそれぞれいくつか. 解 12C:6個,13C:7個,14C:8個 原子のモデル アイソトープ アイソトープ(isotope)の語源 は,iso(同じ)と topos(場所) というギリシア語に由来し,周 期表の同じ場所を占めるという 意味である. 原子番号と質量の表し方1
.1
物質とは何か 5 第 1 章 物 質 の 構 成 と 結 合 (2) 分 子 分子とは,物質固有の性質を示すもっとも小さい基本的粒子である.分子は 2個以上の原子が集まったものが多いが,ネオン Ne,アルゴン Ar などは1個の 原子で分子と同じようなふるまいをする.このような分子を単原子分子という. 水素分子は水素原子2個からできているので二原子分子といい,水分子は酸 素原子1個と水素原子2個からできているので三原子分子という.一般に,三 原子分子以上のことを多原子分子という(図1.2
参照). 図1.2 分子のモデル (3) イオン 電気的に中性な原子が電子を失ったり,逆にほかから得たりすると,電気を 帯びたイオンになる.イオンのうち,正に帯電したものを陽イオン,負に帯電 したものを陰イオンという.イオンは,それを構成する原子または原子団を元 素記号で記し,その右肩に陽イオンなら+,陰イオンなら−の符号を,その帯 びている電荷の数とともに記したイオン式で表す.イオンの帯びている電荷数 をイオン価といい,その数の絶対値をイオンの価数という.たとえば,ナトリ ウムイオンは,電子1個のもつ電気量(1.6 × 10-19C)に等しい正の電荷を帯 びているので,1価の陽イオンといい,Na+で表す. イオン イオンという名称は,イギリス のファラデーが電気分解の研究 をしたとき,溶液中に電極に向 かって移動するものがあるのを 発見したことから,ギリシア語 の「行く」という意味にちなん でつけられた. 表1.4 おもな天然同位体の存在比と相対質量 原子番号・元素名 記 号 相対原子質量① 存在比[%] 1 水 素 1H 1.00785 99.985 2H(D) 2.014102 0.015 3H(T) 3.010490 極微量 2 ヘリウム 3He 3.016029 1.3 × 10−4 4He 4.002603 100.0 6 炭 素 12C 12(基準) 98.9 13C 13.003 1.10 14C 14.003 極微量 8 酸 素 16O 15.994915 99.762 17O 16.999133 0.038 18O 17.999160 0.200 17 塩 素 35Cl 34.969 75.77 37Cl 36.966 24.23 92 ウラン 234U 234.04097 0.005 235U 235.04394 0.72 238U 238.05081 99.275 ① 炭素12Cの質量の値を 12 と したときの各原子の質量の相対 値.一方,カルシウムイオンは,電子1個の電気量の2倍に相当する正の電荷を 帯びているので2価の陽イオンといい,Ca2+で表す.Na+や Ca2+のように, 1つの原子が電荷をもったイオンを単原子イオンという.イオンには,原子が いくつか集まった原子団が正や負の電荷を帯びたものもある.たとえば,硫酸 イオン SO42-,アンモニウムイオン NH4+のように,2個以上の原子からなる 原子団が電荷をもったイオンを多原子イオンという.おもなイオンの例を表
1.5
に示す. 表1.5 おもな陽イオンと陰イオン 陽イオン 記 号 陰イオン 記 号 水素イオン H+ フッ化物イオン F -ナトリウムイオン Na+ 塩化物イオン Cl -カリウムイオン K+ 臭化物イオン Br -銅(Ⅰ)イオン Cu+ ヨウ化物イオン I -銀イオン Ag+ 酸化物イオン O 2-アンモニウムイオン NH4+ 水酸化物イオン OH -カルシウムイオン Ca2+ 硝酸イオン NO 3 -マグネシウムイオン Mg2+ シアン化物イオン CN -バリウムイオン Ba2+ 硫酸水素イオン HSO 4 -鉄(Ⅱ)イオン Fe2+ 硫酸イオン SO 4 2-銅(Ⅱ)イオン Cu2+ 炭酸水素イオン HCO 3 -亜鉛イオン Zn2+ 炭酸イオン CO 3 2-アルミニウムイオン Al3+ 硫化物イオン S 2-鉄(Ⅲ)イオン Fe3+ リン酸イオン PO 4 3-(4) 化学式 物質の組成を元素記号を用いて表した式を化学式という.化学式には,分子 式,組成式,示性式,構造式,電子式などがある.以下,それぞれについて説 明する(表1.6
参照). 表1.6 化学式の種類 物質名 水 メタノール 酢 酸 塩化カリウム① 分子式 H2 O CH4 O C2 H4 O2 — 組成式 H2 O CH4 O CH2 O KCl 構造式 — 示性式 H2 O CH3 OH CH3 COOH — 電子式 ① 分子式 分子を表した式を分子式といい,1つの分子を構成する原子の種 類と数を元素記号で表したものである.たとえば,水の分子式は H2 Oであ るが,これは水の分子が2個の水素原子と,1個の酸素原子から成り立って いることを表している. ② 組成式 物質を構成している原子(またはイオン)の種類と数の簡単な比 ① 塩化カリウムは分子をつく らないため,分子式・構造式・ 示性式をもたない.1
.2
原子の構造とその性質 7 第 1 章 物 質 の 構 成 と 結 合 を表した式を組成式または実験式という.組成式は,化学分析により物質の 元素組成を調べれば求められる.アセチレンの分子式は C2 H2,ベンゼンの 分子式は C6 H6で,炭素原子と水素原子の原子数の比は,どちらも 1:1 で あるから,その組成式は,ともに CH である. ③ 構造式 分子のなかで原子がどのような結び方をしているのかを価標で表 した式を,構造式という.価標は,結合手を表し,結合手1つあたり1本の 線で示す. ④ 示性式 官能基① の存在を明示した式を示性式という. ⑤ 電子式 分子などを構成する原子のまわりに,最外殻の電子がどのように 存在しているかを表した式を電子式という.電子は点で表す. 例題1.7
つぎにあげた物質の分子式を記せ. (1)一酸化炭素(炭素原子1個と酸素原子1個からなる) (2)二酸化硫黄(硫黄原子1個と酸素原子2個からなる) (3)メタン(炭素原子1個と水素原子4個からなる) (4)ブドウ糖(炭素原子6個,水素原子 12 個,酸素原子6個からなる) 解 (1)CO (2)SO2 (3)CH4 (4)C6 H12 O6 (5) 原子価 1個の原子から出ている価標の数を原子価という.原子価は,その原子がも つ不対電子の数と等しい.表1.7
にいくつかの原子の電子式と原子価を示す.2
原子の構造とその性質
1.2.1
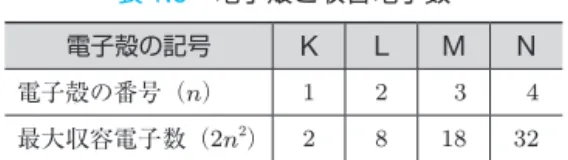
原子の構造 原子核のまわりの電子は,いくつかの層に分かれて存在している.この層を 電 でん 子し殻かくという.図1.3
に示すように,原子核に近い順に,K 殻,L 殻,M 殻, N殻,…とよばれる.各電子殻に収容できる電子の最大数は,K 殻から順に2, 8,18,32,…である.内側から整数 n(= 1,2,3,…) 番目の電子殻に収容 可能な電子の最大数は,2n2という一般式で表せる(表1.8
参照).電子は通常, 原子核に近い原子殻から順に入っていき,その配列の仕方を電子配置という. もっとも外側の電子殻に属するものを最外殻電子といい,それより内側の電子 殻に属するものを内殻電子という. 図1.3 電子配置 図1.4 Na原子の電子配置 価標 構造式では,結合している原子 間に短い直線を引き,結合して いることを示す.この短い線を 価標といい,共有結合の場合は 1本の線あたり2個の電子が共 有されていることを表している. ① 5.4 節参照. 表1.7 原子価の例 原 子 電子式 原子価 水素 1価 酸素 2価 窒素 3価 炭素 4価1.
表1.8 電子殻と収容電子数 電子殻の記号 K L M N 電子殻の番号(n) 1 2 3 4 最大収容電子数(2n2) 2 8 18 32 水素原子1Hは K 殻に1個の電子が,ヘリウム原子2Heでは K 殻に2個の電 子が入り,K 殻は収容数いっぱいとなる.L 殻は,リチウム原子3Liからはじ まり,原子番号が大きくなるとともに L 殻に電子が収容されていき,ネオン原 子10Neに至ると K 殻に2個,L 殻に8個の電子が入り,K 殻,L 殻ともにい っぱいとなる.このような最外殻の電子が収容数いっぱいとなった電子殻を閉 殻という.閉殻になった電子殻をもつ原子は安定した状態となる. 各電子殻に収容される電子の数を示したものを,原子の電子配置という.H から Ca までの電子配置を,表
1.9
に示す① . 表1.9 原子の電子配置表 元素名 電子殻(n) 原子 K (1)(2)L (3)M (4)N 水素 1H 1② ヘリウム 2He 2 リチウム 3Li 2 1 ベリリウム 4Be 2 2 ホウ素 5B 2 3 炭素 6C 2 4 窒素 7N 2 5 酸素 8O 2 6 フッ素 9F 2 7 ネオン 10Ne 2 8 ナトリウム 11Na 2 8 1 マグネシウム 12Mg 2 8 2 アルミニウム 13Al 2 8 3 ケイ素 14Si 2 8 4 リン 15P 2 8 5 硫黄 16S 2 8 6 塩素 17Cl 2 8 7 アルゴン 18Ar 2 8 8 カリウム 19K 2 8 8 1 カルシウム 20Ca 2 8 8 2 M 殻に最外殻電子をもつ原子は,ナトリウム原子11Na(図1.4
参照)からは じまり,電子が最外殻に順次収容されていく.最外殻電子8個のアルゴン原子 18Arでは,M 殻は閉殻と同じように安定した状態となる.ただし,カリウム原 子19Kやカルシウム原子20Caでは,M 殻に最大収容数 18 個の電子が収容され るよりも,M 殻に8個の電子が収容されたまま,N 殻に電子が1個,2個と収 容されたほうがより安定した状態になる. ① 電子配置に関して,より詳 しくは付録 A を参照. ② 表中の太数字は,価電子(1. 2.2 項で説明)を表す.1
.2
原子の構造とその性質 9 第 1 章 物 質 の 構 成 と 結 合1.2.2
イオンの形成 (1) イオンの電子配置ヘリウム He,ネオン Ne,アルゴン Ar,クリプトン Kr,キセノン Xe など を希ガス元素という.これらの原子の最外電子殻には,表
1.10
に示すように, いずれも8個(He は2個)の電子が入っており,このような電子配置はきわ めて安定で,イオンになったり,原子どうしが結合することもまれである.最 外殻電子がとる8個の電子の組のことをオクテットという.希ガス元素以外の 原子は陽イオンや陰イオンになることで,原子番号がもっとも近い希ガス元素 の電子配置と同じオクテットをとり,安定になろうとする傾向がある. 最外殻に存在する電子を価電子という.ただし,希ガス原子の価電子の数は 0とする① .価電子は,原子がイオンになったり,原子がほかの原子と結合す るときに重要なはたらきをする.価電子の数が同じ原子どうしは,化学的性質 がよく似ている.図1.5
に示すように,ナトリウム原子 Na は価電子を1個放 出して1価の陽イオンになる.このナトリウムイオン Na+は,ネオン原子と同 じ電子配置となり,安定となる.また,塩化物イオン Cl-は,塩素原子 Cl が 電子を1個とり入れて,アルゴン原子 Ar と同じ電子配置をとり,安定となる. 図1.5 イオンの形成と電子配置 一般に,価電子の少ない原子は,電子を放出して,陽イオンになりやすく, 価電子の多い原子は,電子をとり入れて,陰イオンになりやすい. 例題1.8
原子番号 12 の Mg 原子は,どのようなイオンになりやすいか. 解 安定な Ne 型の電子配置構造になろうとするため,次式のように電子2個を放 出し(Mg ↗ Mg2++2e-)Mg2+となる. (2) イオン化エネルギー 1個の原子から電子を1個とり去るのに必要な最小のエネルギーをその原子 の第1イオン化エネルギーという.イオン化エネルギーが小さい原子は陽イオ ンになりやすく,それらを,電気的に陽性な元素という.原子が電子をとり込 表1.10 希ガス原子の電子 配置表 電子殻 原子 K (1)(2)L(3)M(4)N(5)O 2He 2 10Ne 2 8 18Ar 2 8 8 35Kr 2 8 18 8 54Xe 2 8 18 18 8 ① 価電子は希ガス原子の場合 を除いて最外殻電子と一致する.むと,原子全体は負の電荷を帯びた陰イオンになる.原子が電子をとり入れて 陰イオンになるときに放出するエネルギーを電子親和力という.電子親和力が 大きい原子は,陰イオンになりやすく,陰イオンになりやすい元素のことを, 電気的に陰性な元素という. ある原子がどの程度陽イオンや陰イオンになりやすいかは,イオン化エネル ギーと電子親和力をもとに判断できる.表
1.11
に,原子番号が 20 までの元素 のイオン化エネルギーの値を,また,表1.12
にハロゲン元素の電子親和力の 値を示す.1.2.3
元素の周期表 元素を原子番号の小さいものから順に並べると,性質のよく似た元素が一定 の間隔で周期的に現れる.このことを元素の周期律という.性質の類似した元 素を縦の欄に並ぶように配列した表を,元素の周期表(本書の見返しに掲載) という.周期表の横の列に並ぶ原子のグループを周期といい,縦の列に並ぶ原 子グループを族という.同じ族に属する元素は互いに性質がよく似ているため, 同属元素という. (1) 典型元素と遷移元素 周期表の両側にある1,2族と 12~18 族は典型元素といい,中央部の3~ 11族を遷移元素という.典型元素は性質のよく似た元素が周期的に現れ,同 族元素群は,固有の名称でよばれることがある.1族典型元素はアルカリ金属 元素とよばれ,1価の陽イオンになりやすく,2族典型元素はアルカリ土類金 属元素とよばれ,2価の陽イオンになりやすい.17 族典型元素はハロゲン元 素とよばれ,1価の陰イオンになりやすい.また,18 族典型元素は希ガス元素 とよばれ,きわめて安定していて,陽イオンや陰イオンになりにくい. 一方,遷移元素では,典型元素にみられる性質の周期性が中断し,周期表に おける縦の族よりも原子番号が隣りあった元素どうしがよく似た性質を示す. また,原子の価電子の数は,必ずしも族の番号とは一致しない. (2) 金属元素と非金属元素 古くからの分類法として,金属元素と非金属元素とに大きく二分する方法が ある.おもに単体の物性に着目し,金属光沢をもち展延性に富み,電気伝導性 や熱伝導性が高い元素を金属元素とし,それに合致しない元素を非金属元素と いう.周期表の左下のほうにある元素ほど,金属元素としての性質が強く,右 上のほうにある元素ほど,非金属元素としての性質が強い① .金属と非金属の 境界部に位置する元素(B,Si,As,Te)は,条件により金属性と非金属性の 両方の性質を示し,半金属とよばれる. イオン化エネルギーにも,図1.6
から明らかなように,元素の周期律に従っ て周期的な変化がみられる.イオンになりにくい希ガス元素の原子で極大とな り,イオンになりやすいアルカリ金属で極小となっている.また,同一周期で は,原子番号が増すに従ってイオン化エネルギーが大きくなる傾向がみられる. 表1.11 イオン化エネルギー 元素 I1 [kJ/mol][kJ/mol]I2 H 1312.0 — He 2372.3 5250.4 Li 513.3 7298.0 Be 899.4 1757.1 B 800.6 2427 C 1086.2 2352 N 1402.3 2856.1 O 1313.9 3388.2 F 1681 374 Ne 2080.6 3952.2 Na 495.8 4562.4 Mg 737.7 1450.7 Al 577.4 1816.6 Si 786.5 1577.1 P 1011.7 1903.2 S 999.6 2251 Cl 1251.1 2297 Ar 1520.4 2665.2 K 418.8 3051.4 Ca 589.7 1145 I1:第 1 イオン化エネルギー I2:第 2 イオン化エネルギー 表1.12 ハロゲン元素の 電子親和力 EA 元 素 EA[kJ/mol] F 322 Cl 349 Br 328 I 299 ハロゲン元素 halogenの名称はギリシア語の halos(塩)と gen(造る)に由 来する.ハロゲン元素について は 4.1.5 項参照. 元素の分類 ① ただし水素は非金属元素に 含まれる.1
.2
原子の構造とその性質 11 第 1 章 物 質 の 構 成 と 結 合 図1.6 第1イオン化エネルギーと原子番号の関係1.2.4
放射性元素 原子核は陽子と中性子とで構成されていて,一般にその数の比がほぼ等しい ときには安定であるが,その比が1からずれるに従って不安定になる.不安定 な原子核は粒子を放出しながら崩壊して新しい原子核(娘じょう 核かく)に変わってい く.たとえば,ウラン‒238 の崩壊は, 2 92 38U →2 90 34Th →2 91 34Pa →2 92 34U →2 90 30Th →2 88 26Ra →2 86 22Rn →…→2 84 10Po →2 82 06Pb と,安定な娘核である鉛が生成するまで続く.最初の2 92 38U →2 90 34Thでは質量数 が4減り,原子番号も2減っている.それに続く2 90 34Th→2 91 34Paでは質量数は 変わらないが原子番号が1増えている.これは,以下の核反応式で示されるよ うに,崩壊の際に放出する粒子が前者ではヘリウム核4 2He(この流れを a 線と いう),後者では電子-01e(b 線)であるからである ① . 2 92 38U ↗ 2 90 34Th(トリウム) +4 2He (1.1) ① 式(1.2)の核反応において 90Thの原子核中の1個の中性 子が陽子に変わり91Paとなり, その際に1個の電子が b 線とな って放出される. コラム1.1
核エネルギーの利用と放射性物質 原子崩壊を人工的に開始(つまり核分裂)させて, その際に放出される大きなエネルギーを利用して電 気エネルギーに変換するのが,原子力発電(正確に は原子「力」発電ではなく,原子「核エネルギー」 発電)である.原子力発電で核分裂を起こさせる反 応容器を原子炉といい,その炉心では235Uに中性 子が照射されてつぎの核分裂反応が起こっている. 2 92 35U +1 0n ↗ 29236U ↗ 1 56 39Ba +9 364Kr + 310n ① この核反応式からわかるように,2 92 35Uに1個の中 性子を照射すると,3個の中性子が生成して,この 反応はねずみ算式に拡大し,連鎖反応となる.高速 中性子より遅い熱中性子のほうがウラン 235 に吸 収され核分裂を起こしやすいため,原子力発電では, 水や黒鉛を用いて中性子を減速している.このよう に,原子力発電ではウランやプルトニウムが核分裂 する際に発生する熱で蒸気タービンを回して発電し ている. 原子炉のなかでは,式(1.1),(1.2)や式①以外に 無数の核反応が起こっている.2011 年3月 11 日の 東日本大震災にともなう原子力発電所事故で発生し た放射性元素のストロンチウム3908Sr[28 年]やヨウ 素1 53 31I[8日]も,副核反応で生じた有害物質であ る([ ]内の数字は半減期で,ある放射性元素が ほかの元素に崩壊していくときにもとの半分になる までの時間を示す半減期). 放射性元素の利用は原子力発電のほかに,年代測 定などにも応用されている.たとえば,炭素‒14 (14C,半減期 5700 年)は木材や貝殻などの考古学 上の年代測定に利用される.生物などが死滅すると 大気中の二酸化炭素にわずかに含まれる14Cの補給 が断たれ,死滅した時点から炭素元素全体に対する 14Cの割合は減少していく.この減少割合から生物 が存在していた年代を推定することが可能である.2 90 34Th(トリウム) ↗ 2 91 34Pa(プロトアクチニウム) + -01e (1.2) a線や b 線を放射線といい,原子が放射線を放出する性質を放射能という.放 射線にはそのほか,c 線(電磁波),中性子線,陽子線,陽電子線などがある.
3
化学結合
物質の性質は,それを構成する原子・分子・イオンの種類だけではなく,そ れらがどのような結合様式で結びついているかにも,大きく左右される.原 子・分子・イオンの結びつき(化学結合)にはいくつかの種類がある.ここで は,陰イオンと陽イオンのイオン結合や,二原子分子に特徴的な共有結合,さ らには金属元素のつくる金属結合について学ぶ.1.3.1
イオン結合 身近な物質である食塩(塩化ナトリウム)は,水に溶けると陽イオンである ナトリウムイオン Na+と陰イオンである塩化物イオン Cl-に電離する① .また, その結晶を 800 ℃以上に熱すると融けて溶融状態となり,電気をよく通すよう になる.これらの事実から,結晶の塩化ナトリウム NaCl が結晶中ですでにイ オンの状態(Na+と Cl-)で存在していることが推測できる. ナトリウムや塩素が,それぞれ陽イオンや陰イオンになりやすい理由はすで に前節で述べたが,あらためてイオンの形成を電子式で書くとつぎのようになる. (1.3)② これらは,いずれも希ガス原子と同じ電子配置をとるので安定な陽イオンと 陰イオンとなり,両イオン間に静電的な引力がはたらくようになる.このよう な結合様式をイオン結合という.塩化ナトリウムの結晶は,ナトリウムイオン と塩化物イオンが図1.7
のように規則正しく並んでいる.このように,イオン からなる結晶をイオン結晶という. 図1.7 NaClの単位格子1.
① 溶解するときにイオンに分 かれることを電離という. ② 式中の(Ne)や(Ar)はそれ ぞれ Ne の電子配置(1s22s22p6) と Ar の電子配置(1s22s22p63s2 3p6)を表す.1
.3
化学結合 13 第 1 章 物 質 の 構 成 と 結 合1.3.2
分子をつくる結合 (1) 共有結合 二原子分子である水素や窒素は,どのような結合様式をもっているのだろう か.一般に,非金属元素は,似たようなイオン化エネルギーあるいは電子親和 力の値をとるために,イオン結合におけるような原子間での電子の移動は起こ りにくい.しかし,この場合でも,原子間で電子を共有することにより,それ ぞれの原子があたかも希ガス原子と似た電子配置をとることができるようにな る.このようにして生じる結合を共有結合とよぶ. 水素分子を例に説明しよう.水素原子は電子1個を最外殻にもっているが, 電子をもう 1 つ得ることができれば,安定なヘリウム原子と同じ電子配置をと ることができる.しかし,同じ水素原子間では,イオン結合のように電子が片 方の原子からもう一方の原子へ移動することはない.この場合は,次式に示す ように,2個の電子を2個の水素原子が共有することによって,エネルギー的 に安定となり,分子ができる. (1.4) 共有結合は,二原子分子ばかりでなく,有機化合物とよばれる主として炭素 と水素からなる化合物の原子間の結合によくみられる(第5章参照).炭素原 子は,最外殻に4個の不対電子① をもっているが,その不対電子がほかの原子 の不対電子と対をつくることによって共有電子対(共有結合)を形成する.メ タン分子の形成の例を示すとつぎのようになる. (1.5) このように,共有結合は原子間の電子の共有によって生じる化学結合と解釈 できる.この共有は一組の電子対とは限らず,たとえば,二酸化炭素分子の炭 素原子と酸素原子との間のように,二組の電子対,すなわち4個の電子を共有 する場合もある.この場合は二重結合とよばれる.つまり,共有結合には,単 結合のほかに,二重結合,さらには三重結合もある.このことは,分子の性質 と密接な関連があるので,有機化学の分野では,分子を表すのに分子式よりも, 1.1 節で述べた,価標をもとにした構造式や,それを簡略化した示性式がよく 用いられる. 共有結合によりできる結晶を共有結合結晶とよぶ.共有結合結晶の特徴は融 点が比較的高く,きわめて硬いことである. ① 実際には最外殻の4個の電 子が混じりあって新たな4個の 不対電子になる(付録 A.6 参 照).(2) 配位結合 ある原子が,ほかの原子に共有されていない電子対(非共有電子対)をもっ ている場合に,それをほかの原子に提供することによって生じる結合を配位結 合という.アンモニウムイオン NH4+を例にとって説明しよう.このイオンの もとになるアンモニアは窒素原子1個と水素原子3個からなる.窒素原子は最 外殻に電子を5個もっているが,そのうちの2個の電子は非共有電子対(孤立 電子対)① である.この非共有電子対に水素イオンがつぎのように配位してでき たイオンがアンモニウムイオンである. (1.6) このような配位結合が生じるためには,以下の条件が備わっていなければな らない. ① 1つの原子あるいは原子団が非共有電子対をもつこと. ② 配位するほうの原子が共有結合をする能力をもっていること. 次式のオキソニウムイオン H3 O+も,配位結合をもつイオンの1つである. (1.7)
1.3.3
電気陰性度 実際の分子は,イオン結合と共有結合の性格をあわせもった結合の仕方をし ている.たとえば,塩化水素 HCl の水素と塩素の結合は,約 20%がイオン結 合性で,残りの約 80%は共有結合性であると見なされている.これは,水素と ① 非共有電子対は,L 殻や M 殻を最外殻とする原子では,最 外殻に5個以上の電子が存在す るときに生じる.つぎに例を示 す. 参考1.1
極性分子 共有結合がイオン結合と異なる点の1つは,結合 に方向性があるということである.共有結合は,電 子雲の重なりによってできた結合であるので,電子 雲の形によって結合に方向性が生まれる.その結果, 分子はさまざまな形をとる.たとえば,二酸化炭素 CO2と水 H2 Oは,それぞれ3つの原子からなる分 子であるが,その形は前者が直線的であるのに対し て,後者は折れ曲がった形をしている.分子の形は, その性質に大きな影響を与える.分子を構成する異 なった種類の原子の間では必ず電荷の偏りがあり, その結果,結合はいくらかのイオン結合性を帯びる ようになる.このような状態は,近似的に+と−の 電荷がある距離をおいて存在した状態と考えられ, 双極子モーメントで表される.分子の形が二酸化炭 素のような直線分子であると,図1.8に示すように, 炭素┻酸素間の双極子モーメントは互いに相殺され て,全体として0になる.このような分子は無極性 分子とよばれる. 一方,水のような折れ曲がった形の分子の場合は, 水素┻酸素間の双極子モーメントは相殺されずに残 る.このような分子は極性分子とよばれる.極性分 子と無極性分子は性質が大きく異なり,たとえば, 極性分子である水はイオン性結晶である塩化ナトリ ウムをよく溶かすが,無極性分子である四塩化炭素 CCl4は塩化ナトリウムを溶かさない. 図1.8 分子の形が双極子モーメントの値に与える影響1
.3
化学結合 15 第 1 章 物 質 の 構 成 と 結 合 塩素で共有している電子が,塩素側にわずかに強く引きつけられているためで ある.このような原子間での電子分布の偏りの程度は,電気陰性度とよばれる 量により,ある程度推定することができる. 電気陰性度は,ある原子が電子を引きつける強さの尺度を示すものであり, 歴史的にいろいろな考え方にもとづく数値が提案されている.もっともよく用 いられているのは,ポーリングによって与えられた電気陰性度で,その数値を 表1.13
に示す.数値の大きい元素ほどその電気陰性度は大きい.周期表にお いて左下から右上に向かって電気陰性度が大きくなっていることがわかる.イ オン結合性は,結合原子間の電気陰性度の差が大きいほど大きく,電気陰性度 の差がおよそ2以上のときに,イオン結合であるといえる. 表1.13 電気陰性度(ポーリングによる) 周期 族 1 2 13 14 15 16 17 1 H 2.1 2 Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0 3 Na 0.9 Mg 1.2 Al 1.5 Si 1.8 P 2.1 S 2.5 Cl 3.0 4 K 0.8 Ca 1.0 Ga 1.6 Ge 1.8 As 2.0 Se 2.4 Br 2.8 5 Rb 0.8 Sr 1.0 In 1.7 Sn 1.8 Sb 1.9 Te 2.1 I 2.5 6 Cs 0.7 Ba 0.9 Tl 1.8 Pb 1.8 Bi 1.9 Po 2.0 At 2.21.3.4
金属結合 金属は,非金属にはないさまざまな特徴をもっている.たとえば,金属の大 部分は電気と熱をよく通す.また,金属独特の光沢をもっており,薄い板状に することができる性質(展性)や,細く引き伸ばすことのできる性質(延性) をもっている.これらの性質は,金属のどのような結晶構造にもとづくのだろ うか. 金属結晶は,規則正しく並んだ金属イオン(陽イオン)のまわりを,自由に 動きまわることのできる電子(自由電子という)がとり囲んだ構造と近似的に 見なすことができる.自由電子は,特定の金属イオンに束縛されることなく, 比較的自由に動きまわることができるので,電気や熱を運ぶ媒体となる.金属 が電気や熱の良導体であるのは,この自由電子の存在による. ある金属が,どのような結晶構造をとるかを予測することは難しいが,ごく 一部の例外の金属を除けば,大部分の金属は図1.9
に示す面心立方格子(立方 最密充てん格子),体心立方格子,六方最密充てん格子のどれかに属する.金 属結合の方向性はあまりないので,原子を硬い球と考えれば,図 1.9 の B,C および図1.10
に描かれているように,原子間のすき間がなるべく少なくなる ように密に球を詰め込んだ並び方をしている.この並び方をわかりやすく示し たのが図 1.9 の下段である.これらは単位格子とよばれる.単位格子は,これ を立体的に積み上げると全体の結晶となる基本単位である.単位格子の一辺の 長さを格子定数という. つぎに,ある単位格子の中に何個の球,つまり金属原子が含まれるか求めて ポーリング[Pauling, Linus Carl] 1901~1994 アメリカの物理 化学者.化学結合の本性の研究 と,それにもとづく複雑な化合 物の構造の解明で,1954 年に ノーベル化学賞を受賞.核実験 反対など平和運動にも尽力し, 1962年のノーベル平和賞も受 賞した.
みよう.面心立方格子の場合には8個の球が角に,6個の球が各面の中心に位 置する.角と面の球が格子に所属する割合は,それぞれ ⁸ および ½ と考えら れるので,合計で ⁸ × 8 個+ ½ × 6 個= 4 個となる.同様に,体心立方格子 では2個,六方最密充てん格子では6個となる.また,1つの球がいくつの球 に囲まれているかを示す数(配位数)は,面心立方格子と六方最密充てん格子 で 12 個,体心立方格子では8個となる. 金属は,圧力をかけたり,温度を変化させたりすると,原子の並び方が変化 する.たとえば,金に圧力を少し加えるだけで容易に原子間ですべりが起こり, 外形が変わる.このような変形しやすい結晶構造をもつことが,金属の展性や 延性のもととなっている. 例題
1.9
ナトリウムは,右図のような結晶構造をもつ 金属である. (1)この単位格子は何とよばれているか. (2)この格子中には何個の原子が含まれているか. (3) ナトリウムの単位格子の一辺の長さを L[nm](1 nm = 10-9 m)とす ると,ナトリウム原子の半径 r は,どのように表せるか. 解 (1)体心立方格子. (2) 単位格子中の原子は,8個の頂点には各 ⁸ 個,中心には1個存在する.単位 格子に含まれる原子は,⁸ × 8 + 1 × 1 = 2 個となる. 図1.9 結晶格子の例 図1.10 最密充てんの例1
糖類
デンプンを加水分解すると,マルトース C12 H22 O11を経て,グルコース C6 H12 O6を生じる.セルロースはグルコースに加水分解される.これらの物質 は,Cm(H2 O)nの一般式で表され,糖類あるいは炭水化物とよばれる.糖類は, それ以上に小さな糖に加水分解できない単糖類と,単糖類が2個結合した二糖 類,単糖類が多数つらなった多糖類の3つに分類される. 植物の骨格は,セルロースでつくられ,生きるためのエネルギーはデンプン で蓄えられる.セルロースもデンプンも,基本的な単位はグルコースである. デンプンやセルロースを酸で加水分解すると,最終的には,グルコースにまで 分解される.生物体内で,デンプンは酵素アミラーゼでデキストリンを経てマ ルトースに,さらに,マルターゼでグルコースにまで加水分解される.動物は, 植物を食べることでエネルギー源としてのグルコースを得ている.つまり動物 にとっても,グルコースは生命の源であるといえる.6.1.1
グルコース グルコース C6 H12 O6は,ブドウ糖ともいい,白い結晶で砂糖(スクロース) よりは甘さが少し弱い.グルコースには,a と b の2つの互変異性体① があり, デンプンは a┻グルコースから,セルロースは b┻グルコースからつくられる. グルコースは,アルコール性のヒドロキシ基を5個もっている.白い結晶で水6.
単糖類 加水分解でより簡単な糖になら ない糖で,炭素数が4,5,6 のものなどがある.グルコース, フルクトース,ガラクトースは いずれも C6 H12 O6の分子式の 異性体である. ① 互いに変換することができ る異性体をいい,どちらの異性 体も共存しうることが多い.第
6
章
高分子化合物
高分子化合物とは,一般に分子量が1万程度以上の分子のことをいう.多糖類,天然ゴム,タンパ ク質,DNA などは高分子である.自然にある高分子には,その構造が単なる繰り返しで構成されて いるものがある.たとえば,デンプンやセルロースは,グルコースという比較的単純な分子が連なっ て巨大分子となったものである.一方,タンパク質や核酸のように,何種類もの分子が組み合わさっ てできた複雑な高分子もある.タンパク質は,炭素,水素,酸素原子だけではなく,窒素,リン,そ のほかの原子を含み,原子配列に加えて立体的に精密につくられた高分子である.糖やタンパク質, アミノ酸は,生命とのかかわりが大きい. 人工の高分子には,二重結合が付加重合したものや,アルコールと酸から縮合重合したポリエステ ルなどがある.フェノール樹脂(ベークライト)やセルロイドからはじまった高分子化合物の化学の 進化は著しい.現代を生きる私たちは,これらの人工高分子化合物にとり囲まれて暮らしている. 単純な分子が大きく複雑になり,組織をつくると,そこに機能が生まれる.本章では,生物や人工 物の中で多様な役割を果たすさまざまな高分子化合物について学ぶ.に溶ける a┻グルコースは六員環である.水に溶けると,少量が直鎖状のアル デヒド型に変わり,さらに,六員環の b┻グルコースへと変化する. (6.1) この3つのグルコースは,互変異性体であり,水中で平衡状態になる.水の なかで少量のアルデヒド型のグルコースが存在するので,グルコースの水溶液 は還元性をもつ① .グルコースの異性体であるフルクトースとガラクトースに も還元性がある.