2.7.4 臨床的安全性の概要
127
2.7.4
臨床的安全性の概要
2.7.4.1
医薬品への曝露
2.7.4.1.1
総括的安全性評価計画及び安全性試験の記述
塩酸モザバプタンについて,日本国内で実施された臨床試験は,健康成人を対象とした臨床薬
理試験(11 試験),異所性 ADH 症候群を対象とした臨床試験(1 試験),異所性 ADH 症候群以
外の SIADH を対象とした臨床試験(1 試験),さらに各種浮腫性疾患を対象とした臨床試験(4
試験)である。
健康成人における安全性は,単回経口投与試験 7 試験(129-
A*-003 試験,129-
B*
-001 試験,
129-
E*
-001P 試験,129-
G*-001 試験,129-
H*-002 試験,129-
H*-004 試験,129-
H*-005 試験)の 132
例(延べ 242 例)及び反復経口投与試験 4 試験(129-
B*
-004 試験,129-
C*
-005P 試験,129-
H*-003
試験,129-
H*-006 試験)の 44 例を対象として評価した。
申請効能である異所性 ADH 症候群における安全性は,異所性 ADH 症候群を対象とした反復経
口投与試験(129-
C*
-001P 試験)の 16 例を対象として評価した。また,SIADH を対象とした反復
経口投与試験(129-
C*
-003P 試験)の 12 例は,いずれも異所性 ADH 症候群以外の SIADH であり,
原疾患が異なることが安全性に関連する可能性があるが,申請効能と類似する病態であることか
ら,異所性 ADH 症候群と併せた評価も行った。
これら国内で実施した試験の一覧を表 2.7.4-1 に示した。
表 2.7.4-1
安全性評価対象試験一覧−国内臨床試験−
対 象 相又は種類 用 法 治験計画番号及び内容 安全性評価対象例数注) 129-A*-003(散剤による単回経口投与) 24 例(延べ 36 例)プラセボ群:12 例 129-B*-001(散剤による食事の影響) 6 例(延べ 12 例) 129-E*-001P(フロセミドとの相互作用) 12 例(延べ 23 例) フロセミド単独群:11 例 プラセボ群:12 例 129-G*-001(市販予定製剤における食事の影響) 32 例(延べ 47 例) 129-H*-002(最終製剤による単回経口投与) 8 例(延べ 24 例) 129-H*-004(治験用製剤の生物学的同等性) 20 例(延べ 40 例) 単回 129-H*-005(CYP3A4 阻害薬との相互作用) 30 例(延べ 60 例) 129-B*-004(散剤による反復経口投与,30mg/日) プラセボ群:6 例12 例 129-C*-005P(散剤による反復経口投与,60mg/日) 6 例 プラセボ群:3 例 129-H*-003(最終製剤による反復投与) 10 例 健康成人 臨床薬理試験 反復 129-H*-006(CYP3A4 阻害作用の検討) 16 例 異所性 ADH 症候群 前期第Ⅱ相 反復 129-C*-001P(異所性 ADH 症候群対象反復経口投 与) 16 例 異所性 ADH 症候群以外の SIADH (申請効能外) 前期第Ⅱ相 反復 129-C*-003P(SIADH 対象反復経口投与) 12 例 注)同一被験者に同一用量又は別用量で複数回の単回投与を行った試験(交叉比較試験を含む)は,『延べ例数』も表示した。 また,129-A*-003,129-E*-001P,129-B*-004 及び 129-C*-005P について,対照群(プラセボ又はフロセミド)の例数も示した。*:新薬承認情報提供時に置き換えた
一方,各種浮腫性疾患を対象とした単回経口投与試験 2 試験(129-B*-006P 試験,129-B*-007P
試験)及び反復経口投与試験 2 試験(129-C*-004P 試験,129-D*-001P 試験)の 169 例(延べ 171
例)(表 2.7.4-2)については,異所性 ADH 症候群とは病態が異なることから,参考としての評
価を行うにとどめた。
表 2.7.4-2
各種浮腫性疾患を対象とした臨床試験(参考資料)
対 象 相又は種類 用 法 治験計画番号及び内容 安全性評価対象例数注) 129-B*-006P(各種浮腫対象単回経口投与) 26 例(延べ 28 例) 単回 129-B*-007P(肝性浮腫対象単回経口投与) 8 例 129-C*-004P(各種浮腫対象反復経口投与) 106 例 各種浮腫性 疾患 (申請効能外) 前期第Ⅱ相 反復 129-D*-001P(低 Na 浮腫対象反復経口投与) 29 例 注)同一被験者に別用量で複数回の単回投与を行った試験(129-B*-006P)は,『延べ例数』も表示した。また,国内で実施した臨床試験の他,海外(英国)において実施した健康成人を対象とした標
識化合物を用いた臨床薬理試験(013873 試験:2.7.2.1.2.1 参照)における有害事象に関する成績
及び塩酸モザバプタンの注射剤を用いた臨床試験における有害事象に関する成績も別途示した。
2.7.4.1.1.1
有害事象の定義
有害事象に関して,各試験の治験実施計画書にはその定義を行っていない場合もあったため,
事後的に下記の通りに評価した。
治験担当医師が調査表に記載した事象名あるいは治験総括医師が判定した事象名は,申請者が
MedDRA/J Ver.4.1 を用いて読み替え,各試験の治験総括報告書を作成した。また,本項(2.7.4 項)
においては MedDRA/J Ver.7.0 で再度読み替えた用語を用いた。
(1) 健康成人を対象とした臨床薬理試験
【治験実施計画書に有害事象を定義していた試験】
129-E*-001P 試験では,治験実施計画書の定義に従い,随伴症状(自覚症状・他覚所見)の発現,
生理学的検査又は心電図における異常並びに臨床検査値の異常変動を有害事象とした。
129-G*-001 試験,129-H*-002 試験,129-H*-003 試験,129-H*-004 試験,129-H*-005 試験及び
129-H*-006 試験では,治験実施計画書の定義に従い,身体的徴候及び症状,バイタルサイン・体
重,心電図検査における新たな異常の発現あるいは増悪並びに臨床検査値の異常変動を有害事象
とした。
【治験実施計画書に有害事象を定義していなかった試験】
129-A*-003 試験,129-B*-001 試験,129-B*-004 試験及び 129-C*-005P 試験では,副作用,自覚
症状・他覚所見として担当医師が調査表に記載したもの,臨床検査,理学的検査,心電図検査の
異常変動を有害事象とした。
(2) SIADH を対象とした臨床試験
【治験実施計画書に有害事象を定義していた試験】
129-C*-001P 試験では,治験実施計画書の定義に従い,偶発症の発現,合併症・併発症の増悪,
理学的検査,心電図検査及び臨床症状の異常又は増悪並びに臨床検査値異常変動を有害事象とし
2.7.4 臨床的安全性の概要
129
た。
【治験実施計画書に有害事象を定義していなかった試験】
129-
C*
-003P 試験では,副作用,偶発症の発症,合併症・併発症の悪化,臨床検査値異常変動,
生理学検査,心電図検査及び臨床症状の異常又は増悪を有害事象とした。
更に,上記の有害事象に加えて,有効性評価項目の悪化を示す記載内容についても,治験総括
医師の判定により有害事象として取り上げた。
(3) 各種浮腫性疾患を対象とした臨床試験
【治験実施計画書に有害事象を定義していた試験】
129-
D*-001P 試験では,治験実施計画書の定義に従い,偶発症の発症,合併症の増悪,原疾患の
増悪,臨床検査値の異常変動及び生理学的検査,心電図検査及び臨床所見等の異常又は増悪を有
害事象とした。
【治験実施計画書に有害事象を定義していなかった試験】
129-
B*
-006P 試験では,副作用,合併症の悪化,偶発症の発症,臨床検査値異常変動,生理学的
検査,心電図検査及び臨床所見等の異常又は増悪を有害事象とした。
129-
B*
-007P 試験では,随伴症状の悪化,偶発症の発症,合併症・併発症の悪化,副作用,臨床
検査値異常変動,生理学的検査,心電図検査及び臨床所見等の異常又は増悪を有害事象とした。
129-
C*
-004P 試験では,副作用,偶発症の発症,合併症・併発症の悪化,臨床検査値異常変動,
生理学的検査,心電図検査及び臨床所見等の異常又は増悪を有害事象とした。
更に,上記の有害事象に加えて,有効性評価項目の悪化を示す記載内容についても,治験総括
医師の判定により有害事象として取り上げた。
2.7.4.1.1.2
その他の重篤な有害事象及びその他の重要な有害事象の定義
死亡,その他の重篤な有害事象は,薬事法施行規則第 66 条の 7 に従って分類した。その他の重
要な有害事象は,平成 8 年 5 月 1 日 薬審第 335 号「治験の総括報告書の構成と内容に関するガイ
ドライン」に準じ,試験の中止に至った有害事象,処置が行われた有害事象,「臨床検査値の重
症度分類」のグレード 3 に相当する臨床検査値異常変動に該当するものとして分類した。なお,
有害事象により中止した被験者において,中止後に実施した臨床検査で認めた臨床検査値異常変
動についても,中止に至った有害事象に含めその他の重要な有害事象として取り扱った。
2.7.4.1.1.3
各試験における安全性評価項目
各試験における安全性に関する評価項目を表 2.7.4-3 に示した。
*:新薬承認情報提供時に置き換えた
表 2.7.4-3
各試験の安全性評価項目
対 象 用法 治験計画番号 検査項目 129-A*-003 診察・問診(自覚症状・他覚所見),臨床検査,血圧・脈拍数,体重,体温, 呼吸数,安静時 12 誘導心電図,心電図モニター 129-B*-001 診察・問診(自覚症状・他覚所見),臨床検査,血圧・脈拍数,体重,体温, 呼吸数,安静時 12 誘導心電図,心電図モニター 129-E*-001P 診察・問診(自覚症状・他覚所見),臨床検査,血圧・脈拍数,体重,体温, 安静時 12 誘導心電図 129-G*-001 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図,心電図モニター 129-H*-002 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図,心電図モニター 129-H*-004 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図 単回 129-H*-005 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図 129-B*-004 診察・問診,自覚症状・他覚所見,臨床検査,血圧・脈拍数,体重,体温,呼 吸数,安静時 12 誘導心電図,心電図モニター 129-C*-005P 診察・問診,自覚症状・他覚所見,臨床検査,血圧・脈拍数,体重,体温,呼 吸数,安静時 12 誘導心電図,心電図モニター 129-H*-003 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図 健康成人 反復 129-H*-006 有害事象(身体的徴候及び症状),臨床検査,血圧・脈拍数,体重,体温,安 静時 12 誘導心電図 異所性 ADH 症候群 反復 129-C*-001P 偶発症,合併症・併発症,副作用,臨床検査,血圧・脈拍数,体重,安静時 12 誘導心電図,臨床症状注) 異所性 ADH 症候群以外の SIADH 反復 129-C*-003P 偶発症,合併症・併発症,副作用,臨床検査,血圧・脈拍数,体重,安静時 12 誘導心電図,臨床症状注) 129-B*-006P 合併症・偶発症,副作用,臨床検査,血圧・脈拍数,体重,安静時 12 誘導心 電図,心電図モニター(不整脈の認められた患者のみ),臨床症状注) 単回 129-B*-007P 随伴症状,偶発症,合併症・併発症,副作用,臨床検査,血圧・脈拍数,体重, 安静時 12 誘導心電図,臨床症状注) 129-C*-004P 偶発症,合併症・併発症,副作用,臨床検査,血圧・脈拍数,安静時 12 誘導 心電図,臨床所見注) 各種浮腫性 疾患 反復 129-D*-001P 偶発症,合併症,副作用,臨床検査,血圧・脈拍数,安静時 12 誘導心電図, 臨床所見注) 注)臨床症状あるいは臨床所見は,治験実施計画書で有効性評価項目としていたが,悪化が見られた場合には,安全性評価 対象とした。臨床検査(血液学的検査,生化学的検査,尿検査)は,以下の項目を測定した。
・血液学的検査:赤血球数,ヘモグロビン,ヘマトクリット値,白血球数,白血球分画,血
小板数(全試験で測定)
FDP,フィブリノーゲン,プロトロンビン時間(一部の試験でのみ測定)
活性化部分トロンボプラスチン時間(健康成人の一部の試験でのみ測定)
・生化学的検査:総ビリルビン,総蛋白,アルブミン,AST(GOT),ALT(GPT),Al-P,
LDH,γ-GTP,クレアチニン,尿酸,BUN,総コレステロール,Na,K,
Cl,Ca(全試験で測定)
LAP,コリンエステラーゼ,中性脂肪,リン脂質,空腹時血糖,iP(一部
の試験でのみ測定)
直接ビリルビン,A/G,CPK,遊離脂肪酸,Mg(健康成人の一部の試験で
のみ測定)
・尿検査:pH,糖,蛋白,潜血(全試験で測定)
2.7.4 臨床的安全性の概要
131
比重,ウロビリノーゲン,ビリルビン,ケトン体,沈渣(一部の試験で実施)
外観(色調,混濁)(健康成人の一部の試験で実施)
これらの臨床検査については,治験担当医師により異常変動の有無が判定され,有害事象とし
て評価された。この他,申請者が別途定めた基準値を用いた「治験依頼者基準に基づく異常変動」
について分析した(2.7.4.3 参照)。
バイタルサイン(血圧・脈拍数,体温)及び体重については臨床検査値と同様の分析を行った。
また,健康成人を対象とした臨床薬理試験(11 試験)での心電図については,QT/QTc を含む心
電図パラメータのマニュアル測定をレトロスペクティブに行い,それらへの影響を評価した。
2.7.4.1.2
全般的な曝露状況
2.7.4.1.2.1
健康成人における曝露
健康成人を対象とした臨床薬理試験における安全性評価対象例の塩酸モザバプタンの投与量・
投与期間別被験者数を表 2.7.4-4 に示した。
表 2.7.4-4
健康成人を対象とした臨床薬理試験における安全性評価対象例の塩酸モザバ
プタンの投与量・投与期間別被験者数
1 回投与量
対 象
投与期間
1)3mg 15mg
30mg
60mg
90mg
100mg 200mg
計
単回投与
2)1 日 6 6 184 14 8 18 6 242
7 日 0 6 6 6 0 0 0 18
反復投与
10 日 0 0 26 0 0 0 0 26
健康成人
合 計 6
12
216
20
8
18
6
286
1)投与期間=最終投与日−投与開始日+1 2)同一被験者に複数回の単回経口投与を行った試験(129-A*-003,129-B*-001,129-E*-001P,129-G*-001,129-H*-002,129-H*-004, 129-H*-005)については,延べ症例数を示した。129-
A*-003 試験では,散剤により塩酸モザバプタンの 3 mg,15 mg,30 mg,60 mg,100 mg 又
は 200 mg(各用量 6 例)を絶食下に単回経口投与した時の安全性を,プラセボ(12 例)を対照と
して検討した。24 例の被験者に対し,プラセボ又は各用量の塩酸モザバプタンのいずれかを 2 回
投与する計画であったが,脱落例が 1 例あったため,実際の被験者数は 25 例となった。このうち,
23 例はプラセボ又は各用量の塩酸モザバプタンのいずれか 2 種類を投与され,1 例は 100 mg のみ
を,1 例はプラセボのみを投与された。
129-
B*
-001 試験では,散剤により塩酸モザバプタン 100 mg を 6 例に対し,交叉比較法により絶
食下又は食後に単回経口投与した時の安全性を検討した。
129-
E*
-001P 試験では,塩酸モザバプタン 30 mg 錠1錠を 12 例に対し,塩酸モザバプタン単独,
フロセミドとの併用,プラセボ,フロセミド単独の 4 群交叉比較法により投与し,塩酸モザバプ
タン単独又はフロセミド 20 mg 錠 1 錠と併用で単回経口投与した時の安全性を検討した。脱落例
が 1 例あったため,プラセボ投与例及び塩酸モザバプタン単独投与例が 12 例,フロセミド単独投
与例及びフロセミドと塩酸モザバプタン併用例が 11 例となった。
129-
G*-001 試験では,塩酸モザバプタン 30 mg 錠 1 錠を 16 例に対し,交叉比較法により絶食下
又は食後に単回経口投与した時の安全性を検討した。中止例が 1 例あったため,絶食下投与例 16
*:新薬承認情報提供時に置き換えた
例,食後投与例 15 例となった。また,本試験では,この他に 16 例が尿検体混合のためⅠ期のみ
で中止しており,この 16 例は市販予定製剤(
)とは異なる製造法の 30 mg 錠(
)を投与されていたが,これらの症例も併せて安全性を検討した。
129-
H*-002 試験では,塩酸モザバプタン 30 mg 錠を 8 例に対し 30 mg(1 錠),60 mg(2 錠)
及び 90 mg(3 錠)の用量で絶食下にそれぞれ漸増法により単回経口投与した時の安全性を検討し
た。
129-
H*-004 試験では,塩酸モザバプタン 30 mg 錠 1 錠又は 30 mg 散剤を 20 例に対し交叉比較法
により絶食下に単回経口投与した時の安全性を検討した。
129-
H*-005 試験では,塩酸モザバプタン 30 mg 錠 1 錠を 24 例に対し,単独又はイトラコナゾー
ル併用下で絶食下単回経口投与した時の安全性を,イトラコナゾールを併用せず塩酸モザバプタ
ン 30 mg 錠 1 錠を 2 回絶食下単回経口投与した 6 例を対照として検討した。
129-
B*
-004 試験では,散剤により塩酸モザバプタン 15 mg を 1 日 2 回又は 30 mg を 1 日 1 回そ
れぞれ 6 例に対し食後に 7 日間反復経口投与した時の安全性をプラセボ(6 例)を対照として検
討した。
129-
C*
-005P 試験では,散剤により塩酸モザバプタン 60 mg を 6 例に対し 1 日 1 回食後に 7 日間
反復経口投与した時の安全性をプラセボ(3 例)を対照として検討した。
129-
H*-003 試験では,塩酸モザバプタン 30 mg 錠を 10 例に対し 1 日 1 回食後に 10 日間反復経
口投与した時の安全性を検討した。
129-
H*-006 試験では,塩酸モザバプタン 30 mg 錠を 16 例に対し 1 日 1 回食後に 10 日間反復経
口投与した時の安全性を検討した。
2.7.4.1.2.2 SIADH における曝露
SIADH を対象とした臨床試験における安全性評価対象例の塩酸モザバプタンの投与量・投与期
間別被験者数を表 2.7.4-5 に示した。
表 2.7.4-5
SIADH を対象とした臨床試験における安全性評価対象例の塩酸モザバプタン
の投与量・投与期間別被験者数
1 回投与量
対 象
投与期間
1)30mg
計
反復投与
2∼7 日 16
16
異所性 ADH
症候群
合 計 16 16
2∼7 日 9
9
反復投与
8 日∼
3
2)3
異所性 ADH
症候群以外の
SIADH
合 計 12 12
1)投与期間=最終投与日−投与開始日+1
2) 8 日目に誤って 30mg 散剤を投与した 1 例を含む
129-
C*
-001P 試験では,異所性 ADH 症候群を対象に塩酸モザバプタン 30 mg 錠 1 錠を 1 日 1 回
反復経口投与した時の安全性を 16 例で検討した。中止例があったため,3 日投与が 2 例,7 日投
与が 14 例であった。2 例が朝食前に,14 例が朝食後に投与された。
129-
C*
-003P 試験では,異所性 ADH 症候群以外の SIADH を対象に塩酸モザバプタン 30 mg 錠 1
2.7.4 臨床的安全性の概要
133
錠を 1 日 1 回反復経口投与した時の安全性を 12 例で検討した。中止例があったため,2 日投与が
1 例,7 日投与が 9 例,28 日投与が 2 例であった。全例朝食後に投与された。
2.7.4.1.2.3
各種浮腫性疾患における曝露
各種浮腫性疾患を対象とした臨床試験における安全性評価対象例の塩酸モザバプタンの投与
量・投与期間別被験者数を表 2.7.4-6 に示した。
表 2.7.4-6
各種浮腫性疾患を対象とした臨床試験における安全性評価対象例の塩酸モザ
バプタンの投与量・投与期間別被験者数
1 回投与量
対 象
投与期間
1)15mg 30mg 60mg 100mg
計
単回投与
2)1 日 4 23 10 3 40
2∼7 日 11 106 12
0
129
反復投与
8 日∼
0 2 0 0 2
各種浮腫性
疾患
(申請効能外)
小 計 15
131
22
3
171
1)投与期間=最終投与日−投与開始日+1 2)同一被験者に複数回の単回経口投与を行った試験(129-B*-006P)については,延べ症例数を示した。129-
B*
-006P 試験では,各種浮腫性疾患を対象に塩酸モザバプタン 15 mg,30 mg,60 mg 又は
100 mg を散剤により単回経口投与した時の安全性を 26 例(延べ 28 例)で検討した。15 mg と 30
mg の 2 用量を投与された 1 例,30 mg と 60 mg の 2 用量を投与された 1 例が含まれており,15 mg
投与が 4 例,30 mg 投与が 11 例,60 mg 投与が 10 例,100 mg 投与が 3 例であった。この投与量
は,臨床症状,尿量,尿・血清浸透圧,尿中電解質濃度,血清ナトリウム濃度等から各患者の状
態を治験担当医師が判断し,3∼200 mg の範囲の 6 用量から選択したものであった。
129-
B*
-007P 試験では,肝性浮腫を対象に塩酸モザバプタン 30 mg を散剤により単回経口投与し
た時の安全性を 8 例で検討した。
129-
C*
-004P 試験では,各種浮腫性疾患を対象に塩酸モザバプタン 30 mg 錠 1 錠を 7 日間反復経
口投与した時の安全性を 106 例で検討した。中止例があったため,1 日投与が 4 例,2 日投与が 1
例,3 日投与が 6 例,4 日投与が 2 例,5 日投与が 2 例,6 日投与が 1 例,7 日投与が 88 例,8 日
投与が 2 例であった。
129-
D*-001P 試験では,低ナトリウム血症を呈する各種浮腫性疾患を対象に塩酸モザバプタン
15 mg(15 mg 錠 1 錠),30 mg(30 mg 錠 1 錠)あるいは 60 mg(30 mg 錠 2 錠)を二重盲検法で
7 日間反復経口投与した時の安全性を 29 例で検討した。中止例があったため,15 mg 2 日投与が
1例,15 mg 4 日投与が1例,15 mg 7 日投与が 9 例,30 mg 7 日投与が 6 例,60 mg 7 日投与が 12
例であった。
2.7.4.1.2.4
その他
塩酸モザバプタンを投与されたが,GCP 違反例とされた症例が 10 例(延べ 11 例)あった。
129-
B*
-005P 試験は,組み入れ患者 7 例中 3 例が GCP 違反例であったため,評価資料としない
こととした。本試験では,SIADH を対象に塩酸モザバプタン 30 mg,60 mg 又は 100 mg を散剤に
より単回経口投与した時の安全性を 7 例(延べ 8 例)で検討した。30 mg 投与が 1 例,60 mg 投与
*:新薬承認情報提供時に置き換えた
が 6 例,100 mg 投与が 1 例であり,この中には,60 mg と 100 mg の 2 用量を投与した 1 例が含ま
れている。この投与量は,臨床症状,尿量,尿・血清浸透圧,尿中電解質濃度,血清ナトリウム
濃度等から各患者の状態を治験担当医師が判断し,3∼200 mg の範囲の 6 用量から選択したもの
であった。これらの症例において,60 mg 投与例の 6 例中 4 例に 11 件,100 mg 投与例の 1 例中 1
例に 1 件の有害事象が発現した。このうち塩酸モザバプタンとの関連性が否定できない有害事象
(副作用)は,60 mg 投与例で 2 例に 5 件(1 例に口渇,血中カリウム増加,他の 1 例にコリンエ
ステラーゼ減少,血中乳酸脱水素酵素減少,脂質減少)が発現した。有害事象による中止例,死
亡又はその他の重篤な有害事象の発現は認められなかった。なお,129-
B*
-005P 試験では,治験実
施計画書に有害事象を定義していなかったが,副作用,合併症の悪化,偶発症の発症,臨床検査
値異常変動,生理学的検査,心電図検査及び臨床所見等の異常又は増悪を併せて有害事象とした。
129-
B*
-006P 試験では,GCP 違反例とされた症例が 2 例あり,それぞれ 30 mg 又は 60 mg を投
与された。これらの症例において,有害事象による中止例,死亡又はその他の重篤な有害事象の
発現は認められなかった。
129-
D*-001P 試験では,GCP 違反とされた症例が 1 例あり,この症例は 15 mg を 1 回投与され
た後,試験を中止された。本症例において,有害事象として血中乳酸脱水素酵素増加がみられた
が,有害事象により中止されたものではなく,重篤又は重要なものではなかった。
2.7.4.1.3
治験対象集団の人口統計学的特性及びその他の特性
2.7.4.1.3.1
健康成人
健康成人の安全性評価対象例数は,176 例であり全て男性であった。年齢は 24.8±3.9 歳(平均
値±標準偏差,以下同様)
(20∼39 歳),体重は 62.79±6.40kg(50.9∼82.5kg)であった(表 2.7.4-7)。
表 2.7.4-7
安全性評価対象(健康成人)の人口統計学的特性及びその他の特性
合 計 単回経口投与試験 (7 試験) 反復経口投与試験 (4 試験) 評価対象例数注) 176 132 44 平均値±標準偏差 24.8±3.9 24.8±3.9 24.9±4.0 中央値 24.0 24.0 23.5 年齢 (歳) 最小−最大 20-39 20-39 20-36 平均値±標準偏差 62.79±6.40 62.52±6.26 63.59±6.82 中央値 62.80 62.90 62.40 体重 (kg) 最小−最大 50.9-82.5 50.9-82.2 53.7-82.5 注)実際の被験者数を示す2.7.4.1.3.2 SIADH
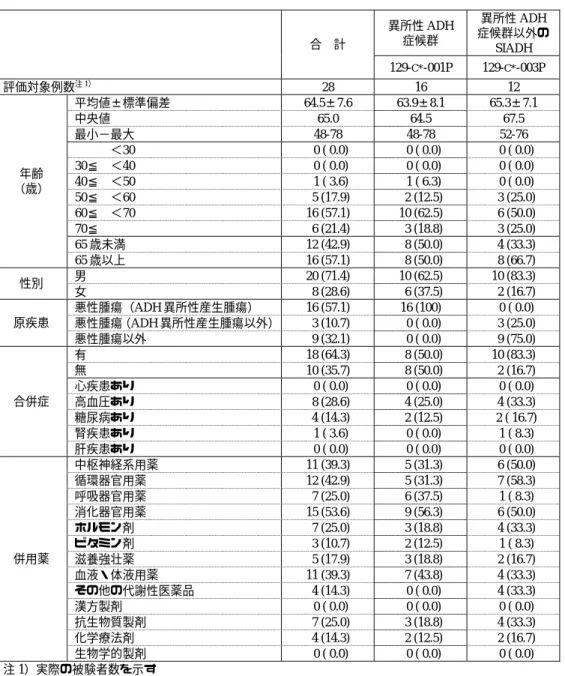
異所性 ADH 症候群の安全性評価対象例は 16 例,異所性 ADH 症候群以外の SIADH の安全性評
価対象例数は 12 例であった。
異所性 ADH 症候群の安全性評価対象例の内訳は,男性 10 例(62.5%),女性 6 例(37.5%)で
あった。年齢は 63.9±8.1 歳(48∼78 歳)で,65 歳未満が 8 例(50.0%),65 歳以上が 8 例(50.0%)
であった。原疾患はすべて ADH 異所性産生腫瘍であった。合併症ありが 8 例(50.0%)であり,
高血圧ありが 4 例(25.0%),糖尿病ありが 2 例(12.5%),腎疾患あり,心疾患あり及び肝疾患
ありはなかった(表 2.7.4-8)。
2.7.4 臨床的安全性の概要
135
異所性 ADH 症候群以外の SIADH の安全性評価対象例の内訳は,男性 10 例(83.3%),女性 2
例(16.7%)であった。年齢は 65.3±7.1 歳(52∼76 歳)で,65 歳未満が 4 例(33.3%),65 歳以
上が 8 例(66.7%)であった。原疾患は,ADH 異所性産生腫瘍以外の悪性腫瘍が 3 例(25.0%),
悪性腫瘍以外が 9 例(75.0%)であった。合併症ありが 10 例(83.3%)であり,高血圧ありが 4
例(33.3%),糖尿病ありが 2 例(16.7%),腎疾患ありが 1 例(8.3%)であり,心疾患あり及び
肝疾患ありはなかった(表 2.7.4-8)。
異所性 ADH 症候群と異所性 ADH 症候群以外の SIADH の安全性評価対象は,その人口統計学
的特性及びその他の特性において,原疾患が異なることを除いて,安全性に関連する可能性のあ
る違いはなかった。
表 2.7.4-8
SIADH を対象とした臨床試験における安全性評価対象例の人口統計学的特性
及びその他の特性
異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 合 計 129-C*-001P 129-C*-003P 評価対象例数注 1) 28 16 12 平均値±標準偏差 64.5±7.6 63.9±8.1 65.3±7.1 中央値 65.0 64.5 67.5 最小−最大 48-78 48-78 52-76 <30 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 30≦ <40 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 40≦ <50 1 ( 3.6) 1 ( 6.3) 0 ( 0.0) 50≦ <60 5 (17.9) 2 (12.5) 3 (25.0) 60≦ <70 16 (57.1) 10 (62.5) 6 (50.0) 70≦ 6 (21.4) 3 (18.8) 3 (25.0) 65 歳未満 12 (42.9) 8 (50.0) 4 (33.3) 年齢 (歳) 65 歳以上 16 (57.1) 8 (50.0) 8 (66.7) 男 20 (71.4) 10 (62.5) 10 (83.3) 性別 女 8 (28.6) 6 (37.5) 2 (16.7) 悪性腫瘍(ADH 異所性産生腫瘍) 16 (57.1) 16 (100) 0 ( 0.0) 悪性腫瘍(ADH 異所性産生腫瘍以外) 3 (10.7) 0 ( 0.0) 3 (25.0) 原疾患 悪性腫瘍以外 9 (32.1) 0 ( 0.0) 9 (75.0) 有 18 (64.3) 8 (50.0) 10 (83.3) 無 10 (35.7) 8 (50.0) 2 (16.7) 心疾患あり 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 高血圧あり 8 (28.6) 4 (25.0) 4 (33.3) 糖尿病あり 4 (14.3) 2 (12.5) 2 ( 16.7) 腎疾患あり 1 ( 3.6) 0 ( 0.0) 1 ( 8.3) 合併症 肝疾患あり 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 中枢神経系用薬 11 (39.3) 5 (31.3) 6 (50.0) 循環器官用薬 12 (42.9) 5 (31.3) 7 (58.3) 呼吸器官用薬 7 (25.0) 6 (37.5) 1 ( 8.3) 消化器官用薬 15 (53.6) 9 (56.3) 6 (50.0) ホルモン剤 7 (25.0) 3 (18.8) 4 (33.3) ビタミン剤 3 (10.7) 2 (12.5) 1 ( 8.3) 滋養強壮薬 5 (17.9) 3 (18.8) 2 (16.7) 血液・体液用薬 11 (39.3) 7 (43.8) 4 (33.3) その他の代謝性医薬品 4 (14.3) 0 ( 0.0) 4 (33.3) 漢方製剤 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 抗生物質製剤 7 (25.0) 3 (18.8) 4 (33.3) 化学療法剤 4 (14.3) 2 (12.5) 2 (16.7) 併用薬 生物学的製剤 0 ( 0.0) 0 ( 0.0) 0 ( 0.0) 注 1)実際の被験者数を示す ( )は,評価対象例数に対する%を示した。 心疾患:心不全,心筋梗塞,心臓弁疾患,心筋症 腎疾患:ネフローゼ症候群,腎不全,各種腎炎,各種腎症 肝疾患:各種肝炎,各種肝硬変,肝癌,肝嚢胞2.7.4.1.3.3
各種浮腫性疾患
各種浮腫性疾患の安全性評価対象例数は,169 例であった。
169 例の内訳は,男性 100 例(59.2%),女性 69 例(40.8%)であった。年齢は 57.4±11.0 歳(22
∼79 歳)であり,65 歳未満が 123 例(72.8%),65 歳以上が 46 例(27.2%)であった。浮腫の原
因疾患は,心疾患が 39 例(23.1%),腎疾患が 52 例(30.8%),肝疾患が 73 例(43.2%),その
他が 5 例(3.0%)であった。基礎疾患又は合併症として,心疾患ありが 43 例(25.4%),高血圧
2.7.4 臨床的安全性の概要
137
ありが 26 例(15.4%),糖尿病ありが 54 例(32.0%),腎疾患ありが 60 例(35.5%),肝疾患あ
りが 85 例(50.3%)であった(表 2.7.4-9)。
表 2.7.4-9
各種浮腫性疾患を対象とした臨床試験における安全性評価対象例の人口統計
学的特性及びその他の特性
各種浮腫性疾患を 対象とした臨床試験 評価対象例数注 1) 169 平均値±標準偏差 57.4±11.0 中央値 58.0 最小−最大 22-79 <30 4 ( 2.4) 30≦ <40 7 ( 4.1) 40≦ <50 26 (15.4) 50≦ <60 57 (33.7) 60≦ <70 54 (32.0) 70≦ 21 (12.4) 65 歳未満 123 (72.8) 年齢 (歳) 65 歳以上 46 (27.2) 男 100 (59.2) 性別 女 69 (40.8) 心疾患 39 (23.1) 腎疾患 52 (30.8) 肝疾患 73 (43.2) 基礎疾患 その他 5 ( 3.0) 心疾患あり 43 (25.4) 高血圧あり 26 (15.4) 糖尿病あり 54 (32.0) 腎疾患あり 60 (35.5) 基礎疾患 又は 合併症注 2) 肝疾患あり 85 (50.3) 中枢神経系用薬 33 (19.5) 循環器官用薬 124 (73.4) 呼吸器官用薬 9 ( 5.3) 消化器官用薬 93 (55.0) ホルモン剤 34 (20.1) ビタミン剤 22 (13.0) 滋養強壮薬 34 (20.1) 血液・体液用薬 45 (26.6) その他の代謝性医薬品 71 (42.0) 漢方製剤 10 ( 5.9) 抗生物質製剤 23 (13.6) 化学療法剤 7 ( 4.1) 併用薬 生物学的製剤 13 ( 7.7) 注 1)実際の被験者数を示す 注 2)基礎疾患又は合併症としてそれぞれの疾患を有する患者数を示した。 心疾患:心不全,心筋梗塞,心臓弁疾患,心筋症 腎疾患:ネフローゼ症候群, 腎不全,各種腎炎,各種腎症 肝疾患:各種肝炎,各種肝硬変,肝癌,肝嚢胞 ( )は,評価対象例数に対する%を示した。2.7.4.2
有害事象
2.7.4.2.1
有害事象の解析
本項では,2.7.4.1.1.1 に記載した定義に従い,有害事象として取り扱った事象について解析を行
った。
2.7.4.2.1.1
比較的よく見られる有害事象
(1) 健康成人を対象とした臨床薬理試験における有害事象の要約
健康成人を対象とした臨床薬理試験における有害事象を塩酸モザバプタンとの関連性別に表
2.7.4-10 に示した。
有害事象は,塩酸モザバプタン投与例の評価対象例 286 例中 51 例(17.8%)に 80 件が発現し
た。また,プラセボ投与例の評価対象例 33 例中 14 例(42.4%)に 27 件が発現した。死亡,その
他の重篤な有害事象及びその他の重要な有害事象の発現はなかった。
器官別大分類で,塩酸モザバプタン投与例において最も高頻度でみられたものは,臨床検査の
27 例(9.4%)であり,次いで胃腸障害 22 例(7.7%),全身障害及び投与局所様態 13 例(4.5%),
神経系障害,呼吸器,胸郭及び縦隔障害各 1 例(0.3%)の順であった。事象ごとでは,軟便 14
例(4.9%),口渇 13 例(4.5%),異常便 8 例(2.8%),血中クレアチンホスホキナーゼ増加 8
例(2.8%)の順であった。
プラセボ投与例での器官別大分類では,胃腸障害 8 例(24.2%),臨床検査 6 例(18.2%),呼
吸器,胸郭及び縦隔障害 3 例(9.1%)がみられた。
関連性を否定できない有害事象は,塩酸モザバプタン投与例の評価対象例 286 例中 46 例
(16.1%)に 61 件が発現した。プラセボ投与例の評価対象例 33 例には,関連性を否定できない
有害事象の発現はなかった。
器官別大分類で,塩酸モザバプタン投与例において最も高頻度でみられた事象は,臨床検査の
21 例(7.3%)であり,次いで胃腸障害 18 例(6.3%),全身障害及び投与局所様態 13 例(4.5%),
神経系障害 1 例(0.3%)の順であった。事象ごとでは,口渇 13 例(4.5%),軟便 10 例(3.5%),
異常便 7 例(2.4%),血中クレアチンホスホキナーゼ増加 7 例(2.4%)の順であった。
健康成人を対象とした臨床薬理試験における用量別の有害事象について,単回経口投与試験で
みられた有害事象を表 2.7.4-11 に,反復経口投与試験でみられた有害事象を表 2.7.4-12 に示した。
単回投与試験でみられた有害事象のうち,口渇は,申請用量より高用量(60 mg,90 mg,100 mg
及び 200 mg)のみの発現であった。その他の事象については,用量による明らかな傾向はなかっ
た。反復投与試験でみられた有害事象についても,口渇が申請用量より高用量(60 mg)のみの発
現であり,その他の事象には用量による明らかな傾向はみられなかった。
2.7.4 臨床的安全性の概要
139
表 2.7.4-10
塩酸モザバプタンとの関連性別の有害事象(健康成人)
a)塩酸モザバプタンとの関連性を問わない有害事象 塩酸モザバプタン プラセボ 器官別大分類 / 基本語 合 計 単回経口 投与試験 反復経口 投与試験 合 計 単回経口 投与試験 反復経口 投与試験 評価対象例数 286 242 44 33 24 9 有害事象発現件数 80 53 27 27 18 9 N % N % N % N % N % N % 有害事象発現例数 51 17.8 37 15.3 14 31.8 14 42.4 9 37.5 5 55.6 胃腸障害 22 7.7 12 5.0 10 22.7 8 24.2 4 16.7 4 44.4 異常便 8 2.8 2 0.8 6 13.6 0 0.0 0 0.0 0 0.0 軟便 14 4.9 9 3.7 5 11.4 7 21.2 3 12.5 4 44.4 悪心 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 水様便 4 1.4 1 0.4 3 6.8 1 3.0 1 4.2 0 0.0 全身障害及び投与局所様態 13 4.5 10 4.1 3 6.8 0 0.0 0 0.0 0 0.0 口渇 13 4.5 10 4.1 3 6.8 0 0.0 0 0.0 0 0.0 臨床検査 27 9.4 20 8.3 7 15.9 6 18.2 4 16.7 2 22.2 アラニン・アミノトランスフェラーゼ増加 4 1.4 2 0.8 2 4.5 0 0.0 0 0.0 0 0.0 アスパラギン酸アミノトランスフェラーゼ増加 2 0.7 2 0.8 0 0.0 0 0.0 0 0.0 0 0.0 血中クレアチンホスホキナーゼ増加 8 2.8 7 2.9 1 2.3 2 6.1 2 8.3 0 0.0 血中ブドウ糖増加 1 0.3 0 0.0 1 2.3 0 0.0 0 0.0 0 0.0 血中乳酸脱水素酵素増加 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 血中尿酸増加 5 1.7 5 2.1 0 0.0 1 3.0 1 4.2 0 0.0 好酸球数増加 0 0.0 0 0.0 0 0.0 1 3.0 0 0.0 1 11.1 遊離脂肪酸増加 2 0.7 2 0.8 0 0.0 1 3.0 1 4.2 0 0.0 ヘマトクリット減少 1 0.3 0 0.0 1 2.3 1 3.0 1 4.2 0 0.0 ヘモグロビン減少 1 0.3 0 0.0 1 2.3 1 3.0 1 4.2 0 0.0 赤血球数減少 1 0.3 0 0.0 1 2.3 1 3.0 1 4.2 0 0.0 尿中赤血球陽性 1 0.3 1 0.4 0 0.0 1 3.0 0 0.0 1 11.1 尿中ビリルビン増加 2 0.7 0 0.0 2 4.5 0 0.0 0 0.0 0 0.0 尿潜血陽性 2 0.7 1 0.4 1 2.3 1 3.0 0 0.0 1 11.1 尿中蛋白陽性 2 0.7 2 0.8 0 0.0 0 0.0 0 0.0 0 0.0 尿中ケトン体陽性 0 0.0 0 0.0 0 0.0 1 3.0 1 4.2 0 0.0 神経系障害 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 体位性めまい 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 呼吸器,胸郭及び縦隔障害 1 0.3 1 0.4 0 0.0 3 9.1 2 8.3 1 11.1 咳嗽 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 鼻出血 0 0.0 0 0.0 0 0.0 1 3.0 1 4.2 0 0.0 鼻閉 0 0.0 0 0.0 0 0.0 1 3.0 1 4.2 0 0.0 咽喉頭疼痛 0 0.0 0 0.0 0 0.0 1 3.0 1 4.2 0 0.0 鼻漏 0 0.0 0 0.0 0 0.0 1 3.0 0 0.0 1 11.1 b)塩酸モザバプタンとの関連性を否定できない有害事象 塩酸モザバプタン プラセボ 器官別大分類 / 基本語 合 計 単回経口 投与試験 反復経口 投与試験 合 計 単回経口 投与試験 反復経口 投与試験 評価対象例数 286 242 44 33 24 9 有害事象発現件数 61 42 19 0 0 0 N % N % N % N % N % N % 有害事象発現例数 46 16.1 33 13.6 13 29.5 0 − 0 − 0 − 胃腸障害 18 6.3 8 3.3 10 22.7 0 0.0 0 0.0 0 0.0 異常便 7 2.4 1 0.4 6 13.6 0 0.0 0 0.0 0 0.0 軟便 10 3.5 5 2.1 5 11.4 0 0.0 0 0.0 0 0.0 悪心 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 水様便 4 1.4 1 0.4 3 6.8 0 0.0 0 0.0 0 0.0 全身障害及び投与局所様態 13 4.5 10 4.1 3 6.8 0 0.0 0 0.0 0 0.0 口渇 13 4.5 10 4.1 3 6.8 0 0.0 0 0.0 0 0.0 臨床検査 21 7.3 19 7.9 2 4.5 0 0.0 0 0.0 0 0.0 アラニン・アミノトランスフェラーゼ増加 4 1.4 2 0.8 2 4.5 0 0.0 0 0.0 0 0.0 アスパラギン酸アミノトランスフェラーゼ増加 2 0.7 2 0.8 0 0.0 0 0.0 0 0.0 0 0.0 血中クレアチンホスホキナーゼ増加 7 2.4 7 2.9 0 0.0 0 0.0 0 0.0 0 0.0 血中乳酸脱水素酵素増加 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 血中尿酸増加 5 1.7 5 2.1 0 0.0 0 0.0 0 0.0 0 0.0 遊離脂肪酸増加 2 0.7 2 0.8 0 0.0 0 0.0 0 0.0 0 0.0塩酸モザバプタン プラセボ 器官別大分類 / 基本語 合 計 単回経口 投与試験 反復経口 投与試験 合 計 単回経口 投与試験 反復経口 投与試験 評価対象例数 286 242 44 33 24 9 有害事象発現件数 61 42 19 0 0 0 N % N % N % N % N % N % 有害事象発現例数 46 16.1 33 13.6 13 29.5 0 − 0 − 0 − 尿中赤血球陽性 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 尿中蛋白陽性 2 0.7 2 0.8 0 0.0 0 0.0 0 0.0 0 0.0 神経系障害 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0 体位性めまい 1 0.3 1 0.4 0 0.0 0 0.0 0 0.0 0 0.0
表 2.7.4-11
用量別の有害事象−単回投与試験−(健康成人)
塩酸モザバプタン 器官別大分類 / 基本語 合計 <申請用量 (15 mg 以下) 申請用量 (30 mg) 申請用量< (60 mg 以上) プラセボ 評価対象例数 242 12 184 46 24 有害事象発現件数 53 7 21 25 18 N % N % N % N % N % 有害事象発現例数 37 15.3 5 41.7 13 7.1 19 41.3 9 37.5 胃腸障害 12 5.0 1 8.3 5 2.7 6 13.0 4 16.7 異常便 2 0.8 0 0.0 1 0.5 1 2.2 0 0.0 軟便 9 3.7 0 0.0 4 2.2 5 10.9 3 12.5 悪心 1 0.4 1 8.3 0 0.0 0 0.0 0 0.0 水様便 1 0.4 0 0.0 1 0.5 0 0.0 1 4.2 全身障害及び投与局所様態 10 4.1 0 0.0 0 0.0 10 21.7 0 0.0 口渇 10 4.1 0 0.0 0 0.0 10 21.7 0 0.0 臨床検査 20 8.3 4 33.3 9 4.9 7 15.2 4 16.7 アラニン・アミノトランスフェラーゼ増加 2 0.8 1 8.3 1 0.5 0 0.0 0 0.0 アスパラギン酸アミノトランスフェラーゼ増加 2 0.8 0 0.0 2 1.1 0 0.0 0 0.0 血中クレアチンホスホキナーゼ増加 7 2.9 3 25.0 0 0.0 4 8.7 2 8.3 血中乳酸脱水素酵素増加 1 0.4 0 0.0 1 0.5 0 0.0 0 0.0 血中尿酸増加 5 2.1 0 0.0 4 2.2 1 2.2 1 4.2 遊離脂肪酸増加 2 0.8 0 0.0 0 0.0 2 4.3 1 4.2 ヘマトクリット減少 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 ヘモグロビン減少 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 赤血球数減少 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 尿中赤血球陽性 1 0.4 0 0.0 0 0.0 1 2.2 0 0.0 尿中ビリルビン増加 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 尿潜血陽性 1 0.4 0 0.0 1 0.5 0 0.0 0 0.0 尿中蛋白陽性 2 0.8 0 0.0 1 0.5 1 2.2 0 0.0 尿中ケトン体陽性 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 神経系障害 1 0.4 1 8.3 0 0.0 0 0.0 0 0.0 体位性めまい 1 0.4 1 8.3 0 0.0 0 0.0 0 0.0 呼吸器,胸郭及び縦隔障害 1 0.4 0 0.0 1 0.5 0 0.0 2 8.3 咳嗽 1 0.4 0 0.0 1 0.5 0 0.0 0 0.0 鼻出血 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 鼻閉 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 咽喉頭疼痛 0 0.0 0 0.0 0 0.0 0 0.0 1 4.2 <申請用量:3mg,15mg,申請用量<:60mg,90mg,100mg,200mg2.7.4 臨床的安全性の概要
141
表 2.7.4-12
用量別の有害事象−反復投与試験−(健康成人)
塩酸モザバプタン 器官別大分類 / 基本語 合計 <申請用量 (15 mg) (30 mg) 申請用量 申請用量< (60 mg) プラセボ 評価対象例数 44 6 32 6 9 有害事象発現件数 27 11 4 12 9 N % N % N % N % N % 有害事象発現例数 14 31.8 5 83.3 3 9.4 6 100 5 55.6 胃腸障害 10 22.7 5 83.3 1 3.1 4 66.7 4 44.4 異常便 6 13.6 4 66.7 0 0.0 2 33.3 0 0.0 軟便 5 11.4 3 50.0 0 0.0 2 33.3 4 44.4 水様便 3 6.8 1 16.7 1 3.1 1 16.7 0 0.0 全身障害及び投与局所様態 3 6.8 0 0.0 0 0.0 3 50.0 0 0.0 口渇 3 6.8 0 0.0 0 0.0 3 50.0 0 0.0 臨床検査 7 15.9 1 16.7 3 9.4 3 50.0 2 22.2 アラニン・アミノトランスフェラーゼ増加 2 4.5 0 0.0 2 6.3 0 0.0 0 0.0 血中クレアチンホスホキナーゼ増加 1 2.3 0 0.0 1 3.1 0 0.0 0 0.0 血中ブドウ糖増加 1 2.3 0 0.0 0 0.0 1 16.7 0 0.0 好酸球数増加 0 0.0 0 0.0 0 0.0 0 0.0 1 11.1 ヘマトクリット減少 1 2.3 1 16.7 0 0.0 0 0.0 0 0.0 ヘモグロビン減少 1 2.3 1 16.7 0 0.0 0 0.0 0 0.0 赤血球数減少 1 2.3 1 16.7 0 0.0 0 0.0 0 0.0 尿中赤血球陽性 0 0.0 0 0.0 0 0.0 0 0.0 1 11.1 尿中ビリルビン増加 2 4.5 0 0.0 0 0.0 2 33.3 0 0.0 尿潜血陽性 1 2.3 0 0.0 0 0.0 1 16.7 1 11.1 呼吸器,胸郭及び縦隔障害 0 0.0 0 0.0 0 0.0 0 0.0 1 11.1 鼻漏 0 0.0 0 0.0 0 0.0 0 0.0 1 11.1また,英国人の健康成人男子を対象とした
14C-標識塩酸モザバプタンを用いた臨床薬理試験
(013873 試験:2.7.2.1.2.1 参照)では,4 例の被験者に 60 mg が投与され,このうち 3 例に 5 件の
有害事象が発現した。発現した事象は,胃痛,咽頭痛,丘疹が各 1 件,頭痛が 2 件(同一症例に
2 回発現)であった。いずれの事象も塩酸モザバプタンとの関連性は否定された。
(2) SIADH を対象とした臨床試験における有害事象の要約
SIADH を対象とした臨床試験における有害事象の器官別大分類を塩酸モザバプタンとの関連性
別に表 2.7.4-13 に示した。
異所性 ADH 症候群では,有害事象は安全性評価対象例 16 例中 11 例(68.8%)に 35 件が発現
した。最も高頻度でみられた事象は,臨床検査 9 例(56.3%)であり,次いで全身障害及び投与局
所様態 5 例(31.3%),心臓障害 2 例(12.5%)の順で,感染症及び寄生虫症,代謝及び栄養障害,
腎及び尿路障害各 1 例(6.3%)であった。
関連性を否定できない有害事象は,安全性評価対象例 16 例中 6 例(37.5%)に 15 件が発現した。
最も高頻度でみられた事象は,全身障害及び投与局所様態 5 例(31.3%)であり,次いで臨床検査
4 例(25.0%)の順で,代謝及び栄養障害,腎及び尿路障害各 1 例(6.3%)であった。
異所性 ADH 症候群以外の SIADH では,有害事象は安全性評価対象例 12 例中 9 例(75.0%)に
25 件が発現した。最も高頻度でみられた事象は,臨床検査 6 例(50.0%)であり,次いで代謝及
び栄養障害 2 例(16.7%)の順で,全身障害及び投与局所様態,肝胆道系障害,神経系障害,皮膚
及び皮下組織障害各 1 例(8.3%)であった。
関連性を否定できない有害事象は,安全性評価対象例 12 例中 5 例(41.7%)に 8 件が発現した。
最も高頻度でみられた事象は,臨床検査 3 例(25.0%)であり,全身障害及び投与局所様態,肝胆
道系障害,皮膚及び皮下組織障害その他は各 1 例(8.3%)であった。
表 2.7.4-13
塩酸モザバプタンとの関連性別の有害事象の器官別大分類(SIADH)
a)塩酸モザバプタンとの関連性を問わない有害事象 SIADH 反復経口投与試験 異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 器官別大分類 合 計 129-C*-001P 129-C*-003P 評価対象症例数 28 16 12 有害事象発現件数 60 35 25 N % N % N % 有害事象発現例数 20 71.4 11 68.8 9 75.0 心臓障害 2 7.1 2 12.5 0 0.0 全身障害及び投与局所様態 6 21.4 5 31.3 1 8.3 肝胆道系障害 1 3.6 0 0.0 1 8.3 感染症及び寄生虫症 1 3.6 1 6.3 0 0.0 臨床検査 15 53.6 9 56.3 6 50.0 代謝及び栄養障害 3 10.7 1 6.3 2 16.7 神経系障害 1 3.6 0 0.0 1 8.3 腎及び尿路障害 1 3.6 1 6.3 0 0.0 皮膚及び皮下組織障害 1 3.6 0 0.0 1 8.3 b)塩酸モザバプタンとの関連性を否定できない有害事象 SIADH 反復経口投与試験 異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 器官別大分類 合 計 129-C*-001P 129-C*-003P 総症例数 28 16 12 有害事象発現件数 23 15 8 N % N % N % 有害事象発現例数 11 39.3 6 37.5 5 41.7 全身障害及び投与局所様態 6 21.4 5 31.3 1 8.3 肝胆道系障害 1 3.6 0 0.0 1 8.3 臨床検査 7 25.0 4 25.0 3 25.0 代謝及び栄養障害 1 3.6 1 6.3 0 0.0 腎及び尿路障害 1 3.6 1 6.3 0 0.0 皮膚及び皮下組織障害 1 3.6 0 0.0 1 8.3SIADH を対象とした臨床試験で発現した有害事象を塩酸モザバプタンとの関連性別に表
2.7.4-14 に示した。
異所性 ADH 症候群で,最も高頻度にみられた有害事象は口渇であり,5 例(31.3%)に発現し
た。次いで,血中カリウム増加,ヘマトクリット減少,ヘモグロビン減少,赤血球数減少の各 2
例(12.5%)であった。
異所性 ADH 症候群で,最も高頻度にみられた関連性を否定できない有害事象は口渇であり 5
例(31.3%)に発現した。次いで,血中カリウム増加の 2 例(12.5%)であった。
異所性 ADH 症候群以外の SIADH で,高頻度にみられた有害事象はアスパラギン酸アミノトラ
ンスフェラーゼ増加,アラニン・アミノトランスフェラーゼ増加,血中ブドウ糖増加,γ-グルタ
2.7.4 臨床的安全性の概要
143
ミルトランスフェラーゼ増加の各 2 例(16.7%)であった。
異所性 ADH 症候群以外の SIADH でみられた関連性を否定できない有害事象は,すべて各 1 例
であった。
有害事象の発現時期について,口渇は異所性 ADH 症候群においてはすべて投与開始初期(1∼3
日目)に発現した。
表 2.7.4-14
SIADH で発現した有害事象(塩酸モザバプタンとの関連性別)
a)塩酸モザバプタンとの関連性を問わない有害事象 SIADH 反復経口投与試験 異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 器官別大分類 / 基本語 合 計 129-C*-001P 129-C*-003P 評価対象症例数 28 16 12 有害事象発現件数 60 35 25 N % N % N % 有害事象発現例数 20 71.4 11 68.8 9 75.0 心臓障害 2 7.1 2 12.5 0 0.0 不整脈 1 3.6 1 6.3 0 0.0 心房細動 1 3.6 1 6.3 0 0.0 全身障害及び投与局所様態 6 21.4 5 31.3 1 8.3 倦怠感 1 3.6 1 6.3 0 0.0 口渇 6 21.4 5 31.3 1 8.3 肝胆道系障害 1 3.6 0 0.0 1 8.3 肝機能異常 1 3.6 0 0.0 1 8.3 感染症及び寄生虫症 1 3.6 1 6.3 0 0.0 単純ヘルペス 1 3.6 1 6.3 0 0.0 臨床検査 15 53.6 9 56.3 6 50.0 アラニン・アミノトランスフェラーゼ増加 3 10.7 1 6.3 2 16.7 アスパラギン酸アミノトランスフェラーゼ増加 3 10.7 1 6.3 2 16.7 血中カルシウム減少 2 7.1 1 6.3 1 8.3 血中塩化物減少 1 3.6 1 6.3 0 0.0 血中コレステロール減少 1 3.6 1 6.3 0 0.0 血中コリンエステラーゼ減少 1 3.6 0 0.0 1 8.3 血中フィブリノゲン増加 1 3.6 1 6.3 0 0.0 血中ブドウ糖増加 2 7.1 0 0.0 2 16.7 血中乳酸脱水素酵素増加 1 3.6 1 6.3 0 0.0 血中カリウム増加 2 7.1 2 12.5 0 0.0 血圧低下 1 3.6 1 6.3 0 0.0 血中ナトリウム減少 1 3.6 1 6.3 0 0.0 血中尿素増加 1 3.6 1 6.3 0 0.0 γ−グルタミルトランスフェラーゼ増加 2 7.1 0 0.0 2 16.7 尿中ブドウ糖陽性 1 3.6 1 6.3 0 0.0 顆粒球数減少 1 3.6 0 0.0 1 8.3 ヘマトクリット減少 2 7.1 2 12.5 0 0.0 ヘモグロビン減少 2 7.1 2 12.5 0 0.0 好中球過分葉核存在 1 3.6 0 0.0 1 8.3 尿pH上昇 1 3.6 0 0.0 1 8.3 総蛋白減少 2 7.1 1 6.3 1 8.3 赤血球数減少 2 7.1 2 12.5 0 0.0 白血球数減少 1 3.6 0 0.0 1 8.3 白血球数増加 1 3.6 1 6.3 0 0.0 尿中白血球陽性 1 3.6 0 0.0 1 8.3 血中リン減少 1 3.6 1 6.3 0 0.0 桿状核好中球数増加 1 3.6 0 0.0 1 8.3 リンパ球百分率減少 1 3.6 0 0.0 1 8.3 尿潜血陽性 2 7.1 1 6.3 1 8.3 血中アルカリホスファターゼ増加 1 3.6 1 6.3 0 0.0 代謝及び栄養障害 3 10.7 1 6.3 2 16.7*:新薬承認情報提供時に置き換えた
SIADH 反復経口投与試験 異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 器官別大分類 / 基本語 合 計 129-C*-001P 129-C*-003P 評価対象症例数 28 16 12 有害事象発現件数 60 35 25 N % N % N % 有害事象発現例数 20 71.4 11 68.8 9 75.0 高コレステロール血症 1 3.6 0 0.0 1 8.3 食欲減退 2 7.1 1 6.3 1 8.3 神経系障害 1 3.6 0 0.0 1 8.3 傾眠 1 3.6 0 0.0 1 8.3 腎及び尿路障害 1 3.6 1 6.3 0 0.0 夜間頻尿 1 3.6 1 6.3 0 0.0 皮膚及び皮下組織障害 1 3.6 0 0.0 1 8.3 口周囲浮腫 1 3.6 0 0.0 1 8.3 b)塩酸モザバプタンとの関連性を否定できない有害事象 SIADH 反復経口投与試験 異所性 ADH 症候群 異所性 ADH 症候群以外の SIADH 器官別大分類 / 基本語 合 計 129-C*-001P 129-C*-003P 評価対象症例数 28 16 12 有害事象発現件数 23 15 8 N % N % N % 有害事象発現例数 11 39.3 6 37.5 5 41.7 全身障害及び投与局所様態 6 21.4 5 31.3 1 8.3 倦怠感 1 3.6 1 6.3 0 0.0 口渇 6 21.4 5 31.3 1 8.3 肝胆道系障害 1 3.6 0 0.0 1 8.3 肝機能異常 1 3.6 0 0.0 1 8.3 臨床検査 7 25.0 4 25.0 3 25.0 アラニン・アミノトランスフェラーゼ増加 2 7.1 1 6.3 1 8.3 アスパラギン酸アミノトランスフェラーゼ増加 2 7.1 1 6.3 1 8.3 血中カルシウム減少 1 3.6 1 6.3 0 0.0 血中コリンエステラーゼ減少 1 3.6 0 0.0 1 8.3 血中乳酸脱水素酵素増加 1 3.6 1 6.3 0 0.0 血中カリウム増加 2 7.1 2 12.5 0 0.0 血中尿素増加 1 3.6 1 6.3 0 0.0 γ−グルタミルトランスフェラーゼ増加 1 3.6 0 0.0 1 8.3 総蛋白減少 1 3.6 0 0.0 1 8.3 代謝及び栄養障害 1 3.6 1 6.3 0 0.0 食欲減退 1 3.6 1 6.3 0 0.0 腎及び尿路障害 1 3.6 1 6.3 0 0.0 夜間頻尿 1 3.6 1 6.3 0 0.0 皮膚及び皮下組織障害 1 3.6 0 0.0 1 8.3 口周囲浮腫 1 3.6 0 0.0 1 8.3