0 5,000 10,000 15,000 20,000 25,000 30,000 35,000 0 2 4 6 8 10 30 25 20 15 10 5 0 35 0 20,000 40,000 60,000 80,000 100,000 120,000 0 2 4 6 8 10 120 100 80 60 40 20 0 0 5,000 10,000 15,000 20,000 25,000 30,000 35,000 0 2 4 6 8 10 30 25 20 15 10 5 0 35 0 5,000 10,000 15,000 20,000 25,000 30,000 35,000 0 2 4 6 8 10 30 25 20 15 10 5 0 35 C ell s ( × 10 ³) mL -1 培養日数 完全培地 トリス海水 N欠培地 P欠培地 図10a. 異なる光条件(通常光●,強光〇)および培地における K. mikimotoi の細胞密度の変 化 0 0.1 0.2 0.3 0.4 0.5 0.6 0 2 4 6 8 10 0 0.1 0.2 0.3 0.4 0.5 0.6 0 2 4 6 8 10 0 0.1 0.2 0.3 0.4 0.5 0.6 0 2 4 6 8 10 0 0.1 0.2 0.3 0.4 0.5 0.6 0 2 4 6 8 10 完全培地 P欠培地 トリス海水 N欠培地 Fv /F m 培養日数 図10b. 異なる光条件(通常光●,強光〇)および培地における K. mikimotoi の光合成活性 (Fv/Fm)の変化
40 50 60 70 80 90 100 0 30 60 90 120 Fv /F m (% ) 照射時間(分) 図11. 異なる培地(完全培地〇, N 欠培地□,P 欠培地△, トリス海水●)で 7 日間培養した K. mikimotoi に強光を照射した時の光合成活性(Fv/Fm)の変化. 培養開始時点の光合成活性(完全培地:0.525, N 欠培地:0.434,P 欠培地:0.460, トリス海 水:0.447)を 100%とした. G ra y va lu e 観察時間(min) 0 0.5 1 1.5 2 0 5 10 15 20 25 30 0 0.5 1 1.5 2 0 5 10 15 20 25 30 100 μmol m-2s-1 1,000 μmol m-2s-1 図12. 異なる培地(完全培地〇, N 欠培地□,P 欠培地△)で 7 日間培養した K. mikimotoi に 異なる光量子束密度の光を照射した時の表層集積度の変化. 培養開始時点の表層集積度を1 とした.
320 km 320 km+V5 360 km 360 km+V5 400 km 400 km+V5 440 km 440 km+V5 600 km 600 km+V5 680 km 680 km+V5 通常光km 通常光km+V5 2 1 3 4 0 細 胞密度 (c ells /m L) 培養日数 103 104 102 101 320 nm 320 nm +ウイルス 360 nm 360 nm +ウイルス 400 nm 400 nm +ウイルス 440 nm 440 nm +ウイルス 600 nm 600 nm +ウイルス 680 nm 680 nm +ウイルス 背景光のみ 背景光のみ+ウイルス 図13. 光条件およびウイルス接種の有無が K. mikimotoi の細胞密度の変化に及ぼす影響
④カレニア等有害赤潮鞭毛藻による魚介類斃死機構の解明と斃死防止技術の開発
ア
. カレニア等有害赤潮鞭毛藻による斃死原因の特定とアッセイ系の構築
水産研究・教育機構 瀬戸内海区水産研究所 外丸裕司,大久保信幸,持田和彦 高知大学 山口晴生 1 全体計画 (1)目的 近年,西日本の海域で有害Karenia 属等鞭毛藻による赤潮が頻発し,養殖魚類を斃死させ るなどの深刻な被害をもたらしている。このような赤潮による漁業被害を未然防止および軽 減するためには,Karenia 属等による魚類へ毒性を評価するとともに,その斃死機構を解明 する必要がある。しかしながら,Karenia 属等鞭毛藻による魚介類の斃死現象を室内で安定 的に再現することは,これまで様々な理由によりきわめて困難であった。そのため,有害赤 潮鞭毛藻による魚類に対する毒性評価法は未だ確立されていない。本課題では,天然赤潮に 依存しないKarenia 属等鞭毛藻の培養細胞を用いた,安定かつ再現性の高い魚類斃死試験法 ならびに魚毒性評価法の確立を目指す。 (2)試験等の方法 1)Karenia 属等の培養株の確立と簡易大量培養法の開発 西日本沿岸を中心に発生する,Karenia 属等の培養株を確立するとともに,それらの増殖 等諸性状に基づいた簡易大量培養手法の開発を行う。その上で選抜無菌株を用いた魚介類 ならびに魚類鰓培養細胞等への曝露試験によって,魚介類斃死能を有する無菌培養株の確 立,ならびにそれを安定かつ大量供給可能なシステムの構築を図る。 2)鰓培養細胞を用いた魚毒性評価手法の開発 マダイ鰓培養細胞等を用い,Karenia 属を含む有害赤潮藻類等の培養株の毒性を評価す る。さらに,マダイ以外の魚種に合わせた鰓細胞培養法の開発に向け,鰓細胞の無菌的調 整法,培養温度,ならびに培養プレートの種類等を検討する。 2 平成28 年度計画及び結果 (1)目的 全体計画と同じ (2)試験等の方法 全体計画と同じ 1)本邦産 Karenia papilionacea 系統の増殖特性と魚毒性高知県浦ノ内湾より分離した Karenia papilionacea KpURN9Y クローン株(原記載種系
統)をDaigo IMK 培地に接種し,水温 15~30°C・塩分 20~30 の範囲で計 12 通りの組み
測定し,各水温・塩分条件における最大クロロフィル収量を算定するとともに,最小二乗 法により最大増殖速度を求めた。
平成25 年度事業で確立した大量培養法により,Karenia papilionacea 新奇系統 KsNOM1H
株の有菌クローン細胞を大量調製した。本細胞を含む培養液(104 cells/mL)ならびに IMK
培地それぞれ6 L を 15 L 容プラスチック製透明水槽に移し,そこに体長 10~13 cm のマア
ジ(Trachurus japonicus)を水槽当たり 5 尾曝露した。その後,供試魚の行動・斃死状況を
観察した。
2)鰓培養細胞を用いた毒性評価法の開発
① Karenia mikimotoi KmURN6Y 株の毒性発現時期を明らかにするため,同じ培養フラス
コから培養5 日目(1.4 × 104 cells/mL),12 日目(5.1 × 104 cells/mL),19 日目(5.1 × 104
cells/mL),26 日目(15.3 × 104 cells/mL),32 日目(20.5 × 104 cells/mL)の赤潮細胞をマ
ダイ鰓培養細胞にそれぞれ曝露し,その毒性を鰓細胞の生残率を指標として比較した。
統計解析は一元配置分散分析を行い,その後,Bonferroni 法による多重比較検定を実施
した。また,データの等分散が仮定できない場合はクラスカル=ウォリス検定を行い,
その後,Steel 法による多重比較検定を実施した。
② 新奇有害赤潮藻 Karenia digitata 培養株の毒性の有無について明らかにするため,
Kdi10(8.0 × 102 cells/mL),Kdi11(6.0 × 102 cells/mL),Kdi mix09-14FKYM(1.1 × 103
cells/mL)の 3 株をマダイ鰓培養細胞にそれぞれ曝露し,その毒性を鰓細胞の生残率を
指標として評価した。また,Kdi mix09-14FKYM 株の毒性発現部位を知る端緒として,
6.3 × 102 cells/mL まで培養した Kdi mix09-14FKYM 株細胞について,そのままの培養液
(6.3 × 102 cells/mL),赤潮細胞をフィルターで除去した培養ろ液,赤潮細胞を遠心分離 にて集藻した後,少量の培養液に再懸濁した細胞濃縮液(2.8 × 103 cells/mL)の 3 種類 の試験培養液を準備し,それぞれマダイ鰓細胞に曝露して,それらの毒性を比較した(統 計解析法は②と同様)。 ③ マダイ鰓培養細胞作製法(大久保ほか 2013)を基本とし,マグロ類のスマ幼魚 5 尾(平 均全長17.6 cm)を用いて鰓培養細胞の作製を検討した。また,マダイ鰓培養細胞作製 法の簡略化,高度化のため,鰓細胞分散時に使う酵素,およびL15 培地中へのコルチゾ ル添加の有効性について検討した。 (3)結果及び考察 1)本邦産 Karenia papilionacea 系統の増殖特性と魚毒性 今回,多くの水温・塩分の条件において,供試藻 KpURN9Y(原記載種系統)の増殖を 認めることができた(図1)。供試藻は,水温 15~30°C・塩分 25~30 の範囲で増殖可能で あり,とりわけ水温25°C・塩分 30 の組み合わせにおいて最も良好に増殖した(最大増殖 速度0.740 divisions/day,図 1A)。最大クロロフィル収量については,やや低い水温 20°C に おいて得られた(図1B)。なお,今回の試験の限りにおいては,塩分 20 における増殖は認 められなかった。 本試験の結果から,K. papilionacea(原記載種系統)は比較的高い水温および塩分環境を 好んで増殖することが示された。これまでの事業成果により,西日本沿岸にはK. mikimotoi のみならず,K. papilionacea 二系統群(原記載種系統と新奇系統)の広域にわたる分布が
認められており,当該系統群が水温20~30°C・塩分 30~34 の範囲で発生する傾向にある (Yamaguchi et al. 2016)。これらに関連することとして,ペルー・チリの沖合においても, おおむね同程度の水温・塩分環境(20.3~30.4°C・塩分 30 以上)にて K. papilionacea の発 生が確認されている(Gómez 2006)。今回得られた K. papilionacea の発生至適水温・塩分域 は,これまでに本藻の発生が認められる水温・塩分範囲内にある。今回の試験結果に基づ くと,おそらくK. papilionacea の発生時期は高水温環境が構築される初夏から初秋であろ う。また,河川水流入に乏しい等により比較的塩分が高い沿岸~沖合域において発生しや すいのではないかと推察される。以上,本研究の成果は,K. papilionacea の発生予測に資 するものとして位置付けられる。 海外のK. papilionacea(原記載種系統)培養株からは,魚類を死に至らしめる神経毒“ブ レベトキシン”が検出されている(Fowler et al. 2015)。このことは,先の事業において K. papilionacea(原記載種系統)培養株が魚類を斃死させた結果と矛盾しない。おそらく K. papilionacea は,高密度で発生した場合,魚を斃死させるのではないかと推察されている。 これまでの大量発生の事例として,養殖業が盛んな高知県浦ノ内湾では,2005 年 8 月,最
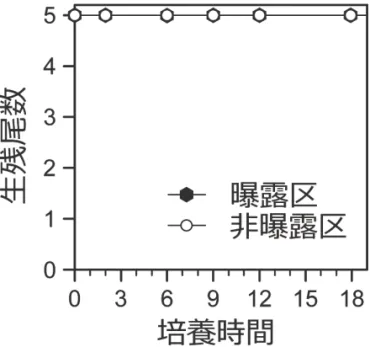
大細胞密度 6.1 × 103 cells/mL の K. papilionacea/K. cf. papilionacea 赤潮が確認されている
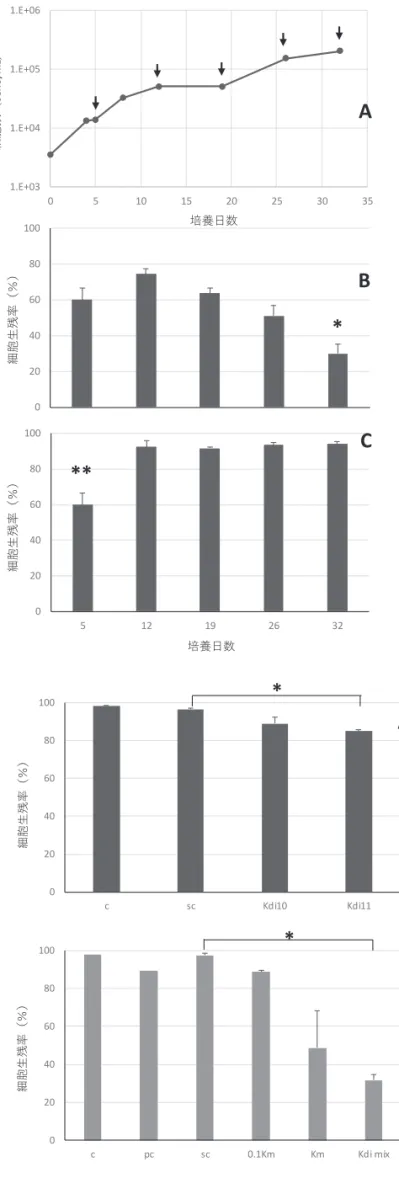
(Yamaguchi et al. 2016)。幸いなことに,この時発生した赤潮は,規模が小さく,養殖場か ら離れて発生していたためか,漁業被害を引き起こしていない。しかし今後,高水温・高 塩分環境という,本研究で明らかにしたK. papilionacea(原記載種系統)の大発生要件が養 殖漁場で満たされれば,本種の大発生に伴い魚類斃死が引き起こされうると考えられよう。 今回明らかにした,本邦産K. papilionacea 原記載種系統の増殖特性・至適環境条件は,本 種の高密度発生時期・環境を高精度に予測する上で,かつ魚類斃死アッセイの材料を効率 よく調製する上で,重要かつ基礎的資料と位置づけられる。 その一方で,今回試験したK. papilionacea 新奇系統株は魚類斃死作用を示さず,曝露開 始から18 時間にわたって試験魚は生残した(図 2)。新奇系統株 KsNOM1H については, 魚類エラ細胞に対する毒性が確認されていることから,今回の試験結果とは整合しないよ うにも見える。ここで考慮すべきは,K. papilionacea 新奇系統株の大量培養にともなう培地 の白濁化であろう。有菌クローン株を用いたためか,大量培養の過程でバクテリア粒子の 大発生(109 cells/mL)が暗視野観察で認められた。それに起因してか,K. papilionacea 新奇 系統細胞のフロック(塊状)も発生していたことから,本来の栄養細胞を適正に調製でき なかった可能性が考えられた。今後は,本系統株の無菌あるいは減菌化を進め,可能な限 りバクテリアフリーに近い材料を構築する必要がある。 2)マダイ鰓由来の培養細胞を用いた毒性評価法の開発 ① KmURN6Y 株の細胞数は培養 12 日目にかけ増加した後,安定し,その後 19-26 日目 にかけてゆるやかに増加した(図3A)。一方,培養液全体の毒性は,培養 19 日目まで は大きな変化が無く,その後,最終盤の26-32 日目に最も強くなる傾向が観察された (図 3B)。同様の傾向は過去のカレニア株の毒性評価でも報告されている(Zou et al. 2010)。なお,細胞数を 1.4 × 104 cells/mL に合わせて培地で希釈して毒性を比較した場 合,その毒性は低下した(図 3C)。培養時期による KmURN6Y 株の細胞当たりの毒性 の差については引き続き検討が必要であるが,培養後期に密度が高くなることで,鰓細 胞が受けるダメージが強くなるものと推察された。
② K. digitata 培養株は 103 cells/mL またはそれ以下の低密度においても毒性が認められ(図
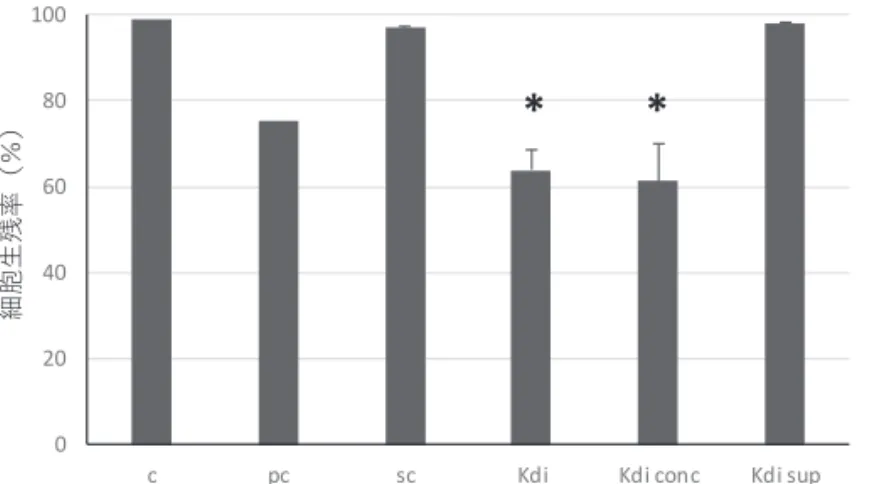
4),特に Kdi mix09-14FKYM 株(1.1 × 103 cells/mL)は K. mikimotoi (KmURN6Y)株
(6.9 × 104 cells/mL)と比較して同程度か,それ以上の毒性が認められた(図 4B)。ま た,Kdi mix09-14FKYM 株細胞をフィルターで除去した培養液のみを曝露した場合,細 胞を含む曝露に比べ毒性は著しく低下した(図5)。このことから,今回用いた K. digitata 培養株の鰓細胞への毒性は,平成26 年度に本事業で報告した K. mikimotoi 株と同様, 培地中に分泌された物質よりも,細胞自体の寄与が大きいことが示唆された。 ③ スマ幼魚 5 尾を用い鰓細胞の培養を試みたところ(図 6),十分量の鰓細胞の単離に成 功したが,細菌の混入があり,培養を断念した。マグロ類の鰓細胞培養の確立について は,小型の個体を複数尾使う等の改良により,十分な細胞数の単離には成功した(表1)。 今後,細菌の混入を完全に防ぐため,より強力な抗生物質の使用や,事前に鰓からの除 菌が必要と思われる。マグロ類の鰓細胞培養はきわめてチャレンジングであるが,その 方法について引き続き試行錯誤をしていく予定である。
なお,ミドリフグの鰓細胞培養(Bui and Kelly 2015)に有効とされた細胞分散時のト
リプシンの使用や L15 培地中へのコルチゾルの添加は,マダイ鰓細胞培養には有効性 は認められなかった。 K. digitata 培養株を供与していただいた瀬戸内海区水産研究所 坂本節子主任研究 員,広島大学 小池一彦教授,スマ幼魚を供与していただいた愛媛大学南予水産研究 センター 松原孝博教授,太田耕平准教授(現九州大学)に感謝いたします。 3)引用文献
Bui P, Kelly SP. Claudins in a primary cultured puffer fish (Tetraodon nigroviridis) gill epithelium model alter in response to acute seawater exposure. Comp. Biochem. Physiol. A, 189, 91–101, 2015.
Fowler N, Tomas C, Baden D, Campbell L, Bourdelais A. Chemical analysis of Karenia papilionacea. Toxicon, 101, 85–91, 2015.
Gómez F. The dinoflagellate genera Brachidinium, Asterodinium, Microceratium and Karenia in the open SE Pacific Ocean. Algae, 21, 445–452, 2006.
大久保信幸,北辻さほ,持田和彦,尾田成幸,長井敏,坂本節子,板倉茂.マダイ鰓の培
養細胞を用いた赤潮プランクトンの毒性評価法の開発.平成25 年度日本水産学会春季
大会講演要旨集(東京海洋大学),217,2013.
Yamaguchi H, Hirano T, Yoshimatsu T, Tanimoto Y, Matsumoto T, Suzuki S, Hayashi Y, Urabe A, Miyamura K, Sakamoto S, Yamaguchi M, Tomaru Y. Occurrence of Karenia papilionacea (Dinophyceae) and its novel sister phylotype in Japanese coastal waters. Harmful Algae, 57, 59– 68, 2016.
Zou YN, Yamasaki Y, Matsuyama Y, Yamaguchi K, Honjo T, Oda T. Possible involvement of hemolytic activity in the contact-dependent lethal effects of the dinoflagellate Karenia mikimotoi on the rotifer Brachionus plicatilis. Harmful Algae, 9, 367–373, 2010.
図1 各水温・塩分における Karenia papilionacea KpURN9Y の増殖。 A:増殖速度(division/day);B:クロロフィル収量(relative
fluorescence)。黒丸プロットは試験した水温・塩分を示す。
図2 Karenia papilionacea 新奇系統 KsNOM1H クローン株の曝露区
図 3 KmURN6Y 株の細胞数の変化 (A),そ の培養液をそのままマダイ鰓細胞に曝露し た際の鰓細胞の生残率(B),各サンプリング 日 の KmURN6Y 株 の 細 胞 数 を 1.4 × 104 cells/mL にそれぞれ希釈し,鰓細胞に曝露し た際の鰓細胞の生残率(C)。 図 A 中の矢印はサンプリング日。図 B 中の *:培養5 日目―19 日目と 32 日目の生残率 との間に有意差あり(p<0.05)。図 C 中の* *:培養5 日目と他の培養日の生残率との間 に有意差あり(p<0.01)。グラフ上のバーは標 準誤差。
図4 Kdi10 株および Kdi11 株(A),Kdi
mix09-14FKYM 株および KmURN6Y 株 (B)をそれぞれ鰓細胞に曝露した際の 鰓細胞の生残率。 c:L15 培地,sc:SWM-3 培地,pc:陽 性対照(凍結KmURN6Y 株),0.1Km: 希釈KmURN6Y 株(8 × 103cells/mL), Km:KmURN6Y 株(6.9 × 104
cells/mL),Kd mix:Kd mix09-14FKYM 株。 *:sc と曝露区の生残率との間に有意 差あり(p<0.05)。グラフ上のバーは標 準誤差。 0 20 40 60 80 100 c sc Kdi10 Kdi11 0 20 40 60 80 100 c pc sc 0.1Km Km Kdi mix 細胞 ⽣残 率( %) 細胞 ⽣残 率( %)
A
B
*
*
0 20 40 60 80 100 5 12 19 26 32 1.E+03 1.E+04 1.E+05 1.E+06 0 5 10 15 20 25 30 35 細 胞 数 ( ce lls/ m L) 培養⽇数 細胞⽣ 残率( %)A
B
*
0 20 40 60 80 100 5 12 19 26 32C
細 胞 ⽣ 残 率 ( % )**
培養⽇数図5 Kdi mix09-14FKYM 株,Kdi mix09-14FKYM 株細胞をフィルターで除去した培養ろ液, Kdi mix09-14FKYM 株濃縮液をそれぞれ鰓細胞に曝露した際の鰓細胞の生残率。
c:L15 培地,sc:SWM-3 培地,pc:陽性対照(凍結 KmURN6Y 株),Kdi:Kd mixFKYM 株, Kdi conc:Kdi mix09-14FKYM 株細胞濃縮液,Kdi sup:Kdi mix09-14FKYM 株細胞除去培養ろ
液。*:sc と曝露区の生残率との間に有意差あり(p<0.05)。グラフ上のバーは標準誤差。 図6 鰓細胞培養に用いたスマ幼魚。 魚を収容した発泡スチロール箱は縦33cm x 横 40cm。 表1 これまで瀬戸内水研で鰓細胞培養を実施した海産魚。 魚種 サイズ(年齢) 細胞単離 細胞増殖 継代培養 赤潮曝露試験 マダイ 30-180g(0+) 0.8-0.9kg(1.5-2+) ○ ○ ○ △ ○ △(1 例) ○ ○ ブリ 35g(0+,1 例) ○ ○ ○(3 代まで) △ ホシガレイ 70-100g(0+) ○ ○ × - スマ 18g, 0.5-0.8kg(0+) ○ × - - クロマグロ 44kg(3+,1 例) △ × - - 〇:成功,△:細胞数または例数少,×:失敗,-:未実施 0 20 40 60 80 100
c pc sc Kdi Kdi conc Kdi sup
細
胞⽣残
率(%