Critical Factors of Vanillin Assay for catechins and Proanthocyanidins
カテキンとプロアントシアニジンに対するバニリン試験の決定因子
著者:
Baoshan Sun, Jorge M. Ricardo-da-Silva, and Isabel Spranger
雑誌:
J. Agric. Food Chem.
1998, 46, 4267-4274
紹介者: 秋元
美桜 (M2)
紹介日:
2012.5.25
1
I n t r o d u c t i o n
2
R1 = H or OH R2 = H or G C OH OH OH O G: Galloylプロアントシアニジン(PA)
► 自然界に広く存在する天然高分子 ► 構成ユニットはflavan-3-ol(カテキン類) ► 植物由来食品で、栄養や感覚刺激特性に関して重要な役割を担う ► 様々な生理活性を有する(抗動脈硬化作用、抗酸化作用) O HO OH OR2 OH OH R1 O HO OH OR2 OH OH R1 O HO OH OR2 OH OH R1 Flavan-3-ol subunit n A C B 8 4 1 2 3 5 7 6 5’ 4’ 3’ 8 4PA含有量の評価
►Folin-Ciocalteu法
►塩酸-BuOH分解
►バニリン試験
O OH HO OH OH OH O OH HO OH OH OH(+)-Catechin [(+)-C] (−)-Epicatechin [(−)-EC]
カテキン類 (flavan-3-ol)
A C
3
PA含有量の評価法
►Folin-Ciocalteu法
►塩酸-BuOH分解
• フェノール性OH基の還元力に基づく試験法 • 特異性が低い • それぞれのOH基は感度が異なる • 熱酸溶液中で、PAをアントシアニジン(λmax ≈550 nm)へ分解 • PAに非常に特異的 • 完全に分解せず、収率はPAの重合度と構造の影響を受ける • 副反応としてポリマー (λmax ≈450 nm)の生成が起こる Folin-Ciocalteu試薬 3H2O・P2O5・13WO3・5MoO3・10H2O 3H2O・P2O5・14WO3・4MoO3・10H2O フェノール 性化合物 λmax ≈750 nm e- Basic condition 有色化合物 HCl / butanol Fe3+ O HO OH OR2 OH OH R1 O HO OH OR2 OH OH R1 O HO OH OR2 OH OH R1 O HO OH OR2 OH OH R1 heat R1 = H or OH R2 = H or galloyl+
I n t r o d u c t i o n
アントシアニジン λmax ≈550 nm4
►バニリン試験
• 感度、特異性、簡便さの点で優れている • 再現性の欠如が示唆されている O OH O H O HO OH OH OH OH O HO OH OH OH OH O O Catechin Vanillin Vanillin adduct λmax≈ 500 nm H++
Flavanol(モノマーおよび多量体)、 meta-配向のヒドロキシ基を持つdihydrochalconeI n t r o d u c t i o n
• 芳香族アルデヒド・バニリンとの反応により有色化合物(λmax ≈500 nm)を得る meta-配向 ジフェノール反応に影響するファクター
正確性と再現性について確かめる適切な反応条件を提案
研究目的
(Hagerman, 2002)E x p e r i m e n t a l
5
UV-Vis
analysis
O OH O H O HO OH OH OH OH O HO OH OH OH OH O OCatechin Vanillin Vanillin adduct λ
max≈ 500 nm H+
+
O OH HO OH OH OH O OH HO OH OH OH ① (+)-Catechin [(+)-C] ② (−)-Epicatechin [(−)-EC]カテキン類
PA
③ PAオリゴマー ④ PAポリマー 重合度: 2 ~ 12-15 重合度: >12-15 Grape seedより抽出■試料または標準物質 (120 mg/L、MeOH溶液 )
■試薬 a: バニリン / MeOH
■試薬 b: HCl or H
2SO
4/ MeOH
試料溶液
1 mL
試薬 a
2.5 mL
試薬 b
2.5 mL
+
+
• バニリン濃度 • 酸の種類と濃度 • 反応温度 • 反応時間 • 含水量 • 妨害物質 MeOH FACTORS 1 %(w/v) (0.5 – 2.0 % (w/v)) 9.0 N (1.8 – 9.0 N) 5-35 ºC 0-30 分 120 mg/LR e s u l t s a n d D i s c u s s i o n
6
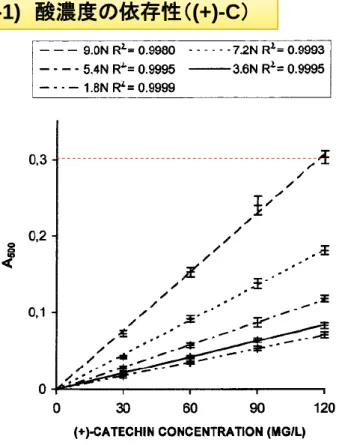
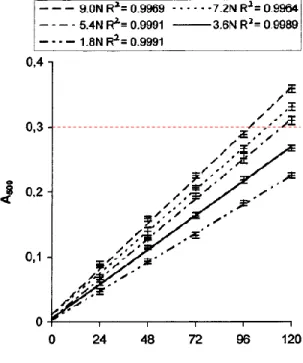
Figure 1. Standard curves of (+)-catechin for vanillin assay established at various HCl concentrations. Each point is a mean of three replicate measurements ± SD.
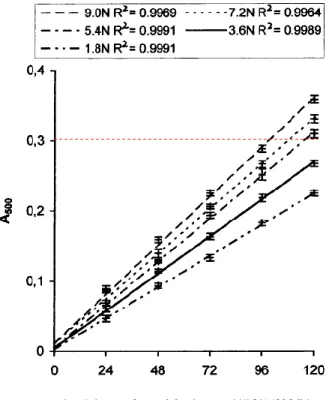
Figure 2. Standard curves of (+)-catechin for vanillin assay established at various H2SO4 concentrations.
Each point is a mean of three replicate measurements ± SD.
1-1) 酸濃度の依存性((+)-C)
酸
・・・触媒的な働き
• 良い線形性 (R2 > 0.998) • 酸の規定度が増加するにしたがい、A500が増加 • A500(HCl) << A500(H2SO4) 目的としている反応の進行 バニリンの自己反応 PAの分解 酸濃度は高いほど応答は良いが 極端に高濃度は避けるべきであるR e s u l t s a n d D i s c u s s i o n
7
1-2) 酸濃度の依存性(PA)
• Rvan/cat と比べ、酸濃度による影響は小さい(直線の傾き変化)
• Rvan/cat と比べ、酸の種類による影響は小さい(Fig.3, 4の吸光度変化) • A500(HCl) < A500(H2SO4)
Figure 3. Standard curves of purified oligomeric PA for vanillin assay established at various HCl concentrations. Each point is a mean of three replicate measurements ±SD.
Figure 4. Standard curves of purified oligomeric PA for vanillin assay established at various H2SO4
concentrations. Each point is a mean of three replicate measurements ±SD.
8
2) 反応時間
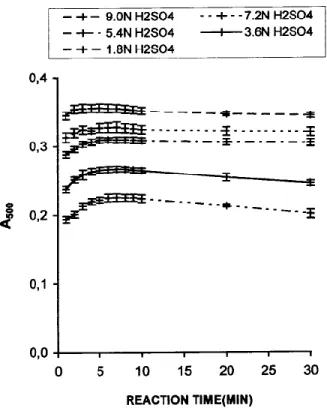
反応時間: A500が極大値をとる時間 反応時間: 15–25分
酸濃度: 高いほど良い Figure 5. Effect of reaction time on A500 of vanillin
reaction with (+)-catechin. (+)-Catechin concentration = 120 mg/L. Each point is a mean of three replicate measurements ±SD.
Figure 6. Effect of reaction time on A500 of vanillin
reaction with purified oligomeric PA. Purified oligomeric PA concentration = 120 mg/L. Each point is a mean of three replicate measurements ±SD.
• 極大値が見られる(反応は遅く、退色もしやすい) • 酸濃度: 高いほど値が安定
• 反応は速く、A500は反応時間に因らずほぼ安定
R e s u l t s a n d D i s c u s s i o n
9
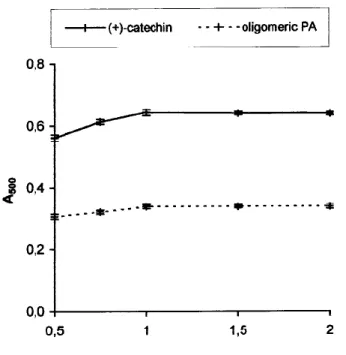
3) 反応温度
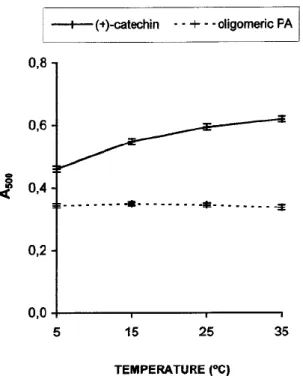
Figure 7. Effect of reaction temperature on A500 of
vanillin reaction with (+)-catechin and purified oligomeric PA. Concentrations: (+)-catechin = 120 mg/L; purified oligomeric PA = 120 mg/L. Each point is a mean of three replicate measurements ±SD. 反応温度: 25–35 ºCに固定 • A500は温度に依存する
(+)-C
PA
• 温度に依存しない • 反応溶液をさらに異なる温度で10minインキュベーションしたとき、 A500が異なる値を与え、温度とA500の関係はFig. 7と一致 反応は5-35 ºCの範囲で可逆的 反応温度: R.T.(Dalby and Shuman, 1978)
R e s u l t s a n d D i s c u s s i o n
10
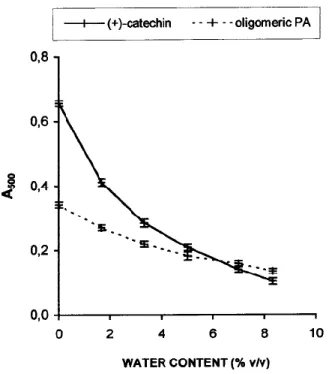
4) 水分
Figure 8. Effect of water content in reaction medium on
A500 of vanillin reaction with (+)-catechin and purified
oligomeric PA. Concentrations: (+)-catechin =120 mg/L; purified oligomeric PA = 120 mg/L. Each point is a mean of three replicate measurements ±SD.
溶媒: 無水メタノール ⇒ 3%(v/v)水 • 水分量の増加に伴い、A500が著しく減少 H2SO4とHClが同じ規定度の場合、
A
500(H
2SO
4) > A
500(HCl)
(+)-C: 56–59%減少 PA: 33–38%減少Levasseurの理論
(Cabannes, 1953) 有機溶媒中の実質的なpHは、溶液中の水の量に強く依存 H2SO4(市販) 純度 96–98% ⇒水 2-4% HCl(市販) 純度 35–37% ⇒水 63–65% 大量の水を含む しかしながら、 カテキンとPAで影響が異なることは説明できない… 低い吸光度の原因R e s u l t s a n d D i s c u s s i o n
11
5) バニリン濃度
Figure 9. Effect of vanillin concentration in reagent a
on A500 of vanillin reaction with (+)-catechin and purified oligomeric PA. Concentrations: (+)-catechin = 120 mg/L; purified oligomeric PA = 120 mg/L. Each point is a mean of three replicate measurements ±SD.
反応を完全に進行させるためにバニリンは試料に対して過剰量が必要 カテキン溶液 (120 mg/L, 1.0 mL) 試薬 a (1 %(w/v), 2.5mL) mM mL mL mol g L g 4 . 27 0 . 6 5 . 2 / 15 . 152 / 10 mM mL mL mol g L mg 0689 . 0 0 . 6 0 . 1 / 27 . 290 / 120 397倍 > 1 %(w/v)で、それ以上増加しない 1-1.2 %(w/v)が推奨される
高濃度で、自己縮合反応の可能性 (Broadhurst and Jones, 1978)
R e s u l t s a n d D i s c u s s i o n
12
Figure 2. Standard curves of (+)-catechin for vanillin assay established at various H2SO4 concentrations. Each point is a mean of three replicate measurements ± SD.
Figure 4. Standard curves of purified oligomeric PA for vanillin assay established at various H2SO4 concentrations. Each point is a mean of three replicate measurements ±SD.
6) 標準化合物
カテキンとPAではバニリンとの反応性が異なる
サンプル試験
R e s u l t s a n d D i s c u s s i o n
13
それぞれの検量線を用いて計算したPA濃度 (PAオリゴマー換算濃度、カテキン換算濃度) Grape seedのメタノール抽出物 から あらかじめカテキン類を除去したサンプル2種 (PAオリゴマーを豊富に含む)6) 標準化合物
14
]) ][ ([ 500 f C H A 015 . 0 ] [ ] [ 02 . 0 500 C H A cat ) 20 , 989 . 0 (R2 n 014 . 0 ) 2625 . 0 ] ([ ] [ 00575 . 0 500 C H A pro ) 20 , 995 . 0 (R2 n ] [ 02 . 0 ] [ 500 C H d A d ] [ 00575 . 0 ] [ 500 C H d A d 48 . 3 ] [ ] [ 500 500 d H A d H d A d 014 . 0 ) 2625 . 0 * ] ([ ] [ 00575 . 0 015 . 0 * ] [ ] [ 020 . 0 500 500 H C H C A d A d pro cat ) 2625 . 0 * ] ([ 00575 . 0 * ] [ 02 . 0 1 H H % 6 . 10 106 . 0 ]* [H 500 500 , ] [ ] [C cat C pro A A 吸光度A500は試料濃度[C]および酸濃度[H+]に依存しているので、 [C] :試料濃度 (mg/L) [H+] : 試薬b中の硫酸濃度 (5-25 %(v/v), 1.8-9.0 N) カテキン: PA: カテキンとPAが同じ濃度とき、すなわち 式(4)、(5)よりR e s u l t s a n d D i s c u s s i o n
(1) (2) (3) ] [ ] [ ] [C cat C pro C のとき、酸濃度依存性は カテキン: PA: (4) (5) ・・・ カテキンの反応はPAの反応の3.5倍、 酸濃度の影響を受けやすい 一方、同じ濃度のカテキンとPAオリゴマーが 同じA500を与える酸濃度 [H+]* を計算すると、 より硫酸濃度を10.6%(ca. 3.6 N)に設定すると
カテキンとPAを同等に扱うことが出来る
(7) (9) (6) (8) あらかじめサンプル中のカテキン類とPAを分離し別々に 高濃度のH2SO4を用いて定量することがしばしば必要になる その一方で、呈色の安定性と感度の観点より、 (Price et al., 1978)(Scalbert et al., 1989, Scalbert., 1992)
PA含有量を過大に見積もる; ≅ 3.3%(v/v) HCl
PA含有量を小さく見積もる; ≅ 46.7%(v/v) H2SO4
2つの矛盾する主張はA500の酸濃度の依存性によって説明できる
15
R e s u l t s a n d D i s c u s s i o n
7) 妨害物質
■ アントシアニジン (490-540 nmに吸収)
■ フェノール酸
ケイ皮酸 p-ヒドロキシ安息香酸 カフェ酸 没食子酸 p-クマル酸 シリング酸 OH O OH HO O OH O HO OH O HO HO OH HO O HO OH OH HO O O O O OH HO OH OH OH O O OH HO OH OH O O OH HO OH OH O OH OH ケルセチン ケンペロール ミリセチン■ 非フラバノール
⇒ バニリンとは反応しない 反応の妨害もしない 酸化力の強いH2SO4と反応していると考えられる ⇒ 反応を妨害 - 2H 非常に酸化を受けやすい■ アスコルビン酸、アスコルビン酸塩
⇒ バニリンとは反応しないが、吸収帯が重なる 適切なブランクを用いることで対処可能 O HO OH OH OH OH16
C o n c l u s i o n
バニリン試験
(1) 試料中のPAからカテキンの分離し、それぞれに対し定量を行う (2) 溶媒には無水メタノールを用いる (3) H2SO4濃度を 7.2-9.0 Nにし、その濃度を厳重にコントロールする (4) 検量線の作成に、試料と同種のPAを標準品に用いる (5) 妨害物質を除去し、適切なブランクを使用する (6) カテキン量の推定において、反応温度を制御し、反応時間は15分に固定する PA量の推定では反応は室温で行い、A500が最大となる時間を反応時間とする18
O HO OH OH OH OH O HO OH OH OH OH A C B A C B O HO OH OH OH OH O OH HO OH OH HO A C B O HO OH OH OH OH O O OH HO HO HO A C B (4→8) (4→6) (2→7, 4→8)B-type proanthocyanidin
A-type proanthocyanidin
Hypothetical reaction mechanism
explaining the acid-catalyzed cleavage of proanthocyanidins
Structure of dimeric proanthocyanidins
Anthocyanidin O HO OH OH OH OH O O OH OH OH OH H H+ O HO OH OH OH OH O O OH OH OH OH H H+ O HO OH OH OH OH O HO OH OH OH OH O HO OH OH OH OH H+ oxidation
+
Catechin dimer (Proanthocyanidin) Catechin19
O O HO OH HO OH OH OH OH OH OH OH O OH O H+
O HO OH OH OH OH O HO OH OH OH OH O O O HO OH OH OH OH H+ H+ O HO OH OH OH OH OxidationHypothetical reaction mechanism
explaining the reaction of vanillin with (+)-catechin
O OH HO OH OH OH O O O OH HO OH OH OH OH O O H+ O OH HO OH OH OH OH O H HO O OH HO OH OH OH OH O HO H+ -H2O H+ O O HO OH HO OH OH OH OH OH OH OH O O O O
20
Charge distribution of (+)-catechin
DFT B3LYP Mulliken