◎効能・効果,用法・用量,使用上の注意(案)
◎効能・効果,用法・用量,使用上の注意(案)
◎効能・効果,用法・用量,使用上の注意(案)
◎効能・効果,用法・用量,使用上の注意(案)
およびその設定根拠
およびその設定根拠
およびその設定根拠
およびその設定根拠
頁
1. 効能・効果およびその設定根拠 ... 807
1.1 効能・効果 ... 807
1.2 効能・効果の設定根拠 ... 807
2. 用法・用量およびその設定根拠 ... 808
2.1 用法・用量 ... 808
2.2 用法の設定根拠... 808
2.3 用量の設定根拠... 808
2.3.1 臨床推奨用量について ... 808
2.3.2 増量について... 813
2.3.3 減量について... 818
3. 使用上の注意(案)およびその設定根拠... 819
1. 効能・効果およびその設定根拠
1.1 効能・効果
2 型糖尿病における食後血糖推移の改善(ただし,食事療法・運動療法を行っている患者で
十分な効果が得られない場合に限る)
1.2 効能・効果の設定根拠
本薬は
SU 剤と同様に,膵β細胞の SU 受容体へ結合し,K
ATPチャネル電流阻害作用によりイ
ンスリン分泌を促進するが,
SU 剤と異なり本薬のインスリン分泌促進作用は速効性であり,
投与後
15 分という短時間で分泌促進が認められた。これにより,2 型糖尿病患者にみられる
食後早期のインスリン分泌の欠如を是正し,健康人の生理的なインスリン分泌パターンに近づ
けることが可能である。また,同時に本薬は短時間作用型であり,投与後
3 時間以内にはイン
スリン分泌促進作用は消失したことから,食後の血糖が高い時間帯のみに作用し,低血糖症状
発現のリスクが低いと考えられる。
2 型糖尿病治療の基本は食事療法および運動療法であるが,それでも十分な血糖コントロー
ルが得られない場合に薬物療法が行われる。本薬の薬理学的類似薬としてナテグリニドがある
が,本薬の第
III 相検証試験立案当時はナテグリニドの臨床的位置付けがまだ浸透しておらず,
本邦ではα-グルコシダーゼ阻害剤であるボグリボースが軽症の 2 型糖尿病治療薬のファースト
ラインに位置付けられ,食後過血糖改善剤として汎用されていた状況であった。このことから,
本薬の第
III 相検証試験は,食事療法で十分な血糖コントロールが得られない 2 型糖尿病患者
を対象とし,ボグリボースを対照薬に設定し,
KAD-1229 1 回 10 mg(30 mg/日),ボグリボー
ス
1 回 0.2 mg(0.6 mg/日)またはプラセボを 1 日 3 回毎食直前に 12 週間経口投与する二重盲
検並行群間比較試験として実施された。その結果,主要評価項目である最終評価時
HbA
1C変化
量(平均値±S.D., 以下同様)は,KAD-1229 群,ボグリボース群およびプラセボ群で,それぞ
れ-
0.44±0.75, -0.11±0.64 および+0.21±0.66%であり,本薬はプラセボおよびボグリボースに
比較して
HbA
1Cの有意な低下を示した。また,食後血糖
1 時間値変化量は,それぞれ
-
53.1±43.0, -24.8±36.0 および+7.1±41.4 mg/dL,食後血糖 2 時間値変化量は,それぞれ
-
50.1±43.5, -5.1±38.1 および+9.9±45.1 mg/dL であり,いずれにおいても,本薬はプラセボ
およびボグリボースに比較して有意な低下を示した。さらに
FPG 変化量は,それぞれ-
8.0±28.0, +0.5±28.4 および+7.1±28.6 mg/dL であり,同様に本薬はプラセボおよびボグリボー
スに比較して有意な低下を示した。一方,安全性の面ではインスリン分泌促進薬で一般に問題
となる低血糖症状の発現率は
KAD-1229 群,ボグリボース群およびプラセボ群で,それぞれ
2.0, 5.5 および 2.9%であり,本薬の低血糖症状発現率はプラセボおよびボグリボースと差はな
く,本薬の低血糖症状発現リスクは低いと考えられた。その他の安全性評価項目においても特
に危惧すべき副作用は認められなかった。
以上のように,食事療法で十分な血糖コントロールが得られない
2 型糖尿病患者において,
本邦の
2 型糖尿病治療薬のファーストラインであるボグリボースを対照薬とした第 III 相検証
試験の結果,本薬の臨床的有用性が確認された。効能・効果の表現については薬理作用を考慮
した上で決定されることから,ナテグリニドの効能・効果の表現を参考に,本薬の効能・効果
を前記のように設定した。
2. 用法・用量およびその設定根拠
2.1 用法・用量
通常,成人にはミチグリニドカルシウム水和物として1回
10 mg を 1 日 3 回毎食直前に経口
投与する。なお,症状により適宜増減する。
2.2 用法の設定根拠
本薬の第
I 相臨床試験において,食直前および食後経口投与の比較検討が行われた。その結
果,食直前投与では,食事摂取開始
15 分後の血糖上昇が抑制されたのに対して,食後投与で
は本薬の薬物動態に吸収遅延が認められ,食後の急峻な血糖上昇が抑制されなかったことから,
本薬の用法は食直前投与が適切であると考えられた。また,食事開始前における本薬の投与タ
イミングを検討した臨床薬理試験より,食事開始
10 分前から食事開始直前(食前 0 分)まで
の投与では,本薬の薬物動態および食後血糖抑制効果に大きな差はなかったが,食事開始
30
分前の投与では食事を開始する前に本薬の効果が発現してしまい,食前における低血糖症状発
現のリスクが高まると考えられた。一方,本薬のインスリン分泌促進は短時間作用型であり,
投与後
3 時間以内には消失することから,有効に使用するためには毎食ごとに投与する必要が
あると考えられ,臨床試験においては
1 日 3 回毎食直前投与で有効性が確認された。
以上より,本薬の用法は「1 日 3 回毎食直前に経口投与する」が妥当であると判断した。
2.3 用量の設定根拠
2.3.1 臨床推奨用量について
NIDDM 患者を対象として,KAD-1229 1 回 2.5, 5 または 10 mg を 12 週間投与し,臨床推奨
用量の探索を行った結果(後期第
II 相試験(1)),主要評価項目である食後血糖 2 時間値の変化
量に有意な用量反応性は認められなかったが,変化量は最高用量の
10 mg 群が最大の低下を示
した(図 1)。なお,HbA
1Cと血中インスリン値の変化量には有意な用量反応性が確認された。
一方,安全性に関しては
3 群間に差は認められなかった。
この結果より,本薬の臨床推奨用量を「1 回 10 mg ないしはそれ以上」と推定し,1 回 10
mg を超える用量での臨床効果を検討するために,2 型糖尿病患者を対象として,プラセボ,
KAD-1229 10, 20 および 40 mg 単回投与を用いた二重盲検クロスオーバー法による用量反応性
の検討を行った(後期第
II 相試験(2))。その結果,いずれの KAD-1229 投与群でもプラセボ群
と比較して食後血糖値の低下が認められ(図 2),主要評価項目である食後血糖値 AUC
0-3hrの
改善効果および食後
30 分までの早期のインスリン追加分泌促進は 10 mg でプラトーに達して
いた。
以上より,食後血糖値を主要評価項目とした場合,本薬の臨床推奨用量は
10 mg が妥当と判
断された。しかしながら,1 回 10 mg を超える用量の HbA
1Cに対する効果は不明であったこと
から,1 回 10 mg を超える用量の HbA
1C改善効果を確認して用量設定を行う必要があると判断
し,2 型糖尿病患者を対象として,KAD-1229 1 回 5, 10, 20 mg またはプラセボを 12 週間投与
する,HbA
1Cの変化量を主要評価項目とした二重盲検並行群間比較試験(後期第
II 相試験
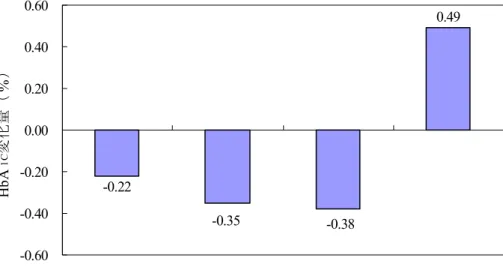
(3))を行った。その結果,最終評価時の HbA
1Cの変化量は,プラセボ群,KAD-1229 5, 10 お
よび
20 mg 群で,それぞれ+0.49±1.41, -0.22±0.96, -0.35±1.03 および-0.38±1.00%であ
り,プラセボに比較して
5 mg 以上の用量で有意に低下した(図 3)。また,HbA
1Cが投与前値
から
0.5%以上低下した症例の割合(HbA
1C改善率)は,それぞれ
20.0, 38.6, 55.6 および 53.5%
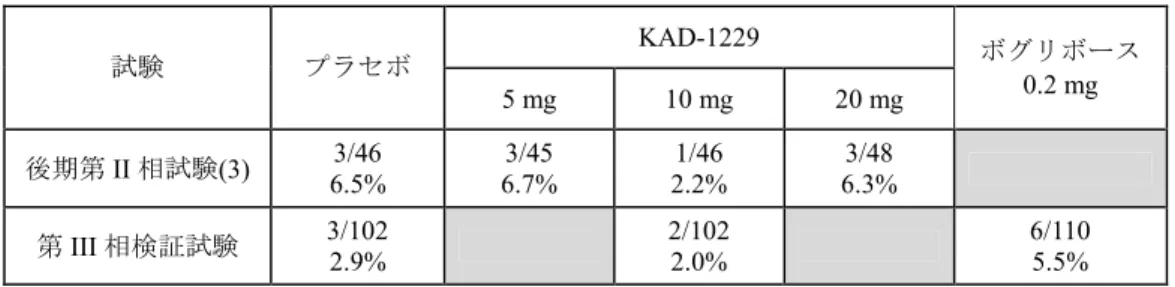
であり,プラセボ群に比較して,10 mg 以上の用量で有意に高かった(図 4)。一方,安全性
においてインスリン分泌促進薬で一般に問題となる低血糖症状の発現率は,プラセボ群,
KAD-1229 5, 10 および 20 mg 群で,それぞれ 6.5, 6.7, 2.2 および 6.3%であり,KAD-1229 のい
ずれの投与群もプラセボ群と有意差は認められなかった(表 1)。その他の副作用の発現率も,
KAD-1229 投与群とプラセボ群では有意差は認められなかった。以上の結果より,本薬の臨床
推奨用量は
1 回 10 mg が妥当と判断され,この用量を用いて第 III 相検証試験を行うこととし
た。
第
III 相検証試験は,食事療法で十分な血糖コントロールが得られない 2 型糖尿病患者を対
象に,本薬のファーストラインとしての臨床的な位置付けを検証することを目的として,ボグ
リボースを対照薬に設定し,KAD-1229 1 回 10 mg, ボグリボース 1 回 0.2 mg またはプラセボ
を
12 週間投与し,HbA
1Cの変化量を主要評価項目とした二重盲検並行群間比較試験を行った。
その結果,最終評価時の
HbA
1Cの変化量は,KAD-1229 群,ボグリボース群およびプラセボ群
で,それぞれ-0.44±0.75, -0.11±0.64 および+0.21±0.66%であり,KAD-1229 群はプラセボ
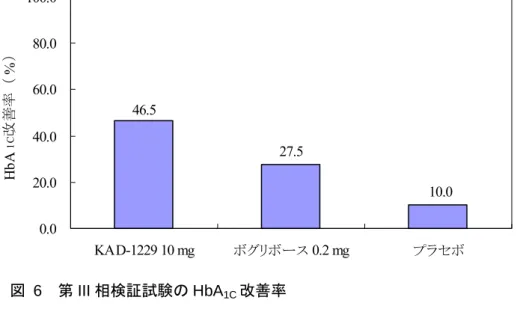
群およびボグリボース群のいずれとの比較においても有意な低下を示した(図 5)。また,
HbA
1Cが投与前値から
0.5%以上低下した症例の割合(HbA
1C改善率)は,それぞれ
46.5, 27.5
および
10.0%であり,KAD-1229 群はプラセボ群およびボグリボース群のいずれとの比較にお
いても有意な低下を示した(図 6)。さらに,KAD-1229 群,ボグリボース群およびプラセボ
群の食後血糖
1 時間値の変化量は,それぞれ-53.1±43.0, -24.8±36.0 および+7.1±41.4 mg/dL
(図 7),食後血糖 2 時間値の変化量はそれぞれ-50.1±43.5, -5.1±38.1 および+9.9±45.1 mg/dL
(図 7),FPG の変化量はそれぞれ-8.0±28.0, +0.5±28.4 および+7.1±28.6 mg/dL(図 8)であ
り,いずれの血糖コントロール指標においても,KAD-1229 群はプラセボ群およびボグリボー
ス群に比較して有意な低下を示した。一方,安全性ではインスリン分泌促進薬で一般に問題と
なる低血糖症状の発現率は
KAD-1229 群,ボグリボース群およびプラセボ群で,それぞれ 2.0,
5.5 および 2.9%であり,KAD-1229 群の低血糖症状発現率はプラセボ群およびボグリボース群
と同程度に低かった(表 1)。以上のように,第 III 相検証試験において本薬 1 回 10 mg は臨床
推奨用量として適切であり,本薬はボグリボースより優れることが確認された。
これらの後期第
II 相試験および第 III 相検証試験における HbA
1C改善効果および食後血糖改
善効果等の成績から,本薬の臨床推奨用量は,1 回 10 mg と設定することは妥当と判断された。
図 1 後期第 II 相試験(1)の食後血糖 2 時間値変化量
図 2 後期第 II 相試験(2)の食後血糖 AUC
0-3hr食後血糖値の変化量
(mg/dL)
2.5 mg群 5 mg群 10 mg群
t検定(片側)
用量反応性(回帰分析)
:
p=0.1022
39059
37784
39093
44039
34000
36000
38000
40000
42000
44000
46000
KAD-1229 10 mg KAD-1229 20 mg KAD-1229 40 mg
プラセボ
食後血糖
AU
C
0-3hr(
mg
・m
in/
dL
)
図 3 後期第 II 相試験(3)の HbA
1C変化量
図 4 後期第 II 相試験(3)の HbA
1C改善率
図 5 第 III 相検証試験の HbA
1C変化量
0.49
-0.22
-0.38
-0.35
-0.60
-0.40
-0.20
0.00
0.20
0.40
0.60
KAD-1229 5 mg KAD-1229 10 mg KAD-1229 20 mg
プラセボ
Hb
A
1C変
化量(
%
)
20.0
55.6
53.5
38.6
0.0
20.0
40.0
60.0
80.0
100.0
KAD-1229 5 mg KAD-1229 10 mg KAD-1229 20 mg
プラセボ
Hb
A
1C改善
率
(
%
)
-0.11
0.21
-0.44
-0.60
-0.40
-0.20
0.00
0.20
0.40
KAD-1229 10 mg
ボグリボース 0.2 mg
プラセボ
Hb
A
1C変化量
(
%
)
図 6 第 III 相検証試験の HbA
1C改善率
図 7 第 III 相検証試験の食後血糖 1 時間値および 2 時間値変化量
図 8 第 III 相検証試験の FPG 変化量
46.5
10.0
27.5
0.0
20.0
40.0
60.0
80.0
100.0
KAD-1229 10 mg
ボグリボース 0.2 mg
プラセボ
Hb
A
1C改善
率
(
%
)
-50.1
9.9
-24.8
7.1
-53.1
-5.1
-60.0
-50.0
-40.0
-30.0
-20.0
-10.0
0.0
10.0
20.0
KAD-1229 10 mg
ボグリボース 0.2 mg
プラセボ
食後血糖
値変化量
(
mg
/d
L
)
1時間値
2時間値
-8.0
7.1
0.5
-10.0
-5.0
0.0
5.0
10.0
KAD-1229 10 mg
ボグリボース 0.2 mg
プラセボ
FP
G
変化量
(
mg
/d
L
)
表 1 プラセボ対照二重盲検並行群間比較試験における低血糖症状の発現率
KAD-1229
試験
プラセボ
5 mg
10 mg
20 mg
ボグリボース
0.2 mg
後期第
II 相試験(3)
6.5%
3/46
6.7%
3/45
2.2%
1/46
6.3%
3/48
第
III 相検証試験
3/102
2.9%
2/102
2.0%
6/110
5.5%
上段:低血糖症状発現例数/全症例数
下段:低血糖症状発現率
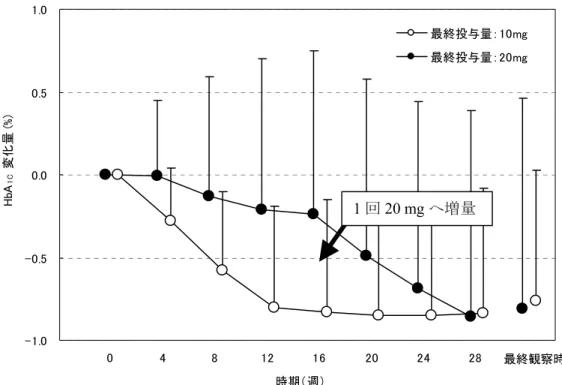
2.3.2 増量について
一般に,SU 剤に代表されるインスリン分泌促進剤は,低用量から投与開始し,患者の病態,
すなわち重症度に応じて,適切な投与量が選択されることが多い。
「薬物治療歴あり」の患者は,薬物未治療例に対して糖尿病の重症度は比較的高く,一部の
患者では膵β細胞の機能低下も進んでいるとも考えられる。
先に示したように,総合的に考えて本薬の臨床推奨用量は
1 回 10 mg ではあるが,以下の成
績より,本薬
1 回 10 mg 投与で十分な血糖コントロールが得られない患者では,1 回 20 mg へ
の増量は妥当と判断された。
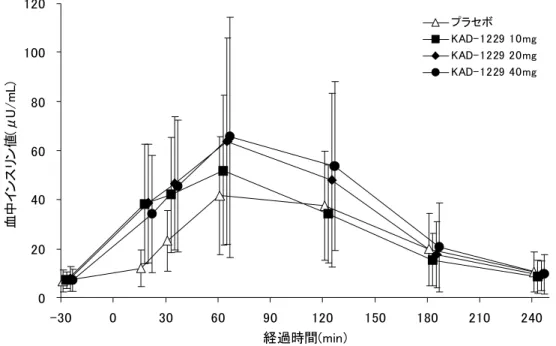
1) 後期第 II 相試験(2)より,食後 30 分までの早期のインスリン追加分泌促進は 10 mg でプラ
トーに達していたが,その後の推移では
20 mg 以上の用量は 10 mg に比較してさらにイン
スリン分泌量が増え,20 mg でほぼプラトーであることから,20 mg は本薬の薬力学的効
果(膵β細胞の刺激)の上限であると考えられること(図 9)。
2) 後期第 II 相試験(3)より,重症度が比較的高いと考えられる「薬物治療歴あり」の患者層
において
20 mg の HbA1C 低下効果が 10 mg の効果を上回ること(表 2)。また,低血糖症
状の発現率(表 1)等,安全性において 10 mg と 20 mg に大きな違いが認められないこと。
3) 長期投与試験の最終投与量別集計において,「薬物治療歴あり」などの重症度のやや高い
患者を中心とした
1 回 10 mg 投与で治療目標が達成できず,20 mg への増量が必要であっ
た症例は,1 回 10 mg 投与では本薬への反応性が低かったが,1 回 20 mg へ 16 週時に増量
することでさらなる効果が認められ,1 回 10 mg を維持できた症例(10 mg で十分な反応
を示した症例)と同等の効果が得られたこと(図 10)。
4) さらに長期投与試験において 20 mg への増量がなされた症例について,10 mg での効果を
示す投与
16 週時 HbA
1C低下効果(表 3)と 20 mg での効果を示す投与 28 週時の HbA
1C低下効果(表 4)から,表 5に示すような 10 グループに分類し詳細な検討を行った。そ
の結果,10 mg では効果が認められなかったグループ 2~5 及び 7~10 の症例は,20 mg に
増量することにより,投与前
HbA
1Cが
8%未満の患者では 41.5%(17 例/41 例),8%以上
の患者では
37.7%(20 例/53 例)の症例において増量効果が認められた(図 11,図 12)。
図 9 後期第 II 相試験(2)の血中インスリン値推移
表 2 後期第 II 相試験(3)の HbA
1C変化量の層別解析
HbA
1C変化量
Shirley-Williamsの多重比較法
部分集団
群
例数
平均
値
S.D.
中央
値
Z値
棄却限界
値
p値
なし
プラセボ群
17 0.02
0.64 0.00
-
-
-
薬物治療歴の
有無
5 mg群
20 -0.52 0.94 -0.30 1.7560
1.9599 p=0.0395
10 mg群
20 -0.76 0.43 -0.70 3.6042
2.0153 * p=0.0001
20 mg群
18 -0.51 0.96 -0.70 2.8353
2.0320 * p=0.0025
あり
プラセボ群
23 0.84
1.71 0.70
-
-
-
5 mg群
24 0.03
0.92 0.00
2.5349
1.9599 *
p=0.0056
10 mg群
25 -0.02 1.24 -0.10 2.7039
2.0153 * p=0.0037
20 mg群
25 -0.28 1.03 -0.50 3.5490
2.0320 * p=0.0002
*:p<0.025
0
20
40
60
80
100
120
-30
0
30
60
90
120
150
180
210
240
経過時間(min)
血中
イ
ン
ス
リ
ン
値
(μ
U/
m
L)
プラセボ KAD-1229 10mg KAD-1229 20mg KAD-1229 40mg図 10 長期投与試験の最終投与量別 HbA
1C変化量の経時的推移
表 3 長期投与試験の 16 週時での効果判定の定義
16 週時の効果判定
定義
8%未満
投与開始前からの
HbA
1Cの変化量が
0.5%以上低下した症例
改善
8%以上
投与開始前からの
HbA
1Cの変化量が
1.0%以上低下した症例
不変
改善でも悪化でもない場合
悪化
投与開始前の
HbA
1C値より上昇した場合
表 4 長期投与試験の 28 週時での効果判定の定義
28 週時の効果判定
定義
8%未満
投与開始前からの
HbA
1Cの変化量が
0.5%以上低下した症例
Responder
8%以上
投与開始前からの
HbA
1Cの変化量が
1.0%以上低下した症例
Non-responder
上記
Responder 以外の症例
表 5 長期投与試験の増量例の分類,並びに症例数
投与前
HbA
1Cグループ
症例数
投与
16 週後
(増量前)
投与
28 週後
(増量
12 週後)
1 3 改善
2 13 不変
3 4 悪化
Responder
4 10 不変
8%未満
5 14 悪化
Non-responder
6 25 改善
7 16 不変
8 4 悪化
Responder
9 16 不変
8%以上
10 17 悪化
Non-responder
平均値+SD
-1.0
-0.5
0.0
0.5
1.0
-4
0
4
8
12
16
20
24
28
32
最終投与量:10mg
最終投与量:20mg
最終観察時
時期(週)
Hb
A
1C変化
量
(%
)
1 回 20 mg へ増量
- 1 . 5 - 1 . 5- 1 . 5 - 1 . 5 - 1 . 0 - 1 . 0- 1 . 0 - 1 . 0 - 0 . 5 - 0 . 5- 0 . 5 - 0 . 5 0 . 0 0 . 0 0 . 0 0 . 0 0 . 5 0 . 5 0 . 5 0 . 5 1 . 0 1 . 0 1 . 0 1 . 0 0 00 0 4444 8888 1 21 21 21 2 W ee kW ee kW ee kW ee k 1 61 61 61 6 2 02 02 02 0 2 42 42 42 4 2 82 82 82 8 Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) グルー プ 1:改善-R es p onder(n=3) グルー プ 1:改善-R es p onder(n=3) グルー プ 1:改善-R es p onder(n=3) グルー プ 1:改善-R es p onder(n=3) グルー プ 2:不変-R es p onder(n=13) グルー プ 2:不変-R es p onder(n=13) グルー プ 2:不変-R es p onder(n=13) グルー プ 2:不変-R es p onder(n=13) グルー プ 3:悪化-R es p onder(n=4) グルー プ 3:悪化-R es p onder(n=4) グルー プ 3:悪化-R es p onder(n=4) グルー プ 3:悪化-R es p onder(n=4) グルー プ 4:不変-N on-res ponder(n=10) グルー プ 4:不変-N on-res ponder(n=10) グルー プ 4:不変-N on-res ponder(n=10) グルー プ 4:不変-N on-res ponder(n=10) グルー プ 5:悪化-N on-res ponder(n=14) グルー プ 5:悪化-N on-res ponder(n=14) グルー プ 5:悪化-N on-res ponder(n=14) グルー プ 5:悪化-N on-res ponder(n=14) 10mg 維持群(n=142) 10mg 維持群(n=142) 10mg 維持群(n=142) 10mg 維持群(n=142)
増量
図 11 長期投与試験での HbA
1C変化量の推移(投与開始前 HbA
1C8%未満)
- 3 . 0 - 3 . 0- 3 . 0 - 3 . 0 - 2 . 0 - 2 . 0- 2 . 0 - 2 . 0 - 1 . 0 - 1 . 0- 1 . 0 - 1 . 0 0 . 0 0 . 00 . 0 0 . 0 1 . 0 1 . 01 . 0 1 . 0 2 . 0 2 . 02 . 0 2 . 0 0 00 0 4444 8888 1 21 21 21 2 W e e kW e e kW e e kW e e k 1 61 61 61 6 2 02 02 02 0 2 42 42 42 4 2 82 82 82 8 Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) Hb A 1 C 変化 量( % ) グルー プ 6:改善-R es ponder(n=25) グルー プ 6:改善-R es ponder(n=25) グルー プ 6:改善-R es ponder(n=25) グルー プ 6:改善-R es ponder(n=25) グルー プ 7:不変-R es ponder(n=16) グルー プ 7:不変-R es ponder(n=16) グルー プ 7:不変-R es ponder(n=16) グルー プ 7:不変-R es ponder(n=16) グルー プ 8:悪化-R es ponder(n=4) グルー プ 8:悪化-R es ponder(n=4) グルー プ 8:悪化-R es ponder(n=4) グルー プ 8:悪化-R es ponder(n=4) グルー プ 9:不変-N on-res p ond er(n=16) グルー プ 9:不変-N on-res p ond er(n=16) グルー プ 9:不変-N on-res p ond er(n=16) グルー プ 9:不変-N on-res p ond er(n=16) グルー プ 10:悪化-Non-res ponder(n=17) グルー プ 10:悪化-Non-res ponder(n=17) グルー プ 10:悪化-Non-res ponder(n=17) グルー プ 10:悪化-Non-res ponder(n=17) 10mg 維持群(n=48) 10mg 維持群(n=48) 10mg 維持群(n=48) 10mg 維持群(n=48)増量
図 12 長期投与試験での HbA
1C変化量の推移(投与開始前 HbA
1C8%以上)
以上のように,本薬
1 回 10 mg 投与で十分な血糖コントロールが得られない患者では,1 回
20 mg へ増量することで,総合的な血糖コントロール指標である HbA
1Cをより低下させること
が可能であった。しかしながら,本薬の適正使用を考えた場合,血糖コントロールのさらなる
改善が必要な患者のみが増量されるべきであり,また,増量しても十分な効果が得られていな
い状態で漫然と使用することを防止する必要があることを考慮し,本薬の増量および他の治療
への変更の目安および留意事項を添付文書の重要な基本的事項(2), (3)に以下の通りに記載した。
2. 重要な基本的注意
(2) 本剤投与中は,血糖を定期的に検査するとともに,経過を十分に観察し,本剤を 2~3
ヵ月投与しても効果が不十分な場合には,より適切と考えられる治療への変更を考慮す
ること。
(3) 投与の継続中に,投与の必要がなくなる場合や,減量する必要がある場合があり,また
患者の不養生,感染症の合併等により効果がなくなったり,不十分となる場合があるの
で,食事摂取量,血糖値,感染症の有無等に留意のうえ,常に投与継続の可否,投与量,
薬剤の選択等に注意すること。
2.3.3 減量について
後期第
II 相試験(3)において 1 回 5 mg の用量でもプラセボと比較して HbA
1Cの有意な低下作
用が認められている。また,長期投与試験において
1 回 10 mg から開始し,1 回 5 mg へ減量
した症例は
10 例(7 例は低血糖症状により減量)であったが,1 回 5 mg へ減量後も本薬の
HbA
1Cの改善効果は継続して認められていたことから(図
13),必要に応じて 1 回 5 mg への
適宜減を可とした。
図 13 長期投与試験の 5 mg への減量例における減量前後の HbA
1C変化量の経時的推移
以上より,本薬の用量は「通常は
1 回 10 mg とするが,症状により適宜増減する。」ことが
妥当であると判断し,前記のように設定した。
平均値+SD
-1.0
-0.5
0.0
0.5
1.0
1.5
2.0
2.5
-12
-8
-4
0
4
8
12
16
20
24
28
減量後の時期(週)
Hb
A
1C変化量
(%
)
1 回 5 mg へ減量
3. 使用上の注意(案)およびその設定根拠
使用上の注意(案) 使用上の注意(案)使用上の注意(案) 使用上の注意(案) 設定根拠設定根拠 設定根拠設定根拠 【禁忌禁忌禁忌(次の患者には投与しないこと)】禁忌 (1)重症ケトーシス,糖尿病性昏睡又は前昏睡,1型糖尿病の患者 [輸液及びインスリンによる速やかな高血糖の是正が必須となる ので本剤の投与は適さない。] (2)重症感染症,手術前後,重篤な外傷のある患者[インスリンによ る血糖管理が望まれるので本剤の投与は適さない。] (3)本剤の成分に対し過敏症の既往歴のある患者 (4)妊婦又は妊娠している可能性のある婦人[「妊婦,産婦,授乳婦 等ヘの投与」の項参照] <効能・効果に関連する使用上の注意> <効能・効果に関連する使用上の注意><効能・効果に関連する使用上の注意> <効能・効果に関連する使用上の注意> (1) 糖尿病の診断が確立した患者糖尿病の診断が確立した患者糖尿病の診断が確立した患者に対してのみ適用を考慮すること。糖尿病の診断が確立した患者 糖尿病以外にも耐糖能異常・尿糖陽性等,糖尿病類似の症状(腎 性糖尿,老人性糖代謝異常,甲状腺機能異常等)を有する疾患が あることに留意すること。 (2) 糖尿病治療の基本である食事療法・運動療法を行っており,投与 の際の空腹時血糖が126 mg/dL以上,又は食後血糖1又は2時間値 が200 mg/dL以上を示す場合に限る。 <用法・用量に関連する使用上の注意> <用法・用量に関連する使用上の注意><用法・用量に関連する使用上の注意> <用法・用量に関連する使用上の注意> 本剤は,食後投与では速やかな吸収が得られず効果が減弱する。効 果的に食後の血糖上昇を抑制するため,本剤の投与は毎食直前(5分 以内)とすること。また,本剤は投与後速やかに薬効を発現するた め,食前30分投与では食前15分に血中インスリン値が上昇し食事開始 時の血糖値が低下することが報告されており,食事開始前に低血糖を 誘発する可能性がある。 【使用上の注意】 【使用上の注意】 【使用上の注意】 【使用上の注意】 1. 慎重投与慎重投与慎重投与(次の患者には慎重に投与すること)慎重投与 (1)肝機能障害のある患者[肝臓は本剤の主代謝臓器の 1 つであるた め,低血糖を起こすおそれがある。また,肝機能障害のある患者 においては肝機能障害を悪化させるおそれがある。] (2)腎機能障害のある患者[慢性腎不全患者において,血漿中薬物未 変化体濃度の消失半減期の延長が報告されていることから,低血 糖を起こすおそれがある。「薬物動態」の項参照] (3)次に掲げる状態 1) 虚血性心疾患のある患者[心筋梗塞を発症した患者が報告され ている。「副作用」の項参照] 2) 脳下垂体機能不全又は副腎機能不全のある患者[低血糖を起こ すおそれがある。] 3) 下痢,嘔吐等の胃腸障害のある患者[低血糖を起こすおそれが ある。] 4) 栄養不良状態,飢餓状態,食事摂取量の不足又は衰弱状態[低 血糖を起こすおそれがある。] 5) 激しい筋肉運動[低血糖を起こすおそれがある。] 6) 過度のアルコール摂取者[低血糖を起こすおそれがある。] 7) 高齢者[一般に高齢者では生理機能が低下している。「高齢者へ の投与」の項参照] 2. 重要な基本的注意重要な基本的注意重要な基本的注意 重要な基本的注意 (1) 本剤は,ときに低血糖症状を起こすことがあるので,高所作業, 自動車の運転等に従事している患者に投与するときには注意する こと。低血糖症状が認められた場合にはショ糖,ブドウ糖,又は 十分量のブドウ糖を含む清涼飲料水等を摂取するなど適切な処置 を行うこと。なお,患者に対し低血糖症状及びその対処方法につ いて十分説明すること。 (2) 本剤投与中は,血糖を定期的に検査するとともに,経過を十分に 観察し,本剤を本剤を本剤を 2~本剤を ~~~3 ヵ月投与しても効果が不十分な場合ヵ月投与しても効果が不十分な場合ヵ月投与しても効果が不十分な場合には,ヵ月投与しても効果が不十分な場合 より適切と考えられる治療への変更を考慮すること。 (3) 投与の継続中に,投与の必要がなくなる場合や,減量する必要が投与の必要がなくなる場合や,減量する必要が投与の必要がなくなる場合や,減量する必要が投与の必要がなくなる場合や,減量する必要が ある場合があり,また患者の不養生,感染症の合併等により効果 ある場合があり,また患者の不養生,感染症の合併等により効果 ある場合があり,また患者の不養生,感染症の合併等により効果 ある場合があり,また患者の不養生,感染症の合併等により効果 がなくなったり,不十分となる場 がなくなったり,不十分となる場 がなくなったり,不十分となる場 がなくなったり,不十分となる場合合合合があるので,食事摂取量,血 糖値,感染症の有無等に留意のうえ,常に投与継続の可否,投与 量,薬剤の選択等に注意すること。 (4) 本剤は,速やかなインスリン分泌促進作用を有する。その作用点 はスルホニル尿素系製剤と同じであり,スルホニル尿素系製剤と の相加・相乗の臨床効果及び安全性が確認されていないので,ス ルホニル尿素系製剤とは併用しないこと。[「薬効薬理」の項参 照] (5) α-グルコシダーゼ阻害剤(アカルボース,ボグリボース)及びイ ンスリン抵抗性改善剤(塩酸ピオグリタゾン)及びビグアナイド 系製剤等との併用については有効性及び安全性は確立されていな い。 【禁忌 【禁忌【禁忌 【禁忌(次の患者には投与しないこと)】】】】 いずれもナテグリニドの記載を参考にして設定した。 <効能・効果に関連する使用上の注意> <効能・効果に関連する使用上の注意><効能・効果に関連する使用上の注意> <効能・効果に関連する使用上の注意> (1)一般的な経口血糖降下剤の記載を参考にして設定した。 (2)糖尿病の診断基準および本剤の臨床試験における対象選択基準を 考慮して設定した。 <用法・用量に関連する使用上の注意> <用法・用量に関連する使用上の注意><用法・用量に関連する使用上の注意> <用法・用量に関連する使用上の注意> 服薬タイミングを検討した臨床試験の結果から,食前 30 分投与では 食前 15 分に血中インスリン値が上昇し,食事開始時の血糖が低下す ること,また,食前 10 分投与では食事開始時に血中インスリン値が 上昇することが報告されており,低血糖症状の発現が懸念される。以 上より,低血糖の誘発の可能性を考慮した場合には,本薬の服薬タイ ミングは食事時間に近い方が注意喚起や誤用を防ぐ意味からも好まし いと考えられ,「毎食直前(5 分以内)」と設定した。 【使用上の注意】 【使用上の注意】 【使用上の注意】 【使用上の注意】 1.慎重投与.慎重投与.慎重投与.慎重投与 (1)肝臓は本剤の主要な代謝臓器であることから,低血糖を起こすお それがあるため設定した。また,本薬の臨床試験において,少数では あるが,顕著に肝機能が悪化した症例においては,何らかの肝機能障 害を合併症として有していたことから,ナテグリニドの記載も参考に して設定した。 (2)本剤の腎機能低下者における臨床試験において得られた成績より 設定した。 (3)1) 本剤の臨床試験において心筋梗塞を発症した患者が報告され ていることから設定した。 (3)2)- 6) ナテグリニドの記載を参考にして設定した。 (3)7) 一般に高齢者では生理機能が低下していることから設定した。 2....重要な基本的注意重要な基本的注意重要な基本的注意 重要な基本的注意 (1)本剤投与により低血糖症状を起こす可能性があることから設定し た。 (2)-(4)ナテグリニドの記載を参考にして設定した。 (5)左記薬剤との併用については有効性及び安全性は確立されていな いことから設定した。使用上の注意(案) 使用上の注意(案)使用上の注意(案) 使用上の注意(案) 設定根拠設定根拠 設定根拠設定根拠 3.相互作用相互作用相互作用相互作用 本剤は主として,UGT1A9及び1A3によるグルクロン酸抱合化によ り代謝される。 併用注意(併用に注意すること) 薬剤名等 臨床症状・措置方法 インスリン製剤 ビグアナイド系製剤 塩酸メトホルミン等 α-グルコシダーゼ阻害剤 アカルボース ボグリボース インスリン抵抗性改善剤 塩酸ピオグリタゾン サリチル酸製剤(アスピリ ン等) 低血糖症状(空腹感,あくび,悪 心,無気力,だるさ等の初期症状 から血圧上昇,発汗,ふるえ,顔 面蒼白等の症状を経て意識消失, けいれん,昏睡にいたる) 血糖降下作用が増強されることが あるので,血糖値モニターその他 患者の状態を十分に観察し,必要 であれば減量する。 クロフィブラート等 サルファ剤 スルファメトキサゾール等 β-遮断剤 プロプラノロール等 モノアミン酸化酵素阻害剤 タンパク同化ホルモン剤 メスタノロン等 テトラサイクリン系抗生物 質 塩酸テトラサイクリン 塩酸ミノサイクリン等 エピネフリン 副腎皮質ホルモン メチルプレドニゾロン等 卵胞ホルモン エチニルエストラジオール 等 ニコチン酸 経 口 血 糖 降 下 剤 の 効 果 を 減 弱 さ せ,血糖値が上昇してコントロー ル不良になることがある。 食後の血糖上昇が加わることによ る影響に十分注意すること。 併用時は血糖値コントロールに注 意し頻回に血糖値を測定し,必要 に応じ投与量を調節する。 イソニアジド ピラジナミド フェノチアジン系薬剤 クロルプロマジン等 利尿剤 チアジド系 クロルタリドン エタクリン酸等 フェニトイン 甲状腺ホルモン 乾燥甲状腺等 血糖値その他患者の状態を十分観 察しながら投与する。 硫酸グアネチジン 3.相互作用相互作用相互作用 相互作用 機序・危険因子 作用機序が異なる薬理作用の相加作用による血糖降下作用の 増強による。 血中蛋白との結合抑制及び抱合代謝阻害による。ただし,ア スピリンとして1 回量 1500 mg の併用時に影響する可能性が あるが,低用量(アスピリンとして1 回量 300 mg)では影 響しない。 血中蛋白との結合抑制および代謝阻害による。 肝臓における糖新生の抑制及び末梢におけるインスリン感受 性の増強により血糖が低下する。 タンパク同化ホルモン剤が糖尿病患者のみに起こる血糖降下 作用に加えて代謝抑制・排泄遅延説がある。 インスリン感受性促進による。 末梢でのグルコースの取り込み抑制及び肝臓での糖新生の促 進により,血糖値を上昇させる。 肝臓での糖新生促進,末梢組織でのインスリン感受性低下に よる。 機序不明 コルチゾール分泌変化,組織での糖利用変化,成長ホルモン の過剰産生,肝機能の変化等が考えられる。 肝臓でのブドウ糖の同化抑制による。 糖質代謝の障害による血糖値上昇及び耐糖能異常による。 機序不明 血糖値のコントロールがむずかしいとの報告がある。 インスリン遊離抑制,副腎からのエピネフリン遊離による。 血清カリウムの低下,インスリンの分泌障害,組織における インスリンの感受性低下による。 インスリン分泌を直接抑制する。 血糖コントロール条件が変わることがある。 投与初期で交感神経終末ノルアドレナリン遊離のため,β刺 激作用の糖新生,グリコーゲン分解促進で高血糖になるが, 以降カテコールアミン枯渇のため低血糖となる。
使用上の注意(案) 使用上の注意(案)使用上の注意(案) 使用上の注意(案) 設定根拠設定根拠設定根拠設定根拠 4. 副作用副作用副作用 副作用 これまでに実施された臨床試験の総症例804 例中,副作用が報告され たのは168 例(20.9%)であった。その主なものは,低血糖症状(5.6%: 「臨床成績」の項参照)の他,腹部膨満(1.4%),便秘(1.1%),下痢 (1.1%),空腹感(1.1%)等の消化器症状,頭痛(1.1%)等であった。ま た,臨床検査値の異常変動は,総症例800 例中 190 例(23.8%)に認めら れた 。そ の主 なも のは ,ピ ルビ ン酸 の上 昇(6.4%),γ-GTP の上昇 (4.5%),乳酸の上昇(2.9%),ALT(GPT)の上昇(2.9%),遊離脂肪酸の上 昇(2.7%),総コレステロールの上昇(2.4%),LDL コレステロールの上 昇(2.0%),トリグリセライドの上昇(2.0%)等であった。(承認時) (1) 重大な副作用重大な副作用重大な副作用重大な副作用 1)心筋梗塞心筋梗塞心筋梗塞(0.1%):本剤投与例に心筋梗塞の発症が報告されている心筋梗塞 ので,投与に際しては観察を十分に行い,異常が認められた場合 には投与を中止し,適切な処置を行うこと。 2)低血糖低血糖低血糖低血糖:低血糖症状(眩暈,空腹感,振戦,脱力感,冷汗等)が あらわれることがある。本剤の投与により低血糖症状が認められ た場合には,ショ糖,ブドウ糖,又は十分量のブドウ糖を含む清 涼飲料水等を投与するなど適切な処置を行うこと。また,1 回 5 mg への減量を検討するなど慎重に投与すること。 3)肝機能障害,黄疸肝機能障害,黄疸肝機能障害,黄疸:類薬(ナテグリニド)にて重篤な肝機能障肝機能障害,黄疸 害,黄疸が報告されているので,観察を十分に行い,異常が認め られた場合には投与を中止し,適切な処置を行うこと。 (2) その他の副作用その他の副作用その他の副作用その他の副作用 5%以上 0.1~5%未満 代謝 低血糖症状(眩暈,空 腹 感 , 振 戦 , 脱 力 ( 感 ) , 冷 汗 , 意 識 低 下,倦怠(感),動悸, 頭重(感),眼のしょぼ しょぼ(感),嘔気,気 分不良,しびれ(感), 眠気,歩行困難等) 口渇 消化器 腹 部 膨 満 , 空 腹 感 , 下 痢,便秘,胃不快感,嘔 気,放屁増加,胸やけ, 軟便,胃炎,口内炎,腹 痛 , 胃 痛 , 嘔 吐 , 胃 潰 瘍,胃腸炎,食欲不振 皮膚 湿疹,そう痒(症) 筋骨格系 筋(肉)痛,関節痛 精神神経系 眩暈,しびれ(感),緊張亢 進,眠気 自律神経系 食欲亢進 耳 耳痛 肝臓 γ-GTP 上昇,ALT(GPT)上 昇,LDH 上昇, AST(GOT)上昇,総ビリル ビン上昇 腎臓 尿蛋白 循環器 動悸 呼吸器 咳,かぜ症候群 泌尿器 腎嚢胞,頻尿 その他 ピルビン酸上昇 頭痛,倦怠(感),体重増 加,右季肋部痛,冷汗, ほてり,乳酸上昇,遊離 脂肪酸上昇,総コレステ ロール上昇,LDL-コレス テロール上昇,トリグリ セ ラ イ ド 上 昇 , 尿 酸 上 昇, カリウム上昇 4.副作用.副作用.副作用.副作用 本剤の臨床試験における副作用及び臨床検査値異常変動の発 現頻度を検討し,設定した。 また,類薬のナテグリニドにおいて,重篤な肝機能障害,黄 疸が報告されている旨を記載した。
使用上の注意(案) 使用上の注意(案) 使用上の注意(案) 使用上の注意(案) 設定根拠設定根拠 設定根拠設定根拠 5. 高齢者への投与高齢者への投与高齢者への投与 高齢者への投与 一般に高齢者では生理機能が低下しているので,状況に応じて低用量 (1 回量 5mg)から投与を開始するなど,血糖値に留意して,経過を十 分に観察しながら慎重に投与すること。 6. 妊婦,産婦,授乳婦等への投与妊婦,産婦,授乳婦等への投与妊婦,産婦,授乳婦等への投与 妊婦,産婦,授乳婦等への投与 (1)妊婦又は妊娠している可能性のある婦人には投与しないこと[本剤 は動物実験(ラット)で胎盤通過が認められている。また,動物実 験(ラット)で周産期に薬理作用に基づく低血糖によると推定され る母動物死亡が認められている。] (2)授乳中の婦人には授乳を避けさせること。[本剤は動物実験(ラッ ト)で母乳への移行が認められている。] 7. 小児等への投与小児等への投与小児等への投与 小児等への投与 小児等に対する安全性は確立していない。[使用経験がない。] 8. 適用上の注意適用上の注意適用上の注意 適用上の注意 薬剤交付時: 薬剤交付時:薬剤交付時: 薬剤交付時:PTP 包装の薬剤は PTP シートから取り出して服用するよう 指導すること。[PTP シートの誤飲により,硬い鋭角部が食道粘膜へ 刺入し,更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発する ことが報告されている。] 5.高齢者への投与.高齢者への投与.高齢者への投与 .高齢者への投与 一般に高齢者では生理機能が低下していることから設定した。 6.妊婦,産婦,授乳婦等への投与.妊婦,産婦,授乳婦等への投与.妊婦,産婦,授乳婦等への投与 .妊婦,産婦,授乳婦等への投与 (1)ラットにラベル体を経口投与した場合に,胎盤を通過し,胎 児への移行が認められていること,ラットでの周産期および 授乳期投与試験において,薬理作用に基づく低血糖によると 推定される母動物死亡が認められていることから設定した。 (2)ラットにラベル体を経口投与した場合に,乳汁中への移行が 認められていることから設定した。 7.小児等への投与.小児等への投与.小児等への投与 .小児等への投与 厚生省(現厚生労働省)薬務局安全課長通知薬安第180 号「小 児に対する医療用医薬品の使用上の注意の記載について」を参考 にして設定した。 8.適用上の注意.適用上の注意.適用上の注意 .適用上の注意 日薬連発第249 号(平成 8 年 3 月 27 日付)を参考にして設定 した。