土と微生物(Soil Microorganisms)Vol. 70 No. 1, pp.17∼22(2016) 17
総 説 窒素固定を行う放線菌
九町健一
*・栫健太郎
鹿児島大学大学院理工学研究科,〒
890
−0065
鹿児島市郡元1
−21
−35
Nitrogen− fixing actinobacteria
Ken-ichi Kucho* and Kentaro Kakoi
Graduate School of Science and Engineering, Kagoshima University Korimoto 1−21−35, Kagoshima 890−0065, Japan Keywords:順遺伝学,突然変異体, Frankia
1.はじめに
窒素(N)は生命に必須の元素であり,核酸やタンパク質をは じめとする数多くの生体分子に含まれる。窒素固定は大気中の窒 素ガス(N2)をアンモニア(NH3)に還元する反応である。植物 や真菌,細菌はアンモニアを有機体窒素に同化する。動物はアン モニアの同化を行えないが,それらの生物を食すことにより有機 体窒素を得る。すなわち窒素固定に由来する窒素原子は地球上の すべての生物に転流する。アンモニアは硝化細菌により硝酸塩に 酸化され,硝酸塩中の窒素原子は脱窒細菌により窒素ガスに還元 されて大気へ戻るので,生態系の窒素量を維持するためには継続 的な窒素固定が必須である。窒素固定能を持つ生物は少なく,細 菌に限られる。歴史的に窒素固定の研究は,実験生物として扱い やすい一部の細菌(プロテオバクテリアやシアノバクテリアなど) で集中的に行われ,それらで共通の特徴があることが分かった。 しかし,その共通例に従わない興味深い特徴を持つにも関わらず, 技術的な問題から研究が進んでいない窒素固定細菌も多い。 本稿ではまず窒素固定を行う細菌種と窒素固定に関わる遺伝子 について概説したのち,放線菌に属する窒素固定細菌とその代表 であるフランキア属(Frankia)について私たちの研究成果をま じえて解説する。
2.窒素固定細菌
窒素固定を行う生物種は真正細菌と古細菌に見いだされ,これ まで真核生物では見つかっていない。図
1
に窒素固定種を含む細 菌の分類群を示す(Young,1992
)。このような特殊能力を持つ細 菌種は特定の分類群に集中して分布しそうなものだが,実際はそ うではなく極めて多様な分類群に散在している。さらに意外なこ とに,窒素固定能を持つのはそれらの分類群のメンバーの一部の みである場合が多い。例えば,ある分類群に含まれる複数の属の うち一部しか窒素固定を行わないことや,ある属に含まれる複数 の種のうち一部しか窒素固定を行わないということが頻繁に見られる。窒素固定能のこのような散発的な分布の原因として二つの 可能性が考えられている(Hartmann and Barnum,
2010
)。一つ目 は,窒素固定に必要な遺伝子は祖先種から垂直的に引き継がれた が多くの細菌種が進化の過程でそれらを失ってしまったというも のであり,もう一つは,窒素固定遺伝子は接合などにより水平的 に異種の細菌間で伝達されたというものである。図1
に示す分類 群の中でも,とりわけシアノバクテリア・α プロテオバクテリア・ γプロテオバクテリアは窒素固定種を含む属が多く(20
属以上, 図1
)(Young,1992
),研究が進んでいるものも多い。古細菌で見 つかっている窒素固定種は,メタン生成菌に限られる。真核生物 と共生して窒素固定を行う例も多く見られ,マメ科植物の根に形 成される根粒中に共生して窒素固定を行う根粒菌は有名である。3.窒素固定酵素
窒素固定反応は以下の反応式で表され,窒素固定酵素がこの反 応を触媒する。
N2 +
8
e- +8
H+ +16
ATP →2
NH3 + H2 +16
ADP +16
Pi窒素固定細菌種が多様な分類群に散在しているにも関わらず, 窒素固定酵素は一つの例外(後述)を除いて保存された構造(ア ミノ酸配列)とそれに伴う類似した機能的特徴を持つ。
窒素固定酵素はジニトロゲナーゼとジニトロゲナーゼ還元酵素 2016年1月12日受付・2016年2月4日受理
* Corresponding author.
E−mail:kkucho@sci.kagoshima-u.ac.jp
図 1 窒素固定細菌種を含むバクテリア分類群。系統樹は16S rRNA の 塩基配列に基づく。窒素固定細菌種を含む分類群を四角で囲ん だ。それらに含まれる窒素固定細菌種を含む属の数を付記した。
〔Young(1992)を改変。〕
という
2
種類の構成要素からなる複合体であり,複雑な金属補因 子を数多く含むことが特徴的である(Dixon and Kahn,2004
)。 ジニトロゲナーゼは窒素分子のアンモニアへの還元反応を触媒 し,2
分子の α サブユニット(NifD タンパク質)と2
分子の β サブユニット(NifK タンパク質)からなるヘテロ4
量体酵素で ある。8
個の鉄原子と7
個の硫黄原子からなる P クラスターと,1
個のモリブデン原子と7
個の鉄原子と9
個の硫黄原子と1
分子 のホモクエン酸からなる鉄−モリブデン補因子(FeMoco)を含み, MoFe タンパク質とも呼ばれる。ジニトロゲナーゼ還元酵素は窒素分子の還元に必要な電子を ジニトロゲナーゼに供給し,
2
分子の同一サブユニット(NifH タンパク質)からなる。4
個の鉄原子と4
個の硫黄原子からなる4
Fe−4
S クラスターを含み, Fe タンパク質とも呼ばれる。ATP 加水分解活性をもち,電子のジニトロゲナーゼへの移動はこれに 依存する。窒素固定酵素複合体は,
2
つのジニトロゲナーゼ還元酵素と1
つのジニトロゲナーゼから構成される。窒素分子の還元反応 は FeMoco で行われると考えられ,その他の金属クラスターは FeMoco への電子の供給に関わる(Dixon and Kahn,2004
)。ま ず,遊離状態のジニトロゲナーゼ還元酵素の4
Fe−4
S クラスター にフェレドキシン等の電子供与体から電子が渡される。次いでジ ニトロゲナーゼ還元酵素がジニトロゲナーゼに結合して複合体が 形成され,電子が P クラスターを経て FeMoco に渡され,窒素 分子が還元される。窒素固定酵素は基質認識がそれほど厳密でな く,窒素分子と構造が類似した化合物(例えばアセチレン HC≡ CH)も還元する。アセチレンの還元により生成されたエチレ ンの検出は,簡便な窒素固定活性測定法としてしばしば用いられ る。
すべての窒素固定細菌は FeMoco を含むジニトロゲナーゼ を持つ。一部の窒素固定細菌はこれに加えて異なる補因子を含 むジニトロゲナーゼも持っている(Eady,
1996
)。Azotobacter vinelandiiや A. chroococcum, Anabaena variabilis は, バ ナ ジ ウ ムと鉄原子を含むジニトロゲナーゼを持ち, A. vinelandii や Rhodobacter capsulatus, Clostridium pasteurianumは金属原子 として鉄原子のみを含むジニトロゲナーゼを持つ。これらの補因 子の構造は FeMoco と類似しており,モリブデン原子がバナジウ ムもしくは鉄原子に置換されていると考えられている。補因子は 異なるものの,これらの非典型的ジニトロゲナーゼを構成するポ リペプチドは鉄−モリブデン型ジニトロゲナーゼの α および β サブユニットと相同性を示し,付随するジニトロゲナーゼ還元酵 素も鉄−モリブデン型のものとよく似ている。4.窒素固定酵素の成熟に関わる遺伝子
窒素固定酵素の構造遺伝子は nifDKH にコードされるが,こ れらが活性を持つためには補因子の合成に関わる遺伝子も必要 である(Dixon,
2004
)。nifBENQX は FeMoco の合成に必要で あり, nifQ は FeMoco へのモリブデン原子の取り込みに関与す る。nifSU は鉄−硫黄クラスターの合成に必要である。nifV は FeMoco に含まれるホモクエン酸の合成を担う。これらの窒素固 定関連遺伝子(nif 遺伝子群)群の多くは,ゲノム中の特定の領 域に集中して存在する。5.nif 遺伝子群の発現調節
一般に nif 遺伝子群の転写は,アンモニアなどの固定窒素と酸 素(窒素固定酵素の活性を阻害する,後述)の濃度が十分低い
ときのみ活性化されるという合目的的な制御を受けている。その しくみはプロテオバクテリアでよく研究されており, Dixon ら の総説(Dixon and Kahn,
2004
)に詳しい。ここでは概略のみを 述べる。プロテオバクテリアにおいて, nif 遺伝子群の転写は NifA という転写因子により活性化される。NifA による転写活性 化のしくみは特徴的であり,RNA ポリメラーゼの σ54サブユニッ トとの相互作用によりなされる。σ54は一般的なシグマ因子(σ70など)とは異なり,単独で open promoter complex −プロモー ター領域の DNA 二本鎖が解離して転写の鋳型鎖が露出した状態
−を作り出すことができない。NifA は σ54に相互作用すること により,open promoter complex への移行を促進する働きをもつ。 Klebsiella や Azotobacter では酸素が存在すると NifL タンパク 質の働きで nif 遺伝子群の転写が抑制される。NifL はフラビンア デニンジヌクレオチド(FAD)を含み,その酸化還元状態によ り酸素濃度を感知する。FAD が酸化されると NifL は NifA に結 合できるようになり,これにより NifA の転写活性化能が阻害さ れる。
アンモニアの欠乏に応答して活性型の NifA を用意する方法は 細菌種により異なる。Klebsiella ではアンモニア欠乏に応答して nifA遺伝子の転写活性化が起こり,NifA タンパク質が発現する。 Azotobacterでは NifA はアンモニアの有無に関わらず発現してい るが,タンパク質レベルの修飾によりその活性が調節される。
6.酸素感受性とその回避
上述したタイプの窒素固定酵素は,酸素が存在すると活性が 失われる。ジニトロゲナーゼ還元酵素に含まれる
4
Fe−4
S クラス ターが表面に露出しており,容易に酸化されてしまうためであ る(Dixon and Kahn,2004
)。したがって,窒素固定細菌は何らか の方法で窒素固定の場の酸素分圧を低めている。最も単純な方法 は,嫌気条件で窒素固定を行うというものである。Clostridium や Desulfobacter などがこれに該当し,窒素固定に必要な ATP は発酵により生産する(絶対嫌気性窒素固定細菌)。Klebsiella な どは,嫌気条件に加えてごく低濃度の酸素存在下でも窒素固定を 行える(通性嫌気性窒素固定細菌)。対照的に,低濃度の酸素を 要求する窒素固定細菌も存在し,これらは好気呼吸により生産さ れた ATP を窒素固定に利用する(微好気性窒素固定細菌)。こ れらの細菌種はさまざまなやり方で窒素固定の場を微好気的な環 境に保っている。放線菌の Frankia や糸状シアノバクテリアのAnabaenaなどの多細胞性の窒素固定細菌は,内部の酸素分圧が
低く保たれた窒素固定専用細胞を分化させる(図
2
)。Anabaena の窒素固定専用細胞はヘテロシストと呼ばれ,糖脂質と多糖から なる酸素の透過を制限する厚い層で覆われている(Thiel,2004
)(図
2
A)。加えてヘテロシスト細胞は光化学系 II を持たないため,図 2 多細胞性窒素固定細菌が分化させる窒素固定専用細胞(矢印)。(A) Anabaena sp. strain PCC 7120株のヘテロシスト。画像は首都大 学東京の得平茂樹博士から頂いた。(B)Frankia sp. のベシクル。 バーは5μm。
光合成による酸素発生が起こらない。Frankia の窒素固定専用細 胞については後述する。単細胞性の窒素固定細菌では,呼吸によ り酸素を大量に消費して細胞質内の酸素濃度を低めるものがある
(Hill,
1992
)。Azotobacter はその代表で,呼吸活性が極めて高い。 Anabaenaや Frankia, Azotobacter は大気レベルの酸素分圧下 でも窒素固定を行えるので,酸素耐性窒素固定細菌とも呼ばれる。 根粒菌は,微好気的な環境を共生の宿主に依存している。マメ科 植物は根粒細胞中で大量のヘモグロビンタンパク質(レグヘモグ ロビン)を発現している。酸素がレグヘモグロビンに捕捉される ことにより根粒細胞内の酸素分圧が低く保たれ,根粒菌は窒素固 定を行える(Ott et al.,2009
)。7.窒素固定を行う放線菌
グラム陽性細菌はゲノムの GC 含量(グアニンとシトシンの割 合)が大きく異なる
2
つのグループに大別され, GC 含量の高い グループは放線菌と呼ばれる。放線菌は(例外もあるが)細胞分 裂後に娘細胞同士が分離しないため,特徴的な菌糸状の形態を示 す(図2
B)。窒素固定能を持つ放線菌として最初に発見された のは Frankia であり,19
世紀末のことである。20
世紀中頃にな ると, Frankia 以外の窒素固定放線菌が報告され始めた(Gtariet al.,
2012
)。窒素源を含まない培地での増殖やアセチレン還元活性が確認されているものとして, Mycobacterium flavum
301
(Biggins and Postgate,
1969
)や Corynebacterium autotrophicum(Berndt et al.,
1978
), Arthrobacter sp.(Cacciari et al.,1979
), Streptomyces spp.(Pankratov and Dedysh,2009
)などが挙げら れる。Micromonospora 属のいくつかの株では,それらに加えて 安定同位体15N を用いた窒素固定能の確認や nifH 遺伝子の PCR による検出が報告されている(Valdes et al.,2005
)。ゲノム解析 の結果から窒素固定酵素遺伝子のホモログが検出された放線菌種 もいくつか報告されているが,窒素固定能の生理学的な裏付けは なされていない(Gtari et al.,2012
)。特筆すべきは,ドイツ・バイエルン地方の炭焼き場(charcoal pile)の土壌から単離された Streptomyces thermoautotrophicus UBT
1
株である。この細菌の窒素固定酵素は,アセチレンを還元 しない,酸素に阻害されない, NifDKH と相同性を示さない等, 既知の窒素固定酵素と大きく異なる特徴を示した(Gadkari etal.,
1992
)。一酸化炭素(CO)を間接的な電子供与体として利用し,CO を CO2に酸化する過程で得られた電子を酸素分子に渡し, スーパーオキシドアニオンを生成する(Ribbe et al.,
1997
)。この スーパーオキシドアニオンが窒素固定反応の直接の電子供与体と なる。酵素をコードする遺伝子の単離・同定が待たれるところだ が,1997
年を最後に続報が途絶えている。8.Frankia
窒素固定放線菌のなかでも最もよく研究されているものが Frankiaである(Benson and Silvester,
1993
)。窒素固定酵素は 一般的な鉄・モリブデン型である。Frankia は大気レベルの酸素 分圧下でも窒素固定を行うことができるが,これはベシクルと 呼ばれる窒素固定に特化した球状の細胞を分化させることによ る(図2
B)。ベシクルはトリテルペノイド系脂質であるホパノ イド(bacteriohopantetrol およびそのフェニル酢酸誘導体)から なる多重膜に覆われており(Berry et al.,1993
),それが酸素の透 過を妨げて細胞内の酸素濃度が低く保たれると考えられている。 ベシクルを作る窒素固定細菌は Frankia 以外に知られていない。 酸素分圧が低いほどベシクル膜は薄くなり,極めて低い条件ではベシクルを形成することなく窒素固定を行う(Silvester et al.,
2008
)。窒素固定酵素はベシクル細胞に局在し,菌糸細胞ではみ られない。他の窒素固定細菌と同様に nif 遺伝子群の転写は固定 窒素(アンモニア)により抑制されるが,その調節機構は不明で ある。NifA や NifL, σ54因子の相同遺伝子が Frankia のゲノム には見つからないことから,プロテオバクテリアとは異なる転写 調節のしくみを持つと考えられる。Frankia は植物の根に共生することができ,共生の場は根に形 成される根粒である。固定窒素を宿主植物に供給するため,貧 栄養土壌での植物の生育を促進する効果がある(九町,
2013
)。Frankiaが共生する宿主植物はアクチノリザル植物と総称さ
れ,
8
科23
属にわたる200
種以上の植物を含み, Datisca 属が 草本である以外はすべて樹木である。この中に,根粒菌(α プ ロテオバクテリア)の宿主であるマメ科植物は含まれない。日 本国内には,ハンノキ属(Alnus),ヤマモモ属(Myrica),グ ミ属(Elaeagnus),ドクウツギ属(Coriaria)の植物種が自 生している(山中,2008
)。オーストラリア原産のモクマオウ 属(Casuarina)は,砂防のためにしばしば植林されている。 Frankiaは16
S rRNA 遺伝子の系統解析により4
つのクラスター に分類され,それぞれが異なる宿主植物と共生する(Normand et al.,2007
)。クラスター Ia はハンノキ属とヤマモモ科の植物と 共生し,ハンノキ株と呼ばれる。クラスター Ib はモクマオウ属 と Allocasuarina 属という狭い範囲の植物と共生し,モクマオウ 株と呼ばれる。以上の植物はすべてブナ目に属する。クラスター III はバラ目のグミ科・クロウメモドキ科およびブナ目のヤマモ モ科の植物と共生し,グミ株と呼ばれる。クラスター II はバラ 目のバラ科およびウリ目のドクウツギ科・ダティスカ科の植物と 共生し,バラ株と呼ばれる。バラ株の単離培養は長らく成功し ていなかったが,今年初めての成功例が報告された(Gtari et al.,2015
)。ハンノキ株とグミ株の生息は宿主植物が自生していない 土地でも確認される(宿主植物を栽培すると根粒が着生する)が, モクマオウ株ではそのような報告例は少なく自然界では非共生状 態での生育力が弱いと考えられている(Normand et al.,2007
)。 根粒菌では, Nod 因子と呼ばれるリポキトオリゴ糖が共生の シグナル化合物として働く(Denarie et al.,1992
)。宿主マメ科植 物は,共生相手の根粒菌が分泌する Nod 因子を受容体タンパク 質により感知することで適切なパートナーであることを認識し, 細胞内への侵入を受け入れる。Nod 因子の生合成には nodABC という3
つの遺伝子が必要である。NodC が N−アセチルグルコ サミンを重合させキチン骨格を作り, NodB が非還元末端のア セチル基を除去した後,そこに NodA がアシル基(脂肪酸)を 付加する。2007
年の3
株の Frankia ゲノムの決定を皮切りに(Normand et al.,
2007
),現在では20
以上の株のゲノムの解析が なされているが,nodABC 遺伝子の明らかなホモログは見つかっ ていない。近年, Frankia の共生シグナル化合物が部分的に精 製され,詳しい性状解析がなされた(Chabaud et al.,2016
)。こ れを宿主植物(モクマオウ)の根に接種すると,共生の開始に 必要な反応(カルシウムスパイキングと NIN 遺伝子の発現)が 誘導された。しかし,この化合物は Nod 因子とは異なり親水性 で,キチン分解酵素で処理しても活性を保った。以上の結果から,Frankiaのシグナル化合物は根粒菌の Nod 因子とは異なると考
えられている。例外的に Datisca 属の植物に共生する candidatus Frankia datiscae Dg
1
は nodABC 遺伝子の明瞭なホモログを持つ が(Persson et al.,2015
),単離培養が成功していないためこれら の共生における役割は分かっていない。9.Frankia の突然変異株の単離法の開発 私たちは, Frankia の nif 遺伝子群の転写調節やベシクルの分 化,アクチノリザル植物との共生等の分子機構に興味を持ってお り,それらの現象に関わる遺伝子を順遺伝学的な手法により単離・ 同定しようと試みている。順遺伝学的手法は特定の生命現象に 関わる未知の遺伝子を同定するための有効な手法であり,バクテ リアから高等真核生物に至るまで広く用いられる。この手法では まず注目する生命現象に異常を示す突然変異株をスクリーニング する。続いてその異常の原因となる変異とそれを含む遺伝子を同 定する。変異同定にはいくつかの方法があるが,バクテリアでは コンプリメンテーション法−野生株のゲノムライブラリークロー ンを導入して表現型が正常に回復する株を単離し,導入されたク ローンをその株から回収して塩基配列を決定し,変異株の対応す る配列と比較する−がよく用いられる。
これまで Frankia では突然変異株の単離法が確立されていな かったため,順遺伝学的な解析が不可能であった。問題点は,
Frankiaが多細胞の菌糸として生育することであり,窒素固定に
異常を示す突然変異株の単離を例として説明する。Frankia を変 異原で処理すると,
1
つの菌糸断片に含まれる各細胞は染色体中 の異なる位置に変異を起こす。よって,このような菌糸断片を固 体培地で培養して単一コロニーを単離したとしても,それは多様 な遺伝子型の細胞からなるヘテロな集団である。もし,あるコロ ニーに窒素固定ができない変異細胞が含まれたとしても,そのよ うな劣性の表現型はそれ以外の細胞が示す窒素固定ができるとい う優性の表現型に覆い隠されてしまい,検出することができない。 つまり,変異細胞が存在したとしてもそれを認識できない。胞子 の利用やプロトプラスト化により単細胞化を行うことが一般的な 解決法であるが,ゲノム配列が決定されたモデル Frankia 株で はそれらは困難だったため,私たちは菌糸を用いて変異株を単離 する方法を開発した。劣性の表現型を示す変異株を単離するためには,同一の遺伝 子型の細胞のみを含む菌糸断片を得ることが必要不可欠である。 私たちは,菌糸の末端が伸長するという Frankia の性質を用い
て,そのような菌糸断片を得ようと試みた(図
3
)(Kakoi et al.,2014
)。まず,液体培養した Frankia CcI3
株の菌糸を超音波で 短く断片化し,変異原(エチルメタンスルホン酸)で処理した。 続いて,菌糸断片を液体培養した。菌糸の末端の細胞が分裂する ため,この過程で菌糸の末端に同一の変異遺伝子型をもつ細胞が 複数連なる(図3
の横線)。このような菌糸をもう一度超音波で 断片化した。末端から遊離した短い菌糸断片は,同一の遺伝子型 をもつ細胞のみを含むと期待され,それらを5
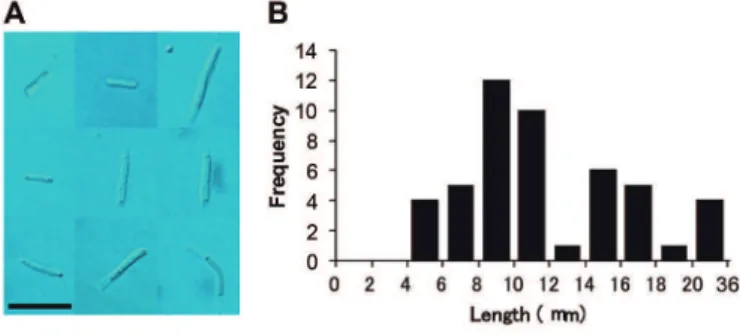
μm のフィルター(Ultrafree centrifugal filter units,ミリポア)を用いて精製した。フィ ルターろ過した菌糸の多くは
8
から10
μm であり(図4
)(Kakoi et al.,2014
), Frankia CcI3
株の1
細胞の長さは約2
.4
μm である ことから,それらは3
から4
細胞を含むと見積もられた。この方法が期待通りに機能していることを確認するため,フィ ルターろ過後の菌糸を固体培地で培養してコロニーを形成させ, それらのゲノム配列を次世代シーケンサーにより決定した。
9
個 の無作為に選択したコロニーおよび4
個の変異表現型を示すコ ロニー(6
A1
と shiro1, shiro2, shiro3。後述)を含む,合計13
個のコロニーを解析した。その結果,すべてのコロニーで置 換変異が見出され,変異の数はゲノムあたり9
から20
個であっ た。確認のため,変異塩基の周辺領域を PCR で増幅し,増幅断 片の塩基配列を直接サンガー法により決定した。10
コロニーに由 来する38
の変異を確認した結果,すべてにおいて次世代シーケ ンサーとサンガー法で同一の変異が同定された(図5
)(Kakoi et al.,2014
)。重要なことに,変異箇所には変異塩基以外の塩基のピー クはまったく検出されなかった。この結果は,これらのコロニー図 3 同一の遺伝子型の細胞のみを含む菌糸断片を濃縮する方法
(Fragmentation and filtration 法)。六角形は細胞を表す。白は野 生型を,異なる模様は異なる変異遺伝子型を示す。横線は,菌糸 末端の細胞が分裂して生じた同一遺伝子型を持つ細胞群を表す。
〔Kakoi et al. (2014), Fig. 2を改変。〕
図 4 フィルターろ過後の菌糸断片。(A)顕微鏡写真。バーは10μm。(B) 菌糸の長さのヒストグラム(n=48)。〔B は Kakoi et al.(2014)の Fig. S2A を転載。〕
図 5 サンガー法による波形データ。調べた38の変異のうち,9つの データを示す。変異塩基とそれに対応する野生株(WT)の塩基 を下線で示す。数字(nt)は, Frankia CcI3株ゲノム中での下線 塩基の位置を示す。6A1は窒素固定変異株, colony1から colony8
は表現型に依存せずに無作為に選択したコロニーである。〔Kakoi
et al. (2014)の Fig. 3を転載。〕
はそれぞれ単一の変異細胞のみからなることを示す。
9
つのコロニーは,見かけ上なんの異常表現型を示さないもの を無作為に選んだにも関わらず,すべてが変異を持っていた。こ のことは処理した細胞のほとんどに突然変異が起きていたことを 示唆する。原理的に,この方法では複数の遺伝子型の細胞を含む ヘテロなコロニーも出現しうるが(図3
),調べたコロニーの中 にそのようなものはなかった。変異原処理した直後の菌糸の長さ に対する,液体培養中に末端から伸長した菌糸の長さの比が大き いほど,ヘテロなコロニーの出現頻度は低くなる。私たちが用い た超音波処理や培養の条件では,その比が十分に大きかったと考 えられる。私たちはこの方法を Fragmentation and filtration 法と 名づけた。実際に Fragmentation and filtration 法を用いて窒素固定変異株 のスクリーニングを行った。本法に従って形成させた約
2400
の コロニーを,窒素源(アンモニア)を含む固体培地と含まない固 体培地とで培養した結果,1
つのコロニー(6
A1
株)が後者の培 地で遅い生育を示した。6
A1
株は野生株と比較して有意に低い窒 素固定活性を示した(図6
A)(Kakoi et al.,2014
)。Frankia CcI
3
株は褐色の色素を合成する。私たちは2400
のコ ロニーの中から,色素の合成がみられない白色のコロニーを単離 した(shiro1, shiro2, shiro3)(図6
B)(Kakoi et al.,2014
)。色 素欠損の表現型は継代培養を行っても維持された。これらの結果から,私たちが開発した Fragmentation and filtration 法を用いれば, Frankia おいて劣性の表現型を示す変 異株を単離できることが分かった。
10 .おわりに
窒素固定変異株のスクリーニングの結果は,
2014
年の栫らの 論文に記載されているものである(Kakoi et al.,2014
)。この時点 では変異株の出現頻度が低かったが,異なる変異原(ニトロソグ アニジンやガンマ線)を用いることでその問題は解決した。その 結果,約50
株の窒素固定変異体を単離し,現在詳しい解析を進 めている。また,長年の懸案事項だった形質転換が成功したとい う報告が,今年8
月に開催された18
th International Meeting on Frankia and Actinorhizal Plants でアメリカのグループによりなされた。これで変異体の原因変異をコンプリメンテーション法に より同定できることから,遂に Frankia で順遺伝学的な解析を 行える体制が整ったと言えよう。今後は窒素固定や共生に関わる
Frankiaに特有な遺伝子を単離・同定し,それらの作用機作を調
べていくことで,生物窒素固定の多様性についての理解を広げて いきたい。
要 旨
窒素固定は窒素ガスをアンモニアに還元する反応であり,生態 系への窒素養分の供給に重要な役割を担う。窒素固定を行う生物 は細菌に限られる。主にプロテオバクテリアに属する窒素固定細 菌の研究から多くの知見が得られ,窒素固定酵素の性質やその発 現制御には共通点があることが知られている。
Frankia は最初に発見された窒素固定能を持つ放線菌であり, 他の窒素固定細菌にはない特徴−ベシクルと呼ばれる窒素固定専 用細胞を分化する,非マメ科のアクチノリザル植物と共生するな ど−を持つ。私たちはこれらの形質に関わる遺伝子を順遺伝学的 に同定することを目的として,Frankia で突然変異株をスクリー ニングするための fragmentation and filtration 法を開発した。こ れは菌糸の末端の細胞が分裂するという性質を利用して,同一の 変異遺伝子型を持つ細胞のみからなる菌糸断片を濃縮するもので ある。コロニーのゲノム解析の結果から,そのような菌糸断片が 効率よく得られることが確認された。実際に,この方法で形成し た約
2400
のコロニーをスクリーニングしたところ,窒素固定や 色素合成に異常を示す変異株を単離できた。引用文献
1)Benson DR, Silvester WB (1993) Biology of Frankia strains, actinomycete symbionts of actinorhizal plants. Microbiol. Rev., 57, 293−319
2)Berndt H, Lowe DJ, Yates MG (1978) The nitrogen−fixing system of Corynebacterium autotrophicum. Purification and properties of the nitrogenase components and two ferredoxins. Eur. J. Biochem., 86, 133−142
3)Berry AM, Harriott OT, Moreau RA, Osman SF, Benson DR, Jones AD (1993) Hopanoid lipids compose the Frankia vesicle envelope, presumptive barrier of oxygen diffusion to nitrogenase. Proc. Natl. Acad. Sci. U. S. A., 90, 6091−6094
4)Biggins DR, Postgate JR (1969) Nitrogen fixation by cultures and cell-free extracts of Mycobacterium flavum 301. J. Gen. Microbiol., 56, 181−193
5)Cacciari I, Lippi D, Bordeleau LM (1979) Effect of oxygen on batch and continuous cultures of a nitrogen−fixing Arthrobacter sp. Can. J. Microbiol., 25, 746−751
6)Chabaud M, Gherbi H, Pirolles E et al. (2016) Chitinase−resistant hydrophilic symbiotic factors secreted by Frankia activate both Ca2+ spiking and NIN gene expression in the actinorhizal plant Casuarina glauca. New Phytol., 209, 86−93
7)Denarie J, Debelle F, Rosenberg C (1992) Signaling and host range variation in nodulation. Annu. Rev. Microbiol., 46, 497−531 8)Dixon R (2004) Histrical perspective−development of nif genetics
and regulation in Klebsiella pneumoniae. In: Genetics and regulation of nitrogen fixation in free−living bacteria, (Eds.) Klipp W, Masepohl B, Gallon JR, Newton WE, pp. 1−25, Kluwer Academic Publishers, Dordrecht, The Netherlands
図 6 Fragmentation and filtration 法で得られた変異株と野生株(WT)
の表現型。(A) 窒素固定変異株。縦軸は窒素固定(アセチレン還
元)活性を,横軸は窒素欠乏培地に移してからの時間を示す。3つ
の測定値の平均と標準誤差を示す。(B)色素合成変異株。〔Kakoi et al.(2014)の Fig. 4と Fig. 5を転載。〕
9)Dixon R, Kahn D (2004) Genetic regulation of biological nitrogen fixation. Nat. Rev. Microbiol., 2, 621−631
10)Eady RR (1996) Structure−function relationships of alternative nitrogenases. Chem. Rev., 96, 3013−3030
11)Gadkari D, Morsdorf G, Meyer O (1992) Chemolithoautotrophic assimilation of dinitrogen by Streptomyces thermoautotrophicus UBT1: identification of an unusual N2−fixing system. J. Bacteriol., 174, 6840−6843
12)Gtari M, Ghodhbane − Gtari F, Nouioui I, Beauchemin N, Tisa LS (2012) Phylogenetic perspectives of nitrogen−fixing actinobacteria. Arch. Microbiol., 194, 3−11
13)Gtari M, Ghodhbane−Gtari F, Nouioui I et al. (2015) Cultivating the uncultured: growing the recalcitrant cluster−2 Frankia strains. Sci. Rep., 5, 13112
14)Hartmann LS, Barnum SR (2010) Inferring the evolutionary history of Mo−dependent nitrogen fixation from phylogenetic studies of nifK and nifDK. J. Mol. Evol., 71, 70−85
15)Hill H (1992) Physiology of nitrogen fixation in free−living heteroprophs. In: Biological nitrogen fixation, (Eds.) Stacey G, Burris RH, Evans HJ, pp. 87−134, Chapman and Hall, New York 16)Kakoi K, Yamaura M, Kamiharai T et al. (2014) Isolation of
mutants of the nitrogen−fixing actinomycete Frankia. Microbes Environ., 29, 31−37
17)九町健一 (2013) 共生窒素固定放線菌 Frankia,生物工学会誌 , 91, 24−27
18)Normand P, Lapierre P, Tisa LS et al. (2007) Genome characteristics of facultatively symbiotic Frankia sp. strains reflect host range and host plant biogeography. Genome. Res., 17, 7−15
19)Ott T, Sullivan J, James EK et al. (2009) Absence of symbiotic leghemoglobins alters bacteroid and plant cell differentiation during development of Lotus japonicus root nodules. Mol. Plant Microbe Interact., 22, 800−808
20)Pankratov TA, Dedysh SN (2009) Cellulolytic Streptomycetes from Sphagnum peat bogs and factors controlling their activity. Microbiology, 78, 227−233
21)Persson T, Battenberg K, Demina IV et al. (2015) Candidatus Frankia Datiscae Dg1, the actinobacterial microsymbiont of Datisca glomerata, expresses the canonical nod genes nodABC in symbiosis with its host plant. PLoS One, 10, e0127630
22)Ribbe M, Gadkari D, Meyer O (1997) N2 fixation by Streptomyces thermoautotrophicus involves a molybdenum−dinitrogenase and a manganese−superoxide oxidoreductase that couple N2
reduction to the oxidation of superoxide produced from O2 by a molybdenum−CO dehydrogenase. J. Biol. Chem., 272, 26627− 26633
23)Silvester WB, Berg RH, Schwintzer CR, Tjepkema JD (2008) Oxygen responses, hemoglobin, and the structure and function of vesicles. In: Nitrogen−fixing actinothizal symbiosis, (Eds.) Pawlowski K, Newton WE, pp. 105−146, Springer, Dordrecht, The Netherlands
24)Thiel T (2004) Nitrogen fixation in heterocyst − forming cyanobacteria. In: Genetics and regulation of nitrogen fixation in free−living bacteria, (Eds.) Klipp W, Masepohl B, Gallon JR, Newton WE, pp. 73−110, Kluwer Academic Publishers, Dordrecht, The Netherlands
25)Valdes M, Perez NO, Estrada−de Los Santos P et al. (2005) Non− Frankia actinomycetes isolated from surface−sterilized roots of Casuarina equisetifolia fix nitrogen. Appl. Environ. Microbiol., 71, 460−466
26)山中高史・岡部宏秋 (2008) わが国に生育する放線菌根性植物と Frankia菌,森林総合研究所研究報告 , 7, 67−80
27)Young JPW (1992) Phylogenetic classification of nitrogen−fixing organisms. In: Biological nitrogen fixation, (Eds.) Stacey G, Burris RH, Evans HJ, pp. 43−86, Chapman and Hall, New York