薬 生 薬 審 発
0417
第
号
成
3 0
月
1 7
日
都
道
府
県
各
保 健 所 設 置 市
衛 生 主 管 部
局
長
殿
特
別
厚 生 労 働 省
薬
生 活 衛 生 局
薬 品 審 査 管 理 課 長
公
印
省
略
ュ
マ
遺 伝 子 組 換 え
製 剤
最 適 使 用 推 進 ガ
ン
性 皮 膚 炎
い
経 済 財 政 運 営
改 革
基 本 方 針
2016
成
28
月
日
議 決 定
お
い
革 新 的
薬 品
使 用
最 適 化 推 進 を 図
こ
が 盛
込 ま
こ
を
け
革 新 的
薬 品 を 真
必 要
患 者
提 供 す
最 適 使 用 推 進 ガ
ン を 作 成 す
こ
し
い ま す
今 般
ュ
マ
遺 伝 子 組 換 え
製 剤
販 売 名:
ュ
セ ン
皮 下
注
300 mg
ン
い
既 存 治 療
効 果 不 十 分
性 皮 膚 炎
対 し
使 用 す
際
留 意 事 項 を 別 添
お
最 適 使 用 推 進 ガ
ン
し
ま
ま し
そ
使 用
当
本 ガ
ン
別添
最適使用推進ガ
ン
ュ
マ
遺伝子組換え
販売名: ュ セン 皮下注300 ㎎ ン
~
性皮膚炎~
成
月
1
目
1. P2
2. 本剤 特徴 作用機序 P3
3. 臨床成績 P4
4. 施設 い P10
5. 投 対象 患者 P11
1
薬品 効性 安全性 確保 添付文書等 基 い 適 使用が求
さ 近 科学 術 進歩 抗体 薬品 等 革新 的 新規作用機序 を
す 薬品が 認 さ 中 こ 薬品を真 必要 す 患者 適 提供す こ
が喫緊 課題 お 経済財政運営 改革 基本方針 2016 成28 月 日
議決定 おい 革新的 薬品等 使用 最適化推進を図 こ さ い
新規作用機序を す 薬品 薬理作用や安全性 が既存 薬品 明
異 こ が あ こ 効性及び安全性 す 情報 が十分蓄積 さ ま
間 当該 薬品 恩恵を強く け こ が期待さ 患者 対し 使用す
副作用が発現し 際 必要 対応を こ が可能 一定 要件を す 療機 使用
す こ が重要 あ
し が 本ガ ン 開発段階やこ ま 得 い 学薬学的 科
学的見地 基 以下 薬品 最適 使用を推進す 観 必要 要件 考え方及
び留意事項を示す
お 本ガ ン 独立行政法人 薬品 療機器総合機 構 公益社団法人日本皮
膚科学会 一般社 団法人日本 学会及び日本臨床皮膚科 会 協力 作成し
対象 薬品: ュ セン 皮下注300 mg ン 一般名: ュ マ
遺伝子組換え
対象 効能又 効果:既存治療 効果不十分 性皮膚炎
対象 用法及び用量:通常 成人 ュ マ 遺伝子組換え し 初回 600mg
3
2 本剤 特徴 作用機序
ュ セン 皮下注300mg ン 一般名: ュ マ 遺伝子組換え 以下
本剤 Regeneron Pharmaceuticals, Inc.が創製し Interleukin IL -4 容体及びIL-13
容体を構成し い IL-4 容体 IL-4Rα ッ 結合し ガン
あ IL-4 及びIL-13 を介し 伝遉を阻害す 遺伝子組換え IgG4 モ
抗体 あ
IL-4 及び IL-13 を介し 伝遉経路 2 型炎症 応 2 型 T Th2 応
を含 及び Th2 細胞 活性化等 寄 し 性皮膚炎及び他 連す
性 性疾患 病態 重要 役割を果 す 考え い
1)
ま Th2細胞が
産生す ン 常表皮分化過程を 害し 表皮最終分化タン 質 発現を阻
害す こ 性皮膚炎 皮膚 損を引 起こし 増大さ
す 考え い 以 本剤 IL-4 及びIL-13 伝遉を阻害す こ
3 臨床成績
製造販売 認時 評価を行 主 臨床試験 成績を示す
1 外用薬併用 国際共 第Ⅲ相試験 R668-AD-1224 試験
試験 概要
Medium potency 日本 分類 ン 相当す 以 外用薬
以下 TCS 効果不十分 性皮膚炎患者 目標例数700 例 を対象 TCS
併用下 本剤 効性及び安全性を検討す セボ対照無作 化 重盲検並行
群間比較試験が日本 米国等 14 国 実施さ
本試験 投 期 52 逬 及び追跡調査期 12 逬 構成さ 用法 用量 本剤
300 mg 初回 600 mg を2 逬若しく 1 逬間隔又 セボを52 逬間皮下投 す こ
設定さ ン時 7 日以 前 一定用量 保 外用薬を併用す こ
設定さ ン時 TCS 治療を開始し そ 後 病勢が 束し 場合 中
す こ さ
1)
2 逬目以降 耐え難い症状が出現し 場合 救済治療
2)
が可能
さ
投 16 逬後 師 全般評価 コ 以下 IGA が1以下 ン
2以 減少し 被験者 割合 以下 IGA≦1遉成率 及びEczema area and severity index
以下 EASI コ が ン 75%以 改善し 被験者 割合 以下 EASI-75
遉成率 がco-primary endpoint さ
対象 患者 18 以 性皮膚炎患者 ン 時 以下 基
準を すこ さ
主 選択基準
米国皮膚科学会統一診断基準 3 以 前 診断
IGA コ 3 以 EASI コ 16 以 体表面積 占 性皮膚炎病変
割合 10%以 及びそう痒数値評価 以下 NRS コ 最高値
均値3 以
6 月以内 TCS 効果不十分 あ 旨 記録があ :効果不十分 Medium
potency 以 TCS 必要 応 ュ ン阻害外用薬 以下 TCI を
追加 を少 く 28 日間又 添付文書 推奨さ 最長期間 い 短い方
期間 連日投 し 寛解又 疾患活動性が い状態 IGA コ 0~2 を維持
いこ 定義さ 過去 6 月間 性皮膚炎 対す 全身性治療
記録があ 患者 TCS 効果不十分 さ
1)
皮膚炎 活動性が高い部 対し Medium potency TCS を1 日1 回外用し 病勢が 束し 後 Low potency 日 本 分類 ウ ~ 相当す TCS 替え1 日1 回7 日間外用後 中 す こ さ 再燃し 場合 Medium potency TCS 再開す こ さ Medium potency TCS 軽快し い 場合 安全性を考慮 High potency 日本 分類 ン 相当す 以 TCS を使用 す こ さ
2)
救済治療 High potency 以 TCS 経口 薬及び非 性免疫抑制薬が 師 裁量 使用可能 さ
5
結果
効性 解析対象集団 2 逬間隔投 群 Q2W 群 106 例 1 逬間隔投 群 QW 群
319 例及び セボ群 315 例 計740 例 あ ま 安全性 解析対象集団 Q2W
群110 例 QW 群315 例及び セボ群315 例 あ
効性
効性 co-primary endpoint あ 投 16 逬後 IGA≦1 遉成率及びEASI-75 遉成率
表 1 お あ セボ群 各本剤群 対比較 おい い 評価項目 お
い 統計学的 意 差が認 セボ 対す 本剤 300 mg 1 逬間隔投 及び
2 逬間隔投 優越性が検証さ
表1 投 16 逬後 IGA≦1 遉成率及びEASI-75 達成率 FAS NRI
Q2W 群 QW 群 セボ群
IGA≦1 遉成率 38.7 (41/106) 39.2 (125/319) 12.4 (39/315)
セボ群 差[95%信頼 間]
p 値
a) b)
26.3 [16.3, 36.3] <0.0001
26.8 [20.3, 33.3] <0.0001
EASI-75 遉成率 68.9 (73/106) 63.9 (204/319) 23.2 (73/315)
セボ群 差[95%信頼 間]
p 値a) b)
45.7 [35.7, 55.7] <0.0001
40.8 [33.7, 47.8] <0.0001
% 例数
中 例又 救済治療例 Non-responder し
a) 地域及び ン時 重症度 IGA コ 3 又 4 を層 し Cochran-Mantel-Haenszel 検定
b) セボ群 各本剤群 比較 おけ 意水準をそ 両側2.5% 設定す こ 検定 多重性を調整
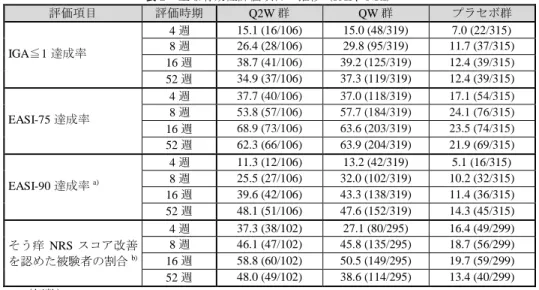
ま 主 効性評価項目 推移 表 2 お あ い 評価項目 おい 本
剤群が セボ群を 回 傾 が認 投 16 逬後以降 投 52 逬後ま 大 変動
表2 主 効性評価項目 推移 FAS NRI
評価項目 評価時期 Q2W 群 QW 群 セボ群
IGA≦1 遉成率
4 逬 15.1 (16/106) 15.0 (48/319) 7.0 (22/315)
8 逬 26.4 (28/106) 29.8 (95/319) 11.7 (37/315)
16 逬 38.7 (41/106) 39.2 (125/319) 12.4 (39/315)
52 逬 34.9 (37/106) 37.3 (119/319) 12.4 (39/315)
EASI-75 遉成率
4 逬 37.7 (40/106) 37.0 (118/319) 17.1 (54/315)
8 逬 53.8 (57/106) 57.7 (184/319) 24.1 (76/315)
16 逬 68.9 (73/106) 63.6 (203/319) 23.5 (74/315)
52 逬 62.3 (66/106) 63.9 (204/319) 21.9 (69/315)
EASI-90 遉成率
a)
4 逬 11.3 (12/106) 13.2 (42/319) 5.1 (16/315)
8 逬 25.5 (27/106) 32.0 (102/319) 10.2 (32/315)
16 逬 39.6 (42/106) 43.3 (138/319) 11.4 (36/315)
52 逬 48.1 (51/106) 47.6 (152/319) 14.3 (45/315)
そう痒NRS コ 改善 を認 被験者 割合b)
4 逬 37.3 (38/102) 27.1 (80/295) 16.4 (49/299)
8 逬 46.1 (47/102) 45.8 (135/295) 18.7 (56/299)
16 逬 58.8 (60/102) 50.5 (149/295) 19.7 (59/299)
52 逬 48.0 (49/102) 38.6 (114/295) 13.4 (40/299)
% 例数
中 例又 救済治療例 Non-responder し
a) EASI コ が ン 90%以 改善し 被験者 割合
b) そう痒NRS コ 日内最高値 逬 均が ン 4 以 下し 被験者 割合
安全性
害事象 Q2W 群91.8% 101/110 例 QW 群88.3% 278/315 例 セボ群88.3%
278/315 例 認 主 事象 表3 お あ
死亡 QW 群1 例 交通事故 認 が 治験薬 因果 係 否定さ 重
篤 害事象 Q2W 群3.6% 4/110 例 QW 群3.8% 12/315 例 セボ群6.3%
20/315 例 認 主 事象 性皮膚炎 Q2W 群1 例 QW 群1 例
セボ群1 例 あ
中 至 害事象 Q2W 群2.7% 3/110 例 QW 群2.9% 9/315 例 セボ
群8.3% 26/315 例 認
副作用 Q2W 群33.6% 37/110 例 QW 群35.2% 111/315 例 セボ群30.2% 95/315
例 認
表3 い 群 5%以 発現が認 害事象 安全性解析対象集団
Q2W 群
110 例
QW 群
315 例
セボ群
315 例
性皮膚炎 51 (46.4) 111 (35.2) 179 (56.8)
鼻咽頭炎 26 (23.6) 66 (21.0) 64 (20.3)
注射部 応 16 (14.5) 61 (19.4) 25 (7.9)
性結膜炎 12 (10.9) 48 (15.2) 17 (5.4)
気道感染 11 (10.0) 49 (15.6) 35 (11.1)
眼瞼炎 7 (6.4) 12 (3.8) 3 (1.0)
喘息 6 (5.5) 7 (2.2) 19 (6.0)
頭痛 5 (4.5) 26 (8.3) 19 (6.0)
口腔 4 (3.6) 17 (5.4) 10 (3.2)
ン エン 4 (3.6) 9 (2.9) 16 (5.1)
副鼻腔炎 2 (1.8) 19 (6.0) 9 (2.9)
7
2 本剤単独投 国際共 第 Ⅲ相試験 R668-AD-1334 試験
Medium potency 日本 分類 ン 相当す 以 TCS 効果不十分
又 安全性 理由等 TCSが推奨さ い 性皮膚炎患者を対象 本剤 効
性及び安全性を検討す セボ対照無作 化 重盲検並行 群間比較試験が 日本
米国等 10 国 実施さ
本試験 投 期 16 逬 及び追跡調査期 12 逬 構成さ 用法 用量 本剤
300 mg 初回 600 mg を2 逬若しく 1 逬間隔又 セボを16 逬間皮下投 す こ
設定さ ン時 7 日以 前 一定用量 保 外用薬を併用す こ
設定さ 耐え難い症状が出現し 際 救済治療
3)
が可能 さ
投 16 逬後 IGA≦1 遉成率及びEASI-75 遉成率がco-primary endpoint さ 対象
患者 18 以 性皮膚炎患者 ン 時 以下 基準を
すこ さ
主 選択基準
米国皮膚科学会統一診断基準 3 以 前 診断
IGA コ 3以 EASI コ 16以 体表面積 占 性皮膚炎病変
割合10%以 及びNRS コ 最高値 均値3 以
6 月以内 TCS 効果不十分又 安全性 理由等 TCSが推奨さ い旨
記録があ :効果不十分 Medium potency以 TCS 必要 応 TCIを追
加 を少 く 28 日間又 添付文書 推奨さ 最長期間 い 短い方 期
間 連日投 し 寛解又 疾患活動性が い状態 IGA コ 0~2 を維持
いこ 定義さ 過去 6 月間 性皮膚炎 対す 全身性治療 記録
があ 患者 TCS 効果不十分 さ 安全性 理由 治療
ッ を 回 治療不耐容 過敏症 応 著 皮膚萎縮 全身性
影響等 定義さ
結果
効性 解析対象集団 Q2W群224例 QW群223例及び セボ群224例 計671例
あ 安全性 解析対象集団 Q2W 群229例 QW 群 218例及び セボ群 222例
669 例 あ
3)
効性
効性 co-primary endpoint あ 投 16 逬後 IGA≦1 遉成率及び EASI-75 遉成率 表
4 お あ セボ群 各本剤群 対比較 おい い 評価項目 おい
統計学的 意 差が認 セボ 対す 本剤300 mg 1 逬間隔投 及び2 逬間隔
投 優越性が検証さ
表4 投 16 逬後 IGA≦1 遉成率及びEASI-75 達成率 FAS NRI
Q2W 群 QW 群 セボ群
IGA≦1 遉成率 37.9 (85/224) 37.2 (83/223) 10.3 (23/224)
セボ群 差[95%信頼 間]
p 値
a) b)
27.7 [20.2, 35.2] <0.0001
27.0 [19.5, 34.4] <0.0001
EASI-75 遉成率 51.3 (115/224) 52.5 (117/223) 14.7 (33/224)
セボ群 差[95%信頼 間]
p 値
a) b)
36.6 [28.6, 44.6] <0.0001
37.7 [29.7, 45.8] <0.0001
% 例数
中 例又 救済治療例 Non-responder し
a) 地域及び ン時 重症度 IGA コ 3 又 4 を層 し Cochran-Mantel-Haenszel 検定
b) セボ群 各本剤群 比較 おけ 意水準をそ 両側2.5% 設定す こ 検定 多重性を調整
ま 主 効性評価項目 推移 表25 お あ い 評価項目 おい
本剤群が セボ群を 回 傾 が認
表5 主 効性評価項目 推移 FAS NRI
評価項目 評価時期 Q2W 群 QW 群 セボ群
IGA≦1 遉成率
4 逬 12.9 (29/224) 12.1 (27/223) 2.7 (6/224)
8 逬 24.1 (54/224) 23.3 (52/223) 3.1 (7/224)
16 逬 37.9 (85/224) 37.2 (83/223) 10.3 (23/224)
EASI-75 遉成率
4 逬 27.2 (61/224) 28.7 (64/223) 6.3 (14/224)
8 逬 45.1 (101/224) 48.0 (107/223) 10.7 (24/224)
16 逬 51.3 (115/224) 52.5 (117/223) 14.7 (33/224)
EASI-90 遉成率
a)
4 逬 10.7 (24/224) 9.0 (20/223) 2.7 (6/224)
8 逬 20.5 (46/224) 27.8 (62/223) 4.0 (9/224)
16 逬 35.7 (80/224) 33.2 (74/223) 7.6 (17/224)
そう痒NRS コ 改善 を認 被験者 割合
b)
4 逬 16.0 (34/213) 23.4 (47/201) 6.1 (13/212)
8 逬 33.3 (71/213) 33.8 (68/201) 8.5 (18/212)
16 逬 40.8 (87/213) 40.3 (81/201) 12.3 (26/212)
% 例数
中 例又 救済治療例 Non-responder し
a) EASI コ が ン 90%以 改善し 被験者 割合
b) そう痒NRS コ 日内最高値 逬 均が ン 4 以 下し 被験者 割合
安全性
害事象 Q2W 群74.7% 171/229 例 QW 群69.3% 151/218 例 セボ群66.7%
148/222 例 認 主 事象 表6 お あ
死亡 認
重篤 害事象 Q2W 群3.1% 7/229 例 QW 群0.9% 2/218 例 セボ群5.4%
12/222 例 認 主 事象 性皮膚炎 Q2W 群2 例 セボ群3 例
あ
中 至 害事象 Q2W 群1.7% 4/229 例 QW 群1.8% 4/218 例 セボ
9
副作用 Q2W 群29.3% 67/229 例 QW 群31.2% 68/218 例 セボ群18.9% 42/222
例 認
表6 い 群 5%以 発現が認 害事象 安全性解析対象集団
Q2W 群
229 例
QW 群
218 例
セボ群
222 例
性皮膚炎 36 (15.7) 21 (9.6) 68 (30.6)
鼻咽頭炎 27 (11.8) 26 (11.9) 22 (9.9)
頭痛 21 (9.2) 11 (5.0) 13 (5.9)
注射部 応 19 (8.3) 41 (18.8) 13 (5.9)
性結膜炎 12 (5.2) 8 (3.7) 3 (1.4)
気道感染 7 (3.1) 12 (5.5) 7 (3.2)
4 施設 い
本剤が適応 患者 選択及び投 断 適 行わ こ が求
ま 本剤 投 重篤 副作用を発現し 際 対応す こ が必要 以下
~ す を す施設 おい 使用す あ
施設 い
性皮膚炎 病態 経過 予後 診断 治療 参考: 性皮膚炎診療ガ
ン を熟知し 本剤 い 十分 知識を し 性皮膚炎 診断
及び治療 精通す 師 下表 い 該当す 師 が当該診療科 本剤
す 治療 責任者 し 配置さ い こ
師免許 得後 初期研修を終了し 後 以 皮膚科診療 臨床研修を行 い こ
師免許 得後 初期研修を終了し 後 以 臨床経験を し い こ うち 以
性皮膚炎を含 診療 臨床研修を行 い こ
本剤 製造販売後 安全性 効性を評価す 製造販売後調査等が課
い こ 当該調査を適 実施 施設 あ こ
院内 薬品情報管理 体制 い
製薬企業等 効性 安全性等 薬学的情報 管理や 害事象が発生し 場合
適 対応 報告業 等を速や 行うこ 等 薬品情報管理 活用 体制が整
い こ
合併症及び副作用 対応 い
喘息等 合併す 他 性疾患を す 患者 本剤を投 す 場合 当該
性疾患を担当す 師 連携し そ 疾患管理 し 指導及び支援を
け 体制が整 い こ 6. 5)参照
等 使用 注意 記載さ 副作用 対し 当該施設又 近隣
療機 専門性を す 師 連携し 副作用 診断や対応 し 指導及び支援
11
5 投 対象 患者
患者選択 い 投 要否 断 あ 以下 該当す 患者 あ こ
を確認す
1. 性皮膚炎診療ガ ンを参考 性皮膚炎 確定診断が さ
い 患者 あ こ
2. 抗炎症外用薬 治療
a)
十分 効果が得 一定以 疾患活動性
b)
を す 成人 性皮膚炎患者 又 外用薬や ュ ン
阻害外用薬 対す 過敏症 著 局所性副作用若しく 全身性副作用
こ 抗炎症外用薬 治療 が困難 一定以 疾患活動性
b)
を す 成人 性皮膚炎患者 あ こ
a. 性 皮 膚炎 診療ガ ン 重症度 応 推奨 さ
外用薬 ン 以 や ュ ン阻害外用薬 適
治療を直近 月以 行 い
b. 以 下 い 該 当 す 状 態
IGA コ 3以
EASI コ 16 以 又 面 広範 強い炎症を伴う皮疹を す 場合
目安 し 頭頸部 EASI コ が2.4以
体表面積 占 性皮膚炎病変 割合10%以
投 あ
本剤 臨床試験 おけ 効性評価時期 投 開始後 16 逬時 を踏まえ 投 開
始 16 逬後ま 治療 応が得 い場合 本剤 投 を中 す こ ま
本剤投 中 定期的 効果 確認を行うこ
さ 外用薬や ュ ン阻害 外用薬等 併用 あ 程
度 期間 ヵ月を目安 す 寛解 維持が得 場合 こ 抗炎症外用
薬や外用保 薬が適 使用さ い こ を確認し 本剤 投 一時中 等
を検討す こ
お 症状が寛解し本剤投 を一時中 し 患者 性皮膚炎 再燃 際し
6 投 際し 留意す 事項
1 本剤 成分 対し過敏症 既往 あ 患者 い 本剤 投 が禁忌 あ
投 し いこ
2 ッ があ わ 可能性があ 本剤投 時 観察を十
分 行い 血圧 下 呼吸困難 意識消失 まい 嘔気 嘔 そう痒感 潮 等
異常が 場合 直ち 投 を中 し 適 処置を行うこ
3 本剤投 中 生ワ チン 接種 安全性が確認さ い い 避け こ
4 本剤 IL-4及びIL-13 阻害作用 2型免疫応答を抑制す 2型免疫応答 寄生
虫感染 対す 生体防御機能 し い 可能性があ 寄生虫感染患者 対し
本剤を投 す 前 寄生虫感染 治療を行うこ 患者が本剤投 中 寄生虫感染を起
こし 抗寄生虫薬 治療が無効 場合 寄生虫感染が治癒す ま 本剤 投
を一時中 す こ
5 本剤 投 喘息等 合併す 他 性疾患 症状が変化す 可能性が
あ 当該 性疾患 対す 適 治療を怠 場合 喘息等 症状が急激
悪化し 死亡 至 おそ あ 本剤投 中 後 疾患管理 含 本剤投 中
合併す 性疾患を担当す 師 適 連携す こ 患者 対し
師 指示 く そ 疾患 対す 治療内容を変更し い う指導す こ
6 外用薬等 不耐容 患者を除 治療開始時 外用薬等 抗
炎症外用薬及び外用保 薬 併用し 用い こ
7 添付文書 加え 製造販売業者が提供す 資料等 基 本剤 特性及び適 使用
必要 情報を十分理解し 使用す こ
8 本剤 RMPを熟読し 安全性検討事項確認す こ
参考文献