サムチレール内用懸濁液15%
に関する資料
本資料に記載された情報に係る権利及び内容の責任はグラクソ・スミ
スクライン株式会社に帰属するものであり、当該情報を適正使用以外
の営利目的に利用することはできません。
グラクソ・スミスクライン株式会社
1.4. 特許状況
、
( : ) 、
( : )。
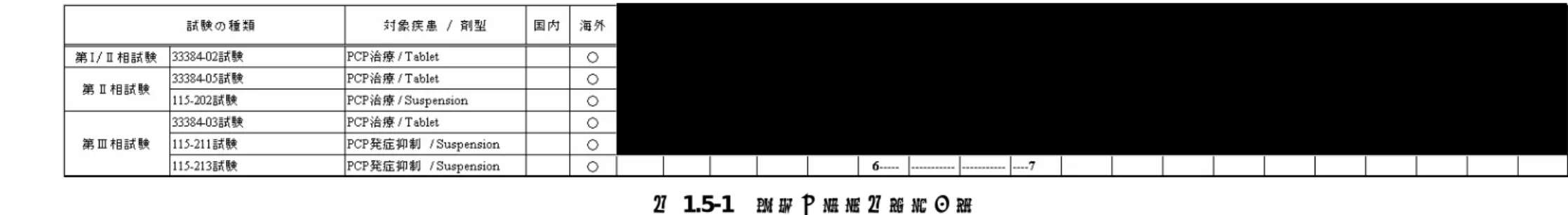
1.5. 起原または発見の経緯および開発の経緯 アトバコン(以下、本剤)は、Wellcome 社(現 GlaxoSmithKline 社)により開発された抗 ニューモシスチス活性を有するユビキノン類似体(hydroxy-1,4-naphthoquinone)である。 2011 年 2 月現在、米国、カナダ、フランス、英国、ドイツを含む世界 21 ヵ国でニューモシ スチス肺炎(以下、PCP)に対する標準的な治療(および予防)薬として承認されている。 1.5.1. 申請に至った経緯 本邦では、本剤は未承認薬であるが、厚生労働省エイズ治療薬研究班(班長 東京医科大 学主任教授 福武 勝幸)によりエイズ治療研究を目的に個人輸入され、国内医療機関に提供 されている。また、国立国際医療センター エイズ治療・研究開発センターも、エイズ治療 薬研究班とは別に個人輸入しており、本剤が PCP 治療の選択肢の一つとして使用されてい る。この状況を踏まえ、日本エイズ学会よりニューモシスチス肺炎の治療および予防を目的 とする本剤懸濁液の開発に関する要望書が提出され、厚生労働省医政局研究開発振興課およ び厚生労働省医薬食品局審査管理課より平成 21 年 9 月 28 日付医政研発 0928 第 1 号および 薬食審査発 0928 第 1 号にて「医療上の必要性が高い未承認の医薬品」として開発の要望に 関する意見に対する企業見解の提出が要請された。 グラクソ・スミスクライン株式会社は、この要請を受け、本剤懸濁液の本邦での承認申請 の可能性について検討した。その結果、本剤懸濁液は国内のガイドラインでは第三選択薬と なっているものの、国内で承認されている ST 合剤(第一選択薬)またはペンタミジン(第 二選択薬)を使用した半数以上の患者で副作用により投与の継続を断念せざるを得ない状況 にあり、本疾患の重篤性を考慮すると、本剤懸濁液は PCP の治療、一次予防(CD4<200 /mm3 の HIV 患者)および二次予防(再発抑制)に必要不可欠な薬剤であると評価した。ま た、海外で本剤の本適応疾患を対象とした臨床試験により有用性が確認され、評価に足る臨 床成績は十分に揃っていること、本邦での臨床試験成績をまとめた論文はないものの、日本 人に対する十分な使用実績があり、有用性を推測することは可能であることから、日本人患 者を対象とした臨床試験を実施することなく、本邦で申請可能であるとの企業見解を平成 21 年 11 月 6 日付けで厚生労働省医薬食品局審査管理課宛に提出した。この企業見解に基づ き、厚生労働省医政局研究開発振興課および厚生労働省医薬食品局審査管理課より、平成 22 年 5 月 21 日付医政研発 0521 第 1 号にて正式な開発要請がなされたことから、本剤懸濁 液の製造販売承認申請を行うこととした。 1.5.2. 申請資料の構成 本申請資料は、次に示す資料構成で作成した。 ① CMC:海外承認申請資料(NDA/MAA)を基に更新情報を反映させて作成した第 3 部か ら第 2 部を作成した。 ② 非臨床:海外承認申請資料(NDA/MAA)を基に第 2 部を作成した。 1.5. 起原または発見の経緯および開発の経緯
③ 臨床:海外承認申請資料(NDA/MAA)を基に第 2 部を作成した。さらに、市販後安全 性情報として直近 3 年間の PSUR(2005 年 12 月 1 日~2008 年 11 月 30 日)および日本人 患者における使用経験を提示した。 1.5.3. 起原または発見の経緯および開発の経緯 起原または発見の経緯および開発の経緯については、平成 13 年 6 月 21 日付医薬審発第 899 号厚生労働省医薬局審査管理課長通知「新医薬品の製造または輸入の承認申請に際し承 認申請書に添付すべき資料の作成要領について」の別紙 2 の 5(1)に作成要領が示されて いるが、その中の「当該内容が第 2 部(5)に記載できる場合は、第 1 部において提出を省 略することができる」との記述をもとに、当該内容をおもに第 2 部(5)に記載した。 表 1.5-1 に、第 2 部での当該内容の記載場所を示す。 また、開発の経緯図を図 1.5-1 に示す。 表 1.5-1 第 1 部(5)に関する内容の第 2 部における記載場所 第 1 部(5)に記載する内容 第 2 部での記載場所 起原 2.5.1.1 薬理学的分類 病態、診断および治療 2.5.1.2 ニューモシスチス肺炎の臨床的 /病態生理学的側面 2.5.1.3 現在の治療法およびその問題点 製剤の特徴 2.5.1.4 本剤の特徴 開発計画、開発の経緯 2.5.1.5 臨床開発計画 申請製剤、臨床試験に使用した製剤 2.3.P.2 製剤開発の経緯 非臨床試験成績(薬理、薬物動態、毒性) 2.4 非臨床試験の概括評価 2.4.2 薬理試験 2.4.3 薬物動態試験 2.4.4 毒性試験 1.5. 起原または発見の経緯および開発の経緯
図 1.5-1 開発の経緯図
1.5. 起原または発見の経緯および開発の経緯
1.5
- p.
図 1.5-1 開発の経緯図(続き)
1.5. 起原または発見の経緯および開発の経緯
1.5
- p.
1.6. 外国における使用状況等に関する資料 本項では、以下の資料を添付した。
1.6.1 米国における添付文書の原文および和訳 1.6.2 英国における添付文書の原文および和訳
1.6.3 企業中核データシート(COMPANY CORE DATASHEET)の原文
本剤は、初めて米国で、ニューモシスチス肺炎(以下、PCP)に対する治療薬としてアト バコン 250mg 錠(Mepron 250mg Tablet)が承認(1992 年 11 月 25 日)され、同 250mg 錠 (Wellvone 250mg Tablet)が、ドイツ(1994 年 8 月 4 日)、英国(1994 年 8 月 23 日)およ びフランス(1994 年 9 月 15 日)でそれぞれ承認された。その後、アトバコンの吸収を高め るためにアトバコンの超微粒子を用いた懸濁液剤が開発され、当該懸濁液剤(Mepron / Wellvone Oral Suspension:750mg/5mL)の承認を米国(1995 年 2 月 8 日)、フランス(1996 年 8 月 21 日)、英国(1997 年 3 月 25 日)およびドイツ(1997 年 4 月 17 日)でそれぞれ取 得した。さらに、同懸濁液剤に対する追加効能(PCP 予防)が米国において承認(1999 年 1 月 5 日)されている。 アトバコン 250mg 錠(Mepron/Wellvone 250mg Tablet)または懸濁液剤(Mepron/Wellvone Oral Suspension:750mg/5mL)が、米国、カナダ、フランス、英国、ドイツを含む海外 21 ヵ 国(2011 年 2 月現在)で PCP に対する治療(予防)薬として承認されている。 主要国(米国および英国)における懸濁液剤の承認状況を表 1.6-1 に示す。 表 1.6-1 米国および英国における懸濁液剤の承認の状況 国/ 地域 名 販売名 承認年月日 ・含量剤型 効能・効果 用法・用量 米国 Mepron (治療) 1995 年 2 月 8 日 (予防) 1999 年 1 月 5 日 経口懸濁 液剤 750 mg / 5mL 効能・効果: ・トリメトプリム/スルファメトキサゾール(TMP-SMX)合剤に 不耐容の患者におけるニューモシスチス・カリニ肺炎(PCP)の予防 ・その他、TMP-SMX 合剤に不耐容の患者における軽度から中等 度の PCP の急性期経口治療 用法・用量: ・PCP の予防:成人および青年(13~16 歳):1,500 mg(10 mL) を 1 日 1 回食後に経口投与。 ・軽度から中等度の PCP の治療:成人および青年(13~16 歳): 750 mg(5 mL)を 1 日 2 回 21 日間、食後に経口投与(1 日総投与 量 1,500 mg)。 英国 Wellvone (治療) 1997 年 3 月 25 日 経口懸濁 液剤 750 mg / 5mL 効能・効果: ・コトリモキサゾールによる治療に不耐容の患者における軽度か ら中等度のニューモシスチス肺炎(PCP)(室内気吸入下での肺 胞気・動脈血酸素分圧較差[(A-a)DO2]が 45 mmHg(6 kPa) 以下かつ動脈血酸素分圧(PaO2)が 60 mmHg(8 kPa)以上)の急 性期治療 用量・用法(成人): ・ニューモシスチス肺炎: 750 mg を 1 日 2 回(5 mL を朝と晩に 1 回ずつ)21 日間、食後に経 口投与。 1.6. 外国における使用状況等に関する資料
PRESCRIBING INFORMATION
MEPRON®
(atovaquone)
Suspension
DESCRIPTION
MEPRON (atovaquone) is an antiprotozoal agent. The chemical name of atovaquone is trans-2-[4-(4-chlorophenyl)cyclohexyl]-3-hydroxy-1,4-naphthalenedione. Atovaquone is a yellow crystalline solid that is practically insoluble in water. It has a molecular weight of 366.84 and the molecular formula C22H19ClO3. The compound has the following structural formula:
MEPRON Suspension is a formulation of micro-fine particles of atovaquone. The atovaquone particles, reduced in size to facilitate absorption, are significantly smaller than those in the previously marketed tablet formulation. MEPRON Suspension is for oral administration and is bright yellow with a citrus flavor. Each teaspoonful (5 mL) contains 750 mg of atovaquone and the inactive ingredients benzyl alcohol, flavor, poloxamer 188, purified water, saccharin sodium, and xanthan gum.
MICROBIOLOGY
Mechanism of Action: Atovaquone is a hydroxy-1,4-naphthoquinone, an analog of
ubiquinone, with antipneumocystis activity. The mechanism of action against Pneumocystis
carinii has not been fully elucidated. In Plasmodium species, the site of action appears to be the
cytochrome bc1 complex (Complex III). Several metabolic enzymes are linked to the
mitochondrial electron transport chain via ubiquinone. Inhibition of electron transport by atovaquone will result in indirect inhibition of these enzymes. The ultimate metabolic effects of such blockade may include inhibition of nucleic acid and ATP synthesis.
Activity In Vitro: Several laboratories, using different in vitro methodologies, have shown the
IC50 (50% inhibitory concentration) of atovaquone against rat P. carinii to be in the range of 0.1
to 3.0 mcg/mL.
Drug Resistance: Phenotypic resistance to atovaquone in vitro has not been demonstrated for
P. carinii. However, in 2 patients who developed P. carinii pneumonia (PCP) after prophylaxis
with atovaquone, DNA sequence analysis identified mutations in the predicted amino acid sequence of P. carinii cytochrome b (a likely target site for atovaquone). The clinical significance of this is unknown.
CLINICAL PHARMACOLOGY
Pharmacokinetics: Absorption: Atovaquone is a highly lipophilic compound with low
aqueous solubility. The bioavailability of atovaquone is highly dependent on formulation and diet. The suspension formulation provides an approximately 2-fold increase in atovaquone bioavailability in the fasting or fed state compared to the previously marketed tablet formulation. The absolute bioavailability of a 750-mg dose of MEPRON Suspension administered under fed conditions in 9 HIV-infected (CD4 >100 cells/mm3) volunteers was 47% ± 15%. In the same study, the bioavailability of a 750-mg dose of the previously marketed tablet formulation was 23% ± 11%.
Administering atovaquone with food enhances its absorption by approximately 2 fold. In one study, 16 healthy volunteers received a single dose of 750 mg MEPRON Suspension after an overnight fast and following a standard breakfast (23 g fat: 610 kCal). The mean (±SD) area under the concentration-time curve (AUC) values were 324 ± 115 and 801 ± 320 hr●mcg/mL under fasting and fed conditions, respectively, representing a 2.6 ± 1.0-fold increase. The effect of food (23 g fat: 400 kCal) on plasma atovaquone concentrations was also evaluated in a multiple-dose, randomized, crossover study in 19 HIV-infected volunteers (CD4
<200 cells/mm3) receiving daily doses of 500 mg MEPRON Suspension. AUC was 280 ± 114 hr●mcg/mL when atovaquone was administered with food as compared to 169 ± 77 hr●mcg/mL under fasting conditions. Maximum plasma atovaquone concentration (Cmax) was 15.1 ± 6.1 and 8.8 ± 3.7 mcg/mL when atovaquone was administered with food and
under fasting conditions, respectively.
Dose Proportionality: Plasma atovaquone concentrations do not increase proportionally
with dose. When MEPRON Suspension was administered with food at dosage regimens of 500 mg once daily, 750 mg once daily, and 1,000 mg once daily, average steady-state plasma atovaquone concentrations were 11.7 ± 4.8, 12.5 ± 5.8, and 13.5 ± 5.1 mcg/mL, respectively. The corresponding Cmax concentrations were 15.1 ± 6.1, 15.3 ± 7.6, and 16.8 ± 6.4 mcg/mL.
When MEPRON Suspension was administered to 5 HIV-infected volunteers at a dose of 750 mg twice daily, the average steady-state plasma atovaquone concentration was 21.0 ± 4.9 mcg/mL and Cmax was 24.0 ± 5.7 mcg/mL. The minimum plasma atovaquone concentration (Cmin)
associated with the 750-mg twice-daily regimen was 16.7 ± 4.6 mcg/mL.
Distribution: Following the intravenous administration of atovaquone, the volume of
distribution at steady state (Vdss) was 0.60 ± 0.17 L/kg (n = 9). Atovaquone is extensively bound
to plasma proteins (99.9%) over the concentration range of 1 to 90 mcg/mL. In 3 HIV-infected children who received 750 mg atovaquone as the tablet formulation 4 times daily for 2 weeks, the cerebrospinal fluid concentrations of atovaquone were 0.04, 0.14, and 0.26 mcg/mL, representing less than 1% of the plasma concentration.
Elimination: The plasma clearance of atovaquone following intravenous (IV) administration
in 9 HIV-infected volunteers was 10.4 ± 5.5 mL/min (0.15 ± 0.09 mL/min/kg). The half-life of atovaquone was 62.5 ± 35.3 hours after IV administration and ranged from 67.0 ± 33.4 to
77.6 ± 23.1 hours across studies following administration of MEPRON Suspension. The half-life of atovaquone is long due to presumed enterohepatic cycling and eventual fecal elimination. In a study where 14C-labelled atovaquone was administered to healthy volunteers, greater than 94% of the dose was recovered as unchanged atovaquone in the feces over 21 days. There was little or no excretion of atovaquone in the urine (less than 0.6%). There is indirect evidence that
atovaquone may undergo limited metabolism; however, a specific metabolite has not been identified.
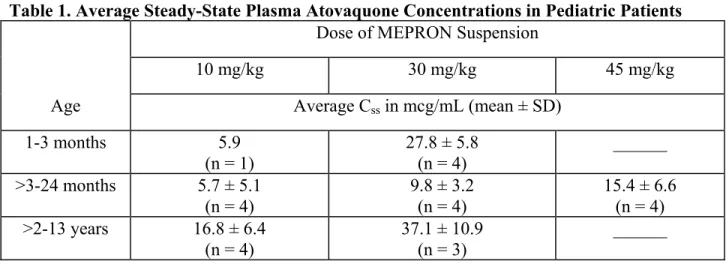
Special Populations: Pediatrics: In a study of MEPRON Suspension in 27 HIV-infected,
asymptomatic infants and children between 1 month and 13 years of age, the pharmacokinetics of atovaquone were age dependent. These patients were dosed once daily with food for 12 days. The average steady-state plasma atovaquone concentrations in the 24 patients with available concentration data are shown in Table 1.
Table 1. Average Steady-State Plasma Atovaquone Concentrations in Pediatric Patients
Dose of MEPRON Suspension
10 mg/kg 30 mg/kg 45 mg/kg
Age Average Css in mcg/mL (mean ± SD)
1-3 months 5.9 (n = 1) 27.8 ± 5.8 (n = 4) ______ >3-24 months 5.7 ± 5.1 (n = 4) 9.8 ± 3.2 (n = 4) 15.4 ± 6.6 (n = 4) >2-13 years 16.8 ± 6.4 (n = 4) 37.1 ± 10.9 (n = 3) ______
Hepatic/Renal Impairment: The pharmacokinetics of atovaquone have not been studied in
patients with hepatic or renal impairment.
Drug Interactions: Rifampin: In a study with 13 HIV-infected volunteers, the oral
administration of rifampin 600 mg every 24 hours with MEPRON Suspension 750 mg every 12 hours resulted in a 52% ± 13% decrease in the average steady-state plasma atovaquone concentration and a 37% ± 42% increase in the average steady-state plasma rifampin
concentration. The half-life of atovaquone decreased from 82 ± 36 hours when administered without rifampin to 50 ± 16 hours with rifampin.
Rifabutin, another rifamycin, is structurally similar to rifampin and may possibly have some of the same drug interactions as rifampin. No interaction trials have been conducted with MEPRON and rifabutin.
Trimethoprim/Sulfamethoxazole (TMP-SMX): The possible interaction between
atovaquone and TMP-SMX was evaluated in 6 HIV-infected adult volunteers as part of a larger multiple-dose, dose-escalation, and chronic dosing study of MEPRON Suspension. In this crossover study, MEPRON Suspension 500 mg once daily, or TMP-SMX tablets (160 mg trimethoprim and 800 mg sulfamethoxazole) twice daily, or the combination were administered with food to achieve steady state. No difference was observed in the average steady-state plasma atovaquone concentration after coadministration with TMP-SMX. Coadministration of
MEPRON with TMP-SMX resulted in a 17% and 8% decrease in average steady-state concentrations of trimethoprim and sulfamethoxazole in plasma, respectively. This effect is minor and would not be expected to produce clinically significant events.
Zidovudine: Data from 14 HIV-infected volunteers who were given atovaquone tablets
750 mg every 12 hours with zidovudine 200 mg every 8 hours showed a 24% ± 12% decrease in zidovudine apparent oral clearance, leading to a 35% ± 23% increase in plasma zidovudine AUC.
The glucuronide metabolite:parent ratio decreased from a mean of 4.5 when zidovudine was administered alone to 3.1 when zidovudine was administered with atovaquone tablets. This effect is minor and would not be expected to produce clinically significant events. Zidovudine had no effect on atovaquone pharmacokinetics.
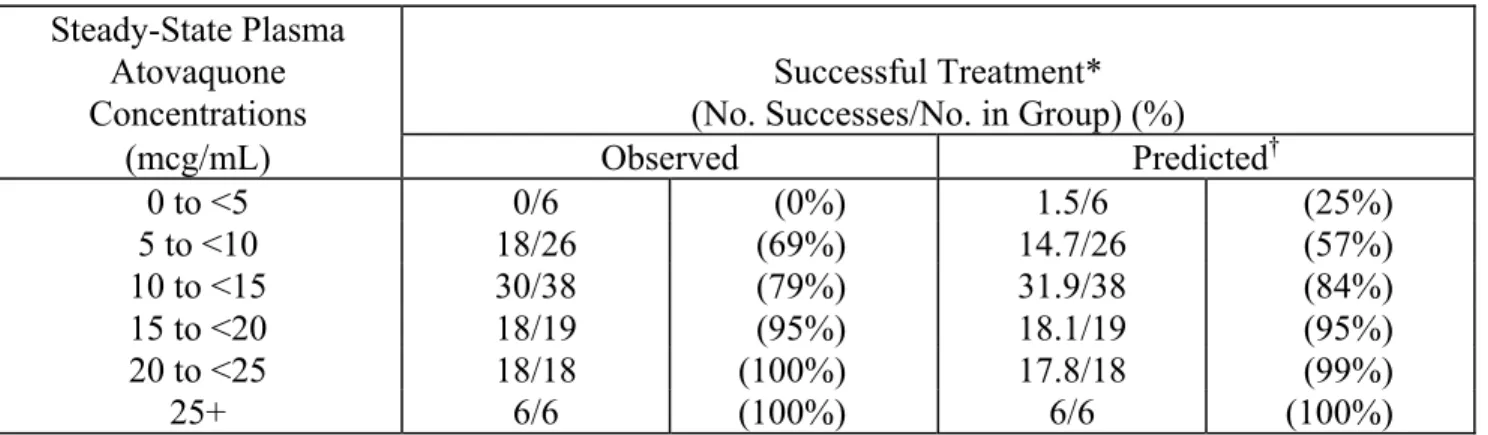
Relationship Between Plasma Atovaquone Concentration and Clinical Outcome:
In a comparative study of atovaquone tablets with TMP-SMX for oral treatment of
mild-to-moderate Pneumocystis carinii pneumonia (PCP) (see INDICATIONS AND USAGE), where AIDS patients received 750 mg atovaquone tablets 3 times daily for 21 days, the mean steady-state atovaquone concentration was 13.9 ± 6.9 mcg/mL (n = 133). Analysis of these data established a relationship between plasma atovaquone concentration and successful treatment. This is shown in Table 2.
Table 2. Relationship Between Plasma Atovaquone Concentration and Successful Treatment
Steady-State Plasma Atovaquone Concentrations
Successful Treatment* (No. Successes/No. in Group) (%)
(mcg/mL) Observed Predicted† 0 to <5 0/6 (0%) 1.5/6 (25%) 5 to <10 18/26 (69%) 14.7/26 (57%) 10 to <15 30/38 (79%) 31.9/38 (84%) 15 to <20 18/19 (95%) 18.1/19 (95%) 20 to <25 18/18 (100%) 17.8/18 (99%) 25+ 6/6 (100%) 6/6 (100%)
* Successful treatment was defined as improvement in clinical and respiratory measures
persisting at least 4 weeks after cessation of therapy. This was based on data from patients for which both outcome and steady-state plasma atovaquone concentration data are available.
† Based on logistic regression analysis.
A dosing regimen of MEPRON Suspension for the treatment of mild-to-moderate PCP has been selected to achieve average plasma atovaquone concentrations of approximately
20 mcg/mL, because this plasma concentration was previously shown to be well tolerated and associated with the highest treatment success rates (Table 2). In an open-label PCP treatment study with MEPRON Suspension, dosing regimens of 1,000 mg once daily, 750 mg twice daily, 1,500 mg once daily, and 1,000 mg twice daily were explored. The average steady-state plasma atovaquone concentration achieved at the 750-mg twice-daily dose given with meals was 22.0 ± 10.1 mcg/mL (n = 18).
INDICATIONS AND USAGE
MEPRON Suspension is indicated for the prevention of Pneumocystis carinii pneumonia in patients who are intolerant to trimethoprim-sulfamethoxazole (TMP-SMX).
MEPRON Suspension is also indicated for the acute oral treatment of mild-to-moderate PCP in patients who are intolerant to TMP-SMX.
Prevention of PCP: The indication for prevention of PCP is based on the results of 2 clinical
adult and adolescent patients at risk of PCP (CD4 count <200 cells/mm3 or a prior episode of PCP) and intolerant to TMP-SMX.
Dapsone Comparative Study: This randomized, open-label trial enrolled a total of 1,057
patients at 48 study centers. Patients were randomized to receive 1,500 mg MEPRON
Suspension once daily (n = 536) or 100 mg dapsone once daily (n = 521). Median follow-up was 24 months. Patients randomized to the dapsone arm who were seropositive for Toxoplasma
gondii and had a CD4 count <100 cells/mm3 also received pyrimethamine and folinic acid. PCP event rates are shown in Table 3. There was no significant difference in mortality rates between the groups.
Aerosolized Pentamidine Comparative Study: This randomized, open-label trial
enrolled a total of 549 patients at 35 study centers. Patients were randomized to receive 1,500 mg MEPRON Suspension once daily (n = 175), 750 mg MEPRON Suspension once daily (n = 188), or 300 mg aerosolized pentamidine once monthly (n = 186). Median follow-up was 11.3 months. The results of the PCP event rates appear in Table 3. There were no significant differences in mortality rates among the groups.
Table 3. Confirmed or Presumed/Probable PCP Events (As-Treated Analysis)* Study 115-211 Study 115-213 Assessment Atovaquone 1,500 mg/day (n = 527) Dapsone 100 mg/day (n = 510) Atovaquone 750 mg/day (n = 188) Atovaquone 1,500 mg/day (n = 172) Aerosolized Pentamidine 300 mg/month (n = 169) % 15% 19% 23% 18% 17% Relative Risk† (CI)‡ 0.77 (0.57, 1.04) 1.47 (0.86, 2.50) 1.14 (0.63, 2.06) * Those events occurring during or within 30 days of stopping assigned treatment.
† Relative risk <1 favors atovaquone and values >1 favor comparator. These trials were
designed to show superiority of atovaquone to the comparator. This was not shown.
‡ The confidence level of the interval for the dapsone comparative study was 95% and for the
pentamidine comparative study was 97.5%.
An analysis of all PCP events (intent-to-treat analysis) showed results similar to those above.
Treatment of PCP: The indication for treatment of mild-to-moderate PCP is based on the
results of comparative pharmacokinetic studies of the suspension and tablet formulations (see CLINICAL PHARMACOLOGY) and clinical efficacy studies of the tablet formulation which established a relationship between plasma atovaquone concentration and successful treatment. The results of a randomized, double-blind trial comparing MEPRON to TMP-SMX in AIDS patients with mild-to-moderate PCP (defined in the study protocol as an alveolar-arterial oxygen diffusion gradient [(A-a)DO2]1 ≤45 mm Hg and PaO2 ≥60 mm Hg on room air) and a
randomized trial comparing MEPRON to IV pentamidine isethionate in patients with
mild-to-moderate PCP intolerant to trimethoprim or sulfa-antimicrobials are summarized below:
TMP-SMX Comparative Study: This double-blind, randomized trial initiated in 1990 was
of AIDS patients with histologically confirmed PCP. Only patients with mild-to-moderate PCP were eligible for enrollment.
A total of 408 patients were enrolled into the trial at 37 study centers. Eighty-six patients without histologic confirmation of PCP were excluded from the efficacy analyses. Of the 322 patients with histologically confirmed PCP, 160 were randomized to receive MEPRON and 162 to TMP-SMX.
Study participants randomized to treatment with MEPRON were to receive 750 mg MEPRON (three 250-mg tablets) 3 times daily for 21 days and those randomized to TMP-SMX were to receive 320 mg TMP plus 1,600 mg SMX 3 times daily for 21 days.
Therapy success was defined as improvement in clinical and respiratory measures persisting at least 4 weeks after cessation of therapy. Therapy failures included lack of response, treatment discontinuation due to an adverse experience, and unevaluable.
There was a significant difference (P = 0.03) in mortality rates between the treatment groups. Among the 322 patients with confirmed PCP, 13 of 160 (8%) patients treated with MEPRON and 4 of 162 (2.5%) patients receiving TMP-SMX died during the 21-day treatment course or 8-week follow-up period. In the intent-to-treat analysis for all 408 randomized patients, there were 16 (8%) deaths in the arm treated with MEPRON and 7 (3.4%) deaths in the TMP-SMX arm (P = 0.051). Of the 13 patients treated with MEPRON who died, 4 died of PCP and 5 died with a combination of bacterial infections and PCP; bacterial infections did not appear to be a factor in any of the 4 deaths among TMP-SMX-treated patients.
A correlation between plasma atovaquone concentrations and death was demonstrated; in general, patients with lower plasma concentrations were more likely to die. For those patients for whom day 4 plasma atovaquone concentration data are available, 5 (63%) of the 8 patients with concentrations <5 mcg/mL died during participation in the study. However, only 1 (2.0%) of the 49 patients with day 4 plasma atovaquone concentrations ≥5 mcg/mL died.
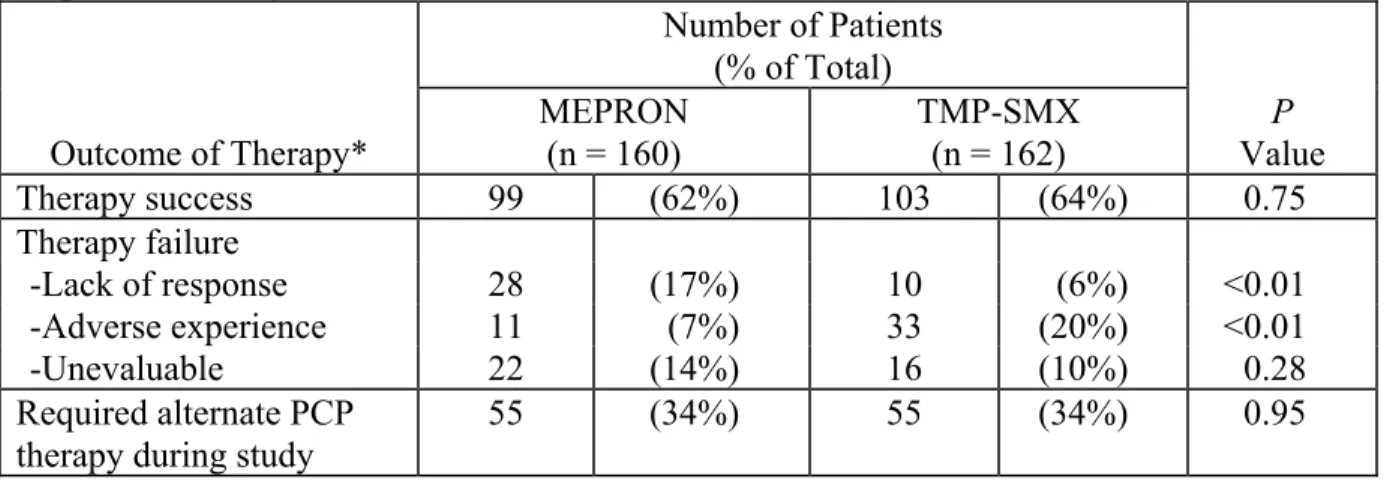
Sixty-two percent of patients on MEPRON and 64% of patients on TMP-SMX were classified as protocol-defined therapy successes (Table 4).
Table 4. Outcome of Treatment for PCP-Positive Patients Enrolled in the TMP-SMX Comparative Study Number of Patients (% of Total) Outcome of Therapy* MEPRON (n = 160) TMP-SMX (n = 162) P Value Therapy success 99 (62%) 103 (64%) 0.75 Therapy failure -Lack of response 28 (17%) 10 (6%) <0.01 -Adverse experience 11 (7%) 33 (20%) <0.01 -Unevaluable 22 (14%) 16 (10%) 0.28 Required alternate PCP therapy during study
55 (34%) 55 (34%) 0.95 * As defined by the protocol and described in study description above.
The failure rate due to lack of response was significantly larger for patients receiving
MEPRON while the failure rate due to adverse experiences was significantly larger for patients receiving TMP-SMX.
There were no significant differences in the effect of either treatment on additional indicators of response (i.e., arterial blood gas measurements, vital signs, serum LDH levels, clinical symptoms, and chest radiographs).
Pentamidine Comparative Study: This unblinded, randomized trial initiated in 1991 was
designed to compare the safety and efficacy of MEPRON to that of pentamidine for the treatment of histologically confirmed mild or moderate PCP in AIDS patients. Approximately 80% of the patients either had a history of intolerance to trimethoprim or sulfa-antimicrobials (the primary therapy group) or were experiencing intolerance to TMP-SMX with treatment of an episode of PCP at the time of enrollment in the study (the salvage treatment group).
Patients randomized to MEPRON were to receive 750 mg atovaquone (three 250-mg tablets) 3 times daily for 21 days and those randomized to pentamidine isethionate were to receive a 3- to 4-mg/kg single IV infusion daily for 21 days.
A total of 174 patients were enrolled into the trial at 22 study centers. Thirty-nine patients without histologic confirmation of PCP were excluded from the efficacy analyses. Of the 135 patients with histologically confirmed PCP, 70 were randomized to receive MEPRON and 65 to pentamidine. One hundred and ten (110) of these were in the primary therapy group and 25 were in the salvage therapy group. One patient in the primary therapy group randomized to receive pentamidine did not receive study medication.
There was no difference in mortality rates between the treatment groups. Among the
135 patients with confirmed PCP, 10 of 70 (14%) patients randomized to MEPRON and 9 of 65 (14%) patients randomized to pentamidine died during the 21-day treatment course or 8-week follow-up period. In the intent-to-treat analysis for all randomized patients, there were 11 (12.5%) deaths in the arm treated with MEPRON and 12 (14%) deaths in the pentamidine arm. For those patients for whom day 4 plasma atovaquone concentrations are available, 3 of 5 (60%) patients with concentrations <5 mcg/mL died during participation in the study. However, only 2 of 21 (9%) patients with day 4 plasma concentrations ≥5 mcg/mL died.
The therapeutic outcomes for the 134 patients who received study medication in this trial are presented in Table 5.
Table 5. Outcome of Treatment for PCP-Positive Patients Enrolled in the Pentamidine Comparative Study
Primary Treatment Salvage Treatment Outcome of Therapy MEPRON (n = 56) Pentamidine (n = 53) P Value MEPRON (n = 14) Pentamidine (n = 11) P Value Therapy success 32 (57%) 21 (40%) 0.09 13 (93%) 7 (64%) 0.14 Therapy failure -Lack of response 16 (29%) 9 (17%) 0.18 0 0 — -Adverse experience 2 (3.6%) 19 (36%) <0.01 0 3 (27%) 0.07 -Unevaluable 6 (11%) 4 (8%) 0.75 1 (7%) 1 (9%) 1.00 Required alternate PCP
therapy during study
19 (34%) 29 (55%) 0.04 0 4 (36%) 0.03
CONTRAINDICATIONS
MEPRON Suspension is contraindicated for patients who develop or have a history of potentially life-threatening allergic reactions to any of the components of the formulation.
WARNINGS
Clinical experience with MEPRON for the treatment of PCP has been limited to patients with mild-to-moderate PCP [(A-a)DO2≤45 mm Hg]. Treatment of more severe episodes of PCP has
not been systematically studied with this agent. Also, the efficacy of MEPRON in patients who are failing therapy with TMP-SMX has not been systematically studied.
PRECAUTIONS
General: Absorption of orally administered MEPRON is limited but can be significantly
increased when the drug is taken with food. Plasma atovaquone concentrations have been shown to correlate with the likelihood of successful treatment and survival. Therefore, parenteral
therapy with other agents should be considered for patients who have difficulty taking MEPRON with food (see CLINICAL PHARMACOLOGY). Gastrointestinal disorders may limit absorption of orally administered drugs. Patients with these disorders also may not achieve plasma
concentrations of atovaquone associated with response to therapy in controlled trials.
Based upon the spectrum of in vitro antimicrobial activity, atovaquone is not effective therapy for concurrent pulmonary conditions such as bacterial, viral, or fungal pneumonia or
mycobacterial diseases. Clinical deterioration in patients may be due to infections with other pathogens, as well as progressive PCP. All patients with acute PCP should be carefully evaluated for other possible causes of pulmonary disease and treated with additional agents as appropriate. Rare cases of hepatitis, elevated liver function tests, and one case of fatal liver failure have been reported in patients treated with atovaquone. A causal relationship between atovaquone use and these events could not be established because of numerous confounding medical conditions and concomitant drug therapies. (See ADVERSE REACTIONS.)
If it is necessary to treat patients with severe hepatic impairment, caution is advised and administration should be closely monitored.
Information for Patients: The importance of taking the prescribed dose of MEPRON should
be stressed. Patients should be instructed to take their daily doses of MEPRON with meals, as the presence of food will significantly improve the absorption of the drug.
Drug Interactions: Atovaquone is highly bound to plasma protein (>99.9%). Therefore,
caution should be used when administering MEPRON concurrently with other highly plasma protein-bound drugs with narrow therapeutic indices, as competition for binding sites may occur. The extent of plasma protein binding of atovaquone in human plasma is not affected by the presence of therapeutic concentrations of phenytoin (15 mcg/mL), nor is the binding of phenytoin affected by the presence of atovaquone.
Rifampin: Coadministration of rifampin and MEPRON Suspension results in a significant
decrease in average steady-state plasma atovaquone concentrations (see CLINICAL
PHARMACOLOGY: Drug Interactions). Alternatives to rifampin should be considered during the course of PCP treatment with MEPRON.
Rifabutin, another rifamycin, is structurally similar to rifampin and may possibly have some of the same drug interactions as rifampin. No interaction trials have been conducted with MEPRON and rifabutin.
Drug/Laboratory Test Interactions: It is not known if MEPRON interferes with clinical
laboratory test or assay results.
Carcinogenesis, Mutagenesis, Impairment of Fertility: Carcinogenicity studies in rats
were negative; 24-month studies in mice showed treatment-related increases in incidence of hepatocellular adenoma and hepatocellular carcinoma at all doses tested which ranged from 1.4 to 3.6 times the average steady-state plasma concentrations in humans during acute treatment of
Pneumocystis carinii pneumonia. Atovaquone was negative with or without metabolic activation
in the Ames Salmonella mutagenicity assay, the Mouse Lymphoma mutagenesis assay, and the Cultured Human Lymphocyte cytogenetic assay. No evidence of genotoxicity was observed in the in vivo Mouse Micronucleus assay.
Pregnancy: Pregnancy Category C. Atovaquone was not teratogenic and did not cause
reproductive toxicity in rats at plasma concentrations up to 2 to 3 times the estimated human exposure. Atovaquone caused maternal toxicity in rabbits at plasma concentrations that were approximately one half the estimated human exposure. Mean fetal body lengths and weights were decreased and there were higher numbers of early resorption and post-implantation loss per dam. It is not clear whether these effects were caused by atovaquone directly or were secondary to maternal toxicity. Concentrations of atovaquone in rabbit fetuses averaged 30% of the
concurrent maternal plasma concentrations. In a separate study in rats given a single
14C-radiolabelled dose, concentrations of radiocarbon in rat fetuses were 18% (middle gestation)
and 60% (late gestation) of concurrent maternal plasma concentrations. There are no adequate and well-controlled studies in pregnant women. MEPRON should be used during pregnancy only if the potential benefit justifies the potential risk to the fetus.
Nursing Mothers: It is not known whether atovaquone is excreted into human milk. Because
many drugs are excreted into human milk, caution should be exercised when MEPRON is administered to a nursing woman. In a rat study, atovaquone concentrations in the milk were 30% of the concurrent atovaquone concentrations in the maternal plasma.
Pediatric Use: Evidence of safety and effectiveness in pediatric patients has not been
established. A relationship between plasma atovaquone concentrations and successful treatment of PCP has been established in adults (see Table 2). In a study of MEPRON Suspension in 27 HIV-infected, asymptomatic infants and children between 1 month and 13 years of age, the
pharmacokinetics of atovaquone were age-dependent (see CLINICAL PHARMACOLOGY: Special Populations). No drug-related treatment-limiting adverse events were observed in the pharmacokinetic study.
Geriatric Use: Clinical studies of MEPRON did not include sufficient numbers of subjects
aged 65 and over to determine whether they respond differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients. In general, dose selection for an elderly patient should be cautious, reflecting the greater frequency of decreased hepatic, renal, or cardiac function, and of concomitant disease or other drug therapy.
ADVERSE REACTIONS
Because many patients who participated in clinical trials with MEPRON had complications of
advanced HIV disease, it was often difficult to distinguish adverse events caused by MEPRON from those caused by underlying medical conditions. There were no life-threatening or fatal adverse experiences caused by MEPRON.
PCP Prevention Studies: In the dapsone comparative study of MEPRON Suspension,
adverse experience data were collected only for treatment-limiting events. Among the entire population (n = 1,057), treatment-limiting events occurred at similar frequencies in patients treated with MEPRON Suspension or dapsone (Table 6). Among patients who were taking neither dapsone nor atovaquone at enrollment (n = 487), treatment-limiting events occurred in 43% of patients treated with dapsone and 20% of patients treated with MEPRON Suspension (P <0.001). In both populations, the type of treatment-limiting events differed between the 2 treatment arms. Hypersensitivity reactions (rash, fever, allergic reaction) and anemia were more common in patients treated with dapsone, while gastrointestinal events (nausea, diarrhea, and vomiting) were more common in patients treated with MEPRON Suspension.
Table 6. Treatment-Limiting Adverse Experiences in the Dapsone Comparative PCP Prevention Study
Percentage of Patients with Treatment-Limiting Adverse Experience All Patients
Patients Not Taking Either Drug at Enrollment Treatment-Limiting Adverse Experience MEPRON 1,500 mg/day (n = 536) Dapsone 100 mg/day (n = 521) MEPRON 1,500 mg/day (n = 238) Dapsone 100 mg/day (n = 249) Any event 24.4% 25.9% 20.2% 43.4% Rash 6.3% 8.8% 7.6% 16.1% Nausea 4.1% 0.6% 2.5% 0.8% Diarrhea 3.2% 0.2% 2.1% 0.4% Vomiting 2.2% 0.6% 1.3% 0.8% Allergic reaction 1.1% 2.9% 0.8% 4.8% Fever 0.6% 2.9% 0% 5.6% Anemia 0% 1.5% 0% 2.0%
Table 7 summarizes the clinical adverse experiences reported by ≥20% of patients in any group in the aerosolized pentamidine comparative study of MEPRON Suspension (n = 549), regardless of attribution. The incidence of adverse experiences at the recommended dose was similar to that seen with aerosolized pentamidine. Rash was the only individual adverse experience that occurred significantly more commonly in patients treated with both dosages of MEPRON Suspension (39% to 46%) than in patients treated with aerosolized pentamidine (28%). Among patients treated with MEPRON Suspension, there was no evidence of a dose-related increase in the incidence of adverse experiences. Treatment-limiting adverse experiences
occurred less often in patients treated with aerosolized pentamidine (7%) than in patients treated with 1,500 mg MEPRON Suspension once daily (25%, P≤0.001) or 750 mg MEPRON
Suspension once daily (16%, P = 0.004). The most common adverse experiences requiring discontinuation of dosing in the group receiving 1,500 mg MEPRON Suspension once daily were rash (6%), diarrhea (4%), and nausea (3%). The most common adverse experience requiring discontinuation of dosing in the group receiving aerosolized pentamidine was bronchospasm (2%).
Table 7. Treatment-Emergent Adverse Experiences in the Aerosolized Pentamidine Comparative PCP Prevention Study
Percentage of Patients with Treatment-Emergent Adverse Experience Treatment-Emergent Adverse Experience MEPRON 1,500 mg/day (n = 175) MEPRON 750 mg/day (n = 188) Aerosolized Pentamidine (n = 186) Diarrhea 42% 42% 35% Rash 39% 46% 28% Headache 28% 31% 22% Nausea 26% 32% 23% Cough increased 25% 25% 31% Fever 25% 31% 18% Rhinitis 24% 18% 17% Asthenia 22% 31% 31% Infection 22% 18% 19% Abdominal pain 20% 21% 20% Dyspnea 15% 21% 16% Vomiting 15% 22% 11%
Patients discontinuing therapy due to an adverse experience
25% 16% 7%
Patients reporting at least 1 adverse experience
98% 96% 89%
Other events occurring in ≥10% of the patients receiving the recommended dose of MEPRON included sweating, flu syndrome, pain, sinusitis, pruritus, insomnia, depression, and myalgia. Bronchospasm occurred more frequently in patients receiving aerosolized pentamidine (11%) than in patients receiving MEPRON 1,500 mg/day (4%) and MEPRON 750 mg/day (2%).
Neither MEPRON nor aerosolized pentamidine was associated with a substantial change from baseline values in any measured laboratory parameter, nor were there any significant differences in any measured laboratory parameter between MEPRON and aerosolized pentamidine. Some patients had laboratory abnormalities considered serious by the investigator or that contributed to discontinuation of therapy.
PCP Treatment Studies: Table 8 summarizes all the clinical adverse experiences reported by
≥5% of the study population during the TMP-SMX comparative study of MEPRON (n = 408), regardless of attribution. The incidence of adverse experiences with MEPRON Suspension at the recommended dose was similar to that seen with the tablet formulation of atovaquone.
Table 8. Treatment-Emergent Adverse Experiences in the TMP-SMX Comparative PCP Treatment Study
Percentage of Patients with Treatment-Emergent Adverse Experience Treatment-Emergent Adverse Experience MEPRON (n = 203) TMP-SMX (n = 205)
Rash (including maculopapular) 23% 34%
Nausea 21% 44% Diarrhea 19% 7% Headache 16% 22% Vomiting 14% 35% Fever 14% 25% Insomnia 10% 9% Asthenia 8% 8% Pruritus 5% 9% Monilia, oral 5% 10% Abdominal pain 4% 7% Constipation 3% 17% Dizziness 3% 8%
Patients discontinuing therapy due to an adverse experience
9% 24% Patients reporting at least 1 adverse
experience
63% 65% Although an equal percentage of patients receiving MEPRON and TMP-SMX reported at
least 1 adverse experience, more patients receiving TMP-SMX required discontinuation of therapy due to an adverse event. Twenty-four percent of patients receiving TMP-SMX were prematurely discontinued from therapy due to an adverse experience versus 9% of patients receiving MEPRON. Four percent of patients receiving MEPRON had therapy discontinued due to development of rash. The majority of cases of rash among patients receiving MEPRON were mild and did not require the discontinuation of dosing. The only other clinical adverse
experience that led to premature discontinuation of dosing of MEPRON by more than 1 patient was vomiting (<1%). The most common adverse experience requiring discontinuation of dosing in the TMP-SMX group was rash (8%).
Laboratory test abnormalities reported for ≥5% of the study population during the treatment period are summarized in Table 9. Two percent of patients treated with MEPRON and 7% of patients treated with TMP-SMX had therapy prematurely discontinued due to elevations in ALT/AST. In general, patients treated with MEPRON developed fewer abnormalities in measures of hepatocellular function (ALT, AST, alkaline phosphatase) or amylase values than patients treated with TMP-SMX.
Table 9. Treatment-Emergent Laboratory Test Abnormalities in the TMP-SMX Comparative PCP Treatment Study
Percentage of Patients Developing a Laboratory Test Abnormality
Laboratory Test Abnormality MEPRON TMP-SMX
Anemia (Hgb<8.0 g/dL) 6% 7%
Neutropenia (ANC<750 cells/mm3) 3% 9%
Elevated ALT (>5 x ULN) 6% 16%
Elevated AST (>5 x ULN) 4% 14%
Elevated alkaline phosphatase (>2.5 x ULN) 8% 6%
Elevated amylase (>1.5 x ULN) 7% 12%
Hyponatremia (<0.96 x LLN) 7% 26%
ULN = upper limit of normal range. LLN = lower limit of normal range.
Table 10 summarizes the clinical adverse experiences reported by ≥5% of the primary therapy study population (n = 144) during the comparative trial of MEPRON and intravenous
pentamidine, regardless of attribution. A slightly lower percentage of patients who received MEPRON reported occurrence of adverse events than did those who received pentamidine (63% vs 72%). However, only 7% of patients discontinued treatment with MEPRON due to adverse events, while 41% of patients who received pentamidine discontinued treatment for this reason (P<0.001). Of the 5 patients who discontinued therapy with MEPRON, 3 reported rash (4%). Rash was not severe in any patient. No other reason for discontinuation of MEPRON was cited more than once. The most frequently cited reasons for discontinuation of pentamidine therapy were hypoglycemia (11%) and vomiting (9%).
Table 10. Treatment-Emergent Adverse Experiences in the Pentamidine Comparative PCP Treatment Study (Primary Therapy Group)
Percentage of Patients with Treatment-Emergent Adverse Experience Treatment-Emergent Adverse Experience MEPRON (n = 73) Pentamidine (n = 71) Fever 40% 25% Nausea 22% 37% Rash 22% 13% Diarrhea 21% 31% Insomnia 19% 14% Headache 18% 28% Vomiting 14% 17% Cough 14% 1% Abdominal pain 10% 11% Pain 10% 10% Sweat 10% 3% Monilia, oral 10% 3% Asthenia 8% 14% Dizziness 8% 14% Anxiety 7% 10% Anorexia 7% 10% Sinusitis 7% 6% Dyspepsia 5% 10% Rhinitis 5% 7% Taste perversion 3% 13% Hypoglycemia 1% 15% Hypotension 1% 10%
Patients discontinuing therapy due to an adverse experience
7% 41% Patients reporting at least 1 adverse
experience
63% 72% Laboratory test abnormalities reported in ≥5% of patients in the pentamidine comparative
study are presented in Table 11. Laboratory abnormality was reported as the reason for
discontinuation of treatment in 2 of 73 patients who received MEPRON. One patient (1%) had elevated creatinine and BUN levels and 1 patient (1%) had elevated amylase levels. Laboratory abnormalities were the sole or contributing factor in 14 patients who prematurely discontinued pentamidine therapy. In the 71 patients who received pentamidine, laboratory parameters most frequently reported as reasons for discontinuation were hypoglycemia (11%), elevated creatinine levels (6%), and leukopenia (4%).
Table 11. Treatment-Emergent Laboratory Test Abnormalities in the Pentamidine Comparative PCP Treatment Study
Laboratory Test
Percentage of Patients Developing a Laboratory Test Abnormality
Abnormality MEPRON Pentamidine
Anemia (Hgb<8.0 g/dL) 4% 9%
Neutropenia (ANC<750 cells/mm3) 5% 9%
Hyponatremia (<0.96 x LLN) 10% 10%
Hyperkalemia (>1.18 x ULN) 0% 5%
Alkaline phosphatase (>2.5 x ULN) 5% 2%
Hyperglycemia (>1.8 x ULN) 9% 13%
Elevated AST (>5 x ULN) 0% 5%
Elevated amylase (>1.5 x ULN) 8% 4%
Elevated creatinine (>1.5 x ULN) 0% 7%
ULN = upper limit of normal range. LLN = lower limit of normal range.
Postmarketing Experience: In addition to adverse events reported from clinical trials, the
following events have been identified during post-approval use of MEPRON. Because they are reported voluntarily from a population of unknown size, estimates of frequency cannot be made. These events have been chosen for inclusion due to a combination of their seriousness, frequency of reporting, or potential causal connection to MEPRON.
Blood and Lymphatic System Disorders: Methemoglobinemia, thrombocytopenia. Immune System Disorders: Hypersensitivity reactions including angioedema,
bronchospasm, throat tightness, and urticaria.
Eye Disorders: Vortex keratopathy.
Gastrointestinal Disorders: Pancreatitis.
Hepatobiliary Disorders: Rare cases of hepatitis, and one case of fatal liver failure have been reported with atovaquone usage.
Skin and Subcutaneous Tissue Disorders: Erythema multiforme, Stevens-Johnson syndrome, and skin desquamation have been reported in patients receiving multiple drug therapy including atovaquone.
Renal and Urinary Disorders: Acute renal impairment.
OVERDOSAGE
There is no known antidote for atovaquone, and it is currently unknown if atovaquone is
dialyzable. The median lethal dose is higher than the maximum oral dose tested in mice and rats (1,825 mg/kg/day). Overdoses up to 31,500 mg of atovaquone have been reported. In 1 such patient who also took an unspecified dose of dapsone, methemoglobinemia occurred. Rash has also been reported after overdose.
DOSAGE AND ADMINISTRATION
Dosage: Prevention of PCP: Adults and Adolescents (13 to 16 Years): The
Treatment of Mild-to-Moderate PCP: Adults and Adolescents (13 to 16 Years):
The recommended oral dose is 750 mg (5 mL) administered with meals twice daily for 21 days (total daily dose 1,500 mg).
Note: Failure to administer MEPRON Suspension with meals may result in lower plasma atovaquone concentrations and may limit response to therapy (see CLINICAL
PHARMACOLOGY and PRECAUTIONS).
Administration: Foil Pouch: Open pouch by removing tab at perforation and tear at notch.
Take entire contents by mouth. Can be discharged into a dosing spoon or cup or directly into the mouth.
Bottle: SHAKE BOTTLE GENTLY BEFORE USING.
HOW SUPPLIED
MEPRON Suspension (bright yellow, citrus flavored) containing 750 mg atovaquone in each
teaspoonful (5 mL).
Bottle of 210 mL with child-resistant cap (NDC 0173-0665-18).
Store at 15° to 25°C (59° to 77°F). DO NOT FREEZE. Dispense in tight container as
defined in USP.
5-mL child-resistant foil pouch - unit dose pack of 42 (NDC 0173-0547-00). Store at 15° to 25°C (59° to 77°F). DO NOT FREEZE.
1(A-a)DO
2 = [(713 x FiO2 ) – (PaCO2/0.8)] – PaO2 (mm Hg)
GlaxoSmithKline
Research Triangle Park, NC 27709
©2008, GlaxoSmithKline. All rights reserved.
添付文書
MEPRON
®(atovaquone)
懸濁液
性状 MEPRON(atovaquone)は抗原虫剤である。化学名はtrans-2-[4-(4-chlorophenyl)cyclohexyl]-3-hydroxy-1,4-naphthalenedioneで、水にほとんど溶けない黄色の 結晶性固体である。分子量は 366.84、分子式はC22H19ClO3で、以下の化学構造を有する。 MEPRON 懸濁液は、atovaquone の超微粒子製剤である。吸収を高めるために小さく したatovaquone の粒子は、すでに市販されている錠剤製剤の粒子よりもはるかに小さ い。MEPRON 懸濁液は経口用製剤で、色は鮮黄色、味は柑橘系である。小さじ 1 杯 (5 mL)中に、atovaquone 750 mg と添加物としてベンジルアルコール、香料、 Poloxamer 188、精製水、サッカリンナトリウムおよびキサンタンガムを含有する。 微生物学 作用機序:Atovaquoneはhydroxy-1,4-naphthoquinoneというユビキノン類似体で、抗ニュ ーモシスティス活性を有する。ニューモシスティス・カリニに対する作用機序は、完全 には解明されていない。マラリア原虫属においては、チトクロムbc1複合体(複合体 III)が作用部位であると思われる。ユビキノンを介するミトコンドリア電子伝達鎖には いくつかの代謝酵素が関係している。Atovaquoneは電子伝達を阻害することにより、こ れらの酵素を間接的に阻害する。このような阻害による代謝への影響として、最終的に 核酸およびATPの合成が阻害されると考えられる。 In Vitroでの活性:In vitroでのさまざまな方法を用いたいくつかの検査室において、ラ ットのニューモシスティス・カリニに対するatovaquoneのIC50(50%阻害濃度)は、0.1 ~3.0 mcg/mLであることが確認されている。 薬剤耐性:ニューモシスティス・カリニについては、in vitroにおいて、atovaquoneに対 する表現型耐性は認められていない。しかし、atovaquoneの予防投与後にニューモシス ティス・カリニ肺炎(PCP)を発症した 2 例において、DNA配列解析により、ニューモ システィス・カリニのチトクロムb(atovaquoneの推定標的部位)の推定アミノ酸配列 に変異が認められた。この変異の臨床的意義は不明である。臨床薬理 薬物動態:吸収:Atovaquoneは、水に溶けにくい高親油性の化合物である。バイオアベ イラビリティは製剤や食事の内容によって大きく異なる。本懸濁液製剤では、空腹時ま たは食後のatovaquoneのバイオアベイラビリティは、すでに市販されている錠剤製剤の 約2 倍となる。MEPRON懸濁液 750 mgをHIV感染患者(CD4 が 100 個/mm3超)9 例に 食後投与したときの絶対バイオアベイラビリティは、47±15%であった。同試験におい て、すでに市販されている錠剤製剤750 mgの投与後のバイオアベイラビリティは、23 ±11%であった。 Atovaquoneを食後に投与すると、吸収率が約 2 倍上昇する。ある試験において、健康 志願者16 例にMEPRON懸濁液 750 mgを一晩絶食後と標準的な朝食(脂肪 23 g、 610 kCal)の摂取後にそれぞれ単回投与したところ、濃度時間曲線下面積(AUC)の平 均値(±SD)は、空腹時で 324±115 hr·mcg/mL、食後で 801±320 hr·mcg/mLであり、 食後では吸収率が2.6±1.0 倍上昇した。また、HIV感染患者(CD4 が 200 個/mm3未満) 19 例にMEPRON懸濁液 500 mgを連日投与する無作為化反復投与クロスオーバー試験に おいて、食事(脂肪 23 g、400 kCal)による血漿中atovaquone濃度への影響も検討した。 その結果、AUCは、食後投与で 280±114 hr·mcg/mL、空腹時投与で 169±77 hr·mcg/mL であった。最高血漿中atovaquone濃度(Cmax)は、食後投与で15.1±6.1、空腹時投与で 8.8±3.7 mcg/mLであった。 用量比例性:血漿中atovaquone濃度は用量比例的には上昇しない。MEPRON懸濁液を 500、750 および 1,000 mgの用量で 1 日 1 回食後投与したときの定常状態の平均血漿中 atovaquone濃度はそれぞれ、11.7±4.8、12.5±5.8 および 13.5±5.1 mcg/mLであった。対 応するCmaxはそれぞれ、15.1±6.1、15.3±7.6 および 16.8±6.4 mcg/mLであった。 MEPRON懸濁液をHIV感染患者 5 例に 750 mg 1 日 2 回投与したときの定常状態の平均 血漿中atovaquone濃度は 21.0±4.9 mcg/mLで、Cmaxは24.0±5.7 mcg/mLであった。 750 mgを 1 日 2 回投与したときの最低血漿中atovaquone濃度(Cmin)は、16.7± 4.6 mcg/mLであった。 分布:Atovaquoneの静脈内投与後における定常状態の分布容積(Vdss)は、0.60± 0.17 L/kg(n=9)であった。Atovaquoneは、1~90 mcg/mLの濃度範囲にわたって高い血 漿蛋白結合率(99.9%)を示す。HIV感染小児 3 例にatovaquoneの 750 mg錠剤製剤を 1 日4 回、2 週間投与したところ、脳脊髄液中atovaquone濃度はそれぞれ、0.04、0.14 およ び0.26 mcg/mLで、血漿中濃度の 1%未満であった。 排泄:HIV感染患者 9 例における静脈内(IV)投与後のatovaquoneの血漿クリアラン スは、10.4±5.5 mL/min(0.15±0.09 mL/min/kg)であった。IV投与後のatovaquoneの半 減期は62.5±35.3 時間で、MEPRON懸濁液を用いた試験全体で 67.0±33.4~77.6±23.1 時間であった。Atovaquoneは、腸肝循環を経て、最終的に糞中に排泄されるため、半減 期が長い。健康志願者に14Cで標識したatovaquoneを投与した試験では、21 日間で投与 量の94%超がatovaquoneの未変化体として糞中に排泄された。尿中にはほとんど、ある いはまったく排泄されない(0.6%未満)。Atovaquoneはわずかに代謝されるということ を示す間接的なエビデンスが存在するが、特定の代謝物は同定されていない。 特別な集団:小児:生後1 ヵ月から 13 歳までの無症候性HIV感染乳幼児および小児 27 例を対象としたMEPRON懸濁液の試験において、atovaquoneは年齢依存的な薬物動態を
示した。これらの患者には1 日 1 回 12 週間、食後に投与を行った。濃度データが得ら れた24 例における定常状態の平均血漿中atovaquone濃度を表 1 に示す。 表1. 小児患者における定常状態の平均血漿中 Atovaquone 濃度 MEPRON 懸濁液の用量 10 mg/kg 30 mg/kg 45 mg/kg 年齢 平均Css[mcg/mL](平均 ± SD) 1 ヵ月超 3 ヵ月以下 5.9 (n = 1) 27.8 ± 5.8 (n = 4) ______ 3 ヵ月超 24 ヵ月以下 5.7 ± 5.1 (n = 4) 9.8 ± 3.2 (n = 4) 15.4 ± 6.6 (n = 4) 2 歳超 13 歳以下 16.8 ± 6.4 (n = 4) 37.1 ± 10.9 (n = 3) ______ 肝/腎機能障害:肝/腎機能障害を有する患者を対象としたatovaquoneの薬物動態試 験は、これまでに実施されていない。 薬物相互作用:リファンピン:HIV感染患者 13 例を対象とした試験において、リファ ンピン600 mg(24 時間ごと)とMEPRON懸濁液 750 mg(12 時間ごと)の併用経口投 与を行ったところ、定常状態の平均血漿中atovaquone濃度は 52±13%低下し、定常状態 の平均血漿中リファンピン濃度は37±42%上昇した。Atovaquoneの半減期は、リファン ピン非併用での82±36 時間から、リファンピン併用では 50±16 時間に短縮した。 同じくリファマイシン系であるリファブチンは、リファンピンと構造が類似してお り、リファンピンと同様の薬物相互作用を示す可能性がある。MEPRON とリファブチ ンの相互作用試験は、これまでに実施されていない。 トリメトプリム/スルファメトキサゾール(TMP-SMX)合剤:大規模なMEPRON懸 濁液の反復投与・用量漸増・慢性投与試験の一環として、HIV感染成人患者 6 例を対象 に、atovaquoneとTMP-SMX合剤との相互作用の可能性について検討した。このクロス オーバー試験では、MEPRON懸濁液 500 mg 1 日 1 回投与、TMP-SMX錠(トリメトプリ ム160 mgとスルファメトキサゾール 800 mgの合剤)1 日 2 回投与またはこれらの併用 投与を定常状態に達するまで食後に行った。TMP-SMX合剤との併用投与では、定常状 態の平均血漿中atovaquone濃度に差は認められなかった。一方、MEPRONとTMP-SMX 合剤の併用投与では、トリメトプリムおよびスルファメトキサゾールの定常状態の平均 血漿中濃度がそれぞれ、17%および 8%低下した。この影響はごく小さなものであり、 臨床的に問題となる事象を引き起こすことはないと予測される。 ジドブジン:HIV感染患者 14 例に、atovaquone錠 750 mgの 12 時間ごと 1 回およびジ ドブジン200 mgの 8 時間ごと 1 回の投与を行ったところ、ジドブジンの見かけの経口 クリアランスが24±12%低下し、その結果、ジドブジンの血漿中AUCが 35±23%増加 した。グルクロニド代謝物と未変化体の比は、ジドブジン単独投与後の平均値である 4.5 から、ジドブジンとatovaquone錠の併用投与後では 3.1 に低下した。この影響はごく
小さなものであり、臨床的に問題となる事象を引き起こすことはないと予測される。ジ ドブジンはatovaquoneの薬物動態に影響を及ぼさなかった。 血漿中atovaquone濃度と臨床転帰の関連性:軽度から中等度のニューモシスティス・ カリニ肺炎(PCP)の経口治療(「効能・効果」の項参照)におけるatovaquone錠と TMP-SMX合剤を比較した試験において、AIDS患者にatovaquone 750 mg錠を 1 日 3 回、 21 日間投与したときの定常状態の平均atovaquone濃度は 13.9±6.9 mcg/mL(n=133 例) であった。これらのデータを解析した結果、血漿中atovaquone濃度と奏効率との間に関 連性が認められた。この結果を表2 に示す。 表 2. 血漿中 atovaquone 濃度と奏効率の関連性 定常状態の血漿中 Atovaquone 濃度 奏効率* (奏効例数/群内総例数)(%) (mcg/mL) 実測値 予測値† 0~<5 0/6 (0%) 1.5/6 (25%) 5~<10 18/26 (69%) 14.7/26 (57%) 10~<15 30/38 (79%) 31.9/38 (84%) 15~<20 18/19 (95%) 18.1/19 (95%) 20~<25 18/18 (100%) 17.8/18 (99%) 25~ 6/6 (100%) 6/6 (100%) * 奏効とは、臨床的および呼吸指標の改善が投与中止後 4 週間以上持続した状態と定 義した。これは、転帰データおよび定常状態の血漿中atovaquone 濃度のデータのい ずれもが得られた患者のデータに基づく結果である。 † ジスティック回帰解析に基づく。 軽度から中等度の PCP の治療のための MEPRON 懸濁液の用量は、平均血漿中 atovaquone 濃度が約 20 mcg/mL に達する用量を選択した。それは、この血漿中濃度が良 好な忍容性を示し、最も高い奏効率をもたらすことがこれまでに確認されているためで ある(表2)。MEPRON 懸濁液を用いた非盲検 PCP 治療試験において、1,000 mg 1 日 1 回、750 mg 1 日 2 回、1,500 mg 1 日 1 回および 1,000 mg 1 日 2 回という用量を探索的に 検討した。750 mg 1 日 2 回の食後投与で達した定常状態の平均血漿中 atovaquone 濃度は、 22.0±10.1 mcg/mL(n=18)であった。 効能・効果 MEPRON 懸濁液は、トリメトプリム/スルファメトキサゾール(TMP-SMX)合剤に 不耐容の患者におけるニューモシスティス・カリニ肺炎の予防を適応とする。 その他、MEPRON 懸濁液は、TMP-SMX 合剤に不耐容の患者における軽度から中等 度のPCP の急性期経口治療を適応とする。 PCPの予防:PCPの予防という適応は、PCPのリスクがあり(CD4 数が 200 個/mm3未満 またはPCP発症の既往歴がある)、TMP-SMX合剤に不耐容のHIV感染成人および青年 患者を対象として、MEPRON懸濁液をダプソンまたは噴霧用ペンタミジンと比較した 2 件の臨床試験の結果に基づいている。
ダプソンとの比較試験:この無作為化非盲検試験には、48 施設にて計 1,057 例の患 者が組み入れられた。これらの患者をMEPRON懸濁液 1,500 mg 1 日 1 回投与群(n= 536)またはダプソン 100 mg 1 日 1 回投与群(n=521)のいずれかに無作為に割り付け た。追跡期間中央値は24 ヵ月であった。ダプソン群に割り付けられた患者のうち、ト キソプラズマ原虫が血清抗体陽性で、CD4 数が 100 個/mm3未満であった患者には、ピ リメタミンおよびフォリン酸の投与も行った。PCPイベントの発生率を表 3 に示す。死 亡率に有意な群間差は認められなかった。 噴霧用ペンタミジンとの比較試験:この無作為化非盲検試験には、35 施設にて計 549 例の患者が組み入れられた。これらの患者をMEPRON懸濁液 1,500 mg 1 日 1 回投与 群(n=175)、MEPRON懸濁液 750 mg 1 日 1 回投与群(n=188)または噴霧用ペンタ ミジン300 mg月 1 回投与群(n=186)のいずれかに無作為に割り付けた。追跡期間中 央値は11.3 ヵ月であった。PCPイベントの発生率を表 3 に示す。死亡率に有意な群間差 は認められなかった。 表3. PCP が確定診断または推定診断された/疑われたイベントの発生率 (As-Treated 解析)* 115-211 試験 115-213 試験 評価項目 Atovaquone 1,500 mg/日 (n = 527) ダプソン 100 mg/日 (n = 510) Atovaquone 750 mg/日 (n = 188) Atovaquone 1,500 mg/日 (n = 172) 噴霧用ペン タミジン 300 mg/月 (n = 169) % 15% 19% 23% 18% 17% 相対リスク† (CI)‡ 0.77 (0.57, 1.04) 1.47 (0.86, 2.50) 1.14 (0.63, 2.06) * 割付け治療中または終了後 30 日以内に発生したイベント † 相対リスクが1 を下回ればatovaquoneの優越性が実証され、1 を上回れば対照薬の優 越性が実証される。これらの試験はatovaquoneの対照薬に対する優越性を実証するた めにデザインされた。これは実証されなかった。 ‡ 区間の信頼度は、ダプソンとの比較試験では95%、ペンタミジンとの比較試験では 97.5%であった。 全 PCP イベントの解析(intent-to-treat 解析)の結果は、上述の解析の結果と同様であ った。 PCPの治療:軽度から中等度のPCPの治療という適応は、懸濁液製剤と錠剤製剤の薬物 動態比較試験(「臨床薬理」の項参照)および血漿中atovaquone濃度と奏効率との関連 性を実証した錠剤製剤の臨床的有効性試験の結果に基づいている。軽度から中等度の PCP(治験実施計画書において、室内気吸入下での肺胞気・動脈血酸素分圧較差 [(A-a)DO2]1が45 mm Hg以下かつPaO2が60 mm Hg以上と定義された)を有するAIDS患
者を対象としてMEPRONをTMP-SMX合剤と比較した無作為化二重盲検試験の結果と、
対象としてMEPRONを静注用イセチオン酸ペンタミジンと比較した無作為化試験の結 果を以下にまとめる。 TMP-SMX合剤との比較試験:1990 年に開始されたこの無作為化二重盲検試験は、組 織学的に確認されたPCPを有するAIDS患者の治療におけるMEPRONの安全性および有 効性をTMP-SMX合剤と比較するためにデザインされた。軽度から中等度のPCPを有す る患者のみを組入れ可とした。 37 施設にて計 408 例の患者を組み入れた。組織学的に PCP が確認されなかった 86 例 は、有効性解析から除外した。組織学的にPCP が確認された 322 例のうち、160 例が MEPRON 群、162 例が TMP-SMX 群に無作為に割り付けられた。 MEPRON 群には MEPRON 750 mg(250 mg 錠×3 錠)を 1 日 3 回、21 日間投与し、 TMP-SMX 群には TMP 320 mg+SMX 1,600 mg を 1 日 3 回、21 日間投与するものとした。 奏効とは、臨床的および呼吸指標の改善が投与中止後 4 週間以上持続した状態と定 義した。非奏効には、効果欠如、有害事象による投与中止および評価不能を含めた。 死亡率に有意な群間差(P=0.03)が認められた。21 日間の治療期間中または 8 週間 の追跡期間中に死亡したのは、PCP が確認された 322 例のうち、MEPRON 群の 160 例 中13 例(8%)および TMP-SMX 群の 162 例中 4 例(2.5%)であった。すべての無作為 化症例(408 例)を対象として実施した intent-to-treat 解析では、死亡例数は MEPRON 群で16 例(8%)、TMP-SMX 群で 7 例(3.4%)であった(P=0.051)。死亡した MEPRON 群の 13 例のうち、死因は 4 例が PCP、5 例が細菌感染と PCP の合併であり、 死亡したTMP-SMX 群の 4 例はいずれも細菌感染が死因ではないようであった。 血漿中 atovaquone 濃度と死亡との間には相関が認められた。全体的に、血漿中濃度 が低い患者ほど死亡する確率が高かった。第4 日の血漿中 atovaquone 濃度のデータが 得られた患者については、濃度が5 mcg/mL 未満であった 8 例のうちの 5 例(63%)が 試験参加中に死亡した。しかし、第4 日の血漿中 atovaquone 濃度が 5 mcg/mL 以上であ った49 例では、死亡したのは 1 例(2.0%)のみであった。 治験実施計画書の規定に基づく奏効率は、MEPRON 群で 62%、TMP-SMX 群で 64% であった(表4)。 表4. TMP-SMX との比較試験に組み入れられた PCP 陽性患者の治療転帰 患者数 (全体に占める割合[%]) 治療転帰* MEPRON (n = 160) TMP-SMX (n = 162) P 値 奏効 99 (62%) 103 (64%) 0.75 非奏効 -効果欠如 28 (17%) 10 (6%) <0.01 -有害事象 11 (7%) 33 (20%) <0.01 -評価不能 22 (14%) 16 (10%) 0.28 試験中に別のPCP 治療 が必要になった 55 (34%) 55 (34%) 0.95 * 治験実施計画書中に定義され、上述のとおり記載されているもの。
効果欠如による非奏効率は MEPRON 群のほうが有意に高かったが、有害事象による 非奏効率はTMP-SMX 群のほうが有意に高かった。 その他の効果の指標(すなわち、動脈血ガス測定値、バイタルサイン、血清中 LDH 濃度、臨床症状および胸部X 線画像)に対するいずれかの投与の影響に有意差は認め られなかった。 ペンタミジンとの比較試験:1991 年に開始されたこの非盲検無作為化試験は、組織 学的に確認された軽度または中等度のPCPを有するAIDS患者の治療におけるMEPRON の安全性および有効性をペンタミジンと比較するためにデザインされた。患者の約 80%が、過去に抗菌薬であるトリメトプリムまたはスルファに不耐容を示したことがあ るか(主要治療集団)、組入れ時にPCPの治療に用いられたTMP-SMX合剤に不耐容を 示した(救済治療集団)。 MEPRON 群には atovaquone 750 mg(250 mg 錠×3 錠)を 1 日 3 回、21 日間投与し、 イセチオン酸ペンタミジン群には3~4 mg/kg の点滴静注を 1 日 1 回、21 日間行うもの とした。 22 施設にて計 174 例の患者を組み入れた。組織学的に PCP が確認されなかった 39 例 は、有効性解析から除外した。組織学的にPCP が確認された 135 例のうち、70 例が MEPRON 群、65 例がペンタミジン群に無作為に割り付けられた。これらのうち、110 例が主要治療集団、25 例が救済治療集団であった。ペンタミジン群に割り付けられた 主要治療集団の1 例は、治験薬の投与を受けなかった。 死亡率に有意な群間差は認められなかった。21 日間の治療期間中または 8 週間の追 跡期間中に死亡したのは、PCP が確認された 135 例のうち、MEPRON 群の 70 例中 (14%)10 例およびペンタミジン群の 65 例中 9 例(14%)であった。すべての無作為 化症例を対象として実施したintent-to-treat 解析では、死亡例数は MEPRON 群で 11 例 (12.5%)、ペンタミジン群で 12 例(14%)であった。第 4 日の血漿中 atovaquone 濃度 のデータが得られた患者については、濃度が5 mcg/mL 未満であった 5 例のうちの 3 例 (60%)が試験参加中に死亡した。しかし、第 4 日の血漿中濃度が 5 mcg/mL 以上であ った21 例では、死亡したのは 2 例(9%)のみであった。 この試験において治験薬の投与を受けた 134 例の治療転帰を表 5 に示す。