原 著 〔東女医大誌 第60巻 第8号頁609∼619平成2年8月〕
遺伝的表現形に基づく胎盤型アルカリ性ホスファタ
ーゼ
分子の差異について
東京女子医科大学 生化学教室(主任:降矢 螢教授) 江東微研東北特殊分析研究所 サ トウ 佐 藤 マツ オ松 男
(受付平成2年4月19日)Allelic Heterogeneity of Placental Alkaline Phosphatases in Hllman Races
Matsuo SATO
Tohoku Branch of Kohtohbiken Laboratories, Division of Special Analysis Laboratories Department of.Biochemistry(Director:Prof. Kei FURIYA)
Tokyo Women’s Medical Coiiege
Allelic forms of placental alkaline phosphatase(PAP, EC 3.1.3.1)were compared with term
placentas of Caucasi皐n(FI−type),Japanese(SS−type), and Negroid(FF−type)subjects. These three PAPs could not be distinguished from each other on the basis of Km value, optimum pH, inhibition by
L−phenylalanine or L−homoarginine, or antigenicity against a polyclonal antibody. However, marked or
slight differences were observed in the electrophoretic charge of the PAP molecule, substrate
specificity, NaCl elution profile on DEAE−cellulose and manner of inhibition by L−leucine, suggesting the presence of different forms of PAP.
Heterogeneity in the sugar chain was examined by means of serial lectin affinity chromatography. It was found that FI−PAP possessed less sugar chains lacking fucose linkages to the innermost Nacetyl
glucosamine of biantennary complex−type and hybrid−type sugar chains, whereas SS・and FF−PAPs
contained more high mannose−type or hybrid−type sugar chains with fucose linkages to the innermost N−acetylglucosamine, respectively, These allelic or racial differences in sugar chains were only slight in liver AP but were not seen in APs from small intestine and bone. No changes in electrophoretic
charge or molecular mass were observed in PAP lnolecules upon endoglycosidase−F treatment,
indicating that the PAP heterogeneity was mainly due to alteration in the sugar structure and in the
number of sugar chains.
緒 言 アルカリ性ホスファターゼ(AR EC3.1.3.1.) はリン酸エステルを無機リン酸とアルコールに加 水分解する酵素で,生体のさまざまな組織に分布 しており,ヒトでは少な.くとも4型のアイソザイ ム,すなわち臓器非特異型(肝/骨/腎型),小腸型, 胎盤型,そして胎盤様型(ReganあるいはNagao 型)に分類されている1)2).臓器非特異型APは実 質上,すべての組織で発現され,ヒト血清中の主 なアイソザイムである.小腸型APのほとんどは 小腸粘膜に由来し,満期分娩胎盤組織に大量検出 される胎盤型APは,ヒトにおいて妊娠約12週目 から発現されるアイソザイムである.また,胎盤 様型APは癌組織で発見されたアイソザイムであ るが,現在では肺や前立腺などの正常組織でも発 現されていることが分かっている.これは胎盤型 609一
APと非常によく類似しているが,構造上あるい は生化学的性質が異なるアイソザイムである. 近年,AP遺伝子の解析が進み, cDNAの塩基 配列から,各APアイソザイムのアミノ酸配列が 決定された3)…6).それによると,これらのアイソザ イムのタソバクー次構造上の相同性は,小腸型あ るいは胎盤型と臓器非特異型との間では50∼60% であるものの,小腸型と胎盤型では87%,そして 胎盤型と胎盤様型では98%であり,後者に進むに つれて構造的に非常に高い相同性が高いといわ れ2),このことは各々のAPアイソザイムが同一 の先祖遺伝子より分化した別の遺伝子から発現し ていることを示唆するものである7). 一方,糖タンパク質であるAPの糖鎖構造は最 近,胎盤型APについて決定されたが8},各種レク チンの糖結合親和性の相違を利用したレクチソア フィニティークロマトグラフィー9)によ.っても各 アイソザイム間,さらに臓器非特異型の中でも心 血,骨型,および腎型APの相互分離も可能となっ たlo).すなわち,このレクチンアフィニティークロ マトグラフィーで得られた結果は,APの糖鎖構 造の相違に合致するもので,各APの糖蜜構造に ヘテロジェニティーのあることが明らかとなっ た. APの各アイソザイムは,電気泳動法により分 離同定できるが,このアイソザイムの中で特に胎 盤型APは電気泳動的に多型性を示し,デンプン ゲル電気泳動法を用いて,古くから18種以上の表 現型が知られている11)12).主なものとしては,SS, FF, II, SF, SI,およびFIと呼ばれる6種で, 全盤現形の98%を占める12).最近,その表現形の cDNAの塩基配列も決定され, II型とSS型との 問でアミノ酸7残基が異なると言われている13), また,電子顕微鏡を用いた研究から,SS型とFF 型とで,胎盤型APに対するモノクロナール抗体 との結合様式が異なるらしい14).これらの結果は 胎盤型APの表現形間でも,立体構造等の分子構 造の相違があることが予測される. 一方,この胎盤型APの表現形の発現頻度は, 人種間で異なることも古くから知られており12) FF型のそれは白人で最も高く約25%で,黒人や 東洋人では数%である.また,II型は東洋人,特 に中国入や日本人で約25%で,白人や黒人では 数%である.SS型は最も発現頻度の高い表現型 で,白人や日本人で約65%,黒人で90%以上であ る.このように,胎盤型APに数多くの表現型が 存在すること,そして人種間でその表現型の発現 頻度が異なることは,APの分子構造等の生化学 的差異からも,注目に値するべき点である. そこで本研究では,特に白人2例,黒人2例, そして日本人3例から得た満期分娩胎盤より胎盤
型APを部分精製し,胎盤型APの遺伝的表現福
間における分子的差異,特にAPの糖部分,すな わち糖鎖構造の差異が胎盤型APの電気泳動的多 型性に関与しているかどうかを中心にして,種々 の検討を行った. 実験材料および方法 1.実験試薬 レクチンアフィニティークロマトクフフィーに 使用するレクチン,すなわちSepharose 4Bに結 合させたconcanavalin A(Cαηα槻1勉6ηs⑳プ厩s, Con A)はPharmacia(Sweden)より,またアガロー スに結合させたphytohemagglutinin(丁癬加胆躍忽αγゴs,PHA−L), pea lectin(P奮%規sα伽%御,
PSA),そしてwheat germ agglutinin(Tγ魏6π規
襯知溶,WGA)はEY. Lab(USA)より購入
した,ゲル濾過の支持体であるSephacryl S−200,およびイオン交換体であるDEAE−Sepharose
もPharmacia(Sweden)より購入した.糖タン パク質のシアル酸を除去するneuraminidaseは 半井化学より,糖タンパク質のN一結合糖鎖を切 断するendoglycosidase F(Endo F)はべーリ ンガーマンハイム山之内より入手した.プロテ ァーーゼ阻害剤,benzamidine chlorideとphenyl− methylsulfonyHuoride(PMSF)は, Sigma Chemi− cals Co.(USA)より入手した.電気泳動に用い る支持体,Cellogel膜はChemtron(Italy),等電 点電気泳動で用いる両性電解質,ampholine(pH 3.5∼9.5)はLKB(Sweden)より入手した.抗 ヒト胎盤型APに対する抗血清は, Merck(Ger− many)より入手した.酵素活性測定の基質であるphateあるいは活性染色に用いる5−bromo−3−
indQlyl phosphate, p−toluidine塩(BIP),そして
その他の試薬は和光純薬より入手した。 2.実験方法
1)胎盤型APの部分精製
白人,黒人そして日本人の満期分娩胎盤組織を
酵素源として使用した.前2者の胎盤組織は
Aalto Co.(Calfornia, USA)を介して,常光(株)
(東京)より提供され,また日本人の胎盤は,埼玉 医科大学産婦人科より分与された三品を使用し た.まず,各組織を5倍容の0.5%Triton X−100, 1mM benzamidine,および0.3mM PMSFを含む トリス緩衝液(10mM, pH 7.5)を加えてホモジ ネートを作製した.これを15,000×g,15分間の遠 心分離を行い,得られた上清画面をMortonの方 法15)に従って,最終濃度20%になるようにn一ブタ ノール処理した.その後,これを遠心分離して得 られた水層画分を最終濃度60%のアセトンによ り,・濃:縮沈殿させた.沈殿物は0.9%NaCl含有ト リス緩衝液(TBS,10mM, pH 7.5)に溶解させ, TBSを用いて透析した.ついで, TBSで平衡化し たSephacryl S−200を用いてゲル濾過を行い,酵 素活性を含む分画を採取,濃縮してAPの部分精 製標示とした.得られた各胎盤型APの比活性は, 白人,黒人,および日本人からのAPで,それぞ
れ11.1,8.7および10.9μmol/min per lng protein
であった.また,それらの胎盤型APはBeckman らのデンプンゲル電気泳動法12)による結果から,
白人はFI型,黒人はFF型,そして日本人はSS
型と判定された. また,白人および日本人の肝,骨,そして小腸 は,胎盤組織と同様,白人の標品はAalto Co.を 介して常光(株)より提供され,日本人の各臓器 は,埼玉医科大学における病理解剖温品の一部を 分与されたものを使用した.AP標品の精製は上 記と同様の操作を行い,それぞれのAPを部分精 製した.比活性は肝型APが3.9∼4.8,骨型AP が8.1∼11.4,および小腸型APが8.8∼12.1μmol/min per mg Proteinであった.
胎盤型APのDEAE−Sepharoseクロマトグラ
フィーは,まずカラムを20mMトリス緩衝液(pH 8.4)で平衡化した後,AP標品をのせ,0から0,2MのNaC1を用いた直線濃度勾配法により溶出
させた.そして各APが溶出された時のNaCl濃 度を測定した. 2)酵素活性の測定 APの酵素活性は炭酸緩衝液(50mM, pH 10.2) 中で2mMのdisodium p−nitrophenylphosphate を基質として用い,37℃でインキュベーションし 遊離したp−nitrophenolを405nmにおける吸光度 より測定しだ16).また,各種アミノ酸による阻害試 験やKm値の測定に際しては, phenyl−phosphate を基質とするKind−King法17)に準じて行った.3)レクチンアフィニティークロマトグラ
フイー APの糖鎖構造の多様性を検討するために, Se−pharoseあるいはAgaroseに結合させたCon
A,PHA−L, PSA,そしてWGAを用いたレクチ ンァフィニティークロマトグラフィー9)10)を行った.Con A, PSA,そしてWGAのレクチンカラ
ム(0.5×10cm)は1mMのMg++, Ca++, Mn++, 10μMのZn++含有TBS(10mM, pH 8.0)で平 衡化した.PHA−しのレクチンカラムは同様の金 属イオンを含むリン酸緩衝液(PBS,10mM, pH 7.5)で平衡化した. まず,酵素小品をCon Aカラムにのぜ,室温で 3時間放置した後,TBS,0。01M α一methyl−D− mannoside(αMM),そして0.5MのαMMを用 いた段階法により,APを溶出させた.すなわち, Con Aカラムで得られた3画分は,非結合画分 (1画分),弱結合画分(II面分),そして強結合面 分(III画分)である.次に,この3画分を透析, 濃縮した後,1画面はPHA−L, II画面はPSA, III書分はWGAのレクチンカラムにのせ,それぞ れ0.1M N−acetyl−D−galactosamine,0.2M αMM,および0.1M N−acetyl−D−glucosamineを 用いて,それぞれ非結合画分(A)と結合画分(B)
とに細画卜した.すなわち,各APをIA, IB, IIA,
IIB, IIIAおよびIIIBの6画分に分離した.また, 各レクチンカラムからの回収率はすべて95%以上
であった.
デンプンゲル電気泳動法はBeckmanらの方
法12)に従って15%ゲルを用いて,アルカリ系の緩 衝液(pH 8.2)で行った.また, APアイソザイム 分画にはCelloge1膜を使用し,60mMバルビター ル緩衝液(pH 8.6)で,150V,60分間の電気泳動を 行った. 等電点電気泳動法には支持体として,2.4%Am− pholine(pH 3.5∼9.5)を含む5%ポリアクリル アミドゲル平板を使用し,電極液に陽極,1MH3 PO4,陰極,1M NaOHを用いて!0℃以下の還流 冷却下で,10W,120分の通電を行った.等電点(pl) は電気泳動終了後,ゲルを5mm間隔で切断し,各 ゲルを蒸留水1mlに1時間浸してから,微小電極 法にて,pHを測定した. 分子量の測定にはLaemmli法18)を基本とし て,0.1%SDSを含む還元剤非存在下で行った.支 持体にはSDS一ポリアクリルアミドグラジエンド ゲル(10∼20%)を使用し,後述する活性染色され た位置より,分子量を算出した.既知分子量マー カーとして,thyroglobulin(330Kd), ferritin(220 Kd), bovine serum aibumin(67Kd), catalase(60 Kd), lactate dehydrogenase(36Kd)を使用した. また,AP分子の糖成分の検討のために,0.1U/ mlのneuraminidaseあるいはEndo Fを酵素標 品に加え,37℃で3時間それぞれ作用させた後に, 電気泳動を行った10). 各電気泳動法における酵素活性バンドの検出に は,5mg/ml BIPを含む1M 2一アミノー2メチルー1,3一 プロパγジオール緩衝液(pH 10.2)で37℃, 15∼20分間反応させ,.遊離のindolが酸化して indigoを形成する反応を利用した10). 5)免疫学的同定法 抗ヒト胎盤型AP血清に対する遺伝的表現形の 異なる胎盤型APの免疫学的差異の判定は1.5% アガロースゲルを用いて,Ouchterlony法による ゲル内拡散沈降線の形状を観察することにより決 定した19). 結 果 1.各人種より得られた胎盤型APの分子的特 性の比較 最初に各人種より精製した胎盤型APの酵素化Table l Some enzymatic and physicochemical properties between Negroid, Japanese and Caucasian APs
Caucasian Japanese Negrold
Elution by NaCl on 85−100 75−85 95−105 DEAE・Sepharose(mM) Km value(mM) 2.0 2.0 2.0 (pNPP) Substrate speci丘city 0.72 0.89 0.58 (pNPP/PhP ratio) Optimum pH @ (pNPP) 10.7 10.8 10.8
Inhibition(%)with 3 aminQ acids
LPhe(10mM) LHomo−arg(10mM) LLeu(10mM) pl(PAA−gel) 78,7 10.5 51,7
without Neu・ase digestion
with Neu−ase digestion
4.1 4.5 80.7 4.2 50.4 6.2 6.3 73.1 6.9 612 4.0 4.3 5.4 5.4 5.3 5.3 5.1 4.9 4.9 4.8 pNPP:p−nitrophenylphosphate, PhP:phenylphosphate, LHomo−arg:Lhomoarginine, Neu−ase;neuraminidase, 学および物理化学的性質についての比較をTable 1に示した.まず,DEAE−Sepharoseカラムから のNaC1による溶出位置は遺伝的表現高間で,明 らかに異なった.すなわち,SS型の日本人の胎盤 型APは75∼85mM NaClで溶出されたが, FI型
の風入およびFF型の黒人ではより高濃度の
NaClで溶出された.また, phenyl phosphateと p−nitrophenyl phosphateの比から求めた基質特 異性も,3者間で僅かではあるが,異なった値を 示した.しかしながら,Km値,至適pH,そして L一ロイシンを除く各種アミノ酸による活性阻害度 は,3者間で大きな相違は認められなかった.興
味深いことにFF型の黒人の胎盤型APはFI型
の白人およびSS型のB本人に比し, L一ロイシン による阻害が大きいようであった.また,各胎盤 型APの等電点をTable 1中に示した.各酵素標 品をneuraminidase消化する前では, FI型の白 人およびFF型の黒人に比し, SS型の日本人胎盤 型APは高い値を示したが, neuraminidase消化 後では3者ともほぼ近似した等電点を示した.し かし,僅かな差は,なお認められ,これらの等電Native 1藩
・響鰹
灘
a b C Endo F 十 一Fig. l Cellogel membrane electrophoreses of the native and endoglycosidase F treated placental APs from three races
a:AP from Japanese, b:AP from Caucasian, c:AP from Negroid
十 点の差異は単純にAP中のシアル酸含量のみによ るものではないことが示唆された. 2.遺伝的表現形の異なる胎盤型APの荷電お よび分子量 胎盤型APの表現型, FI型, FF型,およびSS 型を示す,それぞれ白人,黒人,および日本人の 胎盤型APは,デンプンゲルだけでなく,Celloge1 膜上での電気泳動でも易動度の相違が認められた (Fig.1左).すなわち,日本人の胎盤型AP(ss 型)は最’も遅い易動度を示し,黒人(FF型)では最 も早く,白人(FI型)はFF型とII型の中間,すな わち,黒人より僅かに遅い温感度を示した.Endo Fは糖タンパク質のN結合糖鎖をアスパラギン 結合の部位から切断する酵素である.胎盤型AP の表現磯間での易動度の相違に糖鎖の関与がある かどうか知る目的で,各胎盤型APをあらかじめ neuraminidase消化を行った後, Endo F処理を 行い,同様にCellogel膜を用いて電気泳動を行っ た(Fig.1右).その結果,各種胎盤型APともに Endo F未処理に比べて, Endo F処理したAPの 易動度は遅延し,それぞれの易動度は近似した. しかし,なお僅かに異なる易動度の差は,3者の AP個々のアミノ酸残基の荷電の相違によるもの と思われる13〕. 胎盤型APの分子量はSDS・ポリアクリルアミ Neu−ase
彗
・毎詑 野 毛KDa
㌻纏轍児
頭
a b c
Endo−F畿、
灘
a b c
魯KDa
←128Fig.2 SDS・polyacrylamide gel electrophoresis of
the neuraminidase・and endoglycosidase F・
treated placental APs from three races
ドグラジエントゲルで求めたが,シアル酸による 荷電を除去するために,あらかじめ,neur・ aminidase消化を行った酵素三品について行っ た.Fig.2の左に示すように, ss型の日本人では 134Kdであるのに対し, FI型の白人およびFF型 の黒人ではともに128Kdを示し,各表現形におい て,見かけ上の分子量は異なる結果を得た.さら に,Fig.2右に示すように, neuraminidase消化 後,Endo F処理を行った標品について, SDS・ポ 一613一
曾 ミ10 ・蓬
言5
きて。
二 月 隷 豊 詮 品ConA
↓ 畢 Caucas}an 61% 39% 20一 10 0 10 2D 30 o Con A ↓ 尋J。pan・s・ 46% 54% 20 10 G 10 20 30 0ConA
↓ ↓ NegrQid .37% 63% o 10 20 30遮癒拠:匹位:匹
10 Fraction No. 10 10 10 Fraction No. 10 .廻 Fraction No, F孟g.3 Serial lectin a缶nity chromatographies of various human placental APsTable 2 Relative amounts of the且ve fractions of various human placental APs frorn three human races, obtained on the serial lectin a飯nity coL
umn
mount of each fraction in AP activity(%)
Fractions
Caucasian Japanese NegrQid
1 0 0 0
IIA 35 ユ9 13
IIB 26 27 24
IIIA 18 41 48
IIIB 2/ 13 15
The values represent the enzyme activity of the five
fractions expressed as percentages of total AP activity.
リァクリルァミドグラジエントゲルを用いて分子 量を求めたところ,3者ともに128Kdを示した. これらの結果は3者のAPを構成するアミノ酸残 基数は同一であり,Fig.2右に示したEndo Fに よる処理前の分子量の相違は,AP分子中のシア ル酸以外の糖成分の差異によることが考えられ た. 3.遺伝的表現形の違いによる胎盤型APのレ クチンアフィニティークロマトグラフィーによる 差異 Fig.1および2の結果から,表現形問の電気泳 動上での相違に,糖成分の関与が考えられる.そ こで,表現形の異なる胎盤型APの糖鎖構造を推 定する目的で,系統的なレクチンアフィニティー クロマトグラフィーを行った(Fig.3, Table 2). まず,胎盤型APをCon Aカラムにのせ,3画分 に分別した.Fig.3に示すように,3者ともに1 画分(非結合画分)は認められず,以前の報告と よく一致した10).しかし,異なる2種濃度のαMM で溶出された分画パターンは,表現形間で大きく 異なり,II画分(弱結合画法)およびIII画線(強 結合言分)の相対含有%を求めると,それぞれFI 型の白人で61%および39%,FI型の黒人37%およ び63%,そしてSS型の日本人で46%および54% であった. さらにその相違を詳しく見るために,ConAカ ラムで得られたII画分およびIII画分を,それぞれ
PSAカラムおよびWGAカラムにのせ,非結合画
分(A)および結合画分(B)に細分画した.その 結果をTable 2に示したが,表現形間で各レクチ ンに対する親和性に明らかな相違が認められた. すなおち,II画分のPSAに対する親和性の強さはFI型の白人>SS型の日本人=FF型の黒人の
順であり,II町分のWGAに対する親和性の強さはFI型の白人>FF型の黒人>SS型の日本人の
順であった.特に,III画分のWGAによる分画で, IIIB町分はFI型で21%であるのに対し, FF型は 15%,SS型は13%であった.この一連のレクチン アフィニティークロマトグラフィーで得られた5 画分の相対含有量で見ると,FI型ではIIA画分が,FF型およびSS型ではIIIA画分が最も多
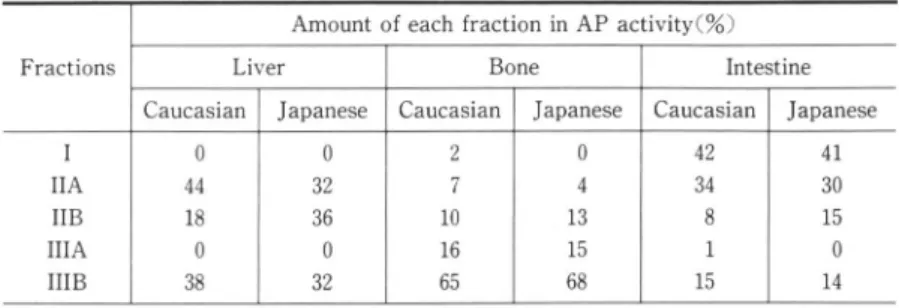
かった.Table 3 Relative amounts of the丘ve fractions of three organ APs from two human races, obtained on the serial lectin amnity column
Amount of each fraction in AP activity(%)
Fractions Liver Bone Intestine
Caucaslan Japanese Caucasian Japanese Caucasian Japanese I hIA hIB hIIA hIIB 0 S4 P8 @0 R8 0 R2 R6 @0 R2 2 @7 P0 P6 U5 0 @4 P3 P5 U8 42 R4 @8 @1 P5 41 R0 P5 @0 P4
The tested APs were pre・treated with l mU/ml of phosphatidylinositoレspecific phospholipase C. The values represent the enzyme activity of the丘ve fractions
expressed as percentages of total AP activity.
礁●
環
Fig.4 Antigenicity of various human placental
AP
Am:AP from CaUcasian, Jpn:AP from
Japanese, Neg:AP from Negroid. Center well contains antiserum(20μ1)for the placental AP from Caucasian. 4.遺伝的表現型の異なる胎盤型APの抗原性 ポリクロナール抗ヒト胎盤型AP血清に対する 表現形の胎盤型APの反応性について, Ouchter・ lony法で検討したところ, Fig.4に示したよう に,すべての胎盤型APは完全に融合する沈降線 を示した. 5.白人および日本人から得た二型,骨型,およ び小腸型APのレクチンアフィニティークロマ トグラフィーによる差異 胎盤型APだけでなく,他のAPアイソザイム についても,人種間または遺伝的表現形の違いに よるAP分子中の糖成分に相違があるかどうか知 る目的で,白人および日本人の肝,骨,および小 腸から部分精製したAPについて胎盤型APと同 様に系統的レクチンアフィニティークロマトグラ フ法を利用した分別を行った(Table 3).なお, ConAカラムでの1画分(非結合画分)はすべての 酵素雲鳥ともにPHA・Lカラムに結合したことか ら,表にはAおよびBの細画分の表示はせず,1 画分と表示した. このうち,二型APにおいて,IIB高分は白人の 18%に対して,日本人では36%と,大きく異なっ た結果が得られたが,それ以外は白人および日本 人との間で,ほぼ同等の相対含有量を示し,両人 種間における,これらのAPアイソザイムの糖成 分に顕著な相違は認められなかった.すなわち,
肝型APでのHI画分はすべてWGAに親和性が
あり,骨型APでの主たる画分はIIIB画分であっ た.また,小腸型APのそれは1およびIIA画分 であった.これらの臓器特異的なAPの糖成分の 違いは以前の報告ともよく一致した10,. 考 察 生体を構成しているさまざまな物質について, 人種間で相違が認められることは人類遺伝学上, 非常に興味深い.酵素としては,グルコースー6・ホ スファターゼ,アルコール脱水素酵素,酸性ホス ファターゼやアミラーゼなどを含む少なくとも30 種類以上について,そのアイソザイムパターンに 人種差があることは,以前より知られている20).ま た,赤血球膜におけるNa+, K+輸送系は白人に比 一615一べ,黒人では低下しているが,これは人種間での 赤血球のNa+一, K+一ATPase活性の相違に起因し ているものであろう21),制限酵素により断片長の 多形性(RFLP)を示す日本人のX染色体汚血は, 白人に比べて長いという報告22)もある.このよう に同一の∬o魏osα勿6π5においても,生体構成成 分に明らかな相違が認められる.
ヒトAPアイソザイムの中で,胎盤型APだけ
が遺伝的に多型性を示すことは,最初,Boyerに よって報告された11).また,これらの表現形の違い は胎児の遺伝子型によって支配されているとい う23),この多型性が認められる表現形はデソプソ ゲルを用いた電気泳動法により,分離同定されて いるが,全表現形の98%を占めるSS型, FF型, II型, SF型, SI型,およびFI型のうち, SS型,FF型,およびII型APはHolmgrenらによって
初めて単離精製された24>25). 胎盤型APの表現形について特徴的なことは, これらの表現形の出現頻度に人種差のあることで ある12)20).そこで,本研究では,この点に着目し, 何故,人種差土または表現形の違いによる差異が あるのか,1つの知見を得る目的で,FI型の白人, FF型の黒人,そしてSS型の日本人の各胎盤より APを部分精製し,その生化学的性質および構造 的差異について検討を行った.表現形の異なる胎盤型APのKm値や至適pH
などの酵素学的性質は3者の間で顕著な相違は認 められなかったが,DEAE−Sepharose上でNaCl による各胎盤型APの溶出位置に,明らかな違い が認められた(Table 1).このクロマトグラフ法 による溶出パターンの相違に糖成分が関与してい ることは,腎臓や小腸のAPについて知られてい る26)27).すなわち,各表現形に伴う胎盤型APの DEAE・Sepharoseからの溶出パターン/に違いが 認められることは,3語間で糖成分の異なること を示唆するものである.事実,neuraminidase未消 化でAPの等電点は,人種間で異なるが, neur− aminidase処理後もなお等電点に差異が認められ ることは,これら人種間におけるAPのヘテロ ジェニティーは単純にシアル酸のみに起因するも のではなく,それ以外の糖鎖も異なることを強く 示唆する(Table l).またCellogel膜を用いた電 気泳動において,自動度に明らかな違いが見られ た各店現形間の胎盤型APぱ,糖タンパク質から N一結合直鎖を除去する酵素,Endo Fで処理する と,それらの上馬度に顕著な相違が認められなく なった(Fig,1).更に, SDS・ポリアクリルアミド ゲルを用いた電気泳動でも同様,Neuraminidase 処理のみでは,なお異なった分子量を示す各人種 間の胎盤型APは, Endo Fで処理することによ り,同一の分子量を示すようになった(Fig.2). 他方,表現形SS型とII型はタンバクー次構造上, アミノ酸7残基が異なることは知られてはいるも のの14),今回の実験結果から,ポリクロナール抗体 に対する各表現形鋼における胎盤型APの抗原性 の相違は認められず,ほぼ同一の抗原決定基を持 つものと考えられ,タンパク部分の構造に大きな 相違はないと判断できよう. そこで,胎盤型APの糖鎖構造について,詳細 に検討するために,前述のように種々レクチンを用いた系統的アフィニティークロマトグラ
フィ」o)ユ1)を行い,得られた3画分,すなわち,多 枝複合型血止,二枝複合型糖鎖,および高マンノー ス型あるいは混成型碧南の画分28)をさらに,それ ぞれ別のレクチンカラムにかけることにより,糖 鎖構造を細分画した,PHA−Lは多枝複合型豪彊 を分別することができ29),PSAはフコース残基を 認識することから,二枝複合型富浜においてフ コースの有無が確認され3。),WGAはフコース残 基を持たない混成型糖鎖に親和性を持つ31).すな わち,この一連のレクチンアフィニティークロマ トグラフィーを行うことで,レクチンに対する親 和性の相違に依存する胎盤型APの多様性を知る ことができ,さらに糖鎖構造の推定も可能であ る32)33).この方法を本研究では部分精製した各誌現形の異なる胎盤型APおよび異なる人種の肝
型,骨型そして小腸型APに対して適用した. ところで最近,ヒト歯型APのcDNA配列は, 骨肉腫細胞Saos−2より得たものと白人肝組織よ り得られたcDNAライブラリーでは,5ヵ所塩基 配列が異なり,結果として87,246,と496番目の アミノ酸配列が異なることが知られ34),また骨型 一616一APも珍談APとアミノ酸配列には反映されない
エクソン1の塩基配列が異なることが,未発表で はあるものの山口大学小児科の岸らによって発見 されている.これらの成績は臓器非特異型(肝/骨/ 腎型)APにも,アミノ酸配列上や人種間における 差異も予測されるが,糖蜜構造上では胎盤型AP ほどの表現形の違いによるヘテロジェニティーは 認められなかった。まず,白人の肝型APではIIA寸分が最も多
く,レクチンの糖結合特異性から考えると,フコー ス残基を持たない二枝複合型飛宇を多く含むのに 対し,日本人ではフコース残基を持つ二枝複:合型 糖鎖も多く含むことがわかった(Table 3),それ 以外は骨型および小腸型APの測鎖構造の人種歯 間の明らかな相違は認められなかった.すなわち, 骨型APは混成型糖鎖を主成分としており,混成型糖鎖に親和性を持つWGAを用いたレクチン
親和電気泳動において,骨型APの易動度がより 遅延する結果20)とよく一致した.また,小腸型AP は多枝複合型糖鎖とフコース残基を持たない二枝 複合型糖鎖を主成分としていた. それに対して,胎盤型APの糖鎖構造は遺伝的 表現型間で明らかな相違が認められた(Fig.3, Table 2).先の報告10)と同様に,いずれの人種の 胎盤型APともに1画分,すなわち多枝複合型糖 鎖を含まなかったが,白人(FI型)の胎盤型AP は肝型APと同様に, IIA西分,すなわちフコース 残基を持たない二枝複合型糖鎖を多く含んでい た.また,IIB画分のフコース残基を持つ二枝複合 型糖鎖の相対含有量は各表現形ともにほぼ同等の 値を示した.一方,FF型の黒人およびSS型の日 本人ではIIIA画分,すなわち高マンノース型ある いはフコース残基を持つ混成型糖鎖がより高い含 有量を示したが,FI型の白人ではIIIB画分のフ コース残基を持たない混成嬉嬉鎖も認められた. このように,本研究から,遺伝的表現形間で胎 盤型APの家蝿構造の相違が明らかとなったが, これらの糖鎖は細胞の粗面小胞体やゴルジ体で生 合成されることから,糖鎖構造の違いは,糖鎖の プロセシングに関与する一連のグリコシダーゼや グリコシルトランスフェラーゼの胎盤組織での発 現あるいは酵素活性に依存するものと考えられ る10)35).N一結合糖鎖は始めに高マンノース型であ るものがプロセシングを受け,混成型を経て,さ らにフコシル化を受けて複合型になる.すなおち, これらの一連の酵素の発現が,人種差または表現 慰問で異なっているかも知れない.例えば,FI型の白人の胎盤型APはIIAおよびIIIB七分を相
対的に多く持ったが,このことは白人(FI型)の胎盤型APはFF型の黒人やSS型の日本人に比
べて,フコシル化を受けていないものが多いこと を意味しており,よってフコシルトランスフェ ラーゼの発現あるいはその酵素活性36)37>が,FI型 の白人ではFF型の黒人やSS型の日本人に比べ て低いことが考えられる.これらの違いが本当に 人種差に依存しているものか,あるいは胎盤型 APの表現形だけに依存しているのかは,未だ明 らかではないが,未発表ではあるものの,日本人 の表現形の異なる胎盤型APにも,上記と似た糖 蜜の違いが見られたことは,表現形による差異で ある可能性が高く,生化学的にも人類遺伝学上で も興味深いものと思われる.もし,糖鎖構造の相 違が表現形に依存しているものとすると,肝型 APのレクチンに対する親和性が,白人と日本人 とで異なることから,塑造APにも表現型が存在 することが,本研究から予測される.これらの結 果は胎盤組織のフコシルトランスフェラーゼの酵 素活性を測定することで,さらに裏付けられると 思われ,今後検討を重ね,さらに発展させたい. 本研究においては,主として胎盤型APの表現 形の違いに起因する分子的相違について検討を 行ったが,1949年のヘモグロビンSの発見から始 まる生体物質の人種間での出現頻度の相違20)は, 各人種間での生活環境,そしてそれに対応する適 応性が,生体内成分の量や質的変化をもたらし, 結果として表現型として認められるのかも知れな い. 結 論 胎盤型APは他のAPアイソザイムと異なり, 多数の表現形からなり,その出現頻度が人種間で 異なることが知られている.そこで本研究ではFI 型の白人,FF型の黒人そしてSS型の日本人胎盤組織より,胎盤型APを部分精製し,その分子的 差異,特に糖鎖構造の差異について比較検討した. 各表現一間で酵素学的相違は認められなかった が,胎盤型AP分子の糖成分に依存する相違が今 回の研究で初めて明らかとなった.各論現形間で 電気泳動での易動度や分子量に違いが認められた が,N・結合点出を切断するEndo Fで各胎盤型 APを処理すると,その易動度や分子量の相違が ほとんど消失した.さらに,系統的レクチンアフィ ニティークロマトグラフ法を適用した結果,いず れの人種の表現形でも胎盤型APは多枝複合型糖 鎖を含まなかったが,白人(FI型)の胎盤i型AP はフコース残基を持たない二枝複合型糖鎖をより 多く含むことが確認された.また,フルコース残 基を持つ二枝複合型糖鎖の相対含有量は各表現形 ともに同等の値を示した.一方,FF型の黒人およ びSS型の日本人では高マンノース心あるいはフ コース残基を持つ混成型糖蜜が高い含有量を示し たが,FI型の白人ではフコース残基を持たない混 成型糖鎖も認められた.糖鎖構造全般的に観察す ると,これらの結果は,白人(FI型)の胎盤型AP はFF型の黒人やSS型の日本人に比べて,フコ シル化を受けにくいことを意味しており,人種差 または表現直間における胎盤型APの差異は,主 としてフコシルトランスフェラーゼの発現あるい は酵素活性が,FF型の黒人やSS型の日本人に比 べて低いことに起因することが判明した. また,白人および日本人における肝,骨および 小腸型APの人種間の差異については,特に肝型 APにおいて若干の糖鎖の差異が認められたが, 骨型,小腸型APにおいてはほとんど認められな かった.このことは,蝋型APにおいても人種間 の差異がある可能性があり,今後検討する余地が あると思われた. 稿を終えるにあたり,御指導,御校閲を賜りました 東京女子医科大学生化学教室降矢 榮教授に謹んで 謝意を捧げるとともに,終始,直接多大な御指導,御 校閲までして下さいました埼玉医科大学生化学教室 菰田ニー助教授に深く感謝いたします.なお,本研究 を実施するにあたり,胎盤組織を提供していただぎま した常光(株)に感謝いたします. 本研究の一部は第60回日本生化学大会において発 表した. 文 献 1)菰田ニー,小山岩雄,坂岸良克:アルカリ性ホス ファ劃一ゼ研究の最近の進歩,蛋・核・酵 30: 1408−1420, 1985
2)Harris H:The human alkaline phosphatase;
what we know and what we don’t know. Clin
Chim Acta 186:133−150,1989
3)Weiss MJ, Ray K, Henthorn PS et al:Struc− ture of the human liver/bone/kidney alkaline
phosphatase gene, J Biol Chem 263:
12002−12010, 1988
4)He凱tLorn PS, Raducka M, Kadesch T et al:
Sequence and characterization of the human
intestinal alkaline phosphatase. J Biol Chem
263:12011−12019, 1988
5)Knoll BJ, Rothblum KN, hon且ey M=Nu・
cleotide sequence of the human placental alka・ line phosphatase gene;evolution of the 5’nank− ing region by deletion/substitusion, J BioI
Chem 263:12020−12027,1988
6)Millan 几, Manes T:Seminoma−derived
Nagao isozyme is encoded by a gerln cell
alkaline phoshatase gene. Proc Natl Acad Sci
USA 85:3024−3028,1988
7)Stigbrand T= Present status and future trends of human alkaline phosphatase, 1η
Human Alkaline Phosphatase(Stigbrand T,
Fishman WH eds)pp3−14, Alan, New York
(1984)
8)Endo T, Ohbayashi H, Hayashi Y et al:
Structural study on the carbohydrate moiety of human placental alkaline phosphatase. J Bio・
chem 103:182−187,1988
9)Cummings RD, Kornfel〔l S:Fractionation Qf asparagine−1inked oligosaccharides by serial
lectin af五nity chromatography. A rapid, sensi− tive and specific technique. J Bまol Chem 257:
11235−11240, 1982
10)Koyama l, Miura M, Matsuzaki H et aL Sugar・chain heterogeneity of human alkaline phosphatase;differences between normal and
tumor−associated isozymes. J Chromatogr
413:65−78, 1987
11)Boyer SH:Alkaline phosphatase in human
sera and placentae. Sciences 134,=1002−1004, ’ 1961
12)Beckman G, Beckman L Human alka1加e
phQsphatase, Genetic variants and their rela一
tionship to natural selection. in Human
line Phosphatases (Stigbrand T, Fishman WH
eds) pp15-23, Alan, New York (l984)
13) Henthorn R, Knoll BL, Raducha M et al: Products of two common alleles at the locus
for hurnan alkaline phosphatase differ by seven
amino acids. Proc Natl Acad Sci USA 83 I 5597-5601, 1986
14) Takeya M, Jemmerson R, Shah N et al:
Immunoelectron microscopic analysis of the
binding of monoclonal antibodies to molecular
variants of human placental alkaline
phatase, Biochemistry 25I7731-7735, 1986
15) Morton RK: The purification of alkaline
phosphatase of animal tissue. Biochem J 57 I
595-603, 1954
16) Bessy OA, Lowry OH, Brok MT : A Thethod
for the rapid determination of alkaline phatase with five cubic milimeters of serum, J
Biol Chem 164I321-329, 1946
17) Kind PR, King ET: Estimation of plasma phosphatase by determination of hydrolysed
phenol with amino-antipyrine. J CIin Phathol 7 : 322-330, 1954
18) LaemmliUK: Cleavageofstructuralproteins
during the assembly of the head of
phage T4. Nature 227I680-684, 1970 19) Miura M, Matsuzaki H, Sakagishi Y et al:
Partial characterizatien of human ileal
line phosphatase. Clin Chim Acta 163 i 279-28Z 1987
20) Harris H: The Principles of Human chemical Genetics. 3rd ed, Elsevier, North
Holland <198e)
21) lpk S- Ets, ,JNee ue- 1 tEft rm Jlj( ee Oc ts e 6 ts ge va en paJ*. EJdiienIU( 45:91-100, 1987
22) Shinmoto M, Tsuji A, Sizuki Y: Restriction fragment length polymorphisms on the short arm of X chromosome among the Japanese
population. Jpn J Human Genet 33 I 333-338,
1988
23) Robson EB, Harris H : Genetics of the
line phosphatase polymorphism of the human placenta. Nature 207:1257-1259, 1965 24) Helmgren PA, Stigbrand T: Purification and partial characterization of two genetic variants of placental alkaline phosphatase. Biochem Genet 14I777-790, 1976
25) Holmgren PA, Stigbrand T: Catalytic
erties and stability of three common variants
of placental alkaline phosphatase, Biochem Genet 16I433-443, 1978
26) Hiwada K, Wachsmuth ED: Alkaline
phatase from pig kidney : Microheterogeneity
and the role of neuraminic acid, Biochem J 141I293-298, 1974
27) Besrnan M, Coleman JK : Isozymes of bovine inte$tinal alkaline phosphatase, J Biol Chem 260 : 11190-11193, 1985
28) fi fi =- I ss di trc k 6 ALP 0 fS fiffi. ee Jl< liEE
79 (tk3E)I120-130, 1988
29) Kornfeld K, Kornfeld S : Characterization of the structural determinants required for the high afinity interaction of asparagine-linked oligosaccharides with immobilized phaseolus vulgar is leukoagglutinating and
lutinating lectins. J Biol Chem 257Z
11230-11234, 1982
30) Kornfeld K, Reitman ML, Kornfeld R : The
carbohydrate-binding specificity of Pea and Lentil lectins, Fucose is an important
minatant.J Biol Chem 25616633-6640, 1981
31) Osavva T, Tsuji T: Fractionation and
tural assessment of oligosaccharides and
glycopeptides by use of immobilized lectins.
Ann Rev Biochem 56 I 21-42, 1987
32) ,]N-Xte, nM=-1 mp-Y77a=ti-a
p -? F g" v 7 x - ce) igMthl. %eik cD th@EZR. 142 :
453-456, 1987
33) Komoda T, Sato M, Furiya K et al : Allelic and ectopic polymorphism in human placental alkaline phosphatases. Clin Chim Acta 186 [
203-210, 1989
34) Kishi F, Matsuura S, Kajii T: Nucleotide sequence of the human liver type alkaline
phosphatase cDNA, Nucl Acid Res 17 I 2129,
1989
35) Roth J: Subcellular organization of
glycosylation in rnammalian cells. Biochim Biophys Acta 9061405-436, 1987
36) Potyin B, Kumar R, Howard DR et al:
Transfection of a human a(1,3) ase gene into chinese hamster ovary cells, J
Biol Chem 265:1615-1622, 1990
37) Madiyalakan R, Yazawa S, Abbas SA et al : Use ef N-acetyl-2'-methyllactosamine as a
specific acceptor for the determination of (1-3) fucosyltransferase in human serum, Anal
BioChem 152I22-28, 1986