医師・薬剤師の先生方へ 2012 年 1 月 中外製薬株式会社 安全管理責任者 謹啓 先生方におかれましては、ますますご清祥のこととお慶び申し上げます。 平素は格別のご高配を賜り、厚く御礼申し上げます。 「エディロール®カプセル 0.5µg、0.75µg」(一般名:エルデカルシトール、以下本剤)につきましては、 2011 年 1 月 21 日に「骨粗鬆症」に対する効能・効果により製造販売承認を取得し、4 月 11 日の販売開始 より 10 月 31 日まで市販直後調査を実施して参りました。先生方におかれましては、本調査にご協力賜 り、誠にありがとうございました。 このたび、市販直後調査期間中にご報告いただきました副作用情報をまとめましたので、ご報告いた します。日常のご診療の一助となれば幸甚に存じます。 引き続き、本剤の適正使用にご留意いただき、副作用等をご経験された場合には、速やかに弊社医薬 情報担当者までご連絡くださいますようよろしくお願い申し上げます。 謹白
■ はじめに
本情報につきましては、ご報告いただいた内容を速やかにお伝えすることを目的としており、調査が 終了していない症例や情報が十分でない症例も含まれております。今後の調査の進行、詳細な情報の 検討により副作用名、副作用の重篤度判定、本剤との因果関係等が変更となる場合がございますので、 ご了承いただきますようお願い申し上げます。エディロール
Ⓡ
カプセル 0.5µg、0.75µg
市販直後調査結果のご報告
【市販直後調査期間:2011 年 4 月 11 日~2011 年 10 月 31 日】副作用収集状況
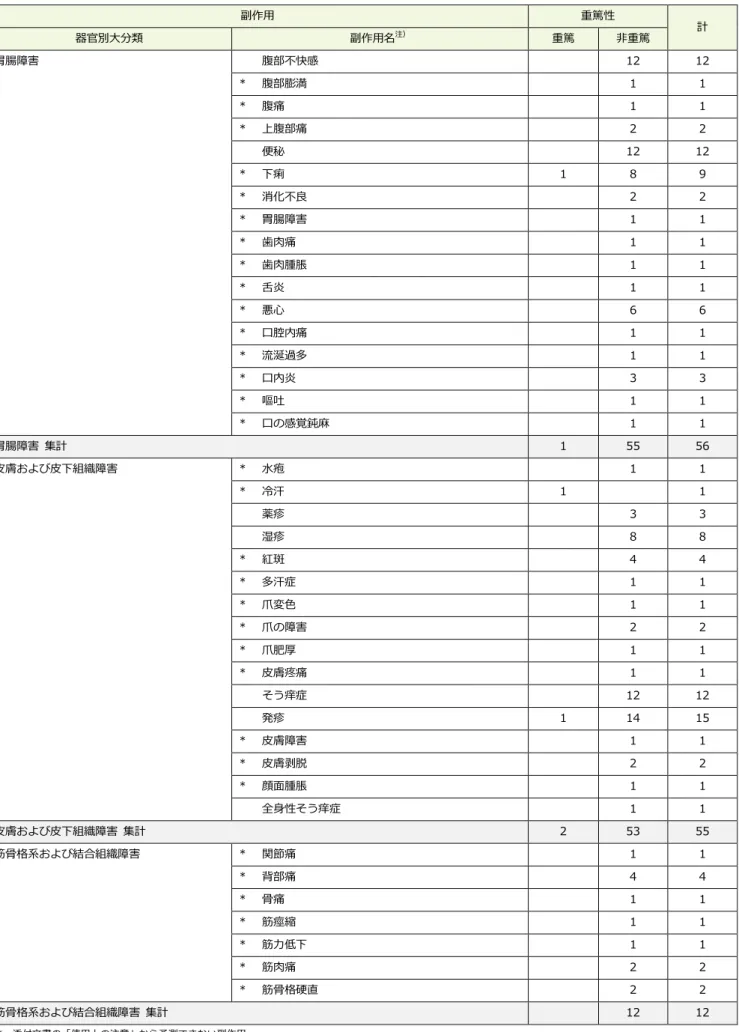
市販直後調査期間中(2011 年 4 月 11 日~2011 年 10 月 31 日)に収集された副作用は 200 例 258 件でし た。そのうち、重篤な副作用は 8 例 14 件でした。副作用の内訳を表 1 に示します。 重篤な副作用は、「高カルシウム血症」3 件、「意識変容状態」2 件、「脱水」、「下痢」、「冷汗」、「発疹」、 「急性腎前性腎不全」、「腎不全」、「胸痛」、「死亡」、「血中カルシウム増加」の各 1 件でした。 表 1 副作用収集件数 副作用 重篤性 計 器官別大分類 副作用名注) 重篤 非重篤 感染症および寄生虫症 * 白癬感染 1 1 感染症および寄生虫症 集計 1 1 内分泌障害 * 抗利尿ホルモン不適合分泌 1 1 内分泌障害 集計 1 1 代謝および栄養障害 * 脱水 1 1 2 高カルシウム血症 3 13 16 * 高リン酸塩血症 2 2 * 低ナトリウム血症 1 1 * 食欲減退 2 2 代謝および栄養障害 集計 4 19 23 精神障害 * 不眠症 1 1 精神障害 集計 1 1 神経系障害 * 意識変容状態 2 2 * 浮動性めまい 9 9 * 味覚異常 3 3 * 頭部不快感 1 1 * 頭痛 5 5 * 感覚鈍麻 1 1 神経系障害 集計 2 19 21 眼障害 * 結膜炎 1 1 眼障害 集計 1 1 耳および迷路障害 * 難聴 1 1 耳鳴 1 1 耳および迷路障害 集計 2 2 心臓障害 * 動悸 1 1 心臓障害 集計 1 1 血管障害 * 潮紅 1 1 * ほてり 3 3 血管障害 集計 4 4 呼吸器、胸郭および縦隔障害 * 咽喉刺激感 1 1 呼吸器、胸郭および縦隔障害 集計 1 1 *:添付文書の「使用上の注意」から予測できない副作用 注):副作用名は MedDRA/J(国際医学用語集の一つ)Ver.14.1 の基本語(PT)を使用表 1 副作用収集件数(続き) 副作用 重篤性 計 器官別大分類 副作用名注) 重篤 非重篤 胃腸障害 腹部不快感 12 12 * 腹部膨満 1 1 * 腹痛 1 1 * 上腹部痛 2 2 便秘 12 12 * 下痢 1 8 9 * 消化不良 2 2 * 胃腸障害 1 1 * 歯肉痛 1 1 * 歯肉腫脹 1 1 * 舌炎 1 1 * 悪心 6 6 * 口腔内痛 1 1 * 流涎過多 1 1 * 口内炎 3 3 * 嘔吐 1 1 * 口の感覚鈍麻 1 1 胃腸障害 集計 1 55 56 皮膚および皮下組織障害 * 水疱 1 1 * 冷汗 1 1 薬疹 3 3 湿疹 8 8 * 紅斑 4 4 * 多汗症 1 1 * 爪変色 1 1 * 爪の障害 2 2 * 爪肥厚 1 1 * 皮膚疼痛 1 1 そう痒症 12 12 発疹 1 14 15 * 皮膚障害 1 1 * 皮膚剥脱 2 2 * 顔面腫脹 1 1 全身性そう痒症 1 1 皮膚および皮下組織障害 集計 2 53 55 筋骨格系および結合組織障害 * 関節痛 1 1 * 背部痛 4 4 * 骨痛 1 1 * 筋痙縮 1 1 * 筋力低下 1 1 * 筋肉痛 2 2 * 筋骨格硬直 2 2
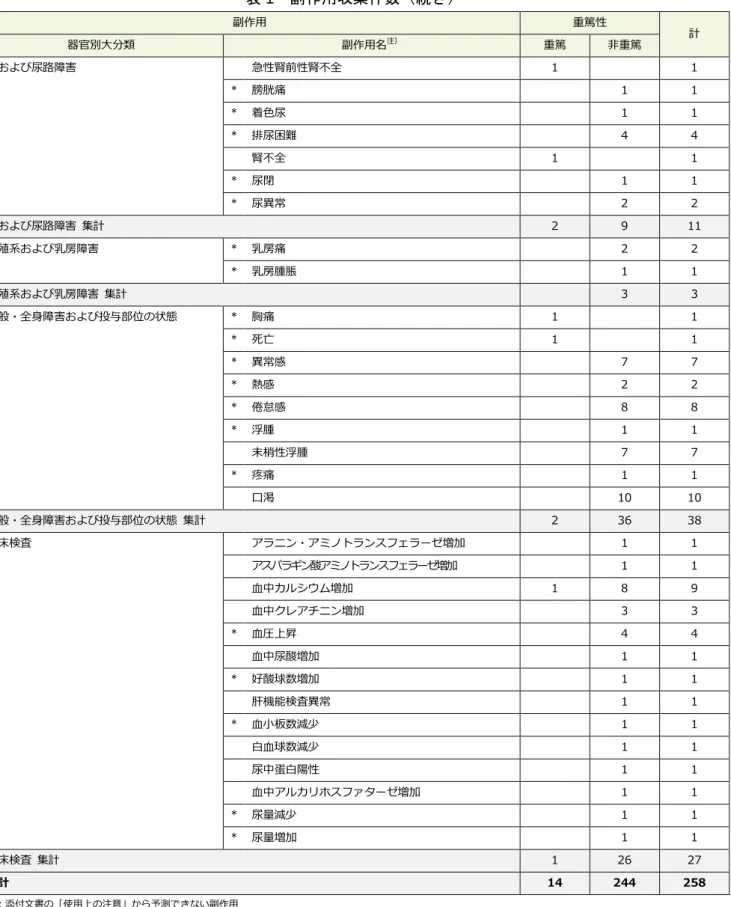
表 1 副作用収集件数(続き) 副作用 重篤性 計 器官別大分類 副作用名注) 重篤 非重篤 腎および尿路障害 急性腎前性腎不全 1 1 * 膀胱痛 1 1 * 着色尿 1 1 * 排尿困難 4 4 腎不全 1 1 * 尿閉 1 1 * 尿異常 2 2 腎および尿路障害 集計 2 9 11 生殖系および乳房障害 * 乳房痛 2 2 * 乳房腫脹 1 1 生殖系および乳房障害 集計 3 3 一般・全身障害および投与部位の状態 * 胸痛 1 1 * 死亡 1 1 * 異常感 7 7 * 熱感 2 2 * 倦怠感 8 8 * 浮腫 1 1 末梢性浮腫 7 7 * 疼痛 1 1 口渇 10 10 一般・全身障害および投与部位の状態 集計 2 36 38 臨床検査 アラニン・アミノトランスフェラーゼ増加 1 1 アスパラギン酸アミノトランスフェラーゼ増加 1 1 血中カルシウム増加 1 8 9 血中クレアチニン増加 3 3 * 血圧上昇 4 4 血中尿酸増加 1 1 * 好酸球数増加 1 1 肝機能検査異常 1 1 * 血小板数減少 1 1 白血球数減少 1 1 尿中蛋白陽性 1 1 血中アルカリホスファターゼ増加 1 1 * 尿量減少 1 1 * 尿量増加 1 1 臨床検査 集計 1 26 27 総計 14 244 258 *:添付文書の「使用上の注意」から予測できない副作用 注):副作用名は MedDRA/J(国際医学用語集の一つ)Ver.14.1 の基本語(PT)を使用
1. 高カルシウム血症、血中カルシウム増加発現症例
市販直後調査期間中に収集した副作用のうち、「高カルシウム血症」が 16 例 16 件、「血中カルシウム 増加」が 9 例 9 件認められました。 発現時の血中カルシウム値 「高カルシウム血症」および「血中カルシウム増加」発現症例(計 25 件)における、発現時の血中カ ルシウム値を図 1 に示します。発現時の血中カルシウム値が確認できた 19 件において、「10.4mg/dL 以下」 が 2 件、「10.4mg/dL を超え、11mg/dL 以下」が 6 件、「11 mg/dL を超え、12mg/dL 以下」が 4 件、「12 mg/dL を超える」が 7 件でした。 図 1 「高カルシウム血症」、「血中カルシウム増加」発現時の血中カルシウム値 発現までの期間 「高カルシウム血症」および「血中カルシウム増加」発現症例(計 25 件)における、発現までの期間 を図 2 に示します。発現までの期間に一定の傾向は認められませんでした。 図 2 「高カルシウム血症」、「血中カルシウム増加」発現までの期間 転帰 「高カルシウム血症」および「血中カルシウム増加」発現症例(計 25 件)における、転帰を図 3 に示 します。転帰が確認できた 16 件中 15 件が回復/軽快しました。処置が確認できた症例では、本剤の減量・ 中止(休薬中を含む)、生理食塩水の投与等が行われました。 0 2 4 6 8 10 不明 12< 11<,≦12 10.4<,≦11 ≦10.4 非重篤 重篤 0 2 4 6 8 10 ~ 7 日 ~ 14 日 ~ 21 日 ~ 28 日 ~ 35 日 ~ 42 日 ~ 49 日 ~ 56 日 ~ 63 日 ~ 70 日 ~ 77 日 ~ 84 日 ~ 91 日 ~ 98 日 ~ 105 日 ~ 112 日 ~ 119 日 120 日~ 不明 回復 13件 軽快 2件 未回復 1件 不明 9件 0% 20% 40% 60% 80% 100% 発現までの期間 (件) (件) * * 発現 2 日前の血中カルシウム値 1 件を含む 血 中 カ ル シ ウ ム 値 (mg/dL) 重篤症例の概要 市販直後調査期間中に収集した副作用のうち、重篤な「高カルシウム血症」が 3 例 3 件、「血中カルシ ウム増加」が 1 例 1 件認められました。これらの症例の概要を表 2 に示します。 4 例中 3 例(表 2、No.2、3、4)については本剤投与前の血中カルシウム値が不明であるものの、4 例 とも本剤投与開始後に血中カルシウム値が高値であることが確認されました。「意識変容状態」、「脱水」、 「急性腎前性腎不全」、「腎不全」は、血中カルシウム値が高値であることに伴って発現した事象と考え られました。転帰が確認できた症例については、本剤の投与中止や生理食塩水の投与後に血中カルシウ ム値および随伴症状の改善が認められました。 表 2 重篤な「高カルシウム血症」、「血中カルシウム増加」発現症例の概要 No. 性別 年齢 副作用名 開始~ 発現 発現~ 転帰 転帰 血中カルシウム値(mg/dL) 備考 開始時 発現時 転帰時 1 女性 70歳代 高カルシウム血症 38日 24日 回復 8.9 12.3 9.5 本剤投与開始前日までアルファカルシ ドール投与。 症状:意識レベル低下→経口摂取不良 →脱水・腎不全 処置:本剤投与中止、生理食塩水の投与 意識変容状態 38日 24日 回復 脱水 48日 29日 回復 急性腎前性腎不全 48日 29日 回復 2 女性 70歳代 高カルシウム血症 不明 不明 回復 不明 発現約2週後: 14.2 (補正カルシウ ム値) 回復1日前: 8.8 20年来ビタミン D 製剤を投与しており、 アルファカルシドールから本剤に変更。 症状:口渇 処置:本剤投与中止、生理食塩水の投与 3 女性 80歳代 高カルシウム血症 63日 11日 回復 不明 発現2日前: 13.0 回復7日後: 9.2 症状:脱水、腎不全 処置:本剤投与中止 腎不全 不明 不明 軽快 4 不明 高齢者 血中カルシウム増加 不明 不明 不明 不明 15 不明 症状:意識障害 処置:本剤投与中止 意識変容状態 不明 不明 回復