第 10 回国際交流奨励賞(橋本賞)受賞者論文
論文種目:技術
リン酸化プロテオミクス情報を活用した Phos-tag SDS-PAGE による
MEK1
リン酸化種の解析
木下英司 *・木下恵美子・小池 透
広島大学大学院医歯薬保健学研究科医薬分子機能科学研究室 (受付 2016 年 12 月 8 日,受理 2017 年 1 月 10 日)SUMMARY
MEK1, a chief component of the mitogen-activated protein kinase (MAPK) pathway, is phosphorylated during acti-vation of the pathway; 12 phosphorylation sites have been identified in human MEK1 by MS-based phosphoproteom-ic methods. By using Phos-tag SDS-PAGE, we found that multiple variants of MEK1 with different phosphorylation states are constitutively present in typical human cell lines. The Phos-tag-based strategy, which makes effective use of existing information on the location of phosphorylation sites (phosphoproteomic data), permits quantitative time-course profiling of MEK1 phosphospecies in their respective phosphorylation states. By subsequent immuno-blotting with an anti-HaloTag antibody, we analyzed a HaloTag-fused MEK1 protein and 12 potential phosphoryla-tion-site-directed mutants of the protein transiently expressed in HEK 293 cells. This strategy revealed that MEK1 is constitutively and mainly phosphorylated at the Thr-292, Ser-298, Thr-386, and Thr-388 residues in vivo, and that combinations of phosphorylations at these four residues produce at least six phosphorylated variants of MEK1. Like the levels of phosphorylation of the Ser-218 and Ser-222 residues by RAF1, which have been well studied, the phosphorylation statuses of Thr-292, Ser-298, Thr-386, and Thr-388 residues vary widely during activation and deactivation of the MAPK pathway. The Phos-tag-based strategy, which effectively uses phosphoproteomic data, per-mits qualitative and quantitative time-course profiling of intact MEK1 phosphospecies molecules in their respective phosphorylation states without loss of information about the molecular masses of the protein species. This combined study involving a Phos-tag-gel-based approach and existing phosphoproteomic data previously obtained by MS-based phosphoproteomic methods has shed new light on the phosphorylation dynamics of MEK1.
Key words: HaloTag, MAPK pathway, MEK1, PhosphoSitePlus, Phos-tag SDS-PAGE
序 論 タンパク質のリン酸化反応は重要な翻訳後修飾であり, これによりその活性は時空間的に厳密に制御される.この 制御が破綻すると,ヒトにおいては癌や神経変性疾患等の 多くの疾病が発症することがよく知られている.よって, タンパク質のリン酸化状態を解析し,その機能を理解する ことは,疾病の原因究明,治療薬の開発,個別化治療に とって極めて重要である.近年,プロテオミクスの進展に 伴って,質量分析によって得られた多くのタンパク質翻訳 後修飾に関する情報が蓄積されてきている1).それらの情 報は膨大で網羅的ではあるが,個々のタンパク質の生体内 での修飾状態を完全にフォローするものではない.本研究 では,プロテオミクス的手法によって明らかにされたタン パク質のリン酸化部位が,生細胞ではどのような状態にお いてどのくらいの割合でリン酸化しているのかを解析する ことを目的とした. 私たちは,リン酸基を特異的に捕捉する分子,Phos-tag を用いたリン酸親和電気泳動法,Phos-tag SDS-PAGE を利 用して,細胞内の情報伝達に関わるタンパク質のリン酸化 状態を解析している2–5).本電気泳動法により細胞抽出液 を分離し,特定のタンパク質のウェスタン解析を行うと,
Phos-tag SDS-PAGE methodology that effectively uses phosphoproteomic data for profiling the phosphorylation dynamics of MEK1 Eiji Kinoshita, Emiko Kinoshita-Kikuta, Tohru Koike
Department of Functional Molecular Science, Institute of Biomedical and Health Sciences, Hiroshima University
* Corresponding author: Eiji Kinoshita; Department of Functional Molecular Science, Institute of Biomedical and Health Sciences, Hiroshima University, Kasumi 1-2-3, Hiroshima 734-8553, Japan
E-mail: kinoeiji@hiroshima-u.ac.jp
4.HaloTag MEK1 の HEK293 細胞における発現とその
リン酸化状態の解析
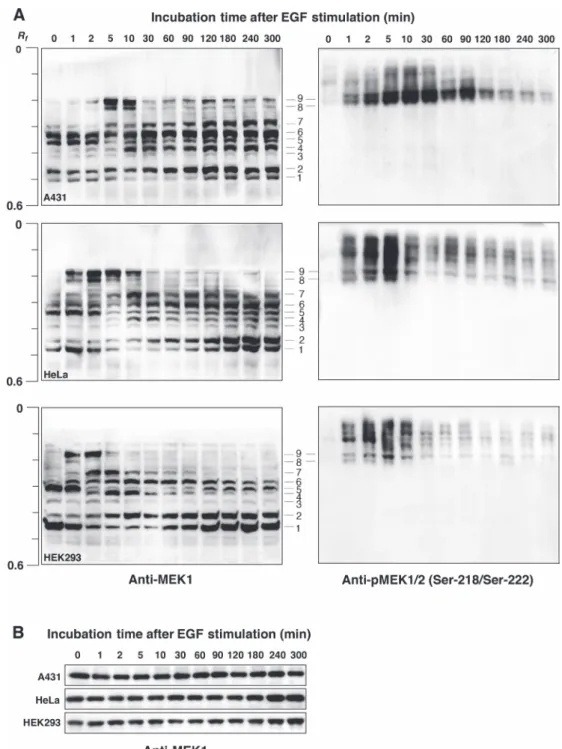
pFN21AE0668及 び そ の 塩 基 置 換 プ ラ ス ミ ド は, Promega 社 の FuGENE HD Transfection reagent を 用 い て HEK293 細胞にトランスフェクションした.24 時間 後に SDS-PAGE 用サンプル溶解液を用いて細胞を溶解 し,SDS-PAGE とその後の抗 HaloTag 抗体を用いたウェス タン解析によって,HaloTag MEK1 の一過性発現を確認し た.その細胞溶解液を Phos-tag SDS-PAGE とウェスタン 解析により分離検出し,HaloTag MEK1 リン酸化種の解析 を行った. 結 果 1.細胞内在性 MEK1 のリン酸化状態の解析 A431,HeLa,HEK293 各 細 胞 株 の 内 在 性 MEK1 は 通 常状態で Phos-tag SDS-PAGE で検出される泳動バンドは 複数あり,複数のリン酸化状態下にあるリン酸化種が少 なくとも 6 つ存在することがわかった(Fig. 1A 左,レー ン 0 min,#1–7 のバンド).EGF 刺激により S218/S222 が 同時にリン酸化され,活性型 MEK1 になることが知られ ているが7, 8),EGF 刺激後において #8 と 9 で示した位置 に新たなバンドが現れた.これらのバンドは抗 pMEK1/2 (S218/S222)抗体と交差性を示した(Fig. 1A 右).また, 通常状態(レーン 0 min)で検出されたバンドの強度比も EGF刺激後に変動した.このことから,MEK1 活性化・ 脱活性化の過程において S218/S222 のリン酸化状態だけ でなく,他の複数のリン酸化部位のリン酸化状態も変動 し,それに伴って生じる複数のリン酸化種の存在比もその 過程で大きく変動していることがわかった.抗体が市販さ れ,既によく研究されているリン酸化部位に関しては,部 位特異的な抗リン酸化抗体を用いることで,そのリン酸化 状態の変動を追跡することは容易である.しかしながら, 抗リン酸化抗体を用いた従来の方法では,標的とするタン パク質分子全体のリン酸化状態を一度に捉えることができ ない.この実験結果は,Phos-tag SDS-PAGE が標的タンパ ク質の経時的リン酸化ダイナミクスのプロファイリングを 可能にすることを示している.一方,Phos-tag を使用しな い従来の SDS-PAGE(Phos-tag-free SDS-PAGE)において は,EGF 刺激前後において,MEK1 のバンドシフトは全 く見られず,いずれのレーンにおいてもほぼ同一の密度の MEK1バンドが確認できた(Fig. 1B). した.既に明らかにされ,データベース(PhosphoSitePlus, http://www.phosphosite. org/homeAction.do)に登録されて いる MEK1 の 12 箇所のリン酸化部位をアラニン置換した 変異体を作製し,Phos-tag SDS-PAGE によるそれらの分離 パターンを野生型のそれと比較解析を行った.これにより, あるリン酸化状態下にあるリン酸化種,並びにそのリン酸 化種に含まれるリン酸化部位を同定することができる.本 研究は,プロテオミクス情報を個々のタンパク質の解析に 活用することで,プロテオミクスのみでは得られない情報 を得ようとする試みである6). 方 法 1.Phos-tag SDS-PAGE とブロッティング Phos-tag SDS-PAGEに お け る 分 離 ゲ ル の 組 成 は, 357 mM Bis-Tris–HCl(pH 6.8),6 %(w/v) ポ リ ア ク リ ルアミド,25 μM Phos-tag アクリルアミド,50 μM ZnCl2 とし,濃縮ゲルの組成は 357 mM Bis-Tris–HCl(pH 6.8), 4%(w/v)ポリアクリルアミドとした.それぞれのゲルは TEMEDと過硫酸アンモニウムを添加して重合した.泳動 緩衝液は 100 mM Tris,100 mM MOPS,0.1%(w/v)SDS, 5 mM NaHSO3とした.1 レーンあたり約 20 μg のタンパ ク質量になるようにアプライして,ゲル 1 枚当たり 40 mA の定電流で 85 分電気泳動を行った.PVDF 膜へのブロッ ティングはタンク式のブロッティング装置を用いた. 2.細胞内在性 MEK1 のリン酸化状態の解析 A431,HeLa,HEK293 各細胞株の通常状態のもの,あ るいは上皮増殖因子(EGF, 100 ng/mL)の刺激を与えたも のを SDS-PAGE 用サンプル溶解液を用いて溶解した.溶 解液は Phos-tag SDS-PAGE で分離し,抗 MEK1 抗体,あ るいは抗 pMEK1/2(S218/S222),pMEK1(pT292, pS298, pT386)抗体(部位特異的抗リン酸化抗体)を用いてウェ スタン解析を行った.
3.Flexi HaloTag ベクターにクローニングされた MEK1
遺伝子上の部位特異的塩基置換
Flexi HaloTagベクターにヒト MEK1 遺伝子がクロー ニ ン グ さ れ た プ ラ ス ミ ド pFN21AE0668 を Promega 社 よ り 購 入 し た.Cell Signaling Technology(CST) 社 の PhosphoSitePlusを参照し,MEK1 のセリン,スレオニン 及びチロシンのリン酸化部位 12 カ所(S72,S212,S218, S222,S231,T286,T292,S298,Y300,S385,T386, T388)について,pFN21AE0668 を鋳型とし,変異導入用
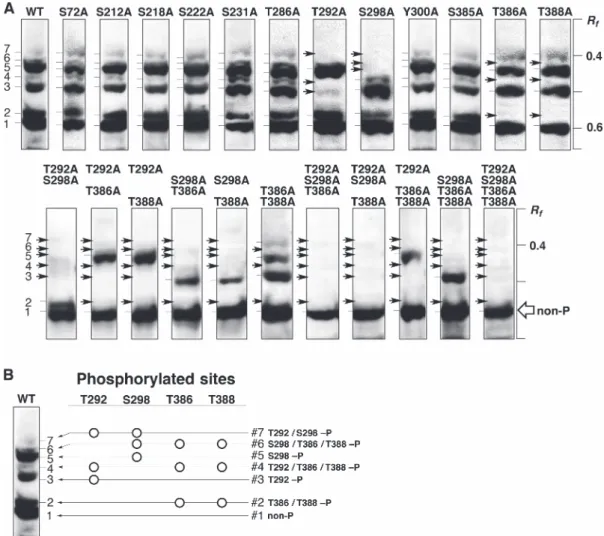
ニン置換し,Phos-tag SDS-PAGE における泳動バンドの 分離パターンを調べた.ゲノム上の塩基置換は煩雑なた め,ヒト MEK1 が HaloTag 融合タンパク質として細胞内 で一過性発現するようにクローニングされたプラスミド pFN21AE0668を用い,抗 HaloTag 抗体によって検出した. HaloTag MEK1は 7 本のバンドとして検出され(Fig. 2A, WT), そ の バ ン ド パ タ ー ン は 内 在 性 MEK1 と 類 似 し 2.HaloTag MEK1(野生型)とその変異体を用いた MEK1 リン酸化種の解析 細胞内 MEK1 のリン酸化状態に寄与するリン酸化部位 を同定した.CST 社の PhosphoSitePlus では,種々のタ ンパク質のリン酸化部位情報が提供されており,ヒトの MEK1では 12 カ所のセリン,スレオニン及びチロシン がリン酸化部位とされている.これらのそれぞれをアラ
Fig. 1 Endogenous MEK1 phosphorylation in A431, HeLa, or HEK293 cells stimulated with EGF, analyzed by using Phos-tag SDS-PAGE or conventional (Phos-tag-free) SDS-SDS-PAGE followed by immunoblotting. (A) The time course of MEK1 phosphorylation after stimulation with EGF (100 ng/mL) for 0–300 min was analyzed by using Zn2+–Phos-tag SDS-PAGE (6.0% w/v polyacrylamide
and 25 μM Zn2+–Phos-tag) followed by immunoblotting with anti-MEK1 antibody (left panels) or anti-pMEK1/2 (Ser-218/Ser-222)
antibody (right panels). (B) The same samples were analyzed by using Phos-tag-free SDS-PAGE followed by immunoblotting with anti-MEK1 antibody. Reprinted with permission from Ref. 6 © (2016) Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim.
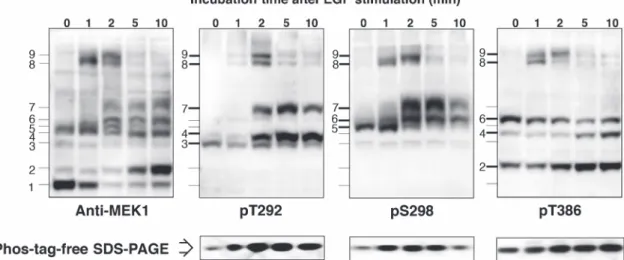
ンドパターンと非常に類似していた.この結果から,内在 性 MEK1 についても T292,S298,T386,T388 の 4 つの アミノ酸が恒常的にリン酸化し,それらのリン酸化残基の 組み合わせによって少なくとも 6 つのリン酸化種が細胞内 において恒常的に存在することが予想された.このことを 確認するため,上記の 4 つのアミノ酸のうち市販化され ている 3 つの部位特異的抗リン酸化 MEK1 抗体(pT292, pS298, pT386)を用いて Phos-tag SDS-PAGE による分離後 の内在性 MEK1 リン酸化種の解析を行った(Fig. 3 上段). その結果,pT292 抗体と交差性を示した内在性 MEK1 リ ン酸化種のバンドは #3,4,7 であり,これは HaloTag MEK1を用いた解析で同定したリン酸化種とすべて一致し た.同様に,pS298 抗体と交差性を示した内在性リン酸化 種のバンドは #5,6,7 であり,pT386 抗体と交差性を示 した内在性リン酸化種のバンドは #2,4,6 であった.こ れらの結果は HaloTag MEK1 を用いた解析結果とすべて同 じであった.以上のことから,内在性 MEK1 においても た(Fig. 1A 左,レーン 0 min を参照).T292A,S298A,
T386A,T388A の各変異体以外は WT と同様に 7 本のバ ンドが検出されたが,それら 4 種の変異体では,矢印で示 したバンドが消失した.このことから,MEK1 の恒常的 なリン酸化に寄与するのはそれら 4 つのアミノ酸(T292, S298,T386,T388)であると考えた.4 つのアミノ酸の うち複数のアミノ酸を同時にアラニン置換した 11 種の変 異体のバンドパターン(Fig. 2A,下段)の結果も合わせて, 6本のシフトアップバンド(#2–7)のそれぞれのリン酸 化種がどのリン酸化アミノ酸を含んでいるのかを決定した (Fig. 2B). 3.部位特異的抗リン酸化抗体を用いた細胞内在性 MEK1 リン酸化種の評価 上述したように,Phos-tag SDS-PAGE によって,細胞内 に発現させた野生型の HaloTag MEK1 は 7 本のバンドと して検出され,そのバンドパターンは内在性 MEK1 のバ
Fig. 2 Profiling of HaloTag-fused MEK1 phosphorylation expressed in HEK 293 cells using Phos-tag SDS-PAGE followed by immuno-blotting. (A) A HaloTag-fused MEK1 protein (WT) and 23 mutants expressed in HEK 293 cells were analyzed by using Zn2+
–Phos-tag SDS-PAGE (5.5% polyacrylamide w/v and 25 μM Zn2+–Phos-tag) followed by immunoblotting with anti-HaloTag antibody. (B)
Phosphorylation sites responsible for each band are summarized. Reprinted with permission from Ref. 6 © (2016) Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim.
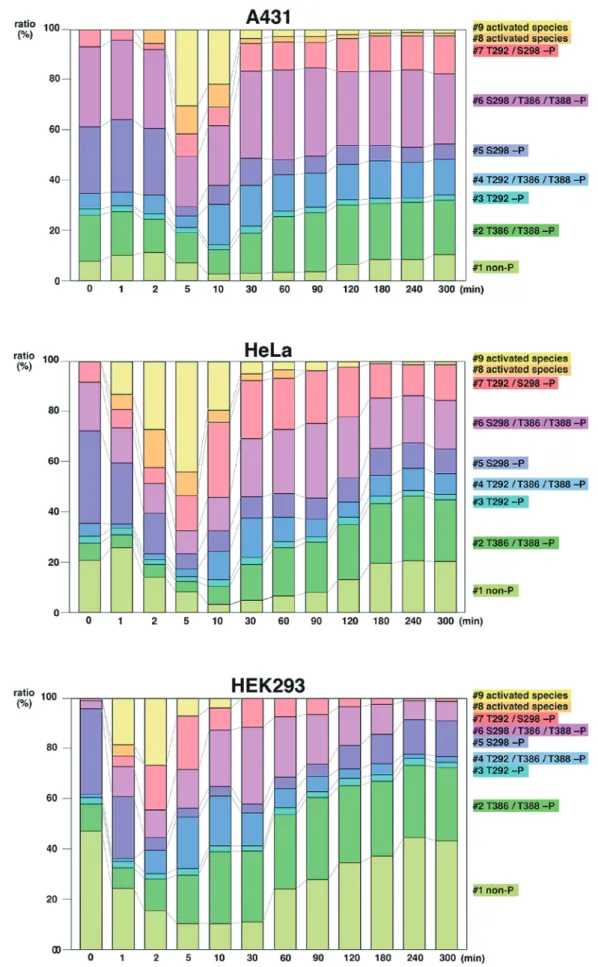
分以内),やがて消失する.これは以前の報告と矛盾しな い3).また,#5 のバンドに相当する S298 残基がリン酸化 されたモノリン酸化種は,活性型リン酸化種の出現に伴い, その存在比がいずれの細胞株においても劇的に減少する. S298残基のリン酸化は MEK1 の活性化に必須であると報 告されている9, 10).したがって,#5 のモノリン酸化種は 活性型リン酸化種を産生するために MEK1 の上流シグナ ル分子である RAF1 の基質として優先的に使用される可能 性が示唆された.これに対して,リン酸化 T386 を含むリ ン酸化種(特に #2 のバンド)は,活性型リン酸化種の出 現に伴い,その存在比がいずれの細胞株においても増大 する.T386 残基のリン酸化は,T292 残基のリン酸化と共 に,MEK1 の活性化を抑制するための ERK によるフィー ドバック制御に関係しているとの報告があり11, 12),今回の MEK1リン酸化ダイナミクスのプロファイリングの結果 はそれと矛盾しない.さらには,EGF 刺激前後の過程に おいて,#3 のバンドに相当する T292 残基がリン酸化さ れたモノリン酸化種は,いずれの細胞株においてもほとん ど変動しなかった.これについても,MEK1 の活性化を 調節するためのフィードバック制御機構の 1 つとしての可 能性が示唆され,大変興味深い.これら各リン酸化種の機 能については,今後のさらなる研究展開が期待される. 考 察 これまでに MEK1 の活性化型において S218/S222 がリ ン酸化されることはよく知られていたが,Phos-tag SDS-PAGEによって,それらの部位以外のアミノ酸が恒常的に T292,S298,T386,T388 の 4 つの主なアミノ酸が恒常的 にリン酸化し,それらのリン酸化残基の組み合わせによっ て少なくとも 6 つのリン酸化種が細胞内において恒常的に 存在することが証明された.なお,いずれの部位特異的抗 リン酸化抗体においても活性型リン酸化種である #8 と 9 のバンドが交差性を示すことから,これらの 2 つの活性型 リン酸化種は少なくとも T292,S298,T386 の 3 つのリン 酸化部位を含んでいることが示唆された.また,以上の結 果から,EGF 刺激前後の MEK1 活性化・脱活性化の過程 において S218/S222 のリン酸化状態だけでなく,他の複数 のリン酸化部位のリン酸化状態も変動し,それに伴って生 じる 6 つのリン酸化種の存在比もその過程で大きく変動し ていることが証明された.一方,Phos-tag を使用しない従 来 の SDS-PAGE(Fig. 3 下 段,Phos-tag-free SDS-PAGE) においても,EGF 刺激前後において,MEK1 のバンドの 密度に差は見られたが,それぞれのリン酸化アミノ酸が含 まれるリン酸化種に関する情報については得ることはでき なかった. 4.細胞内在性 MEK1 のリン酸化ダイナミクス 上記のように,細胞内において恒常的に存在する 6 つ の MEK1 リン酸化種と 2 つの活性型リン酸化種を同定す ることに成功した.最後に,Fig. 1A で示された EGF 刺激 前後の過程における 9 つの MEK1 泳動バンドの存在比の 変動を各細胞株においてデンシトメトリーにより分析した (Fig. 4).その結果,いずれの細胞株においても,2 つの 活性型リン酸化種は EGF 刺激後の早い段階に出現し(10
Fig. 3 Mapping of phosphorylation sites in the respective upshifted migration bands of endogenous MEK1 by immunoblotting with site-specific phosphorylated MEK1 antibodies. The time course of MEK1 phosphorylation in HEK 293 cells after stimulation with EGF (100 ng/mL) for 0–10 min was analyzed by using Zn2+–Phos-tag SDS-PAGE (6.0% w/v polyacrylamide and 25 μM Zn2+
–Phos-tag) followed by immunoblotting with the anti-MEK1 antibody and site-specific phosphorylated MEK1 antibodies against the phosphorylated Thr-292 residue (pT292), phosphorylated Ser-298 residue (pS298), and phosphorylated Thr-386 residue (pT386). We also confirmed that changes occurred in the phosphorylation levels of the three residues of MEK1 in the same samples by using Phos-tag-free SDS-PAGE followed by immunoblotting with the three site-specific phosphorylated MEK1 antibodies. Reprinted with permission from Ref. 6 © (2016) Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim.
Fig. 4 Changes in relative abundance ratios of multiple endogenous MEK1 species before and after EGF stimulation. Densitometric analyses of migration bands #1 to #9 shown in Fig. 1 were performed. The ratios (%) of bands at given incubation times are rep-resented as averages of three independent experiments using the same sample. Reprinted with permission from Ref. 6 © (2016) Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim.
kinase profiling using phosphate affinity polyacrylamide gel electrophoresis. Mol Cell Proteomics. 2007;6:356–366. 4) Kinoshita E, Kinoshita-Kikuta E. Improved Phos-tag
SDS-PAGE under neutral pH conditions for advanced protein phos-phorylation profiling. Proteomics. 2011;11:319–323. 5) Kinoshita E, Kinoshita-Kikuta E, Koike T. Phos-tag
SDS-PAGE systems for phosphorylation profiling of proteins with a wide range of molecular masses under neutral pH conditions. Proteomics. 2012;12:192–202.
6) Kinoshita E, Kinoshita-Kikuta E, Kubota Y, et al. A Phos-tag SDS-PAGE method that effectively uses phosphoproteomic data for profiling the phosphorylation dynamics of MEK1. Proteomics. 2016;16:1825–1836.
7) Alessi DR, Saito Y, Campbell DG, et al. Identification of the sites in MAP kinase kinase-1 phosphorylated by p74raf-1. EMBO J. 1994;13:1610–1619.
8) Zheng CF, Guan KL. Activation of MEK family kinases re-quires phosphorylation of two conserved Ser/Thr residues. EMBO J. 1994;13:1123–1131.
9) Coles LC, Shaw PE. PAK1 primes MEK1 for phosphorylation by Raf-1 kinase during cross-cascade activation of the ERK pathway. Oncogene. 2002;21:2236–2244.
10) Eblen ST, Slack JK, Weber MJ, et al. Rac-PAK signaling stim-ulates extracellular signal-regulated kinase (ERK) activation by regulating formation of MEK1-ERK complexes. Mol Cell Biol. 2002;22:6023–6033.
11) Xu B-e, Wilsbacher JL, Collisson T, et al. The N-terminal ERK-binding site of MEK1 is required for efficient feedback phosphorylation by ERK2 in vitro and ERK activation in vivo. J Biol Chem. 1999;274:34029–34035.
12) Elben ST, Slack-Davis JK, Tarcsafalvi A, et al. Mitogen-activated protein kinase feedback phosphorylation regulates MEK1 complex formation and activation during cellular adhe-sion. Mol Cell Biol. 2004;24:2308–2317.
リン酸化されていることを明らかにした.さらには,恒常 的に存在する MEK1 リン酸化種がその活性化・脱活性化 に伴ってダイナミックに変動することもわかった.また, Phos-tag SDS-PAGEだけでは,恒常的なリン酸化に寄与す るアミノ酸を特定できないが,プロテオミクス情報を活用 して候補アミノ酸をアラニン置換し,それらを同定するこ とができた.個々のタンパク質の生化学的な研究は,プロ テオミクスとは対極にあるように考えられるが,互いに活 用しあって新たな知見を得たことは非常に有意義である. 今後,多くのタンパク質について蓄積されたプロテオミク ス情報を活用して Phos-tag SDS-PAGE による解析を行い, 新たな情報を得たいと考えている. 謝 辞 本研究を通して,東京大学医科学研究所の武川睦寛先生, 久保田裕二先生には有意義なご助言をいただきましたこと, 深く感謝申し上げます.本研究の一部は,東京大学医科学 研究所共同利用・共同研究拠点,平成 28 年度共同研究助 成をいただいて実施しました. 本論文に関して開示すべき利益相反状態は無い. 文 献
1) Kimura Y, Toda T, Hirano H. ModProt: a database for inte-grating laboratory and literature data about protein post- translational modifications. J Electrophoresis. 2016;60:1–4. 2) Kinoshita E, Kinoshita-Kikuta E, Takiyama K, et al.
Phosphate-binding tag, a new tool to visualize phosphorylated proteins. Mol Cell Proteomics. 2006;5:749–757.