部会用資料
モディオダール錠 100 mg
第 2 部(モジュール 2):CTD の概要(サマリー)
2.7.6 個々の試験のまとめ
対照の種類 投与経路 5.3.5.1 比較対照試験 2.7.6.1 有効性, 安全性 (第Ⅲ相) AFT-801-0305 5.3.5.1-1 無作為化, 二重盲検, 並行群間, プラセボ対照 200 mg 1 日 1 回,朝,経口 4 週間 114 例 200 mg 群:52 例 プラセボ群:62 例 閉塞性睡眠時無 呼吸症候群 (日本人) 1 2.7.6.2 有効性, 安全性 (第Ⅱ相) C1538a/402/ AP/US/DB 5.3.5.1-2 無作為化, 二重盲検, 並行群間, プラセボ対照 1 週目 200 mg 2 週目以降 400 mg 1 日 1 回,朝食後, 経口,4 週間 157 例 400 mg 群:77 例 プラセボ群:80 例 閉塞性睡眠時無 呼吸症候群 (外国人) 33 2.7.6.3 有効性, 安全性 (第Ⅲ相) C1538a/303/ AP/US-UK/ DB 5.3.5.1-3 無作為化, 二重盲検, 並行群間, プラセボ対照 200,400 mg 1 日 1 回,朝,経口 12 週間 327 例 400 mg 群:108 例 200 mg 群:110 例 プラセボ群:109 例 閉塞性睡眠時無 呼吸/低呼吸症候 群 (外国人) 63 2.7.6.4 有効性, 安全性 (第Ⅱ相) C1538a/407/ AP/UK 5.3.5.1-4 〔参考資料〕 無作為化, 二重盲検, クロスオーバー, プラセボ対照 1‐5 日目 200 mg 6‐14 日目 400 mg 1 日 1 回,朝,経口 2 週間×2 (休薬 1 週間) 32 例 閉塞性睡眠時無 呼吸 (外国人) 108 2.7.6.5 有効性, 安全性 E-1030 5.3.5.1-5 〔参考資料〕無作為化, 二重盲検, クロスオーバー, プラセボ対照 300 mg 1 日 2 回,朝・昼, 経口,2 週間×2 (休薬 2 週間) 33 例 睡眠時無呼吸症 候群 (外国人) 128 2.7.6.6 有効性, 安全性 E-1033 5.3.5.1-6 〔参考資料〕 無作為化, 二重盲検, 並行群間, プラセボ対照 300 mg 1 日 2 回,朝・昼, 経口,3 週間 49 例 300 mg 群:22 例 プラセボ群:27 例 睡眠時無呼吸症 候群 (外国人) 130 2.7.6.7 有効性, 安全性 (第Ⅲ相) MOD-02 5.3.5.1-7 〔参考資料〕 無作為化, 二重盲検, クロスオーバー, プラセボ対照 300 mg 1 日 2 回,朝・昼食 前,経口, 1 日間×2(休薬な し) 26 例 睡眠時に上気道 閉塞を伴う患者 (外国人) 135 2.7.6.8 有効性, 安全性 (第Ⅲ相) AFT-801-0303 5.3.5.1-8 〔参考資料〕 無作為化, 二重盲検, 並行群間, プラセボ対照 200 mg 1 日 1 回,朝,経口 4 週間 215 例 200mg 群:104 例 プラセボ群:111 例 閉塞性睡眠時無 呼吸症候群 (日本人) 150 5.3.5.2 非対照試験 2.7.6.9 安全性, 有効性 (第Ⅲ相長期) AFT-801-0304 5.3.5.2-1 オープンラベル 100~300 mg 1 日 1 回,朝,経口 52 週間 114 例 閉塞性睡眠時無 呼吸症候群 (日本人) 177 2.7.6.10 安全性, 有効性 (第Ⅱ相) C1538a/402/ AP/US/OL 5.3.5.2-2 オープンラベル 1 週目 200 mg 2 週目 400 mg 3 週目以降 200~ 400 mg 1 日 1 回,朝食後, 経口,12 週間 125 例 閉塞性睡眠時無 呼吸症候群 (外国人) 220 2.7.6.11 安全性, 有効性 (第Ⅲ相長期) C1538a/303/ AP/US-UK/ OL 5.3.5.2-3 オープンラベル 1 週目 200 mg 2 週目 300 mg 3 週目以降 200~ 400 mg 1 日 1 回,朝,経口 12 ヵ月 266 例 閉塞性睡眠時無 呼吸/低呼吸症候 群 (外国人) 247 5.3.5.4 その他の試験 2.7.6.12 安全性, 有効性 (第Ⅲ相長期) CN-0302 5.3.5.4-1 〔参考資料〕 オープンラベル 100~300mg 1 日 1 回,朝,経口 52 週間 64 例 ナルコレプシー (日本人) 276
AHI Apnea Hypopnea Index 無呼吸・低呼吸指数 ALP Alkaline Phosphatase アルカリフォスファターゼ
ALT Alanine Aminotransferase アラニンアミノトランスフェラーゼ ANCOVA Analysis of Covariance 共分散分析
ANOVA Analysis of Variance 分散分析
ArI Arousal Index 覚醒反応指数
ASDA The American Sleep Disorders Association 米国睡眠障害連合会
AST Aspartate Aminotransferase アスパラギン酸アミノトランス フェラーゼ
BiPAP Bilevel Positive Airway Pressure バイレベル型 PAP 装置
BMI Body Mass Index 体格指数[体重(Kg)÷身長(m)2]
BUN Blood Urea Nitrogen 尿素窒素
Ca Calcium カルシウム
CGI-C Clinical Global Impression of Change 全般改善度 CGI-S Clinical Global Impression of Severity
of Disease 全般重症度
CMH Cochran-Mantel-Haenszel(検定) -- CNS Central Nervous System 中枢神経系
COSTART Coding Symbols for a Thesaurus of
Adverse Reaction Terms -- CPAP Continuous Positive Airway Pressure 持続陽圧呼吸
CT Computed Tomography コンピュータ断層撮影 CV Coefficient of Variation 変動係数
百分率表示させた変動係数を「CV%」と表す CYP Cytochrome P450 チトクローム P450
DSM-IV Diagnostic and Statistical Manual of
Mental Disorder, 4th Edition 精神疾患の診断・統計マニュアル第 4 版 ECG Electrocardiogram 心電図
EDS Excessive Daytime Sleepiness 日中の過度の眠気 ESS Epworth Sleepiness Scale エプワース眠気尺度 FAS Full Analysis Set 最大の解析対象集団 FOSQ Functional Outcomes of Sleep
Questionnaire 睡眠の機能的転帰に関する質問票 FT3 Free Triiodothyronine 遊離型トリヨードサイロニン
FT4 Free Thyroxine 遊離型サイロキシン
GCP Good Clinical Practice 医薬品の臨床試験の実施に関する基準 GOT Glutamate Oxaloacetate Transaminase グルタミン酸オキザロ酢酸トランス
アミナーゼ
GPT Glutamate Pyruvate Transaminase グルタミン酸ピルビン酸トランス アミナーゼ
Hb Hemoglobin ヘモグロビン HbA1c Glycosylated Hemoglobin ヘモグロビン A1c
HBs Hepatitis B Surface (antigen) B型肝炎ウイルス(抗原) HIV Human Immunodeficiency Virus ヒト免疫不全ウイルス
K Potassium カリウム
LDH(LD) Lactate Dehydrogenase 乳酸脱水素酵素 LSmean Least Square Mean 最小二乗平均 MAO Monoamine Oxidase モノアミン酸化酵素 MedDRA/J Medical Dictionary for Regulatory
Activities / J
日米欧医薬品規制ハーモナイゼーショ ン国際会議国際医薬用語集日本語版 MSLT Multiple Sleep Latency Test 睡眠潜時反復検査
MWT Maintenance of Wakefulness Test 覚醒維持検査
Na Sodium ナトリウム
NPSG Nocturnal polysomnography 終夜睡眠ポリグラフ検査 OSA Obstructive Sleep Apnea 閉塞性睡眠時無呼吸症 OSAHS Obstructive Sleep Apnea/Hypopnea
Syndrome 閉塞性睡眠時無呼吸/低呼吸症候群 OSAS Obstructive Sleep Apnea Syndrome 閉塞性睡眠時無呼吸症候群 OTC Over-the-Counter 一般用医薬品
P Phosphorus 無機リン
PASAT Paced Auditory Serial Addition Test -- PLMI Periodic Limb Movements Index 周期性四肢運動指数
PPS Per Protocol Set 治験実施計画書に適合した対象集団
PSG Polysomnography 睡眠ポリグラフ検査
PSQI Pittsburgh Sleep Quality Index ピッツバーグ睡眠質問票
PT Preferred Term 基本語
PVT Psychomotor Vigilance Task 精神運動覚醒検査 QOL Quality of Life 生活の質
Q1 Lower Quartile 第 1 四分位点 Q3 Upper Quartile 第 3 四分位点
RBC Red Blood Cell 赤血球数
RDI Respiratory Disturbance Index 呼吸障害指数 REM Rapid Eye Movement 急速眼球運動 SD Standard Deviation 標準偏差
SE Standard Error 標準誤差
SF-36 Medical Outcomes Study 36-Item
SSRI Selective Serotonin Reuptake Inhibitor 選択的セロトニン再取り込み阻害剤
TIB Time in Bed 総就床時間
TMT Trail Making Test --
TSH Thyroid Stimulating Hormone 甲状腺刺激ホルモン TST Total Sleep Time 総睡眠時間
WASO Wake Time after Sleep Onset 中途覚醒時間 WBC White Blood Cell 白血球数 WHO World Health Organization 世界保健機構
βHCG β Human Chorionic Gonadotropin ヒト絨毛性ゴナドトロピン (βサブユニット)
5.3.5 有効性及び安全性試験
5.3.5.1 比
較
対
照
試
験:章番号 2.7.6.1~2.7.6.8
5.3.5.2 非
対
照
試
験 :章番号 2.7.6.9~2.7.6.11
5.3.5.3 複数試験成績を併せた解析 :該当なし
5.3.5.4 そ
の
他
の
試
験:章番号 2.7.6.12
以下,該当なし
5.3.1 生物薬剤学試験
5.3.2 ヒト生体試料を用いた薬物動態試験
5.3.3 臨床薬物動態(PK)試験
5.3.4 臨床薬力学(PD)試験
1)試験方法 試験方法の概要を表 2.7.6.1-1 に示す. 表 2.7.6.1-1 試験方法(1/6) 項目 内容 目的 持続陽圧呼吸(CPAP)治療中の閉塞性睡眠時無呼吸症候群(OSAS)に伴う日中 の過度の眠気(EDS)を有する患者を対象に,モダフィニルのプラセボに対する 優越性について,主要評価項目をエプワース眠気尺度(ESS)の合計スコアとし, 二重盲検比較法を用いて検証する.また,副次評価項目である覚醒維持検査 (MWT)の平均睡眠潜時,夜間睡眠に及ぼす影響,QOL,及びモダフィニルの安 全性についても検討する. 治験デザイン プラセボ対照,無作為化割付,二重盲検並行群間比較,多施設共同試験 被験者数 目標症例数:最大の解析対象集団(FAS)として 102 例(うち,合計 40 例以上で MWT を実施する). 対象選択基準 1)一次登録 一次登録時に以下の選択基準をすべて満たしている患者 (1)OSAS と診断されている患者 (2)CPAP 機器の使用開始から 3 ヵ月以上経過している,かつ治験中において も使用を継続できる患者 (3)CPAP 機器の使用コンプライアンスが良好な患者 (4)一次登録時に評価した ESS 合計スコアが 11 点以上の患者 (5)20 歳以上 70 歳以下の患者(同意取得時) (6)外来患者 (7)説明文書が理解でき,患者本人の自由意思による文書同意が得られる患者 2)二次登録 二次登録時に以下の選択基準をすべて満たしている患者 (1)一次登録時の選択基準を満たしている患者 (2)観察期に実施する終夜睡眠ポリグラフ検査(PSG)において,CPAP 使用時 の無呼吸・低呼吸指数(AHI)が 10 以下である患者 (3)観察期の終夜 PSG 実施時(二次登録前日に終夜 PSG を実施する患者は不 要),及び二次登録時に評価した ESS 合計スコアがいずれも 11 点以上の患 者 (4)二次登録日前 14 日間(連続する 14 夜)のうち,一夜あたり 4 時間以上 CPAP 機器を使用した日数が 10 日(70%)以上であることが,CPAP 機器 の記録により確認できる患者 対象除外基準 1)一次登録 一次登録時に以下の除外基準に抵触する患者 (1)ナルコレプシー,周期性四肢運動障害,中枢性睡眠時無呼吸症候群を合併 する患者 (2)変則的な交代勤務,又は夜間勤務をしている,あるいは観察期開始日から 治療期終了日までに勤務予定がある患者 (3)慢性化した睡眠不足の患者,あるいは就寝時間が著しく不規則な患者 (4)チェーン・ストークス呼吸を合併している患者
表 2.7.6.1-1 試験方法(2/6) 項目 内容 対象除外基準 (5)うつ病,躁病,統合失調症などの精神疾患により,入院歴を有する患者, 又は薬物治療を受けている患者 (6)脳器質障害,てんかんを合併している患者 (7)脳血管障害(無症候性ラクナ梗塞を除く)を合併している,あるいは既往 のある患者 (8)心不全,心筋梗塞,狭心症,心筋症を合併している患者,あるいは治験責任 医師又は治験分担医師が臨床上問題であると判断した不整脈を合併してい る患者(「医薬品等の副作用の重篤度分類基準について(薬安第 80 号)」の グレード 2 以上を参考にする) (9)高血圧(一次登録時の収縮期血圧が 160 mmHg 以上又は拡張期血圧が 100 mmHg 以上)の患者(薬物治療の有無は問わない) (10)緑内障で治療中の患者 (11)甲状腺機能亢進症で治療中の患者 (12)閉塞性の呼吸器疾患(慢性閉塞性肺疾患,気管支喘息等)を合併している 患者 (13) 治験責任医師又は治験分担医師が臨床上問題であると判断した肝臓,腎臓, 血液系の疾患を合併している患者(「医薬品等の副作用の重篤度分類基準に ついて(薬安第 80 号)」のグレード 2 以上の症状を参考にする) (14)薬物アレルギーの既往のある患者 (15)薬物依存症,アルコール依存症のある,あるいはその既往のある患者 (16)妊娠している女性患者,妊娠している可能性のある女性患者,授乳中の女性 患者,又は同意取得日から治療期終了日まで避妊することに同意が得られな い妊娠可能な女性患者 (17)同意取得日から治療期終了日まで避妊することに同意が得られない男性患 者 (18)一次登録日前 4 ヵ月以内に他の治験に参加した患者,あるいは同意取得日 から治療期終了日までに参加の予定がある患者 (19)自動車の運転など危険を伴う機械の操作を主たる業務としている患者,あ るいは同意取得日から治療期終了日までにその予定がある患者 (20)モダフィニル治験(治験番号:AFT-801-0303[資料番号 5.3.5.1-8])に参加 し,治験薬を服用したことのある患者 (21)モダフィニルの服薬経験のある患者 (22)その他,治験責任医師又は治験分担医師が,治験の対象として不適当と判 断した患者 2)二次登録 二次登録時に以下の除外基準に抵触する患者 (1)一次登録時の除外基準に抵触する患者 (2)観察期に実施する終夜 PSG において,周期性四肢運動指数(PLMI)が 15 を超える患者 (3)高血圧(二次登録時の収縮期血圧が 160 mmHg 以上又は拡張期血圧が 100 mmHg 以上)の患者(薬物治療の有無は問わない)
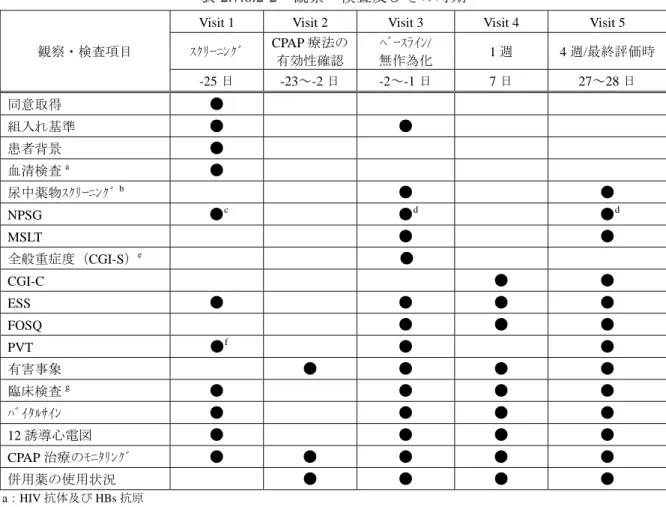
表 2.7.6.1-1 試験方法(4/6) 項目 内容 併用薬・ 併用療法 (9)ワルファリン (10)昇圧薬(ドパミン塩酸塩,エピネフリンなど.但し,歯科用の局所麻酔剤 に配合されている成分は併用可能とする) (11)MAO 阻害薬(セレギリン塩酸塩) (12)トリプタン系片頭痛治療薬(スマトリプタンコハク酸塩,ナラトリプタン 塩酸塩,ゾルミトリプタン,リザトリプタン安息香酸塩,エレトリプタン 臭化水素酸塩) (13)他の治験薬 2)併用注意薬 下記薬剤を併用する場合は十分に注意する. (1)CYP2C9 で代謝される薬剤(トルブタミド,ナテグリニド,ジクロフェナク ナトリウムなど) (2)CYP2C19 で代謝される薬剤(プロプラノロール,オメプラゾールなど) (3)CYP3A4 で代謝される薬剤(カルシウム拮抗薬,ベンゾジアゼピン系薬, ステロイド系避妊薬など) 3)併用療法(CPAP) 二次登録日 14 日前から治療期を通じ,CPAP の使用条件(機種,マスクの型, 送気圧力)は変更しない. 観察・検査 及びその時期 MWT 実施例及び MWT 非実施例における観察・検査及びその時期を表 2.7.6.1-2に示す. 有効性及び 安全性の評価 1)有効性評価項目 (1)主要評価項目 最終評価時における ESS 合計スコア (2)副次評価項目 ① MWT 平均睡眠潜時(実施例のみ) ② 測定時期毎の ESS 合計スコア ③ 終夜 PSG における睡眠パラメータ(実施例のみ) ④ ピッツバーグ睡眠質問票(PSQI)の総合スコア ⑤ SF-36 の各下位尺度の合計スコア 2)安全性評価項目 (1)有害事象(重篤度,程度,処置,治験薬との因果関係) (2)臨床検査値(血液学的検査,血液生化学的検査,内分泌学的検査,尿検査) (3)生理学的検査値(血圧,脈拍数),体重 (4)12 誘導心電図 注)有害事象の取扱い 治験薬投与後,治療期終了日までに被験者に生じた,あらゆる好ましくない, あるいは意図しない徴候(各種検査値の異常変動を含む),症状又は病気を「有害 事象」とし,治験薬との因果関係の有無は問わない.治験薬との因果関係が否定 できないものを「副作用」とする.
表 2.7.6.1-1 試験方法(5/6)
項目 内容
有効性及び 安全性の評価
なお,CPAP 治療中の OSAS に伴う EDS の悪化は,有害事象として基本的に取 扱わないこととするが,重篤な場合又は治験責任医師又は治験分担医師が有害事 象として取り上げると判断した場合はその限りではない. 次の①~⑧を有害事象とする. ① 新たに発現した疾患及び症状 ② 合併症の悪化 ③ 事故 ④ 検査値の異常変動 ⑤ 薬物相互作用による好ましくない所見 ⑥ 過量投与による好ましくない所見(過量投与の判断は,治験責任医師又は治 験分担医師による) ⑦ 依存性の発現 ⑧ その他治験責任医師又は治験分担医師が有害事象と認めたもの 有害事象は,最も悪化した時の程度について下記の 3 段階で判定する.なお, 事象が臨床検査値の異常変動の場合,「医薬品等の副作用の重篤度分類基準につい て(薬安第 80 号)」を参考に判定する. 程度 基準 軽度 日常生活に特に支障をきたさない 中等度 日常生活に支障をきたす 高度 日常生活がほとんどおくれない 統計解析法 1)有効性 有効性の解析は,FAS を対象として行う.また,主要評価項目については治験 実施計画書に適合した対象集団(PPS)を対象とした解析も副次的に行い,結果 の頑健性について検討する. FAS は,以下の全ての基準を満たすものとする. (1)GCP 違反例でない.
(2)対象疾患が CPAP 治療中の OSAS に伴う EDS である. (3)治験薬の投与が 1 回以上行われている. (4)治験薬投与開始後に有効性に関する評価が 1 回以上行われている. PPS は,FAS 対象例のうち,以下の全ての基準を満たすものとする. (1)選択基準を全て満たし,除外基準に抵触しない. (2)服薬遵守例(投与期間中の服薬率が 70%以上) (3)CPAP 機器使用遵守例(投与期間中の CPAP 機器使用率(4 時間以上/1 夜) が 70%以上). (4)併用禁止薬の規定に抵触しない. (5)治療期最終の主要評価項目(ESS)が評価されている. 主要評価項目である ESS 合計スコアの最終評価時におけるベースラインからの 差(変化量)について,ベースライン値を共変量とした共分散分析(ANCOVA) により投与群間の比較を行い,最小二乗平均(LSmean)に基づくプラセボ群に対 するモダフィニル 200 mg 群の差の点推定値と 95%信頼区間を示す.
表 2.7.6.1-1 試験方法(6/6) 項目 内容 統計解析法 2)安全性 安全性解析対象集団は,以下の全ての基準を満たすものとする. (1)GCP 違反例でない. (2)治験薬の投与が 1 回以上行われている. (3)治験薬投与開始後に安全性に関する観察・評価が 1 回以上行われている. 有害事象並びに副作用発現例数について,投与群別並びに症状別〔MedDRA/J Ver. 12.1/基本語(PT)〕に重篤度,程度,処置,治験薬との因果関係について集 計する.また,有害事象並びに副作用について発現率を求め,Fisher の直接法に て,投与群間の比較を行う. 臨床検査(尿検査を除く)値,生理学的検査値及び体重については,投与群別 並びに検査時期別に要約統計量を求める. 3)人口統計学及びその他の基準値の特性 人口統計学及びその他の基準値の特性については,投与群ごとに要約統計量を 求める. 4)有意水準及び信頼係数 有効性及び安全性の検定における有意水準は両側確率 5%とする.信頼区間は 両側信頼区間とし,信頼係数は 95%とする.
表 2.7.6.1-2 観察・検査及びその時期 [MWT 実施例] [MWT 非実施例] 一次 登録日 二次 登録 日 服薬開始日 1週 -14 -14 -8 -7 0 1 7 27 28 ~-14 -42~ -14 -13 -12 -11 -10 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 1 5~9 25~30 25~31 ●※1) ● ● ● ●※2) ●※2), 3) ● ●※2) ●※4) ● ●※5) ●※5) ●※2) ●※2) ●※2) ●※2) ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ※1)同意取得は,全ての観察・検査に先立ち実施する. ※2)ESS,PSQI及びSF-36は,問診を含む全ての諸検査前に実施する.但し,入院し検査を行う場合,入院日の問診を含む全ての諸検査前に実施する. ※3)二次登録前日に観察期の終夜PSGを実施する被験者は実施不要. ※4)AHI並びにPLMIが二次登録実施までに算出が可能なこと. ※5)MWTは,終夜PSG翌日に実施する(治療期4週の場合の許容範囲は26~31日). ※6)血液生化学的検査,血液学的検査,内分泌学的検査,尿検査 ※7)治療期に中止した場合,可能な限り治療期4週の観察・検査を実施する. 網掛け 各観察・検査項目の観察期における来院許容範囲 体重 MWT SF-36 血圧・脈拍数 12誘導心電図 身長 PSQI 併用薬確認 CPAP使用率調査 臨床検査 ※6) 有害事象 妊娠検査 服薬状況 治療期(28日間) 二次登録 同意取得 一次登録 観察期(15日間以上) 基準日 一次 登録前 4週 (中止時※7)) 許容範囲 終夜PSG ESS 観察期(15日間以上) 治療期(28日間) 終 夜 P S G M W T 二 次 登 録 同 意 一 次 登 録 E S S M W T 治験薬 割付 治験薬投与期間 (モダフィニルあるいはプラセボ) PS QI ・ SF 36 終 夜 P S G E S S PS QI ・ SF 36 E S S E S S 一次 登録日 二次 登録 日 服薬開始日 1週 -14 -14 -7 0 1 7 27 28 ~-14 -42~ -14 -13 -12 -11 -10 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 1 5~9 25~30 25~31 ●※1) ● ● ● ●※2) ●※2), 3) ● ●※2) ●※4) ●※5) ●※2) ●※2) ●※2) ●※2) ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ※1)同意取得は,全ての観察・検査に先立ち実施する. ※2)ESS,PSQI及びSF-36は,問診を含む全ての諸検査前に実施する.但し,入院し検査を行う場合,入院日の問診を含む全ての諸検査前に実施する. ※3)二次登録前日に観察期の終夜PSGを実施する被験者は実施不要. ※4)AHI並びにPLMIが二次登録実施までに算出が可能なこと. ※5)最終評価時の終夜PSGの実施に同意した被験者のみ ※6)血液生化学的検査,血液学的検査,内分泌学的検査,尿検査 ※7)治療期に中止した場合,可能な限り治療期4週の観察・検査を実施する. 網掛け 各観察・検査項目の観察期における来院許容範囲 一次 登録前 観察期(15日間以上) 治療期(28日間) 4週(中止時※7)) 臨床検査 ※6) 基準日 同意取得 許容範囲 一次登録 二次登録 ESS 身長 体重 終夜PSG SF-36 血圧・脈拍数 12誘導心電図 PSQI 服薬状況 CPAP使用率調査 併用薬確認 妊娠検査 有害事象 終 夜 P S G 二 次 登 録 同 意 一 次 登 録 E S S PS QI ・ SF 36 治験薬 割付 治療期(28日間) 観察期(15日間以上) 治験薬投与期間 (モダフィニルあるいはプラセボ) 終 夜 P S G E S S E S S PS QI ・ SF 36 E S S E S S
[被験者数の設定根拠]
モダフィニルの CPAP 治療中の OSAS に伴う EDS を対象にした国内試験(治験番号: AFT-801-0303[資料番号:5.3.5.1-8])及び海外試験(治験番号:C1538a/303/AP/US-UK/DB[資 料番号:5.3.5.1-3])の ESS 合計スコアの投与 4 週後におけるベースラインからの変化量を表 2.7.6.1-3 に示す. 表 2.7.6.1-3 ESS 合計スコアの投与 4 週後におけるベースラインからの変化量(点) 試験 モダフィニル a プラセボ 群間差 例数 平均値 ± SD 例数 平均値 ± SD 平均値 ± SD 国内試験 104 -7.50 ± 5.34 111 -3.00 ± 4.21 4.50 ± 4.79 海外試験 95 -3.22 ± 4.25 93 -1.06 ± 3.09 2.15 ± 3.72 国内+海外 199 -5.46 ± 5.29 204 -2.12 ± 3.86 3.34 ± 4.62 a:200 mg/日投与 国内試験での ESS 合計スコアの投与 4 週後におけるベースラインからの差(変化量)の平均 値±SD は,モダフィニル群が-7.50±5.34 点,プラセボ群が-3.00±4.21 点であり,群間差は 4.50 ±4.79 点であった.一方,海外試験における群間差は 2.15±3.72 点であった. 上記の国内及び海外試験結果を併合した成績に基づき,今回の試験の主要評価項目である ESS 合計スコアの投与 4 週後におけるベースラインからの変化量について,プラセボ群に対す るモダフィニル群の平均値の差を 3.34 点,両群共通の標準偏差を 4.62 点と仮定した.このと き,プラセボ群に対するモダフィニル群の優越性を検証するために必要な例数は,1 群につき 51 例(t 検定,α= 0.05(両側),1-β= 0.95)と算出された.従って,FAS として 102 例を目標 症例数として設定した. また,MWT 実施例については,実施可能性を考慮し,1 群 20 例以上,合計 40 例以上と設定 した.
[用法・用量,投与期間の設定根拠] 国内の第Ⅰ相試験〔「ナルコレプシー」承認時 2.7.6.10 p.53〕において,モダフィニルを 100 ~300 mg 1 日 1 回,7 日間反復経口投与した結果,忍容性に問題は認められなかった.一方, 米国の承認用量である 200 mg/日を日本人に反復経口投与した際の薬物動態は,米国人のそれ に近似していたことより,日本人においても臨床用量は 200 mg/日と推察された. また,国内の第Ⅰ相試験〔「ナルコレプシー」承認時 2.7.6.1 p.1〕において,モダフィニル 200 mg を 1 日 1 回空腹時と食後投与にて検討した結果,両投与方法で薬物動態に差が認められ なかったことから投与に際して食事の前後を問う必要はないと考えた. 以上のことから,用法・用量をモダフィニルとして 1 日 1 回 200 mg 投与と設定した. 投与期間は,海外の第 III 相試験(治験番号:C1538a/303/AP/US-UK/DB[資料番号:5.3.5.1-3]) における ESS 合計スコア及び MWT 平均睡眠潜時の改善が 4,8,12 週においてほぼ同程度で あったことから 4 週間と設定した.
2)症例の内訳 症例の内訳を図 2.7.6.1-1,登録抹消症例の内訳を表 2.7.6.1-4 に示す. 151 例が一次登録され,このうち除外基準に抵触するなどの理由で二次登録前に登録抹消され た 37 例を除く 114 例(モダフィニル 200 mg 群 52 例,プラセボ群 62 例)が二次登録され,全例 に治験薬が投与された.114 例全例が投与を完了し,中止症例はなかった.なお,登録抹消症例 37 例の内訳は,二次登録適格基準外が 35 例(PLMI が 15 を超えたため:13 例,一夜あたり 4 時 間以上の CPAP 使用日数が 10 日未満のため:8 例,AHI が 10 を超えたため:5 例,その他(臨床 検査値異常 等):9 例),同意撤回及び被験者のスケジュール都合が各 1 例であった. 一次登録症例 151 例 二次登録/割付症例 登録抹消症例 114 例 37 例 200 mg 52 例 プラセボ 62 例 投与症例 114 例 200 mg 52 例 プラセボ 62 例 完了症例 中止症例 114 例 0 例 200 mg 52 例 200 mg 0 例 プラセボ 62 例 プラセボ 0 例 図 2.7.6.1-1 症例の内訳 表 2.7.6.1-4 登録抹消症例の内訳 登録抹消理由 例数 二次登録時の適格基準外のため 35 PLMI が 15 を超えたため (13) 一夜あたり 4 時間以上の CPAP 使用日数が 10 日未満のため (8) AHI が 10 を超えたため (5) その他(臨床検査値異常 等) (9) 同意撤回 1 被験者のスケジュール都合 1 合計 37
3)解析対象集団の内訳 解析対象集団の内訳を図 2.7.6.1-2 に示す. 治験薬が 114 例に無作為に割付けられ,全例に投与された.FAS 及び安全性解析対象集団はい ずれも 114 例(モダフィニル 200 mg 群 52 例,プラセボ群 62 例)であり,当該解析から除外され た症例はなかった. また,PPS は,6 例(200 mg 群 3 例,プラセボ群 3 例)を除いた 108 例(200 mg 群 49 例,プ ラセボ群 59 例)であった. 二次登録/割付症例 114 例 200 mg 52 例 プラセボ 62 例 投与症例 114 例 200 mg 52 例 プラセボ 62 例 有効性解析対象集団(FAS) 安全性解析対象集団 114 例 114 例 200 mg 52 例 200 mg 52 例 プラセボ 62 例 プラセボ 62 例 有効性解析対象集団(PPS) PPS 除外症例 108 例 6 例 200 mg 49 例 200 mg 3 例 プラセボ 59 例 プラセボ 3 例 図 2.7.6.1-2 解析対象集団の内訳
PPS より除外された 6 例(モダフィニル 200 mg 群 3 例,プラセボ群 3 例)の除外理由を表 2.7.6.1-5 に示す. 治療期に一夜あたり 4 時間以上 CPAP を使用した日数が 70%未満であった症例が 4 例(200 mg 群 3 例,プラセボ群 1 例),観察期に中枢神経刺激薬を服用した症例がプラセボ群で 1 例,観察期 に抗ヒスタミン薬を服用した症例がプラセボ群で 1 例,治療期に中枢神経刺激薬を服用した症例 がプラセボ群で 1 例であった. 表 2.7.6.1-5 PPS 除外理由 除外理由 200 mg プラセボ 観察期に中枢神経刺激薬を 3 日間服用 -- 1 観察期に抗ヒスタミン薬を 3 日間服用 -- 1 治療期に中枢神経刺激薬を 1 日服用 -- 1 治療期に一夜あたり 4 時間以上 CPAP を使用した日数が 70%未満 3 1 計 3 例 3 例* *:重複例を除く
4)CPAP の使用状況 評価時期別の CPAP 使用遵守率(1 夜あたり 4 時間以上使用した日数の割合)及び CPAP 平均 使用時間の推移を表 2.7.6.1-6,表 2.7.6.1-7 に示す. CPAP 使用遵守率はモダフィニル 200 mg 群で 1 週 89.73%,4 週 91.19%,プラセボ群で 1 週 93.24%,4 週 89.30%であり,治療期全体では 200 mg 群 90.90%,プラセボ群 90.23%であった. CPAP 平均使用時間は 200 mg 群で 1 週 5.72 時間/日,4 週 6.05 時間/日,プラセボ群で 1 週 5.88 時間/日,4 週 5.75 時間/日であった.治療期全体では 200 mg 群 5.97 時間/日,プラセボ群 5.78 時 間/日であり,いずれの時期においても両群ともに 5 時間/日以上であった. 表 2.7.6.1-6 CPAP 使用遵守率(%) 評価時期 投与群 使用遵守率(%) 例数 平均値 ± SD Q1 Q3 1 週 200 mg 52 89.73 ± 16.19 83.33 100.00 プラセボ 62 93.24 ± 11.54 85.71 100.00 4 週 200 mg 52 91.19 ± 13.83 87.23 100.00 プラセボ 62 89.30 ± 14.35 85.00 100.00 治療期全体 200 mg 52 90.90 ± 12.66 88.46 100.00 プラセボ 62 90.23 ± 11.98 85.71 100.00 Q1:第 1 四分位点 Q3:第 3 四分位点 表 2.7.6.1-7 CPAP 平均使用時間(時間/日) 評価時期 投与群 平均使用時間(時間/日) 例数 平均値 ± SD Q1 Q3 1 週 200 mg 52 5.72 ± 1.32 4.86 6.57 プラセボ 62 5.88 ± 0.84 5.33 6.43 4 週 200 mg 52 6.05 ± 1.24 5.52 6.63 プラセボ 62 5.75 ± 1.02 5.24 6.25 治療期全体 200 mg 52 5.97 ± 1.19 5.43 6.66 プラセボ 62 5.78 ± 0.91 5.35 6.29 Q1:第 1 四分位点 Q3:第 3 四分位点
5)患者背景 FAS の患者背景を表 2.7.6.1-8 に示す. モダフィニル 200 mg 群,プラセボ群ともに男性の割合が 90%以上と多く,平均年齢はそれぞ れ 49.0 歳,50.5 歳,平均 BMI は 27.86 kg/m2 ,27.30 kg/m2 であった.平均 ESS 合計スコアは 200 mg 群 14.27 点,プラセボ群 14.60 点であった.また,合併症を有する患者は 200 mg 群 35 例(67.3%), プラセボ群 47 例(75.8%)であり,その内訳は高血圧がそれぞれ 13 例(25.0%),20 例(32.3%), 糖尿病が 7 例(13.5%),3 例(4.8%),高脂血症が 4 例(7.7%),14 例(22.6%)であった. このように,両群の患者背景に大きな違いはみられなかった. 表 2.7.6.1-8 患者背景(FAS) 患者背景 (52 例) 200 mg プラセボ (62 例) 性別 男性(%) 49 (94.2) 61 (98.4) 女性(%) 3 (5.8) 1 (1.6) 年齢(歳) 平均値 ± SD 49.0 ± 10.4 50.5 ± 9.2 範囲 24~66 30~69 身長(cm) 平均値 ± SD 166.56 ± 6.30 168.70 ± 5.75 範囲 140.5~178.0 148.0~180.0 体重(kg) 平均値 ± SD 77.42 ± 12.99 77.76 ± 10.91 範囲 46.5~119.5 56.9~106.4 BMI(kg/m2) 平均値 ± SD 27.86 ± 4.31 27.30 ± 3.46 範囲 21.3~46.0 21.3~38.0 ESS 合計スコア(点) 平均値 ± SD 14.27 ± 2.67 14.60 ± 3.12 範囲 11.0~20.0 11.0~23.0 AHI 平均値 ± SD 2.79 ± 2.71 2.63 ± 2.61 範囲 0.0~9.7 0.0~9.8 合併症 全例 有(%) 35 (67.3) 47 (75.8) 無(%) 17 (32.7) 15 (24.2) 高血圧 有(%) 13 (25.0) 20 (32.3) 無(%) 39 (75.0) 42 (67.7) 糖尿病 有(%) 7 (13.5) 3 (4.8) 無(%) 45 (86.5) 59 (95.2) 高脂血症 有(%) 4 (7.7) 14 (22.6) 無(%) 48 (92.3) 48 (77.4) 併用 薬 全例 有(%) 20 (38.5) 36 (58.1) 無(%) 32 (61.5) 26 (41.9) 高血圧治療薬 有(%) 12 (23.1) 17 (27.4) 無(%) 40 (76.9) 45 (72.6) 糖尿病治療薬 有(%) 3 (5.8) 3 (4.8) 無(%) 49 (94.2) 59 (95.2) 高脂血症治療薬 有(%) 3 (5.8) 8 (12.9) 無(%) 49 (94.2) 54 (87.1)
6)有効性 (1)主要評価項目:最終評価時における ESS 合計スコア FAS の最終評価時における ESS 合計スコアを表 2.7.6.1-9,図 2.7.6.1-3 に示す. ESS 合計スコアは,モダフィニル 200 mg 群ではベースライン 14.27 点から最終評価時 7.75 点に,プラセボ群では 14.60 点から 12.08 点に減少した.ベースライン値を共変量とした最終 評価時におけるベースラインからの変化量(LSmean)は,200 mg 群-6.61 点,プラセボ群-2.44 点で,群間差は-4.17 点(95%信頼区間:-5.66~-2.69 点)であり,ESS 合計スコアは 200 mg 群 でプラセボ群に比し有意に減少した(p < 0.001,ANCOVA). 表 2.7.6.1-9 最終評価時における ESS 合計スコア(点)(FAS) 投与群 例数 ベースライン 最終評価時 変化量 変化量の差 検定a 平均値 ± SD 平均値 ± SD LSmean SE 95%信頼区間 LSmean SE 95%信頼区間 200 mg 52 14.27 ± 2.67 7.75 ± 4.52 -6.61 0.55 -7.71~-5.52 -4.17 0.75 -5.66~ -2.69 p < 0.001 プラセボ 62 14.60 ± 3.12 12.08 ± 3.93 -2.44 0.51 -3.44~-1.44 a:投与群を要因とし,ベースライン値を共変量とした ANCOVA 図 2.7.6.1-3 ESS 合計スコア(FAS) PPS での ESS 合計スコアのベースライン値を共変量とした最終評価時におけるベースライン からの変化量(LSmean)は,200 mg 群が-6.68 点,プラセボ群が-2.38 点で,群間差は-4.30 点 (95%信頼区間:-5.78~-2.82 点)であり,両群間に有意差がみられ(p < 0.001,ANCOVA), FAS での結果(表 2.7.6.1-9)と同様であった. 7.75 14.27 14.60 12.08 0 5 10 15 20 200 mg プラセボ n = 52 n = 62 ベースライン n = 52 n = 62 最終評価時 合計 スコア(点) 平均値 ± SD
(2)副次評価項目 ① MWT 平均睡眠潜時 MWT は,各群 20 例以上,両群で 40 例以上を目標として計画し,FAS のうち 50 例(モダフ ィニル 200 mg 群 22 例,プラセボ群 28 例)に実施された.MWT 平均睡眠潜時を表 2.7.6.1-10, 図 2.7.6.1-4 に示す. 平均睡眠潜時は,200 mg 群ではベースライン 13.95 分から最終評価時 16.92 分に延長し,プ ラセボ群では 14.33 分から 13.85 分にやや短縮した.ベースライン値を共変量とした最終評価 時におけるベースラインからの変化量(LSmean)は,200 mg 群 2.83 分,プラセボ群-0.37 分で, 群間差は 3.20 分(95%信頼区間:0.84~5.56 分)であり,200 mg 群がプラセボ群に比し有意に 延長した(p = 0.009,ANCOVA). 表 2.7.6.1-10 MWT 平均睡眠潜時(分)(FAS) 投与群 例数 ベースライン 最終評価時 変化量 変化量の差 検定a 平均値 ± SD 平均値 ± SD LSmean SE 95%信頼区間 LSmean SE 95%信頼区間 200 mg 22 13.95 ± 5.48 16.92 ± 3.22 2.83 0.88 1.06~4.59 3.20 1.17 0.84~ 5.56 p = 0.009 プラセボ 28 14.33 ± 4.55 13.85 ± 5.13 -0.37 0.78 -1.94~1.19 a:投与群を要因とし,ベースライン値を共変量とした ANCOVA 図 2.7.6.1-4 MWT 平均睡眠潜時(FAS) 0 5 10 15 20 200 mg プラセボ 平均値 ± SD 平均 睡眠 潜時 (分 ) ベースライン 最終評価時
MWT 実施・非実施別に ESS 合計スコアのベースライン値を共変量とした最終評価時におけ るベースラインからの変化量(LSmean)を表 2.7.6.1-11 に示す. ベースラインからの変化量(LSmean)はモダフィニル 200 mg 群では「MWT 実施」が-5.59 点,「MWT 非実施」が-7.35 点,プラセボ群では「MWT 実施」が-2.22 点,「MWT 非実施」が -2.63 点であり,MWT 実施例,非実施例で ESS 合計スコアのベースラインからの変化量に大き な違いはみられなかった. 表 2.7.6.1-11 MWT 実施・非実施別の ESS 合計スコアのベースラインからの変化量(点)(FAS) MWT 変化量 変化量の群間差 200 mg プラセボ
例数 LSmean SE 95%信頼区間 例数 LSmean SE 95%信頼区間 LSmean SE 95%信頼区間 実施 22 -5.59 0.74 -7.07 ~ -4.10 28 -2.22 0.65 -3.54 ~-0.90 -3.37 0.99 -5.36 ~-1.38 非実施 30 -7.35 0.79 -8.93 ~ -5.78 34 -2.63 0.74 -4.11 ~-1.15 -4.72 1.08 -6.89 ~-2.56 最終評価時における ESS 合計スコアのベースラインからの変化量と MWT 平均睡眠潜時のベ ースラインからの変化量との関係を図 2.7.6.1-5 に示す. 最終評価時における ESS 合計スコアのベースラインからの変化量と MWT 平均睡眠潜時のベ ースラインからの変化量との Pearson の相関係数は-0.334 であった. 図 2.7.6.1-5 ESS 合計スコアのベースラインからの変化量と MWT 平均睡眠潜時の ベースラインからの変化量との関係 ● ○ ○ ● ○ ● ● ○ ○ ● ● ○ ○ ● ○ ● ○ ● ● ○ ○ ○ ○ ● ○ ● ● ○ ○ ● ○ ○ ○ ○ ○ ○ ● ○ ● ○ ● ○ ● ○ ○ ● ● ○ ● ● r = -0.334 -20 -15 -10 -5 0 5 10 15 20 -20 -15 -10 -5 0 5 10 15 20 平均睡眠潜時 MWT 合計スコア ESS ●:AFT -801 群 ○: プラセボ 群 200 mg プラセボ r = -0.334 MW T 平均睡 眠潜時 のベースライ ンからの変化 量(分) ESS 合計スコアのベースラインからの変化量(点)
② 測定時期毎の ESS 合計スコア FAS における ESS 合計スコアの推移を表 2.7.6.1-12,図 2.7.6.1-6 に示す. ESS 合計スコアはモダフィニル 200 mg 群でベースライン 14.27 点,1 週 8.65 点,4 週 7.75 点 であり,プラセボ群でベースライン 14.60 点,1 週 11.77 点,4 週 12.08 点であった. ベースラインからの変化量は 200 mg 群で 1 週-5.62 点,4 週-6.52 点であり,プラセボ群で 1 週-2.82 点,4 週-2.52 点であった. 表 2.7.6.1-12 ESS 合計スコアの推移(点)(FAS) 評価時期 投与群 例数 ESS 合計スコア 変化量 平均値 ± SD 平均値 ± SD 95%信頼区間 ベースライン 200 mg 52 14.27 ± 2.67 -- -- プラセボ 62 14.60 ± 3.12 -- -- 1 週 200 mg 52 8.65 ± 4.49 -5.62 ± 4.80 -6.95~ -4.28 プラセボ 62 11.77 ± 4.28 -2.82 ± 4.17 -3.88~ -1.76 4 週 200 mg 52 7.75 ± 4.52 -6.52 ± 5.04 -7.92~ -5.12 プラセボ 62 12.08 ± 3.93 -2.52 ± 3.43 -3.39~ -1.64 図 2.7.6.1-6 ESS 合計スコアの推移(FAS) 0 5 10 15 20 200 mg プラセボ 平均値 ± SD 合計 スコア(点) ベースライン 1 週 4 週
③ 終夜 PSG における睡眠パラメータ FAS の終夜 PSG の睡眠パラメータを表 2.7.6.1-13 に示す. FAS のうち,101 例(モダフィニル 200 mg 群 45 例,プラセボ群 56 例)で最終評価時の終夜 PSG 実施の同意が得られた. 200 mg 群では中途覚醒時間が減少し(ベースラインからの変化量:-14.64 分,95%信頼区間: -27.48~-1.80 分),Stage 2 の出現時間が増加した(ベースラインからの変化量:20.73 分,95% 信頼区間:4.33~37.14 分).一方,プラセボ群では覚醒反応回数が減少し(ベースラインから の変化量:-11.5 回,95%信頼区間:-21.5~-1.5 回),Stage 1 の出現時間が減少した(ベースラ インからの変化量:-9.85 分,95%信頼区間:-18.23~-1.47 分).その他の睡眠パラメータにつ いては,両群ともに投与前後で大きな変化はみられなかった. 各睡眠パラメータの最終評価時におけるベースラインからの変化量について,200 mg 群とプ ラセボ群との間に大きな違いはみられなかった. 表 2.7.6.1-13 終夜 PSG の睡眠パラメータ(1/2)(FAS) 投与群 ベースライン 最終評価時 変化量 変化量の差 例数 平均値 ± SD 例数 平均値 ± SD 例数 平均値 ± SD 95%信頼区間 推定値 SE 95%信頼区間 総就床時間 [TIB] (分) 200 mg 52 496.17 ± 38.18 45 501.64 ± 48.47 45 8.12 ± 53.30 -7.89~24.14 17.59 10.02 -2.29~37.46 プラセボ 62 501.99 ± 44.94 56 494.53 ± 39.18 56 -9.46 ± 47.25 -22.12~3.19 睡眠期間 [SPT] (分) 200 mg 52 474.60 ± 41.74 45 475.72 ± 59.52 45 4.16 ± 52.64 -11.66~19.97 18.14 10.94 -3.57~39.84 プラセボ 62 485.73 ± 46.04 56 473.14 ± 48.27 56 -13.98 ± 56.18 -29.03~1.06 総睡眠時間 [TST] (分) 200 mg 52 417.42 ± 55.24 45 432.30 ± 65.04 45 18.80 ± 69.71 -2.14~39.74 24.96 12.82 -0.48~50.40 プラセボ 62 425.24 ± 60.90 56 421.73 ± 61.37 56 -6.16 ± 59.13 -22.00~9.68 中途覚醒時間 [WASO] (分) 200 mg 52 57.17 ± 39.28 45 43.42 ± 29.94 45 -14.64 ± 42.74 -27.48~-1.80 -6.82 8.63 -23.94~10.29 プラセボ 62 60.48 ± 54.73 56 51.41 ± 42.56 56 -7.82 ± 43.37 -19.44~3.79 中途覚醒回数 200 mg 52 35.8 ± 21.8 45 34.9 ± 20.2 45 -1.8 ± 16.7 -6.9~3.2 1.4 3.1 -4.7~7.5 プラセボ 62 34.7 ± 24.2 56 31.9 ± 20.8 56 -3.3 ± 14.0 -7.0~0.5 入眠後の覚醒 の比率(%) 200 mg 52 12.09 ± 8.36 45 9.26 ± 6.84 -- -- -- -- -- -- プラセボ 62 12.28 ± 10.53 56 10.90 ± 8.99 -- -- -- 睡眠潜時 (分) 200 mg 52 10.22 ± 16.77 45 9.26 ± 17.00 45 -0.74 ± 11.24 -4.12~2.63 -3.24 3.05 -9.29~2.80 プラセボ 62 8.79 ± 12.35 56 11.38 ± 14.78 56 2.50 ± 17.78 -2.26~7.26 レム睡眠潜時 (分) 200 mg 52 79.97 ± 53.05 45 88.94 ± 47.21 45 11.47 ± 48.44 -3.09~26.02 11.05 8.51 -5.83~27.92 プラセボ 62 70.00 ± 27.69 56 71.20 ± 33.13 56 0.42 ± 37.04 -9.50~10.34 睡眠効率 (%) 200 mg 52 84.38 ± 10.72 45 86.16 ± 9.65 -- -- -- -- -- -- プラセボ 62 84.98 ± 11.23 56 85.41 ± 11.23 -- -- -- 覚醒反応回数 200 mg 52 100.1 ± 51.6 45 102.0 ± 54.6 45 1.7 ± 33.7 -8.4~11.8 13.2 7.2 -1.0~27.4 プラセボ 62 108.1 ± 51.6 56 98.0 ± 43.4 56 -11.5 ± 37.4 -21.5~-1.5 覚醒反応指数 [ArI] 200 mg 52 12.54 ± 6.03 45 12.76 ± 6.50 45 0.09 ± 4.35 -1.22~1.40 1.23 0.92 -0.60~3.05 プラセボ 62 13.36 ± 6.42 56 12.37 ± 5.25 56 -1.14 ± 4.79 -2.42~0.15
表 2.7.6.1-13 終夜 PSG の睡眠パラメータ(2/2)(FAS) 投与群 ベースライン 最終評価時 変化量 変化量の差 例数 平均値 ± SD 例数 平均値 ± SD 例数 平均値 ± SD 95%信頼区間 推定値 SE 95%信頼区間 各睡眠段階の出 現 時間(分) Stage 1 200 mg 52 69.56 ± 41.05 45 68.06 ± 46.08 45 -4.48 ± 26.72 -12.51~3.55 5.37 5.88 -6.29~17.03 プラセボ 62 66.99 ± 28.56 56 57.83 ± 34.39 56 -9.85 ± 31.29 -18.23~-1.47 Stage 2 200 mg 52 235.86 ± 60.42 45 250.94 ± 65.75 45 20.73 ± 54.60 4.33~37.14 18.78 10.01 -1.09~38.64 プラセボ 62 241.63 ± 51.94 56 244.13 ± 54.23 56 1.96 ± 46.00 -10.36~14.27 Stage 3 200 mg 52 18.43 ± 23.79 45 15.49 ± 20.61 45 0.37 ± 15.30 -4.23~4.96 -3.20 3.04 -9.23~2.82 プラセボ 62 17.84 ± 23.42 56 23.08 ± 26.20 56 3.57 ± 15.08 -0.47~7.61 Stage 4 200 mg 52 5.15 ± 12.46 45 7.33 ± 18.94 45 2.34 ± 12.87 -1.52~6.21 2.56 2.32 -2.04~7.16 プラセボ 62 5.30 ± 15.13 56 5.65 ± 11.77 56 -0.21 ± 10.43 -3.01~2.58 Stage 3+4 200 mg 52 23.59 ± 31.82 45 22.82 ± 35.29 45 2.71 ± 20.82 -3.54~8.97 -0.65 3.90 -8.39~7.10 プラセボ 62 23.14 ± 30.09 56 28.73 ± 33.03 56 3.36 ± 18.37 -1.56~8.28 Stage REM 200 mg 52 88.42 ± 31.63 45 90.47 ± 29.37 45 -0.18 ± 33.17 -10.14~9.79 1.45 6.17 -10.80~13.70 プラセボ 62 93.48 ± 32.05 56 91.04 ± 30.60 56 -1.63 ± 28.84 -9.35~6.10 各睡眠段階の出 現 率 ( %) Stage 1 200 mg 52 16.93 ± 10.69 45 15.70 ± 10.22 -- -- -- -- -- -- プラセボ 62 15.96 ± 6.69 56 13.74 ± 7.73 -- -- -- Stage 2 200 mg 52 56.41 ± 12.33 45 58.32 ± 12.97 -- -- -- -- -- -- プラセボ 62 56.70 ± 8.37 56 57.95 ± 9.88 -- -- -- Stage 3 200 mg 52 4.36 ± 5.71 45 3.60 ± 4.65 -- -- -- -- -- -- プラセボ 62 4.15 ± 5.48 56 5.61 ± 6.62 -- -- -- Stage 4 200 mg 52 1.25 ± 3.09 45 1.66 ± 4.34 -- -- -- -- -- -- プラセボ 62 1.27 ± 3.74 56 1.34 ± 2.85 -- -- -- Stage 3+4 200 mg 52 5.61 ± 7.70 45 5.26 ± 7.85 -- -- -- -- -- -- プラセボ 62 5.42 ± 7.12 56 6.95 ± 8.19 -- -- -- Stage REM 200 mg 52 21.05 ± 6.37 45 20.71 ± 5.46 -- -- -- -- -- -- プラセボ 62 21.92 ± 6.42 56 21.37 ± 5.82 -- -- -- 無呼吸回数 200 mg 52 4.8 ± 7.0 45 4.6 ± 9.8 45 -0.6 ± 7.8 -2.9~1.7 -0.4 1.4 -3.2~2.5 プラセボ 62 4.6 ± 9.4 56 4.7 ± 10.1 56 -0.3 ± 6.5 -2.0~1.5 低呼吸回数 200 mg 52 14.8 ± 17.2 45 14.0 ± 14.8 45 -2.1 ± 14.3 -6.4~2.2 -0.6 2.6 -5.7~4.5 プラセボ 62 14.1 ± 15.8 56 13.7 ± 17.5 56 -1.5 ± 11.5 -4.6~1.6 AHI 200 mg 52 2.79 ± 2.71 45 2.60 ± 2.65 45 -0.45 ± 2.16 -1.10~0.20 -0.26 0.38 -1.01~0.50 プラセボ 62 2.63 ± 2.61 56 2.64 ± 2.81 56 -0.19 ± 1.66 -0.64~0.25
④ PSQI の総合スコア FAS における PSQI の総合スコアを表 2.7.6.1-14 に示す. PSQI の総合スコアは,モダフィニル 200 mg 群ではベースライン 6.3 点から最終評価時 4.8 点,プラセボ群では 6.1 点から 5.4 点に減少した.最終評価時におけるベースラインからの変 化量は,200 mg 群-1.5 点(95%信頼区間:-2.0~-0.9 点),プラセボ群-0.7 点(95%信頼区間: -1.3~-0.2 点)であった.変化量の群間差(点推定値)は-0.7 点(95%信頼区間:-1.5~0.0 点) であり,200 mg 群とプラセボ群との間に大きな違いはみられなかった. 表 2.7.6.1-14 PSQI の総合スコア(点)(FAS) 投与群 ベースライン 最終評価時 変化量 変化量の差 例数 平均値 ± SD 例数 平均値 ± SD 例数 平均値 ± SD 95%信頼区間 推定値 SE 95%信頼区間 200 mg 52 6.3 ± 2.7 52 4.8 ± 2.2 52 -1.5 ± 2.1 -2.0~-0.9 -0.7 0.4 -1.5~0.0 プラセボ 61 6.1 ± 2.3 62 5.4 ± 1.7 61 -0.7 ± 2.0 -1.3~-0.2
⑤ SF-36 の各下位尺度の合計スコア FAS における SF-36 の国民標準値に基づくスコアリングによる得点を表 2.7.6.1-15 に示す. SF-36 の下位尺度及びサマリースコアのいずれの項目においてもベースラインは国民標準値 (50±10)に近く,本治験において QOL が低下していることを示す下位尺度及びサマリース コアは認められなかった. モダフィニル 200 mg 群では,下位尺度及びサマリースコアいずれの項目においても投与前 後の得点に大きな違いはみられなかった.一方,プラセボ群では,下位尺度の「体の痛み」が ベースライン 51.89 から最終評価時 54.16 に増加し,「心の健康」が 49.24 から 51.30 に増加し た.最終評価時におけるベースラインからの変化量の群間差(点推定値)は「体の痛み」で-3.65 (95%信頼区間:-6.80~-0.50),「心の健康」で-3.18(95%信頼区間:-5.55~-0.82)であった. 表 2.7.6.1-15 SF-36 の国民標準値に基づくスコアリングによる得点(FAS) 尺度 投与群 ベースライン 最終評価時 変化量 変化量の差 例数 平均値 ± SD 例数 平均値 ± SD 例数 平均値 ± SD 95%信頼区間 推定値 SE 95%信頼区間 下位 尺度 身体機能 200 mg 52 50.46 ± 7.03 52 51.48 ± 6.76 52 1.02 ± 4.32 -0.19~2.22 -0.23 0.89 -2.00~1.53 プラセボ 62 51.39 ± 7.29 62 52.64 ± 6.06 62 1.25 ± 5.06 -0.04~2.54 日常役割機能 (身体) 200 mg 52 50.41 ± 8.92 52 50.21 ± 10.26 52 -0.20 ± 10.34 -3.08~2.68 -0.47 1.67 -3.78~2.83 プラセボ 62 50.52 ± 9.60 62 50.80 ± 9.31 62 0.28 ± 7.42 -1.61~2.16 体の痛み 200 mg 52 52.38 ± 9.39 52 51.00 ± 10.33 52 -1.38 ± 9.12 -3.92~1.16 -3.65 1.59 -6.80~-0.50 プラセボ 62 51.89 ± 9.45 62 54.16 ± 9.21 62 2.27 ± 7.84 0.28~4.26 全体的健康感 200 mg 52 48.10 ± 8.86 52 47.01 ± 9.04 52 -1.09 ± 5.46 -2.61~0.43 -1.89 1.08 -4.03~0.25 プラセボ 62 47.84 ± 8.23 62 48.64 ± 9.40 62 0.80 ± 5.97 -0.71~2.32 活力 200 mg 52 49.00 ± 9.34 52 49.77 ± 8.11 52 0.77 ± 8.26 -1.53~3.07 -0.77 1.38 -3.50~1.96 プラセボ 62 48.16 ± 8.20 62 49.70 ± 8.73 62 1.54 ± 6.47 -0.10~3.18 社会生活機能 200 mg 52 51.66 ± 8.71 52 51.03 ± 9.99 52 -0.63 ± 9.41 -3.25~1.99 -0.42 1.60 -3.58~2.74 プラセボ 62 52.32 ± 7.82 62 52.11 ± 8.14 62 -0.21 ± 7.62 -2.15~1.72 日常役割機能 (精神) 200 mg 52 50.76 ± 8.95 52 51.90 ± 7.82 52 1.14 ± 9.22 -1.42~3.71 0.46 1.59 -2.69~3.61 プラセボ 62 51.08 ± 6.94 62 51.76 ± 8.20 62 0.69 ± 7.74 -1.28~2.65 心の健康 200 mg 52 50.44 ± 9.58 52 49.32 ± 9.11 52 -1.12 ± 7.34 -3.17~0.92 -3.18 1.19 -5.55~-0.82 プラセボ 62 49.24 ± 8.06 62 51.30 ± 7.48 62 2.06 ± 5.37 0.69~3.42 サマ リー スコア 身体的健康度 200 mg 52 50.34 ± 7.04 52 50.04 ± 6.72 52 -0.29 ± 5.01 -1.69~1.10 -1.30 0.87 -3.03~0.42 プラセボ 62 50.72 ± 7.28 62 51.73 ± 6.28 62 1.01 ± 4.29 -0.08~2.10 精神的健康度 200 mg 52 50.40 ± 9.39 52 50.30 ± 8.66 52 -0.10 ± 7.83 -2.28~2.08 -1.14 1.32 -3.76~1.47 プラセボ 62 49.76 ± 7.32 62 50.80 ± 8.25 62 1.05 ± 6.25 -0.54~2.64
⑥ 有効性の部分集団解析 FAS について有効性の部分集団解析を行った. a)内因性要因 内因性要因別に ESS 合計スコアのベースライン値を共変量とした最終評価時におけるベース ラインからの変化量(LSmean)を表 2.7.6.1-16 に示す. いずれの内因性要因においても各層別で両群ともに大きな違いはみられなかった. 表 2.7.6.1-16 内因性要因別 ESS 合計スコアのベースラインからの変化量(点)(FAS) 内因性要因 変化量 変化量の群間差 200 mg プラセボ
例数 LSmean SE 95%信頼区間 例数 LSmean SE 95%信頼区間 LSmean SE 95%信頼区間
年齢 (歳) <40 8 -6.59 1.31 -9.47~-3.71 6 -0.05 1.51 -3.38~3.28 -6.54 2.00 -10.94~-2.13 40≦ <50 19 -6.43 0.96 -8.37~-4.49 23 -2.60 0.87 -4.37~-0.84 -3.83 1.30 -6.45~-1.20 50≦ 25 -6.71 0.81 -8.33~-5.09 33 -2.79 0.70 -4.21~-1.38 -3.92 1.07 -6.07~-1.77 BMI (kg/m2) <25 12 -5.93 1.19 -8.38~-3.47 15 -2.13 1.06 -4.32~0.06 -3.80 1.61 -7.12~-0.48 25≦ <30 32 -6.34 0.71 -7.76~-4.93 36 -2.53 0.67 -3.86~-1.19 -3.82 0.97 -5.76~-1.87 30≦ 8 -8.74 1.38 -11.67~-5.80 11 -2.55 1.18 -5.06~-0.05 -6.19 1.82 -10.04~-2.33 合併症 有 35 -6.46 0.67 -7.79~-5.12 47 -2.43 0.58 -3.57~-1.28 -4.03 0.89 -5.80~-2.27 無 17 -7.10 0.99 -9.12~-5.08 15 -2.28 1.05 -4.43~-0.13 -4.82 1.44 -7.77~-1.87 AHI <5 41 -7.02 0.64 -8.30~-5.74 52 -2.52 0.57 -3.66~-1.39 -4.49 0.86 -6.21~-2.78 5≦ ≦10 11 -5.09 1.03 -7.25~-2.93 10 -2.00 1.08 -4.27~0.27 -3.10 1.49 -6.23~0.04 ESS 合計スコア (点) 11≦ <16 37 -5.47 0.62 -6.71~-4.24 40 -2.01 0.60 -3.20~-0.82 -3.46 0.86 -5.18~-1.74 16≦ 15 -8.87 1.12 -11.14~-6.60 22 -3.59 0.92 -5.46~-1.71 -5.28 1.45 -8.24~-2.33 b)外因性要因 併用薬の有無別に ESS 合計スコアのベースライン値を共変量とした最終評価時におけるベー スラインからの変化量(LSmean)を表 2.7.6.1-17 に示す. 併用薬の有無別で両群ともに大きな違いはみられなかった. 表 2.7.6.1-17 併用薬の有無別 ESS 合計スコアのベースラインからの変化量(点)(FAS) 外因性要因 変化量 変化量の群間差 200 mg プラセボ
例数 LSmean SE 95%信頼区間 例数 LSmean SE 95%信頼区間 LSmean SE 95%信頼区間
併用薬 有 20 -6.75 0.87 -8.49~-5.01 36 -2.75 0.65 -4.05~-1.45 -4.00 1.08 -6.18~-1.83 無 32 -6.45 0.72 -7.90~-5.00 26 -2.10 0.80 -3.70~-0.50 -4.35 1.08 -6.52~-2.19
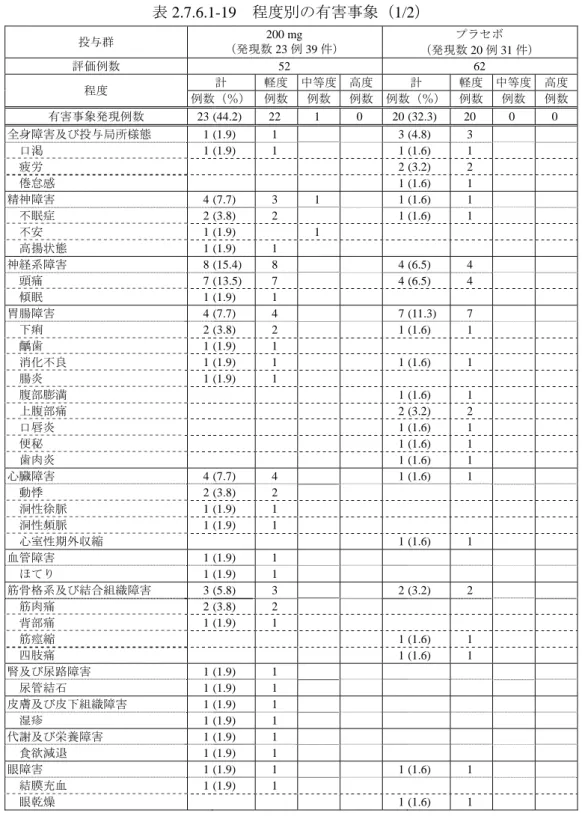
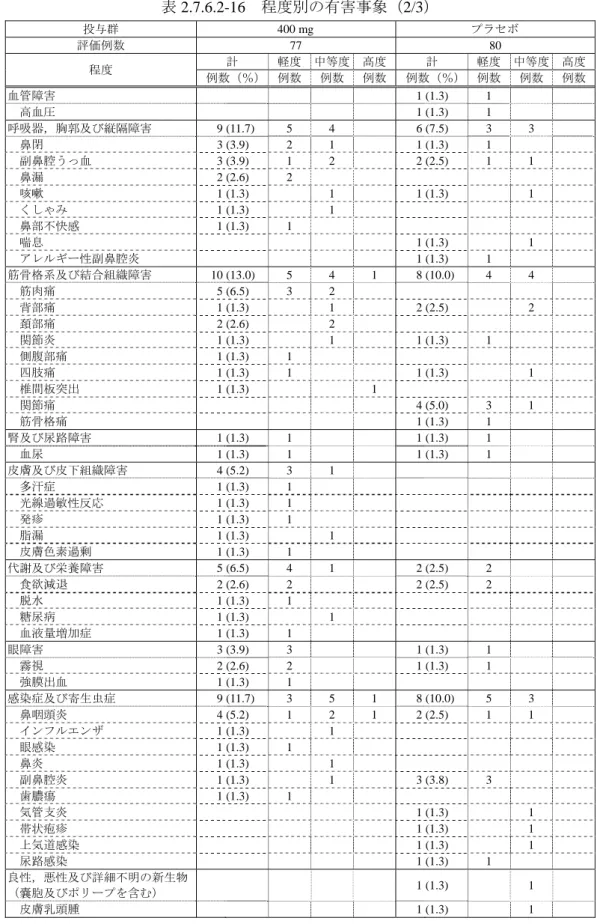
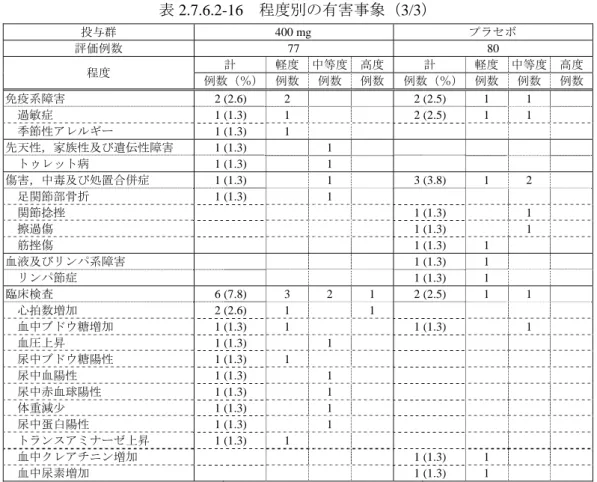
7)安全性 治験薬が投与された 114 例全例(モダフィニル 200 mg 群 52 例,プラセボ群 62 例)を安全性の 解析対象集団とした. (1)有害事象 ① 有害事象及び副作用の発現頻度 有害事象及び副作用の発現頻度を表 2.7.6.1-18 に示す. 有害事象はモダフィニル 200 mg 群 52 例中 23 例(44.2%)に 39 件,プラセボ群 62 例中 20 例(32.3%)に 31 件,副作用は 200 mg 群 52 例中 19 例(36.5%)に 24 件,プラセボ群 62 例 中 14 例(22.6%)に 20 件発現した.これらの有害事象及び副作用の発現頻度は,200 mg 群と プラセボ群との間に有意差はみられなかった(有害事象:p = 0.245,副作用:p = 0.146,Fisher の直接法). 死亡例,重篤な有害事象発現例及び有害事象による中止例はなかった. 表 2.7.6.1-18 有害事象及び副作用の発現頻度 投与群 200 mg プラセボ 検定a 安全性解析対象例数 52 62 有害事象 発現例数(%) 23 (44.2) 20 (32.3) p = 0.245 発現件数 39 31 副作用 発現例数(%) 19 (36.5) 14 (22.6) p = 0.146 発現件数 24 20 a:Fisher の直接法 ② 有害事象及び副作用の種類 有害事象及び副作用の種類を程度別にそれぞれ表 2.7.6.1-19,表 2.7.6.1-20 に示す. モダフィニル 200 mg 群で発現した有害事象は,頭痛 7 例(13.5%),不眠症,下痢,動悸及 び筋肉痛各 2 例(3.8%)などであった.これらのうち,不安 1 例が中等度であったが,その他 はすべて軽度であり,高度なものはなかった.プラセボ群で発現した有害事象は,頭痛 4 例 (6.5%),疲労,上腹部痛及び鼻咽頭炎各 2 例(3.2%)などであり,その程度はすべて軽度で あった. 200 mg 群で発現した副作用は,頭痛 6 例(11.5%),不眠症及び動悸各 2 例(3.8%)などで あった.頭痛がみられた 6 例は,すべて軽度であり,いずれの症例も治験実施中に回復した. プラセボ群で発現した副作用は,頭痛 4 例(6.5%),上腹部痛 2 例(3.2%)などであった.
表 2.7.6.1-19 程度別の有害事象(1/2) 投与群 (発現数 23 例 39 件) 200 mg プラセボ (発現数 20 例 31 件) 評価例数 52 62 程度 計 軽度 中等度 高度 計 軽度 中等度 高度 例数(%) 例数 例数 例数 例数(%) 例数 例数 例数 有害事象発現例数 23 (44.2) 22 1 0 20 (32.3) 20 0 0 全身障害及び投与局所様態 1 (1.9) 1 3 (4.8) 3 口渇 1 (1.9) 1 1 (1.6) 1 疲労 2 (3.2) 2 倦怠感 1 (1.6) 1 精神障害 4 (7.7) 3 1 1 (1.6) 1 不眠症 2 (3.8) 2 1 (1.6) 1 不安 1 (1.9) 1 高揚状態 1 (1.9) 1 神経系障害 8 (15.4) 8 4 (6.5) 4 頭痛 7 (13.5) 7 4 (6.5) 4 傾眠 1 (1.9) 1 胃腸障害 4 (7.7) 4 7 (11.3) 7 下痢 2 (3.8) 2 1 (1.6) 1 齲歯 1 (1.9) 1 消化不良 1 (1.9) 1 1 (1.6) 1 腸炎 1 (1.9) 1 腹部膨満 1 (1.6) 1 上腹部痛 2 (3.2) 2 口唇炎 1 (1.6) 1 便秘 1 (1.6) 1 歯肉炎 1 (1.6) 1 心臓障害 4 (7.7) 4 1 (1.6) 1 動悸 2 (3.8) 2 洞性徐脈 1 (1.9) 1 洞性頻脈 1 (1.9) 1 心室性期外収縮 1 (1.6) 1 血管障害 1 (1.9) 1 ほてり 1 (1.9) 1 筋骨格系及び結合組織障害 3 (5.8) 3 2 (3.2) 2 筋肉痛 2 (3.8) 2 背部痛 1 (1.9) 1 筋痙縮 1 (1.6) 1 四肢痛 1 (1.6) 1 腎及び尿路障害 1 (1.9) 1 尿管結石 1 (1.9) 1 皮膚及び皮下組織障害 1 (1.9) 1 湿疹 1 (1.9) 1 代謝及び栄養障害 1 (1.9) 1 食欲減退 1 (1.9) 1 眼障害 1 (1.9) 1 1 (1.6) 1 結膜充血 1 (1.9) 1 眼乾燥 1 (1.6) 1
表 2.7.6.1-19 程度別の有害事象(2/2) 投与群 (発現数 23 例 39 件) 200 mg プラセボ (発現数 20 例 31 件) 評価例数 52 62 程度 計 軽度 中等度 高度 計 軽度 中等度 高度 例数(%) 例数 例数 例数 例数(%) 例数 例数 例数 感染症及び寄生虫症 3 (5.8) 3 3 (4.8) 3 帯状疱疹 1 (1.9) 1 鼻咽頭炎 1 (1.9) 1 2 (3.2) 2 咽頭炎 1 (1.9) 1 白癬感染 1 (1.6) 1 傷害,中毒及び処置合併症 1 (1.9) 1 1 (1.6) 1 関節捻挫 1 (1.9) 1 筋挫傷 1 (1.6) 1 臨床検査 5 (9.6) 5 4 (6.5) 4 アラニン・アミノトランス フェラーゼ増加 1 (1.9) 1 血中甲状腺刺激ホルモン増加 1 (1.9) 1 γ-グルタミルトランス フェラーゼ増加 1 (1.9) 1 1 (1.6) 1 体重減少 1 (1.9) 1 血中アルカリホスファターゼ増加 1 (1.9) 1 1 (1.6) 1 尿中ブドウ糖陽性 1 (1.6) 1 肝機能検査異常 1 (1.6) 1
表 2.7.6.1-20 程度別の副作用 投与群 (発現数 19 例 24 件) 200 mg プラセボ (発現数 14 例 20 件) 評価例数 52 62 程度 計 軽度 中等度 高度 計 軽度 中等度 高度 例数(%) 例数 例数 例数 例数(%) 例数 例数 例数 副作用発現例数 19 (36.5) 19 0 0 14 (22.6) 14 0 0 全身障害及び投与局所様態 1 (1.9) 1 2 (3.2) 2 口渇 1 (1.9) 1 1 (1.6) 1 倦怠感 1 (1.6) 1 精神障害 3 (5.8) 3 不眠症 2 (3.8) 2 高揚状態 1 (1.9) 1 神経系障害 7 (13.5) 7 4 (6.5) 4 頭痛 6 (11.5) 6 4 (6.5) 4 傾眠 1 (1.9) 1 胃腸障害 1 (1.9) 1 5 (8.1) 5 下痢 1 (1.9) 1 1 (1.6) 1 腹部膨満 1 (1.6) 1 上腹部痛 2 (3.2) 2 便秘 1 (1.6) 1 消化不良 1 (1.6) 1 心臓障害 2 (3.8) 2 1 (1.6) 1 動悸 2 (3.8) 2 心室性期外収縮 1 (1.6) 1 血管障害 1 (1.9) 1 ほてり 1 (1.9) 1 筋骨格系及び結合組織障害 1 (1.9) 1 筋肉痛 1 (1.9) 1 代謝及び栄養障害 1 (1.9) 1 食欲減退 1 (1.9) 1 眼障害 1 (1.9) 1 1 (1.6) 1 結膜充血 1 (1.9) 1 眼乾燥 1 (1.6) 1 感染症及び寄生虫症 1 (1.9) 1 帯状疱疹 1 (1.9) 1 臨床検査 5 (9.6) 5 4 (6.5) 4 アラニン・アミノトランス フェラーゼ増加 1 (1.9) 1 血中甲状腺刺激ホルモン増加 1 (1.9) 1 γ-グルタミルトランス フェラーゼ増加 1 (1.9) 1 1 (1.6) 1 体重減少 1 (1.9) 1 血中アルカリホスファターゼ増加 1 (1.9) 1 1 (1.6) 1 尿中ブドウ糖陽性 1 (1.6) 1 肝機能検査異常 1 (1.6) 1
③ 患者背景因子別の有害事象及び副作用発現頻度 患者背景因子別の有害事象及び副作用発現頻度を表 2.7.6.1-21 に示す. モダフィニル 200 mg 群の有害事象の発現頻度は,年齢では「40 歳未満」,BMI では「25 kg/m2 未満」,AHI では「5 以上 10 以下」,合併症別では高血圧「無」,併用薬別では高血圧治療薬「無」 で高かった. 200 mg 群の副作用の発現頻度は,BMI では「25 kg/m2未満」,AHI では「5 未満」,併用薬有 無別では「無」で高かった. なお,性別では,両群とも女性が少なく有害事象及び副作用の発現頻度の比較については言 及できなかった. 表 2.7.6.1-21 患者背景因子別の有害事象及び副作用発現頻度 有害事象 副作用 投与群 200 mg プラセボ 200 mg プラセボ 評価例数 52 62 52 62 背景因子 発現例/例数(%) 発現例/例数(%) 発現例/例数(%) 発現例/例数(%) 性別 男性 21 / 49 (42.9) 20 / 61 (32.8) 17 / 49 (34.7) 14 / 61 (23.0) 女性 2 / 3 (66.7) 0 / 1 (0.0) 2 / 3 (66.7) 0 / 1 (0.0) 年齢 <40 5 / 8 (62.5) 1 / 6 (16.7) 3 / 8 (37.5) 0 / 6 (0.0) 40≦ <50 8 / 19 (42.1) 9 / 23 (39.1) 8 / 19 (42.1) 7 / 23 (30.4) 50≦ 10 / 25 (40.0) 10 / 33 (30.3) 8 / 25 (32.0) 7 / 33 (21.2) BMI (kg/m2) <25 8 / 12 (66.7) 8 / 15 (53.3) 8 / 12 (66.7) 6 / 15 (40.0) 25≦ <30 12 / 32 (37.5) 11 / 36 (30.6) 10 / 32 (31.3) 7 / 36 (19.4) 30≦ 3 / 8 (37.5) 1 / 11 (9.1) 1 / 8 (12.5) 1 / 11 (9.1) AHI <5 17 / 41 (41.5) 18 / 52 (34.6) 16 / 41 (39.0) 13 / 52 (25.0) 5≦ ≦10 6 / 11 (54.5) 2 / 10 (20.0) 3 / 11 (27.3) 1 / 10 (10.0) 合併 症 全例 有 15 / 35 (42.9) 15 / 47 (31.9) 12 / 35 (34.3) 9 / 47 (19.1) 無 8 / 17 (47.1) 5 / 15 (33.3) 7 / 17 (41.2) 5 / 15 (33.3) 高血圧 有 4 / 13 (30.8) 4 / 20 (20.0) 4 / 13 (30.8) 3 / 20 (15.0) 無 19 / 39 (48.7) 16 / 42 (38.1) 15 / 39 (38.5) 11 / 42 (26.2) 糖尿病 有 1 / 7 (14.3) 1 / 3 (33.3) 1 / 7 (14.3) 1 / 3 (33.3) 無 22 / 45 (48.9) 19 / 59 (32.2) 18 / 45 (40.0) 13 / 59 (22.0) 高脂血症 有 2 / 4 (50.0) 4 / 14 (28.6) 2 / 4 (50.0) 3 / 14 (21.4) 無 21 / 48 (43.8) 16 / 48 (33.3) 17 / 48 (35.4) 11 / 48 (22.9) 併用薬 全例 有 11 / 24 (45.8) 13 / 40 (32.5) 7 / 24 (29.2) 8 / 40 (20.0) 無 12 / 28 (42.9) 7 / 22 (31.8) 12 / 28 (42.9) 6 / 22 (27.3) 高血圧 治療薬 有 4 / 12 (33.3) 3 / 17 (17.6) 4 / 12 (33.3) 3 / 17 (17.6) 無 19 / 40 (47.5) 17 / 45 (37.8) 15 / 40 (37.5) 11 / 45 (24.4) 糖尿病 治療薬 有 1 / 3 (33.3) 1 / 3 (33.3) 1 / 3 (33.3) 1 / 3 (33.3) 無 22 / 49 (44.9) 19 / 59 (32.2) 18 / 49 (36.7) 13 / 59 (22.0) 高脂血症 治療薬 有 2 / 3 (66.7) 2 / 8 (25.0) 2 / 3 (66.7) 1 / 8 (12.5) 無 21 / 49 (42.9) 18 / 54 (33.3) 17 / 49 (34.7) 13 / 54 (24.1)
④ 重篤な有害事象 重篤な有害事象はなかった. ⑤ 中止に至った有害事象 中止に至った有害事象はなかった. (2)臨床検査値 血液学的検査,血液生化学的検査及び内分泌学的検査(甲状腺ホルモン関連)のいずれの項 目でもモダフィニル 200 mg 群及びプラセボ群ともに投与前後の平均値に大きな変化はみられ なかった. 臨床検査値で異常変動ありと判定された症例の一覧を表 2.7.6.1-22 に示す. 臨床検査値の異常変動は,200 mg 群で 4 例[TSH 上昇,γ-GTP 上昇,ALT(GPT)上昇, ALP 上昇が各 1 例],プラセボ群で 5 例[γ-GTP 上昇,尿糖陽性,ALP 上昇,AST(GOT)・ ALT(GPT)・γ-GTP 上昇,WBC 減少が各 1 例]にみられた. 表 2.7.6.1-22 臨床検査値の異常変動例 投与群 薬剤 番号 性別 年齢 (歳) 検査項目 基準値 検査値 ベースライン 4 週 追跡① 追跡② 200 mg 2651 男性 32 TSH 0.49~4.67 μIU/mL 2.76 7.01↑* 2.94 -- 2051 男性 38 γ-GTP 0~80 IU/L/37°C 43 60* 46 -- 1082 男性 47 ALT (GPT) 5~45 IU/L/37°C 37 51↑* 32 -- 2093 男性 45 ALP 100~325 IU/L/37°C 253 327↑* 302 -- プラセボ 2562 男性 52 γ-GTP 0~80 IU/L/37°C 88↑ 175↑* 105↑ -- 2594 男性 50 糖定性 (-) (-) (3+)* (-) -- 2112 男性 43 ALP 100~325 IU/L/37°C 207 333↑* 292 -- 2161 男性 43
AST (GOT) 10~40 IU/L/37°C 34 45↑* 43↑* 40 ALT (GPT) 5~45 IU/L/37°C 77↑ 109↑* 100↑* 91↑*
γ-GTP 0~80 IU/L/37°C 76 90↑* 75 96↑* 2172 男性 48 WBC 3300~9000 /μL 5500 3000↓* -- --
(3)生理学的検査値 収縮期血圧,拡張期血圧及び脈拍数は,モダフィニル 200 mg 群及びプラセボ群ともに投与 前後の平均値に大きな変化はみられなかった.また,個々の症例においても異常変動はみられ なかった. (4)体重 体重は,モダフィニル 200 mg 群及びプラセボ群ともに投与前後の平均値に大きな変化はみ られなかった. 体重で異常変動ありと判定された症例を表 2.7.6.1-23 に示す. 200 mg 群で体重減少が 1 例にみられたが,投与終了後に回復した. 表 2.7.6.1-23 体重の異常変動例 投与群 薬剤 番号 性別 年齢 (歳) 測定値(kg) ベースライン 4 週 追跡 200 mg 2092 男性 63 77.0 73.0* 76.0 *:異常変動あり (5)12 誘導心電図 12 誘導心電図で異常変動ありと判定された症例の一覧表を表 2.7.6.1-24 に示す. 心電図異常がモダフィニル 200 mg 群の 2 例(洞性頻脈及び洞性徐脈各 1 例),プラセボ群の 1 例(心室性期外収縮)にみられたが,いずれも程度は軽度であり,治験期間内又は追跡調査 時に正常範囲に回復していた.洞性頻脈及び洞性徐脈については,治験薬との因果関係はいず れも「関連がない」と判定され,心室性期外収縮については,治験薬との因果関係は「関連が あるかもしれない」と判定された. 表 2.7.6.1-24 12 誘導心電図検査の異常変動例 投与群 薬剤 番号 性別 (歳) 年齢 判定 ベースライン 1 週 4 週 追跡 200 mg 1303 男性 36 正常範囲内 異常* (洞性頻脈) 正常範囲内 -- 2092 男性 63 正常範囲内 正常範囲内 異常* (洞性徐脈) 正常範囲内 プラセボ 1293 男性 41 正常範囲内 (心室性期外収縮)異常* 正常範囲内 -- *:異常変動あり
8)まとめ (1)有効性 主観的評価である ESS 合計スコアは,モダフィニル 200 mg 群がプラセボ群に比し有意に減 少し,本剤の有効性が確認された.また,客観的評価である MWT 平均睡眠潜時においても 200 mg 群がプラセボ群に比し有意に延長し,ESS 合計スコアの結果が補完された. 終夜 PSG 及び PSQI では,200 mg 群とプラセボ群との間に大きな違いはみられず,モダフィ ニルによる夜間睡眠への影響は低いと考えられた. (2)安全性 有害事象及び副作用の発現頻度は,モダフィニル 200 mg 群とプラセボ群との間に大きな違 いはみられなかった.200 mg 群で多く発現した有害事象は,頭痛,不眠症,下痢,動悸,筋肉 痛などであったが,そのほとんどが軽度であり,臨床的に問題となるものはなかった.臨床検 査,生理学的検査,体重及び 12 誘導心電図では臨床的に問題となる異常変動はみられなかった. (3)CPAP の使用状況 治験期間中で CPAP 療法の使用状況に大きな変動はなく,本剤の導入により CPAP のコンプ ライアンスに変化はなかった. (4)結論 モダフィニルは CPAP 治療中の閉塞性睡眠時無呼吸症候群に伴う日中の過度の眠気に対して 有効であり,安全性においても特に問題のない薬剤であると考える.


![表 2.7.6.1-2 観察・検査及びその時期 [MWT 実施例] [MWT 非実施例] 一次 登録日 二次登録日 服薬開始日 1週-14-14-8-7017 27 28~-14 -42~ -14-13-12-11-10-9-8-7-6-5-4-3-2-1015~925~30 25~31●※1)●●● ●※2) ●※2), 3)● ●※2)●※4)●●※5) ●※5) ●※2) ●※2) ●※2) ●※2)●●●●●●●●●●●●●●●●●●●●●●●●●●●※1)同意取得は,全ての](https://thumb-ap.123doks.com/thumbv2/123deta/8544124.930582/15.892.121.763.157.600/開始●●●●●●●●●●●●●●●●●●●●●●●●●.webp)