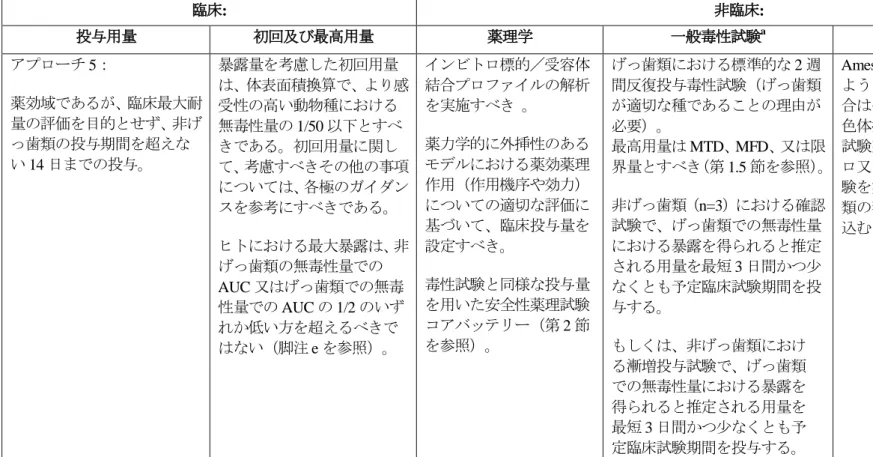
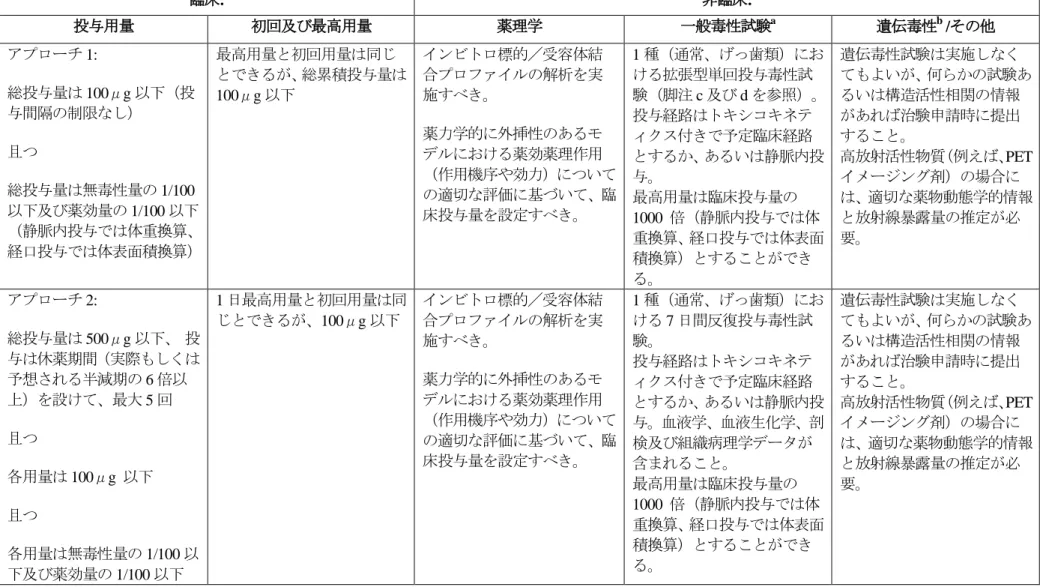
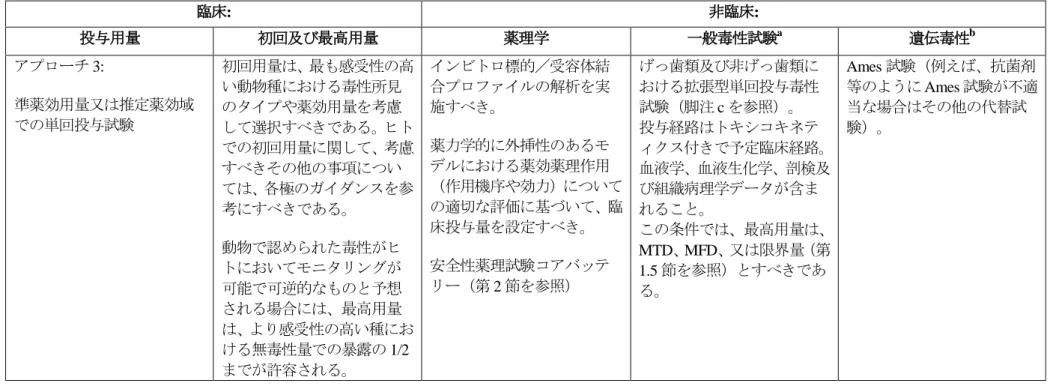
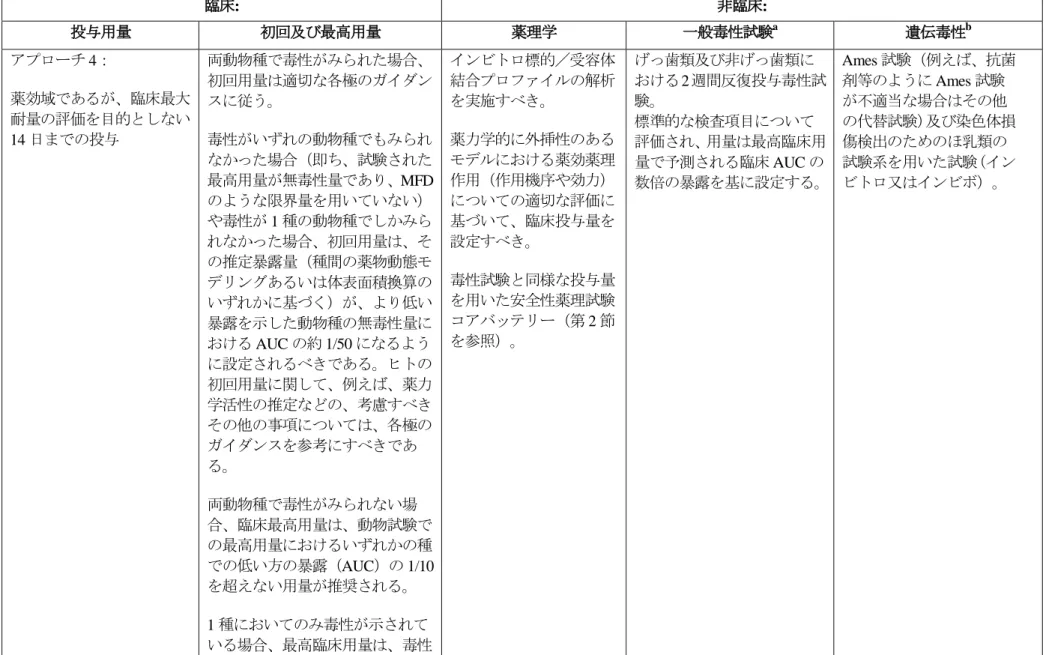
3. 本ガイドラインの実施時期平成 23 年 1 月 1 日以降に申請される医薬品に添付される非臨床安全性試験に関する資料は 今回の改正をふまえたものであること ただし 平成 22 年 3 月 31 日までに実施され または開始されている試験については 当分の間 原則として本ガイドラインに基づいた試
30
0
0
全文
図

+2
関連したドキュメント
Protocols and case report forms are different among clinical trials, however adverse events(AEs)occur in every trial and need to be assessed in the same way. Therefore, we conducted
「臨床推論」 という日本語の定義として確立し
1 月13日の試料に見られた,高い ΣDP の濃度及び低い f anti 値に対 し LRAT が関与しているのかどうかは不明である。北米と中国で生 産される DP の
In vitro での検討において、本薬の主要代謝物である NHC は SARS-CoV-2 臨床分離株(USA-WA1/2020 株)に対して抗ウイルス活性が示されており(Vero
(b) 肯定的な製品試験結果で認証が見込まれる場合、TRNA は試験試 料を標準試料として顧客のために TRNA
問題集については P28 をご参照ください。 (P28 以外は発行されておりませんので、ご了承く ださい。)
妊婦又は妊娠している可能性のある女性には投与しない こと。動物実験(ウサギ)で催奇形性及び胚・胎児死亡 が報告されている 1) 。また、動物実験(ウサギ
・平成29年3月1日以降に行われる医薬品(後発医薬品等)の承認申請