審査報告書 平成 29 年 10 月 23 日 独立行政法人医薬品医療機器総合機構 承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は 以下のとおりである 記 [ 販売名 ] テセントリク点滴静注 1,200 mg [ 一般名 ] アテゾリズマブ ( 遺伝子組換え ) [ 申請
82
0
0
全文
図
Outline
関連したドキュメント
「30 ㎡以上 40 ㎡未満」又は「280 ㎡ 超」の申請住戸がある場合.
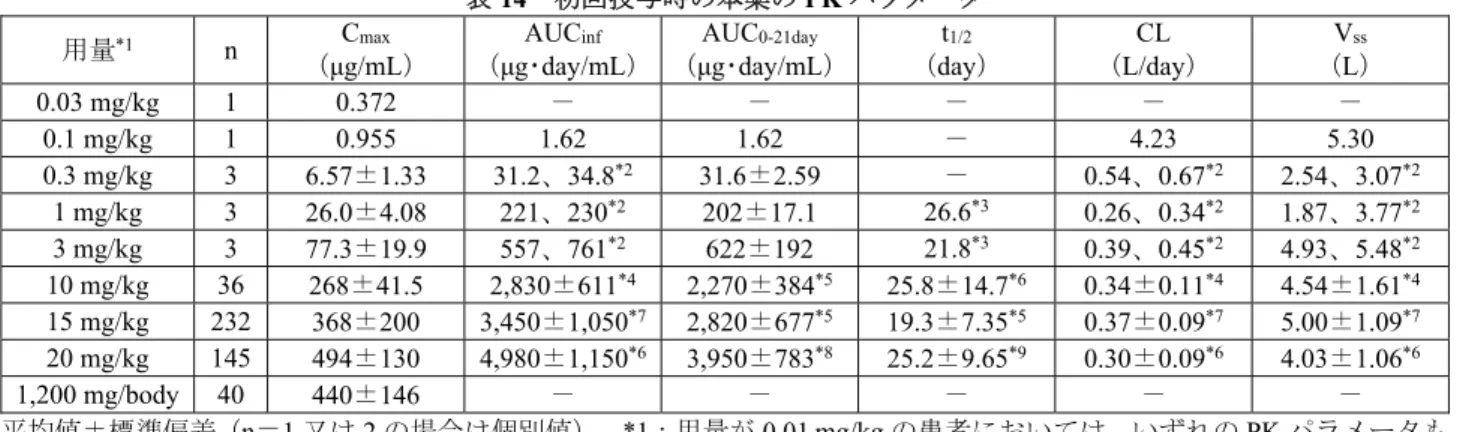
国内の検査検体を用いた RT-PCR 法との比較に基づく試験成績(n=124 例)は、陰性一致率 100%(100/100 例) 、陽性一致率 66.7%(16/24 例).. 2
3 諸外国の法規制等 (1)アメリカ ア 法規制 ・歯ブラシは法律上「医療器具」と見なされ、連邦厚生省食品医薬品局(Food and
[r]
⑴ 次のうち十分な管理が困難だと感じるものは ありますか。 (複数回答可) 特になし 87件、その他 2件(詳細は後述) 、
2012年11月、再審査期間(新有効成分では 8 年)を 終了した薬剤については、日本医学会加盟の学会の
・平成29年3月1日以降に行われる医薬品(後発医薬品等)の承認申請
在宅医療の充実②(24年診療報酬改定)