九州大学学術情報リポジトリ
Kyushu University Institutional Repository
Stem Cell-based study on dentinogenic failure in hyperbilirubinemia
友田, 恵利佳
http://hdl.handle.net/2324/2236158
出版情報:九州大学, 2018, 博士(歯学), 課程博士 バージョン:
権利関係:
高ビリルビン血症における
象牙質形成障害に関する幹細胞学的研究
Stem Cell-based study
on dentinogenic failure in hyperbilirubinemia
2019 年 3 月 友田 恵利佳 九州大学大学院歯学府
口腔保健推進学講座 小児口腔医学分野
九州大学大学院歯学研究院
口腔保健推進学講座 小児口腔医学分野 指導教員 教授 野中 和明 先生
九州大学大学院歯学研究院
口腔常態制御学講座 分子口腔解剖学分野 研究指導者 准教授 山座 孝義 先生
本研究の一部は下記の論文にて報告した。
Bilirubin reversibly affects cell death and odontogenic capacity in stem cells from human exfoliated deciduous teeth. Yamaza, H., Tomoda, E., Sonoda, S., Nonaka, K., Kukita, T., Yamaza, T., Oral Diseases, 24: 809-819, 2018
本研究の一部は、下記学術大会にて報告した。
“Bilirubin induces cell death of human deciduous teeth-derived stem cells” The 58th Annual Meeting of Japanese Association for Oral Biology. Sapporo. 2016. 8.
また、以下の研究に参画した。
Interferon-gamma improves impaired dentinogenic and immunosuppressive functions of irreversible pulpitis-derived human dental pulp stem cells., Sonoda, S., Yamaza, H., Ma, L., Tanaka, Y., Tomoda, E., Aijima, R., Nonaka, K., Kukita, T., Shi, S., Nishimura, F., Yamaza, T., Scientific reports, 6: 19286, 2016
Transplantation of mesenchymal stem cells ameliorates secondary osteoporosis through interleukin-17-impaired functions of recipient bone marrow mesenchymal stem cells in MRL/lpr mice., Ma, L., Aijima, R., Hoshino, Y., Yamaza, H., Tomoda, E., Tanaka, Y., Sonoda, S., Song, G., Zhao, W., Nonaka, K., Shi, S., Yamaza, T., Stem cell research &
therapy, 6: 104, 2015
IL-1β Induces Pathologically Activated Osteoclasts Bearing Extremely High Levels of Resorbing Activity: A Possible Pathological Subpopulation of Osteoclasts,
Accompanied by Suppressed Expression of Kindlin-3 and Talin-1., Shiratori, T., Kyumoto-Nakamura, Y., Kukita, A., Uehara, N., Zhang, J., Koda, K., Kamiya, M., Badawy, T., Tomoda, E., Xu, X., Yamaza, T., Urano, Y., Koyano, K., Kukita, T., The journal of immunology, 200: 218-228, 2018
目 次
§1. 要旨・・・・・・・・・・・・・・・・・・・・・・・・・・・・ 1
§2. 緒言・・・・・・・・・・・・・・・・・・・・・・・・・・・・ 5
§3. 研究Ⅰ:・・・・・・・・・・・・・・・・・・・・・・・・・・・10
3-1. 背景と目的・・・・・・・・・・・・・・・・・・・・・・・・11
3-2. 材料と方法・・・・・・・・・・・・・・・・・・・・・・・・13
3-3. 結果・・・・・・・・・・・・・・・・・・・・・・・・・・・29
3-4. 小括・・・・・・・・・・・・・・・・・・・・・・・・・・・54
§4. 研究Ⅱ:・・・・・・・・・・・・・・・・・・・・・・・・・・・56
4-1. 背景と目的・・・・・・・・・・・・・・・・・・・・・・・・57
4-2. 材料と方法・・・・・・・・・・・・・・・・・・・・・・・・59
4-3. 結果・・・・・・・・・・・・・・・・・・・・・・・・・・・63
4-4. 小括・・・・・・・・・・・・・・・・・・・・・・・・・・・84
§5. 考察・・・・・・・・・・・・・・・・・・・・・・・・・・・・ 85
§6. 総括・・・・・・・・・・・・・・・・・・・・・・・・・・・・ 98
§7. 謝辞・・・・・・・・・・・・・・・・・・・・・・・・・・・・101
§8. 引用文献・・・・・・・・・・・・・・・・・・・・・・・・・・102 付.略語集・・・・・・・・・・・・・・・・・・・・・・・・・・・112
1
§1. 要旨
胆道閉鎖症などによる高ビリルビン血症の患児では、ビリルビン色素沈着に
より生じる緑色歯や象牙質の形成障害など、乳歯の形成障害が臨床的に報告さ
れている。胆道閉鎖症における肝移植後では、高ビリルビン血症において全身
のビリルビン沈着による黄疸や骨減少症は改善する。しかし、乳歯のビリルビ
ン沈着による緑色化は改善されない。これは、骨組織とは異なり、乳歯象牙質
はリモデリングを受けないため、一旦生じた形成障害はその後も乳歯に残存す
ることを意味している。しかし、ビリルビンによる乳歯象牙質形成障害の作用
機序については解明されていない。また、現在、この高ビリルビン血症により
誘導される乳歯象牙質形成障害を予防する治療法はない。そこで、本研究では、
乳歯象牙質形成幹細胞である乳歯幹細胞stem cells from exfoliated deciduous teeth
(SHED)を用いてビリルビンによる乳歯の形成障害やその作用機序を幹細胞・
分子レベルで明らかとすること、また、幹細胞をターゲットとした乳歯象牙質
形成障害に対する治療法を開発することを目的とした。
2
研究 I では、高濃度ビリルビンに対する SHED の生存と象牙質形成への影響
をin vitro実験にて検討した。高濃度ビリルビン刺激によりSHEDが形成した象
牙質基質にビリルビン沈着が認められた。また、高濃度ビリルビンは SHED の 象牙質形成能と生存能を共に抑制した。このビリルビン刺激は SHED における serine/threonine kinase(AKT)およびextracellular signal-regulated kinase 1 and 2
(ERK1/2)のリン酸化を抑制し、nuclear factor kappa B(NF-B)p65のリン酸 化を増強していた。肝移植後の状況をin vitroで再現するために、高濃度ビリル
ビン刺激の中断実験を行なった。ビリルビン刺激の中断は SHED で抑制されて いた象牙質形成能および生存能を回復させ、ビリルビン制御下のAKT、ERK1/2
およびNF-B p65シグナル経路も正常に帰した。これらの結果より、高ビリル
ビン血症の患児における乳歯の形成障害は高濃度ビリルビンが SHED の細胞死 や象牙質形成を障害することで引き起こされ、その障害過程において AKT、
ERK1/2およびNF-B p65シグナル経路が関与することが示唆された。また、高
ビリルビン血症による象牙質形成幹細胞の障害は可逆的であることも示唆され
た。
3
研究 II では、小児の骨減少症の治療薬として臨床で用いられているパミドロ ネートに着目し、高ビリルビン血症により誘発される象牙質形成障害ならびに
その細胞死に対する治療効果を幹細胞・分子レベルで検討した。高濃度ビリル
ビン刺激により誘導されたSHEDの細胞死の過程では、AKTおよび ERK1/2の リ ン 酸 化 の 抑 制 な ら び に NF-B p65 の リ ン 酸 化 の 増 強 と と も に 、B-Cell
CLL/Lymphoma 2(BCL2)-cytochrome Cシグナル経路が関与していた。しかし、
低濃度ビリルビン刺激では SHED に何ら障害は認められなかった。次に、高濃 度ビリルビン刺激と共にパミドロネートを SHED に作用させた。パミドロネー トはビリルビンで誘導される BCL2-cytochrome C シグナル経路を介した SHED の細胞死を抑制した。さらに、SHEDのin vitroならびにin vivo象牙質形成能に 対するビリルビン障害はパミドロネートにより解消された。これらの結果より、
パミドロネートが高ビリルビン血症での乳歯形成障害に対する治療薬となりう
ることが示唆された。
本研究により、高ビリルビン血症による乳歯象牙質の形成障害の原因として、
高濃度ビリルビンが象牙質形成幹細胞の細胞内シグナルAKT、ERK1/2、NF-B
4
p65のリン酸化を変化させ、BCL2-cytochrome Cシグナル経路が関与するミトコ ンドリアを介した細胞死を誘発すること、また、その象牙芽細胞分化能を抑制
することが考えられた。これらの高濃度ビリルビンによる障害はビリルビン刺
激の中断やパミドロネートの同時作用により改善された。高ビリルビン血症に
より誘導される乳歯象牙質の形成障害は肝移植により象牙質形成幹細胞自体の
機能は回復させるが、移植前に生じた象牙質形成障害は改善できないため、パ
ミドロネートによる予防投与が高ビリルビン血症患児での乳歯齲蝕予防治療に
有用であることが示唆された。
5
§2. 緒言
先天性胆道閉鎖症やWillson病に代表される先天性代謝疾患では、肝機能の低 下や不全に伴う肝外への胆汁排泄が行われず、血中に過剰なビリルビンが放出
されるため、高ビリルビン血症を呈する[24、63]。高ビリルビン血症では、脳
(大脳基底核)や眼球、皮膚、骨格などの組織にビリルビンが沈着し、神経症
状や骨低下症を引き起こす。先天性胆道閉鎖症の患児では、高ビリルビン血症
に伴う乳歯に緑色のビリルビン色素の沈着が生じ、象牙質の形成障害や長胴歯
(タウロドント)などの乳歯の形成障害を呈することやその形成障害が原因の
一端と考えられる齲蝕の罹患が報告されている[5、18、34、38、51]。
In vitroにおける研究にて、過剰なビリルビンが骨芽細胞の骨形成能を抑制す
ること、そして、骨芽細胞に障害を与え、細胞死(アポトーシス)を誘導する
ことが明らかとされ[23、47]、その結果として、骨格成長過程において続発性 骨粗鬆症を引き起こすことが考えられている[10、14、21、23、31、47]。しか しながら、乳歯の象牙質形成過程において、ビリルビンが引き起こす象牙質形
6
成障害に対する象牙芽細胞での機序について、細胞レベルならびに分子レベル
においての詳細な研究は行われていない。
先天性胆道閉鎖症に対する治療として肝移植が行われる。この場合、移植前
の高ビリルビン血症による全身のビリルビン沈着による黄疸や骨減少症は移植
後ではその色素沈着が減少・消失し、肝移植後では、骨減少症が改善する[17、
26、44]。また、小児の骨形成不全症や先天性胆道閉鎖症、Willson病における続 発性骨粗鬆症に対し、安全かつ有効な治療薬としてビスホスホネート製剤が使
用されている[4、48]。ビスホスホネート製剤の中でもパミドロネートは肝臓 移植待機患者に対する骨量の減少および骨構造障害の予防のため、臨床的に用
いられている[3]。一方、乳歯におけるビリルビンによる色素沈着は肝移植後
も残存し、緑色を呈したままである[26、34、39]。乳歯のX線写真上では、先 天性胆道閉鎖症における肝移植前に呈していた象牙質の形成障害が経年的に改
善されていた[34]。乳歯象牙質はリモデリングを受けないため、これら臨床所 見と併せ、高ビリルビン血症により生じる乳歯の象牙質形成障害は肝移植後で
も乳歯に残存していると考えられ、この障害の残存が齲蝕発生の一因となって
7
いることが示唆される。高ビリルビン血症に起因する齲蝕や乳歯の形成障害は
患児の健康的な成長および生活の質を二次的に脅かす可能性がある。しかし、
現在、乳歯の保存修復治療などによる対症療法のみが行われ、その根治的治療
や予防治療は行われていない。
乳歯幹細胞stem cells from human exfoliated deciduous teeth(SHED)は脱落し た乳歯に残存する歯髄組織より単離され、間葉系幹細胞mesenchymal stem cells
(MSCs)の亜群として同定された組織幹細胞である[29、33、64]。その特徴 は幹細胞の基本的性質である自己複製能や高い増殖活性を示すとともに、骨芽
細胞や軟骨細胞、脂肪細胞などの間葉系の成熟細胞のみならず、神経細胞や肝
細胞、血管内皮細胞などの外胚葉系ならびに内胚葉系の成熟細胞の一部に分化
する多分化能が報告されている。最近の研究により、SHEDは象牙芽細胞へ分化 し、象牙質形成を担う組織幹細胞であることが明らかとされた[8、33、49]。
従って、ヒトの乳歯における象牙質の発生と形成の過程における生理的ならび
に病理学的な研究を行う上で、理想的なヒト幹細胞ソースであると考えられる。
8
本研究では、研究 Iにおいて、ヒト乳歯象牙質形成幹細胞である SHED に高 濃度ビリルビンを作用させ、その生存能ならびに象牙質形成能について、in vitro
実験系について解析を行った。また、SHEDの生存やその象牙芽細胞分化におい て、serine/threonine kinase(AKT)およびextracellular signal-regulated kinase 1 and 2(ERK1/2)、nuclear factor kappa B(NF-B)p65シグナル経路など多様なシグ ナル経路により維持ならびに制御されていることから[6、25、27、64]、SHED での高濃度ビリルビンによるこれらシグナル分子変化の解析を行った。また、
肝移植を想定し、高濃度ビリルビン刺激を中断することで、肝移植後の SHED の環境変化をin vitroで再現し、生存能ならびに象牙質形成能について検討を行
った。次に、研究 II において、SHED に対し、高濃度ビリルビン刺激下におけ る細胞死について、さらに、その機序として、ミトコンドリア経路の B-Cell CLL/Lymphoma 2(BCL2)ならびにcytochrome Cに着目し、その発現変化を検 討した。ビリルビン刺激による障害を予防する目的で、高濃度ビリルビン刺激
下においてパミドロネートを作用させ、SHEDの細胞死ならびに象牙質形成能を
in vitroおよびin vivoの実験系にて調べた。さらに、パミドロネート作用による
SHED で の AKT および ERK1/2、NF-B p65 の各シグナル経路ならびに
9
BCL2-cytochrome Cシグナル経路についても検討を加えた。
10
§3. 研究Ⅰ
「ビリルビン刺激による SHED の細胞死の誘導ならびに
象牙芽細胞分化能の障害に関する研究」
11
§3-1. 背景と目的
先天性胆道閉鎖症などにより発症する高ビリルビン血症は緑色歯や象牙質の
形成障害など、乳歯に形成障害を引き起こすことが臨床的に認められている[5、
18、34、51]。胆道閉鎖症に対する肝移植治療後、象牙質の形成障害がX線写真
上で改善することも知られている[34]。しかし、乳歯の形成過程におけるビリ ルビンによるそれらの障害について、細胞・分子レベルではほとんど理解され
ていない。
研究Iの目的は、in vitroにおけるビリルビン刺激に対するSHEDの機能的変 化ならびに細胞内シグナル経路に対する影響を明らかとすることである。さら
に、肝移植後を想定し、ビリルビン刺激を中断した場合に生じる SHED の機能 変化および細胞内シグナル経路に対する影響を明らかとすることである。
まず、健常児より単離したSHEDを50 M非抱合型ビリルビン刺激下で象牙 芽細胞分化誘導し、分化能およびその細胞内シグナル経路に関する解析を行っ
12
た。次に、50 Mビリルビン刺激下におけるSHEDの細胞生存能および細胞死 への影響について解析を行った。さらに、ビリルビン刺激を中断し、ビリルビ
ン刺激から解放された後の SHED における象牙芽細胞分化能、細胞生存能およ び細胞死について解析を行った。
13
§3-2. 材料と方法
3-2-1. ヒト乳歯サンプル
ヒト乳歯は九州大学病院小児歯科において健常児および胆道閉鎖症の患児
(いずれも5-7歳)より生物的および臨床的に廃棄された検体として採取した。
九州大学ヒトゲノム・遺伝子研究倫理審査委員会により承認された手順に従っ
て使用した(承認番号:678-00)。乳歯を採取するにあたり、ドナーおよびその 保護者に説明を行い、ドナーの代理として保護者に同意書への同意を得た後、
署名を頂いた。
3-2-2. SHEDの単離、培養、および特性解析
SHEDの単離および培養は過去の報告に従って施行した[29、64]。ヒト脱落 乳歯より取り出された歯髄組織は混合酵素液にて、37℃で 60 分間作用させた。
その混合酵素液の組成は滅菌したリン酸緩衝生理食塩水 phosphate-buffered saline(PBS)に0.3% collagenase type I(Worthington Biochemicals、Lakewood、 NJ)および0.4% dispase II(Godo Syusei、Tokyo)となるように希釈されたもの
14
を用いた。その後、その細胞懸濁液をメッシュサイズ70 mのcell strainerで濾 過し、遠心操作後、細胞を回収した。細胞は培養フラスコに播種し、3 時間後、
PBS にて洗浄し、浮遊細胞を除去した。その後、接着細胞を細胞増殖培地で培 養した。細胞増殖培地の組成は、alpha Modification of Eagle's Medium(Thermo
Fisher Scientific、Waltham、MA)に15%ウシ胎仔血清(Equitech-Bio、Kerrville、
TX)、100 M L-ascorbic acid 2-phosphate(Wako Pure Chemicals、Osaka)、2 mM L-glutamine(Nacalai Tesque、Kyoto)、100 U/ml penicillin および 100 g/ml
streptomycin(Nacalai Tesque)となるように溶解させたものを用いた。播種 10
日後、播種した細胞はプラスチック培養フラスコ上で紡錘型を呈する付着細胞
として観察され、それらが集団化した付着コロニーを形成していた(データ未
公開)。その後、付着コロニーを形成した細胞を継代培養した。培地は1週間に 2回交換した。
単離した細胞の間葉系幹細胞としての特性を確認した。3継代目passage 3(P3)
の細胞をR-フィコエリスリンR-phycoerythrin(R-PE)で標識した抗ヒト CD146、 CD105、CD90、CD73、CD34、CD45、CD14の抗体と反応させ、Flow cytometry
15
により評価した[64]。そのP3 細胞は CD146、CD73、CD105、CD90 に陽性を 示し、CD34、CD45、CD14に陰性を示した(データ未公開)。Flow cytometryに
使用した抗体は表3-2-1に示す。通法に従って、P3細胞は象牙芽細胞/骨芽細胞、
軟骨細胞、および脂肪細胞へ分化誘導する条件下で培養した[29]。その P3 細 胞は象牙芽細胞/骨芽細胞、軟骨細胞、脂肪細胞に分化する多分化能を有してい た(データ未公開)。以上の結果より、単離細胞は間葉系幹細胞としての必要最
小限の特性を満たし[11]、SHEDとみなされた。以後の解析では、P3 SHEDを 用いた。
表3-2-1:Flow cytometry用抗体リスト
Names of antibodies Types of antibodies Names of Suppliers
anti-CD14 R-PE -conjugated eBioscience (San Diego、 CA)
anti-CD34 R-PE-conjugated eBioscience (San Diego、 CA)
anti-CD45 R-PE-conjugated eBioscience (San Diego、 CA)
anti-CD73 R-PE-conjugated eBioscience (San Diego、 CA)
anti-CD90 R-PE-conjugated eBioscience (San Diego、 CA)
anti-CD105 R-PE-conjugated eBioscience (San Diego、 CA)
anti-CD146 R-PE-conjugated eBioscience (San Diego、 CA)
R-PE: R-phycoerythrin
16 3-2-3. ビリルビン溶液の作製
抱合型ビリルビンは血中外ではその活性が不安定であり、作用濃度のコント
ロールが難しい。また、過去のビリルビン刺激のin vitro研究では、非抱合型ビ リルビンが使用されている。それゆえ、本研究においても非抱合型ビリルビン
を使用することとした[58]。非抱合型ビリルビンは過去の報告に従って希釈し
た[58]。つまり、遮光下にて、非抱合型ビリルビン(Merck、Darmstadt、German)
を0.1 N水酸化ナトリウム溶液に溶解し、0.1 N塩酸にてpH 7.2 - 7.4に調整した。
その後、0.22 mサイズのフィルターにて滅菌を行った。この溶液をストック溶
液として、使用時まで-20℃で保存した。
血清中のビリルビン濃度が1.5 mg/dL(25 M)より高値であると、高ビリル ビン血症と診断される。血清中のビリルビン濃度が約3 mg/dL(50 M)を超え ると、乳歯においては緑色の色素沈着を引き起こす[65]。従って、本研究では、
非抱合型ビリルビンの作用濃度を50 Mとした。非抱合型ビリルビンは血液中 ではアルブミンと結合して運搬されている。ストック溶液を滅菌 PBS にてウ シ・アルブミン(Merck)でビリルビン:アルブミン = 1.5 : 1.0の割合とな
17
るように用時希釈し、培地に50 Mとなるように添加した。ビリルビンを加え ず、ビリルビンと同量のアルブミンを加えたものをコントロールとした。
3-2-4. ビリルビン沈着解析
P3 SHED を60 mm培養皿あたり100 × 103個播種し、以前の報告に従って、
象牙芽細胞分化誘導条件下で培養した[29、57、64]。培地として、alpha Modification of Eagle's Medium(Thermo Fisher Scientific)に15%ウシ胎仔血清
(Equitech-Bio)、100 M L-ascorbic acid 2-phosphate(Wako Pure Chemicals)、2 mM L-glutamine(Nacalai Tesque)、100 U/ml penicillinおよび100 g/ml streptomycin
(Nacalai Tesque)、1.8 mM KH2PO4(Merck)、10 nM dexamethasone(Merck)を 添加した象牙芽細胞分化誘導培地を用いた。象牙芽細胞誘導時、SHEDは50 M 非抱合型ビリルビン(Merck)を添加または無添加の条件下で培養を行った。以 後、各ビリルビン濃度による刺激群はB0群、B50群と表記する。誘導開始より 4週間後、ビリルビン沈着の解析を行った。デジタルカメラAxiocam ERc 5S(Carl Zeiss Microscopy、Jena、Germany)を装着した実体顕微鏡Stemi 305(Carl Zeiss
Microscopy)下で試料を撮影した。ビリルビン沈着領域は Image-J software
18
(National Institutes of Health[NIH]、Bethesda、MD)を用いて、培養皿全体の 面積に対するビリルビン沈着領域の面積の割合を百分率(%)にて算出した。続 いて、形成された細胞基質をセルスクレーパーで回収し、hydroxyl chlorideで一 晩 処 理 し た 。 そ の 後 、 溶 出 し た ビ リ ル ビ ン の 濃 度 を 解 析 し た 。 解 析 に は
QuantiChrom assay Kit(BioAssay Systems、Hayward、CA)を使用した。結果は Multiskan GO spectrophotometer(Thermo Fisher Scientific、Rockford、IL)を用い
て、波長530 nmで測定を行った。
3-2-5. ビリルビン刺激およびビリルビン刺激中断後の象牙質形成解析
P3 SHEDを60 mm培養皿あたり100 × 103個播種し、非抱合型ビリルビン(0
および50 M)を添加し、象牙芽細胞誘導条件下で培養した[29、57、64]。肝
移植を想定したビリルビン刺激中断群(Break群と表記)として、ビリルビン刺 激下で 2 週間は象牙芽細胞分化誘導条件で培養を行い、その後はビリルビン無 添加の状態で象牙芽細胞分化誘導を継続した。象牙芽細胞分化誘導開始から 4 週間後、SHEDを回収し、遺伝子およびタンパク質の発現の解析を行った。分化 誘導開始から6週間後の試料はカルシウム沈着解析に用いた。0、50 Mビリル
19
ビン刺激群(B0群、B50群)も同様に誘導開始から同時期に同様の解析を行っ た。
図3-2-1.象牙質形成誘導下でのSHEDへのビリルビン刺激中断の条件概要。
Od:象牙芽細胞分化誘導培地。B0:ビリルビン無刺激群、B50:50 Mビリル
ビン刺激群、Break:ビリルビン刺激中断群。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
3-2-6.カルシウム沈着解析
アリザリンレッド染色法にて、カルシウム沈着解析を行った[29、64]。試料 はPBSにて洗浄し、60%イソプロパノール(Nacalai Tasque)により室温で1分
20
間処理した。その後、蒸留水で洗い、蒸留水で希釈した1%アリザリンレッドS
(Merck)を用いて、室温で3分間、試料を染色した。その後、蒸留水で十分に 洗い、室温乾燥させた。試料はデジタルカメラ Axiocam ERc 5S(Cael Zeiss Microscopy)を装着した実体顕微鏡Stemi 305(Carl Zeiss Microscopy)下で撮影 した。アリザリンレッドS 陽性基質領域はImage-J software(NIH)にて基質総 面積に対してアリザリンレッドS陽性領域の面積の割合を百分率(%)にて算出 した。さらに、基質中のアリザリンレッド S の沈着量を解析するために、試料 は蒸留水にて溶解した10%塩化セチルピリジニウム(Nacalai Tesque)を添加し、
室 温 で 24 時 間 溶 出 処 理 し た 。 そ の 後 、 回 収 し た 上 清 液 を Multiskan GO spectrophotometer(Thermo Fisher Scientific)を用いて、波長562 nmで測定を行 った。
3-2-7. ビリルビン刺激およびビリルビン刺激中断後の細胞培養
35 mmまたは60 mm培養皿あたりSHEDを10 × 103または100 × 103個播種し、
3日間培養を行った。0、50 M非抱合型ビリルビンを添加し、血清含有培地に て 3 日間培養を継続した。その後、さらに 3 日間、血清含有培地あるいは無血
21
清培地にて培養を行った。ビリルビン刺激中断群(Break群)では3日間、50 M 非抱合型ビリルビンを添加した血清含有培地にて培養を行い、ビリルビン添加
を中断し、血清含有培地あるいは無血清培地で培養を3日間行った。B0群、B50
群、Break群において、全て血清含有培地にて培養を行ったSHEDを用いて細胞
増殖解析を行った。また、無血清培地にて培養開始から 9 日間培養を行った SHEDを用いて細胞死解析を行った(図3-2-2)。タンパク質の解析には上記の各 条件で6日間培養し、無血清培地に交換し、0、1、2、3、4、6、12時間におけ るSHEDを解析した。
図3-2-2.SHEDの培養概要。
Breakは50 Mのビリルビン刺激処理は0日目で中断し、3日後のSHEDにて解
析を行った。Reg:通常の培地。FBS:ウシ胎仔血清。B0:ビリルビン無刺激群、
B50:50 Mビリルビン刺激群、Break:ビリルビン刺激中断群。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
22 3-2-8. 細胞増殖解析
SHEDの細胞増殖能はbromodeoxyuridine(BrdU)staining Kit(Thermo Fisher Scientific)を用いて解析した。観察はデジタルカメラ Axiocam mono 503(Carl Zeiss Microscopy)を装着したAxio Imager M2 microscope(Carl Zeiss Microscopy)
にて行った。細胞増殖能は Image-J software(NIH)を用いて、全有核細胞に対 するBrdU陽性核細胞の割合を百分率(%)にて算出した。
3-2-9. Flow cytometryによる細胞死解析
培養SHEDは氷冷した3 %の熱処理した不活化ウシ胎仔血清(Equitech-Bio) を含んだHank’s balanced salt solutionの1 mL中に1 × 106個の細胞を懸濁した。
その細胞懸濁液に R-PE 標識 Annexin-V(eBioscience、San Diego、CA)および 7-amino-actinomycin(eBioscience)を加え、よく混和し、4℃で45分間処理した。
その後、FACSVerse flow cytometer(BD Bioscience、Franklin Lake、NJ)にて検出 し、FACSuite software(BD Bioscience)にて陽性細胞の百分率(%)の解析を行 った。
23
3-2-10. Terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end
labeling(TUNEL)による細胞死の解析
培養SHED はApopTag Peroxidase In Situ Apoptosis Detection Kit(Chemicon International、Temecula、CA)を用いてTUNEL染色を施した。試料はAxiocam mono 503(Carl Zeiss Microscopy)を装着したAxio Imager M2 microscope(Carl Zeiss Microscopy)にて観察した。その後、Image-J software(NIH)を用いて、全有核 細胞に対するTUNEL陽性核細胞の百分率(%)を算出した。
3-2-11. 定量的reverse transcription polymerase chain reation(RT-PCR)解析
培養SHEDをTRIzol(Thermo Fisher Scientific)で処理し、含有ゲノムDNAを DNase I(Promega、Madison、WI)にて処理・分解した。その後、RNeasy Mini Kit
(Qiagen、Venlo、Netherlands)を用いて精製し、Total RNAを得た。ゲノムDNA のコンタミネーションの有無を確認するために、精製した Total RNA をヒト glyceraldehyde-3-phosphate dehydrogenase( GAPDH ) プ ラ イ マ ー (Sense,
5'-TGAAGGTCGGTGTCAACGGATTTGGC-3'; Antisense,
5'-CATGTAGGCCATGAGGTCCACCAC-3')を用いた PCR を行った。PCR では、
24
RT-PCR Quick Taq HS DyeMix(TOYOBO、Osaka)を用いて、T-100 thermal cycler
(Bio-Rad Laboratories、Hercules、CA)にて遺伝子増幅反応を行った。反応条件
はinitial activation stepが95℃で120秒間行い、その後、95℃で30秒、60℃で30 秒、68℃で60秒のthree-step cyclingを30反応繰り返した。そのPCR産物(5L)
は2%アガロースゲルにアプライし、Mupid-2plus(Mupid、Tokyo)にて、室温、
25 分間ゲル電気泳動を行った。2%エチジウムブロマイドで、室温で 20 分間染 色し、ゲル撮影装置Gel Doc EZ System(Bio-Rad Laboratories)にてバンドの検 出を行った。ゲノムDNAのコンタミネーションが検出された場合、再度、DNase
I(Promega)を用いて、抽出試料を処理し、上記の方法で確認した。
Total RNA 1 gをRevertra Ace qPCR kit(TOYOBO)で逆転写し、cDNAを作 製した。その後、定量的 RT-PCR で解析を行った。解析では、TaqMan Gene Expression Master Mix(Applied Biosystems、Foster City、CA)および標的遺伝子 のTaqManプローブを用いて、Light Cycler 96 real-time PCR system (Roche、Basel、
Schwizershe)にて検出を行った。反応条件は preincubation 1(50℃、120 秒)、 preincubation 2(95℃、600秒)、そして、two-step amplification(95℃、15秒と
25
60℃、60秒を45反応)を行った。また、18s ribosomal RNAをinternal controlと して用いた。今回の研究で使用したプローブは表3-2-2に列挙した。研究に用い
た全てのプローブはApplied Biosystemsより購入した。各々の標的遺伝子の発現 は18s ribosomal RNAにて標準化した。
表3-2-2:定量的RT-PCRのTaqManプローブリスト Names of genes Gene assay ID Numbers
ALP Hs01029144_m1
OCN Hs01587814_g1
DSPP Hs00171962_m1
RUNX2 Hs00231692_m1
Ribosomal RNA、 18S Hs99999901_s1 ALP:alkaline phosphatase
OCN:osteocalcin
DSPP:dentin sialo phosphoprotein
RUNX2:runt-related transcription factor 2
26 3-2-12. ウェスタンブロット解析
培養 SHED の総タンパク質は proteinase inhibitor(Nacalai Tesque)および phosphatase inhibitor phoSTOP(Roche) を 加 え た M-PER mammalian protein extraction reagent(Thermo Fisher Scientific)にて溶解した。Protein Assay(Bio-Rad
Laboratories)を用いて、総タンパク質の濃度を測定した。測定にはMultiskan GO
spectrophotometer(Thermo Fisher Scientific)を使用し、波長595 nmで測定を行 った。これらの総タンパク質はTGX FastCast acrylamide gel(Bio-Rad Laboratories)
にて分離させ、Trans-Blot Turbo transfer system(Bio-Rad Laboratories)にてメン
ブレンに転写した。メンブレンはTris-buffered saline(150 mM塩化ナトリウム溶
液および20 mM塩化トリス溶液でpH 7.2に調整したもの)の中に5%スキムミ
ルクを加えた溶液に室温で 1 時間、浸漬させ、ブロックした。その後、メンブ
レンを1次抗体に4℃で一晩浸漬させた。今回の研究では、表3-2-3の1次抗体
を使用した。horseradish peroxidase標識donkey抗rabbit IgG 2次抗体(1 : 1000;
Santa Cruz Biotechnology、Dallas、TX)で室温にて1時間処理した。SuperSignal West Pico(Thermo Scientific)にてメンブレンを処理し、ImageQuant LAS 4010(GE Healthcare Life Sciences、Pittsburgh、PA)にて撮影した。全てのメンブレンは
27
WB stripping solution strong(Nacalai Tesque)にて抗体を剥がし、その後、-actin 抗体(Merck)と反応させ、horseradish peroxidase標識donkey抗mouse IgG 2次 抗体(1 : 1000; Santa Cruz Biotechnology)にて再度標識し、撮影を行った。各々
のバンドの輝度をImade-J(NIH)を用いて測定した。Internal controlとして-actin のバンドにて標準化した。
表3 -2-3:ウェスタンブロット法の抗体リスト
Names of antibodies Types of antibodies Suppliers anti--actin purified Merck(Darmstadt、Germany)
anti-AKT purified Cell Signaling Technology(Danvers、MA)
anti-AKT(Ser473)、phosphorylated purified Cell Signaling Technology(Danvers、MA)
anti-ALP purified Abcam(Cambridge、England)
anti-DSPP purified Santa Cruz Biotechnology(Dallas、TX)
anti-ERK1/2 purified Cell Signaling Technology(Danvers、MA)
anti-ERK1/2、phosphorylated purified Cell Signaling Technology(Danvers、MA)
anti-NF-B p65 purified Cell Signaling Technology(Danvers、MA)
anti- NF-B p65、 phosphorylated purified Cell Signaling Technolog (Danvers、MA)
anti-OCN purified LifeSpan BioSciences(Seattle、WA)
anti-RUNX2 purified Abcam(Cambridge、England)
serine/threonine kinase ALP:alkaline phosphatase DSPP:dentin sialo phosphoprotein
ERK1/2: extracellular signal-related kinase 1 and 2
NF-B:nuclear factor kappa-light-chain-enhancer of activated B cells OCN: osteocalcin
RUNX2:runt-related transcription factor 2
28 3-2-13. 統計解析
全てのデータは平均値±標準誤差として表した。全ての解析は、各サンプル
につき少なくとも3 回繰り返した。2群間の比較解析には独立 2 群のtwo-tailed Student’s t-testsを用いた。多群間の比較解析にはTukey’s post hoc testによる一段 階多重比較法を用いた。0.05未満のP値を有意差ありと見なした。
29
§3-3. 結果
3-3-1. 高ビリルビン血症患児の肝機能ならびに口腔内所見について
一般的に出生後、胆道閉鎖症による高ビリルビン血症と診断を受けた全ての
患児は葛西手術(肝門部空腸吻合術)を受け、肝臓から胆汁排泄を促し、高ビ
リルビン血症を回避させる。九州大学病院小児歯科を受診した先天性胆道閉鎖
症の既往のある 3 例の患児は葛西手術を受けるも高ビリルビン血症による肝機 能不全が生じ、生体肝移植を受けた症例であった(表 3-3-1)。肝移植後から患
児の総ビリルビンおよび直接(抱合型)ビリルビンの各血中値は正常値内に改
善した。(表3-3-1)。総ビリルビンとは抱合型ビリルビンと間接(非抱合型)ビ
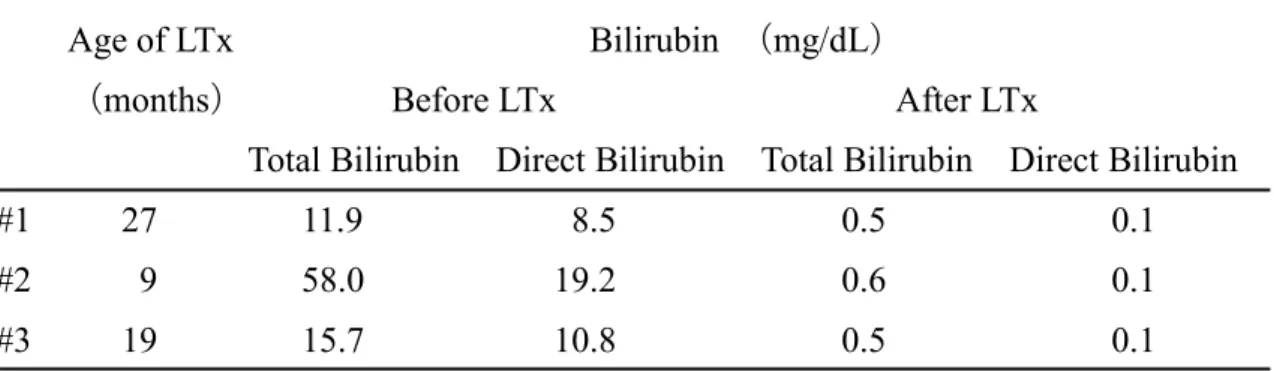
リルビンを合せたものである。この血液検査の結果より、この 3 例の患児#1、
#2、#3での非抱合型ビリルビン値の変化は、肝移植前がそれぞれ3.4、38.8、4.9
mg/dL、肝移植後が0.4、0.5、0.4 mg/dLとなった。高ビリルビン血症において、
抱合型ビリルビンの上昇に併せて、非抱合型ビリルビンも上昇すること、肝移
植後の高ビリルビン血症の改善とともに非抱合型ビリルビンも低下することが
示された。
30
Age of LTx Bilirubin (mg/dL)
(months) Before LTx After LTx
Total Bilirubin Direct Bilirubin Total Bilirubin Direct Bilirubin
#1 27 11.9 8.5 0.5 0.1
#2 9 58.0 19.2 0.6 0.1
#3 19 15.7 10.8 0.5 0.1
表3-3-1.胆道閉鎖症患児に関する血清中のビリルビン濃度の血液検査結果。
この表に示す年齢で胆道閉鎖症患児は肝移植(LTx)を受けた。肝移植前後にお いて総ビリルビン(Total Bilirubin)および直接ビリルビン(Direct Bilirubin)の 濃度は肝移植前および肝移植 1 年後に患児の状態の確認のため、測定された。
総ビリルビンの血清中濃度の正常範囲は 0.4-1.5 mg/dL、直接ビリルビンの血清 中濃度の正常範囲は0.0-0.3 mg/dLである。#1:胆道閉鎖症患児1;#2:胆道閉
鎖症患児2;#3:胆道閉鎖症患児3。Before LTx:肝移植前(葛西手術後);After
LTx:肝移植後。
[Yamaza, H. et al. Oral Dis.(2018)]
31
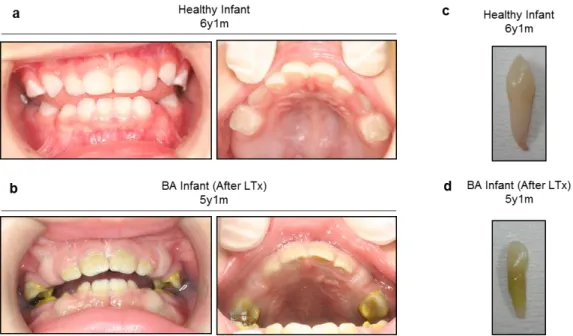
2016 年の厚生労働省歯科疾患実態調査(http://www.mhlw.go.jp/english/)によ ると、日本人4歳齢の齲蝕罹患率の指標である1人平均df歯数(d:未処置齲蝕 歯、f:齲蝕による処置歯)のスコアが 0.9 である。本研究の肝移植を受けた 3 例の 4 歳齢時における齲蝕の罹患と乳歯の形成状態を観察した。いずれの患児 においても緑色を呈する乳歯が観察された(図3-3-1、3-3-2)。患児#1と#2では
df歯数のスコアが5と16であった(表3-3-2)。患児#3では、df歯数のスコアが 0 であった(表 3-3-2)が、これは出生後、歯科における口腔内管理を徹底した 症例であると考えられた。乳歯20歯中、形成障害の数が、患児#1では5歯、患 児#2では12歯、患児#3では8歯であった(表3-3-2)。X線写真により、患児#1 では象牙質の石灰化障害・形成障害ならびに長胴歯(タウロドント)が認めら
れた(図 3-3-3)。これらの臨床所見より、たとえ高ビリルビン血症が一過性で
あったとしても、高ビリルビン血症の改善後において乳歯の形成障害は残存し、
齲蝕のリスク要因の一つとなることが示唆された。
32
図3-3-1. 胆道閉鎖症患児(#3)の乳歯列および抜去歯牙の臨床所見。
(a、b)口腔内写真。(a)1歳11ヶ月の健常児の乳歯列。(b)肝移植後(After LTx) の 2 歳 1 ヶ月の胆道閉鎖症患児(#3)の乳歯列。(c、d)抜去乳歯の肉眼写真。
(c)6 歳1 ヶ月の健常児の抜去乳歯。(d)5 歳 1 ヶ月の胆道閉鎖症患児の抜去 乳歯。Healthy Infant:健常児。BA Infant:胆道閉鎖症。
[Yamaza, H. et al. Oral Dis.(2018)]
図3-3-2.4歳の胆道閉鎖症患児(#2)の口腔内写真。
乳歯、特に乳臼歯における緑色の着色および重篤な形成不全を認めた。(a)左 側上顎歯列。(b)右側上顎歯列。(c)下顎歯列。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
33
Patient (Age) Eruption Dental Caries (dft index) Hypoplasia
#1 (4y1m) 20 5 5
#2 (4y1m) 20 16 12
#3 (4y0m) 20 0 8
表3-3-2.胆道閉鎖症患児における口腔内所見。
表に示す年齢で患児らの口腔内診査を実施した。その結果、萌出した乳臼歯数
(Eruption)、齲蝕罹患歯数(Dental Caries)および形成不全歯数(Hypoplasia) が示された。齲蝕罹患歯数は未処置歯および齲蝕処置歯数のことである。各患 児の年齢は歳(y)と月(m)で示した。#1:胆道閉鎖症患児1;#2:胆道閉鎖 症患児2;#3:胆道閉鎖症患児3。[Yamaza, H. et al. Oral Dis.(2018)]
図3-3-3.胆道閉鎖症患児(#1)のX線写真。
(a)左は1歳5か月、右は3歳6ヶ月の健常児。(b)左は#1の肝移植前(Before
LTx)の1歳11ヶ月、右は肝移植後(After LTx)の4歳0ヶ月の胆道閉鎖症患
児。Healthy Infant:健常児。BA Infant:胆道閉鎖症患児。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
34
3-3-2. in vitro SHED培養系において、高濃度ビリルビン添加による象牙質基質
への沈着について
抱合型ビリルビンは活性が短く、実験上、その濃度のコントロールが難しい。
従って、本研究を通じて、非抱合型ビリルビンを用いたin vitro実験を行った。
高濃度ビリルビンの条件として、50 M 非抱合型ビリルビンを設定した。これ
は乳歯に緑色の色素沈着を生じる血清ビリルビン値が3 mg/dLという報告[65]
を参考にした。高ビリルビン血症が乳歯の象牙質形成過程において沈着するこ
とを細胞生物学的に検証するために、50 M 非抱合型ビリルビンを添加した象
牙芽細胞分化誘導培地でSHEDを培養した。4週間の象牙芽細胞分化誘導により、
SHEDは象牙質様基質を形成することが知られているため[33、64]、分化誘導 4週後において、形成された象牙質様基質中におけるビリルビンの沈着について 形態学的解析ならびに生化学的解析を行った。ビリルビン無添加群(B0群)と 比較すると、50 M非抱合型ビリルビン添加群(B50群)では基質中へのビリル ビンの沈着が有意に認められた(図3-3-4)。SHEDが存在しない条件下で50 M 非抱合型ビリルビンを添加した象牙芽細胞分化誘導培地で 4 週間インキュベー トした場合、培養皿上にビリルビンは検出されなかった(データ未公開)。以上
35
のことから、非抱合型ビリルビンは象牙芽細胞に取り込まれ、象牙質形成に関
わる様々な分泌タンパク質とともに、象牙芽細胞から分泌され、象牙質様基質
の中に沈着することが示唆された。
36
図3-3-4. ビリルビン沈着解析。
(a)培養皿のビリルビン沈着の写真。(b)回収した基質の写真。(c)培養皿に おけるビリルビン沈着領域の面積の割合。(d)基質中のビリルビン濃度。
a-d:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群。c、d:n = 5。
***;危険率P < 0.005。グラフは平均値±標準誤差で表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
37
3-3-3. in vitro SHED培養系において、高濃度ビリルビン添加が象牙質形成に与
える影響について
高ビリルビン血症が乳歯の象牙質形成を障害することを細胞生物学的に検証
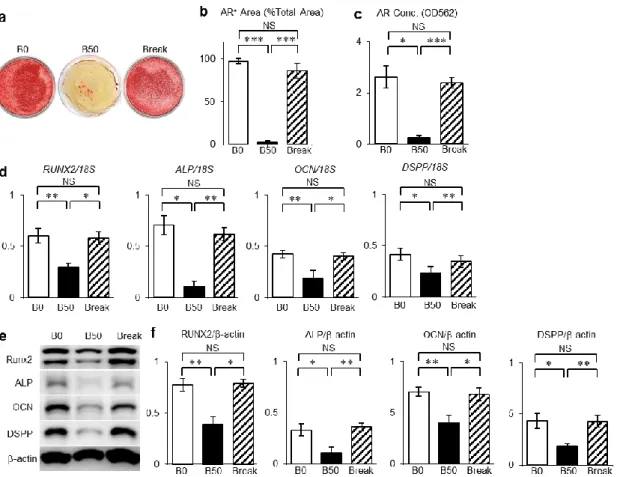
するために、ビリルビン刺激下におけるSHEDの象牙質形成能をin vitro系で解 析した(図3-3-5)。SHED は3-3-2.と同条件で培養した。象牙芽細胞分化誘導 6 週後にアリザリン染色を行い、石灰化基質の形成を解析した。B0群よりB50群 はカルシウム沈着量が低下していた(図3-3-5a - 5c)。定量的RT-PCR法および ウェスタンブロット法を用いた解析により、象牙芽細胞分化誘導 4 週後におい てB0群と比較して、B50群はrunt-related transcription factor 2(RUNX2)、alkaline phosphatase(ALP)、osteocalcin(OCN)およびdentin sialo phosphoprotein(DSPP)
の各遺伝子および各タンパク質の発現が有意に減少していた(図3-3-5d - 5f)。
38
図3-3-5.ビリルビン刺激はSHEDの象牙芽細胞分化能を低下させ、ビリルビン
刺激中断はSHEDの象牙芽細胞分化能を回復させる。
(a-c)カルシウム沈着解析。(a)アリザリンレッド(AR)染色の写真。(b)AR 陽性領域の面積の百分率。(c)AR含有濃度の測定。(d)runt-related transcription factor 2(RUNX2)、alkaline phosphatase(ALP)、osteocalcin(OCN)、dentin sialo phosphoprotein(DSPP)のmRNAの発現を定量的RT-PCR法を用いた測定およ び18s rRNAによる標準化(RUNX2/18s、ALP/18s、OCN/18s、DSPP/18s)後の 発現解析。(e、f)ウェスタンブロット法による象牙芽細胞特異的タンパク質の 発現解析。(e)RUNX2、ALP、OCN、DSPPのバンド像。(f)-actinによる標準 化後のRUNX2、ALP、OCN、DSPPの(RUNX2/-actin、ALP/-actin、OCN/-actin、
DSPP/-actin)発現解析。
a-f:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリル ビン刺激中断群。b-d、f:n = 5。*;危険率P < 0.05、**;危険率P < 0.01、***;
危険率P < 0.005。NS:有意差なし。グラフは平均値±標準誤差で表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
39
3-3-4. 高濃度ビリルビン刺激がin vitro象牙質細胞分化誘導過程におけるSHED
の細胞内シグナル経路、AKT、ERK1/2、NF-B p65に与える影響について
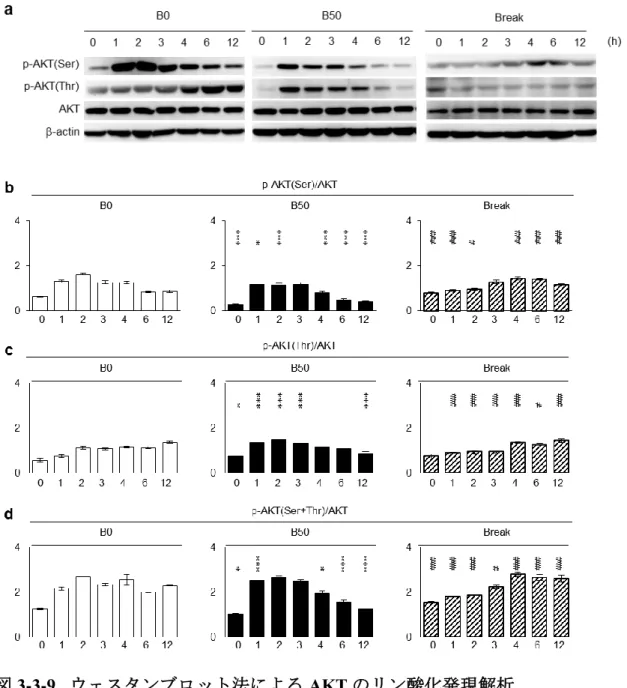
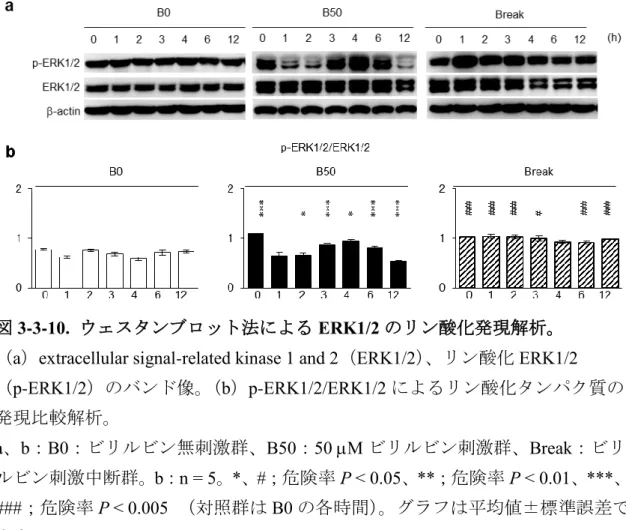
AKT、ERK1/2およびNF-Bの細胞内シグナル経路が、SHEDの象牙芽細胞分
化誘導に関与していることが報告されている[6、25、27]。しかし、ビリルビ ン刺激によるこれら細胞内シグナル経路への影響はまだ報告されていない。そ
こで、高濃度ビリルビン刺激条件下の SHED における serine/threonine kinase
(AKT)、extracellular signal-related kinase 1 and 2(ERK1/2)、nuclear factor kappa-light-chain-enhancer of activated B cells(NF-B)p65のタンパク質およびそ
れらのリ ン酸化 タン パク質、 リン酸 化 AKT(p-AKT)、リ ン 酸化 ERK1/2
(p-ERK1/2)、リン酸化NF-B p65(p-NF-B p65)の発現をウェスタンブロット 法にて解析した。象牙芽細胞分化誘導4週後では、B0群と比較し、B50群では
p-AKTおよびp-ERK1/2のタンパク質発現が有意に抑制され、p-NF-B p65が有
意に増強されていた(図3-3-6a - 6f)。
40
図3-3-6.ウェスタンブロット法によるAKT、ERK1/2、NF-B p65のリン酸化 解析。
(a)serine/threonine kinase(AKT)、Ser473によるリン酸化AKT(p-AKT(Ser))、 Thr308によるリン酸化AKT(p-AKT(Thr))のバンド像。(b) p-AKT(Ser)/AKT、
p-AKT(Thr)/AKT、p-AKT(Ser+Thr)/AKTによるリン酸化タンパク質の発現
比較解析。(c)extracellular signal-related kinase 1 and 2(ERK1/2)、p-ERK1/2のバ ンド像。(d)p-ERK1/2/ERK1/2 によるリン酸化タンパク質発現比較解析。(e) nuclear factor kappa-light-chain-enhancer of activated B cells(NF-B)p65、p-NF-B p65のバンド像。(f)p-NF-B p65/ NF-B p65によるリン酸化タンパク質発現解 析。
a-f:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリル ビン刺激中断群。b、d、f:n = 5。*;危険率P < 0.05、**;危険率P < 0.01、***;
危険率P < 0.005。NS:有意差なし。グラフは平均値±標準誤差で表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
41
3-3-5. ビリルビン刺激中断がSHEDのin vitro象牙質形成および細胞内シグナル
経路に与える影響について
健常児と比較して、先天性胆道閉鎖症患児において、肝移植前のデンタル X 線写真では、乳歯、特にその象牙質形成に低下が認められた(図3-3-3b)。一方、
興味深いことに、肝移植後のX線写真では象牙質低形成の改善が認められた(図
3-3-3b)[51]。本研究では、肝移植前後における乳歯象牙質形成の変化について
高濃度ビリルビン刺激の中断試験法にて細胞生物学的に検証を行った。つまり、
in vitroモデルとして、以下のSHED培養系を用いた(図3-2-1)。SHEDを象牙
芽細胞分化誘導培地にて2 週間培養した。その際、50 M 非抱合型ビリルビン を添加した群、非添加群に分けた。その後、ビリルビン添加群をビリルビン添
加を継続する群と中断する群に分け、最大 4 週間、追加培養を行った。培地は 象牙芽細胞分化誘導培地を用いた。この全6週間の培養過程において、6週目は アリザリンレッド染色法にて石灰化基質の沈着を、4週目は定量的RT-PCR法お よびウェスタンブロット法にて象牙芽細胞分化マーカーの発現解析を行った。
アリザリンレッド染色法により、B50 群にて顕著に低下していた象牙質の形成 はビリルビン刺激中断群(Break 群)において有意に増加し、B0 群と同等の石
42
灰化基質沈着を認めた(図3-3-5a - 5c)。定量的RT-PCR法およびウェスタンブ ロット法により、B50群にて顕著に抑制されていたRUNX2、ALP、OCNおよび DSPP の遺伝子およびタンパク質の発現が Break 群において有意に増加し、B0 群と同等の発現を認めた(図3-3-5d - 5f)。
細胞シグナル分子AKT、ERK1/2、NF-B p65およびそのリン酸化分子の発現 について、ウェスタンブロット法によりビリルビン刺激中断の影響を解析した。
B50群と比較し、2週間ビリルビン刺激を中断したBreak群では、高濃度ビリル ビン刺激により顕著に抑制されていたリン酸化AKTおよびリン酸化ERK1/2の 発現が有意に増大し、顕著に増強されていたリン酸化NF-B p65の発現が有意 に減少し、B0群と同等の発現量を呈した (図3-3-6)。
3-3-6. ビリルビン刺激ならびにその刺激の中断が SHED の細胞増殖および細胞
死に与える影響について
ビリルビン刺激が SHED の細胞増殖および細胞死へ与える影響を検討した。
まず、細胞増殖への影響を調べるために、以下の培養群で SHED を培養した。
43
細胞を播種し、①血清含有細胞増殖培地にて 6 日間培養し、その後も血清含有 培地にて 3 日間培養を行った群(B0 群)、②血清含有細胞増殖培地で 3 日間培 養し、その後、50 M 非抱合型ビリルビンを加えた血清含有培地で3 日間培養 し、さらに、このビリルビンを添加した培地で3日間追加培養を行った群(B50 群)、③培養開始から6日間は②と同じ培養を行い、その後、3日間はビリルビ ン非添加の血清含有培地にて培養を行った群(Break群)とした (図3-2-2)。
各群、培養終了24時間前に、培地量に対して百分の一量の BrdU試薬を添加 した。培養後、各SHED群の細胞増殖をBrdUラベリング染色法により比較検討 した。B0 群と比較し、B50 群では有意に BrdU 陽性細胞の割合が減少した(図
3-3-7)。一方、Break 群では、高濃度ビリルビン刺激により顕著に抑制された細
胞増殖能はB0群と同等の増殖活性を示した(図3-3-7)。
44
図3-3-7.BrdU取り込み解析による細胞増殖解析。
血清含有培地を用いて、SHEDをビリルビン無添加培地あるいは50 Mビリル ビン添加培地にて3日間処理した。
B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリルビン 刺激中断群。n = 5。***;危険率P < 0.005。NS:有意差なし。グラフは平均値
±標準誤差で表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
45
次に、ビリルビン刺激に対する SHED の細胞死への影響を調べた。SHED を 上記の細胞増殖の解析の場合と同様の培養プロトコールで行った。ただし、最
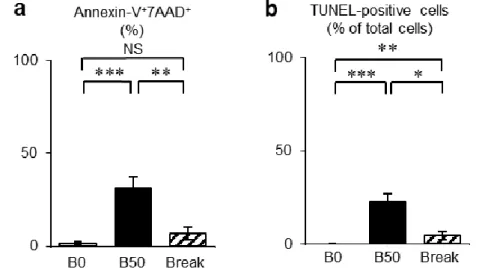
後の3日間は全ての実験群で無血清培地を使用した。Annexin-V/7AAD染色によ るFlow cytometry解析により、B0群と比較して、B50群はAnnexin-V/7AAD二 重陽性細胞が有意に増加した (図3-3-8a)。また、TUNEL染色を施すと、TUNEL 陽性細胞はB0群と比較して、B50群で有意に増加していた(図3-3-8b)。一方、
ビリルビン刺激を中断した場合、Annexin-V/7AAD 二重陽性細胞および TUNEL 陽性細胞はともに有意に減少した(図3-3-8)。B0群と比較し、ビリルビン刺激
を中断した場合、Annexin-V/7AAD 二重陽性細胞は同等に、TUNEL 陽性細胞は 有意に高い割合であった。これらのことから、ビリルビン刺激により SHED に おいて細胞死が誘導される可能性が示唆された。
46
図3-3-8.ビリルビンによるSHEDに対する細胞死解析。
(a)無血清培地を用いて、SHEDをビリルビン無添加あるいは50 Mのビリル ビン添加培地にて3日間処理した。Flow cytometryを用いて、各条件下での培養 SHED において Annexin-V および 7AAD 陽性細胞(Annexin-V+7AAD+)を識別 した。(b)TUNEL解析を用いて各条件下での培養SHEDにおいてTUNEL陽性 核細胞を識別した。
B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリルビン 刺激中断群。n = 5。*;危険率P < 0.05、**;危険率P < 0.01、***;危険率P < 0.005。
NS:有意差なし。グラフは平均値±標準誤差で表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
47
3-3-7. ビリルビン刺激ならびにその刺激の中断が SHED の細胞内シグナル経路
AKT、ERK1/2およびNF-B p65に与える影響について
歯髄幹細胞の細胞増殖または細胞死において、AKT、ERK1/2およびNF-B p65 が重要な細胞内シグナル経路として機能していることが知られている[6、28、
45]。しかし、無刺激下のみならず、ビリルビン刺激およびその刺激中断下にお いて、SHEDの細胞増殖または細胞死にAKT、ERK1/2およびNF-B p65が関与 しているかについては不明である。従って、SHEDにおけるAKT、ERK1/2、NF-B p65およびそれらのリン酸化タンパク質の発現について、ウェスタンブロット法 を用いて、無血清化から0、1、2、3、4、6、12時間後における経時的変化の解 析を行った。
1)AKTのリン酸化の変動について
B0群における AKT のセリン残基473 は、培地を無血清化 2時間後でそのリ ン酸化が最大値に達し、その後、減少した(図3-3-9a - 9b)。一方、AKTのトレ
オニン残基308は経時的にリン酸化が増大した(図3-3-9a、9c)。そのセリン残 基 473 およびトレオニン残基 308 を合わせたトータルのリン酸化は無血清化 2
48
時間後に最大値に達し、その後、そのリン酸化レベルを大きく減じることなく、
無血清化12時間後まで高いレベルを維持していた(図3-3-9d)。
B50群におけるAKTのセリン残基473のリン酸化は相対的にそのリン酸化レ ベルが有意に低く発現していた(図3-3-9a - 9b)。一方、AKTのトレオニン残基
308はリン酸化レベルが無血清化2時間後で最大値に達し、その後、減少し、リ ン酸化ピークの早期化が認められた(図3-3-9a、9c)。トータルのリン酸化は無
血清化3時間後まではB0群と同様の変化を示したが、4時間後よりそのリン酸 化レベルが有意に減少していた(図3-3-9d)。
2)ERK1/2のリン酸化の変動について
B0群における ERK1/2 のリン酸化は培地の無血清化より終始変動が認められ なかった(図3-3-10)。一方で、B50群において無血清化から2時間後よりERK1/2 のリン酸化レベルが上昇した。無血清化 4 時間後でそのリン酸化が最大値を呈 し、その後、減弱していた(図3-3-10)。
49
3)NF-B p65のリン酸化の変動について
B0群ではNF-B p65のリン酸化は無血清化3時間後より減弱した(図3-3-11)。
一方、B50 群において、無血清化 3 時間後にリン酸化レベルが最大に達し、そ の後、減少を認め、リン酸化ピークの遅延が認められた(図3-3-11)。リン酸化
のレベルは有意に高いレベルを呈していた。
4)ビリルビン刺激中断によるAKT、ERK1/2およびNF-B p65のリン酸化の変
動について
ビリルビン刺激中断群(Break群)のAKT、ERK1/2、NF-B p65のリン酸化 の動態を解析した。AKT のセリン残基 473 およびトレオニン残基 308、それら を合わせたトータルのリン酸化は経時的にそれらのリン酸化のレベルが増大し
た(図3-3-9)。特に、無血清化4時間以降では、B50群と比較して、有意に高い
レベルを呈した。ERK1/2のリン酸化はB50群と比較して、無血清化直後から有 意に高いリン酸化レベルを維持していた(図3-3-10)。NF-B p65のリン酸化レ
ベルはB0群と同様に無血清化から2時間後にピークとなり、それ以降は減少し ていた(図3-3-11)。そのリン酸化レベルはB50群と比較すると解析期間を通し
50 て低いレベルを維持していた。
51
図3-3-9. ウェスタンブロット法によるAKTのリン酸化発現解析。
(a)serine/threonine kinase (AKT)、Ser473によるリン酸化AKT(p-AKT(Ser))、 Thr308によるリン酸化AKT(p-AKT(Thr))のバンド像。(b-d)p-AKT(Ser) /AKT、p-AKT(Thr)/AKT、p-AKT(Ser+Thr)/AKTによるリン酸化タンパク質 の発現比較解析。
a-d:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリル ビン刺激中断群。b-d:n = 5。*、#;危険率P < 0.05、**;危険率P < 0.01、***、
###;危険率P < 0.005 (対照群はB0の各時間)。グラフは平均値±標準誤差で
表す。[Yamaza, H. et al. Oral Dis.(2018)より改変]
52
図3-3-10. ウェスタンブロット法によるERK1/2のリン酸化発現解析。
(a)extracellular signal-related kinase 1 and 2(ERK1/2)、リン酸化ERK1/2
(p-ERK1/2)のバンド像。(b)p-ERK1/2/ERK1/2によるリン酸化タンパク質の 発現比較解析。
a、b:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリ ルビン刺激中断群。b:n = 5。*、#;危険率P < 0.05、**;危険率P < 0.01、***、
###;危険率P < 0.005 (対照群はB0の各時間)。グラフは平均値±標準誤差で
表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
53
図3-3-11. ウェスタンブロット法によるNF-B p65のリン酸化発現解析。
(a)nuclear factor kappa-light-chain-enhancer of activated B cells(NF-B)p65、リ ン酸化NF-B p65(p- NF-B p65)の画像。(b)p-NF-B p65 / NF-B p65による リン酸化タンパク質の発現比較解析。
a、b:B0:ビリルビン無刺激群、B50:50 Mビリルビン刺激群、Break:ビリ ルビン刺激中断群。b:n=5。*、#;危険率P < 0.05、**;危険率P < 0.01、***、
###;危険率P < 0.005 (対照群はB0の各時間)。グラフは平均値±標準誤差で
表す。
[Yamaza, H. et al. Oral Dis.(2018)より改変]
54
§3-4. 小括
実験Iから以下のことが分かった。
高濃度(50 M)非抱合型ビリルビン刺激により、
1. 象牙芽細胞分化誘導された SHED により分泌された基質内へビリルビンの 沈着を認めた。
2. SHEDの象牙芽細胞分化能を障害した。
3. SHEDの細胞増殖能を障害し、細胞死を誘導した。
4. SHEDの象牙芽細胞分化および細胞死の制御に関わるAKTシグナル経路お
よびERK1/2シグナル経路を抑制し、NF-B p65シグナル経路を活性化した。
ビリルビン刺激中断試験より、
5. 高濃度非抱合型ビリルビンで障害された SHED の象牙芽細胞分化能を回復 した。
6. 高濃度非抱合型ビリルビンで障害された SHED の細胞増殖能を回復し、細 胞死を減少させた。
7. 高濃度非抱合型ビリルビンの影響を受けた SHED の AKT シグナル経路、
ERK1/2シグナル経路、NF-B p65シグナル経路を回復した。
55
以上のことから、胆道閉鎖症などに随伴する高ビリルビン血症は乳歯の緑色
の色素沈着や歯数不足、象牙質の形成障害の原因となる可能性を示した。
56
§4. 研究 II
「ビリルビンによる SHED の細胞死ならびに象牙芽細胞分
化能の障害に対するパミドロネートの治療効果に関する研
究」
57
§4-1. 背景と目的
小児期の血中の過剰なビリルビンは骨芽細胞の骨形成能および細胞生存能を
障害し[23、47]、結果として、全身の骨格に続発性骨粗鬆症が生じ、成長障害 が引き起こされる[10、21]。加えて、この小児期の高ビリルビン血症では乳歯 に緑色の色素沈着ならびに象牙質の形成障害が見られ[5、34]、齲蝕の発症原
因と考えられている[5、34]。先天性胆道閉鎖症やWillson 病など難治性の肝疾 患の患児では、生体肝移植を受けると、骨粗鬆症は改善することが知られてい
る[26、44]。一方で、残念なことに、高ビリルビン血症による乳歯に対する障 害は肝移植後も残存することが報告されている[18、38]。しかし、高ビリルビ ン血症における象牙質の形成障害を含む乳歯の形成障害の発症機序や適切な治
療については十分に解明されていない。従って、齲蝕の多発などによる高ビリ
ルビン血症患児の生活の質を二次的に低下させる可能性がある。そのため、高
ビリルビン血症による乳歯の障害を治療する方法の確立が必要である。
ビスホスホネート製剤は骨形成不全症および胆道閉鎖症やWillson病による続
58
発性骨粗鬆症に対する安全かつ有効性が示されている薬剤として使用されてい
る[4、48]。また、パミドロネートは肝臓移植待機患児に対して、骨量の減少 および骨の構造障害の予防のために、臨床で用いられている[3]。しかし、高 ビリルビン血症で認められる乳歯の形成障害に対してパミドロネートの効果に
ついては未だよく分かっていない。
そこで、研究 II では、SHED を用いて、高ビリルビン血症で生じる乳歯の形 成障害に対する新たな治療法の可能性を調べることを目的とした。SHEDの機能 において、AKTやERK1/2、NF-B p65シグナル経路を含む多様なシグナル経路 が関与している可能性が報告されている[64]。SHEDの有する象牙質形成能も
AKTやERK1/2、NF-B p65シグナル経路を含む様々なシグナル経路で制御され
ている[6、25、27]。まず、SHEDを過剰なビリルビンに曝露し、象牙質形成能、
細胞死およびそれに関連するAKT、ERK1/2、NF-B p65シグナル経路を解析す るとともに、ミトコンドリアを介した細胞死について解析することとした。次
に、高ビリルビン血症による SHED の象牙質形成障害や細胞死についてパミド ロネートの予防効果を評価した。