高速液体クロマトグラフィーと電気化学検出器を利用したリファン ピシンとクラリスロマイシンの血中濃度測定法の臨床的有用性
1)
独立行政法人国立病院機構東名古屋病院薬剤科,
2)同 呼吸器科,
3)名城大学薬学部
滝 久司
1)小川 賢二
2)中川 拓
2)二改 俊章
3)(平成 18 年 9 月 11 日受付)
(平成 19 年 4 月 20 日受理)
Key words : rifampicin, clarithromycin, high-performance liquid chromatography, electrochemical detector
要 旨
リファンピシン(RFP)は肝臓の薬物代謝酵素活性の誘導作用を持っており薬物相互作用などが臨床上非 常に重要な問題となっている.特にクラリスロマイシン(CAM)は RFP の肝薬物代謝酵素(CYP3A4 等)
誘導作用により代謝が促進され血中濃度が低下するとの報告がある.そこで,われわれは病院内に高速液体 クロマトグラフィー(HPLC)とこの吸光度検出器に電気化学検出器を接続した分析装置を設置し簡便かつ 迅速に RFP と CAM の血中濃度を測定した.対象は患者血清とそれぞれの標準血清および標準品試料.本 測定法と外部委託による HPLC 法および LC! MS! MS 分析法にて測定されたそれぞれの結果を比較した.そ の結果,RFP では本測定法である HPLC と外部委託で測定された HPLC の結果との間には r=0.975,p<
0.01 という強い相関が得られた.また CAM においても本測定法である電気化学検出器により測定した結果 と外部委託され LC ! MS ! MS 分析法により測定した結果との間には r=0.995,p<0.01 という強い相関が得 られた.このことから HPLC と電気化学検出器を直列に接続した本測定方法により RFP と CAM の血中濃 度を簡便かつ迅速に測定できることが分かった.また RFP と CAM 併用時に本測定法を用い実際に投与量 調節が可能であった.このように迅速かつ簡便に薬物血中濃度を同時測定可能とすることは特に十分でない 肺非結核性抗酸菌症の治療成績の向上につながる可能性が期待され,意義深いものと考えられた.
〔感染症誌 81:414〜420,2007〕
序 文
非結核性抗酸菌症は近年増加している感染症である が,現在の治療法では完治させられない難治性感染症 のひとつである.本疾患の克服のためには血中濃度に 影響を及ぼす因子の解析が重要であると考えられる.
特に Streptomyces mediteranei の産生する Rifamycin 群 から化学的に修復して導かれた半合成抗生物質である
1)
リファンピシン(以下 RFP)とエリスロマイシンの ラクトン環の 6 位水酸基を O―メチル化した半合成マ クロライド系抗生物質である
2)クラリスロマイシン(以 下 CAM)は,非結核性抗酸菌の治療薬として汎用さ
れており
3)〜9),RFP の肝臓での薬物代謝酵素活性の誘
導作用
10)が薬物相互作用として現在臨床上重要な問題 となっている.RFP は肝薬物代謝酵素(CYP3A4 等)
誘導作用により CAM の代謝を促進し,その血中濃度 を低下させるとの報告がある
11)〜13).この 2 剤の血中濃 度を把握することは抗菌薬の効果を高める上で重要な ポイントとなる.そこで,RFP についてはこれまで に Pharmacokinetics で解析されてきた生物学的測定 法,吸光度測定法,蛍光測定法,高速液体クロマトグ ラ フ ィ ー(以 下 HPLC)の な か か ら HPLC を 利 用
し
14)〜16),また CAM については HPLC の検出に電気
化学検出器を利用し HPLC に接続することで RFP お よび CAM の血中濃度を簡便かつ迅速に同時測定する ことが可能となった.また臨床症例おいても RFP お よび CAM 併用時に本測定法を用いそれぞれの血中濃 度を測定することは投与量決定など臨床上有用性が高 いと考えられたので報告する.
材料および方法
1.患者血清
RFP と CAM を同時服用している患者の中で本研
原 著別刷請求先:(〒465―8620)名古屋市名東区梅森坂 5―101 独立行政法人国立病院機構東名古屋病院
滝 久司
究に同意された 23 名の患者を対象とし薬剤投与 2 時 間後に採血した血液の血清を測定検体とした.また本 研究は東名古屋病院倫理審査委員会での承認を得た.
2.標準品および試薬
RFP,CAM の標準品,HPLC 用アセトニトリル,
HPLC 用蒸留水,HPLC 用メタノール,りん酸二水素 ナトリウム二水和物,りん酸水素二ナトリウム・12 水,標準血清(コントロール血清 I ワコー! B)は和 光純薬工業製を使用した.
3.移動相の調製
40mmol ! L りん酸緩衝液(pH 6.7)520mL を作成し,
これにアセトニトリル 390mL,メタノール 90mL を よく混和し移動相として 1L 分を調製した.
4.試験溶液の調整 1)抽出
RFP および CAM の標準品 5mg にアセトニトリル 10mL を徐々に加えた後,メスフラスコ内にて 1 分間 混和する.さらにアセトニトリルで 10 倍希釈,CAM については 100 倍まで希釈し,同様な操作を繰り返し た.このうち以下の各標準血清濃度,標準品試料濃度 になるような量を抽出液として分取した.
2)各標準血清の作成
次に標準血清 1mL に標準血清の濃度が RFP 標準血 清として 2.5,5,7.5,10.0,12.5 および 15µg! mL,ま た CAM 標準血清として 0.25,0.5,0.75,1.0,1.25 お よび 1.5µg! mL になるような 1)の RFP および CAM を加え 10 秒間攪拌し調製した.
3)各標準品試料
各標準品試料は蒸留水 1mL に濃度が RFP 標準血清 として 10.0µg! mL,CAM 標準血清として 1.0µg! mL になるような 1)の RFP および CAM を加え 10 秒間 攪拌し調製した.
5.前処理方法
各標準血清および患者血清 1mL に除蛋白を目的に アセトニトリル 3mL を加え 10 秒間攪拌し,2,500rpm で 15 分間遠心分離後,その上清 1mL を検体とした.
また各標準品試料についても標準血清と同条件とする ため各標準品試料 1mL にアセトニトリル 3mL を加え 10 秒間攪拌し,2,500rpm で 15 分間遠心分離後,そ の上清 1mL を検体とした.
6.HPLC 装置
前処理した RFP 標準血清および RFP 標準品試料は HPLC により分析した.装置は,島津製作所の Promi- nence(送液ユニット:LC-20AD,オートサンプラ:
SIL-20A,カラムオーブン:CTO-20A,UV-VIS 検出 器:SPD-20A)を使用し,分析カラムには Shim-pack FC-ODS(内 径 4.6mm,長 さ 150mm,粒 径 3 µ m),
およびガードカラム(内径 4.6mm,長さ 10mm)を
使用した.分析条件としてカラム温度:40℃,移動相:
40mmol ! L りん酸緩衝液(pH6.7) ! アセトニトリル ! メタノール=520! 390! 90(v! v),流速:1.1mL! min,
測定波長:340nm,注入量:10µL に設定した.
7.電気化学検出器装置
前処理した CAM 標準血清および CAM 標準品試料 は電気化学検出器により分析した.装置は,ESA 社 の CoulochemIII を使用した.分析条件としてガード セル電位:850mV(vs.Pd),
第一電極:500mV(vs.Pd),第二電極:800mV(vs.
Pd),感度:1 µ A に設定した.
8.検量線の作成
HPLC および電気化学検出器による定量時の検量線 の作成は,RFP 標準血清 と し て 2.5,5,7.5,10.0,
12.5 お よ び 15µg! mL,CAM 標 準 血 清 と し て 0.25,
0.5,0.75,1.0,1.25 および 1.5 µ g ! mL に調製した各 6 点を 5.項と同様に処理し本測定法により行った.定 量計算法は外部標準法を利用し,添加濃度とピーク面 積に対する RFP および CAM のピーク面積比より得 られた直線を検量線とした.
9.RFP および CAM の安定性の検討
RFP および CAM 標準品試料を 5.項と同様に処理 し本測定法を行い,初回分析結果を基準としその経時 的変化を検討した.
10.RFP および CAM 併用時の測定系への影響の 検討
RFP と CAM を混和した標準品試料を 5.項と同様 に処理し本測定法を行い,標準品試料濃度と分析結果 に差異がないか検討した.
11.1 外部委託 HPLC 条件
カ ラ ム:Nucleosil C18,150mm×4.0mmid,5µm
(GL サ イ エ ン ス),カ ラ ム 温 度:40℃,移 動 相:50 mmol! L りん酸緩衝液(pH6.5)! アセトニトリル=6!
4(v ! v),流速:0.8mL ! min,オートサンプラ温度:
10℃,測定波長:332nm.
11.2 外部委託 LC! MC! MC 条件
カラム:XTerraMS C18,50mm×4.6mmid,5µm
(ウォーターズ),カラム温度:40℃,移動相:20mmol
! L ギ酸アンモニウム! アセトニトリル! メタノール=
55! 40! 5(by voL.),流速:0.5mL! min,オートサン プ ラ 温 度:10℃,イ オ ン 源:エ レ ク ト ロ ス プ レ イ
(ESI),極性:正イオン,シーガス圧:90psi,補助ガ ス流量:30unit,加熱キャピラリ温度:260℃,衝突 ガス圧:2mTorr,検出イオンおよび衝突エネルギー:
CAM m! z749→m! z158 −34Ev,走査時間:1.0sec
(Total)
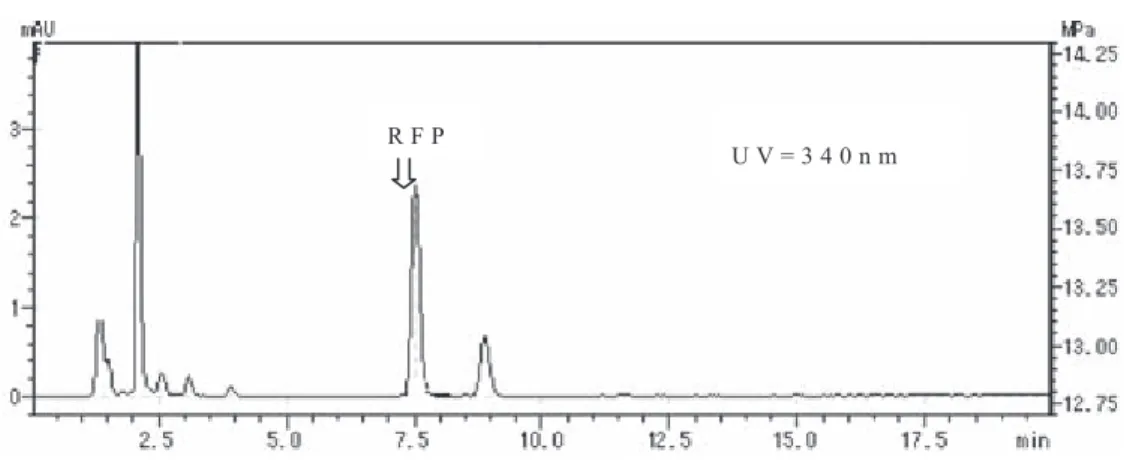
Fig. 1 HPLC chromatogramsofRFP-spiked plasma
Table 1 MeasurementsofcontrolRFP serum obtained with thisassay Measured value
μg/mL Peak Area count
Plasma Concentration Spike μg/mL
2.36 9,781
2.50
RFP
4.76 19,747
5.00
7.65 31,749
7.50
10.00 41,745
10.00
12.50 51,872
12.50
15.00 62,136
15.00
12.本測定法による 測 定 結 果 と 外 部 委 託 に よ る HPLC と LC ! MS ! MS の測定結果との比較 本測定法と前記の測定条件により外部委託にて測定 された RFP と CAM の血中濃度を比較し,相関係数 をもって検討した(n=22).
13.回収率と同時再現性
回収率と同時再現性は,RFP 標準血清(10 µ g ! mL)
お よ び CAM 標 準 血 清(1µg! mL)と RFP 標 準 品 試 料および CAM 標準品試料を 5.項と同様に処理した 検体を本測定法に従い測定した結果の比をもって検討 した(n=5).
14.日差再現性
日差再現性は,5.項と同様に処理して本測定法を 行い,これを 2 日間繰り返して検討した(n=4).
15.臨床応用
71 歳,女性.非結核性抗酸菌症(M. intracellulare)
に て,RFP+CAM+エ タ ン ブ ト ー ル(以 下 EB)+
ガチフロキサシン(以下 GFLX)+カナマイシン(以 下 KM)投与中,RFP および CAM の血中濃度を本 測定法にて測定し投与量を検討した.
16.データ処理
データの算出,解析は島津製作所の LCsolution を 使用した.このデータファイルにより,サンプル情報,
クロマトグラムとその解析結果(分析時,再解析時),
メソッド(分析時,再解析時,装置構成等),レポー トフォーマット,バッチテーブル(分析時,再解析時)
などの種々の記録およびパラメーターの保持を行っ た.
成 績
1.分析結果
1)RFP
RFP 標 準 血 清(2.5,5,7.5,10,12.5,15µg! mL)
を HPLC による本測定法に従っ て 分 析 し た と こ ろ Fig. 1のような 7.5 分近くに保持時間をもつ RFP が検 出され,妨害となるピークも見られず良好なクロマト グラムが得られた.またこのクロマトグラムから Ta- ble 1の結果が得られた.RFP の化学的修復物質であ る 3-Formylrifampicin SV,25-Desacetylrifampicin お よび 3-Formyl-25-DesacetylrifamPicin SV については 推測することは出来たが,それぞれの標準品が入手で きなかったため解析には至らなかった.
2)CAM
CAM 標準血清(0.25,0.5,0.75,1.0,1.25,1.5µg!
mL)を HPLC の吸光度検出器と直列に接続した電気 化学検出器を利用した本測定法に従って分析したとこ ろ Fig. 2のような 16.1 分近くに保持時間をもつ CAM が検出され,妨害となるピークも見られず良好なクロ マトグラムが得られた.またこのクロマトグラムから Table 2の結果が得られた.
2.検量線および検出限界濃度 1)RFP
標 準 血 清 に RFP の 標 準 品 を 2.5,5,7.5,10,
Fig. 2 ElectrochemicaldetectorchromatogramsofCAM-spiked plasma
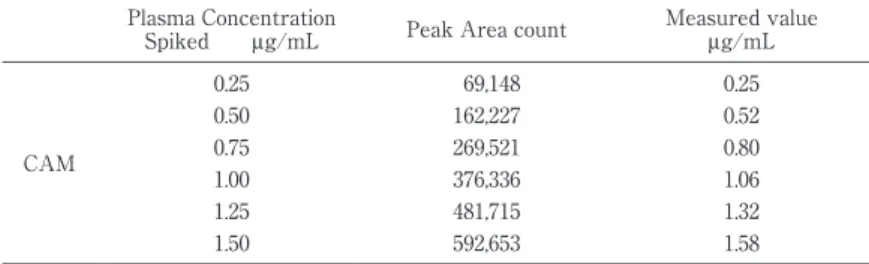
Table 2 MeasurementsofcontrolCAM serum obtained with thisassay Measured value
μg/mL Peak Area count
Plasma Concentration Spiked μg/mL
0.25 69,148
0.25
CAM
0.52 162,227
0.50
0.80 269,521
0.75
1.06 376,336
1.00
1.32 481,715
1.25
1.58 592,653
1.50
Table 3 RFP and CAM standard concentrationsfrom days1 to 35
Percentage ofexpected
% Expected
μg/mL Measured
μg/mL Day
100 10.00
10.010 1
RFP
94 10.00
9.411 7
95 10.00
9.501 14
94 10.00
9.379 21
93 10.00
9.345 28
87 10.00
8.662 35
104 1.00
1.037 1
CAM
105 1.00
1.049 7
101 1.00
1.009 14
106 1.00
1.055 21
105 1.00
1.049 28
98 1.00
0.983 35
RFP and CAM standard were stored at5℃ in the dark
12.5,15 µ g ! mL になるように添加して作成した RFP 標準血清の検量線式は f(x)=0.0002410337×x とな り,RFP 標 準 血 清 濃 度 と ピ ー ク 面 積 の 間 に は r=
0.999,p=0.003 と有意な相関が得られた.また,RFP の検出限界濃度は 0.454µg! mL であった.
2)CAM
標準血清に CAM の標準品を 0.25,0.5,1µg! mL に なるように添加して作成した CAM 標準血清の検量線 式 は f(x)=0.000002673268×x と な り,CAM 標 準 血清濃度とピーク面積の間には r=0.999,p=0.005 と 良好な相関が得られた.
また,CAM の検出限界濃度は 0.041 µ g ! mL であっ た
3.安定性
安定性の判断基準は残存率が 90% 以上とした.RFP および CAM の標準品試料を 5℃ で放置したときの,
標準品試料における RFP および CAM の濃度の経時 的変化を Table 3に示した.RFP の残存率については 28 日目まで 90% 以上を示し,また CAM の残存率は 35 日 目 ま で 90% 以 上 を 示 し た.CAM に 比 較 し て RFP は不安定であった.
4.測定系への影響
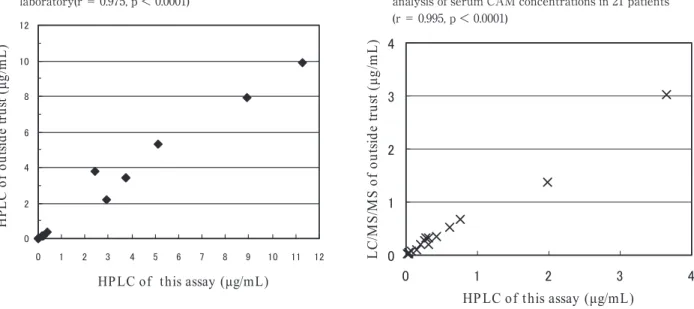
Fig. 3 Relationship between serum RFP concentrations of19 patientsdetermined by thisassay and an external laboratory(r= 0.975,p< 0.0001)
Fig. 4 Relationship between electrochemical detection with this assay and results of external LC/MS/MS analysisofserum CAM concentrationsin 21 patients (r= 0.995,p< 0.0001)
Table 4 Accuracy,reproducibility,and recovery ofRFP and CAM obtained with spiked plasma samplesand standard samples
Standard Plasma spiked
Recovery CV
SD Mean
CV SD
Mean
%
% μg/mL
μg/mL
% μg/mL
μg/mL
102.8 7.249
0.72 9.926
3.263 0.333
10.203 RFP
Standard Plasma spiked
Recovery CV
SD Mean
CV SD
Mean
%
% μg/mL
μg/mL
% μg/mL
μg/mL
99.6 3.293
0.034 1.033
4.57 0.047
1.029 CAM
RFP の 濃 度 が 7.5 µ g ! mL,CAM の 濃 度 が 0.75 µ g ! mL となるように調整した標準品試料の混合液と RFP の濃度が 10µg! mL,CAM の濃度が 1.0g! mL となる ように調整した標準品試料の混合液を本測定法にて分 析した結果,前者の RFP 濃度が 7.247µg! mL,CAM 濃度が 0.763 µ g ! mL となり,後者の RFP 濃度が 9.863 µg! mL,CAM 濃 度 が 0.984µg! mL と な り RFP と CAM 併用時においてもお互いの測定系には影響がな いことが分かった.
5.本 測 定 法 に よ る 測 定 結 果 と 外 部 委 託 に よ る HPLC と LC! MS! MS の測定結果との比較 凍結保存された血清 22 検体を室温において溶解後,
それぞれの分析法を用いて測定した結果,RFP は本 測定法により平均 RFP 血中濃度が 3.267µg! mL,外 部委託の測定により平均 RFP 血中 濃 度 が 3.262 µ g ! mL となり,それぞれの HPLC 分析法にて測定された 結果の間には r=0.975,p<0.0001 と良好な相関が得 られた(Fig. 3).また CAM は本測定法により平均 CAM 血中濃度が 0.573 µ g ! mL,外部委託の測定によ り平均 CAM 血中濃度が 0.480µg! mL となり,電気化
学検出器によって検出された本測定法による結果と外 部委託による LC! MS! MS 分析法により測定された結 果との間には r=0.995,p<0.01 という良好な相関が 得られた(Fig. 4).
6.回収率と同時再現性
本測定法における RFP および CAM の標準血清と 標準品試料の分析結果(n=5)を Table 4に示した.10 µg! mL になるように調製した RFP 標準血清の平均値 は 10.203µg! mL,標準偏差(以下 SD)=0.33µg! mL,
変動係数(以下 CV)=3.263% と な り 1 µ g ! mL に な るように調製した CAM 標準血清の平均値は 1.029µg
! mL,SD=0.047µg! mL,CV=4.570% となった.次に 10 µg! mL になるように調製した RFP 標準品試料の平均 値 は 9.926µg! mL,SD=0.720µg! mL,CV=7.249%
となり 1 µ g ! mL になるように調製した CAM 標準品 試料の平均値は 1.033µg! mLSD=0.034µg! mL,CV=
3.293% となった.以上の結果より RFP および CAM
の同時再現性は CV=3.263〜7.249% と非常に安定し
た変動を示した.また RFP および CAM 標準血清と
RFP お よ び CAM 標 準 品 試 料 の 間 に は RFP が
102.8%(平均 RFP 標準血清! 平均 RFP 標準品試料),
CAM が 99.6%(平均 CAM 標準血清 ! 平均 CAM 標準 品試料)という高い回収率も得られた.
7.日差再現性
患者血清での日差再現性試験時の 4 検体における CV は,それぞ れ 5.0%,3.1%,10.6%,7.1% と RFP および CAM の日差再現性とも非常に安定した変動を 示した.
8.臨床応用
2006 年 7 月 14 日抗酸菌塗抹(1+),8 月 3 日 TBLB にて肺組織,ブラシ,簡易 BAL すべて抗酸菌培養陽 性,Tb-PCR(−),イントラセルラ PCR(+).7 月 25 日より RFP+CAM+EB+GFLX+KM 投与開始し た 71 歳,女性において検討した.治療継続中の 9 月 6 日 follow up CT にて画像悪化認めたため GFLX か ら MFLX に変更が行われた後,10 月 4 日本測定法に て RFP および CAM の血中濃度を測定した.その結 果,RFP450mg 投 与 に お け る 血 中 濃 度 は 10.47µg!
mL,CAM600mg 投 与 に お け る 血 中 濃 度 は 0.43µg!
mL と RFP による薬物相互作用と考えられる CAM 血中濃度低下がみられた.そこで RFP を 300mg に減 量,CAM を 800mg に増量した結果,10 月 12 日再度 本測定法にてそれぞれの血中濃度を測定した結果,
RFP が 9.431µg! mL,CAM が 1.321µg! mL と CAM の血中濃度の上昇が見られた.このように本測定法の 結果にもとづいて投与量の調節を行うことが可能で あった.
考 察
HPLC による血清中 RFP 濃度の測定法と HPLC―電 気 化 学 検 出 器
17)ま た は LC! MS! MS に よ る 血 清 中 CAM 濃度の測定法はこれまでにも報告があったが,
HPLC では測定し難い血清中 CAM 濃度を分析するた めには非常に高価な分析器が完備していない施設など においてはその分析は容易ではなかった.そこで,わ れわれは血清をアセトニトリルにて除蛋白するという 簡易な前処理方法と HPLC に注入し吸光度検出器と 電気化学検出器を直列に接続して迅速に検出できる本 測定法にて RFP および CAM の血中濃度が同時に測 定できるかどうかを検討した.その結果,RFP は測 定波長を 340nm に設定した HPLC により保持時間が 7.5 分近くにピークをもつクロマトグラムが得られ血 清中 RFP 濃度を測定できることが分かった.ただし,
血清中 RFP 濃度の保持時間を検証するために使用し た RFP 標準品試料は,5℃ にて保管した検体を経時 的に測定しその残存率を検討した結果,35 日目で 90%
以下となったため安定性の判断基準とした残存率 90% 以上となる 28 日目を RFP 標準品試料の限度と した.この結果から RFP は経時的に分解されること
が分かった.また,RFP を服用している患者の凍結 保存された血清を本測定法である HPLC によって測 定した結果と外部委託で測定された HPLC の結果と の間には r=0.975,p<0.0001 という良好な相関が得 られた.
次に CAM は,HPLC の吸光度検出器に電気化学検 出器を接続した測定法により保持時間が 16.1 分近く にピークをもつクロマトグラムが得られ血清中 CAM 濃度を測定できることが分かった.この CAM 検出を 妨げるピークの存在も認められなかった.また血清中 CAM 濃 度 の 保 持 時 間 を 検 証 す る た め に 使 用 し た CAM 標準品試料は,5℃ にて保管した検体を経時的 に測定しその残存率を検討した結果,35 日目におい ても 90% 以上を保っていたため CAM 標準品試料は 本測定法において安定性があるものと考えられた.
CAM を服用している患者の凍結保存された血清を本 測定法である電気化学検出器により測定した結果と外 部委託で LC! MS! MS 分析法により測定した結果との 間には r=0.995,p<0.0001 と RFP より良好な相関が 得られた.また,同時および日差再現性にもおいても 安定した変動を示した.このことからもわれわれが工 夫して行った検体を HPLC に注入し吸光度検出器と 電気化学検出器を直列に接続して RFP 血中濃度と CAM 血中濃度を測定する本測定方法は信頼性がある ものと考えられた.
また,血清をアセトニトリルにて除蛋白するだけの 簡易な前処理方法が適用できるか否かを調べるため RFP および CAM の標準血清と標準品試料を本測定 法に従い測定した結果,それぞれの回収率から RFP が 102.8%,CAM が 99.6% と両者とも血清をアセト ニトリルにより除蛋白する方法は分析結果にほとんど 影響をおよぼさないものと考えられた.
非結核性抗酸菌症は近年増加している感染症である が,化学療法の効果が十分でなく,治療したにもかか わらず悪化する症例も珍しくない.そこで,この RFP および CAM の血中濃度測定法を確立した上で行った 臨床応用では,RFP による CAM の血中濃度低下を 回避するためにそれぞれの血中濃度を測定した結果,
用量を変更することで CAM の血中濃度上昇を得るこ とができた.こうした治療戦略が非結核性抗酸菌症な どの治療効果の改善につながる可能性があり,今後更 なる検討が必要であると考えられた.
以上,今回われわれが行った高速液体クロマトグラ
フィーと電気化学検出器を利用した RFP と CAM の
血中濃度測定法は,従来の測定法に比べ数段階の前処
理の簡略化が可能となりかつ操作方法の簡便性に優れ
た測定方法であると考えられた.また分析時間につい
ても外部委託することなく病院内にて分析が可能であ
り分析時間の短縮化に伴い臨床への迅速なフィード バックが実現できた.つまり本測定法は臨床において 非常に有用性のある測定法であると考えられた.
謝辞:本研究の実施にあたり,ご協力賜りました株式会 社島津製作所 山部恵子氏,エム・シー・メディカル株式 会社 兼台靖弘氏に深く感謝致します.
文 献
1
)佐 野 光 司,網 川 延 孝:Rifadin の 化 学.診 療 1970;23:928―35.
2
)アボットジャパン株式会社:クラリシッド錠 200 mg.医薬品インタビューフォーム 2007;7:
1―2.
3
)第一製薬株式会社:リファジンカプセル.医薬 品インタビューフォーム 2004;2:9―11.
4
)山岸文雄:肺結核症と MAC 症の治療の実際.埼 玉医科大学雑誌 2001;28:26―7.
5
)日本結核病学会非定型抗酸菌症対策委員会:非 定型抗酸菌の治療に関する見解.結核 1998;
73:599―605.
6
)American Thoracic Society:Am.J Respir Crit Care Med 1997;156:s1―s25.
7
)山本正彦,久世文幸,斉藤 肇,板谷光則,下 出久雄,副島林造,他:Mycobacterium avium-M.
intracellulare complex 肺 感 染 症 に 対 す る Clarithromycin の臨床的検討.結核 1997;72:
1―7.
8
)Tanaka E, Kimoto T, Tsuyuguchi K, Watanabe I, Matsumoto H, Nimi A, et al.:Effect of Clarithromycin regimen for Mycobacterium avium complex pulmonary disease. Am J Respir Crit Care Med 1999;160:866―72.
9
)河原 伸,多田敦彦,永礼 旬:諸種抗酸菌に 対する ofloxacin, levofloxacin,ciprofloxacin,spar- floxacin の in vitro 抗 菌 活 性 の 比 較.結 核 2001;76:357―62.
10
)千葉 寛:ヒト P450 分子種同定:臨床薬理学及 び医薬品開発における意義.薬物動態 1995;
10:391―402.
11
)第一製薬株式会社:リファジンカプセル.医薬 品インタビューフォーム 2004;2:25―7.
12
)アボットジャパン株式会社:クラリシッド錠 200 mg.医薬品インタビューフォーム 2007;7:
62―4.
13
)Yamamoto F, Harada S, Mitsuyama T, Harada Y, Kitahara M, Nakanishi Y:Concentration of clarithromycin 14-R-hydroxy-clarithromycin in plasma of patients with Mycobacterium avium complex infection,before and after the additin of rifampicin. Jpn J Antibiot 2004;57:124―33.
14
)河野晴一,羽田文四郎,土屋俊晶,久保博昭,小 林 良 江:Rifampicin の 体 内 動 態.臨 床 薬 理 1982;13:403―12.
15
)中川英雄,丹治昭治,津田 潔,山田捷司,岸 田 弘:測定法を異にする血清 RFP 濃度とその 評価.結核 1989;65:317―32.
16
)久保博昭,木下俊夫,小林良江,徳永 彦:高 速液体クロマトグラフィーによる血清中リファ ンピシン濃度.分析化学 1982;31:175―9.
17
)大竹盾夫,小椋 薫,岩立周子,諏訪俊男:TE- 031 の体液内濃度測定法に関する研究(第 2 報)
HPLC 法 に よ る 体 液 内 濃 度 測 定.Chemother- apy 1988;36(suppl 3):192―7.
Measurement of Rifampicin and Clarithromycin in Serum by High-performance Liquid Chromatography with Electrochemical Detection
Hisashi TAKI
1), Kenji OGAWA
2), Taku NAKAGAWA
2)& Toshiaki NIKAI
3)1)